ورم ميلانيني: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
تطوير المقال |
|||
| سطر 1: | سطر 1: | ||
{{مصدر|تاريخ=يونيو_2011}} |
|||
{{معلومات مرض |
{{معلومات مرض |
||
| الاسم = الميلانوما |
| الاسم = الميلانوما |
||
| سطر 19: | سطر 17: | ||
| اسم مراجعة جين = |
| اسم مراجعة جين = |
||
}} |
}} |
||
'''الميلانوما'''، '''سرطان الخلايا الصبغية ''' {{إنج|Melanoma}}، |
'''الميلانوما'''، '''سرطان الخلايا الصبغية ''' {{إنج|Melanoma}}، أيضا يعرف بالورم الميلانيني الخبيث, وهو نوع من أنواع [[السرطانات]] الذي يتطور من الخلايا التي تحتوي على الصبغة -الغامقة "[[الميلانين]] المسؤولة عن لون البشرة"-المعروفة باسم الخلية الميلانينية<ref name=NCI2015>{{cite web|title=Melanoma Treatment–for health professionals (PDQ®)|url=http://www.cancer.gov/types/skin/hp/melanoma-treatment-pdq|website=National Cancer Institute|accessdate=30 June 2015|date=June 26, 2015}}</ref>. عادة ما يحدث الورم الميلانيني في [[الجلد]], ولكن نادرا ما يحدث في [[الفم]] و[[الأمعاء]] و[[العين]]<ref name=NCI2015/><ref name=WCR2014/>أو أي أجزاء أخرى من الجسم. |
||
يعتبر سرطان الخلايا الصبغية أقل شيوعا مقارنة بالأنواع الأخرى من سرطانات الجلد، ولكنه أكثر خطورة وتعزى إليه غالبية (75%) الوفيات المرتبطة ب[[سرطان الجلد]]، ويتم تشخيص 160000 حالة إصابة بسرطان الخلايا الصبغية سنويا في كل أرجاء العالم، ويرتفع معدل الإصابة بهذا السرطان عند النساء منه عند الرجال، وعند أصحاب البشرة الفاتحة بالتحديد, ممن يعيشون في مناطق مشمسة، وبمعدلات عالية في أستراليا ونيوزلندا، وأمريكا الشمالية، وشمال أوروبا.، وتنسب منظمة الصحة العالمية. في تقريرها أسباب 48000 حالة وفاة سنوية إلى سرطان الخلايا الصبغية. |
|||
في النساء يشيع حدوث هذا المرض في الساقين, بينما في الرجال يشيع حدوثه في الظهر<ref name=WCR2014/>. في بعض الأحيان تتطور من كتل تتعلق بتغيرات تتضمن زيادة في الحجم, حواف غير منتظمة, تغير اللون, حكة وتدمر [[الجلد]]<ref name=NCI2015/>. |
|||
السبب الرئيسي للأورام الميلانينية هو تعرض الذين لديهم مستويات منخفضة من صبغة الجلد "[[الميلانين]]" <ref name=WCR2014/><ref>{{cite journal |vauthors=Kanavy HE, Gerstenblith MR |title=Ultraviolet radiation and melanoma |journal=Semin Cutan Med Surg |volume=30 |issue=4 |pages=222–8 |date=December 2011 |pmid=22123420 |doi=10.1016/j.sder.2011.08.003 |url=http://linkinghub.elsevier.com/retrieve/pii/S1085-5629(11)00130-1}}</ref> للأشعة فوق البنفسجية. قد يكون ضوء [[الأشعة فوق البنفسجية]] من أشعة الشمس أو من أجهزة التسمير. تقريبا 25% يتطور من أورام وكتل جلدية<ref name=WCR2014/>. هؤلاء الذين لديهم العديد من هذه الكتل أو الشامات يعود ذلك إلى أفراد العائلة المتضررين, وأولئك الذين لديهم ضعف في وظائف [[المناعة]] معرضون لخطر أكبر<ref name=NCI2015/>. وهناك عدد من العيوب الوراثية النادرة مثل [[جفاف الجلد]] المصبغ يزيد أيضا من المخاطر<ref name=Az2014/>. التشخيص يكون بأخذ خزعة من الآفة الجلدية<ref name=NCI2015/>. |
|||
إن تجنب ضوء [[الأشعة فوق البنفسجية]] واستخدام واقي الشمس قد يمنع من حدوث هذا الميلانوما<ref name=WCR2014/>. يشمل العلاج الاستئصال الجراحي للورم، والعلاج المساعد، والكيميائي المناعي، والعلاج بالأشعة، وتعد فرصة الشفاء أعظم إذااكتشفت الميلانوما بينما لا تزال صغيرة وضئيلة وبالإمكان استئصالها جراحيا بالكامل. يمكن اختبار الانتشار من [[الغدد الليمفاوية]] القريبة, ويشفى معظم الناس إذا لم يحدث انتشار, أما الذين قد انتشر عندهم السرطان فإن العلاج المناعي أو العلاج البيولوجي أو العلاج الإشعاعي أو العلاج الكيميائي قد يمكنه من البقاء على قيد الحياة<ref name=NCI2015/>. مع العلاج معدلات البقاء على قيد الحياة لمدة خمس سنوات هي 98% من بين الذين يعانون من أمراض محلية و 17% منهم قد حدث لديهم انتشار<ref name=SEER2015>{{cite web|title=SEER Stat Fact Sheets: Melanoma of the Skin|url=http://seer.cancer.gov/statfacts/html/melan.html|website=NCI|accessdate=June 2015}}</ref>. واحتمال انه سوف يعود أو يحدث انتشار يعتمد على سمك الميلانوما و على سرعة انقسام الخلايا وفيما إذا كان [[الجلد]] قد تدمر وانهار<ref name=WCR2014/>. |
|||
الميلانوما هي أكثر سرطانات الجلد خطورة. عالميا في عام 2012 أصيب في هذا المرض 232000 شخص وسببت 55000 حالة وفاة. في أستراليا و نيوزلندا أعلى نسبة مصابين بالميلانوما في العالم, وأيضا هنالك نسبة عالية في أوروباوأمريكا الشمالية, ولكنها أقل شيوعا في آسياوأفريقياوأمريكا اللاتينية<ref name=WCR2014/>. وتشيع الميلانوما في الرجال أكثر من النساء<ref name=Az2014/>. الميلانوما أصبحت أكثر شيوعا منذ 1960 في المناطق التي هي في معظمها القوقاز "الذين يمتلكون البشرة البيضاء". <ref name=WCR2014>{{cite book|title=World Cancer Report 2014.|date=2014|publisher=World Health Organization|isbn=9283204298|pages=Chapter 5.14}}</ref><ref name=Az2014>{{cite journal|last1=Azoury|first1=SC|last2=Lange|first2=JR|title=Epidemiology, risk factors, prevention, and early detection of melanoma.|journal=The Surgical clinics of North America|date=October 2014|volume=94|issue=5|pages=945–62, vii|pmid=25245960|doi=10.1016/j.suc.2014.07.013}}</ref> |
|||
== العلامات والأعراض == |
|||
من العلامات المبكرة للميلانوما تغيرات في شكل ولون الكتل أو في حالة الميلانوما العقدية يظهر كتل جديدة في أي مكان على [[الجلد]]<ref>[http://www.melanomawarningsigns.com/ MelanomaWarningSigns.com]</ref>. في مراحل لاحقة تظهر [[حكة]] او قد تتقرح الكتل او تنزف, وتتلخص علامات الحكة المبكرة ب: |
|||
*عدم تناسق |
|||
*حواف غير منتظمة |
|||
*تلون |
|||
*قطر اكبر من 6ملم عن حجم ممحاة قلم رصاص |
|||
*تتطور مع مرور الوقت |
|||
هذه التصنيفات تنطبق على اكثر انواع الميلانوما خطورة "الميلانوما العقدية" التي لها تصنيفاتها الخاصة: |
|||
*مرتفع عن سطح الجلد |
|||
*ملمس متين متراص |
|||
*متزايد |
|||
قد تسبب الميلانوما المنتشرة في الجسم أعراض الأباعد الورمية الغير محددة, تتضمن [[فقدان الشهية]] والغثيان القيء والتعب. انتشار الميلانوما المبكرة ممكن ولكنه نادرا تقريبا, انتشاره في [[الدماغ]] شائع في المرضى الذين يعانون من الميلانوما المنشره<ref>{{cite journal |author=Fiddler IJ |title=Melanoma metastasis |journal=Cancer Control |volume=2 |issue=5 |pages=398–404 |date=October 1995 |pmid=10862180}}</ref>, كما يمكن أيضا أن ينتشر إلى [[الكبد]] و[[العظام]] والبطن أو العقد الليمفاوية البعيدة. |
|||
== المسببات == |
|||
تعزى أسباب السرطانات المختلفة إلى خلل يصيب [[الحمض النووي]] داخل الخلايا, قد يكون قد يكون هذا الخلل وراثيا في شكل [[طفرة جينية|طفرات جينية]], لكنه في اغلب الحالات يتطور تدريجيا خلال حياة الشخص وتسببه عوامل بيئية, ويؤدي هذا الخلل إلى تضخم دون سيطرة مسببا ورم, ويتسبب غالبا أشعة الشمس فوق البنفسجية الميلانوما وكذلك من الممكن أن تسهم بالمرض الأشعة البنفسجية المستخدمة في تسمير البشرة. |
|||
=== الأشعة فوق البنفسجية === |
|||
إن [[الأشعة فوق البنفسجية]] الصادرة من أجهزة التسمير تزيد من خطر الإصابة بالميلانوما<ref name="pmid22833605">{{cite journal|last=Boniol|first=M|author2=Autier, P|author3= Boyle, P|author4= Gandini, S|title=Cutaneous melanoma attributable to sunbed use: systematic review and meta-analysis.|journal=BMJ (Clinical research ed.)|date=Jul 24, 2012|volume=345|pages=e4757|pmid=22833605|pmc=3404185|doi=10.1136/bmj.e4757}}</ref>, ووجدت الوكالة الدولية لبحوث السرطان أن تسمير الجلد مسببة للسرطان و أن الناس الذين يبدؤون باستخدام أجهزة التسمير قبل سن 30 هم 75٪ أكثرعرضة لتطوير الميلانوما.<ref>{{Cite journal |author=WHO International Agency for Research on Cancer Monograph Working Group |title=A Review of Human Carcinogens—Part D:Radiation |journal=[[The Lancet Oncology]]|date = August 2009| volume=10| issue=8| pages=751–2| doi=10.1016/S1470-2045(09)70213-X| pmid=19655431}}</ref> أولئك الذين يعملون في الطائرات يظهر لديهم زيادة الخطر في الإصابة, ويعتقد ذلك بسبب الزيادة في التعرض للأشعة الفوق البنفسجية<ref>{{cite journal|last1=Sanlorenzo|first1=Martina|last2=Wehner|first2=Mackenzie R.|last3=Linos|first3=Eleni|last4=Kornak|first4=John|last5=Kainz|first5=Wolfgang|last6=Posch|first6=Christian|last7=Vujic|first7=Igor|last8=Johnston|first8=Katia|last9=Gho|first9=Deborah|last10=Monico|first10=Gabriela|last11=McGrath|first11=James T.|last12=Osella-Abate|first12=Simona|last13=Quaglino|first13=Pietro|last14=Cleaver|first14=James E.|last15=Ortiz-Urda|first15=Susana|title=The Risk of Melanoma in Airline Pilots and Cabin Crew|journal=JAMA Dermatology|date=3 September 2014|doi=10.1001/jamadermatol.2014.1077}}</ref>. |
|||
يمتص ضوء الأشعة الفوق بنفسجية (طول الموجة 315-280 مم) القادم من الشمس بواسطة المادة الوراثية لخلايا الجلد وتتسبب في نوع من تدمير المادة الوراثية المباشر.<ref name="pmid22005748">{{cite journal |vauthors=Rünger TM, Farahvash B, Hatvani Z, Rees A |title=Comparison of DNA damage responses following equimutagenic doses of UVA and UVB: a less effective cell cycle arrest with UVA may render UVA-induced pyrimidine dimers more mutagenic than UVB-induced ones |journal=Photochem. Photobiol. Sci. |volume=11 |issue=1 |pages=207–15 |date=January 2012 |pmid=22005748 |doi=10.1039/c1pp05232b |url=}}</ref> |
|||
وتشير الدراسات أن التعرض للأشعة فوق البنفسجية واحدة من الأسباب الرئيسية في تطوير الميلانوما. في بعض الأحيان التعرض المفرط لأشعة الشمس "مما يؤدي الى حروق الشمس" هي علاقة تسبب الميلانوما. الميلانوما هو الأكثر شيوعا على ظهر الرجال وعلى الساقين عند النساء (مناطق متقطعة تتعرض لأشعة الشمس). يظهر الخطر أكثر شدة في الأوضاع الاجتماعية والاقتصادية بدلا من الأماكن المغلقة مقابل المهن في الهواء الطلق, وهو أكثر شيوعا في العمال الإداريين والمهنيين من العمال غير المهرة. عوامل أخرى هي الطفرات أو فقدان تام للجينات الكابتة للورم, وقد تم ربط استخدام أجهزة التسمير (مع اختراق عميق للأشعة فوق البنفسجية) لتطوير [[سرطان الجلد|سرطانات الجلد]] بما في ذلك الميلانوما. وتشمل العناصر الهامة الممكنة فيتحديد المخاطر كافة و مدة التعرض لأشعة الشمس، والعمرالذي يحدث التعرض لأشعة الشمس، و درجة تصبغ الجلد. وتميل معدلات الميلانوما إلىأن تكون أعلى في البلدان المستقرة على طريق المهاجرين من شمال أوربا التي تحتوي على كمية كبيرة من ضوء الشمس المباشر المكثف الذي لا تتكيف معه جلود الناس, زمن أبرزها استراليا. التعرض أثناء الطفولة لاشعة الشمس هوأحد عوامل الخطر الأكثرأهمية من التعرض في مرحلة البلوغ. ويبرز هذا في دراسات الهجرة في أستراليا. |
|||
=== الوراثة === |
|||
في بعض الحالات يسري [[سرطان الجلد]] في الأسرة، فلقد حددت عدة جينات مسئولة عن زيادة خطر تطور [[سرطان الجلد]]، فبعض الجينات النادرة تمثل خطرا عاليا نسبيا مسببة سرطان الجلد,بينما هناك [[جينات]] مثل الجين MCIRوالذي يعطي اللون الاحمر للشعر يمثل خطرا اقل بالنسبة لسرطان الجلد, ويمكن استخدام الفحص الجيني لمعرفة ما اذا كان الشخص لديه ايا من الطفرات الجينية المعروفة وتزيد عدد من الطفرات النادرة التي تتوارث بالأسر قابلية الإصابة بسرطان الجلد، فأحد أصناف الطفرات تؤثر على جين CDKNA , وتؤدي طفرة جينية نسبية في اطار القراءة الى زعزعةP53 والذي يشكل عامل وصف في الموت المبرمج للخلايا وفي خمسين بالمئة من السرطانات التي تصيب البشر، وتنتج طفرة أخرى في نفس الجين مثبطًا غير وظيفي من CDK4 الذي يسمح بانقسام الخلايا التي تسبب الحالة الجلدية Xeroderma Pigmentosum هي عرضة لسرطان الجلد، وتقلل هذه الطفرات من خلال توزعها على الجينيوم من قدرة الخلية على إصلاح DNA وكلٌ من طفراتCDKN2A and XP متوغلة للغاية. |
|||
== الفسيولوجيا المرضية == |
|||
[[ملف:Diagram_showing_where_melanoma_is_most_likely_to_develop_CRUK_383.svg|تصغير|يسار|أين الاماكن أكثر عرضة لتطور الميلانوما]] |
|||
تبدأ المرحلة المبكرة من الميلانوما عندما تفقد السيطرة على نمو الخلايا الصبغية. توجد الخلايا الصاغية بين الطبقة الخارجية للجلد(البشرة) والطبقة التي تليها (الأدمة), وتسمى هذه المرحلة المبكرة من المرض مرحلة النمو الكعبري عندما يكون الورم اقل من 1مم. لان الخلايا السرطانية لم تصل بعد إلى اوعية دمويةأعمق في الجلد، فإنه من غير المحتمل أن هذه المرحلة المبكرة من الميلانوما سوف تنتشر إلى أجزاء أخرى من الجسم. اذا تم الكشف عن الميلانوما في هذه المرحلة فانه عادة ما يمكن ازالتها بالكامل عن طريق الجراحة. |
|||
عندما تبدأ الخلية السرطانية في التحرك باتجاه مختلف-عموديا يصل الى البشرة والأدمة الحليمية- يتغير سلوك الخلية بشكل كبير. الخطة التالية في التطور هي مرحلة النمو الكعبري الغازية, وهو مصطللح مذهل, من هذه النقطة الميلانوما قادرة على الانتشار. |
|||
مرحلة النمو الرأسي التالية هي الميلانوما الغازية, يصبح الورم قادرا على النمو في الانسجة المحيطة بها, زيمكن ان ينتشر في جميع انحاء الجسم من خلال الاوعية الدمويه او الليمفاوية. عادة ما يكون سمك الورم اكثر من 1 ملم, ويشمل الورم اجزاء عميقة من [[الأدمة|الادمة]]. يثار رد فعل مناعي ضد الورم خلال VGPالتي تحكم بوجود ونشاط الورم تسلسل [[الخلايا اللمفاوية|الخلايا اليمفاوية]] (TILs) هذه الخلايا احيانا تدمر تماما الورم الرئيسي وهذا ما يسمى انحدار وهي اخر مرحلة من مراحل التطور, في بعض الحالات يتم تدمير الورم الرئيسي تماما واكتشاف الورم المنتشر. حوالي 40% من الاورام الميلانينيه للإنسان تحتوي على الطفرات النشطة التي تؤثر على بنية البروتين B-Raf. |
|||
بشكل عام, تحدث السرطانات بسبب تلف [[الحمض النووي]] 28. ضوء الاشعة فوق البنفسجيه يسبب بشكل رئيسي جزئ ثايمين29. تنتج الاشعة فوق البنفسجية انواع من الاكسجين الذي يلحق ضررا اخر بالحمض النووي ال DNA, اولا سلسلة واحدة تكسر. تأكسد البيرميدينات وتأكسد ال purine 8-oxoguanine (طفرات في الحمض النووي) على تردد 1\10 و 1\3 للاشعة فوق البنفسجية. |
|||
تسبب الاشعة فوق البنفسجية اضرارا بالحمض النووي للخلايا, وعادة توين جزئ [[الثايمين]] والتي لا تصلح يمكن الن تخلق الطفرات في جينات الخلايا, عندما تنقسم الخلية يتم نشر هذه الطفرات الى اجيال جديدة من الخلايا, في حالة حدوث الطفرات protooncogenes او ورم الجينات الكابته فإن معدل الانقسام للخلايا الحاملة للطفرات يمكن ان تصبح غير منضبطة مما يؤدي الى تشكيل الورم. وتشير البيانات من المرضى ان مستويات الخلايا الشاذة تفعل عامل النسخ في نواة خلايا الميلانوما وترتبط مع زيادة انتشار خلايا الميلانوما<ref>{{cite journal |vauthors=Leslie MC, Bar-Eli M |title=Regulation of gene expression in melanoma: new approaches for treatment |journal=J. Cell. Biochem. |volume=94 |issue=1 |pages=25–38 |date=January 2005 |pmid=15523674 |doi=10.1002/jcb.20296}}</ref><ref>{{cite journal |vauthors=Bhoumik A, Singha N, O'Connell MJ, Ronai ZA |title=Regulation of TIP60 by ATF2 modulates ATM activation |journal=J. Biol. Chem. |volume=283 |issue=25 |pages=17605–14 |date=June 2008 |pmid=18397884 |pmc=2427333 |doi=10.1074/jbc.M802030200}}</ref><ref>{{cite journal |vauthors=Bhoumik A, Jones N, Ronai Z |title=Transcriptional switch by activating transcription factor 2-derived peptide sensitizes melanoma cells to apoptosis and inhibits their tumorigenicity |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=101 |issue=12 |pages=4222–7 |date=March 2004 |pmid=15010535 |pmc=384722 |doi=10.1073/pnas.0400195101}}</ref> , دراسات من [[الفئران]] اشارت الى ذلك ايضا<ref>{{cite journal |vauthors=Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V |title=The role of ATF-2 in oncogenesis |journal=BioEssays |volume=30 |issue=4 |pages=314–27 |date=April 2008 |pmid=18348191 |doi=10.1002/bies.20734 }}</ref><ref>{{cite journal |vauthors=Huang Y, Minigh J, Miles S, Niles RM |title=Retinoic acid decreases ATF-2 phosphorylation and sensitizes melanoma cells to taxol-mediated growth inhibition |journal=J Mol Signal |volume=3 |page=3 |year=2008 |pmid=18269766 |pmc=2265711 |doi=10.1186/1750-2187-3-3}}</ref>. |
|||
== التشخيص == |
|||
[[ملف:Melanoma_vs_normal_mole_ABCD_rule_NCI_Visuals_Online.jpg|تصغير|يسار|توضيح قاعدة ال ABCD : على الجانب الايسر من اعلى الى اسفل:الاورام الميلانينية تظهر (A) asymmetry ,(B) border thatis uneven, ragged, or notched , (C) coloring of different shades of brown, black, or tan and, (D) diameter that had changed in size, الشامة العادية على الجانب الايمن لا تملك خصائص غير طبيعية (عدم التماثل الحدود اللون او اي تغيير في القطر).]] |
|||
[[ملف:Dermatoscope1.JPG|تصغير|يسار|اداة التصوير الجلدي المجهري]] |
|||
[[ملف:Malignant_melanoma_%281%29_at_thigh_Case_01.jpg|تصغير|يسار|الميلانوما في خزعة الجلد مع صبغة الهيماتوكسيلين والايوزين, هذه الحاله يمكن ان تمثل سطح سرطان الجلد المنتشر]] |
|||
[[ملف:Anal Melanoma.JPG|تصغير|يسار|ميلانوما الشرج]] |
|||
الفحص البصري هو اسلوب التشخيص الاكثر شيوعا<ref name="ap01">{{cite journal |vauthors=Wurm EM, Soyer HP |title=Scanning for melanoma |date=October 2010 |journal=Australian Prescriber |issue=33 |pages=150–5 |url=http://www.australianprescriber.com/magazine/33/5/150/5}}</ref> , وعادة ما يتم التعامل مع الكتل الغير منتظمة في اللون والحجم والشكل كمرشحه بانها اورام. للكشف عن الاورام الميلانينيه (وزيادة معدلات البقاء على قيد الحياة) فمن المستحسن ان نتعلم كيف نتعرف عليهم (انظر ال ABCDE أعلاه) لفحص التغيرات بانتظام (الشكل والحجم واللون والحكة او النزيف) واستشارة طبيب مؤهل<ref>{{cite web |title=Prevention: ABCD's of Melanoma |publisher=American Melanoma Foundation |url=http://www.melanomafoundation.org/prevention/abcd.htm}}</ref><ref>{{Cite journal|vauthors=Friedman R, Rigel D, Kopf A | title = Early detection of malignant melanoma: the role of physician examination and self-examination of the skin | journal = CA Cancer J Clin | volume = 35 | issue = 3 | pages = 130–51 | year = 1985| pmid = 3921200 |url=http://onlinelibrary.wiley.com/doi/10.3322/canjclin.35.3.130/abstract | doi = 10.3322/canjclin.35.3.130}}</ref> |
|||
. |
|||
=== ABCDE === |
|||
وهناك طريقة شعبية لتذكر علامات وأعراض الميلانوما "ABCDE" |
|||
*Asymmetrical skin lesion |
|||
*Border of the lesion |
|||
*Color الميلانوما عادة لها اكثر من لون |
|||
*Diameter |
|||
*Enlarging |
|||
ومع ذلك فان العديد من الاورام الميلانينة موجودة كآفات اصغر من مم في القطر. |
|||
وجميع الاورام الميلانينيه خبيثة عند اول ظهورها كنقطة صغيره يقوم الاطباء عادة بفحص جميع الكتل بما في ذلك الاقل من 6 ملم في القطر.قد يجمع |
|||
(Seborrheic keratosis)بعض او كل معايير ABCDE ويمكن ان يؤدي الى انذارات كاذبة, ويمكن للأطباء عموما ان يميزوه من الميلانوما عند الفحص أو مع اداة الجلدي المجهري بعضهم مؤيدين بالتوسع مع التطور بالتأكيد الكتل التي تتطور وتتغير ستكون مصدرا للقلق. بدلا من ذلك بعض ممارسي الطب التقليدي يفضلون التطور لهذه الكتل لأنه قد يساعد على التعرف على الميلانوما, ولكن عدم وجود التطور لا يعني ان الافه ليست ميلانوما تم الكشف عن معظم الاورام الميلانينيه في الولايات المتحدة قبل ان تتطور. |
|||
الميلانينية العقدية لا تحقق هذه المعايير لها رموز مختصرة تساعد على تذكرها "EFG" : |
|||
*E: Elevated ترتفع الافه فوق الجلد المحيط بها |
|||
*F:Firm العقد صلبه في الملمس |
|||
*G:Growing يزداد حجم العقد |
|||
=== البطة القبيحة === |
|||
طريقة جديدة وغير مألوفة Ugly duckling sign "علامة البطة القبيحة" <ref name="pmid9828892">{{cite journal |vauthors=Mascaro JM, Mascaro JM |title=The dermatologist's position concerning nevi: a vision ranging from "the ugly duckling" to "little red riding hood" |journal=Arch Dermatol |volume=134 |issue=11 |pages=1484–5 |date=November 1998 |pmid=9828892 |doi=10.1001/archderm.134.11.1484}} |
|||
</ref>انها بسيطة وسهلة للتعلم وفعالة جدا, يتم الربط بين خصائص الافة المشتركة وصف الافات التي تحيد كثيرا عن الخصائص المشتركة بالبطة القبيحة, ويتطلب امتحان مهني اخر. علامة ال little Red Riding Hood<ref name="pmid9828892" /> تشير الى ان الافراد ذوي البشرة الفاتحة والشعر ذات الالوان الفاتحة قد يصعب تشخيص الاورام الميلانينة عديمة الميلانين لديهم, مطلوب مزيد من الحذر عند فحص هؤلاء الافراد كما قد يكون لديهم ميلانوما متعددة. يجب استخدام اداة التصوير الجلدي المجهري للكشف عن ال ugly ducklings والعديد من الاورام الميلانينية في هؤلاء الاشخاص تشبه غير الميلانينية<ref name="dermnetnz.org">[http://dermnetnz.org/doctors/dermoscopy-course/introduction.html Dermnetnz.org]</ref>. الاشخاص ذوو البشرة البيضاء غالبا لديهم تصبغات فاتحه او الميلانوما عديمة [[الميلانين]] مما يجعل اكتشاف وجودها او تغير اللون صعبا .غالبا ما تكون حدودها غير واضحة مما يعقد التعرف البصري عليها بدون اداة التصوير الجلدي المجهري . الميلانوما عديمة الميلانين او الميلانوما التي صيب الافراد ذوو البشرة البيضاء من الصعب جدا اكتشافها كما فشلوا في اظهار العديد من الخصائص في قاعدة ABCD كسر قاعدة ugly duckling وكما يصعب تميزها عن ندبات [[حب الشباب]] ولدغ الحشرات وعن الكتل الليفية بالجلد وعن التصبغات. |
|||
=== خزعة === |
|||
بعد الفحص البصري وامتحان الفحص الجلدي المجهري<ref name="dermnetnz.org" />, او في ادوات التشخيص الحي مثل المجهر متحد البؤر, يمكن للطبيب اخذ [[خزعة]] من الكتله المشبوهه, وغالبا ما يتم اخذ الخزعة تحت تخدير موضعي لتحديد الخطورة , استئصال الخزعات بيضاوية الشكل قد تزيل الورم يليها التحليل النسيجي. وكثيرا ما يستخدم التصوير الفوتوغرافي الكلي للجسم خلال الفترة الخطرة من متابعة المرضى تم الكشف عن هذه التقنيه لتمكين الكشف المبكر ويوفر نهجا فعالا من حيث التكلفه (مع اي كاميرا رقمية), ولكن اذا تشكك في فعاليته بسبب عدم قدرتها على كشف التغيرات التي ترى بالمجهر<ref name="ap01" />, ينبغي ان تستخدم طريقة التشخيص جنبا الى جنب (وليس كبديل) للتصوير الجلدي المجهري واستخدام الطريقتين لاعطاء معدلات مرتفعة جدا من الكشف. |
|||
=== التصنيف === |
|||
تنقسم الميلانوما الى الانواع التالية<ref>{{Cite book|author1=James, William D. |author2=Berger, Timothy G. |title=Andrews' Diseases of the Skin: clinical Dermatology|publisher=Saunders Elsevier |year=2006 |isbn=0-7216-2921-0 |pages=694–9|display-authors=etal}}</ref>: |
|||
*Lentigo maligna |
|||
*Lentigo maligna melanoma |
|||
*Superficial spreading melanoma |
|||
*Acral lentiginous melanoma |
|||
*Mucosal melanoma |
|||
*Nodular melanoma |
|||
*Polypoid melanoma |
|||
*Desmoplastic melanoma |
|||
*Amelanotic melanoma |
|||
*Soft-tissue melanoma |
|||
انظر ايضا<ref name="Bolognia">{{Cite book|author1=Rapini, Ronald P. |author2=Bolognia, Jean L. |author3=Jorizzo, Joseph L. |title=Dermatology: 2-Volume Set |publisher=Mosby |location=St. Louis|year=2007 |isbn=1-4160-2999-0 }}</ref>: |
|||
*Melanoma with small nevus-like cells |
|||
*Melanoma with features of a Spitz nevus |
|||
*Uveal melanoma |
|||
=== المختبر === |
|||
غالبا ما يستخدم نازعة الاكتات ([[Lactate dehydrogenase]]) (LHD) لاختبار الكشف عن النقائل, على الرغم من ان المرضى الذين يعانون من الانبثاث (حتى نهاية المرحلة) لديهم نازعات الاكتات الطبيعي غالبا ما يشير بشكل غير عادي الى ارتفاع انتشار المرض المنتشر في الكبد. |
|||
ومن الشائع للمرضى تشخيص الميلانوما ان يكون الصدر بالاشعة السينية واختبار LHD وفي بعض الحالات CT،MRI،PETو / أو مسحPET / CT. على الرغم من الجدل, يتم تنفيذ فحص [[الغدد الليمفاوية]] في المرضى لتقييم انتشارها اليها ويدعمتشخيصالميلانومابنسبةحضورS-100البروتينعلامة. |
|||
HMB-45 هو من الاجسام المضادة احادي النسيلة ان يتفاعل ضد المستضد الموجود في الاورام الميلانينية مثل الميلانوما, وتقف على الانسان الميلانوما السوداء والتي يتم استخدامها في علم الامراض التشريحي كعلامة لمثل هذه الاورام. تم انشاء الاجسام المضادة لاستخراج الميلانوما. يتفاعل بشكل ايجابي ضد اورام ميلانينية ولكن ليس اورام اخرى, وبالتالي خصوصية وحساسية. وتتفاعل الاجسام المضادة ايضا ضد خلايا الشامات ولكن ليس داخل شامات [[الأدمة]] وضد اجنة الخلايا الصباغية ولكن ليس الخلايا الصباغية البالغة الطبيعية. |
|||
=== المراحل === |
|||
ويعتبر سرطان الخلايا الصبغية أقل شيوعا مقارنة بالأنواع الأخرى من [[سرطان الجلد|سرطانات الجلد]]، ولكنه أكثر خطورة وتعزى إليه غالبية (75%) الوفيات المرتبطة [[سرطان الجلد|بسرطان الجلد]]، ويتم تشخيص 160000 حالة إصابة بسرطان الخلايا الصبغية سنويا في كل أرجاء [[العالم]]، ويرتفع معدل الإصابة بهذا [[السرطان]] عند [[النساء]] منه عند [[الرجال]]، وعند أصحاب البشرة الفاتحة بالتحديد (القوقازيون), ممن يعيشيون في مناطق مشمسة، وبمعدلات عالية في [[إستراليا]] [[نيوزلاندا|ونيوزلاندا]]، [[أمريكا الشمالية|وأمريكا الشمالية،]] [[شمال أوروبا|وشمال أوروبا.]]، وتنسب [[منظمة الصحة العالمية]] في تقريرها أسباب 48000 حالة وفاة سنوية إلى سرطان الخلايا الصبغية. |
|||
[[ملف:Diagram_showing_the_T_stages_of_melanoma_CRUK_373.svg|تصغير|يسار|مرحلة Tمن الميلانوما]] |
|||
[[ملف:Malignes Melanom.jpg|تصغير|يسار|F18-FDG PET / CT في مريض الميلانوما تظهرآفات متعددة، انتشارالأرجح]] |
|||
مراحل الميلانوما<ref name=AJCC /> معدلات البقاء على قيد الحياة لمدة 5 سنوات: |
|||
مرحلة0: الميلانوما في موقع (كلارك المستوى الاول) 99% يبقى على قيد لحياة |
|||
مرحلة I\II : ميلاوما غزوية 89-95% يبقى على قيد الحياة |
|||
*T1a: أقل من 1.0 مم سمك الورم الرئيسي, دون تقرح والانقسام> 1 مم2 |
|||
*T1b: اقل من 1.0 مم سمك الورم الرئيسي مع تقرح او انقسام اكبر او يساوي 1 |
|||
*T2a: سمك الورم الرئيسي دون تقرح 1.01-2.0مم |
|||
مرحلة II : الميلانوما عالية المخاطر 45-79% يبقى على قيد الحياة |
|||
*T2b: سمك الورم الرئيسي مع تقرح 1.01- 2,0 مم |
|||
*T3a: سمك الورم الرئيسي دون تقرح 2.01-4.0 مم |
|||
*T3b: سمك الورم الرئيسي مع تقرح 2.01-4.0 مم |
|||
*T4a: اكبر من 4.0 مم سمك الورم الرئيسي دون تقرح |
|||
*T4b: اكبر من 4.0 مم سمك الورم الرئيسي مع تقرح |
|||
مرحلة III: ورم اقليمي خبيث 24-70% يبقى على قيد الحياة |
|||
*N1: عقدة ليمفاويه واحدة حسنة |
|||
*N2: من 2-3 عقد ليمفاوية حسنة او جلد اقليمي\ ورم خبيث في الانتشار |
|||
*N3: اربعة عقد ليمفاوية ايجابية او عقدة واحده و جلد اقليمي وورم خبيث في الانتشار |
|||
مرحلة IV: ورم خبيث بعيد 7-19% يبقى على قيد الحياة |
|||
*M1a: انتشار الورم في الجلد LHD طبيعي |
|||
*M1b: انتشار في الرئة LHD طبيعي |
|||
*M1c: ورم خبيث اخر او اي تطور اخر له مع LHD مرتفعة |
|||
يعتمد على ال AJCC خمس سنوات بقاء تشخيص اولي للميلانوما مع العلاج المناسب. |
|||
== الوقاية == |
|||
يشمل العلاج الاستئصال الجراحي للورم، والعلاج المساعد، والكيميائي المناعي، والعلاج بالأشعة، وتعد فرصة الشفاء أعظم إذا اكتشفت الميلانوما بينما لا تزال صغيرة وضئيلة وبالإمكان استئصالها جراحيا بالكامل. |
|||
=== تجنب الاشعة فوق البنفسجية === |
|||
التقليل من التعرض لمصادر [[الاشعة فوق البنفسجية]] (الشمس واجهزة تسمير البشرة)<ref>{{Cite journal| author = Autier P | title = Cutaneous malignant melanoma: facts about sunbeds and sunscreen | journal = Expert Rev Anticancer Ther | volume = 5 | issue = 5 | pages = 821–33 | year = 2005 | pmid = 16221052 | doi = 10.1586/14737140.5.5.821}}</ref> , بعد اجراءات الحماية من أشعة الشمس و ارتداء ملابس واقية الشمس (القمصان بأكمام طويلة وسراويل طويلة، والقبعات واسعة الحواف) يمكن أن تقدم الحماية. استخدام الضوء الاصطناعي لدباغة كان يعتقد يساعد في منع سرطانات الجلد، ولكن يمكن أن يؤدي في الواقع إلى زيادة في حدوث الأورام الميلانينية<ref>{{cite journal |vauthors=Clough-Gorr KM, Titus-Ernstoff L, Perry AE, Spencer SK, Ernstoff MS |title=Exposure to sunlamps, tanning beds, and melanoma risk |journal=Cancer Causes Control |volume=19 |issue=7 |pages=659–69|date=September 2008 |pmid=18273687 |doi=10.1007/s10552-008-9129-6 }} |
|||
</ref> . لتقليل التعرض للضوء فوق البنفسجي فمن المستحسن تجنب الشمس بين الساعة 9:00 و 3:00 أو تجنب أشعة الشمس عندما يكون ظل أقصر من ارتفاعه. |
|||
=== واقي الشمس === |
|||
==الأسباب== |
|||
واقيات الشمس يبدو انها قد تكون فعالة من الميلانوما<ref name=WCR2014/><ref name=SunM>{{cite journal |vauthors=Kanavy HE, Gerstenblith MR | title = Ultraviolet radiation and melanoma | journal = Semin Cutan Med Surg | volume = 30 | issue = 4| pages = 222–8 |date=December 2011 | pmid = 22123420 | doi = 10.1016/j.sder.2011.08.003 }}</ref>. في الماضي، و قد أوصى استخدام واقيات الشمس مع عامل حماية من الشمس (SPF) تصنيف 50 أو أعلى على المناطق المعرضة كما ان واقيات الشمس القديمة أكثر فعالية مع ارتفاعSPF)<ref>[http://www.cancer.org/docroot/cri/content/cri_2_4_2x_can_melanoma_be_prevented_50.asp Can Melanoma Be Prevented?] {{wayback|url=http://www.cancer.org/docroot/cri/content/cri_2_4_2x_can_melanoma_be_prevented_50.asp |date=20060627025413 }}</ref>). |
|||
يحمي واقي الشمس أيضا ضد سرطان الخلايا الحرشفية وسرطانات جلد أخرى<ref name=SunS>{{cite journal |author1=Burnett M.E. |author2=Wang S.Q. | title = Current sunscreen controversies: a critical review | journal = Photodermatology, Photoimmunology & Photomedicine | volume = 27 | issue = 2 | pages = 58–67 |date=April 2011 |pmid = 21392107 | doi = 10.1111/j.1600-0781.2011.00557.x }}</ref>. |
|||
== العلاج == |
|||
تعزى أسباب السرطانات المختلفة إلى خلل يصيب [[الحمض النووي]] داخل الخلايا، قد يكون هذا خلل وراثيا في شكل طفرات جينية، لكنه في أغلب الحالات يتطور تدريجيا خلال حياة الشخص وتسببه عوامل بيئية، ويؤدي هذا الخلل إلى تضخم الخلية دون سيطرة مسببا ورم، وتسبب غالبا أشعة الشمس فوق البنفسجية الميلانوما وكذلك من الممكن أن تسهم بالمرض الأشعة البنفسجية المستخدمة في أجهزة تسمير البشرة. |
|||
[[ملف:Malignant melanoma on chest.jpg|تصغير|يسار|الميلانوما الخبيث واسع النطاق على صدر شخص]] |
|||
يتم تاكيد التشخيص السريري مع خزعة الجلد, وعادة يعقب هذا المر مع استئصال على نطاق اوسع لندبة او ورم, اعتمادا على المراحل يتم اخذ خزعة العقد الليمفاوية الحارسة, كذلك على الرغم من وجود جدل حول هذا الاجراء<ref>{{cite web|url=http://www.malignant-melanoma.org/sentinel-node-biopsy/sentinel-node-biopsy-false-positivity/ |title=The Sentinel Node Biopsy Procedure in Melanoma does not offer a survival advantage |publisher=Malignant Melanoma |date=2008-01-08 |accessdate=2012-08-13}}</ref> يتم اجراء علاج للميلانوما المتقدمة باتباع نهج متعدد التخصصات. |
|||
=== الجراحة === |
|||
==التاريخ الطبيعي للمرض== |
|||
استئصال الخزعات قد تزيل الورم ولكن مزيد من الجراحة غالبا ما يكون ضروريا للحد من عودته. الاستئصال الجراحي الكامل مع هوامش جراحية كافية وتقييم لوجود واكتشاف المرض المنتشر جنبا الى جنب مع متابعة قصيرة وطويلة الاجل هو معيار. وغالبا ما يتم ذلك مع استئصال محلي واسع (WLE wide local excision) مع هامش 1-2 سم. يتم التعامل مع الميلانوما ونمشه خبيثة مع هوامش جراحية اضيق عادة من 0.2-0.5 سم. معظم الجراحين ينظرون الى ان 0.5 سم مستوى الرعاية لاستئصال الميلانوما في الموقع<ref>{{cite journal |vauthors=Clark GS, Pappas-Politis EC, Cherpelis BS, etal |title=Surgical management of melanoma in situ on chronically sun-damaged skin |journal=Cancer Control |volume=15 |issue=3 |pages=216–24 |date=July 2008 |pmid=18596673}}</ref>. ولكن 0.2 سم قد يكون مقبولا. يهدف الاستئصال الواسع للحد من عودة [[الورم]] في موقع الافة الاصلية هذا هو النمط الشائع في العلاج لفشل الميلانوما. وتهدف البحوث الواسعة لتوضيح هوامش مناسبة للاستئصال مع الاتجاه العام نحو علاج اقل قوة في العقود الماضية.<ref>{{cite journal |vauthors=Balch C, Urist M, Karakousis C, Smith T, Temple W, Drzewiecki K, Jewell W, Bartolucci A, Mihm M, Barnhill R | title = Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial | journal = Ann Surg | volume = 218 | issue = 3 | pages = 262–7; discussion 267–9 | year = 1993 | pmid = 8373269 | doi = 10.1097/00000658-199309000-00005 | pmc = 1242959}}</ref> |
|||
تم الابلاغ عن جراحة موس ( الجراحة الكيميائية) مع نسبة شفاء منخفضة تصل ال 77%<ref name="Mikhail, G. Mohs Micrographic Surgery 1991, pp. 13">{{cite book|first1=Frederic Edward |last1=Mohs|first2=George R. |last2=Mikhail|title=Mohs micrographic surgery|url=https://books.google.com/books?id=8j9sAAAAMAAJ |date=January 1991|publisher=W.B. Saunders|isbn=978-0-7216-3415-9 |pages=13–14}}</ref> وتصل ال 98% للميلانوما في الموقع<ref name=Bene08>{{cite journal |vauthors=Bene NI, Healy C, Coldiron BM |title=Mohs micrographic surgery is accurate 95.1% of the time for melanoma in situ: a prospective study of 167 cases |journal=Dermatol Surg |volume=34 |issue=5 |pages=660–4 |date=May 2008 |pmid=18261099 |doi=10.1111/j.1524-4725.2007.34124.x |url=http://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=1076-0512&date=2008&volume=34&issue=5&spage=660 |quote=Cure rate as high as 98% for small melanoma in situ, and as high as 95% noted for lentigo maligna variant of melanona in situ has been reported with [[Mohs surgery]].}}</ref>. الميلانوما التي تنتشرعادة إلى العقد الليمفاوية في منطقة الورم قبل أن تنتشر في أماكن أخرى, نحاول لتحسين البقاء على قيد الحياة عن طريق ازالة الغدد الليمفاوية جراحيا (استئصال الغدد الليمفاوية ) وترتبط مع العديد من المضاعفات ولكن عموما لا فائدة , مؤخرا تم تطوير هذه التقنية للحد من مضاعفات هذه العملية الجراحية في حين انتشر هذا الورم للعقد الليمفاوية<ref>[http://www.malignant-melanoma.org/surgery/lymph-node-dissection-surgery/ Malignant-Melanoma.org]</ref>. خزعة[[العقد اللمفاوية|العقد الليمفاوية]]الحارسه هو إجراء يستخدم على نطاق واسع عند علاج الميلانوما الجلدية<ref>{{cite journal|last=Crowson|first=AN|author2=Haskell, H|title=The role of sentinel lymph-node biopsy in the management of cutaneous melanoma.|journal=Giornale italiano di dermatologia e venereologia : organo ufficiale, Societa italiana di dermatologia e sifilografia|date=Oct 2013|volume=148|issue=5|pages=493–9|pmid=24005142}}</ref><ref>{{cite journal|last=Ross|first=MI|author2=Gershenwald, JE|title=Sentinel lymph node biopsy for melanoma: a critical update for dermatologists after two decades of experience.|journal=Clinics in dermatology|date=May–Jun 2013|volume=31|issue=3|pages=298–310|pmid=23608449|doi=10.1016/j.clindermatol.2012.08.004}}</ref>. لا خزعة ليمفاوية ولا اختبارات شخصية اخرى يجب ان تنفذ لتقييم في وقت مبكر, الميلانوما الرقيقة بما في ذلك الميلانوما في مرحلة T1a ميلانوما او T1b ميلانوما اقل او تساوس 0.5 مم.<ref name="AADfive">{{Citation |author1=American Academy of Dermatology |author1-link=American Academy of Dermatology |date=February 2013 |title=Five Things Physicians and Patients Should Question |publisher=[[American Academy of Dermatology]] |work=[[Choosing Wisely]]: an initiative of the [[ABIM Foundation]] |page= |url=http://www.choosingwisely.org/doctor-patient-lists/american-academy-of-dermatology/ |accessdate=5 December 2013}}, which cites |
|||
*{{cite journal |last1=Bichakjian |first1=CK |last2=Halpern |first2=AC |last3=Johnson |first3=TM |last4=Foote Hood |first4=A |last5=Grichnik |first5=JM |last6=Swetter |first6=SM |last7=Tsao |first7=H |last8=Barbosa |first8=VH |last9=Chuang |first9=TY |last10=Duvic |first10=M |last11=Ho |first11=VC |last12=Sober |first12=AJ |last13=Beutner |first13=KR |last14=Bhushan |first14=R |last15=Smith Begolka |first15=W |author16=American Academy of Dermatology |title=Guidelines of care for the management of primary cutaneous melanoma. American Academy of Dermatology. |journal=Journal of the American Academy of Dermatology |date=Nov 2011 |volume=65 |issue=5 |pages=1032–47 |pmid=21868127 |doi=10.1016/j.jaad.2011.04.031}} |
|||
*{{cite book|title=AJCC cancer staging manual|year=2010|publisher=Springer|location=New York|isbn=978-0-387-88440-0|author=American Joint Committee on Cancer|edition=7th|editor=Stephen B. Edge}} |
|||
*{{Citation |author=National Comprehensive Cancer Network |year=2012 |title=National Comprehensive Cancer Network clinical practice guidelines in oncology (NCCN Guidelines): melanoma |publisher=National Comprehensive Cancer Network |publication-place=[[Fort Washington, Pennsylvania]] |page= |url=https://subscriptions.nccn.org/gl_login.aspx?ReturnURL=http://www.nccn.org/professionals/physician_gls/pdf/melanoma.pdf |accessdate=5 December 2013}}{{closed access}}</ref>. |
|||
الناس مع هذه الظروف من غيرالمرجح أن يكون السرطان انتشر إلى الغدد الليمفاوية أو في أي مكان آخر، و بالفعل 97٪ معدل البقاءعلى قيد الحياة لمدة 5 سنوات <ref name="AADfive"/>. بسبب هذه الأمور، خزعة العقدة الليمفاوية الحارسة هو الرعاية الصحية غير الضرورية لهم <ref name="AADfive"/>. و علاوة على ذلك، اختبارات الدم الأساسية و الدراسات الشعاعية لاينبغي القيام بها إلا على أساس تحديد هذا النوع من الميلانوما كما أنها كاختبارات أكثر دقة للكشف عن السرطان و هذه الاختبارات لديهم معدلات إيجابية كاذبة عالية<ref name="AADfive"/>. |
|||
غالبا ما تنفذ خزعة العقدة الليمفاوية الحارسه وخاصة بالنسبة للT1B / T2 + الأورام و أورام الغشاء المخاطي [[سرطان الجلد]] العين والأورام في الأطراف (بحاجة لمصدر), يتم اجراء عملية تسمى lymphoscintigraphy حيث يتم حقن التتبع الإشعاعي في موقع الورم لحصرالعقدة \ العقد الحارسة يتم توفير مزيد من الدقة باستخدام كاشف صبغة زرقاء, ويتم تنفيذ عملية جراحية لخزعة العقدة\العقد. |
|||
اذا العقد الليمفاوية حسنة وهذا يتوقف على مدى انتشار العقد الليمفاوية وغالبا ما يتم تنفيذ تشريح متطرف للعقدةالليمفاوية, اذا تم استئصال المرض تماما سوف يلجأ المريض للعلاج المساعد خزعة الجلد المتأصلة يتمثل في كيفية ادارة الاختيار, هنا يتم ازالة الافة المشبوهة تماما ( ولكن عادة اقل شئ 1-2 مم )القطع الناقص من الجلد والانسجة المحيطة بها<ref>{{Cite journal|vauthors=Swanson N, Lee K, Gorman A, Lee H | title = Biopsy techniques. Diagnosis of melanoma | journal = Intensive 2011: The Third International Conference on Resource Intensive Applications and Services | volume = 20 | issue = 4 |pages = 677–80 | year = 2002 | pmid = 12380054 | doi = 10.1016/S0733-8635(02)00025-6}}</ref>. لتجنب تصريف الليمفاوي المحلي يفضل ان يكون الهامش الجراحي للخزعة ضيق 1 مم, وينبغي أن تتضمن خزعة من [[البشرة]] و [[الجلد]]، و طبقات تحت الجلد.وهذا يتيحلل اختصاصي الهيستوباثولوجيا لتحديد سماكة من [[سرطان الجلد]] عن طريق الفحص المجهري. يتم وصف هذا عن طريق سمك بريسلوفي (قياس في ملليمتر). ومع ذلك، للآفات الكبيرة مثل النمشة الخبيثة او الآفات في المناطق الصعبة جراحيا (الوجه والقدمين و الأصابع و الجفون)، في أي حال من الاحوال يجب ان تتضمن الخزعة الاولية هامش الجراحية النهائي (0.5 سم، 1.0 سم،أو 2 سم), و ذلك التشخيص الخاطئ يمكن أن يؤدي إلى الظهورالمفرط للندب و الإصابة بالأمراض من الإجراء و الاستئصال الأولي الكبير يعطل التصريف الليمفاوي المحلي و يمكن أن تؤثر صورة الاوعية الليمفاوية المباشرة على تشريح [[العقد اللمفاوية|العقد الليمفاوية]]. |
|||
=== إضافة على العلاج === |
|||
الميلانوما عالية المخاطر قد تتطلب العلاج المساعد على الرغم من التوجهات لهذا قد تختلف باختلاف البلدان. في الولايات المتحدة فان معظم المرضى في صحة جيدة, تبدأ جرعة عالية من العلاج "الانترفيرون" تصل الى عام والتي لها اثار جانبية خطيرة ولكن قد تتحسن احوال المريض قليلا<ref>{{cite journal |vauthors=Kirkwood J, Strawderman M, Ernstoff M, Smith T, Borden E, Blum R | title = Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684 | journal = J Clin Oncol | volume = 14 | issue = 1 | pages = 7–17 | year = 1996 | pmid = 8558223}}</ref>. لكن الجمعية البيريطانية للمبادئ التوجيهية لامراض الجلدية في حالة الميلانوما ان الانترفيرون لا ينصح كعلاج مساعد للميلانوما<ref name="Dermatologists' Management Guidelines">{{cite book|last=English|title=British Association of Dermatologists' management guidelines|year=2010|publisher=Wiley-Blackwell|location=Chichester, West Sussex|isbn=978-1-4443-3552-1|url=http://as.wiley.com/WileyCDA/WileyTitle/productCd-1444335529,descCd-buy.html|editor1=Neil H. Cox |editor2=John S.C. |accessdate=19 August 2013}}</ref>. وفي عام 2011 استخلص من التحليل ان الانترفيرون يمكن ان يطيل الوقت قبل ان تعود الميلانوما مرة اخرى ولكن تزيد نسبة البقاء على قيد الحياة بنسبة 3% لمدة 5 سنوات والاثار غير السارة ايضا تقلل نوعية الحياة الى حد كبير<ref>{{cite journal |vauthors=Wheatley K, Ives N, Eggermont A, etal | year = 2007 | title = Adjuvant therapy for melanoma: an individual patient meta-analysis of randomised trials | url = | journal = J Clin Oncol | volume = 25 | issue = | page = 8526 }}</ref>. في اوروبا عادة لا يتم استخدام الانتروفيرون خارج نطاق التجارب السريرية<ref>{{cite journal |vauthors=Kirkwood J, Ibrahim J, Sondak V, Richards J, Flaherty L, Ernstoff M, Smith T, Rao U, Steele M, Blum R | title = High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190 | journal = J Clin Oncol | volume = 18 | issue = 12 | pages = 2444–58 | year = 2000 | pmid = 10856105}}</ref><ref>{{cite journal |vauthors=Kirkwood J, Ibrahim J, Sondak V, Ernstoff M, Ross M | title = Interferon alfa-2a for melanoma metastases | journal = Lancet | volume = 359 | issue = 9310 | pages = 978–9 | year = 2002 | pmid = 11918944 | doi = 10.1016/S0140-6736(02)08001-7}}</ref>. |
|||
ويمكن الكشف عن الأورام الميلانينية المتنقله بواسطة [[الأشعة السينية]] و المقطعية، [[الرنين المغناطيسي]] و التصويرPETوPET / CTS و الموجات فوق الصوتية و اختبار LDH و الكشف الضوئي<ref>{{cite journal |vauthors=Weight RM, Viator JA, Dale PS, Caldwell CW, Lisle AE | title = Photoacoustic detection of metastatic melanoma cells in the human circulatory system | journal = Opt Lett.| volume = 31 | issue = 20 | pages = 2998–3000 | year = 2006 | pmid = 17001379 | doi = 10.1364/OL.31.002998}}</ref>. |
|||
=== العلاج الكيميائي والعلاج المناعي === |
|||
يختلف وكلاء العلاج الكيميائي بما في ذلك داكاربازين (و هو ما يسمى أيضا DTIC)، العلاج المناعي (معانترلوكين 2 (IL-2) أو الانتروفيرون وكذلك الرذاذ المحلي يتم استخدامها من قبل مراكز مختلفة النجاح الشامل في [[سرطان الجلد]] المنتشر محدود للغاية.<ref>{{cite journal |vauthors=Bajetta E, Del Vecchio M, Bernard-Marty C, Vitali M, Buzzoni R, Rixe O, Nova P, Aglione S, Taillibert S, Khayat D |title=Metastatic melanoma: chemotherapy |journal=Semin Oncol |volume=29 |issue=5 |pages=427–45 |year=2002 |pmid=12407508 |doi=10.1053/sonc.2002.35238}}</ref> |
|||
IL-2 )Proleukin) كان اول علاج جديد قُبل (1990 أوروبا، 1992 الولايات المتحدة الامريكية ) لعلاج الميلانوما المنتشر في 20 سنة . وقد اثبتت الدراسات ان IL-2توفرإمكانية تخفيف كامل وطويل الامد في هذا المرض على الرغم من نسبة صغيرة في المرضى<ref>{{cite journal |author=Buzaid A |title=Management of metastatic cutaneous melanoma |journal=Oncology (Williston Park) |volume=18 |issue=11 |pages=1443–50; discussion 1457–9 |year=2004 |pmid=15609471}}</ref>. داخل الآفةIL-2 في عبور النقيلة لديها معدل استجابة كاملة عالية تتراوح 40-100٪. <ref name="Current_Future_Melanoma">{{cite journal |vauthors=Maverakis E, Cornelius LA, Bowen GM, Phan T, Patel FB, Fitzmaurice S, He Y, Burrall B, Duong C, Kloxin AM, Sultani H, Wilken R, Martinez SR, Patel F |title=Metastatic melanoma - a review of current and future treatment options |journal=Acta Derm Venereol |volume=95 |issue=5 |pages=516–524 |year=2015 |pmid=25520039 |doi=10.2340/00015555-2035}}</ref>. وقد تمت الموافقة على العلاج الكيميائي الجديد drug temozolomide من قبل مؤسسة الغذاء والدواء عام1999 . |
|||
في عام 2009 واعتبرمشاركة التجارب السريرية على لرعاية الميلانوما المنتشر <ref>{{cite journal |vauthors=Bhatia S, Tykodi SS, Thompson JA |title=Treatment of Metastatic Melanoma: An Overview |journal=Oncology |volume=23 |issue=6 |year=2009 |url=http://www.cancernetwork.com/display/article/10165/1413720 |pmid=19544689 |pages=488–96 |pmc=2737459}}</ref>. |
|||
وتشمل علاجات بيولوجية مناعية للميلانوما المنتشره ipilimumab،pembrolizumab،وnivolumab. مثبطات BRAF، مثل vemurafenibوdabrafenib. وtrametinib <ref name="Current_Future_Melanoma"/>. |
|||
البحوث الجارية تبحث في العلاج عن طريق نقل الخلايا بالتبني<ref>{{cite journal|last1=Rosenberg|first1=SA|last2=Restifo|first2=NP|title=Adoptive cell transfer as personalized immunotherapy for human cancer.|journal=Science|date=3 April 2015|volume=348|issue=6230|pages=62–8|pmid=25838374|doi=10.1126/science.aaa4967}}</ref>,وتطبق قبل التحفيز او التعديل على خلايا T<ref>Med Sci Monit. 2014 Jun 10;20:953-9. doi: 10.12659/MSM.890496. Clinical application of adoptive T cell therapy in solid tumors. Zang YW, Gu XD, Xiang JB, Chen ZY</ref> او ممكن الخلايا الجذعية<ref>{{cite journal |last1=Van Lint |first1=S |last2=Wilgenhof |first2=S |last3=Heirman |first3=C |last4=Corthals |first4=J |last5=Breckpot |first5=K |last6=Bonehill |first6=A |last7=Neyns |first7=B |last8=Thielemans |first8=K |title=Optimized dendritic cell-based immunotherapy for melanoma: the TriMix-formula. |journal=Cancer immunology, immunotherapy : CII |date=September 2014 |volume=63 |issue=9 |pages=959–67 |pmid=24878889 |doi=10.1007/s00262-014-1558-3}}</ref>. |
|||
=== نمشة خبيثة === |
|||
تبدأ الحالة المبكرة من الميلانوما عندما تأخذ الخلايا الصبغية في التكاثر دون سيطرة، حيث تتواجد الخلايا الصبغية بين الطبقة الخارجية (البشرة)، والطبقة التي تليها (الأدمة), وتدعى هذه الحالة المبكرة من المرض مرحلة النمو الكعبي، ويكون سمك الورم فيها أقل من إنش واحد، ويكون احتمال انتشار الورم إلى أجزاء أخرى من الجسم ضئيلا لأن السرطان لم يصل بعد الأوعية الدموية أسفل البشرة، وإذا اكتشفت الميلانوما في هذه المرحلة فبالإمكان استئصالها جراحيا بشكل كامل. |
|||
لا يزال يجري الاستئصال من قبل معظم الجراحين, لسوء الحظ فان معدل عودتها مرتفع يصل الى 50%. ويرجع ذلك الى الهامش الجراحي المرئي الغير واضح, والموقع الوجهي للافات (في كثير من الأحيان يضطر الجراح إلى استخدامها مشال جراحية الضيق), وق دتم إجراء جراحة موسم بنسبة الشفاء ذكر تأنت كون منخفضة مثل 77٪،<ref name="Mikhail, G. Mohs Micrographic Surgery 1991, pp. 13"/> ويصل إلى 95٪ من مؤلف آخر<ref name=Bene08/>. بعض الشامات والميلانوما ،في الوضع الطبيعي (نمشة خبيث) قد تحمل عالعلاج التجريبي ,imiquimod الدرا الكريم موضعي لتعزيز [[المناعة]]. |
|||
بعض جراحين الجلد يجمعو بين اسلوبين : |
|||
استئصال السرطان جراحيا ومن ثم علاج المنطقة ب الدرا كريم بعد العمل الجراحي لمدة ثلاثة اشهر |
|||
=== العلاج الاشعاعي === |
|||
وكثيرا ما يستخدم العلاج الإشعاعي بعد الاستئصال الجراحي لمرضى الميلانوما محليا أو إقليميا أو متقدمة للمرضى الذين يعانون من النقائل البعيدة الغير منتشرة. |
|||
وغالبا ما تستخدم [[الاشعة السينية]] لهذه العلاجات ويكون ملكا للجرعة الإشعاعية القصوى التيتحدث بالقرب من سطح [[الجلد]]<ref>{{cite journal|last1=Hill|first1=R|last2=Healy|first2=B|last3=Holloway|first3=L|last4=Kuncic|first4=Z|last5=Thwaites|first5=D|last6=Baldock|first6=C|title=Advances in kilovoltage x-ray beam dosimetry.|journal=Physics in medicine and biology|date=21 March 2014|volume=59|issue=6|pages=R183-231|pmid=24584183|doi=10.1088/0031-9155/59/6/r183}}</ref>. أنه قد يقلل من معدل تكرار رجوعها المحلي ولكن لا يطيل البقاء على قيد الحياة.<ref>{{cite journal |vauthors=Bastiaannet E, Beukema J, Hoekstra H | title = Radiation therapy following lymph node dissection in melanoma patients: treatment, outcome and complications | journal = Cancer Treat Rev | volume = 31 | issue = 1 | pages = 18–26 | year = 2005 | pmid = 15707701 | doi = 10.1016/j.ctrv.2004.09.005}}</ref> اعلاج المناعي الاشعاعي للميلانوما المنتشرة حاليا قيد الفحص العلاج الاشعاعي له دور في التخفيف من الميلانوما المنتشرة<ref>{{cite book|author=Boyer|others=Ford|title=Primary Care Oncology|year=1999}}</ref>. |
|||
== التنبؤ == |
|||
وعندما تبدأ الخلايا السرطانية بالانتشار في أجزاء مختلفة – عموديا باتجاه البشرة وباتجاه الأدمة الحليمية – فإن سلوك الخلايا يتغير بشكل كبير. |
|||
[[ملف:Diagram_showing_the_most_common_places_for_melanoma_to_spread_to_CRUK_312.svg|تصغير|يسار|رسم تخطيط ييبين مواقع الأكثر شيوعا لانتشار الميلانوما]] |
|||
ويكون الخطوة التالية في تطور المرض هي طور التكاثر الغازي الكعبي، وهو مصطلح مربك, لكنه يشرح الخطوة التالية في تطور التكاثر الكعبي عندما تكتسب خلايا فردية القدرة على الغزو، وهذه الخطوة مهمة جدا لأنه من تلك اللحظة تكون الملانويا قادرة على الانتشار، ويكون عامل البريسلو (طريقة في تشخيص العمق) للضرر أقل من مليمتر (0،04 إنش)، ومستوى الكلرك (مستوى الغزو التشريحي) عادة 2. |
|||
الميزات التي تؤثر على التشخيص هي سمك [[الورم]] في ملليمتر (عمق بريسلو)، والعمق المتعلق بهياكل الجلد (مستوى كلارك), نوع الميلانوما, وجود تقرح وانتشار حول العصب,الانتشار, وجود [[الخلايا اللمفاوية|الخلايا الليمفاوية]] وانتشار الورم, (اذا كان موجودا التشخيص افضل) , موقع الافة, وجود ورم خبيث في المنطقة او بعيد<ref>{{Cite journal|vauthors=Homsi J, Kashani-Sabet M, Messina J, Daud A | title = Cutaneous melanoma: prognostic factors | journal = Cancer Control | volume = 12 | issue = 4 | pages = 223–9 | year = 2005 | pmid = 16258493 |url=https://www.moffitt.usf.edu/pubs/ccj/v12n4/pdf/223.pdf |format=PDF}}</ref>. انواع معينه من الميلانوما لها توقعات اسوأ ولكن هذا ما يفسره سمكها زمن المثير للاهتمام الميلانوما الاقل انتشارا حتى الانتشار مع [[العقد اللمفاوية|العقد الليمفاوية]] لها توقعات افضل من الميلانوما المنتشره عميقا دون الانتشار. |
|||
VGPمرحلة |
|||
عندما تنتشر الميلانوما الى الغدد الليمفاوية, واحدة من اهم العوامل عدد العقد المصابة, ومدى خباثة الورم في العقدة. |
|||
الخطوة التابعة من التطور هي الملانويا الغازية - طور التكاثر العامودي- فعندما يحصل الورم على القدرة على الغزو فهذا يعني أن بإمكانه أن يتوغل في الأنسجة المجاورة وأن ينتشر في أنحاء الجسم من خلال الأوعية الدموية أو الليمفاوية. |
|||
عندما يوجد ورم خبيث بعيد يعتبر السرطان عموما غير قابل للشفاء, معدل البقاء على قيد الحياة لمدة 5 سنوات اقل من 10%<ref name=AJCC>{{Cite journal|vauthors=Balch C, Buzaid A, Soong S, Atkins M, Cascinelli N, Coit D, Fleming I, Gershenwald J, Houghton A, Kirkwood J, McMasters K, Mihm M, Morton D, Reintgen D, Ross M, Sober A, Thompson J, Thompson J | title = Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma | journal = J Clin Oncol | volume = 19 | issue = 16 | pages = 3635–48 | year = 2001 | pmid = 11504745 |url=http://www.jco.org/cgi/content/full/19/16/3635}}</ref>, والبقاء على قيد الحياة 6-12 شهر, العلاج هو المسكن مع على امتداد الحياة وكيفيتها, في بعض الحالات قد يعيش المرضى اشهرا او حتى عدة سنوات مع الميلانوما المنتشرة اعتمادا على شدتها الانتشار على الجلد والرئتين لهم تنبؤ افضل بينما النتشار [[الدماغ|للدماغ]] و[[العظام]] و[[الكبد]] لهم تنبؤ اسوأ, البقاء على قيد الحياة بالميلانوما المنتشرة في موقع افضل من الورم الرئيس الغير معروف.<ref>{{cite journal|last1=Bae|first1=JM|last2=Choi|first2=YY|last3=Kim|first3=DS|last4=Lee|first4=JH|last5=Jang|first5=HS|last6=Lee|first6=JH|last7=Kim|first7=H|last8=Oh|first8=BH|last9=Roh|first9=MR|last10=Nam|first10=KA|last11=Chung|first11=KY|title=Metastatic melanomas of unknown primary show better prognosis than those of known primary: a systematic review and meta-analysis of observational studies.|journal=Journal of the American Academy of Dermatology|date=January 2015|volume=72|issue=1|pages=59–70|pmid=25440435|doi=10.1016/j.jaad.2014.09.029}}</ref> |
|||
يستدعي الغزو رد فعل مناعي ضد الورم (خلال مرحلة VGP)، والتي يمكن أن تشخص بوجود ونشاط الخلايا الليمفاوية المتسللة، وتدمر تلك الخلايا أحيانا الورم الابتدائي بشكل كامل، وهذه يطلق عليها مرحلة الانحدار ،وهي مرحلة لأخيرة في تطور الملانويا، وفي حالات معينة يدمر الورم الابتدائي بشكل كامل ويكتشف الورم الانبثاثي (الخبيث). |
|||
==الوراثة والجينات== |
|||
== علم الاوبئة == |
|||
في بعض الحالات، يسري سرطان الجلد في الأسرة، فلقد حددت عدة جينات مسئولة عن زيادة خطر تطور سرطان الجلد، فبعض الجينات النادرة تمثل خطرا عاليا نسبيا مسببة سرطان الجلد، بينما هناك جينات مثل الجين المدعو MCIR والذي يعطي اللون الأحمر للشعر، يمثل خطرا أقل بالنسية لسرطان الجلد، ويمكن استخدام الفحص الجيني لمعرفة ما إذا كان الشخص لديه أيا من الطفرات الجينية المعروفة. |
|||
[[File:Melanoma and other skin cancers world map - Death - WHO2004.svg|thumb|upright=1.15|الوفاة من الميلانوما وسرطانات الجلد الأخرى لكل 100000 نسمة في عام 2004<ref>{{cite web|url=http://www.who.int/healthinfo/global_burden_disease/estimates_country/en/index.html |title=WHO Disease and injury country estimates |year=2009 |work=World Health Organization |accessdate=Nov 11, 2009}}</ref>{{refbegin|2}} |
|||
وتزيد عدد من الطفرات النادرة التي تتوارث بالأسر قابلية الإصابة بسرطان الجلد، فأحد أصناف الطفرات تؤثر على جين CDKNA2، وتؤدي طفرة جينية نسبية في إطار القراءة إلى زعزعة P53، والذي يشكل عامل وصف في الموت المبرمج للخلايا وفي خمسين بالمئة من السرطانات التي تصيب البشر، وتنتج طفرة أخرى في نفس الجين مثبطًا غير وظيفي من CDK4 a [cyclin-dependent kinase] الذي يسمح بانقسام الخلايا، بينما الطفرات التي تسبب الحالة الجلدية Xeroderma Pigmentosum هي عرضة لسرطان الجلد، وتقلل هذه الطفرات من خلال توزعها على الجينيوم من قدرة الخلية على إصلاح DNA ،وكلٌ من طفرات CDKN2A and XP متوغلة للغاية. |
|||
{{legend|#b3b3b3|لا يوجد بيانات}} |
|||
{{legend|#ffff65|أقل من 0.7}} |
|||
{{legend|#fff200|0.7–1.4}} |
|||
{{legend|#ffdc00|1.4–2.1}} |
|||
{{legend|#ffc600|2.1–2.8}} |
|||
{{legend|#ffb000|2.8–3.5}} |
|||
{{legend|#ff9a00|3.5–4.2}} |
|||
{{legend|#ff8400|4.2–4.9}} |
|||
{{legend|#ff6e00|4.9–5.6}} |
|||
{{legend|#ff5800|5.6–6.3}} |
|||
{{legend|#ff4200|6.3–7}} |
|||
{{legend|#ff2c00|7–7.7}} |
|||
{{legend|#cb0000|أكثر من 7.7}} |
|||
{{refend}}]] |
|||
على الصعيد العالمي، في عام 2012،حدث الميلانوما في 232000 شخص وأدى إلى 55000حالة وفاة.<ref name=WCR2014/> أستراليا و نيوزيلندا لديها أعلى معدلات [[سرطان الجلد]] في العالم<ref name=WCR2014/>, فقد أصبح أكثر شيوعا في السنوات ال 20 الماضية في المناطق التي في معظمها القوقاز<ref name=WCR2014/>. |
|||
وقد ارتفعت نسبة الميلانوما في السنوات الأخيرة, و لكن من غير الواضح إلى أي مدى تغير السلوك، في البيئة، أو المشاركة في الكشف المبكر <ref>{{Cite journal|vauthors=Berwick M, Wiggins C | title = The current epidemiology of cutaneous malignant melanoma | journal = Front Biosci | volume = 11 | pages = 1244–54 | year = 2006| pmid = 16368510 | doi = 10.2741/1877}}</ref>. |
|||
=== استراليا === |
|||
ولدى [[أستراليا]] نسبة عاليةجدا - وتزايد – الميلانوما و في عام 2012، وقعت الوفيات الناجمة عن الميلانوما في 7،3-9،8 لكل 100،000 من السكان. في أستراليا، الميلانوما هي ثالث أكثر أنواع السرطان شيوعا في كلا الجنسين في الواقع نسبة حدوثه اعلى من [[سرطان الرئة]] وتشيرالتقديرات إلى أنه في عام 2012، تم تشخيص أكثر من 12000 الاستراليين مع الميلانوما حالات سرطان الجلد في أستراليا هي مسألة ذات أهمية، و ذلك للأسباب التالية: |
|||
*زاد معدل الاصابة بالميلانوما في الاستراليين الى ما يزيد عن 30 بالمائة بين عامين 1991 و 2009 |
|||
*اصابة الاستراليين بالميلانوما كانت في سن موحدة اعتبارا من عام 2008 بزيادة 12 مرة على الاقل من المستوى العالمي. |
|||
*حدوث الميلانوما الأسترالية وهي اعلى نسبة في العالم |
|||
*عموما الإصابة بالسرطان في سن موحد في أستراليا هو الأعلى في العالم, وهذا يعزى إلى الميلانوما وحدها. حدوث سرطان الكلي في سن موحد مشابه لنيوزيلندا، و لكن هناك فرق اذ اتدلاله إحصائية بين استراليا و جميع أجزاء أخر ىمن العالم المتقدم بما في ذلك أمريكا الشمالية و أوروبا الغربية، والبحرالأبيض المتوسط. |
|||
=== الولايات المتحدة === |
|||
في الولايات المتحدة يموت حوالي 9000 شخص من الميلانوما سنويا<ref name=Vital2015/> في عام 2011 اثرت 19.7 لكل 100،000، وأسفرت عن وفيات في 2.7 في 100،000 <ref name=Vital2015>{{cite journal|title=Vital Signs: Melanoma Incidence and Mortality Trends and Projections — United States, 1982–2030|journal=Morbidity and Mortality Weekly Report|date=June 2, 2015|url=http://www.cdc.gov/mmwr/preview/mmwrhtml/mm64e0602a1.htm?s_cid=mm64e0602a1_x}}</ref>. |
|||
== تاريخ == |
|||
==إشعاع أجهزة تسمير البشرة== |
|||
على الرغم من أن الميلانوما ليس مرضا جديداً، دليل على وقوعه في العصور القديمة نادرة إلى حد ما’ ومع ذلك مثال واحد يقع في 1960s من تسعة المومساء بيرو الكربون المشع تعود إلى أن ما يقرب من 2400 سنة، و التي أظهرت علامات واضحة من الميلانوما: الكتل الميلانينية في الجلد والنقائل المنتشرة في [[العظام]]<ref name="urteaga">{{Cite journal|vauthors=Urteaga O, Pack G | title = On the antiquity of melanoma | journal = Cancer | volume = 19 | issue = 5 | pages = 607–10 | year = 1966 | pmid = 5326247 | doi = 10.1002/1097-0142(196605)19:5<607::AID-CNCR2820190502>3.0.CO;2-8}}</ref>. |
|||
و ذكر جون هنتر أنه أول من عمل على [[سرطان الجلد]] المنتشر في 1787, على الرغم من عدم معرفة بالضبط ما كان عليه، وصفها بأنها "زائدة الكمئي سرطاني" وقدحفظ استئصال الورم في متحف هو نتيريانمن الكلية الملكية للجراحين في إنجلترا. لم يكن حتى عام 1968 أن الفحص المجهري للعينة كشفت أن يكون مثالا للميلانوما المنتشر<ref name="bodenham">{{Cite journal| author = Bodenham D | title = A study of 650 observed malignant melanomas in the South-West region | journal = Annals of the Royal College of Surgeons of England | volume = 43 | issue = 4 | pages = 218–39 | year = 1968 | pmid = 5698493 | pmc = 2312310}}</ref>. وكان الطبيب الفرنسي رينيه لينيك أول من وصف الميلانوما ككيان المرض, و قدم تقريره في البداية خلال محاضرة لكلية الحقوق جامعة الطب في باريس في عام 1804 ثم نشرت كنشرة في 1806 <ref name="laennec">{{Cite journal| author = Laennec RTH | year = 1806 | title = Sur les melanoses | journal = Bulletin de la Faculte de Medecine de Paris | volume = 1 | pages = 24–26}}</ref>. لأول مرة قدم التقرير باللغة الإنجليزية للميلانوما من قبل طبيب عام الإنجليزية من ستو وربريدج، وليام نوريسفي 1820 <ref name="norris1">{{cite journal |author=Norris, W. |title=A case of fungoid disease |journal=Edinb. Med. Surg. J. |volume=16 |pages=562–5 |year=1820 }}</ref>. في عمل لاحق له في عام 1857 انه لاحظ أن هناك استعداد عائلي لتطور الميلانوما (ثمانية حالات تصبغ مع ملاحظات المرضية و العلاجية على هذا المرض). كان نوريس أيضا رائد في يفترض وجود صلة بين الشامات و الميلانوما و احتمال وجود علاقة بين الميلانوما و التعرض للعوامل البيئية، بملاحظة أن معظم مرضاه كانو شاحبي البشرة<ref>Norris W. Eight cases of Melanosis with pathological and therapeutical remarks on that disease. London: Longman; 1857.</ref>. |
|||
جاء أول اعتراف رسمي من سرطان الجلد المتقدم غير قابل للعلاج من صموئيل كوبر في عام 1840, وقال إن الفرصة الوحيدة للعلاج تعتمد على الإزالة المبكرة للمرض (أي الاستئصال المبكر للكتل الخبيثة) <ref name="cooper">{{Cite book| last = Cooper | first = Samuel | title = First lines of theory and practice of surgery | publisher = Longman, Orme, Brown, Green and Longman | year = 1840 | location = London}}</ref>. |
|||
عالم سرطان الجلد من الالماني μέλας melas تعني الظلام<ref>[http://www.perseus.tufts.edu/hopper/text?doc=Perseus%3Atext%3A1999.04.0057%3Aentry%3Dme%2Flas μέλας], Henry George Liddell, Robert Scott, ''A Greek-English Lexicon'', on Perseus</ref>. |
|||
== البحث == |
|||
البحوث الدوائية للغير قطوعة أو الميلانوما النقيله تتيح إمكانيات العلاج الجديد<ref name="melanoma2012">{{cite journal|title=Drugs in Clinical Development for Melanoma|journal=Pharmaceutical Medicine|date=23 December 2012|volume=26|issue=3|pages=171–183|doi=10.1007/BF03262391|url=http://adisonline.com/pharmaceuticalmedicine/Abstract/2012/26030/Drugs_in_Clinical_Development_for_Melanoma__.4.aspx}}</ref>. بالاضافة الى التقدم مع عوامل وافقت مؤخرا البحوث الجارية الى الجمع بين العلاج مثل dabrafenibوtrametinib، قد تكشف عن خيار أكثر فعالية و أفضل السكوت للمرضى الذين يعانون من الميلانوما المنتشرة. و احد الطرق الهامة في تخليق الميلانين ينطوي على عامل النسخ MITF. الجين MITF هو حافظ جدا و يوجد في الناس، والفئران، والطيور، وحتى الأسماك. وينظم إنتاج MITF عن طريق مسار واضح إلى حد ما. الأشعة فوق البنفسجية رفعت التعبيرعن عامل النسخ البروتين p53 في الخلايا الكيراتينية، و البروتين p53 يسبب هذه الخلايا لإنتاج المنشط للخلايا الصباغية هرمون (MSH)، التي تربط لمستقبلات ميلانوكورتين 1 (MC1R) على الخلايا الصباغية. مرتبط في مستقبلات MC1R ينشط cyclases أدينيلات، و التي تنتج cAMPا لذي ينشط CREB، التي تشجع التعبيرMITF و تشمل أهداف MITF P16 (مثبطCDK ) وBcl2، الجين الضروري لبقاء الخلايا الصباغية غالبا ما يكون من الصعب تصميم الأدوية التي تتداخل مع عوامل النسخ، ولكن ربما سوف يتم اكتشاف الأدوية الجديدة التي يمكن أن تعوق بعض ردود الفعل في مسار MITF. دراسات هيكل كروماتين وعدت ايضا لتسليط الضوء على تنظيم النسخ في خلايا الميلانوما<ref>{{cite journal | author = Bastonini E | date = Sep 2014 | title = Chromatin barcodes as biomarkers for melanoma | url = | journal = Pigment Cell Melanoma Res | volume = 27 | issue = 5| pages = 788–800 | doi = 10.1111/pcmr.12258 |display-authors=etal}}</ref>. منذ فترة طويلة يفترض أن الجسيمات النووية متوضعة بشكل عشوائي على [[DNA]]، و لكن تشير الدراسات الفئران من الجينات المسؤولة عن إنتاج مادة الميلانين الآن أن الجسيمات النووية يتموضعها في نمطية على DNA. عندما يمر جين النسخ، موقع بداية النسخ منه هو دائما تقريبا خالية من الجسيم النووي. عندما يكون الجين صامت، و لكن في كثير من الأحيان الجسيمات النووية تحجب موقع بداية النسخ، مما يشير إلى أن موقف جسيم نووي قد يلعب دورا في تنظيم الجينات. وأخيرا، نظر الحقيقة أن الميلانين يساعد على حماية خلايا الجلد من الأشعة فوق البنفسجية التي يسبب الضرر,استراتيجيات جديدة للوقاية من سرطان الجلد يمكن أن تنطوي على محاولات للحث على الميلانين في الأفراد. حمرالشعر،على سبيل المثال، لا يضلل لأن لديهم طفرات MC1R. |
|||
=== العلاجات المستهدفة === |
|||
في البحوث السريرية و ضع علاجا تأخر ىمثل العلاج بالخلايا بالتبني أو العلاج الجيني، و يجري اختبارها<ref>{{cite journal |vauthors=Sotomayor M, Yu H, Antonia S, Sotomayor E, Pardoll D | title = Advances in gene therapy for malignant melanoma | journal = Cancer Control | volume = 9 | issue = 1 | pages = 39–48 | year = 2002| pmid = 11907465|format=PDF}}</ref>. نوعين من العلاجات التجريبية المتقدمة في المعهد الوطني للسرطان (NCI)، و قد استخدمت في الميلانوما المنتشر نجاح مؤقت<ref name=Hershkovitz10>{{cite journal |vauthors=Hershkovitz L, Schachter J, Treves AJ, Besser MJ |title=Focus on adoptive T cell transfer trials in melanoma |journal=Clin. Dev. Immunol. |volume=2010 |page=260267 |year=2010 |pmid=21234353 |pmc=3018069 |doi=10.1155/2010/260267 }}</ref>. |
|||
المعالجة الأولى تشمل العلاج بالتبني الخلية (ACT) باستخدام TILs [[الخلايا المناعية]] (الورم انتشر للخلايا الليمفاوية) معزولة عن الورم الميلانوما الشخص نفسه<ref name="Current_Future_Melanoma"/>. و تزرع هذه الخلايا بأعداد كبيرة في المختبر، وتعاد إلى المريض بعد العلاج الذي يقلل مؤقتا خلاياT الطبيعية في جسم المريض. علاج TIL يتبع استنزاف الخلايا الليمفاوية يمكن أن يؤدي إلى استجابة كاملة دائمة في مجموعة متنوعة من الاجهزة<ref>{{cite journal |vauthors=Dudley ME, Yang JC, Sherry R, etal |title=Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens |journal=J. Clin. Oncol. |volume=26 |issue=32 |pages=5233–9 |date=November 2008 |pmid=18809613 |pmc=2652090|doi=10.1200/JCO.2008.16.5449 |url=http://jco.ascopubs.org/content/26/32/5233.full}}</ref><ref name=Besser10>{{cite journal |vauthors=Besser MJ, Shapira-Frommer R, Treves AJ, etal |title=Clinical responses in a phase II study using adoptive transfer of short-term cultured tumor infiltration lymphocytes in metastatic melanoma patients |journal=Clin. Cancer Res. |volume=16 |issue=9 |pages=2646–55 |date=May 2010 |pmid=20406835 |doi=10.1158/1078-0432.CCR-10-0041 |url=http://clincancerres.aacrjournals.org/cgi/pmidlookup?view=long&pmid=20406835}}</ref> |
|||
المعالجة الثانية، نقل من الخلايا الليمفاوية ذاتي المعدلة وراثيا، ويعتمد على إيصال الجينات التي تكون ما يسمى مستقبلا بالخلايا التائية (TCRs)، إلى الخلايا الليمفاوية المريض<ref name="Current_Future_Melanoma"/>. بعد التلاعب الخلايا الليمفية تعرف وتربط بعض الجزيئات الموجودة على سطح خلايا الميلانوما و تقتلهم<ref name="nih">[http://www.nih.gov/news/pr/aug2006/nci-31b.htm Press release from the NIH]</ref>. |
|||
وهنا كل قاحل تدريب الجهازالمناعي لمحاربة السرطان أظهر تفائدة متواضعة في اختبار المرحلة الأخيرة في عام 2009 ضد الميلانوما <ref>{{cite news |title=Immune System Taught To Fight Melanoma |date=30 May 2009 |publisher=CBSNews |url=http://www.cbsnews.com/stories/2009/05/30/health/main5050957.shtml}}</ref><ref>{{Cite journal | doi = 10.1056/NEJMoa1012863| title = Gp100 Peptide Vaccine and Interleukin-2 in Patients with Advanced Melanoma| journal = New England Journal of Medicine| volume = 364| issue = 22| pages = 2119–2127| year = 2011| last1 = Schwartzentruber | first1 = D. J. | last2 = Lawson | first2 = D. H. | last3 = Richards | first3 = J. M. | last4 = Conry | first4 = R. M. | last5 = Miller | first5 = D. M. | last6 = Treisman | first6 = J. | last7 = Gailani | first7 = F. | last8 = Riley | first8 = L. | last9 = Conlon | first9 = K. | last10 = Pockaj | first10 = B. | last11 = Kendra | first11 = K. L. | last12 = White | first12 = R. L. | last13 = Gonzalez | first13 = R. | last14 = Kuzel | first14 = T. M. | last15 = Curti | first15 = B. | last16 = Leming | first16 = P. D. | last17 = Whitman | first17 = E. D. | last18 = Balkissoon | first18 = J. | last19 = Reintgen | first19 = D. S. | last20 = Kaufman | first20 = H. | last21 = Marincola | first21 = F. M. | last22 = Merino | first22 = M. J. | last23 = Rosenberg | first23 = S. A. | last24 = Choyke | first24 = P. | last25 = Vena | first25 = D. | last26 = Hwu | first26 = P. }}</ref>, و نتائج اختبار المرحلة الأولى في 2015 من العلاج الذي تدريب الجهاز المناعي على التعرف على كل الأفراد وأظهرت خلايا الورم القتامي بعض الأمل. |
|||
=== مثبط BARAF === |
|||
حوالي 60٪ من الأورام الميلانينية تحتوي على طفرة في الجين B-راف. و أشارت التجارب السريرية الأولى أن مثبطات B-راف بما في ذلك vemurafenib Plexxicon يمكن أن يؤدي إلى تراجع الورم كبير في الغالبية العظمى من المرضى إذا الورم تحتوي على طفرة B-راف<ref>{{cite news|url=http://www.nytimes.com/2010/02/22/health/research/22trial.html? | work=The New York Times | title=A Roller Coaster Chase for a Cure | first=Amy | last=Harmon | date=February 21, 2010}}</ref> في يونيو 2011، و أكدت التجارب السريرية الكبيرة النتائج الإيجابية من تلك التجارب السابقة <ref name="studies">{{cite news |publisher=New York Times|author=Andrew Pollack |date=June 5, 2011 |title=Drugs Show Promise Slowing Advanced Melanoma|url=http://www.nytimes.com/2011/06/06/health/research/06melanoma.html}}</ref><ref name="pmid21639808">{{cite journal|last=Chapman|first=Paul B.|coauthors=Hauschild, Axel; Robert, Caroline; Haanen, John B.; Ascierto, Paolo; Larkin, James; Dummer, Reinhard; Garbe, Claus; Testori, Alessandro; Maio, Michele; Hogg, David; Lorigan, Paul; Lebbe, Celeste; Jouary, Thomas; Schadendorf, Dirk; Ribas, Antoni; O'Day, Steven J.; Sosman, Jeffrey A.; Kirkwood, John M.; Eggermont, Alexander M.M.; Dreno, Brigitte; Nolop, Keith; Li, Jiang; Nelson, Betty; Hou, Jeannie; Lee, Richard J.; Flaherty, Keith T.; McArthur, Grant A.|title=Improved Survival with Vemurafenib in Melanoma with BRAF V600E Mutation|journal=New England Journal of Medicine|date=30 June 2011|volume=364|issue=26|pages=2507–2516|doi=10.1056/NEJMoa1103782|pmid=21639808|pmc=3549296}}</ref>. |
|||
في آب 2011 تلقى Vemurafenib موافقة مؤسسة الغذاء والدواء لعلاج المراحل المتأخرة من الميلانوما. في يونيو 2012 ذكرت الدراسة أن المرضى الذين يتناولون مختلف B-رافا ،Dabrafenib، كان أفضل من المرضى الذين يخضعون العلاج الكيميائي<ref name=r20150530>{{cite news | url = http://www.reuters.com/article/2013/05/30/us-glaxosmithkline-approvals-idUSBRE94S1A020130530 | title = GSK melanoma drugs add to tally of U.S. drug approvals | publisher = Reuters | date = May 30, 2013}}</ref>. و يعتقد بعض الباحثين أن العلاجات المركبة التي تمنع في نفس الوقت مسارات متعددة قد يحسن فعالية من خلال جعلها أكثر صعوبة للحصول على [[الخلايا السرطانية]] إلى التحور قبل تدميرها. في أكتوبر 2012 ذكرت الدراسة أن الجمع بين Dabrafenib معtrametinib مع مانع MEK أدى إلى نتائج أفضل. مقارنة Dabrafenib وحده، تم زيادة البقاء على قيد الحياة إلى 41٪ من 9٪، و ارتفع الرقم البقاء على قيد الحياة إلى 9.4 أشهر مقابل 5.8 أشهر. كانت بعض الآثارالجانبية، و مع ذلك فقد زاد في الدراسة مجتمعة <ref>{{cite news|publisher=News Medical|date=October 1, 2012|title=Combination of dabrafenib and trametinib delays development of treatment resistance in MM patients|url=http://www.news-medical.net/news/20121001/Combination-of-dabrafenib-and-trametinib-delays-development-of-treatment-resistance-in-MM-patients.aspx?page=2}}</ref><ref name="pmid23020132">{{cite journal|last=Flaherty|first=Keith T.|coauthors=Infante, Jeffery R.; Daud, Adil; Gonzalez, Rene; Kefford, Richard F.; Sosman, Jeffrey; Hamid, Omid; Schuchter, Lynn; Cebon, Jonathan; Ibrahim, Nageatte; Kudchadkar, Ragini; Burris, Howard A.; Falchook, Gerald; Algazi, Alain; Lewis, Karl; Long, Georgina V.; Puzanov, Igor; Lebowitz, Peter; Singh, Ajay; Little, Shonda; Sun, Peng; Allred, Alicia; Ouellet, Daniele; Kim, Kevin B.; Patel, Kiran; Weber, Jeffrey|title=Combined BRAF and MEK Inhibition in Melanoma with BRAF V600 Mutations|journal=New England Journal of Medicine|date=1 November 2012|volume=367|issue=18|pages=1694–1703|doi=10.1056/NEJMoa1210093|pmid=23020132|pmc=3549295}}</ref>. في يناير 2014، و افقت ادارة الاغذية والعقاقير مزيج من dabrafenib و trametinib لعلاج المرضى الذين يعانون من BRAF V600E / K-mutant الميلانوما المنتشر<ref>{{cite news | url = http://www.onclive.com/web-exclusives/FDA-Approves-First-Ever-Combination-for-Metastatic-Melanoma | title = Dabrafenib/Trametinib Combination Approved for Advanced Melanoma | publisher = OncLive | date = January 9, 2014}}</ref>. |
|||
المقاومةالمحتملة إلى BRAFوMEK مثبط اتقد يكون راجعا إلى بروتين سطح الخلية المعروفة باسم EphA2 الذي يجري الآن التحقيق فيها<ref>{{cite web |url=http://www.oncotherapynetwork.com/skin-cancer-melanoma-targets/counteracting-drug-resistance-melanoma |title=Counteracting Drug Resistance in Melanoma |year=2015 }}</ref>. |
|||
=== أساليب المراقبة === |
|||
وقد مكنت التطور ارتفاع دقة المسح الضوئي ب[[الموجات فوق الصوتية]] مراقبة عبء الانتشار إلى الغدد الليمفاوية <ref>{{cite journal |vauthors=Voit C, Van Akkooi AC, Schäfer-Hesterberg G, etal |title=Ultrasound morphology criteria predict metastatic disease of the sentinel nodes in patients with melanoma |journal=J. Clin. Oncol. |volume=28 |issue=5 |pages=847–52 |date=February 2010 |pmid=20065175 |doi=10.1200/JCO.2009.25.7428 |url=http://www.jco.org/cgi/pmidlookup?view=long&pmid=20065175}}</ref>. لفحص و مراقبة الموجات فوق الصوتية في الميلانوما تجربة (SUNMEL) هو تقييم [[الموجات فوق الصوتية]] كبديل للطرق الجراحية.<ref>[http://www.malignant-melanoma.org/sunmel The Screening and Surveillance of Ultrasound in Melanoma trial (SUNMEL)]</ref> |
|||
=== علاج بالفيروس اتحال الورم === |
|||
في بعض البلدان يتم دراسة طرق علاج ب[[الفيروسات]] حال الورم و يستخدم لعلاج الميلانوما. علاج بالفيروسات حال الورم هي فرع واعد للعلاج بالفيروسات، حيث تستخدم الفيروسات حال الورم لعلاج الأمراض. [[الفيروسات]] يمكن أن تزيد من عملية التمثيل الغذائي، و الحد من المناعة المضادة للورم و فسد النظام الأوعية الدموية <ref>{{cite journal|last=Forbes|first=NE|author2=Abdelbary, H|author3= Lupien, M|author4= Bell, JC|author5= Diallo, JS|title=Exploiting tumor epigenetics to improve oncolytic virotherapy.|journal=Frontiers in Genetics|date=Sep 20, 2013|volume=4|page=184|pmid=24062768|doi=10.3389/fgene.2013.00184}}</ref>. |
|||
Talimogene laherparepvec ) T-VEC)(و هو العلاج المناعي حال الورم نوع فيروس الهربس البسيط 1 المشتقة)، وقد تبين أن تكون مفيدة ضد الميلانوما المنتشره في عام 2015 مع بقاء زيادة قدرها 4.4 أشهر<ref>{{cite journal|title=Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma|journal=Journal of Clinical Oncology|date=2015|doi=10.1200/JCO.2014.58.3377|volume=33|pages=2780–2788}}</ref>. |
|||
== المراجع == |
|||
{{مراجع|2}} |
|||
في يوليو من 2009، أطلقت الأي آيه أر سي - وهي وكالة تابعة لمنظمة الصحة العالمية- تقريرا صنف أجهزة تسمير البشرة " كمسرطنة للبشر"، وكانت قد صنفتها مسبقا " على أنها ربما تكون مسرطنة "، وجاء هذا التغيير في التصنيف بعد تحليل ابيدمولوجي لأكثر من 20 دراسة، فتلك الدراسات أشارت أن الذين استخدمو أجهزة تسمير البشرة قبل عمر الثلاثين هم أكثر قابلية للإصابة بسرطان الجلد بنسبة 75%.</big> |
|||
{{أورام الجهاز البولي التناسلي الأنثوي}} |
{{أورام الجهاز البولي التناسلي الأنثوي}} |
||
{{شريط بوابات|طب}} |
{{شريط بوابات|طب}} |
||
نسخة 16:14، 21 يونيو 2016
| الميلانوما | |
|---|---|
صورة لميلانوما
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | سرطان الجلد، وسرطان خلوي ، ومرض |
| الإدارة | |
| أدوية | |
| التاريخ | |
| وصفها المصدر | الموسوعة السوفيتية الكبرى ، والموسوعة السوفيتية الأرمينية، المجلد السابع |
| تعديل مصدري - تعديل | |
الميلانوما، سرطان الخلايا الصبغية (بالإنجليزية: Melanoma)، أيضا يعرف بالورم الميلانيني الخبيث, وهو نوع من أنواع السرطانات الذي يتطور من الخلايا التي تحتوي على الصبغة -الغامقة "الميلانين المسؤولة عن لون البشرة"-المعروفة باسم الخلية الميلانينية[1]. عادة ما يحدث الورم الميلانيني في الجلد, ولكن نادرا ما يحدث في الفم والأمعاء والعين[1][2]أو أي أجزاء أخرى من الجسم. يعتبر سرطان الخلايا الصبغية أقل شيوعا مقارنة بالأنواع الأخرى من سرطانات الجلد، ولكنه أكثر خطورة وتعزى إليه غالبية (75%) الوفيات المرتبطة بسرطان الجلد، ويتم تشخيص 160000 حالة إصابة بسرطان الخلايا الصبغية سنويا في كل أرجاء العالم، ويرتفع معدل الإصابة بهذا السرطان عند النساء منه عند الرجال، وعند أصحاب البشرة الفاتحة بالتحديد, ممن يعيشون في مناطق مشمسة، وبمعدلات عالية في أستراليا ونيوزلندا، وأمريكا الشمالية، وشمال أوروبا.، وتنسب منظمة الصحة العالمية. في تقريرها أسباب 48000 حالة وفاة سنوية إلى سرطان الخلايا الصبغية. في النساء يشيع حدوث هذا المرض في الساقين, بينما في الرجال يشيع حدوثه في الظهر[2]. في بعض الأحيان تتطور من كتل تتعلق بتغيرات تتضمن زيادة في الحجم, حواف غير منتظمة, تغير اللون, حكة وتدمر الجلد[1]. السبب الرئيسي للأورام الميلانينية هو تعرض الذين لديهم مستويات منخفضة من صبغة الجلد "الميلانين" [2][3] للأشعة فوق البنفسجية. قد يكون ضوء الأشعة فوق البنفسجية من أشعة الشمس أو من أجهزة التسمير. تقريبا 25% يتطور من أورام وكتل جلدية[2]. هؤلاء الذين لديهم العديد من هذه الكتل أو الشامات يعود ذلك إلى أفراد العائلة المتضررين, وأولئك الذين لديهم ضعف في وظائف المناعة معرضون لخطر أكبر[1]. وهناك عدد من العيوب الوراثية النادرة مثل جفاف الجلد المصبغ يزيد أيضا من المخاطر[4]. التشخيص يكون بأخذ خزعة من الآفة الجلدية[1]. إن تجنب ضوء الأشعة فوق البنفسجية واستخدام واقي الشمس قد يمنع من حدوث هذا الميلانوما[2]. يشمل العلاج الاستئصال الجراحي للورم، والعلاج المساعد، والكيميائي المناعي، والعلاج بالأشعة، وتعد فرصة الشفاء أعظم إذااكتشفت الميلانوما بينما لا تزال صغيرة وضئيلة وبالإمكان استئصالها جراحيا بالكامل. يمكن اختبار الانتشار من الغدد الليمفاوية القريبة, ويشفى معظم الناس إذا لم يحدث انتشار, أما الذين قد انتشر عندهم السرطان فإن العلاج المناعي أو العلاج البيولوجي أو العلاج الإشعاعي أو العلاج الكيميائي قد يمكنه من البقاء على قيد الحياة[1]. مع العلاج معدلات البقاء على قيد الحياة لمدة خمس سنوات هي 98% من بين الذين يعانون من أمراض محلية و 17% منهم قد حدث لديهم انتشار[5]. واحتمال انه سوف يعود أو يحدث انتشار يعتمد على سمك الميلانوما و على سرعة انقسام الخلايا وفيما إذا كان الجلد قد تدمر وانهار[2]. الميلانوما هي أكثر سرطانات الجلد خطورة. عالميا في عام 2012 أصيب في هذا المرض 232000 شخص وسببت 55000 حالة وفاة. في أستراليا و نيوزلندا أعلى نسبة مصابين بالميلانوما في العالم, وأيضا هنالك نسبة عالية في أوروباوأمريكا الشمالية, ولكنها أقل شيوعا في آسياوأفريقياوأمريكا اللاتينية[2]. وتشيع الميلانوما في الرجال أكثر من النساء[4]. الميلانوما أصبحت أكثر شيوعا منذ 1960 في المناطق التي هي في معظمها القوقاز "الذين يمتلكون البشرة البيضاء". [2][4]
العلامات والأعراض
من العلامات المبكرة للميلانوما تغيرات في شكل ولون الكتل أو في حالة الميلانوما العقدية يظهر كتل جديدة في أي مكان على الجلد[6]. في مراحل لاحقة تظهر حكة او قد تتقرح الكتل او تنزف, وتتلخص علامات الحكة المبكرة ب:
- عدم تناسق
- حواف غير منتظمة
- تلون
- قطر اكبر من 6ملم عن حجم ممحاة قلم رصاص
- تتطور مع مرور الوقت
هذه التصنيفات تنطبق على اكثر انواع الميلانوما خطورة "الميلانوما العقدية" التي لها تصنيفاتها الخاصة:
- مرتفع عن سطح الجلد
- ملمس متين متراص
- متزايد
قد تسبب الميلانوما المنتشرة في الجسم أعراض الأباعد الورمية الغير محددة, تتضمن فقدان الشهية والغثيان القيء والتعب. انتشار الميلانوما المبكرة ممكن ولكنه نادرا تقريبا, انتشاره في الدماغ شائع في المرضى الذين يعانون من الميلانوما المنشره[7], كما يمكن أيضا أن ينتشر إلى الكبد والعظام والبطن أو العقد الليمفاوية البعيدة.
المسببات
تعزى أسباب السرطانات المختلفة إلى خلل يصيب الحمض النووي داخل الخلايا, قد يكون قد يكون هذا الخلل وراثيا في شكل طفرات جينية, لكنه في اغلب الحالات يتطور تدريجيا خلال حياة الشخص وتسببه عوامل بيئية, ويؤدي هذا الخلل إلى تضخم دون سيطرة مسببا ورم, ويتسبب غالبا أشعة الشمس فوق البنفسجية الميلانوما وكذلك من الممكن أن تسهم بالمرض الأشعة البنفسجية المستخدمة في تسمير البشرة.
الأشعة فوق البنفسجية
إن الأشعة فوق البنفسجية الصادرة من أجهزة التسمير تزيد من خطر الإصابة بالميلانوما[8], ووجدت الوكالة الدولية لبحوث السرطان أن تسمير الجلد مسببة للسرطان و أن الناس الذين يبدؤون باستخدام أجهزة التسمير قبل سن 30 هم 75٪ أكثرعرضة لتطوير الميلانوما.[9] أولئك الذين يعملون في الطائرات يظهر لديهم زيادة الخطر في الإصابة, ويعتقد ذلك بسبب الزيادة في التعرض للأشعة الفوق البنفسجية[10]. يمتص ضوء الأشعة الفوق بنفسجية (طول الموجة 315-280 مم) القادم من الشمس بواسطة المادة الوراثية لخلايا الجلد وتتسبب في نوع من تدمير المادة الوراثية المباشر.[11]
وتشير الدراسات أن التعرض للأشعة فوق البنفسجية واحدة من الأسباب الرئيسية في تطوير الميلانوما. في بعض الأحيان التعرض المفرط لأشعة الشمس "مما يؤدي الى حروق الشمس" هي علاقة تسبب الميلانوما. الميلانوما هو الأكثر شيوعا على ظهر الرجال وعلى الساقين عند النساء (مناطق متقطعة تتعرض لأشعة الشمس). يظهر الخطر أكثر شدة في الأوضاع الاجتماعية والاقتصادية بدلا من الأماكن المغلقة مقابل المهن في الهواء الطلق, وهو أكثر شيوعا في العمال الإداريين والمهنيين من العمال غير المهرة. عوامل أخرى هي الطفرات أو فقدان تام للجينات الكابتة للورم, وقد تم ربط استخدام أجهزة التسمير (مع اختراق عميق للأشعة فوق البنفسجية) لتطوير سرطانات الجلد بما في ذلك الميلانوما. وتشمل العناصر الهامة الممكنة فيتحديد المخاطر كافة و مدة التعرض لأشعة الشمس، والعمرالذي يحدث التعرض لأشعة الشمس، و درجة تصبغ الجلد. وتميل معدلات الميلانوما إلىأن تكون أعلى في البلدان المستقرة على طريق المهاجرين من شمال أوربا التي تحتوي على كمية كبيرة من ضوء الشمس المباشر المكثف الذي لا تتكيف معه جلود الناس, زمن أبرزها استراليا. التعرض أثناء الطفولة لاشعة الشمس هوأحد عوامل الخطر الأكثرأهمية من التعرض في مرحلة البلوغ. ويبرز هذا في دراسات الهجرة في أستراليا.
الوراثة
في بعض الحالات يسري سرطان الجلد في الأسرة، فلقد حددت عدة جينات مسئولة عن زيادة خطر تطور سرطان الجلد، فبعض الجينات النادرة تمثل خطرا عاليا نسبيا مسببة سرطان الجلد,بينما هناك جينات مثل الجين MCIRوالذي يعطي اللون الاحمر للشعر يمثل خطرا اقل بالنسبة لسرطان الجلد, ويمكن استخدام الفحص الجيني لمعرفة ما اذا كان الشخص لديه ايا من الطفرات الجينية المعروفة وتزيد عدد من الطفرات النادرة التي تتوارث بالأسر قابلية الإصابة بسرطان الجلد، فأحد أصناف الطفرات تؤثر على جين CDKNA , وتؤدي طفرة جينية نسبية في اطار القراءة الى زعزعةP53 والذي يشكل عامل وصف في الموت المبرمج للخلايا وفي خمسين بالمئة من السرطانات التي تصيب البشر، وتنتج طفرة أخرى في نفس الجين مثبطًا غير وظيفي من CDK4 الذي يسمح بانقسام الخلايا التي تسبب الحالة الجلدية Xeroderma Pigmentosum هي عرضة لسرطان الجلد، وتقلل هذه الطفرات من خلال توزعها على الجينيوم من قدرة الخلية على إصلاح DNA وكلٌ من طفراتCDKN2A and XP متوغلة للغاية.
الفسيولوجيا المرضية

تبدأ المرحلة المبكرة من الميلانوما عندما تفقد السيطرة على نمو الخلايا الصبغية. توجد الخلايا الصاغية بين الطبقة الخارجية للجلد(البشرة) والطبقة التي تليها (الأدمة), وتسمى هذه المرحلة المبكرة من المرض مرحلة النمو الكعبري عندما يكون الورم اقل من 1مم. لان الخلايا السرطانية لم تصل بعد إلى اوعية دمويةأعمق في الجلد، فإنه من غير المحتمل أن هذه المرحلة المبكرة من الميلانوما سوف تنتشر إلى أجزاء أخرى من الجسم. اذا تم الكشف عن الميلانوما في هذه المرحلة فانه عادة ما يمكن ازالتها بالكامل عن طريق الجراحة. عندما تبدأ الخلية السرطانية في التحرك باتجاه مختلف-عموديا يصل الى البشرة والأدمة الحليمية- يتغير سلوك الخلية بشكل كبير. الخطة التالية في التطور هي مرحلة النمو الكعبري الغازية, وهو مصطللح مذهل, من هذه النقطة الميلانوما قادرة على الانتشار. مرحلة النمو الرأسي التالية هي الميلانوما الغازية, يصبح الورم قادرا على النمو في الانسجة المحيطة بها, زيمكن ان ينتشر في جميع انحاء الجسم من خلال الاوعية الدمويه او الليمفاوية. عادة ما يكون سمك الورم اكثر من 1 ملم, ويشمل الورم اجزاء عميقة من الادمة. يثار رد فعل مناعي ضد الورم خلال VGPالتي تحكم بوجود ونشاط الورم تسلسل الخلايا اليمفاوية (TILs) هذه الخلايا احيانا تدمر تماما الورم الرئيسي وهذا ما يسمى انحدار وهي اخر مرحلة من مراحل التطور, في بعض الحالات يتم تدمير الورم الرئيسي تماما واكتشاف الورم المنتشر. حوالي 40% من الاورام الميلانينيه للإنسان تحتوي على الطفرات النشطة التي تؤثر على بنية البروتين B-Raf. بشكل عام, تحدث السرطانات بسبب تلف الحمض النووي 28. ضوء الاشعة فوق البنفسجيه يسبب بشكل رئيسي جزئ ثايمين29. تنتج الاشعة فوق البنفسجية انواع من الاكسجين الذي يلحق ضررا اخر بالحمض النووي ال DNA, اولا سلسلة واحدة تكسر. تأكسد البيرميدينات وتأكسد ال purine 8-oxoguanine (طفرات في الحمض النووي) على تردد 1\10 و 1\3 للاشعة فوق البنفسجية. تسبب الاشعة فوق البنفسجية اضرارا بالحمض النووي للخلايا, وعادة توين جزئ الثايمين والتي لا تصلح يمكن الن تخلق الطفرات في جينات الخلايا, عندما تنقسم الخلية يتم نشر هذه الطفرات الى اجيال جديدة من الخلايا, في حالة حدوث الطفرات protooncogenes او ورم الجينات الكابته فإن معدل الانقسام للخلايا الحاملة للطفرات يمكن ان تصبح غير منضبطة مما يؤدي الى تشكيل الورم. وتشير البيانات من المرضى ان مستويات الخلايا الشاذة تفعل عامل النسخ في نواة خلايا الميلانوما وترتبط مع زيادة انتشار خلايا الميلانوما[12][13][14] , دراسات من الفئران اشارت الى ذلك ايضا[15][16].
التشخيص


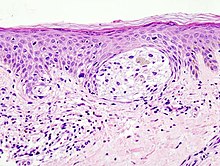

الفحص البصري هو اسلوب التشخيص الاكثر شيوعا[17] , وعادة ما يتم التعامل مع الكتل الغير منتظمة في اللون والحجم والشكل كمرشحه بانها اورام. للكشف عن الاورام الميلانينيه (وزيادة معدلات البقاء على قيد الحياة) فمن المستحسن ان نتعلم كيف نتعرف عليهم (انظر ال ABCDE أعلاه) لفحص التغيرات بانتظام (الشكل والحجم واللون والحكة او النزيف) واستشارة طبيب مؤهل[18][19] .
ABCDE
وهناك طريقة شعبية لتذكر علامات وأعراض الميلانوما "ABCDE"
- Asymmetrical skin lesion
- Border of the lesion
- Color الميلانوما عادة لها اكثر من لون
- Diameter
- Enlarging
ومع ذلك فان العديد من الاورام الميلانينة موجودة كآفات اصغر من مم في القطر. وجميع الاورام الميلانينيه خبيثة عند اول ظهورها كنقطة صغيره يقوم الاطباء عادة بفحص جميع الكتل بما في ذلك الاقل من 6 ملم في القطر.قد يجمع (Seborrheic keratosis)بعض او كل معايير ABCDE ويمكن ان يؤدي الى انذارات كاذبة, ويمكن للأطباء عموما ان يميزوه من الميلانوما عند الفحص أو مع اداة الجلدي المجهري بعضهم مؤيدين بالتوسع مع التطور بالتأكيد الكتل التي تتطور وتتغير ستكون مصدرا للقلق. بدلا من ذلك بعض ممارسي الطب التقليدي يفضلون التطور لهذه الكتل لأنه قد يساعد على التعرف على الميلانوما, ولكن عدم وجود التطور لا يعني ان الافه ليست ميلانوما تم الكشف عن معظم الاورام الميلانينيه في الولايات المتحدة قبل ان تتطور. الميلانينية العقدية لا تحقق هذه المعايير لها رموز مختصرة تساعد على تذكرها "EFG" :
- E: Elevated ترتفع الافه فوق الجلد المحيط بها
- F:Firm العقد صلبه في الملمس
- G:Growing يزداد حجم العقد
البطة القبيحة
طريقة جديدة وغير مألوفة Ugly duckling sign "علامة البطة القبيحة" [20]انها بسيطة وسهلة للتعلم وفعالة جدا, يتم الربط بين خصائص الافة المشتركة وصف الافات التي تحيد كثيرا عن الخصائص المشتركة بالبطة القبيحة, ويتطلب امتحان مهني اخر. علامة ال little Red Riding Hood[20] تشير الى ان الافراد ذوي البشرة الفاتحة والشعر ذات الالوان الفاتحة قد يصعب تشخيص الاورام الميلانينة عديمة الميلانين لديهم, مطلوب مزيد من الحذر عند فحص هؤلاء الافراد كما قد يكون لديهم ميلانوما متعددة. يجب استخدام اداة التصوير الجلدي المجهري للكشف عن ال ugly ducklings والعديد من الاورام الميلانينية في هؤلاء الاشخاص تشبه غير الميلانينية[21]. الاشخاص ذوو البشرة البيضاء غالبا لديهم تصبغات فاتحه او الميلانوما عديمة الميلانين مما يجعل اكتشاف وجودها او تغير اللون صعبا .غالبا ما تكون حدودها غير واضحة مما يعقد التعرف البصري عليها بدون اداة التصوير الجلدي المجهري . الميلانوما عديمة الميلانين او الميلانوما التي صيب الافراد ذوو البشرة البيضاء من الصعب جدا اكتشافها كما فشلوا في اظهار العديد من الخصائص في قاعدة ABCD كسر قاعدة ugly duckling وكما يصعب تميزها عن ندبات حب الشباب ولدغ الحشرات وعن الكتل الليفية بالجلد وعن التصبغات.
خزعة
بعد الفحص البصري وامتحان الفحص الجلدي المجهري[21], او في ادوات التشخيص الحي مثل المجهر متحد البؤر, يمكن للطبيب اخذ خزعة من الكتله المشبوهه, وغالبا ما يتم اخذ الخزعة تحت تخدير موضعي لتحديد الخطورة , استئصال الخزعات بيضاوية الشكل قد تزيل الورم يليها التحليل النسيجي. وكثيرا ما يستخدم التصوير الفوتوغرافي الكلي للجسم خلال الفترة الخطرة من متابعة المرضى تم الكشف عن هذه التقنيه لتمكين الكشف المبكر ويوفر نهجا فعالا من حيث التكلفه (مع اي كاميرا رقمية), ولكن اذا تشكك في فعاليته بسبب عدم قدرتها على كشف التغيرات التي ترى بالمجهر[17], ينبغي ان تستخدم طريقة التشخيص جنبا الى جنب (وليس كبديل) للتصوير الجلدي المجهري واستخدام الطريقتين لاعطاء معدلات مرتفعة جدا من الكشف.
التصنيف
تنقسم الميلانوما الى الانواع التالية[22]:
- Lentigo maligna
- Lentigo maligna melanoma
- Superficial spreading melanoma
- Acral lentiginous melanoma
- Mucosal melanoma
- Nodular melanoma
- Polypoid melanoma
- Desmoplastic melanoma
- Amelanotic melanoma
- Soft-tissue melanoma
انظر ايضا[23]:
- Melanoma with small nevus-like cells
- Melanoma with features of a Spitz nevus
- Uveal melanoma
المختبر
غالبا ما يستخدم نازعة الاكتات (Lactate dehydrogenase) (LHD) لاختبار الكشف عن النقائل, على الرغم من ان المرضى الذين يعانون من الانبثاث (حتى نهاية المرحلة) لديهم نازعات الاكتات الطبيعي غالبا ما يشير بشكل غير عادي الى ارتفاع انتشار المرض المنتشر في الكبد. ومن الشائع للمرضى تشخيص الميلانوما ان يكون الصدر بالاشعة السينية واختبار LHD وفي بعض الحالات CT،MRI،PETو / أو مسحPET / CT. على الرغم من الجدل, يتم تنفيذ فحص الغدد الليمفاوية في المرضى لتقييم انتشارها اليها ويدعمتشخيصالميلانومابنسبةحضورS-100البروتينعلامة. HMB-45 هو من الاجسام المضادة احادي النسيلة ان يتفاعل ضد المستضد الموجود في الاورام الميلانينية مثل الميلانوما, وتقف على الانسان الميلانوما السوداء والتي يتم استخدامها في علم الامراض التشريحي كعلامة لمثل هذه الاورام. تم انشاء الاجسام المضادة لاستخراج الميلانوما. يتفاعل بشكل ايجابي ضد اورام ميلانينية ولكن ليس اورام اخرى, وبالتالي خصوصية وحساسية. وتتفاعل الاجسام المضادة ايضا ضد خلايا الشامات ولكن ليس داخل شامات الأدمة وضد اجنة الخلايا الصباغية ولكن ليس الخلايا الصباغية البالغة الطبيعية.
المراحل


مراحل الميلانوما[24] معدلات البقاء على قيد الحياة لمدة 5 سنوات: مرحلة0: الميلانوما في موقع (كلارك المستوى الاول) 99% يبقى على قيد لحياة مرحلة I\II : ميلاوما غزوية 89-95% يبقى على قيد الحياة
- T1a: أقل من 1.0 مم سمك الورم الرئيسي, دون تقرح والانقسام> 1 مم2
- T1b: اقل من 1.0 مم سمك الورم الرئيسي مع تقرح او انقسام اكبر او يساوي 1
- T2a: سمك الورم الرئيسي دون تقرح 1.01-2.0مم
مرحلة II : الميلانوما عالية المخاطر 45-79% يبقى على قيد الحياة
- T2b: سمك الورم الرئيسي مع تقرح 1.01- 2,0 مم
- T3a: سمك الورم الرئيسي دون تقرح 2.01-4.0 مم
- T3b: سمك الورم الرئيسي مع تقرح 2.01-4.0 مم
- T4a: اكبر من 4.0 مم سمك الورم الرئيسي دون تقرح
- T4b: اكبر من 4.0 مم سمك الورم الرئيسي مع تقرح
مرحلة III: ورم اقليمي خبيث 24-70% يبقى على قيد الحياة
- N1: عقدة ليمفاويه واحدة حسنة
- N2: من 2-3 عقد ليمفاوية حسنة او جلد اقليمي\ ورم خبيث في الانتشار
- N3: اربعة عقد ليمفاوية ايجابية او عقدة واحده و جلد اقليمي وورم خبيث في الانتشار
مرحلة IV: ورم خبيث بعيد 7-19% يبقى على قيد الحياة
- M1a: انتشار الورم في الجلد LHD طبيعي
- M1b: انتشار في الرئة LHD طبيعي
- M1c: ورم خبيث اخر او اي تطور اخر له مع LHD مرتفعة
يعتمد على ال AJCC خمس سنوات بقاء تشخيص اولي للميلانوما مع العلاج المناسب.
الوقاية
تجنب الاشعة فوق البنفسجية
التقليل من التعرض لمصادر الاشعة فوق البنفسجية (الشمس واجهزة تسمير البشرة)[25] , بعد اجراءات الحماية من أشعة الشمس و ارتداء ملابس واقية الشمس (القمصان بأكمام طويلة وسراويل طويلة، والقبعات واسعة الحواف) يمكن أن تقدم الحماية. استخدام الضوء الاصطناعي لدباغة كان يعتقد يساعد في منع سرطانات الجلد، ولكن يمكن أن يؤدي في الواقع إلى زيادة في حدوث الأورام الميلانينية[26] . لتقليل التعرض للضوء فوق البنفسجي فمن المستحسن تجنب الشمس بين الساعة 9:00 و 3:00 أو تجنب أشعة الشمس عندما يكون ظل أقصر من ارتفاعه.
واقي الشمس
واقيات الشمس يبدو انها قد تكون فعالة من الميلانوما[2][27]. في الماضي، و قد أوصى استخدام واقيات الشمس مع عامل حماية من الشمس (SPF) تصنيف 50 أو أعلى على المناطق المعرضة كما ان واقيات الشمس القديمة أكثر فعالية مع ارتفاعSPF)[28]). يحمي واقي الشمس أيضا ضد سرطان الخلايا الحرشفية وسرطانات جلد أخرى[29].
العلاج
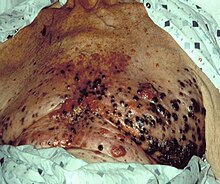
يتم تاكيد التشخيص السريري مع خزعة الجلد, وعادة يعقب هذا المر مع استئصال على نطاق اوسع لندبة او ورم, اعتمادا على المراحل يتم اخذ خزعة العقد الليمفاوية الحارسة, كذلك على الرغم من وجود جدل حول هذا الاجراء[30] يتم اجراء علاج للميلانوما المتقدمة باتباع نهج متعدد التخصصات.
الجراحة
استئصال الخزعات قد تزيل الورم ولكن مزيد من الجراحة غالبا ما يكون ضروريا للحد من عودته. الاستئصال الجراحي الكامل مع هوامش جراحية كافية وتقييم لوجود واكتشاف المرض المنتشر جنبا الى جنب مع متابعة قصيرة وطويلة الاجل هو معيار. وغالبا ما يتم ذلك مع استئصال محلي واسع (WLE wide local excision) مع هامش 1-2 سم. يتم التعامل مع الميلانوما ونمشه خبيثة مع هوامش جراحية اضيق عادة من 0.2-0.5 سم. معظم الجراحين ينظرون الى ان 0.5 سم مستوى الرعاية لاستئصال الميلانوما في الموقع[31]. ولكن 0.2 سم قد يكون مقبولا. يهدف الاستئصال الواسع للحد من عودة الورم في موقع الافة الاصلية هذا هو النمط الشائع في العلاج لفشل الميلانوما. وتهدف البحوث الواسعة لتوضيح هوامش مناسبة للاستئصال مع الاتجاه العام نحو علاج اقل قوة في العقود الماضية.[32] تم الابلاغ عن جراحة موس ( الجراحة الكيميائية) مع نسبة شفاء منخفضة تصل ال 77%[33] وتصل ال 98% للميلانوما في الموقع[34]. الميلانوما التي تنتشرعادة إلى العقد الليمفاوية في منطقة الورم قبل أن تنتشر في أماكن أخرى, نحاول لتحسين البقاء على قيد الحياة عن طريق ازالة الغدد الليمفاوية جراحيا (استئصال الغدد الليمفاوية ) وترتبط مع العديد من المضاعفات ولكن عموما لا فائدة , مؤخرا تم تطوير هذه التقنية للحد من مضاعفات هذه العملية الجراحية في حين انتشر هذا الورم للعقد الليمفاوية[35]. خزعةالعقد الليمفاويةالحارسه هو إجراء يستخدم على نطاق واسع عند علاج الميلانوما الجلدية[36][37]. لا خزعة ليمفاوية ولا اختبارات شخصية اخرى يجب ان تنفذ لتقييم في وقت مبكر, الميلانوما الرقيقة بما في ذلك الميلانوما في مرحلة T1a ميلانوما او T1b ميلانوما اقل او تساوس 0.5 مم.[38]. الناس مع هذه الظروف من غيرالمرجح أن يكون السرطان انتشر إلى الغدد الليمفاوية أو في أي مكان آخر، و بالفعل 97٪ معدل البقاءعلى قيد الحياة لمدة 5 سنوات [38]. بسبب هذه الأمور، خزعة العقدة الليمفاوية الحارسة هو الرعاية الصحية غير الضرورية لهم [38]. و علاوة على ذلك، اختبارات الدم الأساسية و الدراسات الشعاعية لاينبغي القيام بها إلا على أساس تحديد هذا النوع من الميلانوما كما أنها كاختبارات أكثر دقة للكشف عن السرطان و هذه الاختبارات لديهم معدلات إيجابية كاذبة عالية[38]. غالبا ما تنفذ خزعة العقدة الليمفاوية الحارسه وخاصة بالنسبة للT1B / T2 + الأورام و أورام الغشاء المخاطي سرطان الجلد العين والأورام في الأطراف (بحاجة لمصدر), يتم اجراء عملية تسمى lymphoscintigraphy حيث يتم حقن التتبع الإشعاعي في موقع الورم لحصرالعقدة \ العقد الحارسة يتم توفير مزيد من الدقة باستخدام كاشف صبغة زرقاء, ويتم تنفيذ عملية جراحية لخزعة العقدة\العقد. اذا العقد الليمفاوية حسنة وهذا يتوقف على مدى انتشار العقد الليمفاوية وغالبا ما يتم تنفيذ تشريح متطرف للعقدةالليمفاوية, اذا تم استئصال المرض تماما سوف يلجأ المريض للعلاج المساعد خزعة الجلد المتأصلة يتمثل في كيفية ادارة الاختيار, هنا يتم ازالة الافة المشبوهة تماما ( ولكن عادة اقل شئ 1-2 مم )القطع الناقص من الجلد والانسجة المحيطة بها[39]. لتجنب تصريف الليمفاوي المحلي يفضل ان يكون الهامش الجراحي للخزعة ضيق 1 مم, وينبغي أن تتضمن خزعة من البشرة و الجلد، و طبقات تحت الجلد.وهذا يتيحلل اختصاصي الهيستوباثولوجيا لتحديد سماكة من سرطان الجلد عن طريق الفحص المجهري. يتم وصف هذا عن طريق سمك بريسلوفي (قياس في ملليمتر). ومع ذلك، للآفات الكبيرة مثل النمشة الخبيثة او الآفات في المناطق الصعبة جراحيا (الوجه والقدمين و الأصابع و الجفون)، في أي حال من الاحوال يجب ان تتضمن الخزعة الاولية هامش الجراحية النهائي (0.5 سم، 1.0 سم،أو 2 سم), و ذلك التشخيص الخاطئ يمكن أن يؤدي إلى الظهورالمفرط للندب و الإصابة بالأمراض من الإجراء و الاستئصال الأولي الكبير يعطل التصريف الليمفاوي المحلي و يمكن أن تؤثر صورة الاوعية الليمفاوية المباشرة على تشريح العقد الليمفاوية.
إضافة على العلاج
الميلانوما عالية المخاطر قد تتطلب العلاج المساعد على الرغم من التوجهات لهذا قد تختلف باختلاف البلدان. في الولايات المتحدة فان معظم المرضى في صحة جيدة, تبدأ جرعة عالية من العلاج "الانترفيرون" تصل الى عام والتي لها اثار جانبية خطيرة ولكن قد تتحسن احوال المريض قليلا[40]. لكن الجمعية البيريطانية للمبادئ التوجيهية لامراض الجلدية في حالة الميلانوما ان الانترفيرون لا ينصح كعلاج مساعد للميلانوما[41]. وفي عام 2011 استخلص من التحليل ان الانترفيرون يمكن ان يطيل الوقت قبل ان تعود الميلانوما مرة اخرى ولكن تزيد نسبة البقاء على قيد الحياة بنسبة 3% لمدة 5 سنوات والاثار غير السارة ايضا تقلل نوعية الحياة الى حد كبير[42]. في اوروبا عادة لا يتم استخدام الانتروفيرون خارج نطاق التجارب السريرية[43][44]. ويمكن الكشف عن الأورام الميلانينية المتنقله بواسطة الأشعة السينية و المقطعية، الرنين المغناطيسي و التصويرPETوPET / CTS و الموجات فوق الصوتية و اختبار LDH و الكشف الضوئي[45].
العلاج الكيميائي والعلاج المناعي
يختلف وكلاء العلاج الكيميائي بما في ذلك داكاربازين (و هو ما يسمى أيضا DTIC)، العلاج المناعي (معانترلوكين 2 (IL-2) أو الانتروفيرون وكذلك الرذاذ المحلي يتم استخدامها من قبل مراكز مختلفة النجاح الشامل في سرطان الجلد المنتشر محدود للغاية.[46] IL-2 )Proleukin) كان اول علاج جديد قُبل (1990 أوروبا، 1992 الولايات المتحدة الامريكية ) لعلاج الميلانوما المنتشر في 20 سنة . وقد اثبتت الدراسات ان IL-2توفرإمكانية تخفيف كامل وطويل الامد في هذا المرض على الرغم من نسبة صغيرة في المرضى[47]. داخل الآفةIL-2 في عبور النقيلة لديها معدل استجابة كاملة عالية تتراوح 40-100٪. [48]. وقد تمت الموافقة على العلاج الكيميائي الجديد drug temozolomide من قبل مؤسسة الغذاء والدواء عام1999 . في عام 2009 واعتبرمشاركة التجارب السريرية على لرعاية الميلانوما المنتشر [49]. وتشمل علاجات بيولوجية مناعية للميلانوما المنتشره ipilimumab،pembrolizumab،وnivolumab. مثبطات BRAF، مثل vemurafenibوdabrafenib. وtrametinib [48]. البحوث الجارية تبحث في العلاج عن طريق نقل الخلايا بالتبني[50],وتطبق قبل التحفيز او التعديل على خلايا T[51] او ممكن الخلايا الجذعية[52].
نمشة خبيثة
لا يزال يجري الاستئصال من قبل معظم الجراحين, لسوء الحظ فان معدل عودتها مرتفع يصل الى 50%. ويرجع ذلك الى الهامش الجراحي المرئي الغير واضح, والموقع الوجهي للافات (في كثير من الأحيان يضطر الجراح إلى استخدامها مشال جراحية الضيق), وق دتم إجراء جراحة موسم بنسبة الشفاء ذكر تأنت كون منخفضة مثل 77٪،[33] ويصل إلى 95٪ من مؤلف آخر[34]. بعض الشامات والميلانوما ،في الوضع الطبيعي (نمشة خبيث) قد تحمل عالعلاج التجريبي ,imiquimod الدرا الكريم موضعي لتعزيز المناعة. بعض جراحين الجلد يجمعو بين اسلوبين : استئصال السرطان جراحيا ومن ثم علاج المنطقة ب الدرا كريم بعد العمل الجراحي لمدة ثلاثة اشهر
العلاج الاشعاعي
وكثيرا ما يستخدم العلاج الإشعاعي بعد الاستئصال الجراحي لمرضى الميلانوما محليا أو إقليميا أو متقدمة للمرضى الذين يعانون من النقائل البعيدة الغير منتشرة. وغالبا ما تستخدم الاشعة السينية لهذه العلاجات ويكون ملكا للجرعة الإشعاعية القصوى التيتحدث بالقرب من سطح الجلد[53]. أنه قد يقلل من معدل تكرار رجوعها المحلي ولكن لا يطيل البقاء على قيد الحياة.[54] اعلاج المناعي الاشعاعي للميلانوما المنتشرة حاليا قيد الفحص العلاج الاشعاعي له دور في التخفيف من الميلانوما المنتشرة[55].
التنبؤ
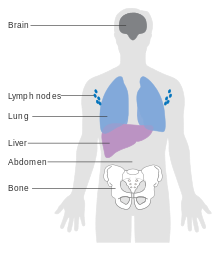
الميزات التي تؤثر على التشخيص هي سمك الورم في ملليمتر (عمق بريسلو)، والعمق المتعلق بهياكل الجلد (مستوى كلارك), نوع الميلانوما, وجود تقرح وانتشار حول العصب,الانتشار, وجود الخلايا الليمفاوية وانتشار الورم, (اذا كان موجودا التشخيص افضل) , موقع الافة, وجود ورم خبيث في المنطقة او بعيد[56]. انواع معينه من الميلانوما لها توقعات اسوأ ولكن هذا ما يفسره سمكها زمن المثير للاهتمام الميلانوما الاقل انتشارا حتى الانتشار مع العقد الليمفاوية لها توقعات افضل من الميلانوما المنتشره عميقا دون الانتشار. عندما تنتشر الميلانوما الى الغدد الليمفاوية, واحدة من اهم العوامل عدد العقد المصابة, ومدى خباثة الورم في العقدة. عندما يوجد ورم خبيث بعيد يعتبر السرطان عموما غير قابل للشفاء, معدل البقاء على قيد الحياة لمدة 5 سنوات اقل من 10%[24], والبقاء على قيد الحياة 6-12 شهر, العلاج هو المسكن مع على امتداد الحياة وكيفيتها, في بعض الحالات قد يعيش المرضى اشهرا او حتى عدة سنوات مع الميلانوما المنتشرة اعتمادا على شدتها الانتشار على الجلد والرئتين لهم تنبؤ افضل بينما النتشار للدماغ والعظام والكبد لهم تنبؤ اسوأ, البقاء على قيد الحياة بالميلانوما المنتشرة في موقع افضل من الورم الرئيس الغير معروف.[57]
علم الاوبئة

على الصعيد العالمي، في عام 2012،حدث الميلانوما في 232000 شخص وأدى إلى 55000حالة وفاة.[2] أستراليا و نيوزيلندا لديها أعلى معدلات سرطان الجلد في العالم[2], فقد أصبح أكثر شيوعا في السنوات ال 20 الماضية في المناطق التي في معظمها القوقاز[2]. وقد ارتفعت نسبة الميلانوما في السنوات الأخيرة, و لكن من غير الواضح إلى أي مدى تغير السلوك، في البيئة، أو المشاركة في الكشف المبكر [59].
استراليا
ولدى أستراليا نسبة عاليةجدا - وتزايد – الميلانوما و في عام 2012، وقعت الوفيات الناجمة عن الميلانوما في 7،3-9،8 لكل 100،000 من السكان. في أستراليا، الميلانوما هي ثالث أكثر أنواع السرطان شيوعا في كلا الجنسين في الواقع نسبة حدوثه اعلى من سرطان الرئة وتشيرالتقديرات إلى أنه في عام 2012، تم تشخيص أكثر من 12000 الاستراليين مع الميلانوما حالات سرطان الجلد في أستراليا هي مسألة ذات أهمية، و ذلك للأسباب التالية:
- زاد معدل الاصابة بالميلانوما في الاستراليين الى ما يزيد عن 30 بالمائة بين عامين 1991 و 2009
- اصابة الاستراليين بالميلانوما كانت في سن موحدة اعتبارا من عام 2008 بزيادة 12 مرة على الاقل من المستوى العالمي.
- حدوث الميلانوما الأسترالية وهي اعلى نسبة في العالم
- عموما الإصابة بالسرطان في سن موحد في أستراليا هو الأعلى في العالم, وهذا يعزى إلى الميلانوما وحدها. حدوث سرطان الكلي في سن موحد مشابه لنيوزيلندا، و لكن هناك فرق اذ اتدلاله إحصائية بين استراليا و جميع أجزاء أخر ىمن العالم المتقدم بما في ذلك أمريكا الشمالية و أوروبا الغربية، والبحرالأبيض المتوسط.
الولايات المتحدة
في الولايات المتحدة يموت حوالي 9000 شخص من الميلانوما سنويا[60] في عام 2011 اثرت 19.7 لكل 100،000، وأسفرت عن وفيات في 2.7 في 100،000 [60].
تاريخ
على الرغم من أن الميلانوما ليس مرضا جديداً، دليل على وقوعه في العصور القديمة نادرة إلى حد ما’ ومع ذلك مثال واحد يقع في 1960s من تسعة المومساء بيرو الكربون المشع تعود إلى أن ما يقرب من 2400 سنة، و التي أظهرت علامات واضحة من الميلانوما: الكتل الميلانينية في الجلد والنقائل المنتشرة في العظام[61]. و ذكر جون هنتر أنه أول من عمل على سرطان الجلد المنتشر في 1787, على الرغم من عدم معرفة بالضبط ما كان عليه، وصفها بأنها "زائدة الكمئي سرطاني" وقدحفظ استئصال الورم في متحف هو نتيريانمن الكلية الملكية للجراحين في إنجلترا. لم يكن حتى عام 1968 أن الفحص المجهري للعينة كشفت أن يكون مثالا للميلانوما المنتشر[62]. وكان الطبيب الفرنسي رينيه لينيك أول من وصف الميلانوما ككيان المرض, و قدم تقريره في البداية خلال محاضرة لكلية الحقوق جامعة الطب في باريس في عام 1804 ثم نشرت كنشرة في 1806 [63]. لأول مرة قدم التقرير باللغة الإنجليزية للميلانوما من قبل طبيب عام الإنجليزية من ستو وربريدج، وليام نوريسفي 1820 [64]. في عمل لاحق له في عام 1857 انه لاحظ أن هناك استعداد عائلي لتطور الميلانوما (ثمانية حالات تصبغ مع ملاحظات المرضية و العلاجية على هذا المرض). كان نوريس أيضا رائد في يفترض وجود صلة بين الشامات و الميلانوما و احتمال وجود علاقة بين الميلانوما و التعرض للعوامل البيئية، بملاحظة أن معظم مرضاه كانو شاحبي البشرة[65]. جاء أول اعتراف رسمي من سرطان الجلد المتقدم غير قابل للعلاج من صموئيل كوبر في عام 1840, وقال إن الفرصة الوحيدة للعلاج تعتمد على الإزالة المبكرة للمرض (أي الاستئصال المبكر للكتل الخبيثة) [66]. عالم سرطان الجلد من الالماني μέλας melas تعني الظلام[67].
البحث
البحوث الدوائية للغير قطوعة أو الميلانوما النقيله تتيح إمكانيات العلاج الجديد[68]. بالاضافة الى التقدم مع عوامل وافقت مؤخرا البحوث الجارية الى الجمع بين العلاج مثل dabrafenibوtrametinib، قد تكشف عن خيار أكثر فعالية و أفضل السكوت للمرضى الذين يعانون من الميلانوما المنتشرة. و احد الطرق الهامة في تخليق الميلانين ينطوي على عامل النسخ MITF. الجين MITF هو حافظ جدا و يوجد في الناس، والفئران، والطيور، وحتى الأسماك. وينظم إنتاج MITF عن طريق مسار واضح إلى حد ما. الأشعة فوق البنفسجية رفعت التعبيرعن عامل النسخ البروتين p53 في الخلايا الكيراتينية، و البروتين p53 يسبب هذه الخلايا لإنتاج المنشط للخلايا الصباغية هرمون (MSH)، التي تربط لمستقبلات ميلانوكورتين 1 (MC1R) على الخلايا الصباغية. مرتبط في مستقبلات MC1R ينشط cyclases أدينيلات، و التي تنتج cAMPا لذي ينشط CREB، التي تشجع التعبيرMITF و تشمل أهداف MITF P16 (مثبطCDK ) وBcl2، الجين الضروري لبقاء الخلايا الصباغية غالبا ما يكون من الصعب تصميم الأدوية التي تتداخل مع عوامل النسخ، ولكن ربما سوف يتم اكتشاف الأدوية الجديدة التي يمكن أن تعوق بعض ردود الفعل في مسار MITF. دراسات هيكل كروماتين وعدت ايضا لتسليط الضوء على تنظيم النسخ في خلايا الميلانوما[69]. منذ فترة طويلة يفترض أن الجسيمات النووية متوضعة بشكل عشوائي على DNA، و لكن تشير الدراسات الفئران من الجينات المسؤولة عن إنتاج مادة الميلانين الآن أن الجسيمات النووية يتموضعها في نمطية على DNA. عندما يمر جين النسخ، موقع بداية النسخ منه هو دائما تقريبا خالية من الجسيم النووي. عندما يكون الجين صامت، و لكن في كثير من الأحيان الجسيمات النووية تحجب موقع بداية النسخ، مما يشير إلى أن موقف جسيم نووي قد يلعب دورا في تنظيم الجينات. وأخيرا، نظر الحقيقة أن الميلانين يساعد على حماية خلايا الجلد من الأشعة فوق البنفسجية التي يسبب الضرر,استراتيجيات جديدة للوقاية من سرطان الجلد يمكن أن تنطوي على محاولات للحث على الميلانين في الأفراد. حمرالشعر،على سبيل المثال، لا يضلل لأن لديهم طفرات MC1R.
العلاجات المستهدفة
في البحوث السريرية و ضع علاجا تأخر ىمثل العلاج بالخلايا بالتبني أو العلاج الجيني، و يجري اختبارها[70]. نوعين من العلاجات التجريبية المتقدمة في المعهد الوطني للسرطان (NCI)، و قد استخدمت في الميلانوما المنتشر نجاح مؤقت[71]. المعالجة الأولى تشمل العلاج بالتبني الخلية (ACT) باستخدام TILs الخلايا المناعية (الورم انتشر للخلايا الليمفاوية) معزولة عن الورم الميلانوما الشخص نفسه[48]. و تزرع هذه الخلايا بأعداد كبيرة في المختبر، وتعاد إلى المريض بعد العلاج الذي يقلل مؤقتا خلاياT الطبيعية في جسم المريض. علاج TIL يتبع استنزاف الخلايا الليمفاوية يمكن أن يؤدي إلى استجابة كاملة دائمة في مجموعة متنوعة من الاجهزة[72][73] المعالجة الثانية، نقل من الخلايا الليمفاوية ذاتي المعدلة وراثيا، ويعتمد على إيصال الجينات التي تكون ما يسمى مستقبلا بالخلايا التائية (TCRs)، إلى الخلايا الليمفاوية المريض[48]. بعد التلاعب الخلايا الليمفية تعرف وتربط بعض الجزيئات الموجودة على سطح خلايا الميلانوما و تقتلهم[74]. وهنا كل قاحل تدريب الجهازالمناعي لمحاربة السرطان أظهر تفائدة متواضعة في اختبار المرحلة الأخيرة في عام 2009 ضد الميلانوما [75][76], و نتائج اختبار المرحلة الأولى في 2015 من العلاج الذي تدريب الجهاز المناعي على التعرف على كل الأفراد وأظهرت خلايا الورم القتامي بعض الأمل.
مثبط BARAF
حوالي 60٪ من الأورام الميلانينية تحتوي على طفرة في الجين B-راف. و أشارت التجارب السريرية الأولى أن مثبطات B-راف بما في ذلك vemurafenib Plexxicon يمكن أن يؤدي إلى تراجع الورم كبير في الغالبية العظمى من المرضى إذا الورم تحتوي على طفرة B-راف[77] في يونيو 2011، و أكدت التجارب السريرية الكبيرة النتائج الإيجابية من تلك التجارب السابقة [78][79]. في آب 2011 تلقى Vemurafenib موافقة مؤسسة الغذاء والدواء لعلاج المراحل المتأخرة من الميلانوما. في يونيو 2012 ذكرت الدراسة أن المرضى الذين يتناولون مختلف B-رافا ،Dabrafenib، كان أفضل من المرضى الذين يخضعون العلاج الكيميائي[80]. و يعتقد بعض الباحثين أن العلاجات المركبة التي تمنع في نفس الوقت مسارات متعددة قد يحسن فعالية من خلال جعلها أكثر صعوبة للحصول على الخلايا السرطانية إلى التحور قبل تدميرها. في أكتوبر 2012 ذكرت الدراسة أن الجمع بين Dabrafenib معtrametinib مع مانع MEK أدى إلى نتائج أفضل. مقارنة Dabrafenib وحده، تم زيادة البقاء على قيد الحياة إلى 41٪ من 9٪، و ارتفع الرقم البقاء على قيد الحياة إلى 9.4 أشهر مقابل 5.8 أشهر. كانت بعض الآثارالجانبية، و مع ذلك فقد زاد في الدراسة مجتمعة [81][82]. في يناير 2014، و افقت ادارة الاغذية والعقاقير مزيج من dabrafenib و trametinib لعلاج المرضى الذين يعانون من BRAF V600E / K-mutant الميلانوما المنتشر[83]. المقاومةالمحتملة إلى BRAFوMEK مثبط اتقد يكون راجعا إلى بروتين سطح الخلية المعروفة باسم EphA2 الذي يجري الآن التحقيق فيها[84].
أساليب المراقبة
وقد مكنت التطور ارتفاع دقة المسح الضوئي بالموجات فوق الصوتية مراقبة عبء الانتشار إلى الغدد الليمفاوية [85]. لفحص و مراقبة الموجات فوق الصوتية في الميلانوما تجربة (SUNMEL) هو تقييم الموجات فوق الصوتية كبديل للطرق الجراحية.[86]
علاج بالفيروس اتحال الورم
في بعض البلدان يتم دراسة طرق علاج بالفيروسات حال الورم و يستخدم لعلاج الميلانوما. علاج بالفيروسات حال الورم هي فرع واعد للعلاج بالفيروسات، حيث تستخدم الفيروسات حال الورم لعلاج الأمراض. الفيروسات يمكن أن تزيد من عملية التمثيل الغذائي، و الحد من المناعة المضادة للورم و فسد النظام الأوعية الدموية [87]. Talimogene laherparepvec ) T-VEC)(و هو العلاج المناعي حال الورم نوع فيروس الهربس البسيط 1 المشتقة)، وقد تبين أن تكون مفيدة ضد الميلانوما المنتشره في عام 2015 مع بقاء زيادة قدرها 4.4 أشهر[88].
المراجع
- ^ ا ب ج د ه و "Melanoma Treatment–for health professionals (PDQ®)". National Cancer Institute. 26 يونيو 2015. اطلع عليه بتاريخ 2015-06-30.
- ^ ا ب ج د ه و ز ح ط ي يا يب World Cancer Report 2014. World Health Organization. 2014. ص. Chapter 5.14. ISBN:9283204298.
- ^ Kanavy HE، Gerstenblith MR (ديسمبر 2011). "Ultraviolet radiation and melanoma". Semin Cutan Med Surg. ج. 30 ع. 4: 222–8. DOI:10.1016/j.sder.2011.08.003. PMID:22123420.
- ^ ا ب ج Azoury، SC؛ Lange، JR (أكتوبر 2014). "Epidemiology, risk factors, prevention, and early detection of melanoma". The Surgical clinics of North America. ج. 94 ع. 5: 945–62, vii. DOI:10.1016/j.suc.2014.07.013. PMID:25245960.
- ^ "SEER Stat Fact Sheets: Melanoma of the Skin". NCI. اطلع عليه بتاريخ June 2015.
{{استشهاد ويب}}: تحقق من التاريخ في:|accessdate=(مساعدة) - ^ MelanomaWarningSigns.com
- ^ Fiddler IJ (أكتوبر 1995). "Melanoma metastasis". Cancer Control. ج. 2 ع. 5: 398–404. PMID:10862180.
- ^ Boniol، M؛ Autier, P؛ Boyle, P؛ Gandini, S (24 يوليو 2012). "Cutaneous melanoma attributable to sunbed use: systematic review and meta-analysis". BMJ (Clinical research ed.). ج. 345: e4757. DOI:10.1136/bmj.e4757. PMC:3404185. PMID:22833605.
- ^ WHO International Agency for Research on Cancer Monograph Working Group (أغسطس 2009). "A Review of Human Carcinogens—Part D:Radiation". The Lancet Oncology. ج. 10 ع. 8: 751–2. DOI:10.1016/S1470-2045(09)70213-X. PMID:19655431.
- ^ Sanlorenzo، Martina؛ Wehner، Mackenzie R.؛ Linos، Eleni؛ Kornak، John؛ Kainz، Wolfgang؛ Posch، Christian؛ Vujic، Igor؛ Johnston، Katia؛ Gho، Deborah؛ Monico، Gabriela؛ McGrath، James T.؛ Osella-Abate، Simona؛ Quaglino، Pietro؛ Cleaver، James E.؛ Ortiz-Urda، Susana (3 سبتمبر 2014). "The Risk of Melanoma in Airline Pilots and Cabin Crew". JAMA Dermatology. DOI:10.1001/jamadermatol.2014.1077.
- ^ Rünger TM، Farahvash B، Hatvani Z، Rees A (يناير 2012). "Comparison of DNA damage responses following equimutagenic doses of UVA and UVB: a less effective cell cycle arrest with UVA may render UVA-induced pyrimidine dimers more mutagenic than UVB-induced ones". Photochem. Photobiol. Sci. ج. 11 ع. 1: 207–15. DOI:10.1039/c1pp05232b. PMID:22005748.
- ^ Leslie MC، Bar-Eli M (يناير 2005). "Regulation of gene expression in melanoma: new approaches for treatment". J. Cell. Biochem. ج. 94 ع. 1: 25–38. DOI:10.1002/jcb.20296. PMID:15523674.
- ^ Bhoumik A، Singha N، O'Connell MJ، Ronai ZA (يونيو 2008). "Regulation of TIP60 by ATF2 modulates ATM activation". J. Biol. Chem. ج. 283 ع. 25: 17605–14. DOI:10.1074/jbc.M802030200. PMC:2427333. PMID:18397884.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Bhoumik A، Jones N، Ronai Z (مارس 2004). "Transcriptional switch by activating transcription factor 2-derived peptide sensitizes melanoma cells to apoptosis and inhibits their tumorigenicity". Proc. Natl. Acad. Sci. U.S.A. ج. 101 ع. 12: 4222–7. DOI:10.1073/pnas.0400195101. PMC:384722. PMID:15010535.
- ^ Vlahopoulos SA، Logotheti S، Mikas D، Giarika A، Gorgoulis V، Zoumpourlis V (أبريل 2008). "The role of ATF-2 in oncogenesis". BioEssays. ج. 30 ع. 4: 314–27. DOI:10.1002/bies.20734. PMID:18348191.
- ^ Huang Y، Minigh J، Miles S، Niles RM (2008). "Retinoic acid decreases ATF-2 phosphorylation and sensitizes melanoma cells to taxol-mediated growth inhibition". J Mol Signal. ج. 3: 3. DOI:10.1186/1750-2187-3-3. PMC:2265711. PMID:18269766.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب Wurm EM، Soyer HP (أكتوبر 2010). "Scanning for melanoma". Australian Prescriber ع. 33: 150–5.
- ^ "Prevention: ABCD's of Melanoma". American Melanoma Foundation.
- ^ Friedman R، Rigel D، Kopf A (1985). "Early detection of malignant melanoma: the role of physician examination and self-examination of the skin". CA Cancer J Clin. ج. 35 ع. 3: 130–51. DOI:10.3322/canjclin.35.3.130. PMID:3921200.
- ^ ا ب Mascaro JM، Mascaro JM (نوفمبر 1998). "The dermatologist's position concerning nevi: a vision ranging from "the ugly duckling" to "little red riding hood"". Arch Dermatol. ج. 134 ع. 11: 1484–5. DOI:10.1001/archderm.134.11.1484. PMID:9828892.
- ^ ا ب Dermnetnz.org
- ^ James, William D.؛ Berger, Timothy G.؛ وآخرون (2006). Andrews' Diseases of the Skin: clinical Dermatology. Saunders Elsevier. ص. 694–9. ISBN:0-7216-2921-0.
- ^ Rapini, Ronald P.؛ Bolognia, Jean L.؛ Jorizzo, Joseph L. (2007). Dermatology: 2-Volume Set. St. Louis: Mosby. ISBN:1-4160-2999-0.
- ^ ا ب Balch C، Buzaid A، Soong S، Atkins M، Cascinelli N، Coit D، Fleming I، Gershenwald J، Houghton A، Kirkwood J، McMasters K، Mihm M، Morton D، Reintgen D، Ross M، Sober A، Thompson J، Thompson J (2001). "Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma". J Clin Oncol. ج. 19 ع. 16: 3635–48. PMID:11504745.
- ^ Autier P (2005). "Cutaneous malignant melanoma: facts about sunbeds and sunscreen". Expert Rev Anticancer Ther. ج. 5 ع. 5: 821–33. DOI:10.1586/14737140.5.5.821. PMID:16221052.
- ^ Clough-Gorr KM، Titus-Ernstoff L، Perry AE، Spencer SK، Ernstoff MS (سبتمبر 2008). "Exposure to sunlamps, tanning beds, and melanoma risk". Cancer Causes Control. ج. 19 ع. 7: 659–69. DOI:10.1007/s10552-008-9129-6. PMID:18273687.
- ^ Kanavy HE، Gerstenblith MR (ديسمبر 2011). "Ultraviolet radiation and melanoma". Semin Cutan Med Surg. ج. 30 ع. 4: 222–8. DOI:10.1016/j.sder.2011.08.003. PMID:22123420.
- ^ Can Melanoma Be Prevented? تم أرشفته يونيو 27, 2006 بواسطة آلة واي باك
- ^ Burnett M.E.؛ Wang S.Q. (أبريل 2011). "Current sunscreen controversies: a critical review". Photodermatology, Photoimmunology & Photomedicine. ج. 27 ع. 2: 58–67. DOI:10.1111/j.1600-0781.2011.00557.x. PMID:21392107.
- ^ "The Sentinel Node Biopsy Procedure in Melanoma does not offer a survival advantage". Malignant Melanoma. 8 يناير 2008. اطلع عليه بتاريخ 2012-08-13.
- ^ Clark GS، Pappas-Politis EC، Cherpelis BS، وآخرون (يوليو 2008). "Surgical management of melanoma in situ on chronically sun-damaged skin". Cancer Control. ج. 15 ع. 3: 216–24. PMID:18596673.
- ^ Balch C، Urist M، Karakousis C، Smith T، Temple W، Drzewiecki K، Jewell W، Bartolucci A، Mihm M، Barnhill R (1993). "Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial". Ann Surg. ج. 218 ع. 3: 262–7, discussion 267–9. DOI:10.1097/00000658-199309000-00005. PMC:1242959. PMID:8373269.
- ^ ا ب Mohs، Frederic Edward؛ Mikhail، George R. (يناير 1991). Mohs micrographic surgery. W.B. Saunders. ص. 13–14. ISBN:978-0-7216-3415-9.
- ^ ا ب Bene NI، Healy C، Coldiron BM (مايو 2008). "Mohs micrographic surgery is accurate 95.1% of the time for melanoma in situ: a prospective study of 167 cases". Dermatol Surg. ج. 34 ع. 5: 660–4. DOI:10.1111/j.1524-4725.2007.34124.x. PMID:18261099.
Cure rate as high as 98% for small melanoma in situ, and as high as 95% noted for lentigo maligna variant of melanona in situ has been reported with Mohs surgery.
- ^ Malignant-Melanoma.org
- ^ Crowson، AN؛ Haskell, H (أكتوبر 2013). "The role of sentinel lymph-node biopsy in the management of cutaneous melanoma". Giornale italiano di dermatologia e venereologia : organo ufficiale, Societa italiana di dermatologia e sifilografia. ج. 148 ع. 5: 493–9. PMID:24005142.
- ^ Ross، MI؛ Gershenwald, JE (مايو–يونيو 2013). "Sentinel lymph node biopsy for melanoma: a critical update for dermatologists after two decades of experience". Clinics in dermatology. ج. 31 ع. 3: 298–310. DOI:10.1016/j.clindermatol.2012.08.004. PMID:23608449.
- ^ ا ب ج د American Academy of Dermatology (فبراير 2013)، "Five Things Physicians and Patients Should Question"، Choosing Wisely: an initiative of the ABIM Foundation، American Academy of Dermatology، اطلع عليه بتاريخ 2013-12-05, which cites
- Bichakjian، CK؛ Halpern، AC؛ Johnson، TM؛ Foote Hood، A؛ Grichnik، JM؛ Swetter، SM؛ Tsao، H؛ Barbosa، VH؛ Chuang، TY؛ Duvic، M؛ Ho، VC؛ Sober، AJ؛ Beutner، KR؛ Bhushan، R؛ Smith Begolka، W؛ American Academy of Dermatology (نوفمبر 2011). "Guidelines of care for the management of primary cutaneous melanoma. American Academy of Dermatology". Journal of the American Academy of Dermatology. ج. 65 ع. 5: 1032–47. DOI:10.1016/j.jaad.2011.04.031. PMID:21868127.
- American Joint Committee on Cancer (2010). Stephen B. Edge (المحرر). AJCC cancer staging manual (ط. 7th). New York: Springer. ISBN:978-0-387-88440-0.
- National Comprehensive Cancer Network (2012)، National Comprehensive Cancer Network clinical practice guidelines in oncology (NCCN Guidelines): melanoma (PDF)، Fort Washington, Pennsylvania: National Comprehensive Cancer Network، اطلع عليه بتاريخ 2013-12-05

- ^ Swanson N، Lee K، Gorman A، Lee H (2002). "Biopsy techniques. Diagnosis of melanoma". Intensive 2011: The Third International Conference on Resource Intensive Applications and Services. ج. 20 ع. 4: 677–80. DOI:10.1016/S0733-8635(02)00025-6. PMID:12380054.
- ^ Kirkwood J، Strawderman M، Ernstoff M، Smith T، Borden E، Blum R (1996). "Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684". J Clin Oncol. ج. 14 ع. 1: 7–17. PMID:8558223.
- ^ English (2010). Neil H. Cox؛ John S.C. (المحررون). British Association of Dermatologists' management guidelines. Chichester, West Sussex: Wiley-Blackwell. ISBN:978-1-4443-3552-1. اطلع عليه بتاريخ 2013-08-19.
- ^ Wheatley K، Ives N، Eggermont A، وآخرون (2007). "Adjuvant therapy for melanoma: an individual patient meta-analysis of randomised trials". J Clin Oncol. ج. 25: 8526.
- ^ Kirkwood J، Ibrahim J، Sondak V، Richards J، Flaherty L، Ernstoff M، Smith T، Rao U، Steele M، Blum R (2000). "High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190". J Clin Oncol. ج. 18 ع. 12: 2444–58. PMID:10856105.
- ^ Kirkwood J، Ibrahim J، Sondak V، Ernstoff M، Ross M (2002). "Interferon alfa-2a for melanoma metastases". Lancet. ج. 359 ع. 9310: 978–9. DOI:10.1016/S0140-6736(02)08001-7. PMID:11918944.
- ^ Weight RM، Viator JA، Dale PS، Caldwell CW، Lisle AE (2006). "Photoacoustic detection of metastatic melanoma cells in the human circulatory system". Opt Lett. ج. 31 ع. 20: 2998–3000. DOI:10.1364/OL.31.002998. PMID:17001379.
- ^ Bajetta E، Del Vecchio M، Bernard-Marty C، Vitali M، Buzzoni R، Rixe O، Nova P، Aglione S، Taillibert S، Khayat D (2002). "Metastatic melanoma: chemotherapy". Semin Oncol. ج. 29 ع. 5: 427–45. DOI:10.1053/sonc.2002.35238. PMID:12407508.
- ^ Buzaid A (2004). "Management of metastatic cutaneous melanoma". Oncology (Williston Park). ج. 18 ع. 11: 1443–50, discussion 1457–9. PMID:15609471.
- ^ ا ب ج د Maverakis E، Cornelius LA، Bowen GM، Phan T، Patel FB، Fitzmaurice S، He Y، Burrall B، Duong C، Kloxin AM، Sultani H، Wilken R، Martinez SR، Patel F (2015). "Metastatic melanoma - a review of current and future treatment options". Acta Derm Venereol. ج. 95 ع. 5: 516–524. DOI:10.2340/00015555-2035. PMID:25520039.
- ^ Bhatia S، Tykodi SS، Thompson JA (2009). "Treatment of Metastatic Melanoma: An Overview". Oncology. ج. 23 ع. 6: 488–96. PMC:2737459. PMID:19544689.
- ^ Rosenberg، SA؛ Restifo، NP (3 أبريل 2015). "Adoptive cell transfer as personalized immunotherapy for human cancer". Science. ج. 348 ع. 6230: 62–8. DOI:10.1126/science.aaa4967. PMID:25838374.
- ^ Med Sci Monit. 2014 Jun 10;20:953-9. doi: 10.12659/MSM.890496. Clinical application of adoptive T cell therapy in solid tumors. Zang YW, Gu XD, Xiang JB, Chen ZY
- ^ Van Lint، S؛ Wilgenhof، S؛ Heirman، C؛ Corthals، J؛ Breckpot، K؛ Bonehill، A؛ Neyns، B؛ Thielemans، K (سبتمبر 2014). "Optimized dendritic cell-based immunotherapy for melanoma: the TriMix-formula". Cancer immunology, immunotherapy : CII. ج. 63 ع. 9: 959–67. DOI:10.1007/s00262-014-1558-3. PMID:24878889.
- ^ Hill، R؛ Healy، B؛ Holloway، L؛ Kuncic، Z؛ Thwaites، D؛ Baldock، C (21 مارس 2014). "Advances in kilovoltage x-ray beam dosimetry". Physics in medicine and biology. ج. 59 ع. 6: R183-231. DOI:10.1088/0031-9155/59/6/r183. PMID:24584183.
- ^ Bastiaannet E، Beukema J، Hoekstra H (2005). "Radiation therapy following lymph node dissection in melanoma patients: treatment, outcome and complications". Cancer Treat Rev. ج. 31 ع. 1: 18–26. DOI:10.1016/j.ctrv.2004.09.005. PMID:15707701.
- ^ Boyer (1999). Primary Care Oncology. Ford.
- ^ Homsi J، Kashani-Sabet M، Messina J، Daud A (2005). "Cutaneous melanoma: prognostic factors" (PDF). Cancer Control. ج. 12 ع. 4: 223–9. PMID:16258493.
- ^ Bae، JM؛ Choi، YY؛ Kim، DS؛ Lee، JH؛ Jang، HS؛ Lee، JH؛ Kim، H؛ Oh، BH؛ Roh، MR؛ Nam، KA؛ Chung، KY (يناير 2015). "Metastatic melanomas of unknown primary show better prognosis than those of known primary: a systematic review and meta-analysis of observational studies". Journal of the American Academy of Dermatology. ج. 72 ع. 1: 59–70. DOI:10.1016/j.jaad.2014.09.029. PMID:25440435.
- ^ "WHO Disease and injury country estimates". World Health Organization. 2009. اطلع عليه بتاريخ 2009-11-11.
- ^ Berwick M، Wiggins C (2006). "The current epidemiology of cutaneous malignant melanoma". Front Biosci. ج. 11: 1244–54. DOI:10.2741/1877. PMID:16368510.
- ^ ا ب "Vital Signs: Melanoma Incidence and Mortality Trends and Projections — United States, 1982–2030". Morbidity and Mortality Weekly Report. 2 يونيو 2015.
- ^ Urteaga O، Pack G (1966). "On the antiquity of melanoma". Cancer. ج. 19 ع. 5: 607–10. DOI:10.1002/1097-0142(196605)19:5<607::AID-CNCR2820190502>3.0.CO;2-8. PMID:5326247.
- ^ Bodenham D (1968). "A study of 650 observed malignant melanomas in the South-West region". Annals of the Royal College of Surgeons of England. ج. 43 ع. 4: 218–39. PMC:2312310. PMID:5698493.
- ^ Laennec RTH (1806). "Sur les melanoses". Bulletin de la Faculte de Medecine de Paris. ج. 1: 24–26.
- ^ Norris, W. (1820). "A case of fungoid disease". Edinb. Med. Surg. J. ج. 16: 562–5.
- ^ Norris W. Eight cases of Melanosis with pathological and therapeutical remarks on that disease. London: Longman; 1857.
- ^ Cooper، Samuel (1840). First lines of theory and practice of surgery. London: Longman, Orme, Brown, Green and Longman.
- ^ μέλας, Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
- ^ "Drugs in Clinical Development for Melanoma". Pharmaceutical Medicine. ج. 26 ع. 3: 171–183. 23 ديسمبر 2012. DOI:10.1007/BF03262391.
- ^ Bastonini E؛ وآخرون (سبتمبر 2014). "Chromatin barcodes as biomarkers for melanoma". Pigment Cell Melanoma Res. ج. 27 ع. 5: 788–800. DOI:10.1111/pcmr.12258.
- ^ Sotomayor M، Yu H، Antonia S، Sotomayor E، Pardoll D (2002). "Advances in gene therapy for malignant melanoma". Cancer Control. ج. 9 ع. 1: 39–48. PMID:11907465.
{{استشهاد بدورية محكمة}}:|format=بحاجة لـ|url=(مساعدة) - ^ Hershkovitz L، Schachter J، Treves AJ، Besser MJ (2010). "Focus on adoptive T cell transfer trials in melanoma". Clin. Dev. Immunol. ج. 2010: 260267. DOI:10.1155/2010/260267. PMC:3018069. PMID:21234353.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Dudley ME، Yang JC، Sherry R، وآخرون (نوفمبر 2008). "Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens". J. Clin. Oncol. ج. 26 ع. 32: 5233–9. DOI:10.1200/JCO.2008.16.5449. PMC:2652090. PMID:18809613.
- ^ Besser MJ، Shapira-Frommer R، Treves AJ، وآخرون (مايو 2010). "Clinical responses in a phase II study using adoptive transfer of short-term cultured tumor infiltration lymphocytes in metastatic melanoma patients". Clin. Cancer Res. ج. 16 ع. 9: 2646–55. DOI:10.1158/1078-0432.CCR-10-0041. PMID:20406835.
- ^ Press release from the NIH
- ^ "Immune System Taught To Fight Melanoma". CBSNews. 30 مايو 2009.
- ^ Schwartzentruber، D. J.؛ Lawson، D. H.؛ Richards، J. M.؛ Conry، R. M.؛ Miller، D. M.؛ Treisman، J.؛ Gailani، F.؛ Riley، L.؛ Conlon، K.؛ Pockaj، B.؛ Kendra، K. L.؛ White، R. L.؛ Gonzalez، R.؛ Kuzel، T. M.؛ Curti، B.؛ Leming، P. D.؛ Whitman، E. D.؛ Balkissoon، J.؛ Reintgen، D. S.؛ Kaufman، H.؛ Marincola، F. M.؛ Merino، M. J.؛ Rosenberg، S. A.؛ Choyke، P.؛ Vena، D.؛ Hwu، P. (2011). "Gp100 Peptide Vaccine and Interleukin-2 in Patients with Advanced Melanoma". New England Journal of Medicine. ج. 364 ع. 22: 2119–2127. DOI:10.1056/NEJMoa1012863.
- ^ Harmon، Amy (21 فبراير 2010). "A Roller Coaster Chase for a Cure". The New York Times.
- ^ Andrew Pollack (5 يونيو 2011). "Drugs Show Promise Slowing Advanced Melanoma". New York Times.
- ^ Chapman، Paul B. (30 يونيو 2011). "Improved Survival with Vemurafenib in Melanoma with BRAF V600E Mutation". New England Journal of Medicine. ج. 364 ع. 26: 2507–2516. DOI:10.1056/NEJMoa1103782. PMC:3549296. PMID:21639808.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|coauthors=تم تجاهله يقترح استخدام|author=(مساعدة) - ^ "GSK melanoma drugs add to tally of U.S. drug approvals". Reuters. 30 مايو 2013.
- ^ "Combination of dabrafenib and trametinib delays development of treatment resistance in MM patients". News Medical. 1 أكتوبر 2012.
- ^ Flaherty، Keith T. (1 نوفمبر 2012). "Combined BRAF and MEK Inhibition in Melanoma with BRAF V600 Mutations". New England Journal of Medicine. ج. 367 ع. 18: 1694–1703. DOI:10.1056/NEJMoa1210093. PMC:3549295. PMID:23020132.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|coauthors=تم تجاهله يقترح استخدام|author=(مساعدة) - ^ "Dabrafenib/Trametinib Combination Approved for Advanced Melanoma". OncLive. 9 يناير 2014.
- ^ "Counteracting Drug Resistance in Melanoma". 2015.
- ^ Voit C، Van Akkooi AC، Schäfer-Hesterberg G، وآخرون (فبراير 2010). "Ultrasound morphology criteria predict metastatic disease of the sentinel nodes in patients with melanoma". J. Clin. Oncol. ج. 28 ع. 5: 847–52. DOI:10.1200/JCO.2009.25.7428. PMID:20065175.
- ^ The Screening and Surveillance of Ultrasound in Melanoma trial (SUNMEL)
- ^ Forbes، NE؛ Abdelbary, H؛ Lupien, M؛ Bell, JC؛ Diallo, JS (20 سبتمبر 2013). "Exploiting tumor epigenetics to improve oncolytic virotherapy". Frontiers in Genetics. ج. 4: 184. DOI:10.3389/fgene.2013.00184. PMID:24062768.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma". Journal of Clinical Oncology. ج. 33: 2780–2788. 2015. DOI:10.1200/JCO.2014.58.3377.
| في كومنز صور وملفات عن: ورم ميلانيني |

