أمين (كيمياء)
| صنف فرعي من | |
|---|---|
| جزء من |
G protein-coupled amine receptor activity (en) amine binding (en) amine metabolic process (en) amine biosynthetic process (en) amine catabolic process (en) response to amine (en) cellular response to amine stimulus (en) amine transmembrane transporter activity (en) amine transport (en) chromaffin granule amine transport (en) aminergic neurotransmitter loading into synaptic vesicle (en) |
| الحمض المرافق | |
| SMARTS notation |
أمين أولي: 
|
أمين ثانوي: 
|
أمين ثالثي: 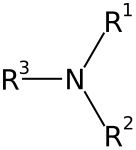
|
الأمين[4] (من أمونيا «النشادر») مركب عضوي نتروجيني (آزوتي) ينتج عن استبدال جذر أو جذرين أو ثلاثة جذور هيدروكربونية مكان ذرات الهيدروجين في جزيء الأمونياك.
الأمينات: هي عبارة عن مشتقات الأمونيا تستبدل فيها ذرة هيدروجين (أو أكثر) بمجموعة (أو أكثر) قد تكون ألكيلية (أمينات أليفاتية) أو أريلية (أمينات أروماتية). وهي مركبات عضوية قاعدية لاحتوائها على ذرة النيتروجين والتي تحمل زوجا من الإلكترونات الحرة (غير مشاركة). تقسم الأمينات إلى أمينات أولية وثانوية وثالثية بناء على عدد ذرات الكربون المرتبطة مباشرة بذرة النيتروجين. حيث أن الأمين الأولي يحتوي على ذرة كربون واحدة مرتبطة بذرة النيتروجين، بينما ترتبط ذرة نيتروجين الأمين الثانوي بذرتي كربون، ويحتوي الأمين الثالثي على ثلاث ذرات كربون مرتبطة بذرة نيتروجين، وعندما تكون ذرة النيتروجين هي إحدى الذرات المكونة للحلقة في المركب الحلقي فإن الأمين عندئذٍ يسمى أمين حلقي غير متجانس مثل مركب البيبيريدين والبيروليدين اللذان يتصرفان مثل تصرف الأمينات الثانوية الأليفاتية.[5]
أصناف الأمينات
[عدل]الأمينات الأليفاتية لا تمتلك حلقة عطرية مرتبطة بشكل مباشر بذرة النيتروجين.[6] الأمينات العطرية تمتلك ذرة نيتروجين مرتبطة بالحلقة العطرية كما في مركبات الأنيلين المختلفة. الحلقة العطرية (الأروماتية) تقلل قلوية الأمين اعتمادا على التفرعات الموجودة عليها. وجود مجموعة الأمين يزيد من قدرة الحلقة العطرية على التفاعل (يزيد تفاعليتها) بسبب وجود تأثير مانح للإلكترونات.
ولذلك تنظم الأمينات ضمن أربع تصنيفات فرعية:
- أمينات أولية تحوي زمرة أمينية مرتبطة بجذر ألكيلي واحد.
- أمينات ثانوية تحوي زمرة أمينية مرتبطة بجذرين ألكيليين.
- أمينات ثالثية تحوي زمرة أمينية مرتبطة بثلاث جذور ألكيلية.
- أمينات حلقية وهي إما أمينات ثانوية أو ثالثية.
اصطلاح التسمية
[عدل]تسمى الأمينات بطرق متعددة. نموذجيا، يعطى المركب البادئة «أمينو-» أو اللاحقة «-أمين». البادئة "N-" تدل على وجود التفرع على ذرة النيتروجين. المركب العضوي الذي يمتلك عدة مجموعات أمين يسمى دايامين، ترايامين، تترامين، وهكذا.
التسمية النظامية لبعض الأمينات الشائعة:
| الأمينات القليلة الذرات تسمى باستخدام اللاحقة "-أمين". | الأمينات كثيرة الذرات تسمى باستخدام البادئة "أمينو-". اتحاد الأيوباك بالرغم من ذلك لا يعتمد هذه الاصطلاح.بل يفضل صيغة الألكانامين، على سبيل المثال بنتان-2-أمين.  2-أمينوبنتان |
الخصائص الفيزيائية
[عدل]يؤثر الترابط الهيدروجيني بشكل هام على خصائص الأمينات الأولية والثانوية.[7] لذلك تكون درجة الغليان للأمينات أعلى منها للفوسفينات المناظرة لها، لكنها أقل من تلك التي للكحولات المناظرة من حيث عدد الذرات. على سبيل المثال، الميثيلامين والإيثيلامين هما غازان في الظروف المعيارية، في حين أن الكحولين المناظرين لهما الميثانول (الكحول الميثيلي) والإيثانول (الكحول الإيثيلي) على التوالي هما سائلان. الأمينات الغازية تمتلك رائحة مميزة تشبه رائحة الأمونيا في حين أن الأمينات السائلة لها رائحة سمكية مميزة.
الأمان
[عدل]الأمينات ذات الوزن الجزيئي القليل، مثل الإيثيلأمين تكون سامة وبعضها سهلة الامتصاص عبر الجلد. العديد من الأمينات ذات الوزن الجزيئي الكبير هي فعالة جدا بيولوجيا.
روابط خارجية
[عدل]- Primary amine synthesis: synthetic protocols from organic-reaction.com
- docs/factsheet_7_amines_in_foods.pdf Amines have been implicated in صداع نصفي headaches; link contains citations, and list of amine containing foods[وصلة مكسورة].
انظر أيضا
[عدل]مراجع
[عدل]- ^ "Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995)". Pure and Applied Chemistry (بالإنجليزية) (8–9): 1307–1375. 1995. DOI:10.1351/PAC199567081307.
- ^ ا ب ج د ه و ز ح ط ي مذكور في: Gene Ontology release 2019-11-16. تاريخ النشر: 16 نوفمبر 2019.
- ^ مذكور في: Gene Ontology release 2020-05-02. تاريخ النشر: 5 مايو 2020.
- ^ محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 30، OCLC:4769982658، QID:Q126042864
- ^ كتاب "أسس الكيمياء العضوية" للدكتور محمد بن إبراهيم الحسن، والدكتور حسن بن محمد الحازمي
- ^ "OChemPal". Science.uvu.edu. مؤرشف من الأصل في 2015-10-20. اطلع عليه بتاريخ 2013-11-27.
- ^ Lide, D. R.، المحرر (2005)، دليل سي آر سي المرجعي للكيمياء والفيزياء (ط. 86th)، Boca Raton (FL): CRC Press، ISBN:0-8493-0486-5

