جهد الفعل
كامن الفعل[4] أو جهد الفعل (بالإنجليزية: Action Potential) هو الموجة المتشكلة من التفريغ الكهربائي لتوتر الغشاء الخلوي، والتي تنتقل من منطقة إلى مجاورتها على طول الغشاء الخلوي لأي خلية حية وبشكل خاص على محور الخلية العصبية أو الخلايا العضلية. هذا الانتقال لكمون الفعل يسمى السيال العصبي ويلعب دورًا رئيسيًا في نقل المعلومات على مستوى الخلايا والأعصاب، كما يشكل الأساس الحيوي لانقباض العضلات. يقاس كمون الفعل بوحدة فولط لأنه تأثير فرق جهد كهربي.
تعتبر كمونات الفعل خاصية مميزة من خاصيات الحياة الحيوانية، فهي المسؤولة عن حمل المعلومات ضمن وبين الأنسجة الحيوية. يمكن لكمونات الفعل أن تحدث في بعض النباتات. كمون الفعل وإن كان أكثر انتشارًا في الخلايا العصبية إلا أنه يمكن أن يتشكل في أي نمط من أنماط الخلايا لكن الأهمية الهائلة له هي نقل المعلومات بين العصبونات أو نقل المعلومات بين أنسجة الجسم والدماغ إضافة للعضلات والغدد.
تختلف كمونات الفعل حسب نمط الخلية فكمون الفعل القلبي مختلف عن كمون فعل العصبونات.
النقل النشط العصبي[عدل]

يمتاز كمون الفعل في الأعصاب بسرعته الفائقة، وقِصر دور الحِران فيه.
مراحل النقل النشط العصبي[عدل]
يمر الغشاء الخلوي في الخلية العصبية بعدة أدوار هي:
1. دور الاستعداد أو دور الراحة ويمتاز بوجود جهد غشائي سالب يقارب -85 ميللي'فولت، بمعنى أن الغشاء الخلوي سالب الشحنة مقارنة بداخل الخلية، وينشأ هذا الاستقطاب بآلية متعمدة من الخلية عن طريق تحريك الأيونات عبر الغشاء الخلوي بإخراج أيونات الصوديوم وإدخال أيونات البوتاسيوم إلى داخل الخلية. يمثل هذا الوضع الراحة في الخلية، وتكون مستعدة لاستقبال موجات التفريغ بشرط أن تجتاز هذه الموجات عتبة ما تُدعى بعَتَبَة التحفيز.
2. عند وصول موجة تفريغ أكبر من عتبة التحفيز فإن قنوات الصوديوم تفتح فاسحة المجال لحدوث إزالة الاستقطاب (بالإنجليزية: Depolarization) والتي تتمثل في تحول شحنة الغشاء الخلوي إلى ما يقرب +40 ميللي'فولت.
3. إعادة الاستقطاب (بالإنجليزية: Repolarization) وفيها تُغلق قنوات الصوديوم وتفتح قنوات البوتاسيوم لتعملان معاً على توليد استقطاب من جديد، متجاوزة استقطاب وضع الراحة لتُحدث ما يُسمى بفرط الاستقطاب (بالإنجليزية: Hyperpolarization)، الذي سرعان ما يقل ليعود الغشاء الخلوي إلى حالة الراحة والاستعداد.
بمعنى آخر فإن الغشاء الخلوي يكون في وضع استقطاب سالب الشحنة هو وضع الراحة، ثم تمر عليه شحنة تخرجه من وضع الاستقطاب فيما يُدعى بإزالة الاستقطاب يتلوها عودة الاستقطاب وفرط استقطابي، ثم يعود إلى الاستقطاب الأصلي.
توجد جهود كهربائية عبر أغشية خلايا الجسم كلها. بالإضافة إلى ذلك توجد في الجسم خلايا يمكن استثارتها - كالخلايا العصبية والخلايا العضلية - وهي خلايا تتمكن من التوليد الذاتي للدفعات الكهروكيميائية في أغشيتها ومن نقل هذه الإشارات على طول أغشيتها. إن تغييرات الجهود في أغشية بعض الخلايا مثل الخلايا الغدية والخلايا البلعمية والخلايا الهدبية تلعب دوراََ كبيراََ في التحكم بالعديد من وظائفها.
الفيزياء الأساسية لجهود الغشاء الخلوي[عدل]

جهود الغشاء الخلوي المولَّدة بالانتشار: بافتراض وجود ليفٍ عصبي في حالة عدم وجود أي نقل فعال لأيونات الصوديوم أو أيونات البوتاسيوم فيه، وتركيز البوتاسيوم عالِِ جداََ في داخل الخلية ومنخفض جداََ خارجها، وبافتراض أن الغشاء الخلوي في هذه الحالة نفاذ جداََ لأيونات البوتاسيوم ولكنه غير نفاذ لأية أيونات أخرى. وبسبب التدرج التركيزي الكبير لأيونات البوتاسيوم من داخل الخلية إلى خارجها. وعندما يحدث ذلك تحمل هذه الأيونات شحنة موجبة للخارج وبهذا تولد كهربائية إيجابية خارج الغشاء الخلوي وكهربائية سلبية داخله ؛ لأن الصواعد anions السلبية التي تبقى في الداخل لا تنتشر للخارج مع أيونات البوتاسيوم الموجبة.[a] ويؤدي فرق الجهد الجديد هذا عبر الغشاء الخلوي إلى دفع أيونات البوتاسيوم باتجاه رجعي من داخل الخلية إلى خارجها. وفي مللي ثانية واحدة تقريباََ يصبح الجهد (الكمون) عالياََ بحيث يمنع أي انتشار آخر لأيونات البوتاسيوم للخارج بالرغم من تدرج التركيز العالي للبوتاسيوم للخارج. ويبلغ فرق الجهد الضروري لذلك - في الليف العصبي الكبير السوي في الثدييات - حوالي 94 ميللي فولت، مع شحنة سلبية في داخل غشاء الليف. وفي حالة أخرى قد تحدث نفس الظاهرة كتلك السابقة ولكن مع تركيز عالِِ لأيونات الصوديوم خارج الغشاء الخلوي وتركيز منخفض للصوديوم داخل الغشاء. وهذه الأيونات هي إيجابية الشحنة أيضاََ ولكن هنا الغشاء شديد النفاذية لأيونات الصوديوم وغير نفاذ للأيونات الأخرى. ويولد انتشار أيونات الصوديوم للداخل جهداََ غشائياََ ذا قطبية عكسية؛ فهي سلبية في الخارج وإيجيابية في الداخل ومرة أخرى يرتفع جهد الغشاء الخلوي إلى حدِِ عالِِ يكفي لمنع أي انتشار آخر لأيونات الصوديوم إلى الداخل. ولكن في هذه المرة يكون الجهد في الليف العصبي الكبير في الثدييات حوالي 61 ميللي فولت، مع شحنة سلبية داخل الليف العصبي. وبهذا وجد أن فرق تركيز الأيونات عبر الغشاء النفاذ يمكنه - تحت ظروف خاصة - توليد جهد غشائي. كما أن الكثير من تغيرات جهد الغشاء التي تلاحظ أثناء مرور الدفعات في الأعصاب أو العضلات تنتج عن التغير السريع في جهود الغشاء الانتشارية من مثل هذا النوع.[b]
علاقة جهد الانتشار بفرق التركيز[عدل]
يسمى مستوى الجهد ( الكمون ) عبر الغشاء الخلوي، والذي يمنع الانتشار الإجمالي للأيون عبر الغشاء الخلوي تماماََ لأي من الاتجاهين هو جهد نرنست Nernst potential لذلك الأيون. وتتعين شدة هذا الجهد بنسبة تركيز الأيون على جهتي الغشاء الخلوي؛ فكلما زادت هذه النسبة زاد ميل الأيونات للانتشار في أحد الاتجاهين وزاد بذلك جهد نرنست. وتستخدم معادلة نرنست Nernst equation لحساب جهد نرنستت لأي أيون أحادي التكافؤ عند درجة حرارة الجسم 37 درجة مئوية. ويفترض عند استعمال معادلة نرنست أن الجهد خارج الغشاء الخلوي يبقى دائماََ عند جهد الصفر تماماََ. ويكون جهد نرنست الذي سبب عند ذاك الجهد داخل الغشاء الخلوي كما تكون إشارة الجهد موجبة (+) عندما يكون الأيون المدروس أيوناََ سالباََ وتكون الإشارة سالبة(-) عندما يكون الأيون المدروس موجباََ. وبهذا عندما يكون تركيز الأيون الموجب ( مثلاً أيون البوتاسيوم ) في الداخل عشرة أضعاف تركيزه في الخارج فإن لوغاريتم العشرة هو 1، ولذلك يكون جهد نرنست -61 ميللي فولت داخل الغشاء الخلوي.
حساب جهد الانتشار عندما يكون الغشاء نفاذاََ لعدة أيونات مختلفة[عدل]
يعتمد مقدار جهد الانتشار الذي يتولد عندما يكون الغشاء الخلوي نفاذاً لعدة أيونات مختلفة على وجود ثلاثة عوامل وهي:
- قطبية الشحنة الكهربائية لكل أيون.
- نفاذية الغشاء الخلوي لكل أيون.
- تركيز الأيونات المختلفة على داخل الغشاء الخلوي وعلى خارجه.
وبهذا تعطي معادلة الحقل الثابت constant field equation أو معادلة جولدمان - هدجكن - كاتز Goldman - Hodgkin - Katz equation، جهد الغشاء المولَّد على داخله عندما يكون هناك أيونان أحادياََ التكافؤ وموجبان هما الصوديوم والبوتاسيوم، وأيون واحد أحادي التكافؤ وسالب وهو أيون الكلوريد.[5]
وفيما يلي أهمية ومعنى معادلة جولدمان - هدجكن - كاتز: أولاََ: إن أيونات الصوديوم والبوتاسيوم والكلوريد هي أهم الأيونات المشاركة في توليد جهود الغشاء في الألياف العصبية والعضلية وكذلك في الخلايا العصبية داخل الجهاز العصبي المركزي. وإن التدرج التركيزي لكل من هذه الأيونات عبر الغشاء الخلوي يساعد في تعيين فولتية جهد الغشاء. ثانياََ: تتناسب درجة أهمية كل من هذه الأيونات في تعيين الفولتية مع نفاذية الغشاء للأيون المعين. فإذا كان الغشاء غير نفاذ لأيونات البوتاسيوم والكلوريد يتعين جهد الغشاء عندئذ بصورة تامة بتدرج تركيز أيونات الصوديوم ويصبح الجهد المولد مساوياََ تماماََ لجهد نرنست لأيون الصوديوم. وينطبق نفس المبدأ على الأيونين الآخرين إذا ما أصبح الغشاء نفاذاََ انتقائياََ لأي واحد منهما فقط. ثالثاََ: يولِّد تدرج تركيز الأيونات الموجبة من داخل الغشاء لخارجه كهربائية سلبية في داخله. ويعود سبب ذلك إلى أن الأيونات الموجبة تنتشر إلى الخارج عندما يكون تركيزها في داخل الخلية أعلى من تركيزها في الخارج. ويحمل ذلك شحنات موجبة إلى الخارج تاركاََ الصواعد السالبة على الداخل. ويحصل العكس تماماََ عند وجود تدرج أيوني سلبي. وهذا يعني أن تدرج أيونات الكلوريد من الخارج إلى الداخل يولد شحنات سلبية داخل الخلية لأن أيونات الكلوريد السالبة تنتشر عند ذاك إلى داخل الخلية تاركة الأيونات الموجبة في الخارج. رابعاََ: تتغير نفاذية قنوات الصوديوم والبوتاسيوم بسرعة كبيرة أثناء انتقال الدفعة العصبية بينما لا تتغير نفاذية قنوات الكلوريد كثيراََ أثناء ذلك. ولذلك فإن التغييرات في نفاذية أيونات الصوديوم والبوتاسيوم هي المسؤولة بالدرجة الأولى عن انتقال الإشارات في الخلايا العصبية.[α]
قياس جهد الغشاء[عدل]
إن طريقة قياس جهد الغشاء هي طريقة بسيطة نظرياََ ولكنها غالباََ ما تكون صعبة عملياََ؛ حيث توضع مِمَصّة pipette صغيرة مملوءة بمحلول كهرلي قوي ( KCL ) الذي يمرر إلى داخل الليف العصبي خلال غشائه، ثم يوضع مسرى كهربائي ثانٍ يسمى المسرى الحيادي indifferent electrode في السائل الخلالي ويقاس عند ذاك فرق الجهد بين داخل الخلية وخارجها باستعمال مقياس فولتي خاص، وهذا هو جهاز متطور يمكنه قياس فولتية منخفضة جداََ بالرغم من المقاومة العالية للسريان الكهربائي خلال رأس المِمَصّة الصغيرة ذات القطر الذي يقل عادة عن الميكرون الواحد وذات المقاومة التي قد تبلغ مليون أوم. ولغرض تسجيل هذه التغييرات السريعة في جهد الغشاء أثناء انتقال الدفعات العصبية يربط هذا المسرى بمكشاف الذبذبة oscilloscope.
غشاء الخلية كمكثفة كهربائية[عدل]
إن الشحنات الكهربائية الموجبة والسالبة متساوية تماماََ في كل الأجزاء الخلوية ما عدا المناطق المجاورة لسطح غشاء الخلية؛ ويسمى ذلك مبدأ التعادلية الكهربائية electrical neutrality الذي يعني بأنه يوجد لكل أيون موجب أيون سالب مجاور له يعادله، ولولا ذلك لظهرت جهود كهربائية بملايين الفولتات ضمن السائل الخلوي. وعندما تُضخ شحنات كهربائية إلى خارج الغشاء الخلوي فإنها تتراصف على طول الغشاء كما تتراصف داخله الصواعد التي تُركت هناك. ويخلق ذلك طبقة ثنائية القطب dipole layer من شحنات موجبة وسالبة بين داخل الغشاء الخلوي وخارجه، ولكنه يترك أيضاََ أعداداََ متساوية من الشحنات الموجبة والسالبة في كل مكان آخر في السوائل. وهذا هو نفس التأثير الذي يحدث عندما تصبح صفيحات مكثفة capacitor كهربائية مشحونة كهربائياََ؛ أي اصطفاف شحنات موجبة وسالبة على الطرفين المتعاكسين للغشاء العازل الكهربائي dielectric بين الصفيحتين. وفي الواقع تعمل الطبقة المزدوجة الشحمية لغشاء الخلية كعازل كهربائي لمكثفة غشاء الخلية مثل الميكا mica أو الورق أو الميلار Mylar الذي يعمل كعازل كهربائي في المكثفات الكهربائية. وبسبب الرقة المتناهية ( 7 نانومترات فقط ) لغشاء الخلية تتولد فيه مُواسعة capacitance عالية جداََ بالنسبة لمساحته؛ تصل إلى حوالي ميكروفاراد واحد لكل سنتيمتر مربع.[6] وما دام المسرى المستخدم لقياس فرق الجهد موضوعاََ على خارج غشاء العصب يكون الجهد المسجل صفراََ، وهو جهد السائل خارج الخلايا. ومن ثم عندما يمر مسرى التسجيل خلال الطبقة ثنائية القطب في غشاء الخلية ينقص الجهد إلى -90 ميللي فولت، ثم يبقى الجهد الكهربائي عند مستوى ثابت أثناء مرور المسرى عبر داخل الليف ثم ينعكس ثانية إلى الصفر في لحظة مروره خلال غشاء الجهة المعاكسة. وفي الحقيقة إن لعمل غشاء العصب كمكثفة دلالة خاصة مهمة؛ فمن أجل خلق شحنة سلبية داخل الغشاء الخلوي لا بد من نقل أيونات موجبة كافية إلى الخارج لكي تولد طبقة نائية القطب في الغشاء نفسه. ويمكن أن تبقى كل الأيونات داخل الليف العصبي إما موجبة أو سالبة. ولذلك فإن مجرد نقل أعداد صغيرة من الأيونات خلال الغشاء الخلوي يكون كافياََ لتوليد الجهد السوي - 90 ميللي فولت في داخل الليف العصبي، ولا يحتاج لذلك إلا لنقل 1/5000000 إلى 1/100000000 من مجموع الشحنات الموجبة الموجودة داخل الليف العصبي. كما يمكن لحركة عدد صغير مساوِِ من الأيونات الموجبة إلى داخل الليف العصبي من أن تعكس الجهد من -90 ميللي فولت إلى +35 ميللي فولت خلال 1/10000 من الثانية. ويسبب هذا الانزياح السريع للأيونات بهذا الأسلوب توليد الإشارات العصبية خلال الليف العصبي.[c]
جهد الراحة للغشاء العصبي[عدل]
يبلغ جهد غشاء الألياف العصبية الكبيرة عند عدم نقلها للإشارات العصبية - أي عندما تكون في ما يسمى حالة الراحة - حولي -90 ميللي فولت تقريباََ. و هذا يعني أن الجهد داخل الليف العصبي أكثر سلبية بقيمة 90 ميللي فولت من جهد السائل الخلالي على خارج الليف.
النقل الفعال لأيونات الصوديوم والبوتاسيوم خلال الغشاء الخلوي عبر مضخة الصوديوم - البوتاسيوم[عدل]
إن لكل أغشية الخلايا في الجسم مضخة صوديوم - بوتاسيوم قوية وهي تضخ باستمرار أيونات الصوديوم للخارج وأيونات البوتاسيوم للداخل. وهذه المضخة كهربائية المنشأ لأنها تضخ شحنات موجبة لخارج الخلية أكثر مما تضخها للداخل تاركة نقصاََ إجمالياََ للأيونات الموجبة في داخل الخلية. وهذا يعادل نفس القول إن مضخة الصوديوم - البوتاسيوم تولد شحنة سلبية على داخل الغشاء الخلوي. وتولد مضخة الصوديوم - البوتاسيوم تدرجات تركيزية عالية جداََ لأيونات الصوديوم والبوتاسيوم عبر غشاء العصب في فترة الراحة. والتدريحات المولدة هي كما يلي:
- أيونات الصوديوم في خارج الخلية: 142 ملي مكافيء / لتر
- أيونات الصوديوم في داخل الخلية: 14 ملي مكافيء / لتر
- أيونات البوتاسيوم في خارج الخلية: 4 ملي مكافيء / لتر
- أيونات البوتاسيوم في داخل الخلية: 140 ملي مكافيء / لتر
تسرب أيونات البوتاسيوم والصوديوم خلال غشاء العصب[عدل]
يوجد بروتين قناتي channel protein في قناة غشاء الخلية الذي تتمكن أيونات الصوديوم والبوتاسيوم من التسرب عبره. وتسمى هذه القناة التي تتسرب هذه الأيونات من خلالها باسم قناة تسرب البوتاسيوم والصوديوم potassium-sodium leak channel. وهناك في الواقع العديد من البروتينات المختلفة من هذا النوع والتي لها خواص تسريبية مختلفة. ولكن التأكيد هنا هو على البوتاسيوم لأن هذه القنوات تكون نفاذة جداََ لأيونات البوتاسيوم أكثر مما هي نفاذة لأيونات الصوديوم بحوالي 100 ضعف؛ ويكون هذا التباين في نفاذية الغشاء مهم جداََ في توليد جهد الراحة السوي للغشاء الخلوي.[d][e][f]
أصل جهد الراحة السوي للغشاء الخلوي[عدل]
يبلغ جهد الراحة السوي للغشاء الخلوي -90 ملي فولت، ويتحدد ذلك بعدة عوامل تقوم بتوليد جهد الراحة السوي للغشاء. وهذه العوامل هي:
مساهمة جهد انتشار أيونات البوتاسيوم: يفترض أن الحركة الوحيدة للأيونات خلال الغشاء الخلوي هي انتشار أيونات البوتاسيوم بالقنوات المفتوحة في الغشاء الخلوي بين البوتاسيوم الموجود على داخل الغشاء الخلوي وذلك الموجود على خارجه. وبسبب النسبة العالية بين أيونات البوتاسيوم على داخل الغشاء الخلوي وبين أيونات البوتاسيوم خارج الغشاء (والتي قد تصل إلى نسبة 35 إلى 1) يصبح جهد نرنست لهذه النسبة -94 ملي فولت لأن لوغاريتم 35 هو 1.54 وعند ضربه × -61 ملي فولت يكون الناتج -94 . ولهذا إذا ما كانت أيونات البوتاسيوم هي العامل الوحيد الذي يولد جهد راحة العصب فيكون هذا الجهد مساوياََ -94 ملي فولت.
مساهمة انتشار أيونات الصوديوم عبر الغشاء العصبي: إن الغشاء العصبي له نفاذية ضئيلة جداََ لأيونات الصوديوم عبر الغشاء العصبي والمولَّدة عن الانتشار القليل لأيونات الصوديوم خلال قنوات تسرب أيونات الصوديوم والبوتاسيوم. وتبلغ نسبة أيونات الصوديوم في داخل الغشاء لخارجه 0.1 وتعطي هذه النسبة جهد نرنست لداخل الغشاء يبلغ +61 ملي فولت. كما يكون أيضاََ جهد نرنست للبوتاسيوم الذي يبلغ -94 ملي فولت. ولمعرفة كيف يتفاعل هذان الجهدان مع بعضهما وقيمة جهد مجموعهما يتم استخدام معادلة جولدمان. فإذا كان الغشاء الخلوي عالي النفاية لأيونات البوتاسيوم ولكنه قليل النفاذية جداََ لأيونات الصوديوم فمن المنطق أن يساهم انتشار أيونات البوتاسيوم بجهد الغشاء وقيمته أكثر كثيراََ مما يساهم به انتشار أيونات الصوديوم. ومن المعروف أن نفاذية الغشاء العصبي لأيونات البوتاسيوم هي 100 ضعف نفاذيته لأيونات الصوديوم.[g] وباستعمال هذه القيمة في معادلة جولدمان يتم الحصول على جهد داخل الغشاء الخلوي يساوي - 86 ملي فولت.
مساهمة مضخة الصوديوم - البوتاسيوم:تقوم مضخة الصوديوم - البوتاسيوم بالمساهمة الإضافية حيث تقوم بنشر ثلاثة أيونات صوديوم لخارج الخلية لكل واحد من أيوني البوتاسيوم المنتشرين لداخل الخلية. وبما أن عدد أيونات الصوديوم التي تُضخ لخارج الخلية يفوق عدد أيونات البوتاسيوم التي يتم ضخها إلى داخل الخلية، فهذا يسبب فقداََ مستمراََ للشحنات الموجبة من داخل الغشاء الخلوي مما يولد درجة إضافية من الشحنات السلبية (والتي قد تصل إلى حوالي -4 ملي فولت إضافية ) على داخل الغشاء الخلوي أكثر مما يولده الانتشار وحده. ولهذا وجد أن حاصل جهد الغشاء الخلوي بوجود كل هذه العوامل مجتمعة وعندما تعمل كلها سوية يساوي -90 ملي فولت تقريباََ.
جهد فعل العصب[عدل]
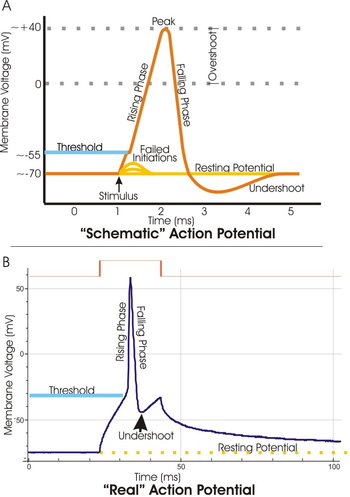
يتم نقل الإشارات العصبية بجهود الفعل وهي تغيرات سريعة في جهد الغشاء الخلوي. ويبدأ كل جهد (كمون) فعل بتغير مفاجيء من جهد الراحة السوي للغشاء إلى جهد غشائي موجب سريع ثم ينتهي بنفس هذه السرعة تقريباََ ليعود إلى جهد سلبي. ولكي ينقل الإشارة العصبية يتحرك جهد الفعل على طول الليف العصبي.[h]
والمراحل المتعاقبة لجهد الفعل هي:
مرحلة الراحة resting stage : وهي جهد الراحة للغشاء الخلوي قبل بدء جهد الفعل. ويقال إن الغشاء مستقطب polarized أثناء هذه المرحلة بسبب جهد الغشاء السلبي الكبير جداً الموجود فيه.
مرحلة زوال الاستقطاب depolarization stage: يصبح الغشاء الخلوي في هذه المرحلة شديد النفاذية لأيونات الصوديوم فيسمح لأعداد كبيرة منها بالتدفق إلى داخل المحور العصبي axon . وتفقد حالة الاستقطاب المتمثلة بكمية -90 ملي فولت، مع صعود سريع للجهد نحو الاتجاه الموجب. ويسمى ذلك زوال الاستقطاب depolarization . وفي الواقع يتجاوز جهد فعل الغشاء في الألياف العصبية الكبيرة حد الصفر ويصبح موجباََ قليلاََ، ولكنه في بعض الأليف الصغيرة وفي الكثير من عصبونات الجهاز العصبي المركزي يصل الجهد إلى حد الصفر فقط ولا يتجاوز إلى الجهد الموجب.[i]
مرحلة عودة الاستقطاب repolarization stage : وبعد أن أصبح الغشاء الخلوي عالي النفاذية لأيونات الصوديوم لبضعة أجزاء من 10000 من الثانية تبدأ قنوات الصوديوم بالانغلاق وتفتح قنوات البوتاسيوم لأكثر من حالتها الاعتيادية. ومن ثم يعيد الانتشار السريع لأيونات البوتاسيوم لخارج الخلية بناء جهد الراحة السلبي السوي للغشاء ويسمى ذلك إعادة استقطاب الغشاء الخلوي. ولتوضيح العوامل التي تولد إزالة الاستقطاب وإعادته بتفصيل أكبر لا بد من وصف الخواص الخاصة لنوعين من قنوات النقل خلال غشاء الأعصاب، وهما القناتان الفولتيتا التبوّب voltage-gated الصوديومية والبوتاسيومية.
القناتان فولتيتا التبوّب voltage-gated الصوديومية والبوتاسيومية[عدل]
إن العامل الفعال الضروري الذي يسبب زوال استقطاب الغشاء العصبي وإعادة استقطابه أثناء جهد الفعل هو القناة الفولتية التبوب الصويومية voltage-gated sodium channel . ومع ذلك تقوم القناة الفولتية التبوب البوتاسيومية أيضاََ بدور مهم في بعض الألياف العصبية في إعادة الاستقطاب. وهاتان القناتان فولتيتا التبوب تضافان إلى مضخة الصوديوم البوتاسيوم وإلى قنوات تسرب أيونات الصوديوم والبوتاسيوم.
تنشيط وتعطيل القناة الفولتية التبوّب الصوديومية[عدل]
لهذه القناة بوابتان منفصلتان إحداهما بالقرب من خارجها ويسمى بوابة التنشيط activation gate والثانية بالقرب من داخلها وتسمى بوابة التعطيل inactivation gate . ويكون الغشاء الخلوي في حالة الراحة عندما يكون جهد الغشاء -90 ملي فولت؛ ففي هذه الحالة تكون البوابة مغلقة وتمنع دخول أية أيونات صوديوم إلى داخل الليف العصبي خلال هذه القنوات. وعلى الطرف الآخر تكون بوابة التعطيل مفتوحة ولذلك لا تكوّن في هذا الوقت أي حاجز لحركة أيونات الصوديوم.
تنشيط قناة الصوديوم: عندما يصبح جهد الغشاء الخلوي أقل سلبية مما هو عليه في حالة الراحة ويرتفع من -90 ملي فولت متجهاََ نحو الصفر فإنه يبلغ مستوى فولتية يتراوح بين -70 و -50 ملي فولت، مما يولد تغيراََ شكلياََ مفاجئاََ في بوابة التنشيط موسعاََ إياها إلى وضع الفتح. ويسمى ذلك حالة التنشيط. وتتمكن أيونات الصوديوم أثناء هذه الحالة من أن تسري للداخل بسرعة كبيرة خلال القنوات، وتزداد نفاذية الغشاء الخلوي للصوديوم لما يتراوح بين 500 و 5000 ضعف.[j]
تعطيل قناة الصوديوم: في هذه الحالة لقناة الصوديوم تغلق فيها بوابة التعطيل بنفس قيمة الفولتية التي فتحت بوابة التنشيط. ولكن ذلك لا يتم إلا بعد حوالي بضعة أجزاء من 10000 من الثانية بعد فتح بوابة التنشيط. وذلك يعني أن عملية تغيير التشكيل التي تغلق بوابة التعطيل هي عملية أبطأ من عملية تغيير التشكيل التي تفتح بوابة التنشيط السريعة جداََ. ولذلك فبعد أن بقيت قناة الصوديوم مفتوحة لبضعة أجزاء من 10000 من الثانية فإنها تعود لتغلق بصورة مفاجئة، ولا تتمكن أيونات الصوديوم من الجريان بعد ذلك إلى داخل الغشاء الخلوي. ويبدأ جهد الغشاء عند هذه النقطة بالعودة إلى حالة راحة الغشاء وهذه هي عملية إعادة الاستقطاب. ومن الخواص المهمة جداََ لعملية تعطيل قناة الصوديوم هي أن بوابة التعطيل لا تعود وتفتح ثانية إلى أن يعود جهد الغشاء إما إلى مستوى جهد راحة الغشاء الأصلي أو قريباََ منه، ولذلك ليس من الممكن لقنوات الصوديوم من أن تنفتح ثانية من دون أن يعود استقطاب الليف العصبي أولاََ إلى مستوى راحته أو قريباََ منه.
القناة الفولتية التبوّب البوتاسيومية وتنشيطها[عدل]
تكون القناة فولتية التبوّب البوتاسيومية مغلقة أثناء حالة الراحة عندما تمنع أيونات البوتاسيوم من المرور لخارج الخلية. وعندما يرتفع جهد الغشاء الخلوي من -90 ملي فولت متجهاََ نحو الصفر يولد هذا التغيير الفولتي فتحاََ تشكيلياََ في بوابة البوتاسيوم مما يزيد انتشار أيونات البوتاسيوم للخارج خلال الغشاء الخلوي. ولكن بسبب بطء فتح هذه القنوات البوتاسيومية فإنها لا تفتح إلا في نفس الوقت الذي يبدأ فيه تعطيل قنوات الصوديوم الفولتية التي تغلق عند ذاك.[k] ولهذا يؤدي نقصان دخول أيونات الصوديوم إلى الخلايا المترافقة مع الزيادة الكبيرة في خروج أيونات البوتاسيوم منها إلى تسريع عملية إعادة الاستقطاب مما يؤدي خلال بضعة أجزاء من 10000 من الثانية إلى العودة التامة إلى جهد راحة الغشاء الخلوي.
طريقة البحث في قياس تأثير الفولتية على فتح القنوات الفولتية التبوّب وغلقها (قامطة الفولتية)[عدل]
كان البحث الأصلي الذي قاد إلى الفهم الكمي لقنوات الصوديوم والبوتاسيوم بارعاََ بحيث بحيث أدى إلى حصول العلماء الذين شاركوا في الكشف عنه - وهم هودجكن وهكسلي - على جائزة نوبل.
والجهاز التجريبي الذي يسمى ( قامطة الفولتية voltage clamp ) الذي يستعمل لقياس جريان الأيونات خلال مختلف القنوات الموجودة في الغشاء الخلوي. وعند استعمال هذا الجهاز يغرز مسريان إلى داخل الليف العصبي، أحدهما لغرض قياس فولتية جهد الغشاء الخلوي، والثاني لغرض توصيل تيار كهربائي إليه ومنه. ويستعمل الجهاز بالطريقة التالية:
يقرر الباحث الفولتية التي يجب توليدها داخل الليف العصبي ويضبط القسم الإلكتروني من الجهاز على الفولتية المقررة، ويقوم هذا بتمرير كهربائية إيجابية أو سلبية بصورة أتوماتيكية خلال مسرى لاتيار بالسرعة المطلوبة لتثبيت الفولتية التي يقيسها مسرى الفولتية ويضبطها عند الحد الذي يقرره الباحث. فمثلاََ عندما يرفع جهد الغشاء الخلوي بصورة مفاجئة بواسطة قامطة الفولتية هذه من -90 ملي فولت إلى الصفر تفتح القنوات الفولتية التبوّب الصوديومية والبوتاسيومية وتبدأ أيونات الصوديوم والبوتاسيوم بالسريان خلال تلك القنوات. ويمرر بالإضافة لذلك تيار كهربائي خلال مسرى التيار لقامطة القولتية ليثبت الفولتية داخل الخلية عند الصفر . ولتحقيق ذلك لا بد من أن يكون التيار المار خلال مسرى التيار مساوياََ تماماََ لمحصلة التيار الساري خلال قنوات الغشاء ولكنه معاكس له.[l] ولغرض قياس مقدار التيار الذي يسري عند كل لحظة، يربط مسرى التيار بمنظار ذبذبة يسجل السريان، كما يظهر على شاشة منظار التردد. وأخيراََ يضبط الباحث تركيز الأيونات عند الحد المرغوب فيه داخل وخارج الليف العصبي، ويعيد الدراسة بعد ذلك . ومن الممكن عمل كل ذلك بسهولة عند استعمال ليف عصبي كبير مزال من بعض القشريات خصوصاََ المحور العصبي الضخم من الحبَّار squid الذي يصل قطره إلى 1 ملم. وعندما يكون أيون الصوديوم هو الأيون النافذ الوحيد في المحلول داخل وخارج المحور العصبي للحبَّار تقوم قامطة الفواتية بقياس سريان التيار خلال قنوات الصوديوم عند ذاك فقط . وعندما يكون أيون البوتاسيوم هو الأيون النافذ الوحيد تقيس القامطة عند ذاك سريان الكهرباء خلال قنوات البوتاسيوم فقط.
والطريقة الأخرى لدراسة سريان الأيونات خلال القنوات الفردية في الغشاء الخلوي هي غلق أحد أنواع القنوات في كل مرة؛ فمثلاََ من الممكن غلق قنوات الصوديوم بالذيفان المسمى تترودوكسين tetrodotoxin عند تطبيقه على خارج الغشاء الخلوي حيث توجد بوابات تنشيط الصوديوم. وعلى العكس من ذلك يغلق أيون رباعي أثيل الأمونيوم tetra-ethyl ammonium ثغرات قنوات البوتاسيوم عند تطبيقه على داخل الليف العصبي إغلاق </ref> مفقود لوسم <ref>
خلاصة الحوادث التي تولد جهد الفعل[عدل]
إن الحوادث المتتالية التي تحدث أثناء جهد الفعل وبعده بقليل بشكل مختصر هي: إن التغييرات في توصيلات الغشاء لأيونات الصوديوم والبوتاسيوم أثناء حالة الراحة وقبل أن يبدأ جهد الفعل يشاهد أن إيصالية أيونات البوتاسيوم هي من الأساس 50 إلى 100 ضعف أكبر من إيصالية أيونات الصوديوم . وينتج هذا عن التسرب الكبير لأيونات البوتاسيوم خلال قنوات التسرب وهذا هو أكبر من تسرب أيونات الصوديوم، ولكن عند بدء جهد الفعل تنشط قنوات الصوديوم فوراََ وتسمح لزيادة تصل إلى 5000 ضعف إيصالية الصوديوم . ومن ثم تقوم عملية التعطيل بغلق قنوات الصوديوم خلال بضعة أجزاء أخرى من الملي ثانية. كما يسبب بدء جهد الفعل تبوّباََ فولتياََ لقنوات البوتاسيوم مسبباََ فتحها بعد جزء من الملي ثانية بعد فتح قنوات الصوديوم . ومن ثم عند نهاية جهد الفعل تسبب عودة جهد الغشاء إلى الحالة السلبية غلق قنوات البوتاسيوم وعودتها إلى حالتها الأصلية ولكن مرة أخرى بعد تأخير قصير المدى.[m] كما تزداد نسبة الإيصالية لكل من الصوديوم والبوتاسيوم في كل لجظة من اللحظات أثناء جهد الفعل نفسه وتزداد هذه النسبة أثناء الجزء الأول من جهد الفعل أكثر من ألف ضعف ولهذا تسري أيونات الصوديوم إلى داخل الليف العصبي أكثر بكثير من سريان أيونات البوتاسيوم إلى خارج الغشاء الخلوي، وهذا هو ما يجعل جهد الغشاء الخلوي موجباََ ويبدأ بعد ذلك تبطيل قنوات الصوديوم في الوقت الذي تفتح فيه قنوات البوتاسيوم فتنحرف عند ذاك نسبة الإيصالية كثيراََ نحو جهة الإيصالية العالية للبوتاسيوم ولكنها منخفضة بالنسبة للصوديوم. ويسمح هذا بالفقدان السريع لأيونات البوتاسيوم لخارج الخلية من دون سريان أيونات الصوديوم للداخل . وكنتيجة لذلك يعود جهد الفعل بسرعة إلى مستوى خطه القاعدي.[n]
الجهد التلوي الموجب[عدل]
يلاحظ أن جهد الغشاء الخلوي يصبح أكثر سلبية من جهده الأصلي عند الراحة لبضع ثوان بعد انتهاء جهد الفعل؛ ومن الغريب أن هذا يسمى جهد التلوي الموجب، وهو في الحقيقة تسمية مغلوطة لأن الجهد التلوي الموجب هو أكثر سلبية في الواقع من جهد الراحة بقليل . والسبب في تسميته موجباََ هو أن أول تسجيل عمل له تاريخياََ كان من على خارج الليف العصبي بدلاََ من داخله، ويولد مثل هذا القياس للجهد من على خارج الغشاء تسجيلاََ موجباََ على المقياس المستخدم بدلاََ من التسجيل السالب. ويعود سبب تولد الجهد التلوي الموجب بصورة رئيسية إلى أن العديد من قنوات البوتاسيوم تبقى مفتوحة لبضع ملي ثوان بعد انتهاء عملية عودة استقطاب الغشاء، ويسمح ذلك بانتشار أيونات بوتاسيوم إضافية إلى خارج الليف العصبي تاركة نقصاََ إضافياََ في الأيونات الموجبة داخله مما يعني وجود سلبية أكبر فيه.[o]
أدوار الأيونات الأخرى أثناء جهد الفعل[عدل]
لقد ذُكرت حتى الآن أدوار أيونات الصوديوم والبوتاسيوم في تولد جهد الفعل؛ ولكن هناك نمطين آخرين من الأيونات على الأقل يجب أن يبحثا، وهما:
الأيونات اللانفوذة السلبية الشحنة (الصواعد) داخل المحاور العصبية[عدل]
يوجد داخل المحاور العصبية العديد من الأيونات التي لا تتمكن من المرور خلال قنوات الغشاء الخلوي، وتشمل هذه جزيئات البروتين والعديد من المركبات الفوسفاتية العضوية ومركبات السلفات ومثل ذلك . ولما كانت هذه المركبات لا تتمكن من ترك داخل المحور العصبي فإن أي نقص في الأيونات الموجبة داخل الغشاء العصبي يترك فيه أيونات فائضة سلبية ولذلك فإن هذه الأيونات السلبية غير النفوذة هي المسؤولة عن وجود الشحنة السلبية داخل الليف العصبي عندما يكون فيه نقص في أيونات البوتاسيوم والأيونات الأخرى موجبة الشحنة.[7]
أيونات الكالسيوم[عدل]
تمتلك معظم خلايا الجسم إن لم يكن كلها مضخة كالسيوم شبيهة بمضخة الصوديوم، ومثل مضخة الصوديوم تفتح هذه المضخة أيونات الكالسيوم من داخل غشاء الخلية إلى خارجه مولدة تدرجاََ لأيونات الكالسيوم إلى حد 1000 ضعف. وبالإضافة لذلك هناك قنوات فولتية التبوّب الكالسيومية وهي قليلة النفاذية لأيونات الصوديوم وأيونات الكالسيوم أيضاََ . فعندما تفتح هذه القنوات تسري خلالها أيونات الكالسيوم وأيونات الصوديوم سوية إلى داخل الليف العصبي؛ ولهذا غالباََ ما تسمى هذه القنوات باسم قنوات الصوديوم والكالسيوم . وتنشيط هذه القنوات بطيء جداََ إذ أنه يستغرق 10 إلى 20 ضعفاََ من الوقت اللزم لتنشيط قنوات الصوديوم السوية، ولذلك فإنها غالباََ ما تسمى أيضاََ باسم القنوات البطيئة بالمقارنة مع قنوات الصوديوم التي تسمى باسم القنوات السريعة . وتوجد قنوات الكالسيوم بكثرة في العضلة القلبية وفي العضلات الملساء . وفي الحقيقة نادراََ ما توجد قنوات صوديوم سريعة في بعض العضلات الملساء ولذلك يتولد جهد الفعل في مثل هذه العضلات بصورة تامة تقريباََ بتنشيط قنوات الكالسيوم البطيئة.[p]
زيادة نفاذية قنوات الصوديوم عند وجود نقص في أيونات الكالسيوم[عدل]
إن لتركيز أيونات الكالسيوم في السائل الخلالي تأثيراََ كبيراََ على مستوى الفولتية الذي تنشط عنده قنوات الصوديوم . ومن الممكن تنشيط قنوات الصوديوم عند وجود نقص في أيونات الكالسيوم، ويتم ذلك بزيادة قليلة في جهد الغشاء فوق مستواه السوي عند الراحة. ولهذا فإن الليف العصبي يصبح عالي الاستثارية ويطلق أحياناََ دفعات متتالية من دون أي تهيج له بدلاََ من بقائه في حالة راحة دائمة. وفي الحقيقة يكفي هبوط تركيز أيونات الكالسيوم 50% تحت مستواه السوي في الكثير من الأعصاب المحيطية قبل أن يبدأ الإطلاق discharge التلقائي للدفعات . وغالباََ ما يولد ذلك تكززاََ يمكن أن يكون مميتاََ بسبب التقلص التكززي للعضلات التنفسية . والطريقة المحتملة التي تؤثر بها أيونات الكالسيوم في قنوات الصوديوم هي كما يلي: يظهر أن هذه الأيونات ترتبط بالسطوح الخارجية لجزيئات بروتين قناة الصوديوم، وتغير الشحنات الموجبة لأيونات الكالسيوم بدورها الحالة الكهربائية للبروتين نفسه، وبهذه الطريقة فإنها تزيد من مستوى الفولتية اللزمة لفتح هذه البوابة [q] whereas the speed of unmyelinated neurons varies roughly as the square root (v ∝√ d).[r]
بدء جهد الفعل[عدل]
تم ذكر حتى الآن تغيرات نفاذية الغشاء الخلوي لأيونات الصوديوم والبوتاسيوم، وكذلك تطور جهد الفعل نفسه، وفيما يلي توضيح كيفية بدء جهد الفعل نفسه .
التلقيم الراجع الموجب الذي يفتح قنوات الصوديوم[عدل]
فأولاََ طالما بقي غشاء الليف العصبي من دون أي تعكير فيه فلن يتكون جهد فعل في العصب السوي . ولكن متى ما أدى أي حادث إلى ارتفاع أولي في جهد الغشاء العصبي من -90 ملي فولت صاعداََ إلى حد الصفر فتؤثر عند ذاك هذه الفولتية الصاعدة نفسها على القنوات الفولتية التبوّب الصوديومية الاقتصادية مباشرة فتنشطها أي تفتحها . ويسمح ذلك بتسرب سريع لأيونات الصوديوم مما يؤدي إلى زيادة إضافية أخرى في جهد الغشاء العصبي مؤدياََ إلى فتح إضافي آخر لقنوات صوديومية فولتية التبوّب وتسرب إضافي لأيونات الصوديوم إلى داخل الليف العصبي . وتستمر هذه العملية في دائرة مفرغة موجبة التلقيم الراجع إلى أن تنشط كل القنوات الفولتية التبوّب الصوديومية.[s] ولكن تؤدي يادة جهد الغشاء العصبي خلال جزء صغير آخر من الملي ثانية إلى تعطيل قنوات الصوديوم وسرعان ما ينتهي جهد الفعل عند ذاك .
عتبة بدء جهد الفعل[عدل]
لا يبدأ جهد فعل قبل أن يصبح الصعود الأولي في جهد الغشاء العصبي كبيراََ لحدِِ كافِِ لتوليد دائرة مفرغة . وهذا يحدث عندما يصبح عدد أيونات الصوديوم الداخلة لليف العصبي أكبر من عدد أيونات البوتاسيوم الخارجة منه . وتقتضي لذلك في العادة زيادة تبلغ 15 إلى 30 ملي فولت. ولذلك فإن أية زيادة مفاجئة في جهد الغشاء في ليف عصبي كبير من -90 إلى -65 ملي فولت تقريباََ تكون كافية لتوليد تطور انفجاري لجهد الفعل . ولذلك يعتبر مستوى -65 ملي فولت عتبة threshold للتنبيه.[8]
تكيّف الغشاء العصبي وفشله في الإطلاق رغم مستوى الفولتية الصاعد[عدل]
إذا صعد جهد الغشاء العصبي ببطء - خلال بضع ملي ثوان بدلاََ من جزء من الملي ثانية - فيعطي هذا البطء عند ذاك مجالاََ لتعطيل بوابات قنوات الصوديوم فتنغلق في نفس الوقت الذي تفتح فيه البوابات المنشطة . ونتيجة لذلك لن يكون فتح البوابات المنشطة هذه مؤثراََ في زيادة سريان أيونات الصوديوم عن الحد السوي لأن العديد من البوابات المعطلة تكون مغلقة عند ذاك . ولذلك فإن زيادة بطيئة للجهد الداخلي لليف العصبي تحتاج إما إلى عتبة فولتية أعلى من حدها السوي لكي تولد الإطلاق أو أنها تمنع الإطلاق بالمرة وأحياناََ حتى مع صعود الفولتية كل المسافة حتى الصفر أو حتى إلى الفولتية الموجبة . وتسمى هذه الخاصية باسم تكيف accommodation الغشاء للمنبه.[t]
انتشار جهد الفعل[عدل]
ذكر فيما سبق جهد الفعل منذ بدء حدوثه في إحدى النقاط على الغشاء العصبي، ولكن هذا الجهد العصبي الذي يولد في نقطة الغشاء المستثار هذه يستثير هو نفسه في العادة الأجزاء المجاورة من الغشاء العصبي مولداََ انتقال جهد الفعل عبر العصب . تكون آلية هذا الانتقال خلال ليفاََ عصبياََ سوياََ في فترة الراحة عند بدء الاستثارة حيث يطور فجأة زيدة في نفاذية أيونات الصوديوم، فتسري شحنات كهربائية موجبة إلى الدلخل خلال الغشاء العصبي مزال الاستقطاب ومن ثم إلى مسافة عدة مليمترات في جوف المحور العصبي . وتزيد هذه الشحنات الموجبة الفولتية لمسافة 1 إلى 3 مليمترات داخل الألياف العصبية الكبيرة إلى مستوى أعلى من مستوى الفولتية العتبية فيبدأ جهد الفعل وبذلك تنشط قنوات الصوديوم في هذه المناطق الجديدة، وينتشر عند ذاك جهد الفعل المتفجر . كما تولد هذه المناطق مزالة الاستقطاب حديثاََ دورات موضعية لجريان التيار إلى مناطق مجاورة لها على طول الغشاء وتزيل استقطابها، وهكذا تنتشر عملية إزالة الاستقطاب في الاتجاهين على طول الليف العصبي . وتسمى عملية انتقال زوال الاستقطاب على طول الليف العصبي أو العضلي باسم الدفعة العصبية أو الدفعة العضلية nerve or muscle impulse.[9] ثم يعود استقطاب العصب بعد نهاية جهد الفعل هذا ولكن يبدأ عند ذاك زوال الاستقطاب مرة ثانية بعد ذلك بفترة قصيرة ويبدأ جهد فعل جديد تلقائياََ. وتستمر هذه الدورة مرة بعد أخرى وتتولد بذلك استثارة نظمية ذاتية التحريض في النسيج المستثار . ومع ذلك لا يزول استقطاب الغشاء مباشرة بعد عودة استقطابه بدلاََ من التأخير لفترة ثانية تقريباََ قبل بدء جهد الفعل التالي حيث أنه عند نهاية كل جهد فعل واستمراراََ بعد ذلك بفترة قصيرة يصبح الغشاء العصبي نفاذاََ لأيونات البوتاسيوم لدرجة كبيرة جداََ. ويحمل سريان أيونات البوتاسيوم المفرط أعداداََ كبيرة جداََ من الشحنات الموجبة إلى خارج الغشاء العصبي مولداََ سلبية إضافية داخل الليف العصبي أكبر مما تحصل في غير ذلك ولفترة قصيرة بعد انتهاء جهد الفعل السابق . ويقترب بذلك جهد الغشاء العصبي من جهد نرنست لأيونات البوتاسيوم.[10] وتسمى هذه الحالة باسم حالة فرط الاستقطاب . وما دامت هذه الحالة مستمرة لا تحدث إعادة الاستثارة ولكن تختفي تدريجياََ إيصالية أيونات البوتاسيوم المفرطة (وحالة فرط الاستقطاب) فيسمح بذلك لجهد الغشاء العصبي بالزيادة حتى يصل إلى عتبة الاستثارة. ومن ثم وبصورة مفاجئة يتولد جهد فعل جديد وتتكرر العملية مرة بعد أخرى .
مظاهر خاصة لانتقال الإشارات في الجذوع العصبية[عدل]
الألياف العصبية النخاعينية واللانخاعينية: عند فحص مقطع عرضي لجذع عصبي نمطي صغير تظهر بعض الألياف العصبية الكبيرة والعديد من الألياف الصغيرة المنتشرة بينها، فالألياف العصبية الكبيرة هي ألياف نخاعينية، أما الألياف العصبية الصغيرة فهي ألياف لانخاعينية . ويحوي الجذع العصبي المتوسط عدداََ من الألياف اللانخاعينية يساوي ضعف عدد أليافه النخاعينية . واللب المركزي لليف هو المحور العصبي axon وغشاؤه هو الغشاء الموصل الحقيقي .[u] ويمتلأ مركز المحور العصبي بجبلة المحور axoplasm وهي سائل لزج داخل الخلية العصبية . ويحيط بالمحور العصبي غمد النخاعين myelin sheath الذي غالباََ ما يكون أسمك من المحور العصبي نفسه . ويتقطع الغمد النخاعيني مرة على مسافة كل مليمتر تقريباََ على طول المحور العصبي فينا يعرف باسم عقد رانفير Ranvier nodes. وترسب خلايا شوان الغمد النخاعيني حول المحور العصبي فتغلفه في البدء ثم تلتف حوله عدة مرات موضعة عدة طبقات من الغشاء الخلوي الذي يحوي مادة شحمية هي السفنجوميلين sphingomyelin وهي مادة عازلة ممتازة تمنع سريان الأيونات خلال الغشاء العصبي بحوالي 5000 ضعف كما أنها تقلل مواسعة الغشاء العصبي حتى 50 ضعفاََ . ولكن تبقى منطقة صغيرة لا نخاعينية عند اتصال خليتي شوان متجاورتين على طول المحور العصبي حيث تتمكن الأيونات عندها من السريان خلالها بسهولة من السائل خارج الخلايا إلى المحور العصبي وهذه المنطقة هي عقدة رانفير.[v]
التوصيل القفزي للإشارات العصبية في الألياف النخاعينية من عقدة لأخرى[عدل]
بالرغم من أن الأيونات لا تتمكن من السريان لدرجة مهمة خلال الغمد النخاعيني السميك للألياف العصبية النخاعينية ولكنها تتمكن من ذلك خلال عقد رانفير ولذلك فإن جهود الفعل يمكن أن تحدث عند هذه العقد فقط. كما توصل هذه الجهود من عقدة لأخرى، ويسمى ذلك التوصيل العصبي باسم التوصيل القفزي saltatory conduction، وهذا يعني أن تياراََ كهربائياََ يسري خلال السوائل خارج الخلايا العصبية وخلال جبلة المحور العصبي من عقدة لأخرى مثيراََ العقد المتتالية واحدة بعد الأخرى، وبهذا تقفز الدفعة العصبية على طول الليف العصبي وهذا هو أصل اصطلاح (القفزي). والتوصيل العصبي القفزي مهم لسببين: الأول: هو أن عملية قفز زوال الاستقطاب عبر فواصل طويلة على طول محور الليف العصبي هي آلية تزيد سرعة الانتقال في الألياف النخاعينية حوالي 5 إلى 50 ضعفاً . الثاني: هو أن التوصيل العصبي القفزي يقتصد في طاقة المحور العصبي لأن عقد رانفير وحدها هي التي يزال استقطابها مقتصدة ما يقارب مئات المرات من فقدان الأيونات الذي كان ضرورياََ للتوصيل. ولذلك لا تدعو الحاجة الآن إلا إلى استقلاب إضافي قليل لإعادة بناء الفروق التركيزية لأيونات الصوديوم وأيونات البوتاسيوم عبر الغشاء العصبي بعد سلسلة من الدفعات العصبية . وهناك خاصية أخرى للتوصيل العصبي القفزي في الألياف العصبية النخاعينية الكبيرة ألا وهي العزل الممتاز الذي يوفره وجود الغشاء النخاعيني ونقص 50 ضعفاََ في السعة الكهربائية للغشاء التي تسمح بعملية إعادة الاستقطاب بقليل من النقل الأيوني.[w] ولهذا فعند انتهاء جهد الفعل وانغلاق قنوات الصوديوم يعود الاستقطاب بسرعة كبيرة حتى قبل أن تبدأ قنوات البوتاسيوم بالانفتاح لدرجة ملحوظة. ولذلك فإن توصيل الدفعات العصبية في الألياف العصبية النخاعية يتم كلياََ تقريباََ بالتغيرات المتتالية في القنوات الفولتية التبوّب الصوديومية بمساهمة قليلة جداََ من قنوات البوتاسيوم.[x]
سرعة التوصيل في الألياف العصبية[عدل]
تختلف سرعة التوصيل في الألياف العصبية من 0.25 متر لكل ثانية في الألياف غير المغمدة والصغيرة جداََ إلى حوالي 100 متر لكل ثانية (وهو طول ملعب كرة القدم في ثانية) في الألياف النخاعينية الكبيرة جداََ. وتزداد السرعة تقريباََ مع قطر الليف في الألياف العصبية النخاعينية وتقريباََ مع الجذر التربيعي لقطر الليف العصبي عديم النخاعين.[y]
الاستثارة وعملية توليد جهد الفعل[عدل]
في الأساس يتمكن أي عامل ينشر أيونات الصوديوم إلى الداخل خلال الغشاء العصبي بكميات كافية من أن يبدأ الفتح الأتوماتيكي التجديدي لقنوات الصوديوم الموجودة في الغشاء الخلوي . ومن الممكن أن يتولد ذلك عن الاضطراب الآلي البسيط للغشاء العصبي أو عن التأثيرات الكيميائية عليه أو عن مرور الكهرباء خلاله . وتستعمل كل هذه التأثيرات الكيميائية عليه أو عن مرور الكهرباء خلاله . وتستعمل كل هذه التأثيرات في مناطق مختلفة من الجسم لتوليد جهود فعل عصبية أو عضلية كالضغط الآلي لاستثارة النهايات العصبية الحسية الموجودة في الجلد أو الناقلات العصبية الكيميائية لنقل الإشارات من عصبون لآخر في الدماغ أو التيار الكهربائي لنقل الإشارات بين الخلايا العضلية في القلب أو في الأمعاء . وفيما يلي بحث أسس التنبيه الكهربائي لفهم عملية الاستثارة.[z]
تنبيه الليف العصبي بمسرى معدني سلبي الشحنة[عدل]
إن الوسيلة الاعتيادية لاستثارة العصب أو العضلة في مختبر التجارب هي بوضع الكهربائية على سطحهما من خلال مسريين صغيرين أحدهما سلبي الشحنة وثانيهما موجب الشحنة . وعند القيام بذلك نجد أن الغشاء الخلوي المستثار ينبه عند المسرى السالب . ويكمن سبب هذا التأثير فيا يلي: أن جهد الفعل يبدأ بفتح القنوات الفولتية التبوّب الصوديومية، كما أن هذه القنوات تفتح بتخفيض الفولتية الكهربائية عبر الغشاء العصبي. إذ أن التيار السلبي من المسرى السالب الفولتية ينقص خارج الغشاء العصبي مباشرة مما يقربها من فولتية الجهد السلبي للغشاء داخل الليف العصبي، فيقلل ذلك من الفولتية الكهربائية عبر الغشاء العصبي ويسمح بتنشيط قنوات الصوديوم مما يولد جهد الفعل . وعلى العكس من ذلك عند المصعد، فعند وضع شحنات موجبة على خارج العصب يزداد فرقة الفولتية عبر الغشاء بدلاََ من نقصانه . ويسبب ذلك فرط الاستقطاب الذي يقلل من استثارة الليف العصبي.[aa]
عتبة الاستثارية والجهود الموضعية الحادة[عدل]
قد لا يكون أحياناََ المنبه الكهربائي الضعيف أو المنبه الآلي أو الكيميائي قادراََ على استثارة الليف العصبي ولكن عند زيادة قوة هذا المنبه تدريجياََ يتم الوصول إلى نقطة تتم عندها الاستثارة العصبية . وبدراسة تأثير المنبهات المتعاقبة ذات الشدة المتزايدة تدريجياََ وجد أن المنبه الضعيف جداََ عند نقطة ما من العصب يسبب تغييراََ في جهد الغشاء العصبي من -90 إلى -85 ملي فولت، ولكن هذا التغيير يكون غير كاف للعملية الأوتوماتيكية المولدة لجهد الفعل . كما وجد أن المنبة الأكبر عند نقطة ما من المحور العصبي - ولكن هنا أيضاََ لا الت الشدة غير كافية للتوليد الأتوماتيكي لجهد الفعل - جعل فولتية الغشاء قد اضطربت طيلة ملي ثانية واحدة أو أكثر بعد المنبهين الضعيفين . وتسمى تغيرات الجهد أثناء هذه الفترات القصيرة من الوقت باسم الجهود دون العتبوية الحادة acute sub-threshold potentials .[ab] كما أن المنبه إذا أصبح أشد مما سبق فيؤدي بالكاد إلى إيصال الجهد الموضعي إلى المستوى الكافي لتوليد جهد فعل؛ ويسمى هذا الجهد باسم المستوى العتبوي threshold level ، ولكن ذلك لا يحدث إلا بعد فترة كمون قصيرة latent period. وإذا أصبح المنبه أكبر شدة عند نقطة ما من العصب فيصبح الجهد الموضعي الحادث أشد أيضاََ، ويبدأ جهد الفعل عند ذاك بعد فترة كمون latent أقصر. ولهذا فحتى المنبه الضعيف يمكنه دائماََ توليد تغيير في الجهد الموضعي على الغشاء ولكن يجب أن ترتفع شدة ذلك الجهد الموضعي الحادث إلى الحد العتبوي قبل أن يتولد جهد الفعل المطلوب حدوثه.[ac]
فترة الحرون التي لا يمكن توليد منبهات جديدة أثنائها[عدل]
لا يمكن أن يتولد جهد فعل جديد في الليف العصبي المستثار ما دام الغشاء العصبي مزال الاستقطاب بتأثير جهد فعل سابق الحدوث . ويعود سبب ذلك إلى أنه لفترة قصيرة بعد بدء جهد الفعل تبطل أثنائها قنوات الصوديوم ( أو قنوات الكالسيوم أو كلاهما معاََ ) فلا تتمكن عند ذاك أية كمية من الإشارات الاستثارية التي توضع على القنوات عند هذه النقطة من فتح القنوات المبطلة . والحالة الوحيدة التي تتمكن من إعادة فتحها هي عودة جهد الغشاء إلى حالة راحته الأصلية أو إلى حدِِ قريب منها . ومن ثم أثناء جزء صغير آخر من الثانية تفتح بوابات تبطيل (تعطيل) قنوات الصوديوم وعند ذاك يمكن أن يبدأ جهد فعل جديد عير الغشاء العصبي.[ad][ab] وتسمى الفترة الزمنية التي لا يمكن فيها توليد جهد فعل ثان حتى باستعمال منبه عصبي قوي جداََ باسم فترة الحرون المطلق absolute refractory period وتدوم هذه الفترة في الألياف العصبية النخاعية الكبيرة حوالي 1/2500 حزء من الثانية، ولذلك يمكن حساب بأن مثل هذا الليف العصبي يتمكن أن يوصل 2500 دفعة في الثانية الواحدة كحدِِ أقصى . وتتلو فترة الحرون المطلق فترة أخرى تسمى فترة الحرون النسبي relative refractory period، وتدوم هذه الفترة حوالي ربع إلى نصف طول فترة الحرون المطلق. وتتمكن أثناء هذه الفترة المنبهات الأقوى من المنبهات السوية من تنبيه الليف العصبي. وهناك سببان لوجود فترة الحرون النسبي وهما:
- تبقى بعض قنوات الصوديوم مغلقة أثناء هذه الفترة ولا تفتح لكي تخرج من حالة التبطيل.
- تبقى قنوات البوتاسيوم مفتوحة انفتاحاََ واسعاََ أثناء ذلك مولدة تدفقاََ كبيراََ من شحنات أيونات البوتاسيوم إلى داخل الليف العصبي مما يجعل أمر تنبيه الليف العصبي أكثر صعوبة منه في حالة الراحة.[ae]
تثبيط الاستثارية والمثبطات والمبنجات الموضعية[عدل]
تتمكن بعض العوامل من تقليل استثارية الأعصاب بعكس تلك التي تزيدها . وتسمى هذه العوامل باسم العوامل المثبتة للغشاء العصبي membrane- stabilizing factors ؛ فمثلاََ يقلل التركيز العالي لأيونات الكالسيوم [af] في السائل خارج الخلايا من نفاذية الغشاء الخلوي لأيونات الصوديوم، كما أنه يقلل من استثارية الغشاء الخلوي في ذات الوقت، ولهذا تسمى أيونات الكالسيوم مثبتات stabilizers .
المبنجات الموضعية[عدل]
من بين أهم المثبطات والمواد العديدة التي تستعمل سريرياََ كمبنجات موضعية - وهي تشمل الكوكائين والبروكائين والتتراكائين والعديد من العقاقير الأخرى - حيث تعمل هذه المواد كلها على بوابات التنشيط لقنوات الصوديوم مباشرة وتجعلها صعبة الانفتاح فتقلل بذلك من استثارية الغشاء العصبي. وعندما تقلل الاستثارية لهذا الحد المنخفض وتنخفض شدة جهد الفعل إلى عتبة الاستثارية (والتي تسمى عامل السلامة) وتصل إلى أقل من 1.0 تفشل عند ذاك الدفعة العصبية من المرور خلال المنطقة المخدرة.[note 1]
تسجيل جهود الغشاء وجهود الفعل واستخدامات منظار الذبذبة بالأشعة المهبطية[عدل]
من الملاحظ أن تغييرات جهود الفعل تحدث بسرعة كبيرة أثناء دورة جهد الفعل؛ وفي الواقع تتم معظم عمليات معقد جهد الفعل في الألياف العصبية الكبيرة في مدة 1/1000 جزء من الثانية فلا بد لأي مقياس يتمكن من تسجيل هذه الأنشطة أن يستجيب لها بسرعة عالية جداََ. وللأغراض العملية فإن النوع الوحيد من المقاييس الذي يتمكن من الاستجابة بدقة للتغييرات السريعة في جهود أغشية معظم الألياف المستثارة هو منظار الذبذبة بالأشعة المهبطية cathode ray oscilloscope ؛ إذ يتكون أنبوب الأشعة المهبطية نفسه أساساََ من قاذفة الكترونات وسطح تألقي تطلق عليه الالكترونات وتتوهج المادة المتألقة في السطح عندما ترتطم بها الالكترونات . وإذا ما حركت الحزمة الشعاعية الالكترونية على السطح التألقي تتحرك النقطة المتوهجة المولدة أيضاََ وترسم خطاََ متألقاََ على الشاشة . ويجهز أنبوب الأشعة - بالإضافة لقاذفة الالكترونات والسطح التألقي - بمجموعتين من اللوحات المشحونة كهربائياََ.[ag] وتوضع كل مجموعة منهما على كل من جهتي الحزمة الشعاعية الإلكترونية. وتوضع المجموعة الثانية إلى الأعلى والأسفل منها. وتتمكن دارات التحكم الالكترونية المناسبة من تغيير الفولتية على هذه اللوحات بحيث يمكن ثني الحزمة الشعاعية الالكترونية إلى الأعلى أو إلى الأسفل استجابة للإشارات الكهربائية التي تأتي من المساري الموضوعة على الأعصاب . كما تحرك الحزمة الشعاعية أفقياََ عبر الشاشة بسرعة ثابتة فيولد ذلك التسجيل المبين على سطح مكشاف الذبذبة إذ أنه يبين القاعدة الزمنية أفقياََ وتغييرات الفولتية عند المساري عمودياََ.[ah][ai][aj] ويلاحظ عند النهاية اليسرى من التسجيل خادع المنبه stimulus artifact الذي يولده التنبيه الكهربائي المستعمل لتوليد جهد الفعل، كما يوجد إلى اليمين من ذلك تسجيل لجهد الفعل نفسه .
تسجيل جهد الفعل أحادي الطور[عدل]
لتسجيل مثل هذه الجهود أحادية الطور يتم غرز المسرى إلى داخل الليف العصبي . وعندما ينتشر جهد الفعل بعد ذلك في الليف تسجل تغيرات الجهود المولدة داخله.[ak]
تسجيل جهد الفعل ثنائي الطور[عدل]
عند تسجيل الدفعات من كل الجذع العصبي، فلا يمكن عند ذاك من إدخال المسرى إلى داخل الليف العصبي، ولذلك فالأسلوب المستعمل في مثل هذا التسجيل هو وضع مسريين على السطح الخارجي للعصب. ولكن التسجيل الذي يتم الحصول عليه بهذه الطريقة يكون ثنائي الطور للأسباب التالية: عندما يصل جهد الفعل المنتقل بالعصب إلى المسرى الأول يجعله سالب الشحنة في الوقت الذي يكون فيه المسرى الآخر لا يزال موجب الشحنة لعدم تأثره بالدفعة العصبية.[11] ويؤدي ذلك إلى تسجيل مكشاف الذبذبة بالاتجاه السلبي . وبعد ذلك عندما يسير جهد الفعل في العصب ويصل إلى نقطة في وقت تصبح فيه النقطة الأولى تحت المسرى الأول قد استعادت استقطابها بينما يصبح المسرى الثاني سالباََ يسجل مكشاف الذبذبة عند ذاك باتجاه معاكس للاتجاه الأول ويسجل المكشاف كل هذه التغيرات بشكل خطي حيث يكون تغير الجهد في أحد الاتجاهين أولاََ ومن ثم بالاتجاه المعاكس له.[al]
انظر أيضًا[عدل]
- جهد فعل قلبي
- جهد غشائي
- جهد الراحة
- جهد الاعتكاس
- جهد مشبكي
- جهد بعد مشبكي
- جهد تثبيطي بعد مشبكي
- جهد استثاري بعد مشبكي
- معادلة نرنست
- معادلة غولمدان
- ريوباز
- فترة الجموح
- زوال الاستقطاب
- فرط الاستقطاب
- إشارة (أحياء)
- ثابت زمني Time constant
مراجع[عدل]
- ^ Ross WN، Salzberg BM، Cohen LB، Davila HV (1974). "A large change in dye absorption during the action potential". Biophysical Journal. ج. 14 ع. 12: 983–986. Bibcode:1974BpJ....14..983R. DOI:10.1016/S0006-3495(74)85963-1. PMC:1334592. PMID:4429774.
- ^ Ling G، Gerard RW (1949). "The normal membrane potential of frog sartorius fibers". J. Cell. Comp. Physiol. ج. 34 ع. 3: 383–396. DOI:10.1002/jcp.1030340304. PMID:15410483.
- ^ Gradmann D (2001). "Models for oscillations in plants". Austr. J. Plant Physiol. ج. 28: 577–590.
- ^ نزار مصطفى الملاح، معجم الملاح في مصطلحات علم الحشرات (بالعربية والإنجليزية)، الموصل: جامعة الموصل، ص. 15، QID:Q118929029
- ^ Purves D, Augustine GJ, Fitzpatrick D, et al., editors. Neuroscience. 2nd edition. Sunderland (MA): Sinauer Associates; 2001. Voltage-Gated Ion Channels. Available from: http://www.ncbi.nlm.nih.gov/books/NBK10883/ نسخة محفوظة 2018-06-05 على موقع واي باك مشين.
- ^ Schmidt-Nielsen, p. 484.
- ^ Tasaki, I in Field 1959، صفحات 75–121
- ^ Waxman, SG in Waxman 2007، Multiple Sclerosis as a Neurodegenerative Disease, pp. 333-346.
- ^ Segev, I; Fleshman, JW; Burke, RE in Koch & Segev 1989، Compartmental Models of Complex Neurons, pp. 63-96.
- ^ Rall, W in Koch & Segev 1989، Cable Theory for Dendritic Neurons, p. 9-62.
- ^ Gradmann, D; Mummert, H in Spanswick, Lucas & Dainty 1980، Plant action potentials, pp. 333-344.
- ^ MacDonald PE، Rorsman P (فبراير 2006). "Oscillations, intercellular coupling, and insulin secretion in pancreatic beta cells". PLoS Biol. ج. 4 ع. 2: e49. DOI:10.1371/journal.pbio.0040049. PMC:1363709. PMID:16464129.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link)
- ^ Barnett MW؛ Larkman PM (يونيو 2007). "The action potential". Pract Neurol. ج. 7 ع. 3: 192–7. PMID:17515599. مؤرشف من الأصل في 2019-04-11.
- ^ Golding NL، Kath WL، Spruston N (ديسمبر 2001). "Dichotomy of action-potential backpropagation in CA1 pyramidal neuron dendrites". J. Neurophysiol. ج. 86 ع. 6: 2998–3010. PMID:11731556. مؤرشف من الأصل في 2008-11-22.
- ^ Sasaki, T., Matsuki, N., Ikegaya, Y. 2011 Action-potential modulation during axonal conduction Science 331 (6017), pp. 599-601
- ^ Aur، D.؛ Connolly، C.I.؛ Jog، M.S. (2005). "Computing spike directivity with tetrodes". Journal of Neuroscience Methods. ج. 149 ع. 1: 57–63. DOI:10.1016/j.jneumeth.2005.05.006. PMID:15978667.
- ^ Aur D., Jog, MS., 2010 Neuroelectrodynamics: Understanding the brain language, IOS Press, 2010. دُوِي:10.3233/978-1-60750-473-3-i
- ^ Noble D (1960). "Cardiac action and pacemaker potentials based on the Hodgkin-Huxley equations". Nature. ج. 188 ع. 4749: 495–497. Bibcode:1960Natur.188..495N. DOI:10.1038/188495b0. PMID:13729365.
- ^ Naundorf B، Wolf F، Volgushev M (أبريل 2006). "Unique features of action potential initiation in cortical neurons". Nature. ج. 440 ع. 7087: 1060–1063. Bibcode:2006Natur.440.1060N. DOI:10.1038/nature04610. PMID:16625198. مؤرشف من الأصل (Letter) في 2017-07-03. اطلع عليه بتاريخ 2008-03-27.
- ^ آلن لويد هودجكين (1937). "Evidence for electrical transmission in nerve, Part I". Journal of Physiology. ج. 90 ع. 2: 183–210. PMC:1395060. PMID:16994885.
* آلن لويد هودجكين (1937). "Evidence for electrical transmission in nerve, Part II". Journal of Physiology. ج. 90 ع. 2: 211–32. PMC:1395062. PMID:16994886. - ^ Zalc B (2006). "The acquisition of myelin: a success story". Novartis Found. Symp. Novartis Foundation Symposia. ج. 276: 15–21, discussion 21–5, 54–7, 275–81. DOI:10.1002/9780470032244.ch3. ISBN:978-0-470-03224-4. PMID:16805421.
- ^ S. Poliak؛ E. Peles (2006). "The local differentiation of myelinated axons at nodes of Ranvier". Nature Reviews Neuroscience. ج. 4: 968–80. DOI:10.1038/nrn1253. PMID:14682359.
- ^ Simons M، Trotter J (أكتوبر 2007). "Wrapping it up: the cell biology of myelination". Curr. Opin. Neurobiol. ج. 17 ع. 5: 533–40. DOI:10.1016/j.conb.2007.08.003. PMID:17923405.
- ^ Lillie RS (1925). "Factors affecting transmission and recovery in passive iron nerve model". J. Gen. Physiol. ج. 7 ع. 4: 473–507. DOI:10.1085/jgp.7.4.473. PMC:2140733. PMID:19872151. See also Keynes and Aidley, p. 78.
- ^ Tasaki I (1939). "Electro-saltatory transmission of nerve impulse and effect of narcosis upon nerve fiber". Am. J. Physiol. ج. 127: 211–27.
- ^ Tasaki I، Takeuchi T (1941). "Der am Ranvierschen Knoten entstehende Aktionsstrom und seine Bedeutung für die Erregungsleitung". Pflüger's Arch. Ges. Physiol. ج. 244 ع. 6: 696–711. DOI:10.1007/BF01755414.
* Tasaki I، Takeuchi T (1942). "Weitere Studien über den Aktionsstrom der markhaltigen Nervenfaser und über die elektrosaltatorische Übertragung des nervenimpulses". Pflüger's Arch. Ges. Physiol. ج. 245 ع. 5: 764–82. DOI:10.1007/BF01755237. - ^ Huxley A (1949). "Evidence for saltatory conduction in peripheral myelinated nerve-fibers". Journal of Physiology. ج. 108 ع. 3: 315–39. DOI:10.1113/jphysiol.1949.sp004335.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)
* Huxley A (1949). "Direct determination of membrane resting potential and action potential in single myelinated nerve fibers". Journal of Physiology. ج. 112 ع. 3–4: 476–95. PMC:1393015. PMID:14825228.{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعhursh_1939 - ^ Rushton WAH (1951). "A theory of the effects of fibre size in the medullated nerve". Journal of Physiology. ج. 115 ع. 1: 101–22. PMC:1392008. PMID:14889433.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Hartline DK، Colman DR (2007). "Rapid conduction and the evolution of giant axons and myelinated fibers". Curr. Biol. ج. 17 ع. 1: R29–R35. DOI:10.1016/j.cub.2006.11.042. PMID:17208176.
- ^ Miller RH، Mi S (2007). "Dissecting demyelination". Nat. Neurosci. ج. 10 ع. 11: 1351–54. DOI:10.1038/nn1995. PMID:17965654.
- ^ لورد كلفن (1855). "On the theory of the electric telegraph". Proceedings of the Royal Society. ج. 7: 382–99. DOI:10.1098/rspl.1854.0093.
- ^ Humeau Y، Doussau F، Grant NJ، Poulain B (مايو 2000). "How botulinum and tetanus neurotoxins block neurotransmitter release". Biochimie. ج. 82 ع. 5: 427–46. DOI:10.1016/S0300-9084(00)00216-9. PMID:10865130.
- ^ Rusakov DA (أغسطس 2006). "Ca2+-dependent mechanisms of presynaptic control at central synapses". Neuroscientist. ج. 12 ع. 4: 317–26. DOI:10.1177/1073858405284672. PMC:2684670. PMID:16840708.
- ^ Süudhof TC (2008). "Neurotransmitter release". Handb Exp Pharmacol. Handbook of Experimental Pharmacology. ج. 184 ع. 184: 1–21. DOI:10.1007/978-3-540-74805-2_1. ISBN:978-3-540-74804-5. PMID:18064409.
- ^ Brink PR، Cronin K، Ramanan SV (1996). "Gap junctions in excitable cells". J. Bioenerg. Biomembr. ج. 28 ع. 4: 351–8. DOI:10.1007/BF02110111. PMID:8844332.
- ^ Zoidl G، Dermietzel R (2002). "On the search for the electrical synapse: a glimpse at the future". Cell Tissue Res. ج. 310 ع. 2: 137–42. DOI:10.1007/s00441-002-0632-x. PMID:12397368.
- ^ Hirsch NP (يوليو 2007). "Neuromuscular junction in health and disease". Br J Anaesth. ج. 99 ع. 1: 132–8. DOI:10.1093/bja/aem144. PMID:17573397. مؤرشف من الأصل في 2020-05-21.
- ^ أ ب Hughes BW، Kusner LL، Kaminski HJ (أبريل 2006). "Molecular architecture of the neuromuscular junction". Muscle Nerve. ج. 33 ع. 4: 445–61. DOI:10.1002/mus.20440. PMID:16228970.
- ^ Costa LG (2006). "Current issues in organophosphate toxicology". Clin. Chim. Acta. ج. 366 ع. 1–2: 1–13. DOI:10.1016/j.cca.2005.10.008. PMID:16337171.
- ^ Newmark J (2007). "Nerve agents". Neurologist. ج. 13 ع. 1: 20–32. DOI:10.1097/01.nrl.0000252923.04894.53. PMID:17215724.
- ^ Kléber AG، Rudy Y (أبريل 2004). "Basic mechanisms of cardiac impulse propagation and associated arrhythmias". Physiol. Rev. ج. 84 ع. 2: 431–88. DOI:10.1152/physrev.00025.2003. PMID:15044680. مؤرشف من الأصل في 2020-03-24.
- ^ Tamargo J، Caballero R، Delpón E (يناير 2004). "Pharmacological approaches in the treatment of atrial fibrillation". Curr. Med. Chem. ج. 11 ع. 1: 13–28. DOI:10.2174/0929867043456241. PMID:14754423.
- ^ Slayman CL، Long WS، Gradmann D (1976). "Action potentials in عصيباء مبوغة سميكة , a mycelial fungus". Biochimica et Biophysica Acta. ج. 426 ع. 4: 737–744. DOI:10.1016/0005-2736(76)90138-3. PMID:130926.
- ^ Mummert H، Gradmann D (1991). "Action potentials in أسيتابولاريا: measurement and simulation of voltage-gated fluxes". Journal of Membrane Biology. ج. 124 ع. 3: 265–273. DOI:10.1007/BF01994359. PMID:1664861.
- ^ Gradmann D (2001). "Models for oscillations in plants". Austr. J. Plant Physiol. ج. 28: 577–590.
- ^ Beilby MJ (2007). "Action potentials in charophytes". Int. Rev. Cytol. International Review of Cytology. ج. 257: 43–82. DOI:10.1016/S0074-7696(07)57002-6. ISBN:978-0-12-373701-4. PMID:17280895.
- ^ Gradmann D، Hoffstadt J (1998). "Electrocoupling of ion transporters in plants: Interaction with internal ion concentrations". Journal of Membrane Biology. ج. 166 ع. 1: 51–59. DOI:10.1007/s002329900446. PMID:9784585.
- ^ Leys SP، Mackie GO، Meech RW (1 مايو 1999). "Impulse conduction in a sponge". J. Exp. Biol. ج. 202 ع. 9: 1139–50. PMID:10101111. مؤرشف من الأصل في 2020-03-24.
- ^ "FitzHugh-Nagumo model". مؤرشف من الأصل في 2018-12-18. اطلع عليه بتاريخ 2014-05-24.
- ^ Note that these ألياف بيركنجيs are muscle fibers and not related to the خلية بركنجيs, which are عصبونs found in the مخيخ.
وصلات خارجية[عدل]
- شرح فيزيولوجيا الأعصاب. عن صفحة جامعة Eastern Kentucky University. (بالإنجليزية)
- Electrochemistry of plant life, from جامعة كيس وسترن ريسرف
- Demonstration of ion flow during action potential
- Open-source software to simulate neuronal and cardiac action potentials
- Nernst/Goldman Equation Simulator
- Electrophysiology and The Molecular Basis of Excitability
- Action Potential Len Kravitz, University of New Mexico
- PSY 340 Brain and Behavior, 2.2a Neural Impulse (part 2) Vincent W. Hevern, Le Moyne College, Syracuse New York
- Action Potentials Dawn A. Tamarkin, Springfield Technical Community College, Springfield, Massechusets
- Action Potential Rachel McCready, Intensive Care Unit, London Health Services Centre
- Propagation of an Action Potential National Health Museum Resource Center, Washington DC
- Neurotransmission Steve Croker, University of Derby. Derby, England
- Action Potential Charges Lesley Meek, University of Minnesota
- Action Potential Barbara Han, Oregon State University
- Neurotransmitter and neuron diagrams Edward I. Pollack, West Chester University of Pennsylvania
- Action Potential Conduction Encyclopedia Britannica
- The Action Potential John Kinnamon, University of Denver
- Excitable Cells John Kimball, Tufts University (retired)
- Resting and Action Membrane Potentials Teaching Resources Center, UC Davis. Animated tutorials
- Action Potential Frank Werblin, UC Berkely. Animated and interactive tutorials
- Action Potential Movement Through an Axon
| في كومنز صور وملفات عن: جهد الفعل |
