تأريخ بالكربون المشع

التأريخ باستخدام الكربون المشع هو التأريخ عن طريق تقنية الإشعاع بحيث يستخدم اضمحلال الكربون-14 (14C) لتقدير عمر المواد العضوية، مثل الخشب والجلود، وتصل إلى نحو 58,000 إلى 62,000 سنة ماضية.[1] التأريخ عن طريق الكربون اكتشف عبر ويلارد ليبي في عام 1949، والذي حصل على جائزة نوبل في الكيمياء.
منذ إدخال التأريخ عن طريق الكربون، استخدمت هذه الطريقة مرات عديدة، بما في ذلك عينات من مخطوطات البحر الميت وكفن تورينو، وكذلك مع القطع الأثرية المصرية للحصول على التسلسل الزمني للأسرات الفرعونية في مصر[2] وكذلك مع الأوتزي(رجل الثلج[3]).
يحتوي الغلاف الجوي للأرض نظائر مختلفة من الكربون، تقريبا بنسب ثابتة. وتشمل هذه النظائر: النظير المستقر الرئيسي 12C والنظير غير المستقر 14C. من خلال عملية التمثيل الضوئي، النباتات تمتص كلا نظائر ثاني أكسيد الكربون في الغلاف الجوي. وعندما يموت الكائن الحي، فإنه يحتوي على نسبة قياسية بين 14C و12C ولكن 14C يضمحل مع عدم وجود إمكانية التجديد، وبالتالي تختل النسبة بين 14C و12C بمقدار ثابت ومعروف. والوقت المستغرق للاضمحلال لنصف الكمية يسمى عمر النصف. وقياس النسبة المتبقية من النظير الكربوني في المواد العضوية يعطي تقديرا لعمرها (العمر الكربوني).[4] ومع ذلك، فهناك تقلبات صغيرة في نسبة 14C إلى 12C في الغلاف الجوي، والتقلبات هذه سجلت في الطبيعة ويمكن ملاحظتها في حلقات بعض جذوع الأشجار وأحجار الكهوف. هذه السجلات تتيح للباحثين تعديل أو «معايرة» التأريخ الكربوني، لإعطاء تقدير أكثر دقة للعينة. وأحد الاستخدامات الأكثر شيوعا من الكربون المشع هو تقدير عمر البقايا العضوية من المواقع الأثرية.
خلفية فيزيائية وكيميائية[عدل]

الكربون لديه نظيران غير مشعين (مستقران) هما الكربون-12 12C والكربون-13 13C وهناك كميات ضئيلة من النظير (غير المستقر) الكربون-14 14C، المعروف أيضا باسم الكربون المشع. ونصف عمر 14C (الوقت الذي يستغرقه نصف كمية معينة من 14C للاضمحلال) حوالي 5,730 سنة، لذا فإن تركيزه في الغلاف الجوي قد ينخفض على مدى آلاف السنين. ومع ذلك، فإنه يجري دوماً إنتاج 14C في الطبقة السفلى من الستراتوسفير والتروبوسفير العلوي بواسطة الأشعة الكونية، التي تولد بدورها النيوترونات التي تشكّل 14C عندما تضرب ذرات النيتروجين-14 14N.

2: اضمحلال الكربون-14
3: المعادلة هي للكائنات الحية، وعلامة عدم المساواة هي للكائنات الميتة، بحيث يبدأ اضمحلال الكربون-14 (انظر 2).
حينما تصطدم الأشعة الكونية في الجو تنتج نيوترونات التي تتفاعل بالتالي مع نيتروجين الجو فيتكون الكربون-14 . توصف عملية تكوين الكربون-14 من قبل التفاعل النووي التالي، حيث n يمثل النيوترون الذي يصطدم بالنيتروجين N ؛ وP يمثل بروتون:
بمجرد إنتاج الكربون-14 يتحد بسرعة مع الأكسجين في الغلاف الجوي لتشكيل ثنائي أكسيد الكربون (CO2) وثنائي أكسيد الكربون المنتج من هذه العملية ينتشر في الغلاف الجوي ويذوب في المحيط، وكذلك يتم تناولها من قبل النباتات من خلال عملية التمثيل الضوئي. الحيوانات تأكل النباتات، وفي نهاية المطاف، يتوزع الكربون المشع في جميع أنحاء المحيط الحيوي. وتسمى هذه العملية بدورة الكربون.
إذا فُرض أن تدفق الأشعة الكونية ظل ثابتا على مدى المئة ألف سنة الماضية، فالكربون-14 أُنتج بمعدل ثابت، وبما أنه كذلك فسيكون اضمحل بمعدل ثابت، وعلى ذلك تكون نسبة الكربون المشع إلى غير المشع ثابتة. وبناءً على هذه الافتراضات فستكون نسبة 14C إلى 12C في الطبيعة 1.5 جزء من 14C إلى 1012 جزء من 12C.
اكتشاف طريقة التأريخ باستخدام الكربون[عدل]
في منتصف أربعينيات القرن الماضي، أدرك ويلارد ليبي - الذي كان في جامعة شيكاغو - أن اضمحلال الكربون-14 قد يؤدي إلى وسيلة لتأريخ المادة العضوية. ليبي نشر بحثا علميا في عام 1946م وبيّن أن الكربون في المواد الحية قد يشمل الكربون-14 وكذلك الكربون غير المشع. ليبي وعدد ممن هم معه بدأوا بتجربة مع غاز الميثان الذي تم جمعه من الصرف الصحي في بالتيمور، وبعد فصل النظائر تبينوا أن العينات تحتوي على الكربون المشع (كربون-14).[5][6]
على النقيض من ذلك، فغاز الميثان الناتج من النفط لم يحتوِ على أي نشاطٍ للكربون المشع. وقد لخصت النتائج في ورقة في دورية ساينس العلمية التي تنشرها الجمعية الأمريكية لتقدم العلوم في عام 1947م، وعلق الباحثون أن نتائجها تبين أنه سيكون من الممكن تأريخ المواد العضوية بناء على المواد التي تحتوي على الكربون فيها.[5][7] وهنا قام ليبي وجيمس ارنولد باختبارها على عينات من الخشب معروفة العمر، فقاما بأخذ عينتين من الخشب أُخذتا من قبر الفرعونين المصريين، زوسر وسنفرو، كانتا مؤرختين لـ 2625 قبل الميلاد زائد أو ناقص 75 عامًا، وعندما تم تأريخها بواسطة الكربون المشع تبين أنها تعود إلى ما متوسطه 2800 قبل الميلاد زائد أو ناقص 250 سنة.[8][9] هذه التجربة نُشرت في دورية ساينس للعلوم في عام 1949م، وحينذاك بدأت «ثورة الكربون المشع» في علم الآثار، وسرعان ما أدت إلى تغييرات جذرية في التسلسل الزمني. وفي عام 1960م، منحت جائزة نوبل في الكيمياء لليبي بسبب هذا الاكتشاف.[10]
حساب العصور[عدل]
ما دام النبات أو الحيوان على قيد الحياة، فإنه يتبادل الكربون مع محيطه، بحيث أن نسبة الكربون-14 التي يحتويها ستكون لها نفس نسبة الكربون-14 في محيطه الحيوي. وبمجرد أن يموت، فإنه يتوقف عن اكتساب الكربون-14 وهنا يبدأ في الاضمحلال بمعدل ثابت مع الزمن من خلال اطلاق جسيمات بيتا ولا يتم تعويضه كما هو الحال للكائن الحي. يتم قياس أشعة الإلكترونات (أشعة بيتا) من عينة معروفة الوزن فيمكن معرفة كمية الكربون-14 الباقية في العينة . بينما يبقى الكربون-12 ثابتا في جسم الكائن قبل الوفاة وبعده. المعادلة التي تحكم اضمحلال النظائر المشعة هي:
- حيث N0 هي عدد ذرات النظائر في العينة الأصلية (في الوقت t = 0).
- N هو عدد ذرات الباقية بعد t من الوقت.
- λ ثابت يعتمد على النظير، وبالنسبة للكربون-14 فإن متوسط الوقت المتوقع قبل أن يخضع للإضمحلال الإشعاعي هو 8,267 سنة، وبالتالي فإن المعادلة أعلاه يمكن إعادة كتابتها بالشكل التالي.[11]
- نسبة ذرات الكربون-14 في العينة الأصلية ( N0 ) تفرض أنها نفس نسبة الذرات في المحيط الحيوي.
- حساب الذرات المتبقية في العينة N يسمح لنا بحساب الوقت t الذي يرمز لعمر العينة.
- عمر النصف للنظير المشع يرمز له عادة بـT1/2 وهو في الكربون 5,730 وهذه العلاقة بين نصف العمر ومتوسط العمر
الحسابات المذكورة أعلاه ليست بتلك الدقة لأننا افترضنا عدة فرضيات فعلى سبيل المثال
- فرضنا أن مستوى الكربون-14 ظل ثابتاً في المحيط الحيويّ، وفي الواقع، فإن مستوى الكربون-14 قد تفاوت في المحيط الحيوي بشكل ملحوظ خلال السنوات السحيقة الماضية، ونتيجة لذلك فإن القيم التي تقدمها المعادلة أعلاه لا بد من تصحيحها باستخدام بيانات من مصادر أخرى، وذلك باستخدام منحنى المعايرة الذي سنتطرق له لاحقًا.[12]
خزان تبادل الكربون[عدل]

يقصد بخزان تبادل الكربون الأماكن التي يمكن أن يُخزن فيها الكربون في الطبيعة حيث تجري عملية التبادل نتيجة الاضمحلال بين كربون-12 وكربون-14. هناك تفاوت في نسبة التخزين وفي الوقت اللازم للنظير كربون-14 ليتشكل من الأشعة الكونية وليختلط مع نظائر الكربون الأخرى.[13] في الغلاف الجوي، حيث يتشكل 14C يوجد 1.9% من هذا النظير بالنسبة للكمية الكلية في جميع الخزانات، والكربون-14 الموجود فيه يحتاج إلى أقل من سبع سنوات للاختلاط.[14][15] تُعد نسبة الكربون-14 14C إلى الكربون-12 12C في الغلاف الجوي كأساس بالنسبة لباقي الخزانات؛ حيث أنه في حال كان أي خزان آخر نسبة أقل من 14C إلى 12C يشير ذلك إلى أن الكربون أقدم وبالتالي فإن بعض من 14C قد اضمحل.[12]
إن سطح المحيط يعد مثالاً على ذلك، إذ أنه يحوي 2.4% من الكربون في خزان التبادل،[14] ولكن هناك حوالي 95% من 14C متوقع وجودها في حال كانت النسبة نفسها الموجودة في الغلاف الجوي.[13] إن الوقت المستغرق للكربون من الغلاف الجوي ليختلط مع سطح المحيط هو حوالي بضع سنين،[16] ولكن المياه الموجودة على السطح تختلط أيضاً مع المياه القادمة من أعماق المحيط، والتي لديها أكثر من 90% من الكربون في الخزان.[12] إن المياه في أعماق المحيط تستغرق حوالي 1,000 سنة كي تخضع لعملية تدوير من العمق إلى السطح، بالتالي فإن مياه السطح تحوي مزيجاً من مياه قديمة ذات محتوى منضب من 14C ومياه متشكلة حديثاً على السطح ذات محتوى من 14C بحالة توازن مع الغلاف الجوي.[12]
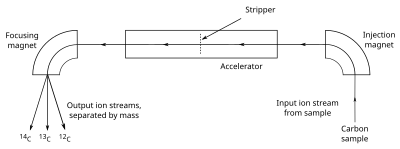
إن المخلوقات التي تعيش بالقرب من سطح المحيط لديها نفس نسبة 14C كالمياه التي تعيش فيها. باستعمال طريقة الحساب المعطاة في الأعلى لحساب عمر الحياة البحرية فإنها تعطي عمراً بشكل وسطي مقداره 400 سنة[17][note 2]. بالنسبة للمخلوقات التي تعيش على اليابسة فإنها على توازن أكبر مع الغلاف الجوي، وبالتالي فإن لها نفس نسبة 14C إلى 12C كما للغلاف الجوي.[13]
مقالات لها ارتباط[عدل]
- كربون-14
- قبل الحاضر
- تأريخ الأرجون-أرجون
- تأريخ إشعاعي
- عمر النصف
- علم تحديد أعمار الأشجار
- علم الآثار
- أرصاد الطقس السطحي
المصادر[عدل]
ملاحظات[عدل]
المراجع[عدل]
- ^ Plastino، L.؛ Kaihola؛ Bartolomei، P.؛ Bella، F. (2001). "hCosmic Background Reduction In The Radiocarbon Measurement By Scintillation Spectrometry At The Underground Laboratory Of Gran Sasso" (PDF). Radiocarbon. ج. 43 ع. 2A: 157–161. مؤرشف من الأصل (PDF) في 2017-03-01.
- ^ Christopher Bronk Ramsey, Michael W. Dee, Joanne M. Rowland, Thomas F. G. Higham, Stephen A. Harris, Fiona Brock, Anita Quiles, Eva M. Wild, Ezra S. Marcus, Andrew J. Shortland (18 يونيو 2010). "Radiocarbon-Based Chronology for Dynastic Egypt". Science. مؤرشف من الأصل في 2015-09-24. اطلع عليه بتاريخ 2013-01-27.
{{استشهاد ويب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "The Incredible Age of the Find". South Tyrol Museum of Archaeology. 2013. مؤرشف من الأصل في 2016-09-01. اطلع عليه بتاريخ 2013-01-27.
- ^ Higham، Thomas. "The 14C Method". مؤرشف من الأصل في 2018-10-12. اطلع عليه بتاريخ 2013-01-27.
- ^ أ ب Bowman, Radiocarbon Dating, p. 9.
- ^ Atmospheric Helium Three and Radiocarbon from Cosmic Radiation. Phys. Rev.. 1946;69(671):2. معرف الوثيقة الرقمي:1103/PhysRev.69.671.2.
- ^ Anderson, E. C.; Libby, W. F.; Weinhouse, S.; Reid, A. F.; Kirshenbaum, A. D.; and Grosse, A. V.. Radiocarbon from cosmic radiation. Science. 1947;105(2765):576–577. معرف الوثيقة الرقمي:10.1126/science.105.2735.576. بيب كود:1947Sci...105..576A.
- ^ Arnold، J. R.؛ Libby، W. F. (1949). "Age Determinations by Radiocarbon Content: Checks with Samples of Known Age". Science. ج. 110 ع. 2869: 678–680. Bibcode:1949Sci...110..678A. DOI:10.1126/science.110.2869.678. JSTOR:1677049. PMID:15407879. مؤرشف من الأصل في 2019-01-15.
- ^ Aitken, Science-based Dating, pp. 60–61.
- ^ Bowman, Radiocarbon Dating, p. 10.
- ^ Aitken, Science-based Dating in Archaeology, p. 59.
- ^ أ ب ت ث Aitken, Science-based Dating in Archaeology, pp. 61–66.
- ^ أ ب ت ث Bowman, Radiocarbon Dating, p. 13.
- ^ أ ب ت Goudie & Cuff, Environmental Change and Human Society, pp. 128–129.
- ^ Warneck, Chemistry of the Natural Atmosphere, p. 690.
- ^ Sundquist, "Geological perspectives on carbon dioxide and the carbon cycle", p. 13.
- ^ Bowman, Radiocarbon Dating, pp. 24–27.
| في كومنز صور وملفات عن: تأريخ بالكربون المشع |




