تخطيط صدى معزز بالتباين
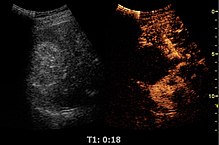
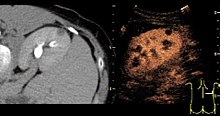
تخطيط الصدى المعزز بالتباين، هو تخطيط صدى طبي تقليدي يقترن باستخدام وسيط تباين. يعتمد التباين على اختلاف انعكاس الموجات الصوتية من المسافات بين المواد. قد يكون ذلك سطح فقاعة هواء صغيرة أو بنية أخرى أكثر تعقيدًا. تتكون وسائط التباين المتوفرة تجاريًا من فقاعات صغيرة مملوءة بالهواء تدخل للجسم عبر الحقن الوريدي. تكون تلك الفقاعات الصغيرة عالية الصدوية (أي ذات قدرة كبيرة على عكس الموجات الصوتية). يوجد اختلاف كبير بين صدوية الغاز في الفقاعات وصدوية الأنسجة الرخوة في الجسم. ولهذا، يعزز تخطيط الصدى المتزامن مع حقن وسيط تباين من التبعثر المرتد -أو انعكاس الموجات الصوتية- لينتج عن ذلك تخطيط صدى عالي التباين بسبب الاختلاف الكبير في الصدوية.
تقرن الفقاعات الصغيرة بجزيئات صغيرة (ربيطات) ترتبط بمستقبلات خاصة بالأمراض داخل الوعائية، وهذا سيسمح للمعقد المتشكل بالتراكم ضمن الأنسجة المريضة أو غير الطبيعية. يعرف هذا الشكل من التصوير الجزيئي باسم تخطيط الصدى الموجه والمعزز بالتباين. يولد هذا الشكل من التصوير إشارة صدوية قوية بعد ارتباط الفقاعات الدقيقة بالمنطقة المستهدفة. يفيد تخطيط الصدى الموجه والمعزز بالتباين في التشخيص الطبي والعلاجي. ومع ذلك، لم توافق إدارة الغذاء والدواء الأمريكية بعد على الاستخدام السريري لهذه التقنية في الولايات المتحدة.[2]
التطبيقات[عدل]
يستخدم تخطيط الصدى المعزز بالتباين غير الموجه في تخطيط صدى القلب وعلم الأشعة، بينما يستخدم التخطيط الموجه في سياق مجموعة متنوعة من التطبيقات الطبية.
تخطيط الصدى غير الموجه المعزز بالتباين[عدل]
تستخدم فقاعات أوبتسيون وليفوفيست المتوفرة حاليًا في تخطيط صدى القلب، بينما تستخدم مادة التباين لشركة سونوفو في الأشعة لتوصيف الآفات.[3]
- تحديد حواف العضو: تعزز الفقاعات الدقيقة التباين بين الأنسجة والدم، وهذا يمنح الطبيب صورة أوضح لهيكل العضو. يشكل ذلك أمرًا بالغ الأهمية في تخطيط صدى القلب، حيث يشير ترقق جدار القلب أو سماكته أو عدم انتظامه إلى حالة قلبية خطيرة تتطلب المراقبة أو العلاج.
- حجم الدم والتروية: يساعد تخطيط الصدى المعزز بالتباين بما يلي: (1) تقييم درجة التروية الدموية لعضو أو منطقة ما و(2) تقييم حجم الدم ضمن عضو أو منطقة ما. تسمح الفقاعات الدقيقة بقياس معدل التدفق القلبي عند استخدام تقنية الإيكو دوبلر معها، وهذا يمكننا من تشخيص اضطراب صمامات القلب. توفر الكثافة النسبية لصدوية الفقاعات الدقيقة مقدار كمي تقريبي لحجم الدم.[4]
- توصيف الآفة: يلعب تخطيط الصدى المعزز بالتباين دورًا في التفريق بين آفات الكبد البؤرية الحميدة والخبيثة. يعتمد التفريق بين الآفات على ملاحظة أو معالجة نمط الحركية الوعائية ضمن الآفة ومقارنة ذلك مع الأنسجة المحيطة بها.[5][6]
تخطيط الصدى الموجه المعزز بالتباين[عدل]
الالتهاب: يمكن تصميم وسائط تباين مخصصة للارتباط ببروتينات معينة يفرزها الجسم في الأمراض الالتهابية بشكل خاص كما في داء كرون والتصلب العصيدي والنوبات القلبية مثلًا. تستهدف هذه التقنية الخلايا البطانية للأوعية الدموية والكريات البيض:
تعبر الأوعية الدموية الملتهبة -على وجه التحديد- عن مستقبلات معينة تعمل كجزيئات التصاق خلوية، ومن هذه الجزيئات: VCAM-1 وICAM-1 والسيليكتين إي. يمكن استخدام الفقاعات التي تستهدف هذه الجزيئات وترتبط بها للكشف عن بداية حدوث الالتهاب عبر التصوير بالموجات فوق الصوتية. يسمح الاكتشاف المبكر للالتهاب بوضع علاجات أفضل. حاول بعض الباحثين صنع فقاعات دقيقة تحوي أجسام مضادة وحيدة النسيلة ترتبط بجزيئات السيليكتين بي وICAM-1 وVCAM-1، ولكن كان الالتصاق بالهدف الجزيئي ضعيف؛ فقد انفصل جزء كبير من الفقاعات الدقيقة عن الهدف بعد الارتباط به، خاصةً في الحالات التي ترافقت بإجهاد قص هام فيزيولوجيًا.[7][8]
تمتلك كريات الدم البيضاء قدرة كبيرة على الالتصاق، ويرجع ذلك جزئيًا إلى نظام الإيقاف الخلوي مزدوج الارتباط بالسيليكتين والإنتغرين. يملك زوجPSGL-1: سيليكتين قدرة ارتباط سريعة تعمل على إبطاء الكريات البيض، بينما يملك زوج الإنتغرين: غلوبولين مناعي قدرتي ارتباط وانفصال بطيئتين مهمتين لإيقاف الكريات البيض وتعزيز الالتصاق حركيًا. حاول الباحثون ربط وسائط تباين بجزيئات كهذه عبر استخدام تقنيات خاصة -كالاستهداف مزدوج الربيطات لمستقبلات مميزة للبوليمرات الكروية الدقيقة، كما حاولوا إنشاء محاكاة حيوية لنظام كبح الكريات البيض الذي يستخدم الإنتغرين والسيليكتين. أوضحت هذه المحاولات القدرة العالية على الالتصاق، ولكنها لم تصل لدرجة تسمح باستخدامها سريريًا للكشف عن الالتهاب.[9][10][11]
الخثرات وانحلالها: تشكل الصفائح الدموية المفعلة جزء أساسي من الخثرات الدموية. يمكن ربط الفقاعات الدقيقة بجزء مأشوب متبدل أحادي السلسلة نوعي للبروتين السكري المنشط 2ب/3أ، وهو أشيع المستقبلات الموجودة على سطح الصفائح الدموية. ترتبط الفقاعات الدقيقة الموجهة للبروتين السكري 2ب/3أ بالصفائح الدموية المفعلة على الرغم من ارتفاع إجهاد القص في منطقة تشكل الخثرة، وهذا سيسمح بتصوير جزيئي مباشر لحالات الخثار -كاحتشاء العضلة القلبية مثلًا، بالإضافة إلى مراقبة نجاح انحلال الخثرة الدوائي أو فشله.[12]
السرطان: تعبر الخلايا السرطانية أيضًا عن مجموعة محددة من المستقبلات وأهمها المستقبلات المحفزة لنمو أوعية دموية جديدة. بناءً على ذلك، يمكننا صنع فقاعات دقيقة تستهدف عامل النمو البطاني الوعائي أو البروتين السكري 2ب/3أ مثلًا، وهذا سيساعدنا في تحديد مواضع السرطانات بطريقة نوعية وغير متوغلة.[13]
إدخال الجينات: يمكن ربط ناقل من حمض نووي ريبوزي منقوص الأكسجين بالفقاعات الدقيقة، ثم تصمم تلك الفقاعات لترتبط بمستقبلات خاصة بالخلايا المستهدفة. تستخدم الموجات فوق الصوتية -فيما بعد- لتفجير الفقاعة الدقيقة فور وصولها سطح الخلية الهدف مع الحمض النووي المحمول. تؤدي القوة المرتبطة بالانفجار إلى ارتفاع مؤقت في نفوذية الأنسجة المحيطة؛ ما يسمح للحمض النووي المحمول بالدخول بسهولة أكبر إلى الخلايا.[14]
إدخال الأدوية: يمكن ربط الأدوية بالغلاف الشحمي للفقاعات الدقيقة. يسمح الحجم الكبير للفقاعات بإدخال كمية أكبر من الدواء مقارنةً بمركبات الإدخال الأخرى –كالجسيمات الشحمية مثلًا. تزود الفقاعات الدقيقة الحاملة للدواء بجزيئات تقترن بمستقبلات نوعية خاصة بالخلايا المستهدفة. لن تساعدنا هذه الطريقة بتوصيل الدواء بشكل نوعي فحسب، بل يمكننا أيضًا التحقق من ذلك عبر تصوير المنطقة بالموجات فوق الصوتية.[15]
انظر أيضًا[عدل]
مراجع[عدل]
- ^ أ ب Content initially copied from: Hansen، Kristoffer؛ Nielsen، Michael؛ Ewertsen، Caroline (2015). "Ultrasonography of the Kidney: A Pictorial Review". Diagnostics. ج. 6 ع. 1: 2. DOI:10.3390/diagnostics6010002. ISSN:2075-4418. PMC:4808817. PMID:26838799.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) (CC-BY 4.0) - ^ Sidhu، Paul؛ Cantisani، Vito؛ Deganello، Annamaria؛ Dietrich، Christoph؛ Duran، Carmina؛ Franke، Doris؛ Harkanyi، Zoltan؛ Kosiak، Wojciech؛ Miele، Vittorio؛ Ntoulia، Aikaterini؛ Piskunowicz، Maciej؛ Sellars، Maria؛ Gilja، Odd (2016). "Role of Contrast-Enhanced Ultrasound (CEUS) in Paediatric Practice: An EFSUMB Position Statement". Ultraschall in der Medizin – European Journal of Ultrasound. ج. 38 ع. 1: 33–43. DOI:10.1055/s-0042-110394. ISSN:0172-4614. PMID:27414980.
- ^ Rognin، NG؛ Frinking, P.؛ Costa, M.؛ Arditi, M. (نوفمبر 2008). "In-vivo perfusion quantification by contrast ultrasound: Validation of the use of linearized video data vs. Raw RF data". 2008 IEEE Ultrasonics Symposium. ص. 1690–1693. DOI:10.1109/ULTSYM.2008.0413. ISBN:978-1-4244-2428-3. S2CID:45679140.
- ^ Lindner J.R. (2004). "Microbubbles in medical imaging: current applications and future directions". Nat Rev Drug Discov. ج. 3 ع. 6: 527–32. DOI:10.1038/nrd1417. PMID:15173842. S2CID:29807146.
- ^ Lindner, J.R., A.L. Klibanov, and K. Ley. Targeting inflammation, In: Biomedical aspects of drug targeting. (Muzykantov, V.R., Torchilin, V.P., eds.) Kluwer, Boston, 2002; pp. 149–172.
- ^ McCulloch M.؛ Gresser C.؛ Moos S.؛ Odabashian J.؛ Jasper S.؛ Bednarz J.؛ Burgess P.؛ Carney D.؛ Moore V.؛ Sisk E.؛ Waggoner A.؛ Witt S.؛ Adams D. (2000). "Ultrasound contrast physics: A series on contrast echocardiography, article 3". J Am Soc Echocardiogr. ج. 13 ع. 10: 959–67. DOI:10.1067/mje.2000.107004. PMID:11029724.
- ^ Takalkar A.M.؛ Klibanov A.L.؛ Rychak J.J.؛ Lindner J.R.؛ Ley K. (2004). "Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow". J. Control. Release. ج. 96 ع. 3: 473–482. DOI:10.1016/j.jconrel.2004.03.002. PMID:15120903.
- ^ Weller G.E.؛ Villanueva F.S.؛ Tom E.M.؛ Wagner W.R. (2005). "Targeted ultrasound contrast agents: In vitro assessment of endothelial dysfunction and multi-targeting to ICAM-1 and sialyl Lewis(x)". Biotechnol. Bioeng. ج. 92 ع. 6: 780–8. DOI:10.1002/bit.20625. PMID:16121392.
- ^ Wang، X؛ Hagemeyer, CE؛ Hohmann, JD؛ Leitner, E؛ Armstrong, PC؛ Jia, F؛ Olschewski, M؛ Needles, A؛ Peter, K؛ Ingo, A (يونيو 2012). "Novel single-chain antibody-targeted microbubbles for molecular ultrasound imaging of thrombosis: Validation of a unique non-invasive method for rapid and sensitive detection of thrombi and monitoring of success or failure of thrombolysis in mice". Circulation. ج. 125 ع. 25: 3117–3126. DOI:10.1161/CIRCULATIONAHA.111.030312. PMID:22647975.
- ^ Yap، ML؛ McFadyen, JD؛ Wang, X؛ Hohmann, JD؛ Ziegler, M؛ Yao, Y؛ Pham, A؛ Harris, M؛ Donnelly, PS؛ Hogarth, PM؛ Pietersz, GA؛ Lim, B؛ Peter, K (يونيو 2017). "Targeting Activated Platelets: A Unique and Potentially Universal Approach for Cancer Imaging". Theranostics. ج. 7 ع. 10: 2565–2574. DOI:10.7150/thno.19900. PMID:28819447.
- ^ Wang، X؛ Searle, AK؛ Hohmann, JD؛ Liu, AO؛ Abraham, MK؛ Palasubramaniam, J؛ Lim, B؛ Yao, Y؛ Wallert, M؛ Yu, E؛ Chen, YC؛ Peter, K (أبريل 2018). "Dual-Targeted Theranostic Delivery of miRs Arrests Abdominal Aortic Aneurysm Development". Molecular Therapy. ج. 25 ع. 4: 1056–1065. DOI:10.1016/j.ymthe.2018.02.010. PMID:2952574.
- ^ Wang، X؛ Gkanatsas, Y؛ Palasubramaniam, J؛ Hohmann, JD؛ Chen, YC؛ Lim, B؛ Hagemeyer, CE؛ Peter, K (مارس 2016). "Thrombus-Targeted Theranostic Microbubbles: A New Technology towards Concurrent Rapid Ultrasound Diagnosis and Bleeding-free Fibrinolytic Treatment of Thrombosis". Theranostics. ج. 6 ع. 5: 726–738. DOI:10.7150/thno.14514. PMID:27022419.
- ^ Claudon، M؛ Dietrich, CF.؛ Choi, BI.؛ Cosgrove, DO.؛ Kudo, M.؛ Nolsøe, CP.؛ Piscaglia, F.؛ Wilson, SR.؛ Barr, RG.؛ Chammas, MC.؛ Chaubal, NG.؛ Chen, MH.؛ Clevert, DA.؛ Correas, JM.؛ Ding, H.؛ Forsberg, F.؛ Fowlkes, JB.؛ Gibson, RN.؛ Goldberg, BB.؛ Lassau, N.؛ Leen, EL.؛ Mattrey, RF.؛ Moriyasu, F.؛ Solbíatí, L.؛ Weskott, HP.؛ Xu, HX (فبراير 2013). "Guidelines and Good Clinical Practice Recommendations for Contrast Enhanced Ultrasound (CEUS) in the Liver-Update 2012: A WFUMB-EFSUMB Initiative in Cooperation With Representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS". Ultrasound Med Biol. ج. 39 ع. 2: 187–210. DOI:10.1016/j.ultrasmedbio.2012.09.002. PMID:23137926. مؤرشف من الأصل في 2020-07-28.
- ^ Rognin، NG؛ Arditi, M.؛ Mercier, L.؛ Frinking, P.J.A.؛ Schneider, M.؛ Perrenoud, G.؛ Anaye, A.؛ Meuwly, J.؛ Tranquart, F. (نوفمبر 2010). "Parametric imaging for characterizing focal liver lesions in contrast-enhanced ultrasound". IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. ج. 57 ع. 11: 2503–2511. DOI:10.1109/TUFFC.2010.1716. PMID:21041137. S2CID:19339331.
- ^ Anaye، A؛ Perrenoud, G.؛ Rognin, N.؛ Arditi, M.؛ Mercier, L.؛ Frinking, P.؛ Ruffieux, C.؛ Peetrons, P.؛ Meuli, R.؛ Meuwly, JY. (أكتوبر 2011). "Differentiation of focal liver lesions: usefulness of parametric imaging with contrast-enhanced US". Radiology. ج. 261 ع. 1: 300–310. DOI:10.1148/radiol.11101866. PMID:21746815.
