رنح وتوسع الشعيرات
| متلازمة الرّنح وتوسع الشعيرات | |
|---|---|
| معلومات عامة | |
| الاختصاص | طب الجهاز العصبي، وعلم الوراثة الطبية |
| المظهر السريري | |
| الأعراض | نقص تنسج التوتة |
| الوبائيات | |
| انتشار المرض | 0.00009 [1] |
| تعديل مصدري - تعديل | |
متلازمة الرّنح وتوسع الشعيرات (AT) (المشارإليها باسم متلازمة لويس بار أيضا [2]) هو مرض نادر، تنكسي عصبي، وراثي يسبب إعاقة شديدة. يشير مرض الرّنح إلى ضعف في التوازن، وتوسع في شعيرات الأوعية الدموية المتوسعة الصغيرة، وتعد كلا الخاصيتين من السمات المميزة للمرض.[3]
A-T يؤثر على العديد من أجزاء الجسم:
- أنه يؤدي إلى إعاقة مناطق معينة من الدماغ بما فيها المخيخ، مما يؤدي إلى صعوبة في الحركة والتوازن.
- يؤدي إلى إضعاف الجهازالمناعي، مما يؤدي إلى زيادة في احتمالية الحصول على العدوى.
- يمنع إصلاح الأحماض النووية المكسورة، مما يزيد من خطر الإصابة بالسرطان.
غالبا ما تظهر الأعراض لأول مرة في مرحلة الطفولة المبكرة (مرحلة الحبو) عندما يبدأ الأطفال بالمشي. على الرغم من أن الأطفال المصابون بهذه الحالة يبدأون المشي في سن طبيعية الا أنهم يتمايلون ويتأرجحون عند المشي، الوقوف باستقامة أو الجلوس، وربما يبدون تقريبا كما لو أنهم في حالة من الثمالة. وفي أواخر مرحلة ما قبل المدرسة وبداية مرحلة سن المدرسة المبكرة، يواجهون صعوبة في تحريك عيونهم بطريقة طبيعية من مكان إلى لآخر (تعذر الأداء الحركي العيني).[4] يصبح لديهم لفظ مدغم ومشاكل في البلع. بعضهم يصبح أكثر قابلية للإصابة بامراض الجهازالتنفسي (التهابات الأذن، التهاب الجيوب، التهاب القصبات، والتهاب رئوي). وبما أن الأطفال لا ينمون جميعا بنفس السرعة والطريقة، فقد تستغرق عملية تشخيص المرض بصورة صحيحة عدة سنوات. لدى معظم الأطفال المصابين مؤشرات عصبية مستقرة لأول 4-5 سنوات من حياتهم، ولكن يبدأ ظهور المرض في بداية سنواتهم الدراسية.
هذا المرض يسببه خلل في جين (ا.ت.م ATM)المسؤول عن التحكم في ردود فعل الخلية إلى عدة أشكال من الإجهاد، مثل كسرالمسارات المزدوجة للحمض النووي. بطريقة أبسط، البروتين الذي ينتجه جين (ا.ت.م) يتعرف على وجود كسر أو قطع في الحمض النووي، ثم يجند ويوظف بروتينات أخرى لإصلاح الكسر أو القطع، ويوقف الخلية من إنتاج أي حمض نووي جديد إلى أن تنتهي عملية الإصلاح.[5]
الأعراض[عدل]
الأعراض هناك تفاوت كبير في شدة ملامح متلازمة الرنح بين الأفراد المتضررين وباختلاف الأعمار. الأعراض والمشاكل التالية تعد إما شائعة أو هامة لمتلازمة الرنح:
- الترنح (صعوبة في السيطرة على الحركة) والتي تبدو واضحة في وقت مبكر الا أنها تزداد سوءاً في المدرسة إلى ما قبل سن المراهقة.
- تعذر الأداء الحركي للعين (صعوبة في التنسيق بين حركة الرأس والعين عندما ينتقل البصر من مكان إلى آخر).
- حركات لا إرادية
- توسع في الشعيرات (الأوعية الدموية المتوسعة) الموجودة على المنطقة البيضاء (الصلبة) من العين، مما يجعلها تبدو محتقنة بالدم. هذه الاعراض لا تكون واضحة في مرحلة الطفولة وقد تظهر لأول مرة في سن 5-8 سنوات. وقد يظهر توسع في الشعيرات على المناطق الجلدية المعرضة للشمس أيضا.
- مشاكل متعلقة بالعدوى، وخاصة في الأذنين، والجيوب الأنفية والرئتين.
- زيادة في احتمالية حدوث السرطانات (في المقام الأول -ولكن ليس على سبيل الحصر- الليمفوما واللوكيميا).
- تأخر بدء أو عدم اكتمال التطور البلاغي وانقطاع مبكر جدا في دورة الطمث.
- تباطؤ في معدل النمو (الوزن و\أو الطول).
- سيلان اللعاب وخاصة عند الأطفال الصغار عند التعب أو التركيز على الأنشطة.
- رتة(يكون النطق (أصوات الكلام) مدغما، بطيئا أو مشوها).
- الإصابة بالسكري في مرحلة المراهقة أو في وقت لاحق.
- تغيرات مبكرة في الشعر والجلد.
- يتم تشخيص العديد من الأطفال في البداية تشخيصا خاطئا بان لديهم شلل دماغي رنحي. ولا يجوز تشخيص متلازمة رنح وتوسع الشعيرات حتى سنوات ما قبل المدرسة إلى حين ظهور الأعراض العصبية من مشية متضررة، تنسيق حركة اليد، الكلام وحركة العيون أو ازديادها سوءا، ويظهر توسع الشعيرات أولا. ولأن مرض ترنح الشعيرات نادر جدا قد لا يكون الأطباء على دراية بالأعراض أو أساليب التوصل إلى التشخيص. الظهور المتأخر لتوسع الشعيرات قد يكون عائقا امام التشخيص وقد يستغرق الأمر بعض الوقت قبل أن ينظر الأطباء ل AT كاحتمال بسبب الاستقرار المبكر للأعراض والعلامات.
الترنح ومشاكل عصبية أخرى[عدل]
عادة ماتظهر المؤشرات الأولى للمرض في سنوات الطفولة المبكرة (عند تعلم الطفل المشي)، يبدأ الأطفال المشي في سن طبيعي ولكن قد لا تتحسن مشيتهم عن المشية المتهادة الأولية.[6][7] وقد يكون لديهم أحيانا مشاكل في الوقوف أو الجلوس كما انهم قد يميلون للخلف أو من جانب لآخر. في سنوات الدراسة الابتدائية يصبح المشي أكثر صعوبة وقد يستخدم الأطفال المداخل والجدران للحصول على الدعم. غالبا ما يظهر الأطفال اللذين يعانون من متلازمة الرنح وتوسع الشعيرات بصورة أفضل عند الركض أو المشي بسرعة بالمقارنة مع المشي البطيء أو الوقوف في مكان واحد. حول بداية عقدهم الثاني، يبدأ الأطفال اللذين يعانون من الأشكال النموذجية لمتلازمة الترنح باستخدام الكرسي المتحرك للمسافات الطويلة. خلال سنوات الدراسة، قد يواجه الأطفال صعوبة متزايدة في القراءة بسبب ضعف تنسيق حركة العين. وفي الوقت نفسه، قد تنشأ مشاكل أخرى في الوظائف الحركية الدقيقة(الكتابة، التلوية واستخدام الأواني لتناول الطعام) كما وقد تظهر الرتة (الإدغام في الكلام). يتوقف تطور معظم هذه المشاكل العصبية بعد سن 12-15 سنة على الرغم من أن الحركات اللارادية قد تبدأ في أي عمر، وربما تزداد سوءا مع مرور الوقت. وويمكن لهذه الحركات الاضافية أن تتخذ أشكالا عديدة، بما في ذلك الرعشات الصغيرة في اليدين والأقدام والتي قد تبدو مثل التململ (الرقاص وهو مرض عصبي)، حركات التواء أبطأ في الجزء العلوي من الجسم (كنع)، واعتماد وضعيات صلبة وملتوية(خلل التوتر)، ارتعاشات غير منضبطة بين الحين والآخر (نفضة الرمع العضلي)، ومختلف الحركات المتناغمة وغير المتناغمة مع محاولات للقيام بعمل منسق (ارتعاشات).
توسع الشعيرات[عدل]

تظهر الأوعية الدموية البارزة (توسع الشعيرات) على المنطقة البيضاء من العيون(الصلبة) عادة قبل سن ال 5-8 سنوات وفي بعض الأحيان في وقت لاحق وقد لا تظهر على الإطلاق.[8] ان غياب توسع الشعيرات لا يستبعد التشخيص بمتلازمة الترنح. قد يمثل توسع الشعيرات مشكلة تجميلية الا أنها لا تنزف ولا تسبب الحكة، على الرغم من أنها تشخص بالخطأ أحيانا على أنها التهاب مزمن في الملتحمة. وهذه طبيعتها الثابتة، ولا تتغير مع مرور الوقت والطقس أو الحالة العاطفية مما يجعلها تختلف عن الأوعية الدموية المرئية الأخرى. يمكن أن يظهر توسع الشعيرات على المناطق الجلدية المعرضة للشمس أيضا، وخاصة الوجه والأذنين. وقد تحدث في المثانة نتيجة مضاعفات متأخرة من العلاج الكيميائي بالسيكلوفوسفامايد، وقد تمت مشاهدتها في أعماق الدماغ عند المرضى كبار السن المصابين بمتلازمة الترنح وتوسع الشعيرات، وقد تنشأ أحيانا في الكبد والرئتين.
مشاكل مناعية[عدل]
حوالي ثلثي الأشخاص اللذين يعانون من متلازمة الترنح لديهم تشوهات في الجهاز المناعي. ومن التشوهات الأكثر شيوعا المستويات المنخفضة لواحد أو أكثر من الكريينات المناعية ((IgA،IgG،IgM\IgG، عدم القدرة على تكوين أجسام مضادة كاستجابة للقاحات أو العدوى، وكذلم انخفاض في أعداد الخلايا اللمفاوية (خاصة الخلايا اللمفية تي) في الدم.[9] يعاني بعض الأشخاص من التهابات متكررة في الجزء العلوي (نزلات البرد، وعدوي الجيوب الأنفية والاذن) والجزء السفلي (التهاب الشعب الهوائية والاتهاب الرئوي) من الجهاز التنفسي. يجب أن يتم تقييم جهاز المناعة عند جميع الأطفال المصابين بمتلازمة الترنح كي يتم الكشف عن الحالات التي تعاني من مشاكل حادة والتي قد تتطلب علاجا للتخفيف من عدد أو شدة العدوى. بعض المصابين بمتلازمة الترنح وتوسع الشعيرات قد يحتاجون إلى تطعيمات اضافية (وخاصة لقاحات الالتهاب الرئوي والإنفلونزا)، مضادات حيوية لتوفير الحماية (الوقاية) من العدوى، و\أو دفعات من الغلوبيولينات (الجاما غلوبيولين). وينبغي أن تحدد الحاجة لهذه العلاجات من قبل خبير في مجال نقص المناعة أو الأمراض المعدية.
السرطان[عدل]
لدى الأشخاص المصابين بمتلازمة الترنح وتوسع الشعيرات زيادة عالية في احتمالية حدوث (حوالي 25% خطر مدى الحياة) السرطانات، وخاصة أورام الغدد اللمفاوية وسرطان الدم، ولكن يمكن أن تحدث أنواع أخرى من السرطان. عندما يكون ممكنا، ينبغي تجنب استخدام العلاج الإشعاعي والعلاج الكيميائي التي تعمل بطريقة مشابهة للعلاج الإشعاعي (الأدوية المحاكية للإشعاع)، لأنها تعد سامة وخاصة للأشخاص الذين يعانون من متلازمة الترنح. المشاكل الخاصة التابعة لادارة السرطان معقدة بما فية الكفاية لأن يتم العلاج فقط في مراكز الأورام الأكاديمية وبعد التشاور مع الأطباء الذين لديهم خبرة محددة في متلازمة الترنح وتوسع الشعيرات.[10] للأسف لا يوجد طريقة للتنبؤ لمعرفة أي من الأشخاص قد يصاب بالسرطان. ولأن سرطانات الدم والأورام اللمفاوية تختلف عن الأورام الصلبة حيث انها لا تتطور من سرطانات غير منتشرة إلى سرطانات منتشرة، ولذلك تقل الحاجة إلى تشخيصهم في وقت مبكر. وبالتالي تعد مراقبة سرطان الدم وسرطان الغدد اللمفاوية غير مفيدة، الا عند النظر إلى السرطان كتشخيص في حالة ظهور الأعراض المحتملة للسرطان (مثل تورم الغدد اللمفاوية الثابتة، الحمى غير المفسرة).[11][12] تعاني النساء الحاملات لمتلازمة الترنح وتوسع الشعيرات (التي تملك نسخة واحدة مشوهة من جين ال ATM) من زيادة بمقدار الضعف في احتمالية اصابتهن بسرطان الثدي مقارنة مع عموم السكان. وهذا يشمل جميع أمهات الأطفال المصابين بمتلازمة الترنح وتوسع الشعيرات وبعض الإناث من الأقارب. الإجماع الحالي هو أن الفحوصات الخاصة غير مفيدة، ولكن يجب على جميع النساء أن يقمن بمراقبة روتينية للسرطان.
الجلد[عدل]
يمكن أن تسبب متلازمة الترنح وتوسع الشعيرات ملامح شيخوخة مبكرة مثل شيب الشعر. كما ويمكن أن يسبب البهاق (مرض مناعة ذاتية يتسبب في فقدان صبغة الجلد مما يؤدي إلى مظهر مبقع (شائبة جلدية ذات لون أبيض (لطخات بيضاء)، والتآليل التي يمكن أن تكون واسعة ومتمردة على العلاج. وقد يتطور لدى عدد قليل من الأفراد إلى مرض التهاب الجلد المزمن (ورم حبيبي).[13]
مرض الرئة[عدل]
يتطور مرض الرئة المزمن في أكثر من 25% من المصابين بمتلازمة الترنح وتوسع الشعيرات.[14] ثلاثة أنواع رئيسية من أمراض الرئة يمكن أن تتطور: (1) الالتهابات الرئوية الجيبية المزمنة والمتكررة. (2)أمراض الرئة الناجمة عن السعال الغير فعال، الاختلال الوظيفي في عملية البلع، خلل في تنقية المجرى الهوائي. (3)أمراض الرئة الخلالية المقيدة. ومن الشائع بالنسبة للأفراد المصابين بمتلازمة الترنح وتوسع الشعيرات الإصابة بواحد أو أكثر من الحالات الرئوية السابقة. يمكن أن يحدث مرض الرئة المزمن بسبب التهابات الرئة المتكررة الناتجة عن نقص المناعة. الأفراد المصابون بهذه المشكلة معرضون لخطر تطوير مرض توسع القصبات، وهي حالة مرضية تكون فيها الأنابيب الشعيبية قد اتلفت بشكل دائم، مسببا التهابات متكررة في الشعب الهوائية السفلية. الجلوبيولين غاما للأشخاص الذين يعانون نقص الأجسام المضادة و/ أو العلاج بالمضادات الحيوية المزمنة قد يقلل من مشاكل العدوى. قد يجد أفراد آخرون مصابون بمتلازمة الترنح صعوبة في اتخاذ نفس عميق ويمكن أن يكون السعال غير فعال، مما يجعل من الصعب التخلص من افرازات الفم والشعب الهوائية. هذا يمكن أن يؤدي إلى أعراض تنفسية مطولة تالية لأمراض الجهاز التنفسي الفيروسية المشتركة. التقنيات التي تسمح بإزالة المخاط قد تكون مفيدة في بعض الأفراد أثناء أمراض الجهاز التنفسي. بعض الناس تتطور لديهم مشاكل في البلع مع تقدمهم في السن، مما يزيد من مخاطر الالتهاب الرئوي التنفسي. الاصابات المتكررة للرئتين الناجمة عن الالتهابات المزمنة أو الشفط قد تسبب تليف في الرئة أو تندب. يمكن تعزيز هذه العملية من خلال الإصلاح غير الكافي للأنسجة في خلايا ال ATM الضعيفة (التي تعاني من نقص). ويتطور لدى عدد قليل من الأفراد مرض الرئة الخلالي. يعاني هؤلاء الأفردا من انخفاض الاحتياط الرئوي، صعوبة في التنفس، الحاجة للأكسجين والسعال المزمن في غياب التهابات الرئة. ويمكن أن تستجيب للعلاج بالستيرويد المجموعية أو أدوية أخرى لتخفيف الالتهاب. ينبغي إجراء اختبارات وظائف الرئة (قياس التنفس) سنويا على الأقل في الأطفال البالغين من العمر ما يكفي لأدائها، يجب اعطاء لقاحات الإنفلونزا والللقاحات المتعلقة بالمكورات الرئوية للأفراد المؤهلين، ويجب معالجة الاتهابات الرئوية الجيبية بشدة للحد من تطور أمراض الرئة المزمنة.
الاطعام، البلع والتغذية[عدل]
قد يعاني الأشخاص المصابون بمتلازمة الترنح من صعوبة في الاكل(التغذية) والبلع مع تقدم السن. ويقصد بالتغذية هنا جميع جوانب الأكل والشرب بما في ذلك وصول الغذاء والسوائل إلى الفم; يشير البلع إلى ادخال الطعام إلى المعدة أو ما يحدث بعد ادخال الطعام والسوائل إلى الفم. الأهداف الأساسية للتغذية والبلع هي تناول وجبات الطعام آمنة، كافية، وممتعة.[15] قد تجعل الحركات اللا ارادية التغذية صعبة أو فوضوية ويمكن أن تطيل بشكل مفرط الوقت المستغرق في تناول وجبة الطعام. قد يكون من الأسهل الاطعام باستخدام الأصابع بدلا من أدوات الطعام (على سبيل المثال، ملعقة أو شوكة). للسوائل، غالبا ما يكون من الأسهل الشرب من علبة(اناء) مغلقة باستخدام القشة بدلا من الكأس المفتوحة. قد يحتاج مقدمي الرعاية لتوفير الطعام والسوائل للمصابين بحيث تصبح التغذية الذاتية ممكنة، أو قد يحتاج مقدمو الرعاية لإطعام المصابين بمتلازمة الترنح بـأنفسهم. بشكل عام، يجب أن تكتمل الوجبات في غضون ما يقارب ال 30 دقيقة. قد تكون الوجبات التي تستغرق وقتا أطول مجهدة، تتداخل مع الأنشطة اليومية الأخرى، وتحد من تناول السوائل والعناصر الغذائية الضرورية. في حالة حدوث مشاكل في البلع (عسر البلع)، فانها عادة تحدث في العقد الثاني من العمر. عسر البلع شائع بسبب التغيرات العصبية التي تتداخل مع تنسيق حركة الفم والبلعوم (الحلق) الضرورية لعملية بلع آمنة وفعالة. مشاكل التنسيق التي تنطوي على الفم قد تجعل المضغ صعبا وقد تزيد من مدة وجبات الطعام. قد تسبب المشاكل المتعلقة بالبلعوم استنشاق السوائل، الغذاء واللعاب إلى داخل المجرى الهوائي (الشفط). الأشخاص المصابون بعسر البلع قد لا يسعلون عند الشفط (الشفط الصامت). مشاكل البلع وخصوصا البلع الذي يصاحبه الشفط الصامت قد تسبب مشاكل في الرئة بسبب عدم القدرة على السعال وازالة الغذاء والسوائل من مجرى الهواء.
- دلائل تحذيرية على وجود مشكلة في البلع
- الاختناق أو السعال عند تناول الطعام أو الشرب.
- زيادة قليلة (فقيرة) في الوزن (خلال الأعمار من النمو المتوقع) أو فقدان الوزن في أي سن.
- الإفراط في الترويل (سيلان اللعاب)
- مدة تناول وجبات الطعام تكون أطول من 40-45 دقيقة، على اساس منتظم.
- رفض الأطعمة والمشروبات التي كانوا يتمتعون بها سابقا أو قد يواجهون صعوبة معها.
- مشاكل في المضغ.
- زيادة في وتيرة أو مدة التنفس أو مشاكل تنفسية.
- زيادة في عدوى الرئة.
العين والرؤية[عدل]
- يتطور لدى معظم الناس توسع في الشعيرات (الأوعية الدموية البارزة) على الغطاء الذي يغطي الجزء الأبيض (الصلبة) من العين.
- الرؤية (القدرة على رؤية الأشياء في البؤرة) تكون طبيعية.[16]
- في كثير من الأحيان يحدث ضعف في السيطرة على حركة العين، مما يؤثر على الوظائف البصرية التي تتطلب حركات عينية سريعة ودقيقة من نقطة إلى نقطة (على سبيل المثال القراءة).
- اختلالات العين (الحول) شائعة، ولكنها قد تكون قابلة للعلاج.
- قد تكون هناك صعوبة في تنسيق موقع العين وتشكيل العدسة لرؤية الأشياء عن قرب.
جراحة العظام[عدل]
يتطور لدى العديد من الأفراد المصابين بمتلازمة الترنح وتوسع الشعيرات تشوهات في القدم التي تسبب صعوبة في المشي بسبب عدم التنسيق. العلاج المبكر قد يبطئ عملية التشوه. التقويم أو التصحيح الجراحي أحياناً يحسن استقرار الكاحل إلى حدٍّ كافٍ ليسمح للفرد بالمشي بمساعدة، أو تحمّل الأوزان أثناء الوقوف بالمعاونة أو الانتقال من كرسي لآخر. الجنف الشديد (سكوليوسيس) نادر نسبياً، لكنه يحدث غالبا بصورة أكبر في هؤلاء الغير مصابين بمتلازمة الترنح. لَحْمُ الفقرات (سباينل فيوجن) نادراً ما يحدد كطريقة للعلاج.
الفسيولوجيا المرضية[عدل]
كيف يؤدي فقدان بروتين ATM إلى اضطرابات متعددة؟

يتم وصف متلازمة الترنح وتوسع الشعيرات بمتلازمة عدم استقرار الجينوم، اضطراب في إصلاح الحمض النووي، ومتلازمة الاستجابة لضرر الحمض النووي. ATM (و هو الجين المسؤول عن اضطراب عدة أنظمة في الجسم) يقوم بتشفير بروتين بنفس الاسم ATM يقوم بتنسيق ردة فعل الخلايا لتكسّر شريطيّ الحمض النووي.[18] العلاج الإشعاعي، العلاج الكيميائي المشابه للأشعة (أدوية محاكية للإشعاع)، وبعض العمليات الكيميائية الحيوية والأيض قد تسبب تكسّر شريطي الحمض النووي. عندما يحدث تكسّر شريطي الحمض النووي، يقوم ATM بإيقاف الخلية عن صنع المزيد من الحمض النووي (إيقاف دورة الخلية) ثم يقوم بتوظيف وتنشيط بروتينات أخرى لإصلاح الضرر. بالتالي، ATM يسمح للخلية بإصلاح حمضها النووي قبل إتمام انقسام الخلية. أما إذا كان الضرر في الحمض النووي شديدا جداً، فإن ATM يقوم بالتوسط في عملية موت الخلية المبرمَج ليقضي على الخلية ويزيلها فيمنع عدم الاستقرار الجيني .[19]
السرطان وحساسية الأشعة[عدل]
بغياب بروتينATM، فإن تنظيم دورة حياة الخلية وموت الخلية المبرمج بسبب تكسّر شريطي الحمض النووي يصبح غير فعّال. وتكون النتيجة عدم استقرار جيني والذي قد يؤدي إلى نشوء السرطانات (الأورام الخبيثة).[26]
يقوم التعرض للإشعاع والمركبات المحاكية للإشعاع إلى حث شريطي الحمض النووي الغير قابلة للإصلاح بطريقة مناسبة بسبب غياب بروتين ATM على التكسر. بناءً على ذلك، هذه العوامل تعتبر سامة بشكل خاص للخلايا والأفراد المصابين بمتلازمة الترنح وتوسع الشعيرات.
تطور البلوغ المتأخر (خلل في تكوين الغدد التناسلية)[عدل]
غالباً ما يوصف العُقُم كَمِيزة لمرضى متلازمة الترنح وتوسع الشعيرات.[27] هذا ما دائماً يحدث في نماذج الفئران المصابة بمتلازمة الترنح وتوسع الشعيرات، أما في الإنسان فمن الدقة أكثر أن يُعْزى شذوذ الإنجاب إلى ضمور أو خلل في تكوّن الغدد التناسلية الذي يميزه تأخرفي تطور البلوغ. خلل وتوقف الانقسام المنصّف قد يحدث عند غيابATM، وذلك لأن تكسّرات شريطي الحمض النووي المُبَرْمَجة تحدث إعادة تركيب جيني الامر الذي يدخل في إنتاج الحيوانات المنوية والبويضات في الأعضاء التناسلية (بعملية تعرف بالانقسام المنصف).[27][28][29]
عيوب جهاز المناعة وأمراض السرطان المرتبطة بالمناعة[عدل]

أثناء تطور الخلايا الليمفاوية من الخلايا الجذعية في نخاع العظم إلى خلايا ليمفاوية ناضجة في المحيط، فإنها تقوم بإعادة ترتيب قطع معينة من حمضها النووي (عملية إعادة التركيب). هذه العملية تتطلب من هذه الخلايا تكسير أشرطة حمضها النووي، لكن سيصعب اصلاح هذه الأشرطة بغياب ATM.[34][35][36][37] كنتيجة لهذا، فإن معظم الأفراد المصابين بمتلازمة الترنح وتوسع الشعيرات لديهم نقص في أعداد الخلايا الليمفاوية ووظائفها (مثل خلل في القدرة على إنتاج أجسام مضادة كردة فعل للمطاعيم الوقائية والعدوى). بالإضافة لهذا، فإن قطع الحمض النووي في الكروموسومات المشاركة في عملية إعادة تركيب الحمض النووي لديها المَيْل لتتحد مع جينات أخرى (الانتقال)، مما يعرّض الخلايا إلى تطوير السرطان (لوكيميا، ليمفوما).
الشيخوخة المبكرة[عدل]
الخلايا المأخوذة من الأفراد المصابين بمتلازمة الترنح وتوسع الشعيرات تظهر عدم استقرار جيني، بطء في النمو، شيخوخة مبكرة في عينة زراعة الخلايا، قِصَر التيلوميرات، واستجابة منخفضة ومستمرة للضغط النفسي.[5][38] هذه العوامل قد تساهم في ظهور أعراض الشيخوخة المبكرة على البشرة والشعر التي تلاحَظ في الأفراد المصابين بمتلازمة الترنح وتوسع الشعيرات. فعلى سبيل المثال، وجود ضرر في الحمض النووي وعدم استقرار في الجينات يؤدي إلى تمايز الخلايا الصباغية الجذعية مما يؤدي إلى الشيب. ATM قد يعتبر «محطة تفتيش جذعية» لأنه يحمي من تمايز الخلايا الصباغية الجذعية وبالتالي الشيب المبكر للشعر.[39]
توسع الشعيرات[عدل]
سبب توسع الشعيرات أو وجود الأوعية الدموية المتوسعة في غياب البروتين ATM لم يعرف بعد.
زيادة مستويات الفا فيتو بروتين AFP[عدل]
يعاني تقريبا 95% من الأشخاص المصابين بمتلازمة الترنح وتوسع الشعيرات من زيادة في مستويات ال AFP في الدم بعد عمر السنتين، وتزداد مستويات ال AFP المقاسة ببطء مع مرور الوقت.[40] تكون مستويات ال AFP مرتفعة جدا في الأطفال حديثي الولادة، وتنحدر عادة إلى مستويات البالغين خلال السنة الأولى وحتى 18 شهرا. السبب في ارتفاع مستويات ال AFP لم يعرف بعد.
التنكس العصبي[عدل]
متلازمة الترنح وتوسع الشعيرات هي واحدة من العديد من اضطرابات اصلاح الحمض النووي والتي تؤدي إلى تشوهات عصبية وتنكس. يمكن القول أن بعض الأعراض الأكثر تدميرا المرافقة لمتلازمة الترنح وتوسع الشعيرات هي نتيجة لانحطاط المخيخ التدريجي، والتي تتميز بفقدان الخلايا العصبية (خلايا بيركنجي)، وإلى حد أقل، الخلايا الحبيبية (التي تقع حصريا في المخيخ).[6] سبب خسارة هذه الخلية غير معروف، على الرغم من أن العديد من الفرضيات قد تم اقتراحها بناء على تجارب اجريت على حد سواء في زراعة الخلايا ونماذج الفئران المصابة بمتلازمة الترنح وتوسع الشعيرات. وتشمل الفرضيات الحالية التي تشرح التنكس العصبي المرتبط بمتلازمة الترنح وتوسع الشعيرات ما يلي:
- الاستجابة لضرر الحمض الأميني المعيب [20][41] والتي يمكن أن تؤدي إلى
- الأكسدة[47][48][49][50]
- خلل في وظائف الميتوكندريا .[51][52][53]
- خلل في الوظائف العصبية .
- تغير دوران البروتين [60]
قد لا تستبعد هذه النظريات بعضها بعضا وقد تكمن أكثر من واحدة من هذه الآليات وراء موت الخلايا العصبية عندما يكون هناك غياب أو نقص في بروتين ال ATM. وعلاوة على ذلك، الضرر الدماغي وفقدان الخلايا العصبية والحبيبية لا تفسر كل التشوهات العصبية الموجودة لدى المصابين بمتلازمة الترنح وتوسع الشعيرات. ويجري التحقيق في الآثار المترتبة على نقص ATM على مناطق أخرى من الدماغ خارج المخيخ بنشاط.
التعرض للإشعاع[عدل]
لدى الأشخاص المصابين بمتلازمة الترنح وتوسع الشعيرات زيادة في الحساسية للإشعاع (الأشعة السينة وأشعة جاما) المؤينة. لذلك ينبغي أن يقتصر التعرض لاشعة X على الأوقات التي يكون فيها ضروريا من الناحية الطبية، فتعريض المريض المصاب بمتلازمة الترنح وتوسع الشعيرت للإشعاع المؤين يمكن أن يتلف الخلايا بطريقة لا يقدر الجسم على اصلاحها. تستطيع الخلايا عادة التعامل مع أنواع أخرى من الإشعاع، مثل الأشعة فوق البنفسجية، لذلك ليس هناك حاجة لأخذ احتياطات خاصة من التعرض لأشعة الشمس.
علم الوراثة ومعلومات عن ناقلي متلازمة الترنح وتوسع الشعيرات[عدل]
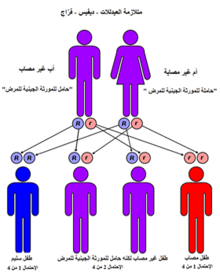
يسبب متلازمة الترنح وتوسع الشعيرات طفرات في جين ATM الذي تم استنساخه في 1995.[4] يقع ATMعلى الكروموسوم البشري رقم 11، ومكون من 96 اكسون موزعة بين 150 الف زوج قاعدي من الحمض النووي الجيني.[61]
طريقة وراثة متلازمة الترنح وتوسع العيرات هي جين متنحي في الكروموسومات الجسمية. كل من الوالد والوالدة يعتبر حامل، أي أن لديه نسخة من جين متلازمة الترنح وتوسع الشعيرات ((ATMو نسخة متحولة (طفرة). تظهر متلازمة الترنح وتوسع الشعيرات إذا ورث الطفل النسخة المتحولة من الجين من كلا والديه، فمثلا في عائلة كلا الوالدين حاملين للجين المتحول فإن نسبة اصابة أحد أبنائهم هي 1 من 4. التشخيص قبل الولادة (و تشخيص الحاملين للجين المتحول) يمكن إجرائها في العائلات إذا كانت التحولات (الطفرات) في جينين ATM قد تم تحديدها والتعرف عليها في الطفل المصاب. هذه العملية قد تكون معقدة وتحتاج إلى الوقت، لذلك يجب التجهيز لها قبل الحمل.
البحث عن طفرات في جين ATMفي شخص لا علاقة له (مثل الزوج/ة لفرد يُعرف بأنه حامل للجين) تظهر العديد من التحديات. في العادة لدى الجينات ترجمات متنوعة (تعدد أشكال) لا تؤثر في وظيفتها. الجينات الكبيرة مثل ATM تحدث ترجمات متنوعة فلا يستطيع الأطباء أت يتنبأوا إذا كان بديل محدد سيسبب المرض أو لا. الاستشارة الوراثية قد تساعد عائلة الفرد المصاب ب ا-ت لفهم ما يمكن وما لا يمكن فحصه، وكيف يتم تفسير نتائج الفحوصات.
حاملين متلازمة الترنح وتوسع الشعيرات، مثل أبوا الفرد المصاب ب متلازمة الترنح وتوسع الشعيرات، لديهم نسخة واحدة متحولة من الجين ATM ونسخة من الجين الطبيعي. بشكل عام يكونون أصحّاء، إلا أنه يوجد زيادة في احتمالية الإصابة بسرطان الثدي عند النساء. تم تأكيد هذه النتيجة بعدة طرق، وهي موضوع بحث حالي. ينصح بالمراقبة القياسية (تتضمن الفحص الذاتي للثدي شهرياً والتصوير الشعاعي للثدي في الأوقات المناسبة للعمر)، إلا إذا تم النصح باختبارات أخرى لأن الأنثى لديها عوامل أخرى تزيد خطر الإصابة (مثل تاريخ عائلي للإصابة بسرطان الثدي).
التشخيص[عدل]
عادة ما يشتبه بتشخيص متلازمة الترنح وتوسع الشعيرات عند اجتماع مجموعة من الميزات العصبية السريرية (ترنح، وسيطرة غير طبيعية على حركة العين، وعدم الاستقرار الوضعي) مع توسع في الشعيرات وزيادة في بعض الأحيان بالعدوى، ومؤكدا ذلك مجموعة من الشواذ المخبرية (مستويات ألفا فيتوبروتين مرتفعة، وزيادة في تكسر الكروموسومات أو موت خلايا الدم البيضاء بعد التعرض لأشعة X، وغياب البروتين ATM في خلايا الدم البيضاء، أو طفرات في كل من جينات ATM عند الشخص) . تحدث مجموعة متنوعة من الشذوذ المخبرية في معظم الناس المصابين بمتلازمة الترنح وتوسع الشعيرات الدموية مما يسمح بالقيام بتشخيص مبدئي في ظل وجود مظاهر سريرية نموذجية. لا تظهر جميع الشواذ في جميع المرضى. وتشمل هذه الشواذ:
- ارتفاع مستويات الالفا فيتو بروتين وازديادها ببطء في مصل الدم بعد سنتين من العمر.
- نقص مناعة يصاحبه انخفاض في الغلوبيولينات (خاصةً IgA وIgE والأنواع الفرعية من IgG) وانخفاض عدد الخلايا اللمفية في الدم.
- عدم استقرار الكروموسومات (قطع مكسرة من الكروموسومات).
- زيادة حساسية الخلايا للتعرض للأشعة السينية (الخلايا تموت أو تطور المزيد من التكسرات وغيرها من الأضرار على الكروموسومات).[62]
- ضمور المخيخ الظاهرعلى صورة أشعة الرنين المغناطيسي.
يمكن تأكيد التشخيص في المختبر من خلال إيجاد غياب أو نقص في البروتين ATM في خلايا الدم المزروعة،[63][64] غياب أو نقص في وظيفة ATM (فحص كيناز)، أو طفرات في نسختي جين ATM الخلية. ليس هناك حاجة دائما للتجارب المتخصصة، بل هي مفيدة بشكل خاص إذا كانت أعراض الطفل شاذة.
التشخيص التفريقي (التمييزي)[عدل]
هناك العديد من الاضطرابات الأخرى التي يصاحبها أعراض وملامح مخبرية مشابهة قد يأخذها الأطباء في عين الاعتبار عند تشخيص متلازمة الترنح وتوسع الشعيرات.[65] والاضطرابات الثلاثة الأكثر شيوعا التي يتم الخلط بينها وبين متلازمة الترنح وتوسع الشعيرات هي:
- الشلل الدماغي
- ترنح فريدريك
- تعذر الأداء الحركي العيني كوجان
ويمكن التمييز بين هذه الاضطرابات ومتلازمة الترنح عن طريق فحص عصبي والتاريخ الطبي.
يصف الشلل الدماغي اضطراب غير تقدمي في الوظائف الحركية الناتجة عن تشوه أو تلف مبكر في الدماغ. يمكن أن يظهر الشلل الدماغي بطرق عديدة نظرا إلى الطرق المختلفة التي يمكن أن يتلف الدماغ فيها; تشترك جميع الاشكال بظهور علامات وأعراض ضعف (تلف) مع تطور الطفل. ومع ذلك، المعالم البارزة التي حصلت والوظائف العصبية التي تطورت لا تتدهور في الأطفال المصابين بالشلل الدماغي كما في الأطفال المصابين بمتلازمة الترنح وتوسع الشعيرات في وقت متأخر من سنوات ما قبل المدرسة. معظم الأطفال المصابون بالترنح الناتج عن الشلل الدماغي لا يبدئون المشي في سن طبيعي، في حين ان معظم الأطفال المصابون بمتلازمة الترنح وتوسع الشعيرات يبدئون المشي في سن طبيعي على الرغم من أنهم في كثير من الاحيان يتمايلون في البداية.
الترنح البحت هو مظهر نادر لتلف الدماغ المبكر أو التشوه، ومع ذلك ينبغي النظر في احتمال وجود اضطراب وراثي غامض في الدماغ عندما يكون الترنح هو المظهر الاساسي للشلل الدماغي. لن تظهر الشواذ المخبرية في الأطفال المصابين بالترنح المصاحب للشلل الدماغي.
تعذر الأداء الحركي العيني كوجان هو اضطراب نادر للتطور (للتنمية). يعاني الأطفال المصابون من صعوبة في تحريك أعينهم إلى هدف بصري جديد فقط، بحيث انهم يلفون رؤوسهم متجاوزين الهدف لسحب أعينهم لرؤية الهدف المراد، ثم يلفون رؤوسهم إلى الخلف. يصبح الميل لهذه الحركة واضحا في أواخرمرحلة الطفولة وسنوات المشي ويتحسن غالبا مع مرور الوقت الطفولة. وهذا يتناقض مع الصعوبات العينية الحركية الواضحة في الأطفال المصابين بمتلازمة الترنح وتوسع الشعيرات والتي لا تتضح في مرحلة الطفولة المبكرة ولكنها تظهر مع مرور الوقت. تعذر الأداء الحركي العيني كوجان هو عموما مشكلة معزولة، أو قد تترافق مع تأخر في النمو على نطاق أوسع.
ترنح فريدريك هو السبب الجيني الأكثر شيوعا للترنح عند الأطفال. ومثل متلازمة الترنح وتوسع الشعيرات يعد ترنح فريدريك مرضا متنحيا، ويظهر في الأسر التي ليس لها تاريخ مع هذا المرض. يحدث ترنح فريدريك نتيجة لطفرة في جين فراتاكسين، في معظم الأحيان توسع في عملية تكرار طبيعية للقواعد النيتروجينية GAA من عدد التكرار الطبيعي وهو 33-5 تكرارا لهذا التسلسل الثلاثي من النيوكليوتيدات إلى أكثر من 65 تكرار على كل كروموسوم. غالبا ما يظهر الترنح بين 10-15 سنة من العمر، ويختلف عن متلازمة الترنح وتوسع الشعيرات بسبب عدم وجود توسع في الشعيرات وعدم وجود تعذر في الأداء الحركي العيني، مستويات طبيعية من الألفا فيتو بروتين ، والوجود المتكرر للجنف، ردود فعل الوتر غائبة ، ومظاهر شاذة على مخطط القلب الكهربائي. يعاني الافراد المصابون بترنح فريدريك من صعوبة في الوقوف في مكان واحد والتي قد تتحسن كثيرا عند اغلاق العينين (علامة رومبرغ) والتي لا تتضح عند المصابين بمتلازمة الترنح وتوسع الشعيرات على الرغم من أن المصابين بمتلازمة الترنح وتوسع الشعيرات قد يجدون صعوبة أكبر في الوقوف في مكان واحد مع ايقاء أعينهم مفتوحة.
هناك اضطرابات أخرى نادرة يمكن الخلط بينها وبين متلازمة الترنح وتوسع الشعيرات ، اما بسبب المظاهر السريرية المتشابهة، أو تشابه بعض الملامح المخبرية أو كلاهما. وتشمل هذه:
- تعذر الاداء المحرك للعين الرنحي النوع الأول AOA1
- تعذر الأداء المحرك للعين الرنحي النوع الثاني AOA2 والمعروف أيضا باسم سكار 1
- شبيه متلازمة الترنح وتوسع الشعيرات
- متلازمة كسر نيميغن.

تعذر الاداء المحرك للعين الرنحي النوع الأول AOA1 هو اضطراب وراثي متعلق بالصيغة الجسدية ويشبه متلازمة الترنح وتوسع الشعيرات في اظهار زيادة في مشاكل التنسيق وتعذر الاداء الحركي للعين، وفي كثير من الأحيان في سن مماثلة لاولئك المصابين بمتلازمة الترنح وتوسع الشعيرات. ان هذا المرض ناتج عن طفرة في جين الترميز للبروتين أبراتاكسين. يختلف الأفراد المتضررون عن المصابين بمتلازمة الترنح وتوسع الشعيرات بالظهور المبكر للاعتلال العصبي المحيطي، في وقت مبكر من مسار الاعتلال تظهر صعوبة في بدء التحولات العصبية، وعدم وجود توسع في الشعيرات في العين، ولكن تعد الملامح المخبرية ذات أهمية رئييسية في التفريق بين الاثنين. لدى الأفراد المصابين ب AOA1 مستويات الفا فيتو بروتين طبيعية، تدابير طبييعية للوظائف المناعية، ويصبح لديهم بعد 10-15 سنة مستويات منخفضة من الألبيومين في مصل الدم. يمكن تأكيد التشخيص عن طريق الفحوصات الجينية لجين الأبراتاكسين. لا يوجد أي خطر معزز لحدوث السرطان.
الاضطراب شبيه متلازمة الترنح وتوسع الشعيرات هو حالة نادرة للغاية، وناتج عن طفرة في جين hMre1، وقد تأخذ بعين الاعتبار عند التشخيص التفريقي لمتلازمة الترنح وتوسع الشعيرات. يشبه المرضى المصابون بهذا المرض المصابون بمتلازمة الترنح وتوسع الشعيرات في اظهار رنح مخيخي تدريجي، وفرط الحساسية للإشعاع المؤين وعدم الاستقرار الجيني. يختلف الأفراد النادرون المصابون بالاضطراب الشبية بمتلازمة الترنح وتوسع الشعيرات والذين تم وصفهم كما يجب عن المصابين بمتلازمة الترنح وتوسع الشعيرات بسبب عدم وجود توسع في الشعيرات، مستويات الغلوبيولينات المناعية طبيعية، ظهور متأخر، وتطور أبطأ للأعراض. بسبب ندرته، ليس من المعروف حتى الآن ما إذا كان الاضطراب الشبيه بمتلازمة الترنح وتوسع الشعيرات يحمل مخاطر متزايدة للإصابة بسرطان أم لا. ولأن تلك الطفرات التي تصيب Mre11 وتؤثر بشدة على البروتين Mre11 تتعارض من الحياة، فان لدى الأفراد المصابين بالاضطراب الشبية بمتلازمة الترنح وتوسع الشعيرات بعض من وظائف (وظائف جزئية) البروتين Mre11. وبالتالي من المرجح أن لدى كل منهم مستوى خاص من شدة المرض.
متلازمة كسر نيميغن هو اضطراب وراثي نادر ويشترك مع متلازمة الترنح وتوسع الشعيرات في عدم استقرار الكروموسومات ، ولكن المشاكل التي يعاني منها المصابون بهذا المرض مختلفة تماما. يعاني الأطفال المصابون بمتلازمة كسر نيميغن من صغر جليل في الرأس، ومظهر وجه مميز، قصر في القامة، وضعف الإدراك المعتدل، ولكن لا يواجه أي تدهور عصبي مع مرور الوقت. كما في الأطفال المصابين بمتلازمة الترنح وتوسع الشعيرات، يعاني الأطفال المصابون بمتلازمة كسر نيغين من حساسية للإشعاع، قابلية لحدوث سرطان الغدد اللمفاوية وسرطان الدم، وبعض التدابير المخبرية للضعف في الوظيفة المناعية، ولكن ليس لديهم توسع في الشعيرات وليس لديهم مستويات مرتفعة من الألفا فيتو بروتين.[66]
إدارة المرض[عدل]
العيادات والدعم[عدل]
لدى كل من الولايات المتحدة، المملكة المتحدة، أستراليا، إسرائيل، هولندا، ألمانيا، بولندا، النرويج واليابان عيادات متخصصة للمرضى الذين يعانون من متلازمة الترنح وتوسع الشعيرات. هذه العيادات تأوي فرق طبية متعددة التخصصات، بما في ذلك أطباء الأعصاب، المناعة، أخصائيو أمراض الجهاز التنفسي والمعالجين، وقادرة على التعامل مع العديد من جوانب هذا المرض.
علم الأوبئة[عدل]
يتأثر الأفراد من جميع الأجناس والأعراق على قدم المساواة. ويقدر معدل الإصابة في جميع أنحاء العالم ما بين 1 في 40000 و1 في 100,000 شخص.[5][67]
توقعات سير المرض[عدل]
متوسط العمر المتوقع للأشخاص الذين يعانون من متلازمة الترنح وتوسع الشعيرات متغير بدرجة كبيرة. يكون المتوسط تقريبا 25 عاما، ولكنه يتحسن باستمرار مع التقدم في الرعاية. السببان الأكثر شيوعا للوفاة هي أمراض الرئة المزمنة (حوالي ثلث الحالات) والسرطان (حوالي ثلث الحالات).
اتجاهات البحث[عدل]
وجدت المرحلة الثانية من التجارب السريرة التي تدرس استخدام خلايا الدم الحمراء (كريات الدم الحمراء) المحملة بديكساميثازون صوديوم فوسفات بأن الأعراض قد تحسنت مع هذا العلاج وأنه جيد التحمل.[68] يستخدم هذا العلاج نظاما فريدا لتسليم الدواء باستخدام خلايا الدم الحمراء في المريض باعتبارها وسيلة لتسليم الأدوية.[69] ونظرا للتحديات المناعية الأخرى الموجودة في الأفراد المصابين بمتلازمة الترنح وتوسع الشعيرات، لا تزال هناك حاجة لتقييم الإمكانات العلاجية من المنشطات (الستيرويدات) إلى مدى أبعد من ذلك، لا سيما فيما يتعلق بمدة أي فائدة والسلامة على المدى الطويل.
المراجع[عدل]
- ^ Cynthia Rothblum-Oviatt (25 Nov 2016). "Ataxia telangiectasia: a review". Orphanet Journal of Rare Diseases (بالإنجليزية). 11 (1): 159. DOI:10.1186/S13023-016-0543-7. ISSN:1750-1172. PMC:5123280. PMID:27884168. QID:Q28079581.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Louis-Bar D (1941). "Sur un syndrome progressif cormprenant des télangiectasies capillaires cutanées et conjonctivales symétriques, à disposition naevoïde et des troubles cérébelleux". Confinia Neurologica. ج. 4: 32–42.
- ^ Boder، E. (1985). "Ataxia-telangiectasia: an overview". Kroc Foundation series. ج. 19: 1–63. PMID:2415689.
- ^ أ ب Savitsky، K.؛ Bar-Shira، A.؛ Gilad، S.؛ Rotman، G.؛ Ziv، Y.؛ Vanagaite، L.؛ Tagle، D. A.؛ Smith، S.؛ Uziel، T.؛ Sfez، S.؛ Ashkenazi، M.؛ Pecker، I.؛ Frydman، M.؛ Harnik، R.؛ Patanjali، S. R.؛ Simmons، A.؛ Clines، G. A.؛ Sartiel، A.؛ Gatti، R. A.؛ Chessa، L.؛ Sanal، O.؛ Lavin، M. F.؛ Jaspers، N. G.؛ Taylor، A. M.؛ Arlett، C. F.؛ Miki، T.؛ Weissman، S. M.؛ Lovett، M.؛ Collins، F. S.؛ Shiloh، Y. (23 يونيو 1995). "A single ataxia telangiectasia gene with a product similar to PI-3 kinase". Science. ج. 268 ع. 5218: 1749–53. DOI:10.1126/science.7792600. PMID:7792600.
- ^ أ ب ت Shiloh، Y.؛ Kastan، M. B. (2001). "ATM: genome stability, neuronal development, and cancer cross paths". Advances in cancer research. ج. 83: 209–54. DOI:10.1016/s0065-230x(01)83007-4. PMID:11665719.
- ^ أ ب Crawford، T. O. (ديسمبر 1998). "Ataxia telangiectasia". Seminars in pediatric neurology. ج. 5 ع. 4: 287–94. DOI:10.1016/s1071-9091(98)80007-7. PMID:9874856.
- ^ Crawford، T. O.؛ Mandir، A. S.؛ Lefton-Greif، M. A.؛ Goodman، S. N.؛ Goodman، B. K.؛ Sengul، H.؛ Lederman، H. M. (11 أبريل 2000). "Quantitative neurologic assessment of ataxia-telangiectasia". Neurology. ج. 54 ع. 7: 1505–9. DOI:10.1212/wnl.54.7.1505. PMID:10751267.
- ^ Cabana، M. D.؛ Crawford، T. O.؛ Winkelstein، J. A.؛ Christensen، J. R.؛ Lederman، H. M. (يوليو 1998). "Consequences of the delayed diagnosis of ataxia-telangiectasia". Pediatrics. ج. 102 ع. 1 Pt 1: 98–100. DOI:10.1542/peds.102.1.98. PMID:9651420.
- ^ Nowak-Wegrzyn، A.؛ Crawford، T. O.؛ Winkelstein، J. A.؛ Carson، K. A.؛ Lederman، H. M. (أبريل 2004). "Immunodeficiency and infections in ataxia-telangiectasia". The Journal of Pediatrics. ج. 144 ع. 4: 505–11. DOI:10.1016/j.jpeds.2003.12.046. PMID:15069401.
- ^ Reiman، A.؛ Srinivasan، V.؛ Barone، G.؛ Last، J. I.؛ Wootton، L. L.؛ Davies، E. G.؛ Verhagen، M. M.؛ Willemsen، M. A.؛ Weemaes، C. M.؛ Byrd، P. J.؛ Izatt، L.؛ Easton، D. F.؛ Thompson، D. J.؛ Taylor، A. M. (9 أغسطس 2011). "Lymphoid tumours and breast cancer in ataxia telangiectasia; substantial protective effect of residual ATM kinase activity against childhood tumours". British Journal of Cancer. ج. 105 ع. 4: 586–91. DOI:10.1038/bjc.2011.266. PMC:3170966. PMID:21792198.
- ^ Thompson، D.؛ Duedal، S.؛ Kirner، J.؛ McGuffog، L.؛ Last، J.؛ Reiman، A.؛ Byrd، P.؛ Taylor، M.؛ Easton، D. F. (1 يونيو 2005). "Cancer risks and mortality in heterozygous ATM mutation carriers". Journal of the National Cancer Institute. ج. 97 ع. 11: 813–22. DOI:10.1093/jnci/dji141. PMID:15928302.
- ^ Renwick، A.؛ Thompson، D.؛ Seal، S.؛ Kelly، P.؛ Chagtai، T.؛ Ahmed، M.؛ North، B.؛ Jayatilake، H.؛ Barfoot، R.؛ Spanova، K.؛ McGuffog، L.؛ Evans، D. G.؛ Eccles، D.؛ Breast Cancer Susceptibility Collaboration, (UK)؛ Easton، D. F.؛ Stratton، M. R.؛ Rahman، N. (أغسطس 2006). "ATM mutations that cause ataxia-telangiectasia are breast cancer susceptibility alleles". Nature Genetics. ج. 38 ع. 8: 873–5. DOI:10.1038/ng1837. PMID:16832357.
- ^ Paller، A. S.؛ Massey، R. B.؛ Curtis، M. A.؛ Pelachyk، J. M.؛ Dombrowski، H. C.؛ Leickly، F. E.؛ Swift، M. (ديسمبر 1991). "Cutaneous granulomatous lesions in patients with ataxia-telangiectasia". The Journal of Pediatrics. ج. 119 ع. 6: 917–22. DOI:10.1016/s0022-3476(05)83043-4. PMID:1960607.
- ^ McGrath-Morrow، S. A.؛ Gower، W. A.؛ Rothblum-Oviatt، C.؛ Brody، A. S.؛ Langston، C.؛ Fan، L. L.؛ Lefton-Greif، M. A.؛ Crawford، T. O.؛ Troche، M.؛ Sandlund، J. T.؛ Auwaerter، P. G.؛ Easley، B.؛ Loughlin، G. M.؛ Carroll، J. L.؛ Lederman، H. M. (سبتمبر 2010). "Evaluation and management of pulmonary disease in ataxia-telangiectasia". Pediatric pulmonology. ج. 45 ع. 9: 847–59. DOI:10.1002/ppul.21277. PMID:20583220.
- ^ Lefton-Greif، M. A.؛ Crawford، T. O.؛ Winkelstein، J. A.؛ Loughlin، G. M.؛ Koerner، C. B.؛ Zahurak، M.؛ Lederman، H. M. (فبراير 2000). "Oropharyngeal dysphagia and aspiration in patients with ataxia-telangiectasia". The Journal of Pediatrics. ج. 136 ع. 2: 225–31. DOI:10.1016/s0022-3476(00)70106-5. PMID:10657830.
- ^ Farr، A. K.؛ Shalev، B.؛ Crawford، T. O.؛ Lederman، H. M.؛ Winkelstein، J. A.؛ Repka، M. X. (ديسمبر 2002). "Ocular manifestations of ataxia-telangiectasia". American journal of ophthalmology. ج. 134 ع. 6: 891–6. DOI:10.1016/s0002-9394(02)01796-8. PMID:12470759.
- ^ Savitsky، K.؛ Bar-Shira، A.؛ Gilad، S.؛ Rotman، G.؛ Ziv، Y.؛ Vanagaite، L.؛ Tagle، D. A.؛ Smith، S.؛ Uziel، T.؛ Sfez، S.؛ Ashkenazi، M.؛ Pecker، I.؛ Frydman، M.؛ Harnik، R.؛ Patanjali، S. R.؛ Simmons، A.؛ Clines، G. A.؛ Sartiel، A.؛ Gatti، R. A.؛ Chessa، L.؛ Sanal، O.؛ Lavin، M. F.؛ Jaspers، N. G.؛ Taylor، A. M.؛ Arlett، C. F.؛ Miki، T.؛ Weissman، S. M.؛ Lovett، M.؛ Collins، F. S.؛ Shiloh، Y. (23 يونيو 1995). "A single ataxia telangiectasia gene with a product similar to PI-3 kinase". Science. ج. 268 ع. 5218: 1749–53. DOI:10.1126/science.7792600. PMID:7792600.
- ^ أ ب Derheimer، F. A.؛ Kastan، M. B. (10 سبتمبر 2010). "Multiple roles of ATM in monitoring and maintaining DNA integrity". FEBS Letters. ج. 584 ع. 17: 3675–81. DOI:10.1016/j.febslet.2010.05.031. PMC:2950315. PMID:20580718.
- ^ أ ب Kurz، E. U.؛ Lees-Miller، S. P. (أغسطس–سبتمبر 2004). "DNA damage-induced activation of ATM and ATM-dependent signaling pathways". DNA repair. ج. 3 ع. 8–9: 889–900. DOI:10.1016/j.dnarep.2004.03.029. PMID:15279774.
- ^ أ ب Dar، I.؛ Biton، S.؛ Shiloh، Y.؛ Barzilai، A. (19 يوليو 2006). "Analysis of the ataxia telangiectasia mutated-mediated DNA damage response in murine cerebellar neurons". The Journal of neuroscience : the official journal of the Society for Neuroscience. ج. 26 ع. 29: 7767–74. DOI:10.1523/JNEUROSCI.2055-06.2006. PMID:16855104.
- ^ Gorodetsky، E.؛ Calkins، S.؛ Ahn، J.؛ Brooks، P. J. (نوفمبر 2007). "ATM, the Mre11/Rad50/Nbs1 complex, and topoisomerase I are concentrated in the nucleus of Purkinje neurons in the juvenile human brain". DNA repair. ج. 6 ع. 11: 1698–707. DOI:10.1016/j.dnarep.2007.06.011. PMC:2797317. PMID:17706468.
- ^ Valentin-Vega، Y. A.؛ Maclean، K. H.؛ Tait-Mulder، J.؛ Milasta، S.؛ Steeves، M.؛ Dorsey، F. C.؛ Cleveland، J. L.؛ Green، D. R.؛ Kastan، M. B. (9 فبراير 2012). "Mitochondrial dysfunction in ataxia-telangiectasia". Blood. ج. 119 ع. 6: 1490–500. DOI:10.1182/blood-2011-08-373639. PMC:3286212. PMID:22144182.
- ^ Guo، Z.؛ Kozlov، S.؛ Lavin، M. F.؛ Person، M. D.؛ Paull، T. T. (22 أكتوبر 2010). "ATM activation by oxidative stress". Science. ج. 330 ع. 6003: 517–21. DOI:10.1126/science.1192912. PMID:20966255.
- ^ Bakkenist، C. J.؛ Kastan، M. B. (30 يناير 2003). "DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation". Nature. ج. 421 ع. 6922: 499–506. DOI:10.1038/nature01368. PMID:12556884.
- ^ Kanu، N.؛ Behrens، A. (15 نوفمبر 2008). "ATMINistrating ATM signalling: regulation of ATM by ATMIN". Cell cycle (Georgetown, Tex.). ج. 7 ع. 22: 3483–6. DOI:10.4161/cc.7.22.7044. PMID:19001856.
- ^ Shiloh، Y. (مارس 2003). "ATM and related protein kinases: safeguarding genome integrity". Nature Reviews Cancer. ج. 3 ع. 3: 155–68. DOI:10.1038/nrc1011. PMID:12612651.
- ^ أ ب Barlow، C.؛ Hirotsune، S.؛ Paylor، R.؛ Liyanage، M.؛ Eckhaus، M.؛ Collins، F.؛ Shiloh، Y.؛ Crawley، J. N.؛ Ried، T.؛ Tagle، D.؛ Wynshaw-Boris، A. (12 يوليو 1996). "Atm-deficient mice: a paradigm of ataxia telangiectasia". Cell. ج. 86 ع. 1: 159–71. DOI:10.1016/S0092-8674(00)80086-0. PMID:8689683.
- ^ Plug، A. W.؛ Peters، A. H.؛ Xu، Y.؛ Keegan، K. S.؛ Hoekstra، M. F.؛ Baltimore، D.؛ de Boer، P.؛ Ashley، T. (ديسمبر 1997). "ATM and RPA in meiotic chromosome synapsis and recombination". Nature Genetics. ج. 17 ع. 4: 457–61. DOI:10.1038/ng1297-457. PMID:9398850.
- ^ Barchi، M.؛ Roig، I.؛ Di Giacomo، M.؛ de Rooij، D. G.؛ Keeney، S؛ Jasin، M. (23 مايو 2008). "ATM promotes the obligate XY crossover and both crossover control and chromosome axis integrity on autosomes". PLOS Genetics. ج. 4 ع. 5: e1000076. DOI:10.1371/journal.pgen.1000076. PMC:2374915. PMID:18497861.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link)
- ^ Lumsden، J. M.؛ McCarty، T.؛ Petiniot، L. K.؛ Shen، R.؛ Barlow، C.؛ Wynn، T. A.؛ Morse III، H. C.؛ Gearhart، P. J.؛ Wynshaw-Boris، A.؛ Max، E. E.؛ Hodes، R. J. (1 نوفمبر 2004). "Immunoglobulin class switch recombination is impaired in Atm-deficient mice". The Journal of Experimental Medicine. ج. 200 ع. 9: 1111–21. DOI:10.1084/jem.20041074. PMC:2211853. PMID:15504820.
- ^ Franco، S.؛ Alt، F. W.؛ Manis، J. P. (8 سبتمبر 2006). "Pathways that suppress programmed DNA breaks from progressing to chromosomal breaks and translocations". DNA repair. ج. 5 ع. 9–10: 1030–41. DOI:10.1016/j.dnarep.2006.05.024. PMID:16934538.
- ^ Callén، E.؛ Jankovic، M.؛ Wong، N.؛ Zha، S.؛ Chen، H. T.؛ Difilippantonio، S.؛ Di Virgilio، M.؛ Heidkamp، G.؛ Alt، F. W.؛ Nussenzweig، A.؛ Nussenzweig، M. (15 مايو 2009). "Essential role for DNA-PKcs in DNA double-strand break repair and apoptosis in ATM-deficient lymphocytes". Molecular Cell. ج. 34 ع. 3: 285–97. DOI:10.1016/j.molcel.2009.04.025. PMC:2709792. PMID:19450527.
- ^ Bagley، J.؛ Singh، G.؛ Iacomini، J. (15 أبريل 2007). "Regulation of oxidative stress responses by ataxia-telangiectasia mutated is required for T cell proliferation". Journal of Immunology (Baltimore, Md. : 1950). ج. 178 ع. 8: 4757–63. DOI:10.4049/jimmunol.178.8.4757. PMID:17404255.
- ^ Bredemeyer، A. L.؛ Sharma، G. G.؛ Huang، C. Y.؛ Helmink، B. A.؛ Walker، L. M.؛ Khor، K. C.؛ Nuskey، B.؛ Sullivan، K. E.؛ Pandita، T. K.؛ Bassing، C. H.؛ Sleckman، B. P. (27 يوليو 2006). "ATM stabilizes DNA double-strand-break complexes during V(D)J recombination". Nature. ج. 442 ع. 7101: 466–70. DOI:10.1038/nature04866. PMID:16799570.
- ^ Bredemeyer، A. L.؛ Huang، C. Y.؛ Walker، L. M.؛ Bassing، C. H.؛ Sleckman، B. P. (15 أغسطس 2008). "Aberrant V(D)J recombination in ataxia telangiectasia mutated-deficient lymphocytes is dependent on nonhomologous DNA end joining". Journal of Immunology (Baltimore, Md. : 1950). ج. 181 ع. 4: 2620–5. DOI:10.4049/jimmunol.181.4.2620. PMID:18684952.
- ^ Bredemeyer، A. L.؛ Helmink، B. A.؛ Innes، C. L.؛ Calderon، B.؛ McGinnis، L. M.؛ Mahowald، G. K.؛ Gapud، E. J.؛ Walker، L. M.؛ Collins، J. B.؛ Weaver، B. K.؛ Mandik-Nayak، L.؛ Schreiber، R. D.؛ Allen، P. M.؛ May، M. J.؛ Paules، R. S.؛ Bassing، C. H.؛ Sleckman، B. P. (11 ديسمبر 2008). "DNA double-strand breaks activate a multi-functional genetic program in developing lymphocytes". Nature. ج. 456 ع. 7223: 819–23. DOI:10.1038/nature07392. PMC:2605662. PMID:18849970.
- ^ Callén، E.؛ Jankovic، M.؛ Difilippantonio، S.؛ Daniel، J. A.؛ Chen، H. T.؛ Celeste، A.؛ Pellegrini، M.؛ McBride، K.؛ Wangsa، D.؛ Bredemeyer، A. L.؛ Sleckman، B. P.؛ Ried، T.؛ Nussenzweig، M.؛ Nussenzweig، A. (13 يوليو 2007). "ATM prevents the persistence and propagation of chromosome breaks in lymphocytes". Cell. ج. 130 ع. 1: 63–75. DOI:10.1016/j.cell.2007.06.016. PMID:17599403.
- ^ Shiloh، Y.؛ Tabor، E.؛ Becker، Y. (يوليو 1982). "Colony-forming ability of ataxia-telangiectasia skin fibroblasts is an indicator of their early senescence and increased demand for growth factors". Experimental Cell Research. ج. 140 ع. 1: 191–9. DOI:10.1016/0014-4827(82)90169-0. PMID:6213420.
- ^ Inomata، K.؛ Aoto، T.؛ Binh، N. T.؛ Okamoto، N.؛ Tanimura، S.؛ Wakayama، T.؛ Iseki، S.؛ Hara، E.؛ Masunaga، T.؛ Shimizu، H.؛ Nishimura، E. K. (12 يونيو 2009). "Genotoxic stress abrogates renewal of melanocyte stem cells by triggering their differentiation". Cell. ج. 137 ع. 6: 1088–99. DOI:10.1016/j.cell.2009.03.037. PMID:19524511.
- ^ Stray-Pedersen، A.؛ Borresen-Dale، A. L.؛ Paus، E.؛ Lindman، C. R.؛ Burgers، T.؛ Abrahamsen، T. G. (نوفمبر 2007). "Alpha fetoprotein is increasing with age in ataxia-telangiectasia". European journal of paediatric neurology : EJPN : official journal of the European Paediatric Neurology Society. ج. 11 ع. 6: 375–80. DOI:10.1016/j.ejpn.2007.04.001. PMID:17540590.
- ^ Biton، S.؛ Dar، I.؛ Mittelman، L.؛ Pereg، Y.؛ Barzilai، A.؛ Shiloh، Y. (23 يونيو 2006). "Nuclear ataxia-telangiectasia mutated (ATM) mediates the cellular response to DNA double strand breaks in human neuron-like cells". The Journal of Biological Chemistry. ج. 281 ع. 25: 17482–91. DOI:10.1074/jbc.M601895200. PMID:16627474.
- ^ Herzog، K. H.؛ Chong، M. J.؛ Kapsetaki، M.؛ Morgan، J. I.؛ McKinnon، P. J. (15 مايو 1998). "Requirement for Atm in ionizing radiation-induced cell death in the developing central nervous system". Science. ج. 280 ع. 5366: 1089–91. DOI:10.1126/science.280.5366.1089. PMID:9582124.
- ^ Lee، Y.؛ Chong، M. J.؛ McKinnon، P. J. (1 سبتمبر 2001). "Ataxia telangiectasia mutated-dependent apoptosis after genotoxic stress in the developing nervous system is determined by cellular differentiation status". The Journal of neuroscience : the official journal of the Society for Neuroscience. ج. 21 ع. 17: 6687–93. PMID:11517258.
- ^ Sordet، O.؛ Redon، C. E.؛ Guirouilh-Barbat، J.؛ Smith، S.؛ Solier، S.؛ Douarre، C.؛ Conti، C.؛ Nakamura، A. J.؛ Das، B. B.؛ Nicolas، E.؛ Kohn، K. W.؛ Bonner، W. M.؛ Pommier، Y. (أغسطس 2009). "Ataxia telangiectasia mutated activation by transcription- and topoisomerase I-induced DNA double-strand breaks". EMBO Reports. ج. 10 ع. 8: 887–93. DOI:10.1038/embor.2009.97. PMC:2726680. PMID:19557000.
- ^ Das، B. B.؛ Antony، S.؛ Gupta، S.؛ Dexheimer، T. S.؛ Redon، C. E.؛ Garfield، S.؛ Shiloh، Y.؛ Pommier، Y. (2 ديسمبر 2009). "Optimal function of the DNA repair enzyme TDP1 requires its phosphorylation by ATM and/or DNA-PK". The EMBO Journal. ج. 28 ع. 23: 3667–80. DOI:10.1038/emboj.2009.302. PMC:2790489. PMID:19851285.
- ^ Iourov، I. Y.؛ Vorsanova، S. G.؛ Liehr، T.؛ Kolotii، A. D.؛ Yurov، Y. B. (15 يوليو 2009). "Increased chromosome instability dramatically disrupts neural genome integrity and mediates cerebellar degeneration in the ataxia-telangiectasia brain". Human Molecular Genetics. ج. 18 ع. 14: 2656–69. DOI:10.1093/hmg/ddp207. PMID:19414482.
- ^ Guo، Z؛ Kozlov، S؛ Lavin، MF؛ Person، MD؛ Paull، TT (22 أكتوبر 2010). "ATM activation by oxidative stress". Science. ج. 330 ع. 6003: 517–21. DOI:10.1126/science.1192912. PMID:20966255.
- ^ Alexander، A؛ Cai، SL؛ Kim، J؛ Nanez، A؛ Sahin، M؛ MacLean، KH؛ Inoki، K؛ Guan، KL؛ Shen، J؛ Person، MD؛ Kusewitt، D؛ Mills، GB؛ Kastan، MB؛ Walker، CL (2 مارس 2010). "ATM signals to TSC2 in the cytoplasm to regulate mTORC1 in response to ROS". Proceedings of the National Academy of Sciences of the United States of America. ج. 107 ع. 9: 4153–8. DOI:10.1073/pnas.0913860107. PMC:2840158. PMID:20160076.
- ^ Cosentino، C؛ Grieco، D؛ Costanzo، V (2 فبراير 2011). "ATM activates the pentose phosphate pathway promoting anti-oxidant defence and DNA repair". The EMBO Journal. ج. 30 ع. 3: 546–55. DOI:10.1038/emboj.2010.330. PMC:3034007. PMID:21157431.
- ^ Biton، S.؛ Barzilai، A.؛ Shiloh، Y. (1 يوليو 2008). "The neurological phenotype of ataxia-telangiectasia: solving a persistent puzzle". DNA repair. ج. 7 ع. 7: 1028–38. DOI:10.1016/j.dnarep.2008.03.006. PMID:18456574.
- ^ Valentin-Vega، YA؛ Maclean، KH؛ Tait-Mulder، J؛ Milasta، S؛ Steeves، M؛ Dorsey، FC؛ Cleveland، JL؛ Green، DR؛ Kastan، MB (9 فبراير 2012). "Mitochondrial dysfunction in ataxia-telangiectasia". Blood. ج. 119 ع. 6: 1490–500. DOI:10.1182/blood-2011-08-373639. PMC:3286212. PMID:22144182.
- ^ D'Souza، AD؛ Parish، IA؛ Krause، DS؛ Kaech، SM؛ Shadel، GS (يناير 2013). "Reducing mitochondrial ROS improves disease-related pathology in a mouse model of ataxia-telangiectasia". Molecular therapy : the journal of the American Society of Gene Therapy. ج. 21 ع. 1: 42–8. DOI:10.1038/mt.2012.203. PMC:3538311. PMID:23011031.
- ^ Sharma، NK؛ Lebedeva، M؛ Thomas، T؛ Kovalenko، OA؛ Stumpf، JD؛ Shadel، GS؛ Santos، JH (يناير 2014). "Intrinsic mitochondrial DNA repair defects in Ataxia Telangiectasia". DNA repair. ج. 13: 22–31. DOI:10.1016/j.dnarep.2013.11.002. PMID:24342190.
- ^ Yang، Y.؛ Herrup، K. (9 مارس 2005). "Loss of neuronal cell cycle control in ataxia-telangiectasia: a unified disease mechanism". The Journal of neuroscience : the official journal of the Society for Neuroscience. ج. 25 ع. 10: 2522–9. DOI:10.1523/JNEUROSCI.4946-04.2005. PMID:15758161.
- ^ Li، J.؛ Han، Y. R.؛ Plummer، M. R.؛ Herrup، K. (29 ديسمبر 2009). "Cytoplasmic ATM in neurons modulates synaptic function". Current Biology. ج. 19 ع. 24: 2091–6. DOI:10.1016/j.cub.2009.10.039. PMC:2805770. PMID:19962314.
- ^ "Nuclear accumulation of HDAC4 in ATM deficiency promotes neurodegeneration in ataxia telangiectasia". Nat Med. ج. 18 ع. 5: 783–90. مايو 2012. DOI:10.1038/nm.2709. PMID:22466704.
- ^ "ATM and the epigenetics of the neuronal genome". Mech Ageing Dev. ج. 134 ع. 10: 434–9. أكتوبر 2013. DOI:10.1016/j.mad.2013.05.005. PMID:23707635.
- ^ Li، J؛ Hart، RP؛ Mallimo، EM؛ Swerdel، MR؛ Kusnecov، AW؛ Herrup، K (ديسمبر 2013). "EZH2-mediated H3K27 trimethylation mediates neurodegeneration in ataxia-telangiectasia". Nature Neuroscience. ج. 16 ع. 12: 1745–53. DOI:10.1038/nn.3564. PMC:3965909. PMID:24162653.
- ^ Jiang، D؛ Zhang، Y؛ Hart، RP؛ Chen، J؛ Herrup، K؛ Li، J (ديسمبر 2015). "Alteration in 5-hydroxymethylcytosine-mediated epigenetic regulation leads to Purkinje cell vulnerability in ATM deficiency". Brain : a journal of neurology. ج. 138 ع. Pt 12: 3520–36. DOI:10.1093/brain/awv284. PMID:26510954.
- ^ Wood، LM؛ Sankar، S؛ Reed، RE؛ Haas، AL؛ Liu، LF؛ McKinnon، P؛ Desai، SD (26 يناير 2011). "A novel role for ATM in regulating proteasome-mediated protein degradation through suppression of the ISG15 conjugation pathway". PLOS ONE. ج. 6 ع. 1: e16422. DOI:10.1371/journal.pone.0016422. PMC:3027683. PMID:21298066.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Gatti، R. A.؛ Berkel، I.؛ Boder، E.؛ Braedt، G.؛ Charmley، P.؛ Concannon، P.؛ Ersoy، F.؛ Foroud، T.؛ Jaspers، N. G.؛ Lange، K.؛ وآخرون (1988). "Localization of an ataxia-telangiectasia gene to chromosome 11q22-23". Nature. ج. 336 ع. 6199: 577–580. DOI:10.1038/336577a0. PMID:3200306.
- ^ Sun، X.؛ Becker-Catania، S. G.؛ Chun، H. H.؛ Hwang، M. J.؛ Huo، Y.؛ Wang، Z.؛ Mitui، M.؛ Sanal، O.؛ Chessa، L.؛ Crandall، B.؛ Gatti، R. A. (يونيو 2002). "Early diagnosis of ataxia-telangiectasia using radiosensitivity testing". The Journal of Pediatrics. ج. 140 ع. 6: 724–31. DOI:10.1067/mpd.2002.123879. PMID:12072877.
- ^ Chun، H. H.؛ Sun، X.؛ Nahas، S. A.؛ Teraoka، S.؛ Lai، C. H.؛ Concannon، P.؛ Gatti، R. A. (ديسمبر 2003). "Improved diagnostic testing for ataxia-telangiectasia by immunoblotting of nuclear lysates for ATM protein expression". Molecular genetics and metabolism. ج. 80 ع. 4: 437–43. DOI:10.1016/j.ymgme.2003.09.008. PMID:14654357.
- ^ Taylor، A. M.؛ Byrd، P. J. (أكتوبر 2005). "Molecular pathology of ataxia telangiectasia". Journal of clinical pathology. ج. 58 ع. 10: 1009–15. DOI:10.1136/jcp.2005.026062. PMC:1770730. PMID:16189143.
- ^ Anheim، M.؛ Tranchant، C.؛ Koenig، M. (16 فبراير 2012). "The autosomal recessive cerebellar ataxias". The New England Journal of Medicine. ج. 366 ع. 7: 636–46. DOI:10.1056/NEJMra1006610. PMID:22335741.
- ^ Lefton-Greif، M. A.؛ Crawford، T. O.؛ McGrath-Morrow، S.؛ Carson، K. A.؛ Lederman، H. M. (15 مايو 2011). "Safety and caregiver satisfaction with gastrostomy in patients with Ataxia Telangiectasia". Orphanet journal of rare diseases. ج. 6: 23. DOI:10.1186/1750-1172-6-23. PMC:3116459. PMID:21569628.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Swift، M.؛ Morrell، D.؛ Cromartie، E.؛ Chamberlin، A. R.؛ Skolnick، M. H.؛ Bishop، D. T. (نوفمبر 1986). "The incidence and gene frequency of ataxia-telangiectasia in the United States". American Journal of Human Genetics. ج. 39 ع. 5: 573–83. PMC:1684065. PMID:3788973.
- ^ Chessa، L؛ Leuzzi، V؛ Plebani، A؛ Soresina، A؛ Micheli، R؛ D'Agnano، D؛ Venturi، T؛ Molinaro، A؛ Fazzi، E؛ Marini، M؛ Ferremi Leali، P؛ Quinti، I؛ Cavaliere، FM؛ Girelli، G؛ Pietrogrande، MC؛ Finocchi، A؛ Tabolli، S؛ Abeni، D؛ Magnani، M (9 يناير 2014). "Intra-erythrocyte infusion of dexamethasone reduces neurological symptoms in ataxia teleangiectasia patients: results of a phase 2 trial". Orphanet journal of rare diseases. ج. 9 ع. 1: 5. DOI:10.1186/1750-1172-9-5. PMID:24405665.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Yousefpour، P؛ Chilkoti، A (سبتمبر 2014). "Co-opting biology to deliver drugs". Biotechnology and Bioengineering. ج. 111 ع. 9: 1699–716. DOI:10.1002/bit.25307. PMID:24916780.
روابط خارجية[عدل]
- About A–T from the NINDS
- Orphanet for A–T
- GeneReviews for ataxia–telangiectasia
- Replication-Independent Double-Strand Breaks (DSBs) Discusses importance of the ATM kinase
| في كومنز صور وملفات عن: رنح وتوسع الشعيرات |
