جلوتاثيون أس-ترانسفيراز
| جلوتاثيون أس-ترانسفيراز | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
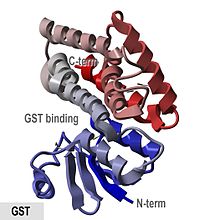 بنية بلورات الجلوتاثيون أس-ترانسفيراز في الأنوفيلة.[1] | |||||||||||
| أرقام التعريف | |||||||||||
| رقم التصنيف الإنزيمي | 2.5.1.18 | ||||||||||
| رقم التسجيل CAS | 50812-37-8 | ||||||||||
| قواعد البيانات | |||||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||||
| إكسباسي | راجع NiceZyme | ||||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||||
| ميتاسيك | المسار الأيضي | ||||||||||
| بريام | ملف التعريف | ||||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||||
| الأونتولوجيا الجينية | AmiGO / EGO | ||||||||||
| |||||||||||
جلوتاثيون أس-ترانسفيراز (بالإنجليزية: Glutathione S-transferase) هو إنزيم مضاد للأكسدة واسع الطيف. يضم أسرة مكونة من حقيقيات النواة وبدائية النواة في المرحلة الثانية للأيضية.[2][3][4]
تواجده[عدل]
يتواجد الجلوتاثيون أس-ترانسفيراز في الكبد حيث يتم إنتاج هذا الإنزيم من خلال بروتين الجلوتاثيون من ثلاثة أحماض أمينية هي الجلايسين وحمض الجلوتاميك والسيستين وهو مضاد قوي للأكسدة حيث يثبط تكون الذرات الحرة ويحمي الخلايا من الإصابة بالتلف.[5][6] ويساعد على حماية الجسم من الآثار المدمرة لتدخين السجائر والتعرض للإشعاع، والعلاج الكيميائي للسرطانات، والسموم وهو مضاد قوي لسموم المعادن الثقيلة والعقاقير ويساعد كثيراً في في علاج أمراض الكبد والدم.[7][8]
وظيفته[عدل]
يقوم جلوتاثيون أس-ترانسفيراز بتطهير الكبد من السموم والبكتيريا التي يتعرض لها، حيث يتم إنتاجه من خلال معادلة بيروكسيد الهيدروجين.[9][10] وهو يشكل أيضًا مكونا لإنزيم آخر هو الجلوتاثيون - أس - ترانسفيراز وهو إنزيم واسع الطيف مزيل لسموم الكبد. وكذلك يحمي أنسجة الشرايين والدماغ والقلب وخلايا جهاز المناعة والكليتين وعدستي العينين والكبد والرئتين والجلد من التدمير بسبب الأكسدة.[11] وهو ما يلعب دورًا هامًا في الوقاية من السرطان وخاصة سرطان الكبد.
المركبات الكيميائية[عدل]
المركبات المستهدفة في هذه الطريقة من قبل جلوتاثيون أس-ترانسفيراز، تشمل مجموعة متنوعة من السموم البيئية أو الخارجية، ومنها المواد العلاجية الكيميائية، والمبيدات الحشرية ومبيدات الأعشاب والمواد المسرطنة، والجدول التالي هو عن مركبات الإنزيم في الإنسان:
| GST الكلاس | في الإنسان GST فئة الأعضاء (22) |
|---|---|
| ألفا | GSTA1 ، GSTA2 ، GSTA3 ، GSTA4 ، GSTA5 |
| دلتا | |
| غابا | GSTK |
| مو | GSTM1, GSTM1L (RNAi), GSTM2, GSTM3, GSTM4, GSTM5 |
| اوميغا | GSTO1, GSTO2 |
| بي | GSTP1 |
| ثيتا | GSTT1, GSTT2, GSTT4 |
| زيتا | GSTZ1 |
| ميكروسومي | MGST1, MGST2, MGST3 |
انظر أيضًا[عدل]
المراجع[عدل]
- ^ ببب: 1R5A; Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ (يونيو 2005). "Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme". Biochem. J. ج. 388 ع. Pt 3: 763–71. DOI:10.1042/BJ20042015. PMC:1183455. PMID:15717864.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ (يونيو 2005). "Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme". Biochem. J. ج. 388 ع. Pt 3: 763–71. DOI:10.1042/BJ20042015. PMC:1183455. PMID:15717864.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Sheehan D, Meade G, Foley VM, Dowd CA (نوفمبر 2001). "Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily". Biochem. J. ج. 360 ع. Pt 1: 1–16. DOI:10.1042/0264-6021:3600001. PMC:1222196. PMID:11695986.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Allocati N, Federici L, Masulli M, Di Ilio C (يناير 2009). "Glutathione transferases in bacteria". FEBS J. ج. 276 ع. 1: 58–75. DOI:10.1111/j.1742-4658.2008.06743.x. PMID:19016852.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Boyer TD (مارس 1989). "The glutathione S-transferases: an update". Hepatology. ج. 9 ع. 3: 486–96. DOI:10.1002/hep.1840090324. PMID:2646197.
- ^ Mukanganyama S, Bezabih M, Robert M؛ وآخرون (أغسطس 2011). "The evaluation of novel natural products as inhibitors of human glutathione transferase P1-1". J Enzyme Inhib Med Chem. ج. 26 ع. 4: 460–7. DOI:10.3109/14756366.2010.526769. PMID:21028940.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Douglas KT (1987). "Mechanism of action of glutathione-dependent enzymes". Adv. Enzymol. Relat. Areas Mol. Biol. ج. 59: 103–67. PMID:2880477.
- ^ Oakley A (مايو 2011). "Glutathione transferases: a structural perspective". Drug Metab. Rev. ج. 43 ع. 2: 138–51. DOI:10.3109/03602532.2011.558093. PMID:21428697.
- ^ Josephy PD (2010). "Genetic variations in human glutathione transferase enzymes: significance for pharmacology and toxicology". Hum Genomics Proteomics. ج. 2010: 876940. DOI:10.4061/2010/876940. PMC:2958679. PMID:20981235. مؤرشف من الأصل في 26 أبريل 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Hayes JD, Flanagan JU, Jowsey IR (2005). "Glutathione transferases". Annu. Rev. Pharmacol. Toxicol. ج. 45: 51–88. DOI:10.1146/annurev.pharmtox.45.120403.095857. PMID:15822171. مؤرشف من الأصل في 2019-12-16.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Eaton DL, Bammler TK (يونيو 1999). "Concise review of the glutathione S-transferases and their significance to toxicology". Toxicol. Sci. ج. 49 ع. 2: 156–64. PMID:10416260. مؤرشف من الأصل في 2020-03-14.
وصلات إضافية[عدل]
- Overview of Glutathione-S-Transferases
- قاعدة بيانات توجهات البروتينات في الأغشية families/superfamily-199 - MAPEG (Eicosanoid and Glutathione metabolism proteins) family
- Glutathione+S-Transferase في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
| جلوتاثيون أس-ترانسفيراز في المشاريع الشقيقة: | |
| |
