مستخدم:بدر/اكتشاف النيوترون

اكتشاف النيوترون (بالإنجليزية: Discovery of the neutron) مصطلح يشير إلى الاكتشاف الحاصل بواسطة جيمس تشادويك للنيوترون واستطاعته تمييزه عن البروتون عام 1932. كان اكتشاف النيوترون وخصائصه عاملاً أساسياً للتطورات غير العادية في الفيزياء الذرية الحاصلة في النصف الأول من القرن العشرين. أول خطوةٍ كانت تطوير إرنست رذرفورد نموذجًا خامًا للذرة في أوائل القرن[1]:188[2] استنادًا إلى تجربة رقائق الذهب التي قام بها هانز جيجر وإرنست مارسدن. تركزت كتلة الذرة وشحنتها الكهربائية الموجبة في هذا النموذج في نواة صغيرة جدًا.[3] ثم اكتشفت النظائر الكيميائية عام 1920، وتم تحديد الكتل الذرية لتكون (تقريبًا) مضاعفات صحيحة لكتلة ذرة الهيدروجين،[4] وتم تعريف العدد الذري لاحقًا على أنه "الشحنة الموجودة على النواة".[5]:§1.1.2 كان يُنظر إلى النواة طوال عشرينيات القرن الماضي على أنها مكونة من مجموعات من البروتوناتوالإلكترونات، وهما الجسيمان الأوليان المعروفان في ذلك الوقت، لكن هذا النموذج قدم العديد من التناقضات التجريبية والنظرية.[1]:298
نشأت الطبيعة الأساسية للنواة الذرية مع اكتشاف النيوترون بواسطة جيمس تشادويك في عام 1932[6] وتحديد أنه جسيم أولي جديد مختلف تماماً عن البروتون.[7][8]:55
تم استغلال النيوترون غير المشحون فور ثبوت صحة الاكتشاف كوسيلة جديدة لكشف البنية النووية، مما أدى إلى اكتشافات مثل إنشاء عناصر مشعة جديدة عن طريق التشعيع النيوتروني (1934) وانشطار ذرات اليورانيوم بواسطة النيوترونات (1938).[9] كما أدى اكتشاف الانشطار إلى إنشاء كل من الطاقة النووية والأسلحة النووية بنهاية الحرب العالمية الثانية. افتُرض أن كلاً من البروتون والنيوترون جسيمات أولية حتى الستينيات، عندما تم تحديدهما على أنهما جسيمات مركبة مبنية من الكواركات.[10]
اكتشاف النشاط الإشعاعي[عدل]

لم يكن الجدل القوي حول وجود الذرات حتى بداية القرن العشرين قد حُلَّ بعد. فقد أنكر فلاسفةٌ مثل إرنست ماخ وويلهلم أوستوالد حقيقة وجود الذرات، واعتبروها "بنية رياضية متلائمة"، بينما رأى علماء مثل أرنولد سومرفيلد ولودفيج بولتزمان أن النظريات الفيزيائية تتطلب وجودًا فعليًّا للذرات.[9]:13–14
اكتُشف النشاط الإشعاعي عام 1896 من قبل الفرنسي هنري بيكريل أثناء عمله مع المواد الفسفورية. ثم استطاع إرنست رذرفورد في مختبر كافنديش عام 1898 تمييز نوعين من النشاط الإشعاعي، أشعة ألفا وأشعة بيتا، والتي تختلف في قدرتها على اختراق الأجسام العادية والغازات. اكتشف بول فيلارد بعد ذلك بعامين أشعة غاما التي تمتلك قوة اختراق أكبر.[1]:8–9 وسرعان ما تم تحديد هذه الإشعاعات بجسيمات معروفة، فقد حدَّد والتر كوفمان عام 1902 أن أشعة بيتا عبارة عن إلكترونات، ثم حدَّد رذرفورد وتوماس رويدز أن أشعة ألفا عبارة عن أيونات الهيليوم وذلك في عام 1907، ثم حدد رذرفورد وإدوارد أندرادي عام 1914 أشعة جاما على أنها إشعاع كهرومغناطيسي، ما يعني أنها شكل من أشكال الضوء.[1]:61–62, 87 تم تحديد هذه الإشعاعات بعد ذلك على أنها منبثقة من الذرات وقدِّمت أدلة على العمليات التي تحدث داخل الذرات. على النقيض، تم التعرف على الإشعاعات كأدوات يمكن استغلالها في تجارب التشتيت لفحص الجزء الداخلي من الذرة.[11]:112–115
تجربة رقائق الذهب واكتشاف النواة الذرية[عدل]
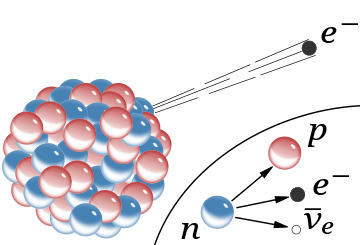
β−
، وهو انبعاث إلكترون سريع من النواة (أهملت مضادات النيوترينو المصاحبة). في نموذج رذرفورد للنواة، كانت الكرات الحمراء عبارة عن بروتونات ذات شحنة موجبة والكرات الزرقاء بروتونات مرتبطة بإحكام بإلكترونٍ دون وجود شحنة صافية.
يُظهر الشكل الداخلي (على اليمين) اضمحلال بيتا للنيوترون الحر كما هو مفهوم اليوم؛ إذ يتم في هذه العملية إنشاء إلكترون ومضاد نيوترينو.
في جامعة مانشستر، وفي الأعوام 1908 حتى 1913، وجَّه رذرفورد هانز جايجر وإرنست مارسدن في سلسلة من التجارب لتحديد ما يحدث عندما تتشتت جسيمات ألفا من الرقائق المعدنية. التجربة التي تسمى الآن تجربة رذرفورد لرقائق الذهب أو تجربة جايجر-مارسدن، حققت هذه القياسات اكتشافًا غير عادي، حيث بينت أنه على الرغم من أن معظم جسيمات ألفا تمر عبر رقاقة ذهبية رفيعة تعاني انحرافاً طفيفاً، إلا أن القليل منها مبعثر بزاوية عالية. ما يشير إليه التشتت أن بعض جسيمات ألفا ارتدت مرة أخرى من مكون صغير ولكنه كثيف داخل الذرات. بناءً على هذه القياسات، وبحلول عام 1911، كان من الواضح لرذرفورد أن الذرة تتكون من نواة صغيرة ضخمة ذات شحنة موجبة محاطة بسحابة أكبر بكثير من الإلكترونات سالبة الشحنة. كانت الكتلة الذرية المركزة مطلوبة لتوفير الانحراف الملحوظ لجسيمات ألفا ، وطور رذرفورد نموذجًا رياضيًا يفسر ذلك التشتت.[2]
كان نموذج رذرفورد مؤثرًا للغاية، حيث ساهم في نشأة نموذج بور للإلكترونات التي تدور حول النواة عام 1913،[12] وأدى في النهاية إلى نشوء ميكانيكا الكم في منتصف عشرينيات القرن الماضي.
اكتشاف النظائر[عدل]
بالتزامن مع عمل رذرفورد وجيجر ومارسدن ، كان عالم الكيمياء الإشعاعية فريدريك سودي في جامعة جلاسكو يدرس المشكلات المتعلقة بالكيمياء على المواد المشعة. عمل سودي مع رذرفورد على دراسة النشاط الإشعاعي في جامعة ماكجيل.[13] وبحلول عام 1910، تم تحديد حوالي 40 عنصرًا نشط الإشعاع مختلفاً، يشار إليها باسم العناصر المشعة تقع بين اليورانيوم والرصاص، على الرغم من أن الجدول الدوري يسمح فقط بـ 11 عنصرًا. اكتشف كل من سودي وكازيميرز فاجانز بشكل مستقل عام 1913 أن العنصر الذي يمر بتحلل ألفا سينتج عنصرًا في موقعين إلى اليسار في الجدول الدوري وأن العنصر الذي يخضع لاضمحلال بيتا سينتج عنصرًا في موقع واحد على اليمين في الجدول الدوري. واكتشفا أيضًا أن العناصر المشعة الموجودة في نفس الأماكن في النظام الدوري متطابقة كيميائيًا. أطلق سودي على هذه العناصر المتطابقة كيميائيًا النظائر.[14]:3–5[15] وقد حصل سودي على جائزة نوبل في الكيمياء عام 1921 لدراسته للنشاط الإشعاعي واكتشاف النظائر.[16]

بناء على عمل جيه جيه طومسون على انحراف الذرات موجبة الشحنة بواسطة المجالات الكهربائية والمغناطيسية، قام فرانسيس أستون ببناء أول مطياف كتلة في مختبر كافنديش عام 1919. كان هدفه الذي حققه بسهولة هو فصل نظيري النيون 20Ne و22Ne عن بعضهما. اكتشف أستون أن كتل جميع الجسيمات عبارة عن أعداد صحيحة، أي أن كتل جميع النظائر هي مضاعفات صحيحة لكتلة ذرة الهيدروجين . في هذه القياسات، قام أستون بحساب الكتلة بالنسبة للأكسجين-16، والذي اعتبره أن كتلته 16 بالضبط.[4] (وحدة الكتلة الذرية (amu) المستخدمة حالياً نسبية إلى الكربون-12.[17]) ومن المفارقات أن الاستثناء الوحيد لهذه القاعدة هو الهيدروجين نفسه، والذي كانت قيمة كتلته 1.008. رغم أن الكتلة الزائدة كانت صغيرة، لكنها كانت خارج حدود عدم اليقين التجريبي. سرعان ما أدرك أستون وآخرون أن التناقض يرجع إلى طاقة ارتباط الذرات، أي أن كتلة عدد من ذرات الهيدروجين المرتبطة بذرة واحدة يجب أن تكون أقل من مجموع كتل ذرات الهيدروجين المنفصلة.[4] حاز أستون جائزة نوبل في الكيمياء عام 1922 لاكتشافه نظائر عدد كبير من العناصر غير المشعة، ولإعلانه عن قاعدة العدد الكامل.[18] لاحظ آرثر إدينجتون اكتشاف أستون الأخير لطاقة الارتباط النووية في عام 1920، حين اقترح أن النجوم قد تحصل على طاقتها عن طريق دمج الهيدروجين (البروتونات) في الهيليوم وأن العناصر الأثقل قد تتشكل في النجوم.[19]
العدد الذري وقانون موزلي[عدل]
لاحظ رذرفورد وآخرون التباين بين كتلة الذرة، المحسوبة بوحدات الكتلة الذرية، والشحنة التقريبية المفترض وجودها على النواة لكي يعمل نموذج رذرفورد. كانت الشحنة المطلوبة للنواة الذرية عادة حوالي نصف كتلتها الذرية.[20]:82 افترض أنطونيوس فان دن بروك بجرأة أن الشحنة المطلوبة، المشار إليها بـ Z، لم تكن نصف الوزن الذري للعناصر، إنما كانت مساوية تمامًا للموضع الترتيبي للعنصر في الجدول الدوري.[1]:228 في ذلك الوقت ، لم يكن من المعروف أن مواضع العناصر في الجدول الدوري لها أي أهمية فيزيائية. إذا كان ترتيب العناصر تم بناءً على زيادة الكتلة الذرية، فقد تم الكشف دورية جديدة في الخواص الكيميائية. كانت الاستثناءات من هذه الدورية واضحة ، مثل الكوبالت والنيكل.[أ] [21]:180
ناقش هنري موزلي في جامعة مانشستر عام 1913 نموذج بور الجديد للذرة أثناء زيارته بور.[20] يضع النموذج في الحسبان طيف الانبعاث الكهرومغناطيسي من ذرة الهيدروجين، وتساءل موزلي وبور عما إذا كانت أطياف الانبعاث الكهرومغناطيسي للعناصر الأثقل مثل الكوبالت والنيكل ستتبع ترتيبها بالوزن، أو حسب موقعها في الجدول الدوري. [22]:346 وفي 1913-1914 اختبر موسلي السؤال عملياً باستخدام تقنيات حيود الأشعة السينية، فوجد أن الخط الأكثر كثافة قصير الموجة في طيف الأشعة السينية لعنصر معين، والمعروف باسم خط ألفا K، كان مرتبطاً بموضع العنصر في الجدول الدوري، أي العدد الذري (Z). وكان موزلي هو من قدم هذا المصطلح.[5]:§1.1.2 وجد موزلي أيضاً أن ترددات الإشعاع كانت مرتبطة بطريقة بسيطة بالعدد الذري للعناصر لعدد كبير من العناصر.[23][5]:5[21]:181
في غضون عام، لوحظ أن معادلة العلاقة، التي تسمى الآن قانون موسلي، يمكن تفسيرها من حيث نموذج بور لعام 1913، مع افتراضات إضافية معقولة حول التركيب الذري في العناصر الأخرى.[24]:87 نتيجة موزلي، حسب حساب بوهر اللاحق، لم تؤسس فقط العدد الذري ككمية تجريبية قابلة للقياس، ولكنها أعطته معنًى فيزيائياً كشحنة موجبة على النواة الذرية. استناداً إلى المعطيات، يمكن ترتيب العناصر في الجدول الدوري بترتيب العدد الذري بدلاً من الوزن الذري.[25]:127 ربطت النتيجة تنظيم الجدول الدوري، نموذج بور للذرة، [26] :56ونموذج رذرفورد لتشتت ألفا من النوى، وقد استشهد به رذرفورد وبور وآخرون باعتباره تقدماً حاسماً في فهم طبيعة النواة الذرية.[27]
توقفت الكثير من البحوث في الفيزياء الذرية بسبب اندلاع الحرب العالمية الأولى. قُتل موسلي عام 1915 في حملة جاليبولي،[28][21]:182 بينما كان جيمس تشادويك، طالب رذرفورد، محتجزًا في ألمانيا طوال فترة الحرب (1914-1918). [29] في برلين، توقف بحث ليز مايتنر وأوتو هان حول تحديد سلاسل الاضمحلال الإشعاعي للراديوم واليورانيوم عن طريق الفصل الكيميائي الدقيق.[9]:§4 قضى مايتنر معظم سنوات الحرب في العمل كأخصائي أشعة وفني الأشعة السينية الطبية بالقرب من الجبهة النمساوية، بينما عمل الكيميائي هان على البحث في حرب الغازات السامة.[9]:61–62, 68

في عام 1920 ، ألقى رذرفورد محاضرة في الجمعية الملكية بعنوان "الدستور النووي للذرات (بالإنجليزية: Nuclear Constitution of Atoms)"، وقد كانت ملخصاً للتجارب الأخيرة على النوى الذرية والاستنتاجات المتعلقة ببنية النوى الذرية.[30][8]:23[5]:5 بحلول عام 1920، كان من المفترض على نطاق واسع وجود الإلكترونات داخل النواة الذرية، وكان من المفترض كذلك أن تتكون النواة من نوى هيدروجين مساوية في العدد للكتلة الذرية. ونظراً لأن كل نواة هيدروجين تحتوي على شحنة +1، فقد تطلبت النواة عددًا أقل من "الإلكترونات الداخلية" لكل منها شحنة −1 لإعطاء النواة شحنتها الإجمالية الصحيحة. كتلة البروتونات أكبر بحوالي 1800 مرة من كتلة الإلكترونات، لذا فإن كتلة الإلكترونات عرضية في هذا الحساب.[1]:230–231 كان مثل هذا النموذج متسقاً مع تشتت جسيمات ألفا من النوى الثقيلة، بالإضافة إلى شحنة وكتلة العديد من النظائر التي تم تحديدها. كانت هناك دوافع أخرى لنموذج البروتون والإلكترون. علق رذرفورد حينها: "لدينا سبب قوي للاعتقاد بأن نوى الذرات تحتوي على إلكترونات بالإضافة إلى أجسام موجبة الشحنة."،[30]:376–377 أي أنه من المعروف أن إشعاع بيتا عبارة عن إلكترونات تنبعث من النواة.[8]:21[5]:5–6
في تلك المحاضرة، توقع رذرفورد وجود جسيمات جديدة. كان من المعروف أن جسيم ألفا مستقر للغاية، وكان من المفترض أن يحتفظ بهويته داخل النواة. يُفترض أن جسيم ألفا يتكون من أربعة بروتونات وإلكترونين مرتبطين بشكل وثيق لإعطائه شحنة +2 وكتلة 4. في ورقة بحثية صدرت عام 1919،[31] أبلغ رذرفورد عن الاكتشاف الواضح لجسيم جديد مزدوج الشحنة كتلته 3، يرمز إلى X++، مفسرًا على أنه يتكون من ثلاثة بروتونات وإلكترون وثيق الصلة. طرحت هذه النتيجة لروذرفورد احتمال وجود جسيمين جديدين: واحد من بروتونين لهما إلكترون وثيق الصلة، والآخر لبروتون وإلكترون وثيق الصلة. تم تحديد جسيم X++ لاحقًا ليكون له كتلة 4 وأن يكون مجرد جسيم ألفا منخفض الطاقة.[8]:25 ومع ذلك، فقد توقع رذرفورد وجود الديوترون، وهو جسيم شحنته 1+ وكتلته 2، والنيوترون، وهو جسيم متعادل كتلته 1.[30]:396 الجسيم الأول كان نواة الديوتيريوم، إذ اكتشفه هارولد أوري عام 1931. [32] كانت كتلة الجسيم المحايد الافتراضي ستكون مختلفة قليلاً عن كتلة البروتون. قرر رذرفورد أن مثل هذا الجسيم عديم الشحنة سيكون من الصعب اكتشافه من خلال التقنيات المتاحة.[30]:396
وقت محاضرة رذرفورد، ظهرت منشورات أخرى تحتوي على اقتراحات مماثلة لمركب بروتون-إلكترون في النواة، وفي عام 1921، أطلق الكيميائي الأمريكي ويليام درابر هاركنز على الجسيم غير المشحون اسم النيوترون.[33][34][35][5]:6 في نفس الوقت تقريبًا، تم اعتماد كلمة بروتون لنواة الهيدروجين،[36] وتم بناء النيوترون على ما يبدو من الجذر اللاتيني للفظة محايد والنهاية اليونانية -on (على غرار الإلكترون والبروتون).[37][38] يمكن العثور على مراجع لكلمة نيوترون فيما يتعلق بالذرة في الأدبيات منذ عام 1899.[1]:398[33]
بدأ رذرفورد وتشادويك على الفور برنامجًا تجريبيًا في مختبر كافنديش في كامبريدج للبحث عن النيوترون.[8]:27[1]:398 استمرت التجارب طوال عشرينيات القرن الماضي دون نجاح.[6]
لم يتم قبول تخمين رذرفورد و"النيوترون" الافتراضي على نطاق واسع. لم يذكر جورج جاموف في دراسته عام 1931 حول دستور النوى الذرية والنشاط الإشعاعي في معهد الفيزياء النظرية في كوبنهاغن النيوترون.[39] في وقت قياساتهم في باريس عام 1932 والتي من شأنها أن تؤدي إلى اكتشاف النيوترون، لم تكن إيرين جوليو-كوري وفردريك جوليو-كوري على دراية بهذا التخمين.[40]
مشاكل فرضية الإلكترونات النووية[عدل]
طوال عشرينيات القرن الماضي، افترض الفيزيائيون أن النواة الذرية تتكون من بروتونات و"إلكترونات نووية".[8]:29–32[41] في ظل هذه الفرضية، ستتكون نواة النيتروجين-14 (14N) من 14 بروتونًا و7 إلكترونات، بحيث يكون لها صافي شحنة +7 وحدات شحن أولية وكتلة 14 وحدة كتلة ذرية. ستدور حول هذه النواة أيضًا 7 إلكترونات أخرى (يطلق عليها رذرفورد "الإلكترونات الخارجية"[30]:375). لكن سرعان ما ظهرت مشاكل هذه الفرضية.
أشار رالف كرونيغ في عام 1926 إلى أن التركيب فائق الدقة للأطياف الذرية كان غير متسق مع فرضية البروتون والإلكترون، حيث أن هذا الهيكل ناتج عن تأثير النواة على ديناميكيات الإلكترونات التي تدور حولها، إذ يجب أن تُنتج اللحظات المغناطيسية لـ "الإلكترونات النووية" المفترضة وصلات خط طيفية فائقة الدقة مشابهة لتأثير زيمان، ولكن لم يتم ملاحظة مثل هذه التأثيرات.[42]:199 وبدا أن العزم المغناطيسي للإلكترون قد اختفى عندما كان داخل النواة.[1]:299
أثناء زيارته لجامعة أوتريخت في عام 1928، علم كرونيغ جانبًا مفاجئًا من الطيف الدوراني لـ N2 +، حيث أظهر قياس الدقة الذي أجراه ليونارد أورنشتاين، مدير المختبر الفيزيائي في أوتريخت، أن دوران نواة النيتروجين يجب أن يكون مساويًا لواحد. ومع ذلك، إذا كانت نواة النيتروجين-14 ( 14N) تتكون من 14 بروتونًا و 7 إلكترونات ، وهو عدد فردي من جسيمات الدوران 1/2، فيجب أن يكون الدوران النووي الناتج نصف عدد صحيح. لذلك اقترح كرونيغ أنه ربما "لا تحتفظ البروتونات والإلكترونات بهويتها داخل النواة بالقدر الذي تفعله خارج النواة".[1]:299–301[43]:117
كانت ملاحظات مستويات الطاقة الدورانية للجزيئات ثنائية الذرة باستخدام مطياف رامان التي قدمها فرانكو راسيتي في عام 1929 غير متوافقة مع الإحصائيات المتوقعة من فرضية البروتون والإلكترون. حصل راسيتي على أطياف النطاق لجزيئات H2 وN2 . بينما أظهرت خطوط كلا الجزيئات ثنائية الذرة تناوبًا في الشدة بين الضوء والظلام، حيث ظهر أن نمط التناوب لـ H2 هو عكس ذلك الخاص بـ N2. بعد تحليل هذه النتائج التجريبية بعناية، أظهر الفيزيائيان الألمان فالتر هايتلر وغيرهارد هيرتسبيرغ أن نواة الهيدروجين تخضع لإحصائيات فيرمي وأن نواة النيتروجين تخضع لإحصائيات بوز. ومع ذلك، أظهرت نتيجة غير منشورة بعد ذلك ليوجين ويغنر أن النظام المركب الذي يحتوي على عدد فردي من جسيمات الدوران 1/2 يجب أن يخضع لإحصائيات فيرمي، ويخضع النظام الذي يحتوي على عدد زوجي من جسيم الدوران 1/2 لإحصائيات بوز. إذا كانت نواة النيتروجين تحتوي على 21 جسيمًا، فيجب أن تخضع لإحصاءات فيرمي، خلافًا للحقيقة. وهكذا، خلص هايتلر وهيرتسبيرغ إلى أن "الإلكترون في النواة ... يفقد قدرته على تحديد إحصائيات النواة".[43]:117–118
قدمت مفارقة كلاين،[44] التي اكتشفها أوسكار كلاين في عام 1928، مزيدًا من الاعتراضات الميكانيكية الكمومية على فكرة وجود إلكترون محصور داخل نواة. تشير هذه المفارقة الواضحة والدقيقة المستمدة من معادلة ديراك إلى أن إلكترونًا يقترب من حاجز عالي الإمكانات لديه احتمال كبير بالمرور عبر الحاجز[39] من خلال عملية الإنتاج الزوجي.
في عام 1927، قام تشارلز إليس و دبليو ووستر في مختبر كافنديش بقياس طاقات إلكترونات اضمحلال البيتا. وجدوا أن توزيع الطاقات من أي نوى مشعة معينة كان واسعًا ومستمرًا ، وهي نتيجة تتناقض بشكل ملحوظ مع قيم الطاقة المتميزة التي لوحظت في تحلل ألفا وغاما. علاوة على ذلك ، يبدو أن التوزيع المستمر للطاقة يشير إلى أن الطاقة لم يتم حفظها بواسطة عملية "الإلكترونات النووية". في الواقع ، اقترح بور في عام 1929 تعديل قانون الحفاظ على الطاقة لمراعاة التوزيع المستمر للطاقة. حصل الاقتراح على دعم Werner Heisenberg. كانت هذه الاعتبارات منطقية على ما يبدو ، حيث أن قوانين ميكانيكا الكم قد قلبت مؤخرًا قوانين الميكانيكا الكلاسيكية.
ملاحظات توضيحية[عدل]
مراجع[عدل]
روابط خارجية[عدل]
- Annotated bibliography for neutrons from the Alsos Digital Library for Nuclear Issues
- Abraham Pais, Inward Bound, Oxford: Oxford University Press, 1986. (ردمك 0198519974)ISBN 0198519974.
- Herwig Schopper, Weak interactions and nuclear beta decay, Publisher, North-Holland Pub. Co., 1966. 644015779OCLC 644015779
- Ruth Lewin Sime, Lise Meitner: A Life in Physics, Berkeley, University of California Press, 1996. (ردمك 0520208609)ISBN 0520208609.
- Roger H. Stuewer, "The Nuclear Electron Hypothesis". In Otto Hahn and the Rise of Nuclear Physics, William R. Shea, ed. Dordrecht, Holland: D. Riedel Publishing Company. pp. 19–67, 1983. (ردمك 90-277-1584-X)ISBN 90-277-1584-X.
- Sin-Itiro Tomonaga, The Story of Spin, The University of Chicago Press, 1997. (ردمك 9780226807942)ISBN 9780226807942
[[تصنيف:نيوترون]]
- ^ أ ب ت ث ج ح خ د ذ ر Pais، Abraham (1986). Inward Bound. Oxford: Oxford University Press. ISBN:978-0198519973.
- ^ أ ب Rutherford, E. (1911). "The Scattering of α and β Particles by Matter and the Structure of the Atom". Philosophical Magazine. Series 6 ع. 21: 669–688. DOI:10.1080/14786440508637080. اطلع عليه بتاريخ 2017-11-15.
- ^ Longair, M.S. (2003). Theoretical concepts in physics: an alternative view of theoretical reasoning in physics. Cambridge University Press. ص. 377–378. ISBN:978-0-521-52878-8.
- ^ أ ب ت Squires، Gordon (1998). "Francis Aston and the mass spectrograph". Dalton Transactions ع. 23: 3893–3900. DOI:10.1039/a804629h.
- ^ أ ب ت ث ج ح Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, (ردمك 0486482383)
- ^ أ ب Chadwick، James (1932). "Existence of a Neutron". Proceedings of the Royal Society A. ج. 136 ع. 830: 692–708. Bibcode:1932RSPSA.136..692C. DOI:10.1098/rspa.1932.0112.
- ^ Chadwick، J.؛ Goldhaber، M. (1935). "A nuclear photoelectric effect". Proceedings of the Royal Society A. ج. 151 ع. 873: 479–493. Bibcode:1935RSPSA.151..479C. DOI:10.1098/rspa.1935.0162.
- ^ أ ب ت ث ج ح Stuewer، Roger H. (1983). "The Nuclear Electron Hypothesis". في Shea، William R. (المحرر). Otto Hahn and the Rise of Nuclear Physics. Dordrecht, Holland: D. Riedel Publishing Company. ص. 19–67. ISBN:978-90-277-1584-5.
- ^ أ ب ت ث Rife, Patricia (1999). Lise Meitner and the dawn of the nuclear age. Basel, Switzerland: Birkhäuser. ISBN:978-0-8176-3732-3.
- ^ Introduction to High Energy Physics، Addison Wesley, Reading, Massachusetts، 1982، ص. 201–202، ISBN:978-0-201-05757-7
- ^ Malley، Marjorie (2011)، Radioactivity: A History of a Mysterious Science (ط. illustrated)، Oxford University Press، ISBN:9780199766413
- ^ Bohr, N. (1913). "On the Constitution of Atoms and Molecules, Part I" (PDF). Philosophical Magazine. ج. 26 ع. 151: 1–24. Bibcode:1913PMag...26....1B. DOI:10.1080/14786441308634955.
- ^ "The Nobel Prize in Chemistry 1921 – Frederick Soddy Biographical". Nobelprize.org. اطلع عليه بتاريخ 2019-09-05.
- ^ Choppin، Gregory؛ Liljenzin، Jan-Olov؛ Rydberg، Jan (2013)، Radiochemistry and Nuclear Chemistry (ط. 4th)، Academic Press، ISBN:978-0124058972
- ^ Others had also suggested the possibility of isotopes; for example:
- ^ "The Nobel Prize in Chemistry 1921: Frederick Soddy – Biographical". Nobelprize.org. اطلع عليه بتاريخ 2014-03-16.
- ^ "Atomic Weights and the International Committee — A Historical Review". 26 يناير 2004.
- ^ "The Nobel Prize in Chemistry 1922: Francis W. Aston – Biographical". Nobelprize.org. اطلع عليه بتاريخ 2017-11-18.
- ^ Eddington، A. S. (1920). "The Internal Constitution of the Stars" (PDF). Nature. ج. 106 ع. 2653: 233–40. Bibcode:1920Natur.106...14E. DOI:10.1038/106014a0. PMID:17747682.
- ^ أ ب Heilbron، J. L. (1974). H.G.J. Moseley: The Life and Letters of an English Physicist, 1887–1915. University of California Press. ISBN:0520023757.
- ^ أ ب ت Abraham Pais (1991). Niels Bohr's Times: In Physics, Philosophy, and Polity. Oxford University Press. ISBN:0-19-852049-2.
- ^ Heilbron، John (1966)، "The Work of H. G. J. Moseley"، Isis، ج. 57 ع. 3: 336–364، DOI:10.1086/350143، JSTOR:228365
- ^ Moseley، Henry G. J. (1913). "The High Frequency Spectra of the Elements". Philosophical Magazine. ج. 26 ع. 156: 1024–1034. DOI:10.1080/14786441308635052.
- ^ Bernard، Jaffe (1971)، Moseley and the numbering of the elements، Doubleday، ASIN:B009I5KZGM
- ^ Born، Max (2013)، Atomic Physics (ط. 8th)، Courier Corporation، ISBN:9780486318585
- ^ Kragh، Helge (2002). Quantum Generations: A History of Physics in the Twentieth Century (ط. Reprint). Princeton University Press. ISBN:978-0691095523.
- ^ "Oral History Interview: Niels Bohr, Session I". American Institute of Physics, Niels Bohr Library and Archives. 31 أكتوبر 1962. اطلع عليه بتاريخ 2017-10-25.
- ^ Reynosa، Peter (7 يناير 2016). "An Ode to Henry Moseley". Huffington Post. اطلع عليه بتاريخ 2017-11-16.
- ^ "This Month in Physics History: May 1932: Chadwick reports the discovery of the neutron". APS News. ج. 16 ع. 5. 2007. اطلع عليه بتاريخ 2017-11-16.
- ^ أ ب ت ث ج Rutherford, E. (1920). "Bakerian Lecture: Nuclear Constitution of Atoms". Proceedings of the Royal Society A. ج. 97 ع. 686: 374–400. Bibcode:1920RSPSA..97..374R. DOI:10.1098/rspa.1920.0040.
- ^ Rutherford, E. (1919). "Collision of α particles with light atoms". Philosophical Magazine. ج. 37: 571.
- ^ Urey، H.؛ Brickwedde، F.؛ Murphy، G. (1932). "A Hydrogen Isotope of Mass 2". Physical Review. ج. 39 ع. 1: 164–165. Bibcode:1932PhRv...39..164U. DOI:10.1103/PhysRev.39.164.
- ^ أ ب Feather, N. (1960). "A history of neutrons and nuclei. Part 1". Contemporary Physics. ج. 1 ع. 3: 191–203. Bibcode:1960ConPh...1..191F. DOI:10.1080/00107516008202611.
- ^ Harkins، William (1921). "The constitution and stability of atomic nuclei. (A contribution to the subject of inorganic evolution.)". Philosophical Magazine. ج. 42 ع. 249: 305. DOI:10.1080/14786442108633770.
- ^ Glasson, J.L. (1921). "Attempts to detect the presence of neutrons in a discharge tube". Philosophical Magazine. ج. 42 ع. 250: 596. DOI:10.1080/14786442108633801.
- ^ Rutherford reported acceptance by the British Association of the word proton for the hydrogen nucleus in a footnote to Masson، O. (1921). "XXIV. The constitution of atoms". Philosophical Magazine. Series 6. ج. 41 ع. 242: 281–285. DOI:10.1080/14786442108636219.
- ^ Pauli, W. (1985). "Das Jahr 1932 Die Entdeckung des Neutrons". Wolfgang Pauli Wissenschaftlicher Briefwechsel mit Bohr, Einstein, Heisenberg u.a. Sources in the History of Mathematics and Physical Sciences. ج. 6. ص. 105. DOI:10.1007/978-3-540-78801-0_3. ISBN:978-3-540-13609-5.
- ^ Hendry، John، المحرر (1 يناير 1984)، Cambridge Physics in the Thirties، Bristol: Adam Hilger Ltd (نُشِر في 1984)، ISBN:978-0852747612
- ^ أ ب Gamow G. (1931) Constitution of Atomic Nuclei and Radiation, Oxford: Clarendon Press
- ^ Crowther, J.G. (1971). "Rutherford the Great". New Scientist and Science Journal. ج. 51 ع. 3: 464–466. اطلع عليه بتاريخ 2017-09-27.
- ^ Brown، Laurie M. (1978). "The idea of the neutrino". Physics Today. ج. 31 ع. 9: 23. Bibcode:1978PhT....31i..23B. DOI:10.1063/1.2995181.
During the 1920s physicists came to accept the view that matter is built of only two kinds of elementary particles, electrons and protons.
- ^ Stuewer، Roger H. (1985). "Niels Bohr and Nuclear Physics". في French، A. P.؛ Kennedy، P. J. (المحررون). Niels Bohr: A Centenary Volume. Harvard University Press. ص. 197–220. ISBN:978-0674624160.
- ^ أ ب Stuewer، Roger (2018)، The Age of Innocence: Nuclear Physics between the First and Second World Wars، Oxford University Press، ISBN:9780192562906
- ^ Klein، O. (1929). "Die Reflexion von Elektronen an einem Potentialsprung nach der relativistischen Dynamik von Dirac". Zeitschrift für Physik. ج. 53 ع. 3–4: 157. Bibcode:1929ZPhy...53..157K. DOI:10.1007/BF01339716.
وسوم <ref> موجودة لمجموعة اسمها "arabic-abajed"، ولكن لم يتم العثور على وسم <references group="arabic-abajed"/> أو هناك وسم </ref> ناقص
