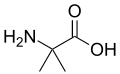
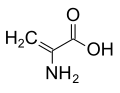
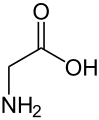
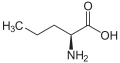
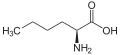
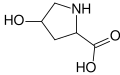
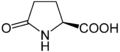
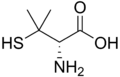
حمض أميني غير مولد للبروتين
هذه مقالة غير مراجعة. (يناير 2021) |

في الكيمياء الحيوية ، الأحماض الأمينية غير المشفرة أو غير البروتينية هي تلك الأحماض الأمينية غير المشفرة بشكل طبيعي أو الموجودة في الكود الجيني لأي كائن حي. على الرغم من استخدام 22 نوعًا من الأحماض الأمينية فقط (21 في حقيقيات النوى) من قبل الآلية الانتقالية لتجميع البروتينات ( الأحماض الأمينية البروتينية ) ، فمن المعروف أن أكثر من 140 من الأحماض الأمينية تحدث بشكل طبيعي في البروتينات وقد تحدث آلاف أخرى في الطبيعة أو يتم تصنيعها في المختبر. العديد من الأحماض الأمينية غير البروتينية جديرة بالملاحظة لأنها كذلك ؛
- وسيطة في التركيب الحيوي ،
- تشكلت بعد متعدية في البروتينات ،
- تمتلك دورًا فسيولوجيًا (مثل مكونات جدران الخلايا البكتيرية والناقلات العصبية والسموم ) ،
- مركبات دوائية طبيعية أو من صنع الإنسان ،
- موجودة في النيازك وفي تجارب البريبايوتيك (على سبيل المثال تجربة ميلر أوري ).
التعريف بالنفي[عدل]

من الناحية التقنية، أي مركب عضوي مع أمين (-NH 2) و حمض الكربوكسيلية (-COOH) مجموعة وظيفية هي الأحماض الأمينية. والأحماض الأمينية المكونة للبروتينات هي مجموعة فرعية صغيرة من هذه المجموعة التي تمتلك ذرة الكربون المركزية (α- أو 2-) تحمل مجموعة الأمينية، مجموعة الكربوكسيل، و سلسلة جانبية وlevo α الهيدروجين التشكل ، باستثناء الجلايسين ، وهو achiral ، والبرولين ، التي تعتبر مجموعتها الأمينية أمينات ثانوية وبالتالي يشار إليها كثيرًا باسم حمض إيمينو لأسباب تقليدية .
يشفر الكود الجيني 20 من الأحماض الأمينية القياسية لإدماجها في البروتينات أثناء الترجمة. ومع ذلك ، هناك نوعان إضافيان من الأحماض الأمينية البروتينية: سيلينوسيستين وبيروليزين . لا تحتوي هذه الأحماض الأمينية الغير قياسية على كودون مخصص ، ولكن تتم إضافتها بدلاً من كودون التوقف عند وجود تسلسل محدد ، كودون UGA وعنصر SECIS للسيلينوسيستين . تسلسل UAG PYLIS المصب للبيروليزين. جميع الأحماض الأمينية الأخرى تسمى «غير مولدة للبروتين»
-
سيلينوسيستين. يحتوي هذا الحمض الأميني على مجموعة سيلينول على الكربون بيتا
-
بيروليزين. يتكون هذا الحمض الأميني من خلال الانضمام إلى مجموعة ε-amino من ليسين حلقة بيرولين كربوكسيلية
هناك مجموعات مختلفة من الأحماض الأمينية:
- 20 من الأحماض الأمينية القياسية
- 22 حمض أميني مولد للبروتين
- أكثر من 80 من الأحماض الأمينية يتم إنشاؤها بطريقة حيوية بتركيزات عالية
- يتم إنتاج حوالي 900 عن طريق المسارات الطبيعية
- تم وضع أكثر من 118 من الأحماض الأمينية المصنعة هندسياً في البروتين
تتداخل هذه المجموعات ، لكنها ليست متطابقة. جميع الأحماض الأمينية المكونة للبروتين وعددها 22 تم تصنيعها حيويًا بواسطة الكائنات الحية ، بعضها وليس كلها ، غير حيوي (موجود في تجارب البريبايوتك والنيازك). يتم دمج بعض الأحماض الأمينية الطبيعية ، مثل النورليوسين ، بشكل انتقالي في بروتينات بسبب خيانة عملية تكوين البروتين. العديد من الأحماض الأمينية ، مثل الأورنيثين ، عبارة عن وسيطة أيضية يتم إنتاجها بطريقة بيولوجية ، ولكنها غير مدمجة في البروتينات. يؤدي التعديل اللاحق للترجمة لبقايا الأحماض الأمينية في البروتينات إلى تكوين العديد من الأحماض الأمينية البروتينية ، ولكن غير البروتينية. توجد الأحماض الأمينية الأخرى فقط في الخلطات اللاأحيائية (مثل α-methylnorvaline). تم إدخال أكثر من 30 من الأحماض الأمينية غير الطبيعية بشكل انتقالي في البروتين في الأنظمة الهندسية ، ومع ذلك فهي ليست حيوية.
التسمية[عدل]
بالإضافة إلى نظام الترقيم IUPAC للتمييز بين مختلف أنواع الكربون في جزيء عضوي ، عن طريق التعيين التسلسلي لرقم لكل كربون ، بما في ذلك تلك التي تشكل مجموعة كربوكسيلية ، يمكن أيضًا تسمية الكربون على طول السلسلة الجانبية للأحماض الأمينية بأحرف يونانية ، حيث أن الكربون ألفا هو الكربون اللولبي المركزي الذي يمتلك مجموعة كربوكسيل ، وسلسلة جانبية ، وفي الأحماض الأمينية ألفا ، مجموعة أمينية - لا يتم حساب الكربون في المجموعات الكربوكسيلية. (وبالتالي ، فإن أسماء IUPAC للعديد من الأحماض الأمينية غير البروتينية تبدأ بـ 2-amino- وتنتهي في -ic acid . )
أحماض أمينية طبيعية ولكنها غير L-α[عدل]
معظم الأحماض الأمينية الطبيعية عبارة عن أحماض أمينية ألفا في شكل L ، ولكن توجد بعض الاستثناءات.
غير ألفا[عدل]

توجد بعض الأحماض الأمينية غير ألفا في الكائنات الحية. في هذه الهياكل ، نزحت مجموعة الأمين أبعد من نهاية حمض الكربوكسيل لجزيء الأحماض الأمينية. وهكذا فإن الحمض الأميني يحتوي على مجموعة أمين مرتبطة بالكربون الثاني بعيدًا ، وحمض أميني يحتوي عليها في الثالث. تشمل الأمثلة- alanine وGABA و δ- aminolevulinic acid .
-
بيتا ألانين: حمض أميني ينتج عن الأسبارتات 1-ديكاربوكسيلاز ومقدمة لأنزيم أ والببتيدات كارنوزين وأنسرين .
-
γ- حمض أمينوبوتيريك (GABA): ناقل عصبي في الحيوانات.
تم ربط سبب استخدام الأحماض الأمينية ألفا في البروتينات بترددها في النيازك وتجارب البريبايوتك. تكهنات أولية حول الخصائص الضارة للأحماض الأمينية بيتا من حيث التركيب الثانوي، تبينت أنها غير صحيحة.
أحماض أمينية D[عدل]
تحتوي بعض الأحماض الأمينية على عكس chirality المطلقة ، والمواد الكيميائية التي لا تتوفر من آلات الترجمة / النسخ الريبوزومية العادية. تتشكل معظم جدران الخلايا البكتيرية بواسطة الببتيدوغليكان ، وهو بوليمر مكون من سكريات أمينية متشابكة مع ببتيدات قليلة الببتيدات قصيرة تربط بين بعضها البعض. قليل الببتيد مركب غير ريبوسومي ويحتوي على العديد من الخصائص المميزة بما في ذلك الأحماض الأمينية D ، بشكل عام D- ألانين و D- الجلوتامات. خصوصية أخرى هي أن الأول يتم فصله عن طريق إنزيمات ملزمة لـ PLP (مشفرة بواسطة alr أو homologue dadX ) ، في حين يتم فصل الأخير عن طريق إنزيم مستقل عامل مساعد ( murI ). بعض المتغيرات موجودة في Thermotoga spp. يوجد D-lysine وفي بعض البكتيريا المقاومة للفانكومايسين D-serine موجود (جين vanT ).[1][2]
في الحيوانات ، بعض الأحماض الأمينية D هي نواقل عصبية.
بدون هيدروجين على α-carbon[عدل]
تحتوي جميع الأحماض الأمينية البروتينية على هيدروجين واحد على الأقل في الكربون ألفا. يحتوي الجلايسين على اثنين من الهيدروجين ، وجميع الأنواع الأخرى بها هيدروجين وسلسلة جانبية واحدة. استبدال الهيدروجين المتبقي ببديل أكبر ، مثل مجموعة الميثل ، يشوه العمود الفقري للبروتين.
في بعض الفطريات ألفا الأمينية isobutyric حمض ينتج تمهيدا الببتيدات ، وبعضها يحمل خصائص المضادات الحيوية. هذا المركب يشبه ألانين, ولكن يمتلك مجموعة الميثيل إضافية على α-الكربون بدلا من الهيدروجين. ولذلك achiral. مركب آخر مشابه ألانين دون α-الهيدروجين هو dehydroalanineالتي تمتلك الميثيلين sidechain. وهو واحد من عدة طبيعيا dehydroamino الأحماض.
-
ألانين
-
حمض أمينويوبيريك
-
ديهيدروالانين
أحماض أمينية مزدوجة[عدل]
مجموعة فرعية من الأحماض الأمينية L-α غامضة فيما يتعلق بأي من الطرفين هو α-carbon. في البروتينات يمكن لبقايا السيستين أن تشكل رابطة ثاني كبريتيد مع بقايا سيستين أخرى ، وبالتالي تشابك البروتين. يشكل سيستين متشابك جزيء سيستين . يتم إنتاج السيستين والميثيونين عموما sulfurylation مباشرة، ولكن في بعض الأنواع التي يمكن أن تنتج عن طريق transsulfuration ، حيث تنشيط homoserine أو السيرين وتنصهر ل السيستين أو الحمض الاميني تشكيل سيستاتيونين . مركب مشابه هو اللانثيونين ، والذي يمكن رؤيته على أنه جزيئين ألانين مرتبطين عبر رابطة ثيوثير ويوجد في كائنات مختلفة. وبالمثل ، فإن حمض djenkolic ، وهو سم نباتي من حبوب جنكول ، يتكون من سيستين متصلتين بواسطة مجموعة ميثيلين. يستخدم حمض ديامينوبيمليك كجسر في الببتيدوغليكان ويستخدم كمقدمة لليسين (عن طريق نزع الكربوكسيل).
-
سيستين
-
سيستاثيونين
-
لانثيونين
-
حمض جينكوليك
-
حمض ديامينوبيمليك
الأحماض الأمينية البريبايوتيك والكيمياء الحيوية البديلة[عدل]
في النيازك وفي تجارب البريبايوتك (على سبيل المثال تجربة Miller – Urey ) تم العثور على العديد من الأحماض الأمينية أكثر من عشرين حمضًا أمينيًا قياسيًا ، والعديد منها بتركيزات أعلى من تلك القياسية: تم التخمين أنه إذا ظهرت الحياة القائمة على الأحماض الأمينية بالتوازي في مكان آخر في الكون ، فلا أكثر من 75٪ من الأحماض الأمينية ستكون مشتركة. الشذوذ الأكثر وضوحا هو نقص حمض أمينوبوتريك.
| نسبة الأحماض الأمينية نسبة إلى الجلايسين (٪) | ||
|---|---|---|
| مركب | التفريغ الكهربائي | نيزك مورشينسون |
| جليكاين | 100 | 100 |
| ألانين | 180 | 36 |
| حمض ألفا أمينو ن الزبد | 61 | 19 |
| نورفالين | 14 | 14 |
| فالين | 4.4 | |
| نورليوسين | 1.4 | |
| يسين | 2.6 | |
| آيسولوسين | 1.1 | |
| الويسولوسين | 1.2 | |
| تي ليسين | <0.005 | |
| حمض ألفا-أمينو- ن- هيبتانويك | 0.3 | |
| برولين | 0.3 | 22 |
| حمض البيبيكوليك | 0.01 | 11 |
| α ، حمض ديامينوبروبيونيك | 1.5 | |
| α ، حمض ديامينوبوتيريك | 7.6 | |
| أورنيثين | <0.01 | |
| ليسين | <0.01 | |
| حمض الأسبارتيك | 7.7 | 13 |
| حمض الجلوتاميك | 1.7 | 20 |
| سيرين | 1.1 | |
| ثريونين | 0.2 | |
| ألوثريونين | 0.2 | |
| ميثيونين | 0.1 | |
| الهوموسيستين | 0.5 | |
| الهوموسرين | 0.5 | |
| β- ألانين | 4.3 | 10 |
| β- أمينو- ن- حمض الزبد | 0.1 | 5 |
| حمض أمينويوبيريك | 0.5 | 7 |
| γ- حمض أمينوبوتيريك | 0.5 | 7 |
| حمض ألفا أمينويوبيريك | 7 | 33 |
| الايزوفالين | 1 | 11 |
| ساركوزين | 12.5 | 7 |
| N- إيثيل جلايسين | 6.8 | 6 |
| N- بروبيل جلايسين | 0.5 | |
| N- ايزوبروبيل جلايسين | 0.5 | |
| N- ميثيل ألانين | 3.4 | 3 |
| N- إيثيل ألانين | <0.05 | |
| N- ميثيل β- ألانين | 1.0 | |
| N- إيثيل β- ألانين | <0.05 | |
| ايزوسرين | 1.2 | |
| حمض ألفا هيدروكسي - بيتا أمينوبوتيريك | 17 |
السلسلة الجانبية المستقيمة[عدل]
تم وصف الكود الجيني على أنه حادث متجمد وأسباب وجود حمض أميني قياسي واحد فقط بسلسلة مستقيمة (ألانين) يمكن ببساطة أن يكون التكرار مع الفالين والليوسين والإيزولوسين. ومع ذلك ، تم الإبلاغ عن أن الأحماض الأمينية ذات السلاسل المستقيمة تشكل حلزونات ألفا أكثر استقرارًا.
-
جلايسين (سلسلة جانبية هيدروجين)
-
ألانين (سلسلة جانبية ميثيل)
-
Homoalanine ، أو حمض α-aminobutyric (سلسلة جانبية إيثيل)
-
نورفالين (سلسلة جانبية ن -بروبيل)
-
نورليوسين (سلسلة جانبية ن -بوتيل)
-
Homonorleucine ( n -pentyl side-chain) (حمض Heptanoic معروض)
كالكوجين[عدل]
سيرين, homoserine, O-ميثيل-homoserine و O-إيثيل-homoserine تمتلك hydroxymethyl ، هيدروكسيثيل, O-ميثيل-hydroxymethyl و O-ميثيل-هيدروكسي إيثيل سلسلة جانبية. في حين السيستين, الحمض الأميني ، ميثيونين و ethionine تمتلك ثيول حكمه. على selenol حكمه هي selenocysteine, selenohomocysteine, selenomethionine و selenoethionine. الأحماض الأمينية مع chalcogen أسفل كما وجدت في الطبيعة: العديد من الأنواع مثل الرشاشية الدخناء, Aspergillus terreus و Penicillium chrysogenum في غياب الكبريت قادرة على إنتاج ودمج إلى البروتين tellurocysteine و telluromethionine.
Hydroxyglycine ، وهو حمض أميني به سلسلة جانبية هيدروكسيل ، غير مستقل للغاية.
دورها[عدل]
في الخلايا ، وخاصة ذاتية التغذية ، تم العثور على العديد من الأحماض الأمينية غير البروتينية كمواد وسيطة أيضية. ومع ذلك ، على الرغم من المرونة التحفيزية للأنزيمات المرتبطة بـ PLP ، يتم تصنيع العديد من الأحماض الأمينية كأحماض كيتو (على سبيل المثال 4-ميثيل 2-أوكسوبنتانوات إلى لوسين) ويتم تربيتها في الخطوة الأخيرة ، وبالتالي الحفاظ على عدد الأحماض الأمينية غير البروتينية وسيطة منخفضة إلى حد ما.
تحدث الأورنيثين والسيترولين في دورة اليوريا ، وهي جزء من هدم الأحماض الأمينية (انظر أدناه).
بالإضافة إلى التمثيل الغذائي الأولي ، فإن العديد من الأحماض الأمينية غير البروتينية هي سلائف أو الإنتاج النهائي في التمثيل الغذائي الثانوي لصنع مركبات صغيرة أو ببتيدات غير ريبوسومية (مثل بعض السموم ).
دمج البروتين بعد المتعدية[عدل]
على الرغم من عدم تشفيرها بواسطة الشفرة الجينية كأحماض أمينية بروتينية ، إلا أن بعض الأحماض الأمينية غير القياسية توجد مع ذلك في البروتينات. تتشكل هذه عن طريق تعديل لاحق متعدية للسلاسل الجانبية للأحماض الأمينية القياسية الموجودة في البروتين الهدف. غالبًا ما تكون هذه التعديلات ضرورية لوظيفة البروتين أو تنظيمه ؛ على سبيل المثال، في غاما carboxyglutamate و كرسلة من الغلوتامات تسمح ملزمة أفضل من الكاتيونات الكالسيوم ، وفي الهيدروكسي برولين في الهيدروكسيل من البرولين أمر بالغ الأهمية للحفاظ على الأنسجة الضامة . مثال آخر هو تكوين hypusine في عامل بدء الترجمة EIF5A ، من خلال تعديل بقايا ليسين. يمكن أن تحدد مثل هذه التعديلات أيضًا توطين البروتين ، على سبيل المثال ، يمكن أن تؤدي إضافة مجموعات طويلة كارهة للماء إلى ارتباط البروتين بغشاء فوسفوليبيد .
-
حمض الكربوكسيجلوتاميك. في حين أن حمض الجلوتاميك يمتلك مجموعة γ-carboxyl واحدة ، يمتلك حمض الكربوكسيلوتاميك اثنتين.
-
هيدروكسي برولين. يختلف حمض الإيمينو هذا عن البرولين بسبب مجموعة الهيدروكسيل على الكربون 4.
هناك بعض الأدلة الأولية على أن حمض الأمينومالونيك قد يكون موجودًا ، ربما عن طريق سوء الدمج ، في البروتين.
النظائر السامة[عدل]
العديد من الأحماض الأمينية غير البروتينية سامة بسبب قدرتها على محاكاة خصائص معينة للأحماض الأمينية البروتينية ، مثل الثياليسين . بعض الأحماض الأمينية غير البروتينية سامة للأعصاب عن طريق محاكاة الأحماض الأمينية المستخدمة كناقلات عصبية (أي ليس للتخليق الحيوي للبروتين) ، على سبيل المثال حمض كيسكواليك أو كانافانين أو حمض أزيتيدين -2 كربوكسيليك . يحتوي السيفالوسبورين C على العمود الفقري لحمض α-aminoadipic (homoglutamate) الذي يتوسطه جزء من السيفالوسبورين. البنسيلامين هو حمض أميني علاجي ، طريقة عمله غير معروفة.
-
ثياليسين
-
حمض كيسكواليك
-
كانافانين
-
حمض أزيتيدين -2 كربوكسيليك
-
سيفالوسبورين سي
-
البنسيلامين
يمكن أن تشتمل السموم الزرقاء الموجودة بشكل طبيعي أيضًا على أحماض أمينية غير بروتينية. Microcystin و nodularin ، على سبيل المثال، على حد سواء المستمدة من ADDA ، وهو حمض أميني β.
الأحماض الغير أمينة[عدل]
التورين هو حمض أميني سلفونيك وليس من الأحماض الأمينية الكربوكسيلية ، ومع ذلك فإنه يعتبر أحيانًا مثل الكميات المطلوبة لقمع auxotroph في كائنات معينة (مثل القطط) أقرب إلى تلك الموجودة في «الأحماض الأمينية الأساسية» (ضمور الأحماض الأمينية) من الفيتامينات (العامل المساعد auxotrophy).
يتم اشتقاق الأوزموليت والساركوزين والجليسين بيتين من الأحماض الأمينية ، ولكن لها أمين ثانوي ورباعي على التوالي.
مراجع[عدل]
- ^ Boniface، A.؛ Parquet، C.؛ Arthur، M.؛ Mengin-Lecreulx، D.؛ Blanot، D. (2009). "The Elucidation of the Structure of Thermotoga maritima Peptidoglycan Reveals Two Novel Types of Cross-link". Journal of Biological Chemistry. ج. 284 ع. 33: 21856–21862. DOI:10.1074/jbc.M109.034363. PMC:2755910. PMID:19542229.
- ^ Arias، C. A.؛ Martín-Martinez، M.؛ Blundell، T. L.؛ Arthur، M.؛ Courvalin، P.؛ Reynolds، P. E. (1999). "Characterization and modelling of VanT: A novel, membrane-bound, serine racemase from vancomycin-resistant Enterococcus gallinarum BM4174". Molecular Microbiology. ج. 31 ع. 6: 1653–1664. DOI:10.1046/j.1365-2958.1999.01294.x. PMID:10209740.
| حمض أميني غير مولد للبروتين في المشاريع الشقيقة: | |
| |