كيمياء كهربائية
| صنف فرعي من | |
|---|---|
| جزء من | |
| يمتهنه | |
| التاريخ |

الكيمياء الكهربائية[1][2] أو الكيمياء الكهربية أو الكهروكيمياء[2] أو الكَهْرَكِيمياء[1] أحد فروع الكيمياء تدرس التفاعلات الحادثة عند سطوح الموصلات الكهربائية (مثل الإلكترودات المؤلفة من المعادن) وأشباه الموصلات (مثل الغرافيت) والمحاليل الشاردية مثل الكهارل.
إذا استطاع تفاعل كيميائي أن يتم بفضل جهد كهربائي أو استطاع التفاعل أن يولد جهدا كهربائيا كما في حالة البطاريات، عندها يسمى مثل هذا التفاعل إلكتروكيميائي. وبشكل عام تتم الكيمياء الكهربائية عن طريق تفاعلات كيميائية من نوع تفاعل أكسدة-اختزال. بشكل منفصل تفصل بينهما مسافة معينة يتم خلالها انتقال للالكترونات مما يتيح فرصة لتشكل جهد كهربائي وتيار كهربائي. أما انتقال الشحنة المباشر من جزيئ إلى آخر فلا يدخل في نطاق الكيمياء الكهربائية.
تعد جميع التفاعلات الكيميائية ذات طبيعة كهربية.و الكيمياء الكهربية في حقيقتها دراسة لظواهر الأكسدة والاختزال حيث تتناول دراسة التحول المتبادل بين الطاقة الكيميائية والكهربية ضمن إطار تفاعلات الأكسدة والاختزال التي تشكل قسمًا هامًا جدًا من التفاعلات الكيميائية
عندما يقترن تفاعل كيميائي بمرور تيار كهربائي تكون تلك العملية عملية كهروكيميائية. فإما أن يكون تفاعل اختزال بسبب جهد كهربائي موصول به من الخارج (كما في تحليل كهربائي)، أو ينشأ التيار الكهربائي من تفاعل كيميائي بين مواد مناسبة تكوّن جهدا كهربائيا (كما في خلية جلفانية). تلك الجهود الكهربائية التي هي من خصائص المواد المختلفة نجدها مدونة في قائمة الجهود القياسية. ولا يعتبر مجرد انتقال الإلكترونات بين جزيئات أو أيونات أو ذرات من العمليات الكهروكيميائية، ولكن من صفة العمليات الكهروكيميائية أنها تتميز بفصل مكان جريان تفاعل أكسدة وجريان تفاعل اختزال.
تجري تفاعلات الأكسدة والاختزال المميزة للكيمياء الكهربائية على السطح الفاصل بين القطب والكهرل. ولهذا يمكن تعريف الكيمياء الكهربائية بأنها علم العمليات التي تتم عل الأسطح الفاصلة بين أطوار مختلفة، أي بين قطب وكهرل.
تطبيقات الكيمياء الكهربائية[عدل]
- إنتاج المواد الكيميائية
- اختزال أملاح المعادن لتحضير المعادن عن طريق التحليل الكهربائي للأملاح المنصهرة، مثل تحضير الليثيوم، والصوديوم، والكالسيوم والبوتاسيوم والمغنسيوم والألمونيوم. وهنا يعمل التيار الكهربائي كمادة اختزال. ويعتبر التيار الكهربائي هو أقوى طرق الاختزال في الكيمياء. كما يستخدم فصل المعادن بواسطة التحليل الكهربائي في «التقنية الجلفانية».
- أكسدة الأنيونات، مثلما في أكسدة الهالوجينات لإنتاج الفلور والكلور عن طريق التحليل الكهربائي لكلوريد القلويات.
- يسمح التيار الكهربائي بتفاعلات اختزال من دون إضافة مادة اختزال أو مادة أكسدة.
- تحضير غاز الأوزون.
- التقنية الجلفانية
- تحضير الهيدروجين، مثل التحليل الكهربائي للماء.
- تحضير تيار كهربائي وعلى الأخص للأجهزة المحمولة:
- قياس الجهد الكهربائي عند القيام بعمليات التحليل الكهربائي:
- في أبحاث الترموديناميكا وتعيين سرعة التفاعلات الكيميائية، ودراسة الصدأ وتآكل المعادن.
- في بحوث تحليل مسلسلات الدنا.
اكتشاف الكيمياء الكهربائية[عدل]


كانت بحوث تشريح الضفدعة للعالم الإيطالي لويجي جلفاني هي المؤدية إلى اكتشاف ظاهرة الكيمياء الكهربية: تتقلص عضلات رجل الضفدعة عنما تتلامس أسلاك من معدنين مختلفين ملامسين لرجل الضفدعة. بعد ذلك استطاع أليساندرو فولتا في عام 1799 اختراع أول بطارية. فكانت البطارية هي أول مصدر - قبل اختراع توليد الكهرباء بواسطة مولد كهربائي للتيار الكهربائي، ساعدت فيما بعد على اكتشافات عظيمة، وكذلك اكتشاف وتحضير الصوديوم والبوتاسيوم والباريوم وسترونشيوم والكالسيوم والمغنسيوم وخلال السنوات 1807 / 1808 عن طريق العالم «همفري ديفي».
تمكن العالم الألماني «يوهان فيلهيلم ريتر» خلال القرن الثامن عشر من القيام ببحوث عن الجلفانية واخترع أول مركم. ثم جاء ميشيل فاراداي وأدخل الاصطلاحات قطب Elektrode , وكهرل electrolyt ، مصعد Anode ومهبط Kathode وأنيون Anion واكتشف عام 1832 قوانين فاراداي عن التحليل الكهربائي.
وحصل العالم ياروسلاف هيروفيسكي عام 1959 على جائزة نوبل في الكيمياء لاكتشافه طريقة تحليل كهروكيميائية، التصوير القطبي.
خلال الأعوام 1887/1894 اكتشف «فلهيلم أوستفالد» الألماني أن الخلية الكهربائية لا بد وأن يكون لها مستقبلا كبيرا. ومن ضمن انجازات القرن العشرين كانت خلية الوقود بالفعل جهازا مهما، ووجد تطبيقه في غزو الفضاء: ففي برنامج أبولو حيث هبط الإنسان على سطح القمر عام 1969 استخدمت خلايا وقود تعمل بالهيدروجين، كانت تحضر رواد الفضاء ماء الشرب.كذلك استخدمت خلال الوقود في مكوك الفضاء لتزويده التيار الكهربائي.
وفي وقتنا الحالي والمستقبل ستطبق خلايا الوقود في إنتاج الطاقة الكهربائية بشكل واسع لتخلف النفط والفحم، وكذلك في تسيير السيارات الكهربائية.
الأكسدة والاختزال[عدل]
تعبر الأكسدة والاختزال عن تغير حالة تأكسد تحدث للذرة أو لأيون أو جزيئ داخل في تفاعل كيميائي. فاصطلاح «تأكسد» معناه اكتساب ذرة «لشحنة كهربائية» في حالة أن تكون جميع رابطة روابطها بذرات أخرى من نوع رابطة أيونية بنسبة 100%. والذرة أو الأيون الذي يعطي إلكترون إلى ذرة أو أيون آخر تزداد حالة اكسدتها، والذرة المستقبلة للإلكترون تنخفض حالة أكسدتها. فالأكسدة والاختزال تجريان في آن واحد ويسمى ذلك تفاعل أكسدة-اختزال (بالإنجليزية redox reaction).
وعلى سبيل المثال، عندما تتفاعل درة صوديوم مع ذرة كلور، يعطي الصوديوم إلكترون واحد ويصل إلى حالة أكسدة +1. وتكتسب ذرة الكلور ذلك الإلكترون وتنخفض درجة أكسدتها بمقدار -1. وتعادل إشارة حالة الأكسدة (موجبة/أو سالبة) قيمة الشحنة الكهربية لكل أيون. ويرجع تكوين الرابطة الأيونية بين ذرة الصوديوم وذرة الكلور إلى تجاذب شحنتيهما المختلفتين.
افتقاد ذرة لإلكترونات يسمى «أكسدة» واكتساب ذرة أو جزيئ لإلكترونات هو «الاختزال» .
الأكسجين هو عامل الأكسدة المعتاد، لكنه ليس الوحيد. وعلى الرغم من التسمية، فلا يحتاج تفاعل الأكسدة إلى الأكسجين دائما. فعلى سبيل المثال، يمكن اشعال النار بمادة مؤكسدة أخرى غير الأكسجين مثل الفلور، وحتى حينما تشتعل النار بالفلور فيصعب إطفاؤها. ذلك بسبب أن الفلور يعتبر مادة مؤكسدة أشد من الأكسجين، حيث يمتلك سالبية كهربية أعلى من السالبية الكهربية للأكسجين.
الخلايا الكهروكيميائية[عدل]
الخلايا الكهروكيميائية هي خلايا تقوم بتحويل الطاقة الكيميائية إلى طاقة كهربائية أو العكس، نتيجة لحدوث عدد من تفاعلات الأكسدة والاختزال في الخلايا. من ضمن تلك الخلايا خلية جلفانية أو الخلية الفولتية المسميتان باسم صاحب كل منهما وهما العالمين لويجي جلفاني وإليساندرو فولتا. وقد قام هذان العالمان الإيطالييان بعدة تجارب وبحوث في التفاعلات الكيميائية وإنتاج التيار الكهربائي خلال القرن الثامن عشر.
وتحوي الخلية الكهروكيميائية قطبين موصلين للكهرباء (يسميان مصعد ومهبط). ويعرف المصعد بأنه القطب الذي يحدث عليه أكسدة عند تغطيسه في كهرل، والمهبط هو القطب الذي يجرى عليه عملية اختزال، وهويكون أيضا غاطسا في كهرل. تنتج الخلية الكهربية عندما نوصل بين القطبين فيسير تيار إلكترونات في خارج الخلية، كما يسير تيار أيونات داخل الخلية في الكهرل. ويمكن استخدام أنواعا عديدة من الأقطاب فقد تكون معادن أو شبه الموصلات أو الجرافيت وحتى مكثور موصل للكهرباء conductive polymer. ويوجد بين القطبين كهرل يحتوي على أيونات يمكنها الحركة لتكملة «الدائرة».
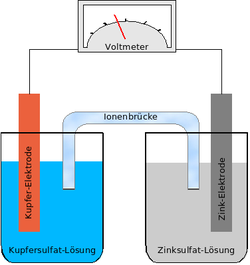
تستخدم الخلية الجلفانية قطبين من معدنين مختلفين، وكل منهما غاطس في كهرل. وبحسب نوع معدن القطب سيتأكسد أحدهما (مكونا المصعد anode) ويختزل القطب الآخر مكونا المهبط cathode. سيتأكسد معدن المصعد حيث تتغير بعض ذراته من حالة الأكسدة 0 (في المادة الصلبة) إلى حالة أكسدة موجبة ويصبح أيونا. أما على المهبط، يأتي الأيون المتحرر من المصعد خلال الكهرل يكتسب إلكترونا من المهبط، وتنخفض حالة أكسدة الأيون إلى 0. يتعادل الأيون ويترسب على سطح المهبط. ويجب توصيل القطبين ببعضهما بواسطة سلك من الخارج فيسمح بمرور الإكترونات المتجمعة على المصعد للاقتران بالأيونات على سطح المهبط. مرور الإكترونات هذا هو مرور تيار كهربائي، يمكن استغلاله في أداء شغل، مثل تحريك محرك أو إضاء لمبة.
الخلية الجلفانية التي تستخدم قطبين من الزنك والنحاس، الزنك غاطس في محلول سلفات الزنك والنحاس غاطس في محلول سلفات النحاس تسمى خلية دانيال.[3]
يجري على القطبين في خلية دانيان نصفي التفاعل الآتيين: [3]
- قطب الزنك (المصعد): Zn(s) → Zn2+(aq) + 2 e–
- قطب النحاس (المهبط): Cu2+(aq) + 2 e– → Cu(s)
يفقد الزنك إلكترونات (يتأكسد الزنك) مكونا أيونات زنك تذهب إلى المحلول، وتكتسب أيونات النحاس من قطب النحاس إلكترونات وتترسب على نحاس المهبط. وكما نرى يجري تيار كهربائي من المصعد إلى المهبط من ذاته خلال السلك خارج الخلية.
يمكن من الوجهة الترموديناميكية عكس العملية عن طريق توصيل القطبين بمصدر خارجي قوي للتيار الكهربائي فيترسب زنك على المصعد (قطب الزنك) وتتكون أيونات نحاس من قطب النحاس تذهب إلى المحلول. [3]
لكي تكتمل الدائرة الكهربائية في خلية دانيال يجب عمل قنطرة توصل بين كهارل المصعد والمهبط تمر خلالها الأيونات في المحلولين. وتعمل القنطرة إلى حد ما على عدم اختلاط المحلولين، بل تسمح فقط بمرور الأيونات. كما يمكن عمل القنطرة من ملح مذاب في هلام. وبينما تمر الإلكترونات في السلك خارج الخلية في الاتجاه من الزنك إلى قطب النحاس تسير الأيونات الموجبة الشحنة في المحلول في عكس الاتجاه، وتكتمل الدائرة.
ويمكن بواسطة فولتمتر قياس فرق الجهد الكهربائي بين المصعد والمهبط. ويسمى هذا الجهد الكهربائي الذي يقيسه الفولتمتر القوة الدافعة الكهربية.
صيغة خلية دانيال[عدل]
يمكن كتابة صيغة خلية دانيال لتتبع مرور إلكترونات الخلية الكهروكيميائية كالآتي:
- (Zn(s) | Zn2+ (1M) || Cu2+ (1M) | Cu(s
نبدأ بكتابة المعدن الذي يكوّن المصعد (Zn(s ، وتعني s صلب من كلمة solid. ويفصلها عن صورتها المؤكسدة خطا رأسيا الذي يمثل السطح بين الطور الصلب والطور السائل (سطح تغير الأكسدة). ثم نكتب خطين رأسيين يمثلان القنطرة الملحية بين نصفي الخلية. ثم نكتب الصورة المؤكسدة لمعدن المهبط (أيونات النحاس) في كهرل، ويفصلها عن لوح النحاس خطا رأسيا [النحاس في صورته المختزلة] (Cu(s.
كما نعطي تركيز المحلولين في الصيغة - وكل منهما في هذا المثال 1 مول - حيث أن تركيز المحلولين مهم في تحديد جهد الخلية.
طاقة جيبس الحرة والخلية الكهروكيميائية[عدل]
خلال عمل خلية كهروكيميائية تتحول طاقة كيميائية إلى طاقة كهربائية ونحسبها بحاصل ضرب القوة الدافعة الكهربائية في كمية الشحنة الكهربية المارة خارج الخلية.
- Electrical energy = Ecell. Ctrans
حيث:
- Ecell جهد الخلية بالفولت،
- Ctrans التيار المار خارج الخلية عبر الزمن ونقيسه بالكولوم. كما يمكن تعيينه بحاصل ضرب عدد الإلكترونات ب المول التي مرت خلال الفترة الزمنية مضروبا في ثابت فاراداي F.
والقوة الدافعة الكهربائية emf للخلية هي الجهد الأقصى بين القطبين عند عدم مرور تيار كهربائي. ويمكن منها حساب أقصى طاقة كهربائية يمكن الحصول عليها من تفاعل كيميائي. وتسمى تلك الطاقة «الشغل الكهربائي» ويُعبر عنه بالمعادلة الآتية:
- Wmax = Welectrical = –nF·Ecell,
حيث الشغل معُرف هنا كشغل موجب الإشارة، أي شغل مؤدى على النظام. وقد اتفق العلماء على أن يكون الشغل ذو إشارة موجبة إذا كان الشغل مؤدى على النظام، ويكون الشغل سالبا الإشارة إذا كان الشغل ناتجا من النظام (كما هو الحال في معادلتنا هنا)، يمكننا الاسفادة بالشغل الناتج، مثلا لإنارة لمبة.
ونظرا لكون طاقة غيبس الحرة هي أقصى كمية شغل يمكن الحصول عليها من نظام، فيمكننا كتابة المعادلة
- [4] على النحو التالي:
- ΔG = –nF·Ecell
حيث n يساوي عدد المولات من الإلكترونات.
يُنتج جهد موجب الإشارة تغيرا سالبا في طاقة غيبس الحرة ، وهذا اصطلاح بين العلماء في تحديد إن كان الشغل مؤدى من الخارج على النظام أو أن الشغل يؤديه النظام وينشره خارج النظام. وعندما يكون جهد الخلية موجبا الشحنة يكون مقترنا بتيار كهربائي من المهبط إلى المصعد خلال السلك خارج الخلية. وفي حالة التغلب على تيار الخلية عن طريق توصيلها بمصدر جهد أكبر خارجي، فيمر فيها تيار كهربائي في عكس الاتجاه، عندئذ نكون قد أدينا شغلا في في الخلية، ونتحدث في تلك الحالة عن «عملية تحليل كهربائي». [4]
ويمكن بواسطة تفاعل كيميائي كهربائي ذاتي (وهو تغير في طاقة جيبس الحرة أقل من الصفر) توليد تيار كهربائي في خلية كهروكيميائية. وهذا هو مبدأ جميع البطاريات وخلايا الوقود. ومثلا، يمكن اتحاد غاز الأكسجين O2 وغاز الهيدروجين H2 في خلية وقود فيتكون ماء وتنتشر طاقة عن هذا التفاعل (تفاعل ناشر للحرارة)، وهو مثال ينتج طاقة كهربائية وطاقة حرارية في نفس الوقت. [4]
وعلى العكس بالنسبة إلى تفاعل كهروكيميائي غير ذاتي، فيمكن تسييره عن طريق توصيله بمصدر كهربائي ذو جهد كهربائي. فيحدث تحليل كهربائي للماء، وينفصل غاز الأكسجين عن غاز الهيدروجين.
العلاقة بين ثابت التوازن K وطاقة جيبس الحرة لخلية كهروكيميائية هي كالآتي:
- ΔG° = –RT ln(K) = –nF·E°cell
وبتغيير المعادلة يمكننا الحصول على «الجهد القياسي» كدالة لثابت التوازن:
ويمكن كتابة المعادلة السابقة باللوغاريتم العشري ونحصل على القوة الدافعة الكهربائية للخلية:
جهد القطب القياسي[عدل]
[مقال رئيسي: جهد قياسي]
أنشئت جداول تحتوي على الجهد القياس لأقطاب من المواد المختلفة يمكن بواسطتها حساب جهد خلية مؤلفة من قطبين من مواد مختلفة. بقد أخذ جهد الهيدروجين كمرجع لمعايرة باقي المواد، ويسمى قطب قياسي للهيدروجين. يجري القطب القياسي للهيدروجين التفاعل التالي:
- 2 H+(aq) + 2 e– → H2
وهو يسمى عادة قطب اختزال إلا أنه يمكن استخدامة كقطب مصعد أو كقطب مهبط وهذا يعتمد على تفاعل القطب الآخر، إذا ما شكلنا من الإثنين خلية كهربية (خلية معايرة). ويعني القطب القياسي للهيدروجين أننا نقوم بتوصيل فقاقيع غاز الهيدروجين في الكهرل عند ضغط 1 ضغط جوي في كهرل حمضي يحتوي على فاعلية لأيونات الهيدروجين H+ قدرها 1 (تكون مساوية لتركيز H+] = 1 mol/liter ]).
ويوصل القطب القياسي للهيدروجين بأي قطب آخر بواسطة قنطرة لتكوين خلية جلفانية. فإذا كان القطب الآخر أيضا في الظروف القياسية فيكون جهد الخلية المقاس يعادل جهد القطب الثاني القياسي. ويعتبر جهد القطب القياسي للهيدروجين مساويا للصفر، وهذا طبقا للتعريف.
وتعطينا قطبية جهد القطب القياسي (موجبا أو سالبا) مقياسا لجهد الاختزال للقطب بالمقارنة بالقطب القياسي للهيدروجين. فإذا طان للقطب القياسي لمادة موجبا الجهد بالمقارنة بالقطب القياسي للهيدروجين فهذا معناه أنه قطب اختزال قوي، يعمل على أن يكون قطب القياسي للهيدروجين يقوم مقام المصعد (مثال على ذلك النحاس في محلول لكبريتات النحاس ويبلغ جهده القياسي 337و0 فولت).
وبالعكس إذا كان جهد القطب المقاس سالبا، فيكون القطب ذو قدرة أكسدة أعلى من القطب القياسي للهيدروجين (مثل قطب الزنك الموجود في محلول كبريتات الزنك حيث له -76و0 فولت). [3]
جهد الأكسدة لقطب معين يساوي جهده الختزالي ولكن بإشارة سالبة. ولمعرفة جهد الخلية القياسي فيمكن جسابه من قائمة جهد القطب القياسي وذلك لقطبي خلية. والقطب الذي يكون جهده أقل يكون هو المصعد ويجري عليه تفاعل أكسدة. ويمكن حساب قطب الخلية بأنه مجموع الجهد الاختزالي للمهبط وجهد الأكسدة للمصعد، طبقا للمعادلة:
- E°cell = E°red(cathode) – E°red(anode) = E°red(cathode) + E°oxi(anode)
فمثلا جهد القطب القياسي للنحاس:
- صيغة الخلية :
- (Pt(s) | H2(1 atm) | H+(1 M) || Cu2+ (1 M) | Cu(s
- E°cell = E°red(cathode) – E°red(anode)
في الطروف القياسية: درجة الحرارة (25 درجة مئوية) والضغط (1 ضغط جوي) وتركيز الكهرل (1 مول/لتر) نحصل على القوة الدافعة الكهربية التي يمكن قياسها بفولتمتر، وقدرها 34و0 فولت. وطبقا للتعريف يكون جهد القياسي للهيدروجين مساويا للصفر. وعل ذلك يكون النحاس هو المهبط وقطب الهيدروجين هو المصعد، أي:
- (Ecell = E°(Cu2+/Cu) – E°(H+/H2
أو:
- E°(Cu2+/Cu) = 0.34 V
اقرأ أيضا[عدل]
- نصف تفاعل
- جهد قياسي
- تفاعل كيميائي
- طاقة حرة ثرموديناميكية
- اختزال
- سالبية كهربية
- بطارية الرصاص
- تفكك كيميائي
- تفاعلات أكسدة-اختزال
- قطب قياسي للهيدروجين
- بنيامين ليفيتش
- الكيمياء الإلكترونية
- قياس الاستقطابية
- قياس فولتي
- خلية وقود قلوية
- تفاعل انتاج الهيدروجين
- محفز كهربائي
المراجع[عدل]
- ^ أ ب منير البعلبكي؛ رمزي البعلبكي (2008). المورد الحديث: قاموس إنكليزي عربي (بالعربية والإنجليزية) (ط. 1). بيروت: دار العلم للملايين. ص. 388. ISBN:978-9953-63-541-5. OCLC:405515532. OL:50197876M. QID:Q112315598.
- ^ أ ب أحمد شفيق الخطيب (2018). معجم المصطلحات العلمية والفنية والهندسية الجديد: إنجليزي - عربي موضح بالرسوم (بالعربية والإنجليزية) (ط. 1). بيروت: مكتبة لبنان ناشرون. ص. 260. ISBN:978-9953-33-197-3. OCLC:1043304467. OL:19871709M. QID:Q12244028.
- ^ أ ب ت ث Wiberg, pp. 215–216
- ^ أ ب ت Swaddle, pp. 308–314
وصلات خارجية[عدل]
| في كومنز صور وملفات عن: كيمياء كهربائية |



