سرطان الغدة الدرقية الحليمي
| سرطان الغدة الدرقية الحليمي | |
|---|---|
| Papillary thyroid cancer | |
سرطان الغدة الدرقية الحليمي
| |
| معلومات عامة | |
| الاختصاص | طب الأنف والأذن والحنجرة |
| المظهر السريري | |
| الأعراض | عقيدة درقية[1][2] |
| تعديل مصدري - تعديل | |
سرطان الغدة الدرقية الحليمي كما يعرف أيضاً بسرطانة الغدة الدرقية الحليمية[3][4]هو أكثر أنواع سرطانات الغدة الدرقية شيوعًا، ويمثل 75 إلى 85 في المائة من جميع حالات سرطان الغدة الدرقية.[5] يحدث بشكل أكثر تكرارًا عند النساء في الفئة العمرية 20-55.[3] وهو أيضًا نوع السرطان السائد لدى الأطفال المصابين بسرطان الغدة الدرقية، وفي المرضى الذين يعانون من سرطان الغدة الدرقية الذين لديهم إشعاع سابق في الرأس والرقبة.[6] غالبًا ما يكون جيد التمايز، بطيئ النمو وموضّع ومتمركز، على الرغم من أنه قابل للانتشار.
العلامات والأعراض[عدل]
في الغالب، لا تسبب معظم سرطانات الغدة الدرقية الحليمية أعراضًا، حيث أنها تكون عديمة الأعراض تمامًا. في الواقع، لن يعرف الكثير من المرضى أنهم مصابون بهذا النوع من السرطان، ولكن قد يلاحظ المرضى أنهم يعانون من عقيدات كبيرة وكتلة واضحة (أي كتلة يمكنهم الشعور بها) أو كتلة مرئية (أي كتلة يمكنهم رؤيتها). قد تسبب العقيدات الكبيرة جدًا أعراضًا انضغاطية تشمل صعوبة البلع، أو الشعور بأن الطعام «يعلق» عند البلع، وضغط أو ضيق في التنفس عند الاستلقاء. في حالات السرطان المتقدم الذي ينمو وينتشر في الهياكل المحيطة، قد يعاني المرضى من بحة في الصوت. العقد اللمفاوية المتضخمة في الرقبة تتعلق بالسرطان ويجب على المرضى الذين يعانون من أعراض انضغاطية كالأعراض الآنفة الذكر البحث عن التقييم الطبي على الفور.[7]
إن أكثر الأعراض شيوعًا هو تطور كتلة في الرقبة. ينشأ السرطان الحليمي عادة ككتلة صلبة أو غير منتظمة أو كيسية تأتي من أنسجة الغدة الدرقية العادية. هذا النوع من السرطان لديه نسبة شفاء عالية - معدلات البقاء على قيد الحياة لمدة 10 سنوات لجميع المرضى الذين يعانون من سرطان الغدة الدرقية الحليمي يقدر بأكثر من 90 ٪. يسمى الانتشار البعيد لسرطان الغدة الدرقية الحليمي بالانبثاث. يُقدّر انبثاث الورم الخبيث في العنق (والذي ينتشر عادةً إلى العقد الليمفاوية في الرقبة) بما يقارب 50٪ في الأورام الدرقية الحليمية الصغيرة، وبأكثر من 75٪ في الأورام الدرقية الحليمية الأكبر.[8]
عادة ما يصاحب وجود ورم خبيث في العقدة الليمفاوية في منطقة الرقبة معدل انتكاس أعلى، ولكن من غير زيادة معدل الوفاة. إن تشكل ورم خبيث من سرطان الغدة الدرقية الحليمي يعتبر غير شائع، ولكن عند حدوثه، قد ينتشر إلى الرئتين والكبد والعظام. سرطانات الغدة الدرقية الحليمية التي تغزو الأنسجة المحيطة بجوار الغدة الدرقية لديها مآلات أسوأ بكثير بسبب ارتفاع معدل تكرار الإصابة بها.[8]
خصائص سرطان الغدة الدرقية الحليمي تشمل ما يلي:[8]
- تتراوح أعمار المصابين من 30 إلى 50 عامًا.
- سرطان الغدة الدرقية الحليمي أكثر شيوعًا عند الإناث مقارنةً بالذكور بنسبة 3:1.
- يرتبط المآل مباشرة بحجم الورم. إذا كان الورم أقل من 1.5 سم (1/2 بوصة)، فالمآل سيكون عادةً جيد.
- يرتبط المآل مباشرة بالعمر أيضاً. المرضى الذين تقل أعمارهم عن 55 عامًا لهم مآلات أفضل بكثير من المرضى الذين تزيد أعمارهم عن 55 عامًا.
- يرتبط المآل مباشرة بالجنس أيضاً. لدى النساء مآلات أفضل بكثير من الرجال في سن مماثلة.
- يمثل هذا السرطان 85٪ من سرطانات الغدة الدرقية بسبب التعرض للإشعاع.
- في أكثر من 50٪ من الحالات، ينتشر الورم إلى العقد اللمفاوية في الرقبة.
- الانتشار البعيد (إلى الرئتين أو الكبد أو العظام) غير شائع.
- معدل الشفاء الكلي مرتفع جدًا (يقارب 100 ٪ للآفات الصغيرة في المرضى الصغار).
الأسباب[عدل]
لا يوجد سبب دقيق معروف لسرطان الغدة الدرقية الحليمي. يعتقد الباحثون في هذا المجال بوجود حالات وراثية معينة يمكن أن تزيد من احتمالات الإصابة، مثل بعض الأمراض الوراثية كداء السلائل الورمي الغدي العائلي (FAP)، ومتلازمة غاردنر، ومرض كاودن.[9] فضلاً عن ذلك، تاريخ العائلة يمكن أن يعتبر أحد الأسباب بحيث أنه في عدد قليل من الحالات، ينتقل سرطان الغدة الدرقية الحليمي في الأسرة عبر الوراثة. كما أن العلاج الإشعاعي قد يزيد من احتمالات الإصابة.[9] على الرغم من أن الباحثين يعتقدون أن الطفرات الجينية تشارك في تطور سرطان الغدة الدرقية الحليمي، إلا أنهم لا يعرفون غالبًا سبب حدوث هذه التغييرات الجينية.[10]
تصبح خلايا الغدة الدرقية سرطانية عندما تتسبب التشوهات الجينية في تحورها. غالبًا ما تحدث هذه التشوهات بسبب العوامل البيئية (مثل التعرض للإشعاع). في حالات أقل، قد يتم وراثة تشوهات الجينات. ولكن في كثير من الأحيان، لا يُفهم سبب حدوثها. هذه الطفرات الجينية تجعل الخلايا تنمو وتتكاثر بشكل غير طبيعي وغير منضبط. وعلى عكس الخلايا السليمة، لا تموت هذه الخلايا غير الطبيعية. عندما ينمو عدد هذه الخلايا، فإنها تشكل في النهاية ورمًا، ويمكن للورم مهاجمة الأنسجة السليمة في أجزاء أخرى من الجسم والانتشار فيها.[10]
الطفرات المرتبطة بالمرض[عدل]
الطفرات المرتبطة بسرطان الغدة الدرقية الحليمي تأخذ أساساً شكلين من أشكال الطفرات: الشكل الأول هو الانتقال الكروموسومي والشكل الآخر هو الطفرات النقطية. تؤدي هذه الطفرات إلى تنشيط مسار مسرطن شائع - وهو مسار MAPK / ERK.
تحدث عمليات الانتقال الكروموسوميالتي تنطوي على طليعة الجين الورمي RET(والتي تُشفر لمستقبلاتكيناز التيروسينالتي تلعب أدوارًا أساسية في تطوير الخلايا العصبية الصماء) الموجودة على الكروموسوم10q11 في حوالي خُمس السرطانات الدرقية الحليمية.
ما يناهز الثلث إلى النصف من سرطانات الغدة الدرقية الحليمية تحتوي على طفرات نقطية في الجينات الورمية BRAF، كما تقوم بتفعييل مسار MAPK / ERK.[11]في تلك الحالات، كانت طفرات BRAF التي تم اكتشافها عبارة عن طفرة V600E. وفقًا للدراسات الحديثة، تميل السرطانات الحليمية التي تحمل طفرة V600E الشائعة إلى الحصول على مسار أكثر عدوانية على المدى الطويل. تحدث طفرات BRAF بشكل متكرر في السرطان الحليمي وفي سرطانات غير متمايزة تطورت من أورام حليمية. إن حدوث انتقالات ret / PTC تكون أعلى بكثير في سرطانات الدرقية الحليمية التي تنشأ عند الأطفال وكذلك بعد التعرض للإشعاع.[12]إضافة إلى ذلك، فإن الجين NTRK1(المسؤول عن التشفير لمُستقبِلTrkA)، الموجود على الكروموسوم 1q، ينتقل بشكل مشابه في حوالي 5% إلى 10% من سرطانات الغدة الدرقية الحليمية.[13]
يجري حالياً دراسة العديد من التغييرات في التعبير الجينيللسرطانات بشكل عام. أظهرت الدراسات السابقة خلل في تنظيم مختلف أنواع الرنا الميكرويفي سرطان الغدة الدرقية. على سبيل المثال، يبدو أن نقص تنظيم miR-369-3p وما يتبع ذلك من زيادة التنظيمالTSPAN13 يكون بشكل أو بآخر متعلق بالفيزيولوجيا المرضية للسرطان الدرقي الحليمي.[14]
يعتقد الباحثون أن التغيرات في بعض الجينات تؤدي إلى نمو خلايا الغدة الدرقية والانقسام بشكل غير طبيعي، وقد يتسبب ذلك في تطور سرطان الغدة الدرقية الحليمي. هناك العديد من الجينات التي تم ربطها بهذا الشكل من سرطان الغدة الدرقية ويمكن تلخيصها فيما يلي:[10]
- جين RET / PTC: تظهر طفرات في جين RET / PTC في 10 ٪ إلى 30 ٪ من مرضى سرطان الغدة الدرقية الحليمي، على الرغم من أنها أكثر شيوعًا في الأطفال أو أولئك الذين تعرضوا للإشعاع.
- جين BRAF: تم العثور على طفرات جين BRAF في 30 ٪ إلى 70 ٪ من المرضى. على عكس طفرة RET، تكون طفرات BRAF أقل شيوعًا في الأطفال وأولئك الذين تعرضوا للإشعاع. يعتقد الباحثون أن طفرات BRAF تنتج سرطانات أكثر عدوانية تنتشر في كثير من الأحيان (تنتشر إلى أجزاء أخرى من الجسم).
- وقد ربط العلماء أيضًا التغييرات في جينات NTRK1 و MET بسرطان الغدة الدرقية الحليمي. ولكن يجب إجراء المزيد من الأبحاث لتحديد ما الذي يسبب هذه الطفرات، وما إذا كانت قد تسبب سرطان الغدة الدرقية الحليمي.[10]
التشخيص[عدل]
عادة ما يتم اكتشاف سرطان الغدة الدرقية الحليمي في الفحص الروتيني كعقيدة درقية عديمة الأعراض تظهر على شكل كتلة في الرقبة. في بعض الحالات، قد تكون الكتلة تسببت في ظهور أعراض موضعية. يتم فحص هذه الكتلة عادةً عن طريق خزعة دقيقة بالإبرة (FNA) للتحقيق فيها. دقة الخزعة بالإبرة عالية للغاية وهي عملية تستخدم على نطاق واسع في هذه الحالات. تشمل طرق التحقيق الأخرى التصوير بالموجات فوق الصوتية والتصوير النووي. يمكن استخدام الموجات فوق الصوتية كاختبار مفيد للتمييز بين الآفات الصلبة والكيسية ولتحديد التكلسات. كما أن الموجات فوق الصوتية للغدة الدرقية فعالة جدًا في اكتشاف الأورام الصغيرة، والتي تشير إلى أورام سرطانية صغيرة جدًا (<1 سم).
يتم اكتشاف سرطانات الغدة الدرقية الحليمية أيضًا عندما يتم العثور على عقيدة صلبة في تضخم الغدة الدرقية المتعدد العقيدات، أو عندما يتم الكشف عن تضخم العقد اللمفية الرقبية، أو عند وجود آفات انبثاثية غير معروفة في مكان آخر من الجسم.[15] يجب فحص الآفات المتوسعة الموجودة في الغدة الدرقية، خاصة إذا كانت مؤلمة، لأنها قد تشير إلى وجود سرطان الغدة الدرقية الحليمي. العلامات السريرية الأخرى التي يمكن أن تشير إلى الغدة الدرقية الحليمية هي تثبيت القصبة الهوائية، وكتلة العنق الثابتة، وتلف الأعصاب الحنجرية الراجعة أو الجهاز الودي الرقبي (العنقي). يمكن أن يكون لدى خمسة في المائة من السكان عقيدات في الغدة الدرقية، وستكون الأغلبية حميدة.[16]
الواسمات الورمية[عدل]
يمكن استخدام الغلوبيولين الدرقي كواسم ورمي لسرطان الغدة الدرقية الحليمي المتمايز.[17][18] قد يكون صبغ HBME-1 مفيدًا للتمييز بين الأورام الحليمية والجريبية؛ في الآفات الحليمية تميل إلى أن تكون إيجابية.[19]
يرتبط التعبير المنخفض للجين ATP5E بشكل كبير بتشخيص سرطان الغدة الدرقية الحليمي وقد يكون بمثابة الواسم الورمي المبكر للمرض.[20]
علم الأمراض[عدل]
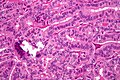
سرطان الغدة الدرقية الحليمي يحصل على اسمه من الحليمات المتواجدة بين خلاياه، والتي يمكن رؤيتها في الفحص المجهري. وتشمل ميزاته ما يلي:
- مشتملات نووية[21] وأجسام رملية على الفحص المجهري الخفيف. الأول مفيد في تحديد الشكل الجريبي لسرطان الغدة الدرقية الحليمي.[22]
- الانتشار اللمفاوي أكثر شيوعًا من الانتشار الدموي.
- تعددية البؤرات أمر شائع.
- إن ما يُسمى بالغدة الدرقية الزائغة الجانبية هو في الواقع ورم خبيث في الغدد الليمفاوية من نوع سرطان الغدة الدرقية الحليمي.[23]
على الرغم من أن السرطان الحليمي لديه ميل لأن يغزو الأوعية اللمفاوية، إلا أنه أقل عرضة لغزو الأوعية الدموية.[24]هذه الأنواع من الأورام غالبًا ما تكون غير مغلفة، ولديها ميل كبير للانتقال موضعياً إلى العقد الليمفاوية، والتي قد تنتج هياكل كيسية بالقرب من الغدة الدرقية، مما يُصعّب تشخيصها بسبب قلة الأنسجة الخبيثة.[25][26]علاوة على ذلك، قد تنتقل الأورام الحليمية إلى الرئتين وتنتج القليل من العقيدات أو قد تظهر حقول الرئة مظهر ندفة الثلج طوال الوقت.
الخصائص الأخرى للسرطان الحليمي هي أن E.M يظهر زيادة في أعداد الميتوكوندريا، وزيادة RER، بالإضافة إلى زيادة الزغيبات القمية. علاوة على ذلك، فإن الأورام الحليمية لها نمو بطيء، و 40 بالمائة من الحالات تنتشر خارج المحفظة.[27]
-
صورة مجهرية توضح أن الحليمات في سرطان الغدة الدرقية الحليمي تتكون من خلايا مكعبية الشكل. صبغة H&E.
-
صورة مجهرية (عرض عالي القدرة) تظهر التغيرات النووية في سرطان الغدة الدرقية الحليمي (PTC)، والتي تشمل تشكل التلم، والتصفية البصرية، والاشتمالات اليوزينية وتداخل النوى. صبغة H&E.
-
صورة مجهرية (منظر عالي القدرة) لـ PTC توضح التصفية النووية والنوى المتداخلة. صبغة H&E.
-
صورة مجهرية لسرطان الغدة الدرقية الحليمي. تكبيير عالي صبغة H&E .
-
صورة مجهرية لسرطان الغدة الدرقية الحليمي، تكبير متوسط. صبغة H&E.
العلاج/الإدارة[عدل]
تبقى الجراحة هي الدعامة الأساسية لعلاج سرطان الغدة الدرقية الحليمي. تنص الإرشادات المنقحة لعام 2009 للجمعية الأمريكية للغدة الدرقية أن الإجراء الأولي لسرطان الغدة الدرقية الحليمي يجب أن يكون استئصال الغدة الدرقية بشكل كامل أو شبه كامل. قد يكون استئصال الفص الدرقي وحده علاجًا كافيًا للسرطان الحليمي الصغير (<1 سم)، حيث يكون منخفض الخطورة، أحادي البؤرة، داخل الخلايا الحليمية في حالة عدم وجود تشعع سابق للرأس والرقبة أو إنبثاث عقيدي عنقي (رقبي) سريري أو إشعاعي.[28]
- الحد الأدنى من المرض (يصل قطر الورم إلى 1.0 سم) - قد يكون استئصال الغدة الدرقية (أو استئصال الفص أحادي الجانب) واستئصال برزخ الغدة الدرقية كافيين. هناك بعض النقاش حول ما إذا كان هذا لا يزال الخيار الأفضل لاستئصال الغدة الدرقية الكامل لهذه المجموعة من المرضى. يسمى هذا الإجراء باستئصال الغدة الدرقية النصفي.
- المرض الإجمالي (يربو قطر الورم عن 1.0 سم) - استئصال الغدة الدرقية الكامل، وإزالة العقدة الليمفاوية في المقصورة المركزية هو العلاج المفضل. يمكن إزالة عقد الرقبة الجانبية الإضافية في نفس الوقت إذا كانت نتائج الخزعة بالإبرة الموجّهة بالموجات فوق الصوتية وغلوبيولين الدرقية TG إيجابين لتقييم الموجات فوق الصوتية لعقيدة الرقبة قبل العملية الجراحة.
يزعم بعض الخبراء أنه إذا كانت هذه الأورام صغيرة ولا تغزو أنسجة أخرى (وهذه هي الحالة المعتادة)، فإن إزالة الفص (أحادي الجانب) من الغدة الدرقية الذي يحوي الورم والجزء المركزي الصغير المسمى البرزخ سيوفر حالة جيدة، وفرصة الشفاء ستكون مماثلة لإزالة الغدة الدرقية بالكامل. يستشهد هؤلاء المؤيدون لهذا النوع من العلاج الجراحي المحافظ (استئصال الغدة الدرقية النصفي) بالمعدل المنخفض لتكرار الورم السريري (5 ٪ إلى 20 ٪)، (على الرغم من حقيقة أنه يمكن العثور على كميات صغيرة من الخلايا السرطانية في ما يصل إلى 88 ٪ من أنسجة الفص الأخر (أي الجانب الآخر) للغدة الدرقية). كما يستشهدون ببعض الدراسات التي تظهر خطرًا متزايدًا وإصابات عصبية حنجرية متكررة في المرضى الذين يخضعون لاستئصال كامل للغدة الدرقية (لأنها عملية على جانبي الرقبة).[29]
في المقابل، يستشهد أنصار الاستئصال الكامل للغدة الدرقية (جراحة أكثر شمولاً) بالعديد من الدراسات الكبيرة التي تظهر أنه إذا تمت العملية الجراحية من قبل خبراء خبيريين، فإن حدوث إصابة في العصب الحنجري الراجع وقصور جارات الدوقية الدائم سيكون منخفض جدًا (حوالي 2 ٪). الأهم من ذلك، تظهر هذه الدراسات أن المرضى الذين يخضعون لاستئصال الغدة الدرقية الكامل متبوعًا بالعلاج باليود المشع وقمع الغدة الدرقية، لديهم معدل تكرار أقل بشكل ملحوظ ومعدل وفيات أقل عندما تكون الأورام أكبر من 1.5 سم. لا يبدو أن معدلات البقاء (المآل) تتأثر بمدى جراحة الغدة الدرقية.[29]
إضافة إلى الجدل هذا كله، قامت الدراسات السريرية في طوكيو ومدينة نيويورك بالتحقيق في سلامة مراقبة سرطانات الغدة الدرقية الحليمية الأصغر بكثير والتي ليس لديها أي دليل على انتشار العقدة الليمفاوية في المرضى الذين لم يتلقوا علاجًا سابقًا لهذا النوع من السرطان. تم إجراء الدراسة الأكثر شمولًا في اليابان. تشير النتائج إلى أنه في المرضى المختارين جيدًا الذين يعانون من سرطانات الغدة الدرقية الحليمية الصغيرة، يشهد عدد قليل من المرضى تقدماً في المرض من خلال الأدلة على نمو السرطان أو يعانون من انبثاث السرطان إلى العقد الليمفاوية في الرقبة خلال فترات المراقبة. ومع ذلك، حتى المبادئ التوجيهية لجمعية الغدة الدرقية الأمريكية تشير إلى أن الأورام الصغيرة (التي يقل حجمها عن سنتيمتر واحد) يجب ألا يتم أخذ خزعة بشكل روتيني ما لم يكن هناك دليل على وجود العقد الليمفاوية غير الطبيعية في الرقبة.[29]
بناءً على هذه الدراسات والتاريخ الطبيعي المعروف للسرطان الحليمي، تعد الجراحة العلاج الأكثر شيوعًا لسرطان الغدة الدرقية الحليمي في جميع أنحاء العالم. يعتمد مدى ونوع العملية الموضحة لسرطان الغدة الدرقية الحليمي على تقييم الخبراء وتجربة الجراح. فيما يلي خطة مقترحة بشكل شائع لعلاج سرطان الغدة الدرقية الحليمي: يمكن علاج الأورام الحليمية المقيدة جيدًا والمعزولة وأقل من 2.5 سم في المرضى الصغار (من 20 إلى 40 عامًا)، دون تاريخ التعرض للإشعاع، عن طريق استئصال فص (وفي بعض الحالات برزخ) الغدة الدرقية (يسمى أيضًا استئصال الغدة الدرقية النصفي، وإزالة نصف الغدة الدرقية).[29]
فيما يخص الخيار الجراحي الآخر للمرضى الذين يعانون من سرطان الغدة الدرقية الحليمي (أي استئصال الغدة الدرقية الكامل)، فيجب طلب تقييم وفحص ما قبل الجراحة لتحديد ما إذا كان هناك أي ورم في الغدد الليمفاوية في الرقبة. في معظم الحالات، يمكن تحديد إصابة العقد اللمفاوية بالرقبة قبل إجراء جراحة الغدة الدرقية. عندما يكون هناك دليل على أن سرطان الغدة الدرقية الحليمي قد انتشر إلى العقد الليمفاوية في الرقبة، يجب إجراء مقاربات جراحية للعقد الليمفاوية المركزية والجانبية. عندما تكون الغدد الليمفاوية في العنق مصابة بسرطان الغدة الدرقية الحليمي، إما أثناء تقييم سرطان الغدة الدرقية الحليمي أو أثناء جراحة سرطان الغدة الدرقية الحليمي، فإن العملية الموصى بها هي استئصال الغدة الدرقية بالكامل.[30]
في كثير من الأحيان، هناك خصائص أخرى للورم يمكن رؤيتها تحت المجهر والتي قد يكون لها تأثير على ما إذا كان يجب على الجراح إزالة الغدة الدرقية بالكامل (مثل غزو الأوعية الدموية، غزو الأعصاب، وغزو الأنسجة الرخوة أو نمو سرطان الغدة الدرقية الحليمي خارج حدود الغدة الدرقية وغزو المحفظة).
باختصار، يمكن تلخيص الادعاءات التي تدعم استئصال الغدة الدرقية الكامل كما يلي:[31]
- تقليل خطر التكرار، إذا تمت إزالة العقيدات المركزية أثناء الجراحة الأصلية.
- 30-85٪ من السرطانات الحليمية تعتبر متعددة البؤر. قد يترك استئصال الغدة الدرقية النصفي مرضًا في الفص الآخر. ومع ذلك، قد لا يصبح المرض متعدد البؤر في الفص المتبقي بالضرورة وقد يصبح إما غير مهمًا سريريًا أو قد يكون ضارًا لبقاء المريض.
- سهولة المراقبة باستخدام الغلوبولين الدرقي (حيث تزداد حساسية ازالة الانتكاسات في حال وجود استئصال كامل للغدة الدرقية، واستئصال الغدة الدرقية الطبيعية المتبقية بجرعة منخفضة من اليود المشع 131 بعد اتباع نظام غذائي منخفض من اليود (LID)).
- سهولة الكشف عن أي مرض انبثاثي بواسطة الغدة الدرقية والعقيدة العنقية (الرقبية) بالموجات فوق الصوتية.
- إن مضاعفات ما بعد الجراحة في مراكز جراحة الغدة الدرقية ذات الحجم الكبير مع الجراحين ذوي الخبرة قابلة للمقارنة مع استئصال الغدة الدرقية النصفي.
في المقابل، الادعاءات التي تدعم استئصال الغدة الدرقية النصفي هي:
- يعاني معظم المرضى من سرطان منخفض الخطورة مع مآل ممتاز، ونتائج بقاء مماثلة في المرضى ذوي المخاطر المنخفضة الذين يخضعون لاستئصال الغدة الدرقية الكامل مقابل استئصال الغدة الدرقية النصفي.
- احتمالية أقل لاحتياج المريض إلى استبدال هرمون الغدة الدرقية مدى الحياة بعد الجراحة.
تعد عمليات فحص الجسم الكلي للغدة الدرقية أقل موثوقية في العثور على الانتكاس من TG والموجات فوق الصوتية.
تميل الأورام الحليمية إلى أن تكون أكثر عدوانية في المرضى الذين تزيد أعمارهم عن 45 عامًا. في مثل هذه الحالات، قد تكون هناك حاجة لإجراء استئصال أكثر شمولاً بما في ذلك أجزاء من القصبة الهوائية. كما قد يجب إزالة العضلة القصية الترقوية الحلمية والوريد الوداجي والعصب الإضافي إذا سمح هذا الإجراء باستئصال الورم بشكل كامل. إذا تم ترك كمية كبيرة من الورم في الرقبة، فهندها يتوجب العلاج بالأشعة وقد أثبتت الأشعة فعاليتها خاصة في الحالات التي لا يأخذ فيها الورم المتبقي اليود المشع.
بعد الاستئصال الجراحي للغدة الدرقية، ينتظر المريض من 4 إلى 6 أسابيع حتى يتلقى العلاج باليود المشع. يهدف هذا العلاج إلى الكشف عن أي انبثاث أو أنسجة ورمية متبقية في الغدة الدرقية وتدميرها. يمكن تكرار العلاج بعد 6-12 شهرًا من العلاج الأولي لمرض الانبثاث حيث يتكرر المرض أو أنه لم يستجب للعلاج بالكامل.[32]
يتم إعطاء المرضى ليفوثيروكسين بديل للهرمون مدى الحياة بعد الجراحة، خاصة بعد استئصال الغدة الدرقية الكامل. أثبت العلاج الكيميائي باستخدام سيسبلاتين أو دوكسوروبيسين فعالية محدودة، ومع ذلك، يمكن أن يكون مفيدًا للمرضى الذين يعانون من نقيلة عظمية لتحسين جودة حياتهم. يوصف المرضى أيضًا ليفوثيروكسين واليود المشع بعد الجراحة. يؤثر ليفوثيروكسين على نمو ونضوج الأنسجة وهو يشارك في النمو الطبيعي والاستقلاب والتطور. في حالة وجود انبثاث، يتم علاج المرضى باستخدام عوامل مضادة للأورام تمنع نمو الخلايا وتكاثرها وتساعد في تخفيف الأعراض في المرض التدريجي.
بعد العلاج الناجح، قد يعاني 35 بالمائة من المرضى من تكرار المرض خلال فترة 40 عامًا. فضلاً عن ذلك، قد يعاني المرضى من نسبة عالية من ورم خبيث العقيدات، مع 35 في المئة من حالات انبثاث العقيدة العنقية. يصاب حوالي 20 بالمائة من المرضى بأورام متعددة داخل الغدة الدرقية.[33]
هناك جدل مستمرة بشأن أفضل إدارة ممكنة فيما يتعلق بالإجراء الجراحي الأمثل لسرطان الغدة الدرقية الحليمي. يعتمد مآل المرضى الذين يعانون من سرطان الغدة الدرقية الحليمي بشكل أساسي على عمر المريض، وحجم الورم، ووجود أي انبثاث، ووجود غزو ورمي في الأنسجة المجاورة بالقرب من الغدة الدرقية. درست الأبحاث الحديثة نهجًا أكثر تحفظًا في الجراحة وأثبتت أن استئصال الغدة الدرقية النصفي قد يكون مقبولًا للمرضى الذين يعانون من سرطان الغدة الدرقية الحليمي منخفض الخطورة (حجم الورم من 1 سم إلى 4 سم) مع عدم وجود غزو للأنسجة المحيطة بالغدة الدرقية وفي حال عدم وجود أي انبثاث. خلصت الدراسات التي فحصت قواعد البيانات الكبيرة للمرضى المصابين بسرطان الغدة الدرقية الحليمي إلى عدم وجود ميزة للبقاء على قيد الحياة للمرضى الذين يعانون من المرحلة الأولى من سرطان الغدة الدرقية الحليمي (من 1 إلى 4 سم) الذين يتلقون استئصال الغدة الدرقية الكامل مقابل استئصال الغدة الدرقية النصفي. في ضوء هذه البيانات، يجب أن ينطوي اختيار الخيار الأمثل للإدارة الجراحية والطبية لسرطان الغدة الدرقية الحليمي على اتخاذ قرارات مشتركة وتشورات بين كل من المريض وأطباء الغدد الصماء والجراحين.
المآل[عدل]
تستند إحصائيات المآل على دراسة مجموعات لا على التعيين من مرضى السرطان الدرقي الحليمي. لا يمكن لهذه الإحصائيات التنبؤ بمستقبل المريض على المستوى الفردي، لكنها يمكن أن تكون مفيدة عند النظر في العلاج والمتابعة الأكثر ملاءمة للمريض. بشكل عام، يقع معظم المرضى في فئة المخاطر المنخفضة (درجة MACIS أقل من 6.0) ويتم علاجهم من السرطان وقت الجراحة.[34]
اعتمادًا على المصدر واستنادًا إلى إجمالي مراحل السرطان في المراحل من الأولى إلى الرابعة، يبلغ معدل البقاء الكلي لسرطان الغدة الدرقية الحليمي لمدة 5 سنوات 100% للمرحلتين الأولى والثانية، و 93% للمرحلة الثالثة و 51% للمرحلة الرابعة.[35] أو حسب مصادر أخرى 96% [36] أو 97%،[37] و معدل بقاء لمدة 10 سنوات 93%.[36]
يعتبر سرطان الغدة الدرقية الحليمي (والجريبي) الأكثر قابلية للعلاج من بين جميع أنواع سرطانات الغدة الدرقية. في المرضى الأصغر سنًا، الذين تقل أعمارهم عن 50 عامًا، يكون للسرطان الحليمي (والجريبي) معدل علاج أكثر من 98% إذا تم علاجهم بشكل مناسب وصحيح.[38]
معظم الأطفال المصابون بانبثاث متعدد في الرئة و/أو في الجانب الدماغي لديهم مآل ممتاز طويل الأمد إذا تم إعطاؤهم العلاج المناسب.[39]
علم الأوبئة[عدل]
وفقًا للSEER، ارتفع معدل الإصابة بالسرطان الحليمي من 4.8 إلى 14.9 لكل 100000 من عام 1975 إلى 2012. من المرجح أن تصاب الإناث بالسرطان الحليمي بنسبة أكبر مقارنة بالذكور (2.5 إلى 1)، حيث يتم تشخيص معظم السرطانات بين سن 40 و 50 سنة لدى الإناث. ومع ذلك، لا تزال معدلات الوفيات الناجمة عن سرطان الغدة الدرقية الحليمي ثابتة من 2003 إلى 2012 عند 0.5 لكل 100,000 من الرجال والنساء. كان هناك زيادة في الإصابة بالسرطان الدرقي الحليمي من عام 1910 إلى عام 1960 بسبب استخدام الإشعاع المؤين في علاج سرطان الرأس والعنق لدى الأطفال. انخفض معدل الإصابة بعد التخلي عن العلاج الإشعاعي.[40] كما يؤدي التعرض البيئي للإشعاع مثل القصف الذري لكارثة هيروشيما وناغازاكي وكارثة تشرنوبيل إلى زيادة في سرطان الغدة الدرقية الحليمي لدى الأطفال بعد 5 إلى 20 عامًا بسبب التعرض للإشعاع. التاريخ العائلي لمتلازمة سرطان الغدة الدرقية مثل داء السلائل الورمي الغدي العائلي، متلازمة كارني، تكون الورم الصماوي المتعدد النوع 2 (MEN-2)، متلازمة ويرنر، ومتلازمة كاودن يزيد من خطر الإصابة بالسرطان الحليمي.[41][42]
انظر أيضًا[عدل]
المراجع[عدل]
- ^ Zubair W Baloch; Seth Fleisher; Virginia A LiVolsi; Prabodh K Gupta (1 Jan 2002). "Diagnosis of "follicular neoplasm": a gray zone in thyroid fine-needle aspiration cytology". Diagnostic Cytopathology (بالإنجليزية). 26 (1): 41–44. DOI:10.1002/DC.10043. ISSN:8755-1039. PMID:11782086. QID:Q77464090.
- ^ Hong Xue (30 Jan 2022). "GABRB2, a key player in neuropsychiatric disorders and beyond". Gene. Gene Wiki Review Series (بالإنجليزية). 809. DOI:10.1016/J.GENE.2021.146021. ISSN:0378-1119. PMID:34673206. QID:Q109615004.
- ^ أ ب Richard Sheppard؛ Mitchell، Richard Sheppard؛ Tucker، Gordon C. (1997). Revised checklist of New York State plants /. Albany, N.Y. :: University of the State of New York, State Education Dept.,. مؤرشف من الأصل في 2020-06-02.
{{استشهاد بكتاب}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ "Papillary Thyroid Cancer". EndocrineWeb (بالإنجليزية). Archived from the original on 2020-06-04. Retrieved 2020-06-05.
- ^ Rena (2005). Pediatric Oncology. Boston, MA: Springer US. ص. 155–166. ISBN:978-0-387-24470-9. مؤرشف من الأصل في 2018-06-11.
- ^ Dinets، Andrii؛ Hulchiy، Mykola؛ Sofiadis، Anastasios؛ Ghaderi، Mehran؛ Höög، Anders؛ Larsson، Catharina؛ Zedenius، Jan (2012-06). "Clinical, genetic, and immunohistochemical characterization of 70 Ukrainian adult cases with post-Chornobyl papillary thyroid carcinoma". European Journal of Endocrinology. ج. 166 ع. 6: 1049–1060. DOI:10.1530/eje-12-0144. ISSN:0804-4643. مؤرشف من الأصل في 2020-06-02.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "Papillary Thyroid Cancer | Columbia University Department of Surgery". columbiasurgery.org. مؤرشف من الأصل في 2019-12-22. اطلع عليه بتاريخ 2020-06-04.
- ^ أ ب ت "Papillary Thyroid Cancer". EndocrineWeb (بالإنجليزية). Archived from the original on 2019-04-01. Retrieved 2020-06-04.
- ^ أ ب "What Is Papillary Thyroid Carcinoma?". WebMD (بالإنجليزية). Archived from the original on 2019-12-26. Retrieved 2020-06-05.
- ^ أ ب ت ث "Papillary Thyroid Cancer Causes". EndocrineWeb (بالإنجليزية). Archived from the original on 2020-06-04. Retrieved 2020-06-05.
- ^ Richard Sheppard؛ Mitchell، Richard Sheppard؛ Tucker، Gordon C. (1997). Revised checklist of New York State plants /. Albany, N.Y. :: University of the State of New York, State Education Dept.,. مؤرشف من الأصل في 2020-06-05.
{{استشهاد بكتاب}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Robbins basic pathology (ط. 8th ed). Philadelphia, PA: Saunders/Elsevier. 2007. ISBN:1-4160-2973-7. OCLC:69672074. مؤرشف من الأصل في 2020-06-05.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة) - ^ Richard Sheppard؛ Mitchell، Richard Sheppard؛ Tucker، Gordon C. (1997). Revised checklist of New York State plants /. Albany, N.Y. :: University of the State of New York, State Education Dept.,. مؤرشف من الأصل في 2020-06-05.
{{استشهاد بكتاب}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Li, Peng; Dong, Mingqiang; Wang, Zhigang (20 May 2019). "Downregulation of TSPAN13 by miR-369-3p inhibits cell proliferation in papillary thyroid cancer (PTC)". Bosnian Journal of Basic Medical Sciences (بالإنجليزية). 19 (2): 146–154. DOI:10.17305/bjbms.2018.2865. ISSN:1840-4812. Archived from the original on 2019-08-03.
- ^ "18-CAUSE". مؤرشف من الأصل في 2010-07-01. اطلع عليه بتاريخ 2020-09-16.
- ^ Surgical recall (ط. 7th edition). Philadelphia. ISBN:978-1-4511-9291-9. OCLC:879119476. مؤرشف من الأصل في 2020-06-03.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة) - ^ Lin, Jen-Der (1 Feb 2008). "Thyroglobulin and human thyroid cancer". Clinica Chimica Acta (بالإنجليزية). 388 (1): 15–21. DOI:10.1016/j.cca.2007.11.002. ISSN:0009-8981. Archived from the original on 2020-06-05.
- ^ Tuttle, R. Michael; Leboeuf, Rébecca; Martorella, Andrew J. (1 Sep 2007). "Papillary Thyroid Cancer: Monitoring and Therapy". Endocrinology and Metabolism Clinics of North America. Thyroid Function and Disease (بالإنجليزية). 36 (3): 753–778. DOI:10.1016/j.ecl.2007.04.004. ISSN:0889-8529. Archived from the original on 2020-06-05.
- ^ Papotti، Mauro؛ Rodriguez، Jaime؛ Pompa، Roberta De؛ Bartolazzi، Armando؛ Rosai، Juan (29 أكتوبر 2004). "Galectin-3 and HBME-1 expression in well-differentiated thyroid tumors with follicular architecture of uncertain malignant potential". Modern Pathology. ج. 18 ع. 4: 541–546. DOI:10.1038/modpathol.3800321. ISSN:0893-3952. مؤرشف من الأصل في 2020-06-05.
- ^ Fernández-Ramírez، Fernando؛ Hurtado-López، Luis M.؛ López، Mario A.؛ Martínez-Peñafiel، Eva؛ Herrera-González، Norma E.؛ Kameyama، Luis؛ Sepúlveda-Robles، Omar (2018). "BRAF 1799T>A Mutation Frequency in Mexican Mestizo Patients with Papillary Thyroid Cancer". BioMed Research International. ج. 2018: 1–5. DOI:10.1155/2018/2582179. ISSN:2314-6133. مؤرشف من الأصل في 2020-06-05.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Papillary Carcinoma of the Thyroid". archive.is. 9 يوليو 2012. مؤرشف من الأصل في 2020-06-05. اطلع عليه بتاريخ 2020-06-05.
- ^ Yang، Grace C.H.؛ Liebeskind، Doreen؛ Messina، Albert V. (2001-06). "Ultrasound-Guided Fine-Needle Aspiration of the Thyroid Assessed by Ultrafast Papanicolaou Stain: Data from 1135 Biopsies with a Two- to Six-Year Follow-Up". Thyroid. ج. 11 ع. 6: 581–589. DOI:10.1089/105072501750302895. ISSN:1050-7256. مؤرشف من الأصل في 5 يونيو 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Escofet، X؛ Khan، A Z؛ Mazarani، Waseem؛ Woods، William GA (2007-01). "Lessons to be learned: a case study approach. Lateral aberrant thyroid tissue: is it always malignant?". Journal of the Royal Society for the Promotion of Health. ج. 127 ع. 1: 45–46. DOI:10.1177/1466424007073207. ISSN:1466-4240. مؤرشف من الأصل في 5 يونيو 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "Papillary Thyroid Carcinoma: Practice Essentials, Pathophysiology, Etiology". 22 أبريل 2020. مؤرشف من الأصل في 2020-01-24.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ "18-CAUSE". web.archive.org. 1 يوليو 2010. مؤرشف من الأصل في 2010-07-01. اطلع عليه بتاريخ 2020-06-05.
- ^ Grani، Giorgio؛ Fumarola، Angela (1 يونيو 2014). "Thyroglobulin in Lymph Node Fine-Needle Aspiration Washout: A Systematic Review and Meta-analysis of Diagnostic Accuracy". The Journal of Clinical Endocrinology & Metabolism. ج. 99 ع. 6: 1970–1982. DOI:10.1210/jc.2014-1098. ISSN:0021-972X. مؤرشف من الأصل في 2020-07-02.
- ^ "Pathology Education: Endocrine". web.archive.org. 19 أبريل 2010. مؤرشف من الأصل في 2017-10-05. اطلع عليه بتاريخ 2020-06-05.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ "Dr. Gerald R. Cooper Obituary, November 19, 1914 – May 25, 2009". Clinical Chemistry. ج. 55 ع. 9: 1754–1755. 1 سبتمبر 2009. DOI:10.1373/clinchem.2009.132969. ISSN:0009-9147. مؤرشف من الأصل في 2020-06-04.
- ^ أ ب ت ث "Papillary Thyroid Cancer". EndocrineWeb (بالإنجليزية). Archived from the original on 2019-04-01. Retrieved 2020-06-04.
- ^ "Papillary Thyroid Cancer". EndocrineWeb (بالإنجليزية). Archived from the original on 2019-04-01. Retrieved 2020-06-05.
- ^ Sanziana؛ Udelsman، Robert (2005). Adrenal Glands. Berlin, Heidelberg: Springer Berlin Heidelberg. ص. 325–332. ISBN:978-3-540-41099-7. مؤرشف من الأصل في 2018-06-18.
- ^ "Papillary Thyroid Carcinoma Treatment & Management: Approach Considerations, Surgical Care, Radioiodine Therapy". 22 أبريل 2020. مؤرشف من الأصل في 2017-09-22.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ "Papillary Thyroid Carcinoma". web.archive.org. 19 يوليو 2008. مؤرشف من الأصل في 2017-09-09. اطلع عليه بتاريخ 2020-06-05.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ "New York Thyroid Center: Prognosis Staging for Thyroid Cancer". web.archive.org. 1 مارس 2005. مؤرشف من الأصل في 2012-03-21. اطلع عليه بتاريخ 2020-06-05.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ "Survival Rates for Thyroid Cancer". www.cancer.org (بالإنجليزية). Archived from the original on 2020-06-03. Retrieved 2020-06-05.
- ^ أ ب Biersack، H.-J.؛ Grünwald، F.، المحررون (2005). "Thyroid Cancer". DOI:10.1007/3-540-27845-1. مؤرشف من الأصل في 2018-06-18.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ Rosario، Pedro Weslley (2010-07). "Ultrasonography for the Follow-up of Patients with Papillary Thyroid Carcinoma: How Important Is the Operator?". Thyroid. ج. 20 ع. 7: 833–834. DOI:10.1089/thy.2010.0025. ISSN:1050-7256. مؤرشف من الأصل في 4 يونيو 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "Thyroid Cancer". EndocrineWeb (بالإنجليزية). Archived from the original on 2020-06-04. Retrieved 2020-06-04.
- ^ Vermeer-Mens، Josephina C.J.؛ Goemaere، Natascha N.T.؛ Kuenen-Boumeester، Vibeke؛ de Muinck Keizer-Schrama، Sabine M.P.F.؛ Zwaan، Christian M.؛ Devos، Annick S.؛ de Krijger، Ronald R. (20 ديسمبر 2006). "Childhood Papillary Thyroid Carcinoma With Miliary Pulmonary Metastases". Journal of Clinical Oncology. ج. 24 ع. 36: 5788–5789. DOI:10.1200/jco.2006.08.8732. ISSN:0732-183X. مؤرشف من الأصل في 2020-06-05.
- ^ "UpToDate". www.uptodate.com. مؤرشف من الأصل في 2020-06-05. اطلع عليه بتاريخ 2020-06-05.
- ^ Vaisman، Fernanda؛ Corbo، Rossana؛ Vaisman، Mario (2011). "Thyroid Carcinoma in Children and Adolescents—Systematic Review of the Literature". Journal of Thyroid Research. ج. 2011: 1–7. DOI:10.4061/2011/845362. ISSN:2042-0072. مؤرشف من الأصل في 2020-06-05.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Huang، Shih-Ming؛ Lee، Chen-Hsen (2017-11). "The role of prophylactic modified neck dissection in papillary thyroid cancer". Annals of Thyroid. ج. 2: 13–13. DOI:10.21037/aot.2017.11.02. ISSN:2522-6681. مؤرشف من الأصل في 2020-06-05.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link)
روابط خارجية[عدل]
- سرطان الغدة الدرقية في DMOZ
- دليل إدارة السرطان: سرطان الغدة الدرقية والغدة الدرقية
- إرشادات الإدارة للمرضى الذين يعانون من عقيدات الغدة الدرقية وسرطان الغدة الدرقية المتمايز فرقة العمل للخطوط التوجيهية لرابطة الغدة الدرقية الأمريكية (2015).
| سرطان الغدة الدرقية الحليمي في المشاريع الشقيقة: | |
| |