هرمونات الغدة الدرقية

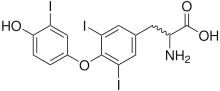
هرمونات الغدة الدرقية هي الهرمونات التي تنتجها الغدة الدرقية وتحررها في الدم، وتشمل ثلاثي يود الثيرونين (تي3) والثيروكسين (تي4). هي هرمونات مشتقة من التيروزين، مسؤولة بشكل أساسي عن تنظيم عملية الأيض (التمثيل الغذائي). يتكون كل من تي3 وتي4 جزئيًا من اليود. يؤدي نقص اليود إلى انخفاض إنتاج تي3 وتي4، ويؤدي إلى تضخم أنسجة الغدة الدرقية ويسبب ما يعرف بتضخم الغدة الدرقية البسيط.[1]
الشكل الرئيسي لهرمون الغدة الدرقية في الدم هو الثيروكسين (تي4)، ويملك عمر نصفي أطول من تي3 لدى البشر، تكون نسبة تي4 إلى تي3 في الدم نحو 1:14.[2] يتحول تي4 إلى تي3 النشط (أقوى من تي4 بثلاث إلى أربع مرات) داخل الخلايا بواسطة إنزيم ′5-نازعة اليود. يخضع أيضًا لعملية نزع الكربوكسيل ونزع اليود لإنتاج يودوثيرونامين (تي1أ) وثيرونامين (تي0أ). تكون جميع النظائر الثلاثة لنازعات اليود عبارة عن إنزيمات تحتوي على السيلينيوم، لذلك يعد السيلينيوم الغذائي ضروريًا لإنتاج تي3.
كان الكيميائي الأمريكي إدوارد كالفن كندال أول من عزل الثيروكسين في عام 1915.[3] في عام 2018، كان الليفوثيروكسين، وهو شكل مصنع من الثيروكسين، ثاني أكثر الأدوية الموصوفة شيوعًا في الولايات المتحدة، بأكثر من 105 مليون وصفة طبية. أُدرج الليفوثيروكسين ضمن قائمة الأدوية الأساسية النموذجية لمنظمة الصحة العالمية.[4]
الاستخدام الطبي[عدل]
يستخدم كلا من تي3 وتي4 لعلاج نقص هرمونات الغدة الدرقية (قصور الدرقية). يتم امتصاصهما جيدًا في المعدة، لذلك يمكن تناولهما عن طريق الفم. يعد الليفوثيروكسين الاسم الصيدلاني للنسخة المصنعة من تي4، والذي يستقلب بشكل أبطأ من تي3 لذلك يتم تناوله مرة واحدة يوميًا فقط. تُشتق هرمونات الغدة الدرقية الطبيعية المجففة من الغدد الدرقية للخنازير، وهي علاج «طبيعي» لقصور الدرقية تحتوي على 20% من تي3 وآثار من تي2 و تي1 والكالسيتونين. تتوفر أيضًا أدوية مركبة من تي3/تي4 بنسب مختلفة (مثل دواء ليوتركس) وتي3 النقي (مثل ليوثيرونين). عادةً ما يكون ليفوثيروكسن الصوديوم أول علاج يتم تجربته. يشعر بعض المرضى بتحسن عند تناول هرمونات الغدة الدرقية المجففة؛ لكن هذا قائم على الأدلة المتناقلة ولم تظهر التجارب السريرية أن فائدتها تغلب الأشكال المصنعة بيولوجيًا. أُبلغ عن تأثيرات مختلفة لتناول أدوية الغدة الدرقية، قد تُعزى إلى الاختلافات في الزوايا الالتوائية المحيطة بالموقع التفاعلي للجزيء.[5]
ليس للثيرونامينات أي استخدامات طبية حتى الآن، رغم اقتراح استخدامها لتحريض انخفاض درجة حرارة الجسم، ما يؤدي إلى دخول الدماغ في دورة وقائية، وهذا مفيد في منع الضرر أثناء الصدمة الإقفارية.
أُنتج الثيروكسين الصناعي لأول مرة بنجاح من قبل تشارلز روبيرت هارينغتون وجورج بارغر في عام 1926.
الصيغ المركبة[عدل]
يُعالج معظم الناس بالليفوثيروكسين، أو هرمون صناعي مشابه. تختلف الأشكال المتعددة للمركب بقابلية الذوبان والفعالية.[6] بالإضافة إلى ذلك، تتوفر مكملات هرمون الغدة الدرقية الطبيعية المشتقة من الغدة الدرقية المجففة للحيوانات. يحتوي الليفوثيروكسين على تي4 فقط فهو غير فعال لدى المرضى غير القادرين على تحويل تي4 إلى تي3. قد يختار هؤلاء المرضى تناول هرمون الغدة الدرقية الطبيعي، لأنه يحتوي على مزيج من تي4 وتي3، أو بديل يحوي تي3 الصناعي. في هذه الحالات، يُفضل استخدام الليوثيرونين الصناعي نظرًا للاختلافات في الفعالية بين منتجات الغدة الدرقية الطبيعية.[7][8] تظهر بعض الدراسات أن العلاج المركب مفيد لجميع المرضى، ولكن إضافة الليوثيرونين يسبب آثار جانبية إضافية ويجب تقييم الدواء على أساس فردي. حصلت بعض الأشكال التجارية لهرمون الغدة الدرقية الطبيعي على موافقة إدارة الغذاء والدواء الأمريكية. تعتبر هرمونات الغدة الدرقية جيدة التحمل بشكل عام. لا تكون هرمونات الغدة الدرقية عادةً خطرة على النساء الحوامل أو المرضعات، لكن يجب إعطاؤها تحت إشراف الطبيب. في الواقع، إذا تُركت الامرأة المصابة بقصور الدرقية دون علاج، يكون طفلها أكثر عرضة للإصابة بعيوب خلقية. أثناء الحمل، يجب زيادة جرعة هرمون الغدة الدرقية للامرأة التي تعاني من قصور في وظائف الغدة الدرقية. المشكلة الوحيدة هي أن هرمونات الغدة الدرقية قد تؤدي إلى تفاقم أمراض القلب، خاصةً عند المرضى الأكبر سنًا. لذلك، لدى هؤلاء المرضى، قد يبدأ الأطباء بجرعة أقل مع زيادتها تدريجيًا لتجنب خطر الإصابة بنوبة قلبية.[9]
القياس[عدل]
يمكن قياس مستويات ثلاثي يود الثيرونين (تي3) والثيروكسين (تي4) بقياس تي3 الحر وتي4 الحر، وهما مؤشران على نشاطهما في الجسم. يمكن أيضًا قياس نسبتي تي3 الكلي وتي4 الكلي، وتعتمدان على الكمية المرتبطة بالغلوبيولين الرابط للثيروكسين (تي بي جي). يوجد قياس آخر وهو مؤشر الثيروكسين الحر، وهو عبارة عن تي4 الكلي مضروبًا بمعدل قبط الثيروكسين، والذي يعد بدوره مقياسًا لتي بي جي غير المرتبط. بالإضافة إلى ذلك، يمكن الكشف عن اضطرابات الغدة الدرقية قبل الولادة باستخدام تقنيات التصوير المتطورة وقياس مستويات هرمونات الجنين.[10]
الأمراض المرتبطة[عدل]
يمكن أن يسبب كل من زيادة الثيروكسين ونقصه اضطرابات.
- فرط الدرقية (مثال على ذلك داء غريفز) هو متلازمة سريرية ناتجة عن زيادة الثيروكسين الحر أو ثلاثي يود الثيرونين الحر أو كليهما. وهو اضطراب شائع يصيب نحو 2٪ من النساء و0.2٪ من الرجال. غالبًا ما يستخدم مصطلح الانسمام الدرقي بالتبادل مع فرط الدرقية، ولكن، توجد اختلافات دقيقة. رغم أن الانسمام الدرقي يشير أيضًا إلى زيادة هرمونات الغدة الدرقية الدموية، قد يكون ناتجًا عن تناول أقراص الثيروكسين أو بسبب فرط نشاط الغدة الدرقية، بينما يشير فرط الدرقية فقط إلى فرط نشاط الغدة الدرقية.
- قصور الدرقية (مثال على ذلك التهاب الغدة الدرقية لهاشيموتو) هو الحالة التي يكون فيها نقص في الثيروكسين أو ثلاثي يود الثيرونين أو كليهما.[11]
- يمكن أن يحدث الاكتئاب السريري أحيانًا بسبب قصور الغدة الدرقية. أظهرت بعض الأبحاث أن تي3 موجود في موصلات المشابك العصبية، وينظم كميات ونشاط السيروتونين والنورإبينفرين وحمض الغاما-أمينوبيوتيريك (غابا) في الدماغ.
- يمكن أن يعزى تساقط الشعر أحيانًا إلى خلل في مستويات تي3 وتي4. قد تتأثر دورة نمو الشعر الطبيعية ويحدث خلل في نمو الشعر.
- يمكن أن يسبب كل من فرط نشاط الغدة الدرقية وقصوره حدوث اضطرابات في القلب والأوعية الدموية أو تفاقم الحالات الموجودة مسبقًا. أثبتت الدراسات وجود ارتباط بين فرط هرمون الغدة الدرقية ونقصه وحالات مثل اضطرابات نظم القلب وفشل القلب وأمراض الأوعية الدموية المرتبطة بتصلب الشرايين منذ نحو 200 عام. [12]
في الولادات المبكرة، قد يصاب الأطفال باضطرابات النمو العصبي بسبب نقص هرمونات الغدة الدرقية للأم، في وقت تكون فيه الغدة الدرقية غير قادرة على تلبية احتياجاتهم بعد الولادة. في حالات الحمل العادية، تعد المستويات الكافية من هرمون الغدة الدرقية للأم أمرًا حيويًا لضمان توافره للجنين وتأمين النمو الطبيعي للدماغ. يحدث قصور الغدة الدرقية الخلقي لدى 1 من كل 1600-3400 طفل حديث الولادة، ويولد معظمهم بدون أعراض وتظهر عليهم أعراض بعد أسابيع من الولادة.[13]
مراجع[عدل]
- ^ Irizarry L (23 أبريل 2014). "Thyroid Hormone Toxicity". Medscape. WedMD LLC. مؤرشف من الأصل في 2021-10-31. اطلع عليه بتاريخ 2014-05-02.
- ^ Pilo A، Iervasi G، Vitek F، Ferdeghini M، Cazzuola F، Bianchi R (أبريل 1990). "Thyroidal and peripheral production of 3,5,3′-triiodothyronine in humans by multicompartmental analysis". The American Journal of Physiology. ج. 258 ع. 4 Pt 1: E715–E726. DOI:10.1152/ajpendo.1990.258.4.E715. PMID:2333963.
- ^ "1926 Edward C Kendall". American Society for Biochemistry and Molecular Biology. مؤرشف من الأصل في 2012-03-19. اطلع عليه بتاريخ 2011-07-04.
- ^ "Levothyroxine - Drug Usage Statistics". ClinCalc. مؤرشف من الأصل في 2021-11-02. اطلع عليه بتاريخ 2021-02-18.
- ^ Schweizer U، Steegborn C (أكتوبر 2015). "Thyroid hormones--From Crystal Packing to Activity to Reactivity". Angewandte Chemie. ج. 54 ع. 44: 12856–12858. DOI:10.1002/anie.201506919. PMID:26358899.
- ^ Mondal S، Mugesh G (سبتمبر 2015). "Structure Elucidation and Characterization of Different Thyroxine Polymorphs". Angewandte Chemie. ج. 54 ع. 37: 10833–10837. DOI:10.1002/anie.201505281. PMID:26213168.
- ^ "Thyroid Information" نسخة محفوظة 2012-02-27 على موقع واي باك مشين., Retrieved on 2009-03-27
- ^ Eliason BC، Doenier JA، Nuhlicek DN (مارس 1994). "Desiccated thyroid in a nutritional supplement". The Journal of Family Practice. ج. 38 ع. 3: 287–288. PMID:8126411.
- ^ "Hypothyroidism Causes, Symptoms, Diagnosis, Treatment Information Produced by Medical Doctors". MedicineNet.com. مؤرشف من الأصل في 2017-07-31. اطلع عليه بتاريخ 2009-03-27.
- ^ Polak M، Luton D (مارس 2014). "Fetal thyroïdology". Best Practice & Research. Clinical Endocrinology & Metabolism. ج. 28 ع. 2: 161–73. DOI:10.1016/j.beem.2013.04.013. PMID:24629859.
- ^ Kirkegaard C، Faber J (يناير 1998). "The role of thyroid hormones in depression". European Journal of Endocrinology. ج. 138 ع. 1: 1–9. DOI:10.1530/eje.0.1380001. PMID:9461307.
- ^ Parry CH. Elements of Pathology and Therapeutics, Being the Outlines of a Work. Bath, England: R. Cruttwell, 1815.
- ^ Szinnai G (مارس 2014). "Genetics of normal and abnormal thyroid development in humans". Best Practice & Research. Clinical Endocrinology & Metabolism. ج. 28 ع. 2: 133–150. DOI:10.1016/j.beem.2013.08.005. PMID:24629857.
| في كومنز صور وملفات عن: هرمونات الغدة الدرقية |


