بطارية أيونات الليثيوم
 بطارية ليثيوم أيون لهاتف نوكيا 3310 | |
| الطاقة النوعية | 100–265 و.س/ك (0.36–0.875 MJ/kg) |
|---|---|
| كثافة الطاقة | 250–693 و.س/ل[1][2] (0.90–2.43 MJ/L) |
| نسبة القوة إلى الوزن | ~250 – ~340 و/كغ |
| الشحن/كفاءة التفريغ | 80–90%[3] |
| الطاقة/الاستهلاك | 6.4 وات/دولار[4] |
| معدل التفريغ الذاتي | 0.35% إلى 2.5% في الشهر بحسب حالة الشحن[5] |
| دورة التحمل | 400–1,200 دورة [6] |
| الجهد الخلوي الاسمي | 3.6 / 3.7 / 3.8 / 3.85 V, LiFePO4 3.2 V |


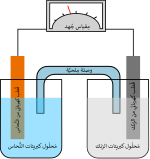
بَطَّارِيَّةُ أَيُون اَلْلِيثْيُوم أو بطارية شاردية ليثيومية[7] نوع من البطاريات القابلة للشحن (مركم / خلية ثانوية)، يتكون مهبطها (القطب الموجب) من عنصر الليثيوم. ويتكون مصعدها (القطب السالب) عادة من الكربون المسامي (الغرافيت). وتشمل مركمات أو بطاريات أيون الليثيوم عدة أنواع من البطاريات تعتمد على نوع التفاعل الكيميائي المميز لها، وطريقة أدائها وسعرها ومدى سلامتها.
أثناء عمل البطارية وتوصيل البطارية بدائرة خارجية يمر التيار الكهربائي داخل البطارية من المصعد إلى المهبط مثلما يحدث في أي بطارية عادية: تتحرك أيونات الليثيوم Li+ في داخل البطارية من المصعد إلى المهبط خلال كهرل غير مائي وغشاء فاصل.
أثناء الشحن يعمل المصدر الخارجي على تمرير تيار كهربائي في الاتجاه العكسي، حيث يوصل القطب الموجب للمصدر بمهبط البطارية ويوصل مصعد البطارية بالقطب السالب للمصدر. عندئذ تتوجه أيونات الليثيوم (وهي موجبة الشحنة) إلى المصعد وتستقر في مادته المسامية.
ويستخدم مخلوط من الكربونات العضوية لتشكيل الكهرل ويحتوي أيضا على أيونات الليثيوم. ويستخدم لذلك أملاح مثل LiPF6 و LiAsF6 و LiClO4 و LiBF4 وتريفلات الليثيوم.
والليثيوم مثله مثل الصوديوم من المواد النشطة كيميائياً. فهو يتفاعل بشدة مع الماء مكونا هيدروكسيد الليثيوم مع انطلاق غاز الهيدروجين. لهذا تستخدم كهرلات في بطارية الليثيوم أيون لا تحتوي على الماء. وفي نفس الوقت يجب منع تلامس الماء مع البطارية وذلك عن طريق تغليفها بعازل محكم.
تاريخ[عدل]
خلفية[عدل]
اقتُرحَت بطاريات الليثيوم من قبل الكيميائي البريطاني ستانلي ويتنجهام، الذي يعمل حاليًا في جامعة بينغهامتون، أثناء عمله في شركة إكسون في السبعينيات.[8] استخدم ويتنجهام ثنائي كبريتيد التيتانيوم (TiS2) ومعدن الليثيوم كأقطاب كهربائية. ومع ذلك، لا يمكن جعل بطارية الليثيوم القابلة لإعادة الشحن هذه عملية. كان ثاني كبريتيد التيتانيوم خيارًا سيئًا؛ نظرًا لأنه يجب تصنيعه في ظل ظروف محكمة الغلق تمامًا، كما أنه مكلف للغاية (حوالي 1000 دولار لكل كيلوغرام من مادة خام ثاني كبريتيد التيتانيوم في السبعينيات). عند تعرضه للهواء، يتفاعل ثاني كبريتيد التيتانيوم لتكوين مركبات كبريتيد الهيدروجين، والتي لها رائحة كريهة وهي سامة لمعظم الحيوانات. لهذا السبب، ولأسباب أخرى، أوقفت إكسون تطوير بطارية ويتنجهام ثاني كبريتيد الليثيوم التيتانيوم.[9] تمثل البطاريات ذات الأقطاب الكهربائية المصنوعة من الليثيوم المعدني مشكلات تتعلق بالسلامة، حيث يتفاعل معدن الليثيوم مع الماء، ويطلق غاز الهيدروجين القابل للاشتعال.[10] ونتيجة لذلك، انتقل البحث لتطوير البطاريات التي توجد فيها مركبات الليثيوم فقط، بدلاً من الليثيوم المعدني، وتكون قادرة على قبول وإطلاق أيونات الليثيوم.
اكتُشِف الإقحام العكسي في الجرافيت[11][12] والإقحام إلى أكاسيد كاثودية[13][14] خلال 1974–76 من قِبل بيسنهارد (J. O. Besenhard) في جامعة ميونخ التقنية. اقترح بيسنهارد تطبيقه في خلايا الليثيوم.[15][16] كان تحلل الإلكتروليت وإقحام المذيبات في الجرافيت من العيوب المبكرة الشديدة لعمر البطارية.
البطارية مقابل الخلية[عدل]
الخلية هي وحدة كهروكيميائية أساسية تحتوي على الأقطاب الكهربائية والفاصل والإلكتروليت.[17][18]
البطارية أو حزمة البطارية (Battery pack) عبارة عن مجموعة من الخلايا أو مجموعات الخلايا، مع مبيت (Housing) وتوصيلات كهربائية وربما إلكترونيات للتحكم والحماية.[19][20]
استخداماتها[عدل]
تستخدم بطاريات الليثيوم أيون كثيرا في الإلكترونيات المحمولة نظرا لسعتها الكهربائية العالية، أي أنها تتميز بنسبة عالية بين قدرتها على إنتاج الكهرباء وانخفاض وزنها. وعلاوة على ذلك فقدرتها على إنتاج الكهرباء لا تتأثر بعدد دورات إعادة شحنها *أغلب بطاريات الليثيوم يكون عدد دورات شحنها 500دورة ثم تبدأ في انخفاض الطاقة بشكل بسيط جدا، وهي أيضا ذات تسريب بطيء عند عدم استخدامها.
وبالإضافة إلى استخداماتها العديدة في الأجهزة الصغيرة المحمولة، فهي تستخدم في الأسلحة وفي تحريك الأجهزة الصغيرة، مثل لعب الأطفال ولها تطبيقات في أجهزة الطيران وغزو الفضاء، وذلك بفضل سعتها الكهربائية العالية.[21]
ولكن يجب الحذر عند استخدام بطاريات الليثيوم أيون العادية، إذ أنها معرضة للانفجار عند سوء الاستخدام.
في السنوات الأخيرة (2018) بدأ استخدام بطاريات الليثيوم أيون لتشغيل السيارات الكهربائية، مثل سيارة «تــسلا». كما تطبق استخدامها الصين لتسيير السيارات في الصين للحفاظ على البيئة؛ علاوةً على ذلك فإن الصين أصبحت تنتج نصف الإنتاج العالمي من تلك البطاريات. وتعزم الصين لسباق الولايات المتحدة في مجال إنتاج تلك البطاريات، فلديها الخبرة، كما تتميز الصين عن الولايات المتحدة في انخفاض أسعار إنتاج بطاريات الليثيوم -أيون بسبب رخص الأرض والعمالة وأجهزة الإنتاج.
حاليا أنشأت الصين نحو 156.000 محطة لإعادة شحن بطاريات السيارات، وتخطط لزيادة عددها إلى 4.8 محطة مع عام 2020.
الحكومة الصينية تشجع المستثمرين والمنتجين في الصين للتوسع في إنتاج تلك البطاريات، وتدعمهم وتوفر لهم المواد الأولية. والمنتجون يستجيبون لمخططات الحكومة ويعملون على إنتاج بطاريات أكثر كفاءةً وأرخص ثمنا لمنافسة العالم أجمع.
تطوير بطاريات الليثيوم أيون[عدل]
تعمل شركات السيارات الكبيرة في العالم على إنتاج السيارات الكهربائية. وعلى هذا السبيل فهي تحتاج إلى تطوير بطاريات الليثيوم أيون بحيث تصلح للاستخدام في تحريك السيارة. وقد اختير هذا النوع من البطاريات حيث أنها كالبطاريات الأخرى بالنسبة إلى كثافة سعتها الكهربائية وانخفاض وزنها نسبيا.
وتتكون بطارية الليثيوم أيون التي ستستعمل في السيارت من مصعد من النحاس ومهبط من الألومنيوم. وتغطي ألواح المصعد والمهبط بطبقة رقيقة 0.2 مليمتر من مخلوط يحتوي على الليثيوم. ثم يغطيها غشاء من الخزف الخاص يمنع من اشتعال الخلية الكهربائية. وعلى الرغم من أن ذلك الغشاء السيراميكي لا يزيد سمكه عن شعرة رأس فهو يتحمل درجات حرارة حتى 700 درجة مئوية بدون أن يشتعل.
تقطع الأقطاب في مساحة أوراق الكتابة وترص بجانب بعضها بحيث يفصل بينها الكهرل وهو طبقة تشبه اللباد الرقيق مشبعة بمركب يحتوي على الليثيوم.
تستطيع حاليا السيارة الصغيرة التي تعمل ببطارية كهذه وزنها 120 كيلوجرام أن تسير مسافة 150 كيلومتر. وإذا استبدلت بطارية الليثيوم أيون ببطارية نيكل-هيدريد فلز فلا تستطيع السيارة السير إلا مسافة 50 كيلومتر. لذلك تعلق الآمال على بطارية الليثيوم أيون لتسيير السيارات الكهربائية في المرحلة القادمة.
التفريغ الذاتي[عدل]

يكون تفريغ البطاريات تدريجيًا ذاتيًا حتى لو لم تكن موصولة وتوصيل التيار. تتميز بطاريات أيون الليثيوم القابلة لإعادة الشحن بمعدل تفريغ ذاتي عادة من قِبل الشركات المصنعة لتكون 1.5-2٪ شهريًا.[22][23]
يزيد المعدل مع درجة الحرارة وحالة الشحن. وجدت دراسة أُجريت عام 2004 أنه في معظم ظروف ركوب الدراجات كان التفريغ الذاتي يعتمد بشكل أساسي على الوقت. ومع ذلك، بعد عدة أشهر من الوقوف في دائرة مفتوحة أو شحنة عائمة، أصبحت الخسائر المعتمدة على حالة الشحن كبيرة. لم يزد معدل التفريغ الذاتي بشكل رتيب مع حالة الشحن، ولكنه انخفض إلى حد ما في حالات الشحن المتوسطة. قد تزيد معدلات التفريغ الذاتي مع تقدم عمر البطاريات. في عام 1999، تم قياس التفريغ الذاتي شهريًا عند 8٪ عند 21 درجة مئوية، و 15٪ عند 40 درجة مئوية، و 31٪ عند 60 درجة مئوية. بحلول عام 2007، قُدِّر معدل التفريغ الذاتي الشهري بـ 2٪ إلى 3٪، و 2-3٪ بحلول عام 2016.[24][25][26][27][28][29]
بالمقارنة، انخفض معدل التفريغ الذاتي لبطاريات نيكل-هيدريد فلز، اعتبارًا من عام 2017، من ما يصل إلى 30٪ شهريًا للخلايا الشائعة سابقًا إلى حوالي 0.08-0.33٪ شهريًا لبطاريات نيكل-هيدريد فلز منخفضة التفريغ الذاتي.[30][31]
المصعد[عدل]
نظرًا لأن الجرافيت محدود بسعة قصوى تبلغ 372 مللي أمبير/غرام، فقد خُصِّصت الكثير من الأبحاث لتطوير المواد التي تظهر قدرات نظرية أعلى، والتغلب على التحديات التقنية التي تعوق تنفيذها حاليًا. مقالة مراجعة شاملة لعام 2007 بقلم (.Kasavajjula et al) يلخّص الأبحاث المبكرة حول المصاعد القائمة على السيليكون لخلايا أيون الليثيوم الثانوية. على وجه الخصوص، أظهر (.Hong Li et al) في عام 2000 أن الإدخال الكهروكيميائي لأيونات الليثيوم في جُسيمات السيليكون النانوية وأسلاك السيليكون النانوية يؤدي إلى تكوين سبيكة ليثيوم-سيليكون غير متبلورة. في نفس العام، وصف بو جاو (Bo Gao) ومستشاره للدكتوراه، البروفيسور أوتو تشو (Otto Zhou)، دورة الخلايا الكهروكيميائية ذات المصاعد التي تتكون من أسلاك نانوية من السيليكون، ذات قدرة عكسية تتراوح من 900 إلى 1500 مللي أمبير/غرام على الأقل.[32][33][34][35]
لتحسين استقرار مصعد الليثيوم، اقتُرِحت عدة طرق لتركيب طبقة واقية.[36] بدأ النظر إلى السيليكون على أنه مادة مصعد لأنه يمكنه استيعاب المزيد من أيونات الليثيوم، وتخزين ما يصل إلى 10 أضعاف الشحنة الكهربائية، إلا أن هذه الخلائط بين الليثيوم والسيليكون تؤدي إلى تمدد كبير في الحجم (حوالي 400٪)،[37] مما يسبب فشل ذريع للبطارية.[38] استُخدِم السيليكون كمادة مصعد، لكن إدخال واستخراج الليثيوم يمكن أن يُحدِث شقوقًا في المادة. تعرض هذه الشقوق سطح السيليكون إلى إلكتروليت، مما يتسبب في تحلل وتشكيل الطور البيني للكهرباء الصلبة ([ا]SEI) على سطح السيليكون الجديد (الغرافين المُكوَّم المُغلَّف بجُسيمات السيليكون النانوية). سيستمر تحسين الطور البيني للكهرباء الصلبة هذا في النمو بشكل أكبر، ويستنفد المتاح من الليثيوم، ويقلل من قدرة واستقرار دورة المصعد.
كانت هناك محاولات باستخدام العديد من الهياكل النانوية للسيليكون التي تشمل الأسلاك النانوية، والأنابيب النانوية، والمجالات المجوفة (Hollow Spheres)، والجُسيمات النانوية، ونانوبوروس (Nanoporous) بهدف تحمُّل إدراج/إزالة الليثيوم بدون تشقق كبير. ومع ذلك، لا يزال تشكيل الطور البيني للكهرباء الصلبة على السيليكون يحدث. لذلك سيكون الطلاء منطقيًا، من أجل حساب أي زيادة في حجم السيليكون، فإن طلاء السطح المحكم غير قابل للتطبيق. في عام 2012، ابتكر باحثون من جامعة نورث وسترن منهجًا لتغليف جزيئات السيليكون النانوية باستخدام أكسيد الغرافين (r-GO) المُكوَّم. تسمح هذه الطريقة بحماية جزيئات السيليكون النانوية من الإلكتروليت بالإضافة إلى السماح بتمدد السيليكون بدون تمدد بسبب التكوّم والتجعُّد في كرات الغرافين.
بدأت هذه الكبسولات كتشتت مائي لجزيئات أكسيد الغرافين والسيليكون، ثم تُرَشُّ في ضباب من القطرات التي تمر عبر فرن أنبوبي (Tube Furnace). أثناء مرورها من خلال تبخر السائل، تُسحَب صفائح أكسيد الغرافين إلى كرة مُكوَّمة بواسطة القوى الشعرية وتغليف جزيئات السيليكون معها. يوجد ملف تعريف شحن/ تفريغ جلفانوستاتي 0.05 مللي أمبير/سم2 حتى 1 مللي أمبير/سم2 للكثافات الحالية 0.2 إلى 4 أمبير/غرام، يوفر 1200 مللي أمبير/غرام عند 0.2 أمبير/غرام.[39]
تُعد إلكتروليتات البوليمر واعدةً لتقليل تكوين التغصّنات (التكوُّمات) في الليثيوم. من المفترض أن تمنع البوليمرات دائرة القصر وتحافظ على الموصلية.[36]
انظر أيضًا[عدل]
- شركة كاتل
- جدار طاقة تسلا
- أكاسيد الكوبالت والمنغنيز والنيكل والليثيوم بطارية
- بطارية أيونات الصوديوم
- فوسفات الحديد الليثيوم
- بطارية ليثيوم بوليمر
- قائمة الجهود القياسية
- بطارية الرصاص
- مركم
- مؤكسد
- بطارية السيارة
- خلية جلفانية
- بطارية
- مقارنة بين أنواع البطاريات التجارية
- بطارية نظائر مشعة
- تفاعل أكسدة-اختزال
- رشيد اليزمي
- بطارية المغنيسيوم
ملاحظات[عدل]
- ^ اختصار لِـ Solid Electrolyte Interphase
مراجع[عدل]
- ^ "NCR18650B" (PDF). Panasonic. مؤرشف من الأصل (PDF) في 2018-08-17. اطلع عليه بتاريخ 2016-10-07.
- ^ "NCR18650GA" (PDF). مؤرشف من الأصل (PDF) في 2021-03-08. اطلع عليه بتاريخ 2017-07-02.
- ^ Valøen, Lars Ole and Shoesmith, Mark I. (2007). The effect of PHEV and HEV duty cycles on battery and battery pack performance (PDF). 2007 Plug-in Highway Electric Vehicle Conference: Proceedings. Retrieved 11 June 2010.
- ^ "Battery Pack Prices Fall As Market Ramps Up With Market Average At $156/kWh In 2019". Bloomberg New Energy Finance. 3 ديسمبر 2019. مؤرشف من الأصل في 2021-07-17. اطلع عليه بتاريخ 2019-12-17.
- ^ Redondo-Iglesias، Eduardo؛ Venet، Pascal؛ Pelissier، Serge (2016). "Measuring Reversible and Irreversible Capacity Losses on Lithium-Ion Batteries". 2016 IEEE Vehicle Power and Propulsion Conference (VPPC). ص. 7. DOI:10.1109/VPPC.2016.7791723. ISBN:978-1-5090-3528-1. S2CID:22822329. مؤرشف من الأصل في 2021-04-28.
- ^ Battery Types and Characteristics for HEV نسخة محفوظة 20 May 2015 على موقع واي باك مشين. ThermoAnalytics, Inc., 2007. Retrieved 11 June 2010.
- ^ معجم المصطلحات المعلوماتية (بالعربية والإنجليزية)، دمشق: الجمعية العلمية السورية للمعلوماتية، 2000، ص. 322، OCLC:47938198، QID:Q108408025
- ^ "Electrical energy storage and intercalation chemistry". مؤرشف من الأصل في 2020-08-28.
- ^ Seth (10 May 2011). Bottled Lightning: Superbatteries, Electric Cars, and the New Lithium Economy (بالإنجليزية). Farrar, Straus and Giroux. ISBN:978-1-4299-2291-3. Archived from the original on 2021-02-14.
- ^ Kirchhoff; Bunsen (1 Jan 1861). "XXIV.—On chemical analysis by spectrum-observations". Quarterly Journal of the Chemical Society of London (بالإنجليزية). 13 (3): 270–289. DOI:10.1039/QJ8611300270. ISSN:1743-6893. Archived from the original on 2021-01-01.
- ^ Besenhard, J. O.; Fritz, H. P. (25 Jun 1974). "Cathodic reduction of graphite in organic solutions of alkali and NR4+ salts". Journal of Electroanalytical Chemistry and Interfacial Electrochemistry (بالإنجليزية). 53 (2): 329–333. DOI:10.1016/S0022-0728(74)80146-4. ISSN:0022-0728. Archived from the original on 2014-07-08.
- ^ Besenhard, J. O. (1 Jan 1976). "The electrochemical preparation and properties of ionic alkali metal-and NR4-graphite intercalation compounds in organic electrolytes". Carbon (بالإنجليزية). 14 (2): 111–115. DOI:10.1016/0008-6223(76)90119-6. ISSN:0008-6223. Archived from the original on 2014-07-08.
- ^ Schöllhorn, R.; Kuhlmann, R.; Besenhard, J. O. (1 Jan 1976). "Topotactic redox reactions and ion exchange of layered MoO3 bronzes". Materials Research Bulletin (بالإنجليزية). 11 (1): 83–90. DOI:10.1016/0025-5408(76)90218-X. ISSN:0025-5408. Archived from the original on 2021-02-14.
- ^ Besenhard, J. O.; Schöllhorn, R. (1 Jan 1976). "The discharge reaction mechanism of the MoO3 electrode in organic electrolytes". Journal of Power Sources (بالإنجليزية). 1 (3): 267–276. DOI:10.1016/0378-7753(76)81004-X. ISSN:0378-7753. Archived from the original on 2021-02-14.
- ^ Besenhard, J. O.; Eichinger, G. (25 Feb 1976). "High energy density lithium cells: Part I. Electrolytes and anodes". Journal of Electroanalytical Chemistry and Interfacial Electrochemistry (بالإنجليزية). 68 (1): 1–18. DOI:10.1016/S0022-0728(76)80298-7. ISSN:0022-0728. Archived from the original on 2021-02-14.
- ^ Eichinger, G.; Besenhard, J. O. (25 Aug 1976). "High energy density lithium cells: Part II. Cathodes and complete cells". Journal of Electroanalytical Chemistry and Interfacial Electrochemistry (بالإنجليزية). 72 (1): 1–31. DOI:10.1016/S0022-0728(76)80072-1. ISSN:0022-0728. Archived from the original on 2021-02-14.
- ^ Secondary cells and batteries containing alkaline or other non-acid electrolytes--safety requirements for portable sealed secondary cells, and for batteries made from them, for use in portable applications = Accumulateurs alcalins et autres accumulateurs à électrolyt non acide--exigences de sécurité pour les accumulateurs portables étanches, et pour les batteries qui en sont constituées, destinés, à l'utilisation dans des applications portables (ط. Ed. 2.0). Geneva: International Electrotechnical Commission. 2012. ISBN:978-2-8322-0505-1. OCLC:823774765. مؤرشف من الأصل في 2021-02-16.
- ^ Secondary cells and batteries containing alkaline or other non-acid electrolytes--secondary lithium cells and batteries for portable applications = Accumulateurs alcalins et autres accumulateurs à électrolyte non acide--éléments et batteries d'accumulateurs au lithium pour applications portables (ط. Ed. 2.0). Geneva: International Electrotechnical Commission. 2011. ISBN:978-2-88912-538-8. OCLC:741248695. مؤرشف من الأصل في 2021-02-16.
- ^ Electrically propelled road vehicles — Test specification for lithium-ion traction battery packs and systems. Part 1: High-power applications. ISBN:978-0-580-62648-7.
- ^ Doughty, Daniel H.; Crafts, Chris C. (August 2006). SAND 2005–3123. FreedomCAR Electrical Energy Storage System Abuse Test Manual for Electric and Hyb
- ^ "Electrovaya, Tata Motors to make electric Indica". مؤرشف من الأصل في 2011-05-09.
- ^ "Wayback Machine" (PDF). web.archive.org. 27 ديسمبر 2015. مؤرشف من الأصل (PDF) في 2021-03-08. اطلع عليه بتاريخ 2021-02-14.
- ^ "Wayback Machine" (PDF). web.archive.org. 3 مارس 2016. مؤرشف من الأصل (PDF) في 2021-03-08. اطلع عليه بتاريخ 2021-02-14.
- ^ 2016 IEEE Vehicle Power and Propulsion Conference (VPPC) : proceedings : 17-20 October 2016, Hangzhou, China. Piscataway, NJ. 2016. ISBN:978-1-5090-3528-1. OCLC:972574067. مؤرشف من الأصل في 2021-02-14.
{{استشهاد بكتاب}}: صيانة الاستشهاد: مكان بدون ناشر (link) - ^ Abe, H; Murai, T; Zaghib, K (1 Feb 1999). "Vapor-grown carbon fiber anode for cylindrical lithium ion rechargeable batteries". Journal of Power Sources (بالإنجليزية). 77 (2): 110–115. DOI:10.1016/S0378-7753(98)00158-X. ISSN:0378-7753. Archived from the original on 2015-09-24.
- ^ Phillip (2014). A systems approach to lithium-ion battery management. Boston. ISBN:978-1-60807-660-4. OCLC:908133209. مؤرشف من الأصل في 2021-02-14.
{{استشهاد بكتاب}}: صيانة الاستشهاد: مكان بدون ناشر (link) - ^ "Self-discharge losses in lithium-ion cells". مؤرشف من الأصل في 2021-02-14.
- ^ "Battery Performance Characteristics - How to specify and test a battery". www.mpoweruk.com. مؤرشف من الأصل في 2021-01-10. اطلع عليه بتاريخ 2021-02-14.
- ^ T. M. (2016). Storing energy : with special reference to renewable energy sources. Amsterdam, Netherlands: Elsevier. ISBN:0-12-803449-1. OCLC:946704193. مؤرشف من الأصل في 2021-02-14.
- ^ "What are batteries, fuel cells, and supercapacitors?". مؤرشف من الأصل في 2020-08-21.
- ^ ChibiM (14 Feb 2017). "Eneloop rechargeable batteries. Tests and more in %currentyear%%". https://eneloop101.com/ (بالإنجليزية الأمريكية). Archived from the original on 2020-11-24. Retrieved 2021-02-14.
{{استشهاد ويب}}: روابط خارجية في|موقع= - ^ Li, Hong; Huang, Xuejie; Chen, Liquan; Zhou, Guangwen; Zhang, Ze; Yu, Dapeng; Jun Mo, Yu; Pei, Ning (1 Nov 2000). "The crystal structural evolution of nano-Si anode caused by lithium insertion and extraction at room temperature". Solid State Ionics. Proceedings of the 12th International Conference on Solid State (بالإنجليزية). 135 (1): 181–191. DOI:10.1016/S0167-2738(00)00362-3. ISSN:0167-2738. Archived from the original on 2021-02-14.
- ^ "ACS applied materials & interfaces". ACS applied materials & interfaces (بالإنجليزية). 2009. ISSN:1944-8244. Archived from the original on 2019-05-22.
- ^ Kasavajjula, Uday; Wang, Chunsheng; Appleby, A. John (1 Jan 2007). "Nano- and bulk-silicon-based insertion anodes for lithium-ion secondary cells". Journal of Power Sources. Selected Papers presented at the FUEL PROCESSING FOR HYDROGEN PRODUCTION SYMPOSIUM at the 230th American Chemical SocietyNational Meeting Washington, DC, USA, 28 August – 1 September 2005 (بالإنجليزية). 163 (2): 1003–1039. DOI:10.1016/j.jpowsour.2006.09.084. ISSN:0378-7753. Archived from the original on 2021-02-14.
- ^ "Alloy Formation in Nanostructured Silicon". مؤرشف من الأصل في 2021-02-14.
- ^ ا ب "The journal of physical chemistry letters". The journal of physical chemistry letters (بالإنجليزية). 2010. ISSN:1948-7185. Archived from the original on 2019-07-11.
- ^ "Materials for rechargeable lithium-ion batteries". مؤرشف من الأصل في 2020-11-04.
- ^ "A Better Anode Design to Improve Lithium-Ion Batteries". web.archive.org. 4 مارس 2016. مؤرشف من الأصل في 2021-03-08. اطلع عليه بتاريخ 2021-02-14.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ "Crumpled Graphene-Encapsulated Si Nanoparticles for Lithium Ion Battery Anodes". مؤرشف من الأصل في 2020-11-05.
| بطارية أيونات الليثيوم في المشاريع الشقيقة: | |
| |