بطارية الرصاص
| الطاقة النوعية | {{{EtoW}}} |
|---|---|
| كثافة الطاقة | {{{EtoS}}} |

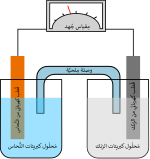
بطارية الرصاص أو مركم الرصاص هي بطارية يستخدم فيها الأقطاب في هيئة ألواح من الرصاص وأكسيد الرصاص منغمسة في كهرل من حامض الكبريتيك المخفف بتركيز يتراوح بين 33 إلى 37 في المئة.
وهي نوع من البطاريات زهيدة الثمن وتعمر طويلا. ولكن بمقارنتها بالأنواع الأخرى من البطاريات فهي ثقيلة الوزن وتحتوي على كثافة طاقية منخفضة تتراوح بين 33 و42 واط ساعة لكل كيلوجرام. (33[1]–42 [2])
ولها العديد من الاستعمالات فتستعمل مثلا في السيارات الكهربائية. وأغلب استعمالاتها لبدء تشغيل بادئ الاشتعال في سيارات الاحتراق الداخلي. ووحدات التغذية غير المنقطعة.[3]
تمتاز بطارية الرصاص الحمضية بإمكانية سحب تيار عالي جدا منها لفترة قصيرة ورخص ثمنها إلا أن مساوئها تتمثل في التلوث البيئي حيث أن أكاسيد الرصاص وأملاح الرصاص تعتبر مواد سامة.
التفاعلات الكيميائية في بطارية الرصاص
[عدل]
تبلغ كثافة الطاقة في بطارية الرصاص 0.11 ميغاجول/ كيلوجرام، في حين أن البطاريات الحديثة مثل بطارية النيكل- هيدريد المعدنية NiMH تحوي أربعة أضعاف تلك الكثافة.
وعند تشغيل البطارية تجري التفاعلات الكيميائية التالية:
القطب السالب:
القطب الموجب:
في هاتين المعادلتين تعني:
- Pb لوح الرصاص
- PbO_2 أكسيد الرصاص
- SO_4-2 أيون الكبريتات
- PbSO_4 كبريتات الرصاص
- H3O+ أيون ماء موجب الشحنة،
- e- إلكترون
- H2O ماء
هذان التفاعلان يجريان أثناء تشغيل البطارية وسحب التيار منها، أما أثناء عملية شحن البطارية فتجري تلك التفاعلات في الاتجاه المضاد.
وبجمع تفاعلي القطب الموجب والقطب السالب يمكن كتابة التفاعل الكلي بالمعادلة:
وطبقا لسير ذلك التفاعل من اليسار إلى اليمين أثناء تشغيل البطارية يتحول كلا من الرصاص وأكسيد الرصاص بالتفاعل مع حمض الكبريتيك إلى كبريتات الرصاص وينتج عن ذلك ماء وطاقة كهربية، ويسير التفاعل من اليمين إلى اليسار أثناء شحن البطارية بوساطة مصدر كهربائي خارجي.
ويمكننا تعيين فرق جهد البطارية الناتج بوساطة قائمة الجهود القياسية:
نجد في الجدول الجهد الكهربي للوح الرصاص Pb يساوي (- 36و0) فولت، والجهد الكهربي للوح أكسيد الرصاص PbO_2 يساوي (+ 68و1) فولت.
ونحصل على فرق الجهد بطرح الجهدين من بعضهما، أي:
أي أن القوة الدافعة الكهربائية للبطارية تبلغ 04و2 فولت، وهذا هو فرق جهد البطارية عندما يكون التيار مساو للصفر. وعند تشغيل البطارية وسحب تيار منها فإن فرق الجهد بين القطبين ينخفض عن القوة الدافعة الكهربية المحسوبة.
التفريغ الذاتي:
يتفاعل أكسيد الرصاص مع حمض الكبريتيك حتى في حالة عدم سحب التيار من البطارية فهو ليس خاملا بالنسبة لحمض الكبريتيك. إلا أن الجهد الذي يمارسه الهيدروجين في المحلول الحامضي يعمل على تخفيض سرعة هذا التفاعل الغير مرغوب فيه نظرا لأنه يعمل على التفريغ البطيء للبطارية رغم عدم استعمالها.
انظر أيضا
[عدل]- شركة كاتل
- أكاسيد الكوبالت والمنغنيز والنيكل والليثيوم بطارية
- كيمياء كهربية
- بطارية السيارة
- مركم
- بطارية ليثيوم أيون
- تفاعل ناشر للحرارة
- تفاعل يمتص الحرارة
- تفاعل الثرميت
- تفاعل كيميائي
- اختزال
- مقارنة بين أنواع البطاريات التجارية
- مؤكسد
- تفاعل عكوس
- قائمة الجهود القياسية
- بطارية نيكل-هيدريد فلز
- مبدأ مانح-متقبل
مراجع
[عدل]- ^ Panasonic، Panasonic LC-R1233P (PDF)، مؤرشف من الأصل (PDF) في 2019-06-06
- ^ PowerSonic، PS and PSG General Purpose Battery Specifications، مؤرشف من الأصل في 2018-12-29، اطلع عليه بتاريخ 2014-01-09
- ^ Cowlishaw, M.F. (ديسمبر 1974). "The Characteristics and Use of Lead-Acid Cap Lamps" (PDF). Trans. British Cave Research Association. ج. 1 ع. 4: 199–214. مؤرشف من الأصل (PDF) في 2019-10-16.