هدرجة
| صنف فرعي من | |
|---|---|
| المكتشف أو المخترع |

الهدرجة هي تفاعل كيميائي يتم من خلاله إضافة الهيدروجين إلى مركب آخر. عادة ما يستخدم هذا التفاعل لتقليل أو تشبيع المركبات العضوية. يتطلب تفاعل الهدرجة بشكل عام وجود تحفيز؛ بدونه قد يتطلب التفاعل وجود درجات حرارة عالية جدا.
يسمى التفاعل العكسي للهدرجة باسم تفاعل نزع الهيدروجين. تسمى التفاعلات التي يتم فيها كسر الروابط أثناء إضافة الهيدروجين باسم التحلل الهيدروجين. الهدرجة مختلفة تماما عن البرتنة أو إضافة الهيدريد، عكس هذه الأخيرة يكون لمنتج أو منتجات تفاعل الهدرجة نفس شحنة المتفاعلات.
خلال تفاعل الهدرجة بشكل عام، يكون غاز ثنائي الهيدروجين مصدرا للهيدروجين. مع ذلك، وباعتباره تفاعلا مهما نسبيا فقد طورت العديد من التقنيات الأخرى، بعضها يستخدم مصادر أخرى غير ثنائي الهيدروجين؛ تسمى هذه النوعية من التفاعلات باسم الهدرجة التحويلية.
يستخدم تفاعل الهدرجة في العديد من المجالات، لا سيما في الصناعات البتروكيماوية (تحويل الألكينات إلى ألكانات) وصناعة الأغذية (هدرجة الدهون غير المشبعة إلى دهون مشبعة).
تاريخ
[عدل]وصف تفاعل الهدرجة لأول مرة من قبل الكيميائي الفرنسي بول ساباتييه الذي يعتبر أب عمليات الهدرجة. بناء على العمل السابق لجيمس بويس، وهو كيميائي أمريكي يعمل في تصنيع منتجات الصابون، اكتشف ساباتييه في سنة 1897 أن إضافة آثار من النيكل كمحفز يسهل عملية إضافة الهيدروجين إلى الهيدروكربونات الغازية، وهي العملية التي أطلق عليها اسم «تفاعل ساباتييه». بفضل عمله المكثف في هدرجة المركبات العضوية وأعمال أخرى، حصل ساباتييه بحلول سنة 1912 على جائزة نوبل في الكيمياء مناصفة مع الكيميائي فيكتور غرينيار.[2]
في وقت لاحق، تم استخدام الهدرجة في عدد من العمليات:
- حصل فيلهلم نورمان في سنة 1902 في ألمانيا، وفي سنة 1903 في المملكة المتحدة على براءة اختراع بشأن عملية هدرجة الزيوت السائلة، والتي سرعان ما أصبحت من الصناعات الجديدة التي توسعت على نطاق عالمي؛
- عملية هابر-بوش، ذات الأهمية التجارية الكبيرة، التي وُصفت لأول مرة سنة 1905، تستخدم فيها الهدرجة بالنيتروجين؛
- في عملية فيشر-تروبش، التي وصفت سنة 1922، يتم هدرجة أحادي أكسيد الكربون الذي يتم الحصول عليه بسهولة من الفحم الحجري وتحويله إلى وقود سائل.
بحلول سنة 1922، وصف كل من فورهيس وآدامز جهازا لإجراء الهدرجة باستخدام ضغط مرتفع.[3] استنادا إلى أعمال فورهيس وآدامز تم بحلول سنة 1926 تسويق «محرض بار» (شاكر بار)، وهو أول جهاز للهدرجة باستخدام حرارة وضغط مرتفعين، ولا يزال شائع الاستخدام إلى غاية اليوم.
في سنة 1938، اكتشف أوتو رولين ما سمي بتفاعل أوكسو (التشكيل بالهيدروجين) الذي يقوم علي إضافة الهيدروجين وأول أكسيد الكربون معا إلى الألكينات لإنتاج الألدهيدات. نظرا لأن هذه العملية تنطوي على تكوين رابطة كربون-كربون، فهي بالإضافة إلى العديد من التغييرات، لا تزال موضوع آنيا.[4] شهدت سنوات الستينيات تطوير محفزات متجانسة مثل محفز ويلكينسون. بوصول الثمانينيات، برزت هدرجة نويوري اللامتناظرة كأحد التطبيقات الأولى للهدرجة في مجال التخليق غير المتماثل، وهو أحد فروع الكيمياء المتنام والتي تسمح بإنتاج مواد كيميائية محددة (الكيمياء الدقيقة).
بحلول سنة 2004، تم تطوير جهاز إتش كوب، وهو جهاز هدرجة متطور.[5]
التفاعل
[عدل]تعتبر تفاعلات الهدرجة بشكل عام متلائمة من الناحية الديناميكية الحرارية. يتطلب إحداث تفاعل الهدرجة وجود ثلاث مكونات رئيسية، الركيزة غير المشبعة، الهيدروجين (أو مصدر الهيدروجين)، والمحفز. يتم تفاعل الاختزال في درجات حرارة وضغط مختلفة اعتمادا على الركيزة ونشاط المحفز.
المتفاعلات
[عدل]المركبات القابلة للهدرجة هي مركبات كيميائية لها رابطة متعددة واحدة أو أكثر. في بعض الحالات، خاصة بالنسبة للمركبات التي تتوفر على رابطة ثلاثية، يعتمد المنتج النهائي أيضا على الظروف التي ستتم فيه الهدرجة. على سبيل المثال الألكاينات، إذا تمت هدرجتها بطريقة لطيفة، فإنها ستنتج الألكينات بينما إذا تمت هدرجتها في ظل ظروف قاسية فإنها ستنتج في هذه الحالة الألكانات المقابلة.
| ألكين: R2C=CR'2 | ألكان: R2CHCHR'2 |
| ألكاين: RCCR | ألكين، -RHC=CHR' أو ألكان: RH2CCR'H2 |
| ألدهيد: RCHO | كحول أولي: RCH2OH |
| كيتون: R2CO | كحول ثانوي: R2CHOH |
| إستر: RCO2R' | جزيئي كحول: RCH2OH, R'OH |
| إيمين: RR'CNR" | أمين: RR'CHNHR" |
| أميد: RC(O)NR'2 | أمين: RCH2NR'2 |
| نتريل: RCN | إيمين: RHCNH |
| مركب نترو: RNO2 | أمين: RNH2 |
مصدر الهيدروجين
[عدل]أكثر مصادر الهيدروجين شيوعا في عملية الهدرجة هو غاز ثنائي الهيدروجين (H2)، يكون مخزنا عادة في أسطوانات مضغوطة. يتطلب تفاعل الهدرجة أيضا في كثير من الأحيان ضغط هيدروجين أكبر من الضغط الجوي. ينتج غاز ثنائي الهيدروجين صناعيا عن طريق إعادة تشكيل بخار الهيدروكربون (يقوم مبدأ عمل هذه الطريقة على تفاعل هيدروكربونات مثل الميثان وغيرها في وجود بخار الماء والحرارة).[6]
يمكن أيضا في بعض التطبيقات المتخصصة الأخرى، استخلاص الهيدروجين (نتكلم عن «نقل») من «مانحي هيدروجين»، تكون غالبا على شكل مذيبات مثل الهيدرازين، ديهيدرونافثالين، ثنائي الهيدروانثراسين، الإيزوبروبانول، حمض الفورميك[7] أو الهيكسادين الحلقي. في التركيب العضوي، تكون عملية الهدرجة بالنقل مفيدة لتقليل المركبات القطبية غير المشبعة مثل الكيتونات أو الألدهيدات أو إيمينات.
المحفزات
[عدل]حتى وإن كانت ظروف التفاعل مواتية من الناحية الديناميكية الحرارية، فمن الصعب جدا بدأ تفاعل الهدرجة بسبب الثبات العالي للهيدروجين. وهكذا مع بعض الاستثناءات، لا يحدث أي تفاعل بين ثنائي الهيدروجين (H2) والمركب العضوي عند درجة حرارة أقل من 480 درجة مئوية وفي حالة عدم وجود محفز. من ناحية، فإن تسخين وسط التفاعل إلى درجة حرارة عالية غير عملي (على الرغم من أنه ممكن)، ومن ناحية أخرى، لا يمكن لبعض المركبات العضوية أن تتحمل درجة حرارة عالية. وبالتالي فإن الحل المفضل يتمثل في استخدام محفز. سوف يرتبط هذا المحفز بكل من الهيدروجين والمركب غير المشبع، وبالتالي «يساعد» في التفاعل بينهما.
تعتبر معادن مجموعة البلاتين، ولا سيما البلاتين والبلاديوم والروديوم والروثينيوم، محفزات نشطة بشكل خاص، ويمكنها العمل في ظل درجة حرارة منخفضة وضغط غاز (H2) منخفض.
في المقابل، طورت محفزات أخرى انطلاقا من الفلزات الأساسية، ولا سيما تلك المنحذرة من النيكل (مثل نيكل راني أو نيكل أوروشيبارا) كبديل أكثر اقتصادي، ولكنها بشكل عام تبقى أبطأ أو تتطلب درجات حرارة وضغط غاز عاليين (خاصة محفز نيكل راني[8][9]). لذلك، من الضروري إيجاد حل وسط بين تفاعل المحفز (وبالتالي سرعة التفاعل) وسعره، وكذلك سعر المعدات اللازمة للعمل تحت ضغط مرتفع. هناك أيضا محفزات مطورة إنطلاقا من الكوبالت والحديد وكروميت النحاس أو الزنك.
تنقسم المحفزات إلى عائلتين رئيسيتين هما:
- المحفزات التي تذوب في المذيب الذي يوجد فيه المركب غير المشبع المراد هدرجة؛ نتحدث هنا عن المحفزات المتجانسة؛
- المحفزات التي تظل في حالتها الصلبة معلقة في المذيب الذي يحتوي على مركب غير مشبع يراد هدرجة، أو المحفزات (مواد صلبة) التي تستخدم في تفاعلات الهدرجة التي يدخل فيها غاز (المتفاعلات الغازية)؛ يطلق عليها في الحالة اسم المحفزات غير المتجانسة.
الديناميكا الحرارية والآلية
[عدل]تكون آليات التحفيز غير المتجانس والتحفز المتجانس في معظم الحالات متشابهة نسبيا. حيث يرتبط المحفز (معدن) بجزيء الهيدروجين، ومن ثم بالمركب عن طريق رابطة المتعددة، لينقل بعدها ذرات الهيدروجين واحدة تلو أخرى. من خلال هذه الآلية، تضاف ذرات الهيدروجين على نفس الجانب الذي توجد به الرابطة المتعددة، وبالتالي يمكننا القول بأنه تفاعل إضافة من النمط مع.
التحفيز غير المتجانس
[عدل]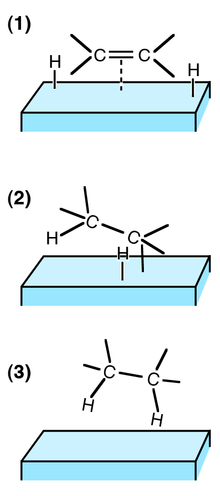
ترتبط كل ذرة من جزيء ثنائي الهيدروجين بالمحفز (عادة ما يكون معدنا)، الشئ الذي يجعل الرابطة الموجودة بين الذرتين أكثر هشاشة وعاجزة إلكترونيا، فتصبح قابلة للتفاعل مع الرابطة المتعددة الغنية بالإلكترونات. كنتيجة لذلك تضاف ذرة هيدروجين إلى الرابطة المزدوجة (هذه الخطوة قابلة للعكس) ثم تضاف بعدها الذرة الأخرى (هذه الخطوة لا رجوع عنها في ظل ظروف الهدرجة).
التحفيز المتجانس
[عدل]في معظم عمليات الهدرجة باستخدام المحفزات المتجانسة،[10] يرتبط المعدن بالهيدروجين وبالمركب المراد هدرجته، لتكوين وسيط مكون من المركب والفلز والهيدروجين معا. إذا افترضنا أن التسلسل العام للتفاعلات هو التسلسل الموصوف أدناه، أو على الأقل تسلسل قريب جدا منه (نأخذ هنا الألكين مثلا كمركب).
- تتشكل رابطة بين المحفز الفلزي والهيدروجين لتكوين مركب ثنائي الهيدريد (إضافة مؤكسِدة):
- LnM + H2 → LnMH2.
- يرتبط هذا المركب بالألكين لنحصل على:
- LnM(H2) + CH2=CHR → Ln-1MH2(CH2=CHR) + L.
- تنتقل بعدها إحدى ذرات الهيدروجين من الفلز إلى الكربون (إضافة بالإزاحة) فتكون النتيجة:
- Ln-1MH2(CH2=CHR) → Ln-1M(H)(CH2-CH2R).
- تنتقل ذرة الهيدروجين الثانية من الفلز إلى مجموعة الألكيل بالتزامن مع تفكك الألكان (استبعاد اختزالي) لنحصل على:
- Ln-1M(H)(CH2-CH2R) → Ln-1M + CH3-CH2R.
تأثير الضغط على عملية الهدرجة
[عدل]بزيادة ضغط غاز الهيدروجين، تزداد معه نسبة إذابة هذا الغاز في المذيب، وهو ما يؤدي بدوره إلى زيادة عدد جزيئات الهيدروجين المفككة (النشطة) بواسطة الفلز. من ناحية أخرى، تؤدي زيادة ضغط غاز الهيدروجين بشكل كبير إلى تقليل قابلية ذوبان المادة المتفاعلة الرئيسية، والتي يمكن أن تتبلور أو تترسب على جسيمات المحفز؛ وهو ما سيوقف تفاعل الهدرجة.
الهدرجة الخالية من الفلزات
[عدل]لمعظم الأغراض العملية، تتطلب الهدرجة محفزًا معدنيًا. ومع ذلك، يمكن أن تنطلق الهدرجة من بعض المانحين للهيدروجين بدون محفزات، والجهات المانحة للهيدروجين التوضيحية هي ثنائي أميد وأيزوبروبوكسيد الألومنيوم، وهذا الأخير يوضحه اختزال ميروين - بونندورف - فيرلي. تم فحص بعض أنظمة التحفيز الخالية من المعادن في البحث الأكاديمي. أحد هذه الأنظمة لتقليل الكيتونات يتكون من ثلاثي البيوتانول وثلاثي بوتوكسيد البوتاسيوم ودرجات حرارة عالية جدًا.[11] يصف التفاعل الموضح أدناه هدرجة البنزوفينون:

وجدت دراسة حركية كيميائية أن هذا التفاعل هو من الدرجة الأولى في جميع المواد المتفاعلة الثلاثة مما يشير إلى حالة انتقالية دورية مكونة من 6 أعضاء.
يعتمد نظام آخر للهدرجة الخالية من المعادن على مركب الفوسفين-بوران، المركب 1، والذي أطلق عليه اسم زوج لويس المحبط. يقبل بشكل عكسي ثنائي الهيدروجين في درجات حرارة منخفضة نسبيًا لتكوين بورات الفوسفونيوم 2 التي يمكن أن تقلل من الإيمينات المعوقة البسيطة.
التطبيقات
[عدل]الكيمياء العضوية
[عدل]هدرجة الروابط المتعددة بين الكاربون والكاربون
[عدل]تعد هدرجة روابط الكاربون-كربون المتعددة (المزدوجة أو الثلاثية)، أحد أحدأهم تطبيقات الهدرجة التحفيزية في الكيمياء العضوية. تستخدم هذه التقنية فعليا في صناعة المواد الغذائية، لتشبع الدهون غير المشبعة وتحويلها من حالتها السائلة إلى الصلبة. في عملية الهدرجة هذه يستخدم بشكل عام ثنائي الهيدروجين مع محفز غير قابل للذوبان، مثل البلاديوم أو البلاتين أو الإيريديوم أو النيكل (نيكل راني). يمكن أن تشكل الهدرجة الجزئية للرابطة الثلاثية للألكينات مركبين: مماكبي الألكين المقابل E أو Z. يؤدي الاختيار الذي يتم الرسو عليه للمحفز أحيانا دورا مهما في الحصول بشكل تفضيلي على واحد من هذين الشبيهين الفراغيين (أمثلة: استخدام الليندلار كمحفز يؤدي في النهاية لإنتاج الشبيه Z بشكل تفضيلي؛ في المقابل يميل النظام المعتمد على الصوديوم أو الأمونيا أكثر نحو إنتاج الشبيه E).

مع ذلك، وفي ظل ظروف الهدرجة، يتم في غالب الأحيان هدرجة الألكينات نفسها بسرعة إلى ألكان؛ باستخدام محفزات خاصة أقل تفاعلا، مثل محفز الليندلار، يمكن إيقاف الهدرجة في مرحلة الألكين.

يلعب العائق الفراغي دورا مهما في تسهيل الهدرجة التحفيزية للألكينات، حيث يسمح إما بتنفيذ هذا التفاعل عند ضغط ودرجة حرارة «عاديين»، أو يتطلب ظروفا أكثر قسوة. وبالتالي، سيتم هدرجة الألكين أحادي الاستبدال بسهولة، بينما سيكون من الصعب هدرجة الألكين متعدد الاستبدال.
يمكن أن تكون الهدرجة أيضا مقياسا لاستقرار المركبات غير المشبعة. على سبيل المثال من خلال ملاحظة عملية هدرجة كل من السيكلوهكسين والسيكلوهكسل 1,3-ديين، يمكننا استقراء الحاصل لاستنتاج تفاعل السيكلو هاكساترين النظري (ذي الروابط الموضعية المزدوجة) وبالتالي مقارنة استقراره مع البنزين، وهو ما يجعل من عملية قياس تأثير الاستقرار الناتج عن عدم تموضع الروابط المزدوجة في مركب عطري ممكنة.
هدرجة الروابط المتعددة الأخرى
[عدل]يمكن عن طريق الهدرجة أيضا اختزال الروابط المتعددة بين الكربون وذرة متغايرة أو بين ذرة متغايرة وأخرى. على وجه التحديد، من الممكن اختزال مجموعات النترو والإيمين والأكسيم.

عملية هابر على سبيل المثال، وهي عملية واسعة النطاق تقوم بهدرجة النيتروجين لإنتاج الأمونيا:
يمكن أيضا هدرجة ثنائي الأكسجين جزئيا إلى بيروكسيد الهيدروجين، ولكنها تبقى عملية غير متطور بشكل جيد.
الصناعة
[عدل]تستعمل عملية الهدرجة في العديد من التطبيقات الصناعية. من بين تلك التطبيقات نجد على سبيل المثال لا الحصر: عملية هابر، وهي عملية هدرجة تمكن من تحويل ثنائي النيتروجين إلى أمونيا، وأيضا عملية بيرجيوس المستعملة في تصنيع البنزين الاصطناعي انطلاقا من الفحم الحجري. تُستخدم الهدرجة أيضا في الصناعات البتروكيماوية، لتحويل الألكينات إلى ألكانات أقل تطاير، وكذا تحويل المركبات العطرية إلى ألكانات مشبعة (بارافينات) وألكانات حلقية (نافثينات). بالإضافة إلى استعمالها التكسير الهيدروجيني للمخلفات الثقيلة لتحويلها إلى ديزل.
سكر الزيليتول (بوليول) كذلك، هو نتاج لعملية هدرجة الزيلوز.
الآثار الصحية
[عدل]أهم الآثار الجانبية للهدرجة غير المكتملة للمواد الدهنية هي مماكبة بعض المركبات غير المشبعة لتنتج على وجه التحديد أحماضا دهنية غير مشبعة (أحماض دهنية متحولة)، وهي أشكال تقابلية مختلفة تماما عن الأحماض الدهنية المقرونة السائدة طبيعيا. ينتج ذلك بسبب الحرارة القياسية لتكوين المنخفظة التي تمتاز بها المركبات التقابلية، وبالتالي فهي تتكون بشكل تفضيلي من الناحية ديناميكية الحرارية، مما يؤدي توازن الرابطة المتقابلة أو المقترنة بنسبة تقارب 1: 2. مع ذلك، للأحماض الدهنية التقابلية الناتجة عن عملية الهدرجة آثار بالغة على الصحة، حيث ان استهلاكها يزيد من خطر الإصابة بأمراض القلب والأوعية الدموية. ارتباطا هذا، تميل التشريعات في أوروبا والولايات المتحدة إلى أن تكون أكثر صرامة مع هذه المنتجات، من خلال تقييد بيعها والزام المصنعين بضرورة وضع نوع الدهون على ملصقات المنتجات الدهنية المشبعة المباعة في المتاجر.
اقرأ أيضاً
[عدل]مراجع
[عدل]- ^ (بالإنجليزية) K. Amoa, « Catalytic Hydrogenation of Maleic Acid at Moderate Pressures », في J. Chem. Educ., vol. 84, no 12, 2007, ص. 1948 ISSN 0021-9584 [lien DOI].
- ^ "Hydrogenation | chemical reaction". Encyclopedia Britannica (بالإنجليزية). Archived from the original on 2020-10-23. Retrieved 2021-02-18.
- ^ (بالإنجليزية) V. Voorhees et R. Adams, « The use of the oxides of platinum for the catalytic reduction of organic compounds. I », في J. Am. Chem. Soc., vol. 44, no 6, 1922, ص. 1397–1405 ISSN 0002-7863 [lien DOI].
- ^ (بالإنجليزية) M.-Y. Ngai, J.-R. Kong قالب:Et al., « Hydrogen-Mediated C−C Bond Formation: A Broad New Concept in Catalytic C−C Coupling », في J. Org. Chem., vol. 72, no 4, 2007, ص. 1063–1072 ISSN 0022-3263 [lien DOI].
- ^ Industry Leader ThalesNano Delivers 500th H-Cube® to Prestigious Institute in China - ThalesNano نسخة محفوظة 2019-07-10 على موقع واي باك مشين.
- ^ P. N., Rylander (2000). "Hydrogenation and Dehydrogenation". Ullmann's Encyclopedia of Industrial Chemistry (بالإنجليزية). Weinheim, Germany: جون وايلي وأولاده. DOI:10.1002/14356007.a13_487..
- ^ (بالإنجليزية) T. van Es et B. Staskun, « Aldehydes from Aromatic Nitriles: 4-Formylbenzenesulfonamide », في Org. Synth., vol. 51, 1971, ص. 20 ISSN 0078-6209 [lien DOI].
- ^ (بالإنجليزية) C. F. H. Allen et J. VanAllan, « m-Toylybenzylamine », في Org. Synth., vol. 21, 1941, ص. 108 ISSN 0078-6209 [lien DOI].
- ^ (بالإنجليزية) A. B. Mekler, S. Ramachandran قالب:Et al., « 2-Methyl-1,3-Cyclohexanedione », في Org. Synth., vol. 41, 1961, ص. 56 ISSN 0078-6209 [lien DOI].
- ^ J., de Vries; J., Cornelis (2007). The Handbook of Homogeneous Hydrogenation (بالإنجليزية). Weinheim, Germany: جون وايلي وأولاده. p. 1568. DOI:10.1002/9783527619382. ISBN:978-3-527-31161-3.
{{استشهاد بكتاب}}: الوسيط غير المعروف|isbn2=تم تجاهله (help). - ^ Walling، Cheves.؛ Bollyky، Laszlo. (1 سبتمبر 1964). "Homogeneous Hydrogenation in the Absence of Transition-Metal Catalysts". Journal of the American Chemical Society. ج. 86 ع. 18: 3750–3752. DOI:10.1021/ja01072a028. ISSN:0002-7863. مؤرشف من الأصل في 2021-03-10.
| في كومنز صور وملفات عن: هدرجة |

![Hydrogenation of nitrogen {\displaystyle \overbrace {\ce {N{\equiv }N}} ^{\text{nitrogen}}+\overbrace {3{\color {red}{\ce {H}}}{\ce {_{2}}}} ^{\underset {\text{(200 atm)}}{\text{hydrogen}}}{\ce {->[{\ce {Fe\ catalyst}}][350-550\,^{\circ }{\ce {C}}]}}\overbrace {{\ce {2N}}{\color {red}{\ce {H}}}{\ce {_{3}}}} ^{\text{ammonia}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62b912b3f344efcad1e52f7609019cf3c169f906)