لولب ألفا
المظهر
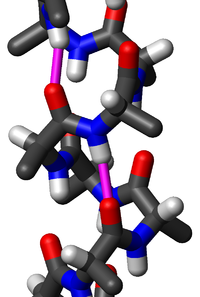
لولب ألفا أو حلزون ألفا[1] في الكيمياء الحيوية (بالإنجليزية: alpha helix أو α-helix) هو بروتين ثانوي البنية في الخلايا الحية شكله لولبي ملتفا طبقا لقاعدة اليد اليمنى.[2][3][4] منه تعطي كل مجموعة N-H في أمين رابطة هيدروجينية إلى مجموعة كربونيل C=O لحمض أميني.
تلك البنية الثانوية تسمى أحيانا «لولب ألفا باولينغ- كوري-برانسون»؛ ويعرف أيضا ب: 3.613-helix _ حيث يعطي عدد البقايا في كل لفة من اللولب وتشمل 13 ذرة في الحلقة التي تكوّن الرابطة الهيدروجينية. من تلك البنيات الثانوية نجد البروتينات وفيها تتواجد اللوالب ألفا شائعة، ويمكن التعرف عليها من المتسلسلات.
اكتشافها
[عدل]انظر أيضاً
[عدل]مراجع
[عدل]- ^ معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 25، OCLC:931065783، QID:Q113378673
- ^ [1]. نسخة محفوظة 30 سبتمبر 2017 على موقع واي باك مشين.
- ^ Huggins M (1943). "The structure of fibrous proteins". Chemical Reviews. ج. 32 ع. 2: 195–218. DOI:10.1021/cr60102a002.
- ^ Hudgins RR، Jarrold MF (1999). "Helix Formation in Unsolvated Alanine-Based Peptides: Helical Monomers and Helical Dimers". Journal of the American Chemical Society. ج. 121 ع. 14: 3494–3501. DOI:10.1021/ja983996a.
| في كومنز صور وملفات عن: لولب ألفا |

