خلية دم حمراء: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
Nada Mawaldi (نقاش | مساهمات) |
Nada Mawaldi (نقاش | مساهمات) لا ملخص تعديل |
||
| سطر 19: | سطر 19: | ||
تكون [[سيتوبلازم|بلازما]] الكريات الحمراء غنية ب[[الهيموغلوبين]]، وهو جزيء حيوي يحتوي على [[الحديد]] الذي يربط [[الأكسجين]] وهو المسؤول عن اللون الأحمر للخلايا والدم.<ref name=":1" /> يتكون [[غشاء خلوي|غشاء الخلية]] من [[بروتين|بروتينات]] و[[ليبيد|ليبيدات]]، ويوفر هذا الهيكل خصائص أساسية لوظيفة [[خلية|الخلية]] الفيزيولوجية مثل [[قابلية الكرية الحمراء لتغيير الشكل|قابلية تغيير الشكل]] و[[هشاشة الكرية الحمراء|الهشاشة]] أثناء عبور الجهاز الدوراني وخاصة شبكة [[الشعيرات الدموية]].<ref>{{Cite journal|عنوان=Erythrocyte Membrane Model with Explicit Description of the Lipid Bilayer and the Spectrin Network|مسار= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4129483/|صحيفة=Biophysical Journal|تاريخ=2014-08-05|issn=0006-3495|PMCID=4129483|PMID=25099803|صفحات=642–653|المجلد=107|العدد=3|DOI=10.1016/j.bpj.2014.06.031|الأول=He|الأخير=Li|الأول2=George|الأخير2=Lykotrafitis|مسار أرشيف= https://web.archive.org/web/20200411171719/https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4129483/|تاريخ أرشيف=2020-04-11}}</ref> |
تكون [[سيتوبلازم|بلازما]] الكريات الحمراء غنية ب[[الهيموغلوبين]]، وهو جزيء حيوي يحتوي على [[الحديد]] الذي يربط [[الأكسجين]] وهو المسؤول عن اللون الأحمر للخلايا والدم.<ref name=":1" /> يتكون [[غشاء خلوي|غشاء الخلية]] من [[بروتين|بروتينات]] و[[ليبيد|ليبيدات]]، ويوفر هذا الهيكل خصائص أساسية لوظيفة [[خلية|الخلية]] الفيزيولوجية مثل [[قابلية الكرية الحمراء لتغيير الشكل|قابلية تغيير الشكل]] و[[هشاشة الكرية الحمراء|الهشاشة]] أثناء عبور الجهاز الدوراني وخاصة شبكة [[الشعيرات الدموية]].<ref>{{Cite journal|عنوان=Erythrocyte Membrane Model with Explicit Description of the Lipid Bilayer and the Spectrin Network|مسار= https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4129483/|صحيفة=Biophysical Journal|تاريخ=2014-08-05|issn=0006-3495|PMCID=4129483|PMID=25099803|صفحات=642–653|المجلد=107|العدد=3|DOI=10.1016/j.bpj.2014.06.031|الأول=He|الأخير=Li|الأول2=George|الأخير2=Lykotrafitis|مسار أرشيف= https://web.archive.org/web/20200411171719/https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4129483/|تاريخ أرشيف=2020-04-11}}</ref> |
||
في البشر، تكون خلايا الدم الحمراء الناضجة أقراص إهليلجية مقعرة الوجهين ومرنة.<ref name=":0" /> تفتقر الكريات الحمر ل[[نواة الخلية]] ومعظم [[عضيات خلوية|العضيات]]، لكي تترك أقصى مساحة [[هيموغلوبين|للهيموغلوبين]] "الخضاب"، إذ يمكن اعتبارها محافظ من [[الغشاء البلازمي]] بداخلها الهيموغلوبين.<ref name=":0" /> يتم إنتاج ما يقرب من 2.4 مليون كريات دموية جديدة في الثانية في البشر البالغين.<ref name="Sackmann">[[Erich Sackmann]], ''Biological Membranes Architecture and Function.'', Handbook of Biological Physics, (ed. R.Lipowsky and E.Sackmann, vol.1, Elsevier, 1995</ref> تتطور الخلايا في [[نقي العظم]] وتدور لمدة حوالي 100-120 يوم في الجسم قبل أن يتم إعادة تدوير مكوناتها عن طريق [[البلاعم]].<ref name=":1" /> تستغرق كل دورة حوالي 60 ثانية (دقيقة واحدة).<ref name="Blom20032">{{cite book|مسار=https://books.google.com/books?id=CJ4c6gbewfQC&pg=PA27|عنوان=Monitoring of Respiration and Circulation|تاريخ=15 December 2003|ناشر=CRC Press|الرقم المعياري=978-0-203-50328-7|صفحة=27|مؤلف=J. A. Blom| مسار أرشيف = https://web.archive.org/web/20200112030022/https://books.google.com/books?id=CJ4c6gbewfQC&pg=PA27 | تاريخ أرشيف = 12 يناير 2020 }}</ref> تشكل كريات الدم الحمراء حوالي 84٪ من الخلايا الموجودة في جسم الإنسان.<ref>{{cite journal |الأخير1=Sender |الأول1=Ron |الأخير2=Fuchs |الأول2=Shai |الأخير3=Milo |الأول3=Ron |عنوان=Revised Estimates for the Number of Human and Bacteria Cells in the Body |صحيفة=PLoS Biology |تاريخ=19 August 2016 |doi=10.1371/journal.pbio.1002533}}</ref><ref name="dean">Laura Dean. [https://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=rbcantigen.TOC&depth=2 ''Blood Groups and Red Cell Antigens''] {{Webarchive|url=https://web.archive.org/web/20070609090814/http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=rbcantigen.TOC&depth=2 |date=9 يونيو 2007}}</ref><ref name="pierige">{{cite journal |المؤلفون=Pierigè F, Serafini S, Rossi L, Magnani M |عنوان=Cell-based drug delivery |صحيفة=Advanced Drug Delivery Reviews |المجلد=60 |العدد=2 |صفحات=286–95 |تاريخ=January 2008 |pmid=17997501 |doi=10.1016/j.addr.2007.08.029}}</ref> كما تشكل الكريات الحمر ما يقرب نصف حجم الدم، إذ يقدر [[هيماتوكريت|الهيماتوكريت]] عند الرجل البالغ (38-46%) والأنثى البالغة (35-44%).<ref>{{ |
في البشر، تكون خلايا الدم الحمراء الناضجة أقراص إهليلجية مقعرة الوجهين ومرنة.<ref name=":0" /> تفتقر الكريات الحمر ل[[نواة الخلية]] ومعظم [[عضيات خلوية|العضيات]]، لكي تترك أقصى مساحة [[هيموغلوبين|للهيموغلوبين]] "الخضاب"، إذ يمكن اعتبارها محافظ من [[الغشاء البلازمي]] بداخلها الهيموغلوبين.<ref name=":0" /> يتم إنتاج ما يقرب من 2.4 مليون كريات دموية جديدة في الثانية في البشر البالغين.<ref name="Sackmann">[[Erich Sackmann]], ''Biological Membranes Architecture and Function.'', Handbook of Biological Physics, (ed. R.Lipowsky and E.Sackmann, vol.1, Elsevier, 1995</ref> تتطور الخلايا في [[نقي العظم]] وتدور لمدة حوالي 100-120 يوم في الجسم قبل أن يتم إعادة تدوير مكوناتها عن طريق [[البلاعم]].<ref name=":1" /> تستغرق كل دورة حوالي 60 ثانية (دقيقة واحدة).<ref name="Blom20032">{{cite book|مسار=https://books.google.com/books?id=CJ4c6gbewfQC&pg=PA27|عنوان=Monitoring of Respiration and Circulation|تاريخ=15 December 2003|ناشر=CRC Press|الرقم المعياري=978-0-203-50328-7|صفحة=27|مؤلف=J. A. Blom| مسار أرشيف = https://web.archive.org/web/20200112030022/https://books.google.com/books?id=CJ4c6gbewfQC&pg=PA27 | تاريخ أرشيف = 12 يناير 2020 }}</ref> تشكل كريات الدم الحمراء حوالي 84٪ من الخلايا الموجودة في جسم الإنسان.<ref>{{cite journal |الأخير1=Sender |الأول1=Ron |الأخير2=Fuchs |الأول2=Shai |الأخير3=Milo |الأول3=Ron |عنوان=Revised Estimates for the Number of Human and Bacteria Cells in the Body |صحيفة=PLoS Biology |تاريخ=19 August 2016 |doi=10.1371/journal.pbio.1002533}}</ref><ref name="dean">Laura Dean. [https://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=rbcantigen.TOC&depth=2 ''Blood Groups and Red Cell Antigens''] {{Webarchive|url=https://web.archive.org/web/20070609090814/http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=rbcantigen.TOC&depth=2 |date=9 يونيو 2007}}</ref><ref name="pierige">{{cite journal |المؤلفون=Pierigè F, Serafini S, Rossi L, Magnani M |عنوان=Cell-based drug delivery |صحيفة=Advanced Drug Delivery Reviews |المجلد=60 |العدد=2 |صفحات=286–95 |تاريخ=January 2008 |pmid=17997501 |doi=10.1016/j.addr.2007.08.029}}</ref> كما تشكل الكريات الحمر ما يقرب نصف حجم الدم، إذ يقدر [[هيماتوكريت|الهيماتوكريت]] عند الرجل البالغ (38-46%) والأنثى البالغة (35-44%).<ref name=":8">{{مرجع كتاب|title=Harrison's Hematology and Oncology, 3E|url=https://books.google.com/books/about/Harrison_s_Hematology_and_Oncology_3E.html?id=GfrwDAAAQBAJ|publisher=McGraw Hill Professional|date=2016-09-22|ISBN=978-1-259-83582-7|language=en|author1=Dan L.}}</ref> |
||
== بنية كريات الدم الحمراء == |
== بنية كريات الدم الحمراء == |
||
| سطر 135: | سطر 135: | ||
== الوظيفة == |
== الوظيفة == |
||
=== الوظيفة الرئيسية<ref name=":0">{{Cite book|عنوان=Textbook of Medical physiology| |
=== الوظيفة الرئيسية<ref name=":0">{{Cite book|عنوان=Textbook of Medical physiology|طبعة=ninth edition|via=|first=|language=|author2=|author1=|الفصل=32|محرر1=translated to arabic by The world Health Organization|عنوان مترجم=المرجع في الفيزيولوجيا الطبية|تاريخ=1996|صفحة=|عمل=|بواسطة=|مكان=|لغة=Arabic|مؤلف2=John E. Hall, Ph.D|مؤلف1=C. Guyton, M.D|ناشر=|العمل=}}</ref> === |
||
إن الوظيفة الرئيسية للكريات الحمراء هي نقل الهيموغلوبين الذي يقوم بدوره بحمل [[أكسجين|الأكسجين]] من [[رئة|الرئتين]] إلى الأنسجة. وفي بعض الحيوانات الدنيا يدور الهيموغلوبين كبروتين حر في البلازما وليس محصوراً في الكريات الحمر. ولكنه عندما يكون حراً في بلازما الإنسان يتسرب حوالي 3% منه خلال أغشية الأوعية الشعرية إلى أحياز الأنسجة أو خلال أغشية [[كبيبة (كلية)|كبيبات الكلية]] إلى [[محفظة بومان]] كل مرة يمر فيها الدم خلال الشعيرات. ولذلك لكي يبقى الهيموغلوبين داخل مجرى الدم لا بد له من أن يبقى داخل كريات الدم الحمراء. |
إن الوظيفة الرئيسية للكريات الحمراء هي نقل الهيموغلوبين الذي يقوم بدوره بحمل [[أكسجين|الأكسجين]] من [[رئة|الرئتين]] إلى الأنسجة. وفي بعض الحيوانات الدنيا يدور الهيموغلوبين كبروتين حر في البلازما وليس محصوراً في الكريات الحمر. ولكنه عندما يكون حراً في بلازما الإنسان يتسرب حوالي 3% منه خلال أغشية الأوعية الشعرية إلى أحياز الأنسجة أو خلال أغشية [[كبيبة (كلية)|كبيبات الكلية]] إلى [[محفظة بومان]] كل مرة يمر فيها الدم خلال الشعيرات. ولذلك لكي يبقى الهيموغلوبين داخل مجرى الدم لا بد له من أن يبقى داخل كريات الدم الحمراء. |
||
=== وظائف ثانوية === |
=== وظائف ثانوية === |
||
| سطر 181: | سطر 181: | ||
إن عدم القدرة على اصطناع البروتين يجعل الكريات الحمراء الخاصة بالثدييات غير مستهدفة من قبل أي [[فيروس |فيروس]].<ref>{{cite news|مسار=https://www.nytimes.com/2007/03/27/science/27viral.html|عنوان=Scientists Explore Ways to Lure Viruses to Their Death|الأخير=Zimmer|الأول=Carl|تاريخ=2007-03-27|newspaper=The New York Times|تاريخ الوصول=2013-03-26| مسار أرشيف = https://web.archive.org/web/20200407003145/https://www.nytimes.com/2007/03/27/science/27viral.html | تاريخ أرشيف = 7 أبريل 2020 }}</ref> ومع ذلك، يمكن أن تؤثر الإصابة ب[[فيروسة صغيرة|الفيروسة الصغيرة]] parvovirus (مثل [[فيروس صغير ب19|فيروس صغير ب 19]]) على [[سليفة الأرومة الحمراء|سلائف الأرومة الحمراء]]، حيث لوحظ وجود سلائف أرومة حمراء عملاقة مع جزيئات فيروسية و[[مشتمل|مشتملات]]، وبالتالي تستنفذ بشكل مؤقت [[خلية شبكية|الشبكيات]] وتسبب [[فقر الدم]].<ref>{{cite journal|تاريخ=July 2002|عنوان=Human parvovirus B19|صحيفة=Clin Microbiol Rev|المجلد=15|العدد=3|صفحات=485–505|doi=10.1128/CMR.15.3.485-505.2002|pmc=118081|pmid=12097253|مؤلف1=Erik D. Heegaard|مؤلف2=Kevin E. Brown|lastauthoramp=yes}}</ref> |
إن عدم القدرة على اصطناع البروتين يجعل الكريات الحمراء الخاصة بالثدييات غير مستهدفة من قبل أي [[فيروس |فيروس]].<ref>{{cite news|مسار=https://www.nytimes.com/2007/03/27/science/27viral.html|عنوان=Scientists Explore Ways to Lure Viruses to Their Death|الأخير=Zimmer|الأول=Carl|تاريخ=2007-03-27|newspaper=The New York Times|تاريخ الوصول=2013-03-26| مسار أرشيف = https://web.archive.org/web/20200407003145/https://www.nytimes.com/2007/03/27/science/27viral.html | تاريخ أرشيف = 7 أبريل 2020 }}</ref> ومع ذلك، يمكن أن تؤثر الإصابة ب[[فيروسة صغيرة|الفيروسة الصغيرة]] parvovirus (مثل [[فيروس صغير ب19|فيروس صغير ب 19]]) على [[سليفة الأرومة الحمراء|سلائف الأرومة الحمراء]]، حيث لوحظ وجود سلائف أرومة حمراء عملاقة مع جزيئات فيروسية و[[مشتمل|مشتملات]]، وبالتالي تستنفذ بشكل مؤقت [[خلية شبكية|الشبكيات]] وتسبب [[فقر الدم]].<ref>{{cite journal|تاريخ=July 2002|عنوان=Human parvovirus B19|صحيفة=Clin Microbiol Rev|المجلد=15|العدد=3|صفحات=485–505|doi=10.1128/CMR.15.3.485-505.2002|pmc=118081|pmid=12097253|مؤلف1=Erik D. Heegaard|مؤلف2=Kevin E. Brown|lastauthoramp=yes}}</ref> |
||
== دورة الحياة == |
|||
=== التشكُّل === |
|||
== مكان تكوين كريات الدم الحمراء == |
|||
[[ملف:Erythropoese-ar.jpg|تصغير|مراحل تمايز الكريات الحمراء]] |
|||
يبدأ تكوين خلايا الدم الحمراء من الأسبوع الرابع من الحمل وحتى الشهر السادس منه في [[طحال|الطحال]] والكبد و في الثلاثة أشهر الأخيرة من الحمل تتكون هذه الكريات في [[نخاع العظام]] وقليلاً منها في الطحال والكبد. وفي الأطفال والبالغين تتكون كريات الدم الحمراء في نخاع العظام الأحمر الموجود في [[عظم مسطح|العظام المفلطحة]] كعظام الوجه و[[عظم الكتف|الكتف]] و[[جمجمة الإنسان|الجمجمة]] والضلوع و[[عمود فقري|العمود الفقري]] ونهايات [[عظم طويل|العظام الطويلة]] في الجسم [[عظم فخذ|كعظمة الفخذ]] و [[عظم عضد|عظم العضد]]. |
|||
تُنتج خلايا الدم المحيطية من [[خلية جذعية|خلايا جذعية]] بعملية تدعى [[تكون الدم|تكوّن الدم]] {{إنج|Hematopoiesis}} حيث Hemo تعني دم أما poiesis تعني تكوّن،<ref name=":8" /> والتي تستغرق حوالي 7 أيام.<ref>{{مرجع كتاب|title=Plasma Medicine|url=https://books.google.com/books?id=jxBenN9tlvIC&printsec=frontcover&hl=ar#v=onepage&q&f=false|publisher=John Wiley & Sons|date=2012-12-19|ISBN=978-1-118-43765-0|language=en|author1=Alexander|first2=Gary|author2=Friedman}}</ref> جميع أنواع الخلايا الجذعية لها وظيفتان أساسيتان: التجدد الذاتي والتمايز. أثناء التطور، تُنتَج كريات الدم في مواقع مختلفة من الجسم. في البداية، يوفر [[كيس محي|كيس المح]] كريات دم حمراء حاملة للأكسجين، ثم تقوم عدة مواقع جنينية بإنتاج الخلايا الدموية. حيث تُنتج الكريات الحمر من قبل [[كبد|الكبد]] ثم في الثلث الثاني من [[حمل|الحمل]] تُنتج في [[نخاع العظام|نقي العظم]] و<nowiki/>[[طحال|الطحال]]. مع تغير موقع الخلايا الجذعية، تتغير قدرة الخلايا الجذعية أيضاً بشكل تدريجي، إذ تزداد أنواع الخلايا المُنتَجة تعقيداً بالإضافة لتلك البسيطة الحاملة للأكسجين تُنتج [[صفيحة دموية|الصفيحات الدموية]] و<nowiki/>[[خلية دم بيضاء|الخلايا المناعية]] أخيراً.<ref name=":8" /> |
|||
يولد نقي كل العظام كريات دم حمراء حتى عمر الخامسة ليصبح [[نخاع العظام|نقي العظام]] بعد ذلك شحمياً، ما عدا الأقسام العلوية لعظمي [[عظم عضد|العضد]] و<nowiki/>[[قصبة الساق|الظنبوب]]، ثم تتولد معظم خلايا الدم بعد سن العشرين من نقي العظام الغشائية ك<nowiki/>[[فقرة (تشريح)|الفقرات]]، [[ضلع (تشريح)|الأضلاع]]، [[عظم القص|القص]] و<nowiki/>[[حرقفة (عظم)|الحرقفة]].<ref name=":0" /> ومع تقدم السن يقل إنتاج نقي العظم للخلايا الدموية.<ref name=":0" /> |
|||
== عمر ومصير كريات الدم الحمراء == |
|||
عند البالغين، الخلية الأولى التي يمكن تمييزها من سلسلة خلايا الدم الحمراء هي ''سليفة الأرومة الحمراء'' التي تتولد بأعداد كبيرة من الخلايا الجذعية، تنقسم سليفة الأرومات الحمر لتشكل ''الأرومات الحمر القعدة'' -تتلون بالملونات القاعدية- التي تحوي كميات قليلة من الخضاب الذي تتمتلئ به في الأجيال اللاحقة كما تتكاثف [[نواة (خلية)|النواة]] إلى حجم صغير وتطرح بقاياها الأخيرة إلى خارج الخلية، ويعاد في الوقت نفسه امتصاص [[شبكة إندوبلازمية|الشبكة الهيولية الباطنية]] لتسمى الخلية في هذه المرحلة ب''الخلية الشبكية'' لأنها مازالت تحوي كمية صغيرة من المادة القاعدية التي تتكون من بقايا [[جهاز غولجي]] و<nowiki/>[[ميتوكندريون|المتقدرات]] والقليل من [[عضية خلوية|عضيات الهيولى]] الأخرى، تصل الخلايا الشبكية إلى [[شعيرة دموية|الشعيرات الدموية]] بعملية الانسلال (تشكل الخلايا الشبكية 1% من تركيز كريات الدم الحمراء)، حيث تختفي خلال يوم أو يومين بقية المواد القاعدية من الخلايا الشبكية لتتحول إلى ''كرية حمراء ناضجة''.<ref name=":0" /> تعيش كريات الدم الحمراء عند الفرد السليم في الدورة الدموية حوالي 100 إلى 120 يوماً<ref>{{Cite journal|title=The genetic basis of the Rh blood group system|url=http://dx.doi.org/10.1046/j.1537-2995.1994.34694295073.x|journal=Transfusion|date=1994-06|issn=0041-1132|pages=539–541|volume=34|issue=6|DOI=10.1046/j.1537-2995.1994.34694295073.x|first=PL|last=Mollison}}</ref><ref name=":0" /> (و 80 إلى 90 يوماً في الرضيع).<ref>{{Cite journal|title=Fetal Erythrocyte Lifespan|url=http://dx.doi.org/10.1111/j.1440-1754.1979.tb01197.x|journal=Journal of Paediatrics and Child Health|date=1979-06|issn=1034-4810|pages=96–97|volume=15|issue=2|DOI=10.1111/j.1440-1754.1979.tb01197.x|first=K. L.|last=HARRISON}}</ref> |
|||
تؤدي هذه الكريات وظيفتها لمدة زمنية محدودة وهي حوالي 120 يوم وبعد ذلك يلتقط الطحال الكرات التي هرمت والمتكسرة ليحللها فيخرج منها مادة [[هيموغلوبين|الهيموجلوبين]]. ويتم أيضاً تحليل الهيموجلوبين لتكوين الصبغات الصفراوية التي يتخلص منها الدم بطردها مع عصارة الصفراء. وكرات الدم التي تنكسر يحل محلها في الحال كرات جديدة في نخاع العظام. |
|||
=== التحطُّم === |
|||
== العوامل التي يجب توافرها حتى يتم تكوين كريات الدم الحمراء == |
|||
مع تقدم عمر الكرية الحمراء، تصبح العمليات الاستقلابية فيها أقل نشاطاً مما يجعل غشاء الكرية هشاً مؤدياً لتحطم الكرية أثناء مرورها في مناطق ضيقة من الدوران، إذ تتشظى العديد من الكريات الحمراء في لب الطحال حيث تكون سعة الأحياز بين الترابيق حوالي 3 ميكرومتر فقط مقارنةً مع 8 ميكرومتر "قطر الكرية الحمراء السوية".<ref name=":0" /><ref>{{Cite journal|title=The Role of the Sinus Wall in the Passage of Erythrocytes Through the Spleen|url=http://dx.doi.org/10.1182/blood.v41.4.529.529|journal=Blood|date=1973-04-01|issn=0006-4971|pages=529–537|volume=41|issue=4|DOI=10.1182/blood.v41.4.529.529|first=Li-Tsun|last=Chen|first2=Leon|last2=Weiss}}</ref><ref>{{Cite journal|title=Das Schicksal toxisch veränderter roter Blutzellen in der Milz|url=http://dx.doi.org/10.1007/bf01486245|journal=Klinische Wochenschrift|date=1958-01|issn=0023-2173|pages=63–66|volume=|issue=2|DOI=10.1007/bf01486245|first=F.|last=Jung|place=|accessdate=}}</ref> وعند استئصال الطحال تزداد الكريات الحمراء الشاذة والهرمة في الدوران.<ref name=":0" /><ref>{{Cite journal|title=Removal of Old and Abnormal Red Blood Cells from Circulation: Mechanical and Immunologic Mechanisms|url=https://link.springer.com/chapter/10.1007/978-3-642-71790-1_7|publisher=Springer|journal=Blood Cells, Rheology, and Aging|date=1988|place=Berlin, Heidelberg|ISBN=978-3-642-71790-1|pages=62–72|DOI=10.1007/978-3-642-71790-1_7|language=en|first=D.|last=Drenckhahn|editor1-first=Dieter|editor1-last=Platt}}</ref> |
|||
* يجب أن يكون نخاع العظام سليمًا ولذلك فإذا أصابه أي مرض أو تلف كما يحدث في حالة التعرض [[أشعة سينية|للأشعة السينية (×)]] أو الإشعاعات الذرية أو بعض السموم فإن ذلك يؤدي إلى نقص في عدد كرات الدم الحمراء. |
|||
* يجب أن يحتوي الغذاء على عنصر الحديد لأنه يدخل في تركيب مادة [[هيموغلوبين|الهيموجلوبين]] ويوجد الحديد في السبانخ والبقول والتفاح واللحوم وصفار البيض وإذا لم يتوفر الحديد في الغذاء أو لم يتمكن الجسم من الاستفادة من الحديد في الغذاء يصبح لون الدم باهتاً وهذا ما يحدث في أحد أنواع الأنيميا، ويسهل علاجها بإعطاء المريض أدوية تحتوي على مركبات الحديد. |
|||
* يجب أن يحتوي الغذاء على [[فيتامين بي 12|فيتامين ب12]] الذي يطلق عليه العامل المانع للأنيميا الخبيثة وقد وجد أن هذا الفيتامين يتحد مع عامل آخر وهو العامل الداخلي والذي تفرزه المعدة ثم يمتص من الأمعاء ويختزن في الكبد إلى أن يستخدمه [[نخاع العظام]] وهذا الفيتامين هام جداً لاستكمال نمو خلايا الدم الحمراء. |
|||
تبلعم [[بلعم|البلاعم]] الخضاب مباشرة بعد تحريره من الكريات الحمر في عدة أقسام من الجسم، خاصة في الكبد ([[خلية كوبفر|خلايا كوبفر]]) والطحال ونقي العظم، ثم تحرر البلاعم [[حديد|الحديد]] إلى الدم ثانية لينقل بواسطة [[ترانسفرين|الترانسفيرين]] إلى نقي العظم ليعاد استخدامه مجدداً لتصنيع كريات حمراء جديدة أو إلى الكبد والأنسجة الأخرى ليُخزَّن على شكل [[فيريتين]]، أما جزء [[بورفيرين|البورفيرين]] تحوله البلاعم إلى [[بيليروبين]] يحرر في الدم ليطرح في [[صفراء|الصفراء]] أخيراً.<ref name=":0" /> |
|||
<br /> |
|||
== بعض الأمراض التي تصيب خلية الدم الحمراء == |
== بعض الأمراض التي تصيب خلية الدم الحمراء == |
||
نسخة 21:58، 25 أبريل 2020
| خلية دم حمراء | |
|---|---|
كريات الدم الحمراء (مقعرة الوجهين)
| |
 صورة بالمجهر الإلكتروني تظهر كرية دم حمراء (في اليسار)، صفيحة دموية (في الوسط)، كرية دم بيضاء (في اليمين).
| |
| تفاصيل | |
| وظيفة | نقل الأوكسجين |
| اختصار | RBC |
| نظام أحيائي | الجهاز الدموي الوعائي |
| المكتشف | يان زفامردام |
| نوع من | خلية دم |
| جزء من | دم |
| معرفات | |
| ترمينولوجيا هستولوجيكا | H2.00.04.1.01001 |
| FMA | 62845 |
| ن.ف.م.ط. | A11.118.290، وA11.443.240، وA15.145.229.334 |
| ن.ف.م.ط. | D004912 |
| تعديل مصدري - تعديل | |
كريات الدم الحمراء أو خلايا الدم الحمراء أو الكريات الحمر، ويشار إليها أيضاً بالخلايا الحمراء،[1] (بالإنجليزية: Red Blood Cells) لذلك يرمز لها اختصاراً RBC ولها مسميات أخرى بالإنجليزية (بالإنجليزية: Red blood corpuscles) أو (بالإنجليزية: Haematids) أو (بالإنجليزية: Erythroid cells) أو (بالإنجليزية: erythrocytes ) وهي كلمة مشتقة من اليونانية (erythros تعني "حمراء" و kytos تعني "وعاء مجوف"، مع اللاحقة cyte- التي تعني "خلية").[2]
وهي أكثر أنواع خلايا الدم تعداداً والوسيلة الرئيسية للفقاريات لتوصيل الأكسجين (O2) إلى أنسجة الجسم بواسطة الجريان الدموي في الدوران الجهازي.[3] تأخذ كريات الدم الحمراء الأكسجين في الرئتين، أو خياشيم الأسماك، وتحرره في الأنسجة أثناء مرورها في الشعيرات الدموية.[4]
تكون بلازما الكريات الحمراء غنية بالهيموغلوبين، وهو جزيء حيوي يحتوي على الحديد الذي يربط الأكسجين وهو المسؤول عن اللون الأحمر للخلايا والدم.[2] يتكون غشاء الخلية من بروتينات وليبيدات، ويوفر هذا الهيكل خصائص أساسية لوظيفة الخلية الفيزيولوجية مثل قابلية تغيير الشكل والهشاشة أثناء عبور الجهاز الدوراني وخاصة شبكة الشعيرات الدموية.[5]
في البشر، تكون خلايا الدم الحمراء الناضجة أقراص إهليلجية مقعرة الوجهين ومرنة.[4] تفتقر الكريات الحمر لنواة الخلية ومعظم العضيات، لكي تترك أقصى مساحة للهيموغلوبين "الخضاب"، إذ يمكن اعتبارها محافظ من الغشاء البلازمي بداخلها الهيموغلوبين.[4] يتم إنتاج ما يقرب من 2.4 مليون كريات دموية جديدة في الثانية في البشر البالغين.[6] تتطور الخلايا في نقي العظم وتدور لمدة حوالي 100-120 يوم في الجسم قبل أن يتم إعادة تدوير مكوناتها عن طريق البلاعم.[2] تستغرق كل دورة حوالي 60 ثانية (دقيقة واحدة).[7] تشكل كريات الدم الحمراء حوالي 84٪ من الخلايا الموجودة في جسم الإنسان.[8][9][10] كما تشكل الكريات الحمر ما يقرب نصف حجم الدم، إذ يقدر الهيماتوكريت عند الرجل البالغ (38-46%) والأنثى البالغة (35-44%).[11]
بنية كريات الدم الحمراء
الفقاريات
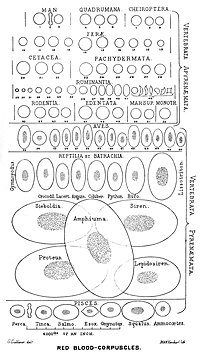
تقريباً جميع الفقاريات، بما في ذلك جميع الثدييات والبشر، تملك كريات دم حمراء. الفقاريات الوحيدة المعروفة بفقدانها لكريات الدم الحمراء هي أسماك التمساح الثلجية (عائلة Channichthyidae)، وهي تعيش في ماء بارد غني بالأكسجين حيث ينتقل الأكسجين المنحل بحرية في دمائهم.[13] على الرغم من أنها لا تستخدم الخضاب، إلا أنه يمكن العثور على بقايا مورثات الخضاب في مَجينها (مادتها الوراثية، وهي مجموع المورثات الموجودة في الكائن الحي).[14]
تتكون كريات الدم الحمراء عند الفقاريات بشكل رئيسي من الهيموغلوبين، وهو بروتين متمعدن يحتوي على مجموعات الهيم التي ترتبط ذراتها الحديدية مؤقتاً بجزيئات الأكسجين (O2) في الرئتين أو الخياشيم وتطلقها في جميع أنحاء الجسم، إذ يمكن للأكسجين أن ينتشر بسهولة من خلال غشاء كريات الدم الحمراء.[15] يحمل الهيموغلوبين الموجود في كريات الدم الحمراء أيضاً بعضاً من ثاني أكسيد الكربون الناتج عن مُستقلَبَات الأنسجة، ومع ذلك، يتم نقل معظم ثاني أكسيد الكربون إلى الشعيرات الدموية الرئوية على شكل بيكربونات (-HCO3) ذوابة في بلازما الدم. يعمل الميوغلوبين، وهو مركب مرتبط بالهيموغلوبين، على تخزين الأكسجين في الخلايا العضلية.[16]

يعود لون كريات الدم الحمراء إلى مجموعة الهيم الموجودة في الهيموغلوبين.[2] أما بلازما الدم فتكون ذات لون شبيه بالقش،[17][18] ولكن تغير كريات الدم الحمراء لونها تبعاً لحالة الهيموغلوبين: عند ارتباطها بالأكسجين فإن أوكسي هيموغلوبين الناتج يكون قرمزي اللون، أما عندما يتم إطلاق الأكسجين يكون لون ديوكسي هيموغلوبين الناتج بلون أحمر داكن (خمري).[18][15] ومع ذلك، يمكن أن يبدو الدم مزرقاً عند رؤيته من خلال جدار الوعاء والجلد.[19] يستفيد مقياس الأكسجة والنبض من تغيير لون الهيموغلوبين لقياس إشباع الأكسجين في الدم الشرياني مباشرة باستخدام تقنيات القياس اللوني.[15] يملك الهيموغلوبين ألفة عالية جداً لأول أكسيد الكربون، مُشكلاً كربوكسي هيموغلوبين ذو لون أحمر قاني جداً.[20] في بعض الأحيان، يُقرأ إشباع الأكسجين 100٪ خطأً على مقياس الأكسجة والنبض عند المتسممين بأول أكسيد الكربون.
وجود البروتينات الحاملة للأكسجين داخل الخلايا المتخصصة (الكريات الحمراء) خطوة مهمة في تطور الفقاريات لأنها تجعل الدم أقل لزوجة، وتوفر تراكيز أعلى من الأكسجين، وانتشار أفضل للأكسجين من الدم إلى الأنسجة. يختلف حجم خلايا الدم الحمراء على نطاق واسع بين أنواع الفقاريات، يكون عَرض كريات الدم الحمراء أكبر من قطر الشعيرات الدموية بحوالي 25٪، وقد تم افتراض أن هذا يحسن نقل الأكسجين من كريات الدم الحمراء إلى الأنسجة.[21]
الثدييات
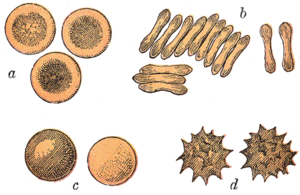
تأخذ كريات الدم الحمراء للثدييات شكل أقراص مقعرة الوجهين: مسطحة ومقعرة في المركز، مع مقطع عرضي يشبه الطارة، وحافة مستديرة للقرص. يسمح هذا الشكل بزيادة نسبة مساحة السطح إلى الحجم (SA/V) مما يسهل انتشار الغازات.[22] ومع ذلك، يوجد بعض الاستثناءات المتعلقة بالشكل في رتبة مزدوجات الأصابع (ذوات الحوافر بما في ذلك الماشية والغزلان)، والتي تملك مجموعة واسعة من أشكال كريات الدم الحمراء: الخلايا الصغيرة والبيضاوية للغاية في اللاما والإبل (عائلة جمليات)، خلايا كروية صغيرة في غزلان الفأر (عائلة طرغولية)، وخلايا ذات أشكال مغزلية، سِنانية الشكل، هلالية، ومتعددة الأضلاع بشكل غير منتظم وغيرها من الأشكال الزاويّة في الغزلان الحمراء والوَبِّيت (عائلة الأيل). من الواضح أن أعضاء من هذه الرتبة قد طوروا نمطاً شكلياً مختلفاً عن الثدييات.[12][23]
بشكل عام، تتميز كريات الدم الحمراء للثدييات بالمرونة وتغيير الشكل بشكل ملحوظ بسبب الضغط المطبق عليها أثناء مرورها في الشعيرات الدموية الصغيرة، وكذلك لزيادة سطحها من خلال افتراض شكل سيجارة، حيث تطلق حمولة الأوكسجين بكفاءة.[24]
إن كريات الدم الحمراء في الثدييات فريدة من نوعها بين الفقاريات لأنها لا تحتوي على نوى عندما تنضج.[15] تملك الكريات الحمراء نوى خلال المراحل المبكرة من تَكَوُّن الكريات الحمر، لكنها تتخلص منها أثناء تطورها عند الوصول إلى مرحلة النضج، مما يوفر مساحة أكبر للهيموغلوبين، تفقد كريات الدم الحمراء غير المنواة، والتي تدعى بالخلايا الشبكية، جميع العضيات الخلوية الأخرى مثل المتقدرات، جهاز كولجي، والشبكة الهيولية الباطنة.[15]
يعمل الطحال كمخزن لكريات الدم الحمراء، ولكن هذا التأثير محدود نوعاً ما في البشر. في بعض الثدييات الأخرى، مثل الكلاب والخيول، يحتجز الطحال أعداداً كبيرة من كريات الدم الحمراء، التي يتم إلقاؤها في الدم عند الجهد، مما يزيد القدرة على نقل الأكسجين.[25]
الإنسان

يبلغ قطر كرية الدم الحمراء البشرية المعتاد حوالي 6.2-8.2 ميكرومتر،[26] ويبلغ سمكها في أثخن نقطة 2-2.5 ميكرون وسمكها في المركز 0.8-1 ميكرون، جاعلاً إياها أصغر بكثير من معظم الخلايا البشرية الأخرى. يبلغ متوسط حجم هذه الخلايا حوالي 90 فيمتوليتر[27] وتبلغ مساحتها حوالي 136 ميكرومتر مربع، ويمكن أن تتضخم إلى شكل كروي يحتوي على 150 فيمتوليتر، دون تَمَدُد الغشاء.[18]
يوجد لدى البشر البالغين في أي وقت من الأوقات ما يقرب من 20 إلى 30 تريليون كرية دم حمراء، وتشكل حوالي 70٪ من تعداد جميع خلايا الجسم.[28] تملك النساء حوالي 4-5 ملايين كرية دم حمراء لكل ميكروليتر (ملليمتر مكعب) من الدم أما الرجال حوالي 5-6 مليون كرية. يكون لدى الأشخاص القاطنين في المرتفعات -حيث يكون ضغط الأكسجين منخفض- تعداد كريات حمر أكبر. إن كريات الدم الحمراء أكثر تعداداً من خلايا الدم الأخرى: فهناك حوالي 4000-11000 خلية دم بيضاء وحوالي 150000-400000 صفيحة لكل ميكروليتر.[18]
تستغرق كريات الدم الحمراء البشرية في المتوسط 60 ثانية لإكمال دورة دموية واحدة.[7][10][29] يعود اللون الأحمر للدم إلى الخواص الطيفية لأيونات الحديد الهيمية في الخضاب. تحتوي كل كرية دم حمراء بشرية على حوالي 270 مليون[30] جزيئة هيموغلوبين. يحمل كل جزيء هيموغلوبين أربع مجموعات من الهيم، يشكل الهيموغلوبين حوالي ثلث إجمالي حجم الخلية. يعتبر الهيموغلوبين هو المسؤول عن نقل أكثر من 98٪ من الأكسجين في الجسم (يتم حمل الأكسجين المتبقي على شكل منحل في بلازما الدم). تخزن كريات الدم الحمراء عند ذكر بالغ حوالي 2.5 غرام من الحديد، وهو ما يمثل حوالي 65٪ من إجمالي الحديد الموجود في الجسم.[31][32]
البنية المجهرية
النواة
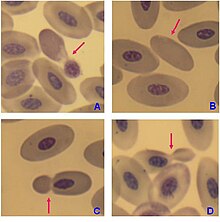
تكون كريات الدم الحمراء الناضجة غير منواة في الثدييات، وهذا يعني أنها تفتقر لنواة الخلية. بالمقابل، تحتوي كريات الدم الحمراء للفقاريات الأخرى على نوى، الاستثناءات الوحيدة المعروفة هي السمندرات من جنس بتراشيب وسمك من جنس موريولوس.[33][34]
تم تفسير ظاهرة غياب النواة في كريات الدم الحمراء عند الفقاريات بالتراكم المتتالي للحمض النووي DNA غير المرمز في الجينوم.[35] يدور الجدل على النحو التالي: يتطلب النقل الفعال للغاز عبور كريات الدم الحمراء عبر شعيرات دموية ضيقة للغاية، وهذا يقيد حجمها. تتواجد كريات الدم الحمراء المنواة في الثدييات في نوعين من الخلايا: الأرومات الطبيعية، وهي سلائف طبيعية منتجة للكريات الحمر الناضجة، والأرومات العرطلة، وهي سلائف غير طبيعية كبيرة تتشكل في فقر الدم العرطل.
تكوين الغشاء
تكون كريات الدم الحمراء قادرة على تغيير شكلها، مرنة، قادرة على الالتصاق بخلايا أخرى، وتكون قادرة على التفاعل مع الخلايا المناعية. يلعب غشاء الكرية العديد من هذه الأدوار، إذ تعتمد هذه الوظائف بشكل كبير على تكوين الغشاء. يتكون غشاء كريات الدم الحمراء من ثلاث طبقات: كنان سكري موجود في الخارج، وهو غني بالسكريات، ليبيد ثنائي الطبقة يخترقه العديد من البروتينات عبر غشائية، إلى جانب مكوناتها الدهنية الرئيسية، وهيكل الغشاء، تتوضع شبكة هيكلية من البروتينات على السطح الداخلي لليبيدات ثنائية الطبقة. تشكل البروتينات حوالي 52% من كتلة الغشاء في كريات الدم الحمراء البشرية ومعظم الثدييات أما النصف الآخر دهون حوالي 40%، وهي فسفوليبيد وكوليسترول، أما السكريات تشكل حوالي 8%.[36][37][38]
ليبيدات الغشاء

يتكون غشاء كريات الدم الحمراء من ليبيد ثنائي الطبقة نموذجي، على غرار ما يمكن العثور عليه في جميع الخلايا البشرية تقريباً.[39] ببساطة، يتكون الليبيد ثنائي الطبقة من كوليسترول وفوسفوليبيد بنسب متساوية من حيث الوزن، كما أن تركيبة الليبيد مهمة لأنها تحدد العديد من الخصائص الفيزيائية مثل نفاذية الغشاء والسيولة.[39] بالإضافة إلى ذلك، يتم تنظيم نشاط العديد من بروتينات الغشاء من خلال التفاعلات مع الليبيدات في الطبقتين. على عكس الكوليسترول، الذي يتم توزيعه بالتساوي بين الطبقتين الداخلية والخارجية، تتوضع الأنواع الخمسة الرئيسية من الفوسفوليبيدات بشكل غير متماثل، كما هو موضح أدناه:
الطبقة الخارجية الأحادية[40]
- فسفاتيديل كولين (PC)
- سفنغوميلين (SM)
الطبقة الداخلية الأحادية[40]
- فسفاتيديل إيثانولامين (PE)
- فوسفوإينوسيتول (PI) (كميات صغيرة)
- فوسفاتيديل سيرين (PS)
توزيع الفوسفوليبيد غير المتماثل بين الطبقة الثنائية هو نتيجة وظيفة العديد من البروتينات الناقلة للفوسفوليبيد المعتمدة وغير المعتمدة على الطاقة.[41][42] تقوم البروتينات المسماة "فليباز" بنقل الفوسفوليبيد من الطبقة الخارجية إلى الطبقة الداخلية، بينما تقوم البروتينات الأخرى المسماة "فلوباز" بإجراء العملية المعاكسة، عكس مدروج التركيز بطريقة تعتمد على الطاقة.[43] بالإضافة إلى ذلك، هناك أيضاً بروتينات "سكرامبلاز" التي تحرك الفوسفوليبيدات في كلا الاتجاهين في نفس الوقت، حسب المدروج الأخفض بطريقة غير معتمدة على الطاقة. لا يزال هناك جدل كبير مستمر حول هوية بروتينات صيانة الغشاء في الكرية الحمراء.
يعد الحفاظ على توزيع الفوسفوليبيدات غير المتماثل في الطبقة الثنائية (مثل التوضع الحصري لـ PS و PIs في الطبقة الداخلية) أمراً مهماً لسلامة الخلية ووظيفتها لعدة أسباب:
- تتعرف البلاعم وتبلعم الكريات الحمراء التي تحوي PS على سطحها الخارجي. وبالتالي فإن توضع PS في الطبقة الأحادية الداخلية ضروري لنجاة الخلية من بالعات الجهاز الشبكي البطاني، خاصة في الطحال.
- تم ربط تدمير كريات الدم الحمراء الباكر في التلاسيميا وفقر الدم المنجلي باضطرابات عدم تناسق الليبيدات مما يؤدي إلى توضع PS في الطبقة الأحادية الخارجية.[44]
- يمكن أن يؤدي التعرض للـ PS إلى تحفيز التصاق كريات الدم الحمراء بالخلايا البطانية الوعائية، ويمنع بشكل فعال المرور الطبيعي خلال الأوعية الدموية الدقيقة. وبالتالي من المهم الحفاظ على PS فقط في الطبقة الداخلية لضمان التدفق الطبيعي للدم في الشعيرات الدموية الدقيقة.[45]
- يمكن لكل من PS و فوسفاتيديل لينوسيتول 4,5 ثنائي الفوسفات (PIP2) تنظيم الوظيفة الميكانيكية للغشاء، بسبب تفاعلهما مع بروتينات هيكلية مثل سبيكترين والبروتين 4.1R.[46] أظهرت الدراسات الحديثة أن ربط السبيكترين مع PS يعزز الاستقرار الميكانيكي للغشاء.[46] يعزز PIP2 ارتباط البروتين 4.1R بالغليكوفرين C ولكنه يقلل تفاعله مع البروتين 3، وبالتالي قد يعدل ارتباط الطبقة الثنائية بهيكل الغشاء.
وقد وصفت الدراسات الحديثة وجود هياكل متخصصة تسمى "الطوافات الليبيدية" في غشاء كريات الدم الحمراء. هذه الهياكل غنية بالكوليسترول والسفينغوليبيد المرتبطة ببروتينات غشاء محددة، وهي FLOT1، ستوماتين (المجموعة 7)، بروتين G، مستقبلات بيتا الأدرينالية.[47][48]
تقوم الطوافات الليبيدية (التي تشارك في إحداث إشارات خلوية في خلايا غير الكريات الحمراء) في الكريات الحمر بالتوسط في إشارات مستقبلات بيتا 2 الأدرينالينية وزيادة مستويات cAMP، وبالتالي تنظيم دخول طفيليات الملاريا إلى كريات حمراء طبيعية.[49][50]
بروتينات الغشاء

تكون بروتينات الغشاء مسؤولة عن تغير شكل كريات الدم الحمراء ومرونتها، مما يمكّنها من الانضغاط أثناء عبورها الشعيرات الدموية[52] التي يقل قطرها عن نصف قطر كرية الدم الحمراء (7–8 ميكرون) واستعادة الشكل القرصي في أقرب وقت عندما تزول قوى الضغط المطبقة عليها، بطريقة مشابهة لجسم مطاطي.
يوجد حالياً أكثر من 50 بروتين غشائي معروف، يتراوح عددها من بضع مئات إلى مليون نسخة في كل كرية دم حمراء.[52] ما يقرب 25 نوع بروتيني غشائي يحمل مستضدات زمر الدم المختلفة، مثل مستضدات A و B و Rh.[52] يمكن أن تؤدي بروتينات الغشاء مجموعة متنوعة من الوظائف، مثل نقل الأيونات والجزيئات عبر غشاء الكرية الحمراء، الالتصاق والتفاعل مع الخلايا الأخرى[39] مثل الخلايا البطانية، كمستقبلات إشارة، بالإضافة إلى وظائف أخرى غير معروفة حالياً. نشأت أنواع الدم عند البشر نتيجة الاختلاف في البروتينات السكرية للكريات الحمراء. ترتبط اضطرابات بروتينات الغشاء بالعديد من الأمراض، مثل كثرة الكريات الحمر الكروية الوراثية، وكثرة الكريات الإهليلجية الوراثي، وكثرة الكريات المفوهة الوراثية، والبيلة الخضابية الليلية الانتيابية.[36][49]
تصنف بروتينات الغشاء وفقاً لوظائفها:

النقل
- البروتين 3 الشريطي: ناقل الأيون، وهو أيضاً مُكوّن هيكلي مهم لغشاء كرية الدم الحمراء، ويُشكّل ما يقارب 25٪ من سطح غشاء الخلية، وتحتوي كل خلية حمراء على مليون نسخة تقريباً. يُعرِّف زمرة الدم دييغو.[53][52]
- أكوابورين 1: ناقل للماء، يُعرِّف زمرة الدم كولتون.[52]
- ناقل الغلوكوز 1: ناقل للغلوكوز وحمض ديهيدروسكوربيك.[52]
- بروتين مستضد Kidd: ناقل للبولة.[52]
- البروتين السكري المرتبط بعامل ريزيوس: ناقل للغاز، وربما ثنائي أكسيد الكربون، يعرف زمرة دم ريزيوس وما يرتبط بها من النمط الظاهري لزمرة الدم رينول.[52]
- مضخة الصوديوم والبوتاسيوم.
- مضخة الكالسيوم.
- ناقل مشترك للصوديوم والبوتاسيوم والكلور.
- ناقل مشترك للصوديوم والكلور.
- مبادل عكسي بين البروتون والصوديوم.
- ناقل مشترك للبوتاسيوم والكلور.
- قناة غاردوس.
التصاق الخلية
- جزيء الالتصاق داخل الخلوي 4 ICAM-4: يتفاعل مع إنتغرين.
- جزيء التصاق الخلية القاعدية BCAM: بروتين سكري يعرف فصيلة الدم اللوثرية ويعرف أيضاً باسم بروتين Lu أو البروتين الرابط للامينين.
الدور الهيكلي
تقوم بروتينات الغشاء التالية بإنشاء روابط مع البروتينات الهيكلية وقد تلعب دوراً مهماًَ في تنظيم التماسك بين طبقة الشحوم الثنائية والهيكل الغشائي، مما يُمكِّن الكرية الحمراء من الحفاظ على مساحة مناسبة لسطح الغشاء عن طريق منع الغشاء من الانخماص.
- بروتينات المطرق كبيرة الجزيئات المعتمدة على الأنكرين: تربط طبقة الشحوم الثنائية بهيكل الغشاء من خلال تفاعل مجالات السيتوبلازم الخاصة بهم مع الأنكرين.
- البروتين 3 الشريطي: يجمع أيضاً العديد من الإنزيمات الحالة للغلوكوز، وناقل ثاني أكسيد الكربون المفترض، وكاربونيك أنهيدراز في مركب جزيئي كبير يسمى "metabolon"، والذي قد يلعب دوراً رئيسياً في تنظيم استقلاب الكريات الحمراء ووظيفة نقل الأيونات والغازات.[54]
- البروتين السكري المرتبط بالعامل ريزيوس: يشارك أيضاً في النقل، ويعرف النمط الظاهري النادر المرتبط بفصيلة الدم Rh mod.
- بروتينات المطرق كبيرة الجزيئات المعتمدة على البروتين 4.1R: بروتينات تتفاعل مع البروتين 4.1R.
- البروتين 4.1R: ضعيف التعبير عن مستضدات Gerbich.
- غليكوفورين C وغليكوبروتين D: يعرف زمرة الدم Gerbich.
- بروتين XK: يحدد زمرة الدم Kell والنمط الظاهري النادر Mcleod (نقص مستضد Kx والتعبير المنخفض لمستضدات Kell).
- نظام الزمرة الدموية الريسوسية RhD/RhCE: يُعرّف زمرة الدم الريزيوسية وما يرتبط بها من النمط الظاهري النادر لزمرة الدم Rh null.
- نظام مستضد دافي: تم اقتراحه ليرتبط مع كيموكين.[55]
- أديوسين: يتفاعل مع البروتين 3 الشريطي.
- ديماتين: يتفاعل مع ناقل الجلوكوز Glut1.[36][49]
الكمون الكهربائي السطحي
الكمون زيتا هي خاصية كهروكيميائية لأسطح الخلايا يتم تحديدها بواسطة الشحنة الكهربائية للجزيئات المكشوفة على سطح أغشية الخلية. كمون زيتا الطبيعي للكريات الحمراء هو 15.7 مللي فولت.[56] يبدو أن جزءً كبيراً من هذا الكمون قد ساهمت به بقايا حمض السياليك المتبقية في الغشاء إذ يؤدي إزالتها إلى كمون زيتا قدره −6.06 ميللي فولت.
الوظيفة
الوظيفة الرئيسية[4]
إن الوظيفة الرئيسية للكريات الحمراء هي نقل الهيموغلوبين الذي يقوم بدوره بحمل الأكسجين من الرئتين إلى الأنسجة. وفي بعض الحيوانات الدنيا يدور الهيموغلوبين كبروتين حر في البلازما وليس محصوراً في الكريات الحمر. ولكنه عندما يكون حراً في بلازما الإنسان يتسرب حوالي 3% منه خلال أغشية الأوعية الشعرية إلى أحياز الأنسجة أو خلال أغشية كبيبات الكلية إلى محفظة بومان كل مرة يمر فيها الدم خلال الشعيرات. ولذلك لكي يبقى الهيموغلوبين داخل مجرى الدم لا بد له من أن يبقى داخل كريات الدم الحمراء.
وظائف ثانوية
- التوازن الحمضي القاعدي: تحوي الكريات الحمر كمية كبيرة من الأنهيدراز الكربونية التي تحفز التفاعل بين ثاني أكسيد الكربون والماء فتزيد بذلك من سرعة هذا التفاعل آلاف المرات. وتمكِّن سرعة هذا التفاعل العالية مصل الدم من أن يتفاعل مع كميات كبيرة من ثاني أكسيد الكربون فينقله بذلك من الأنسجة إلى الرئتين على شكل أيونات البيكربونات -HCO3. كما يكون الهيموغلوبين دارئاً حمضياً قاعدياً ممتازاً (كما هو الحال مع معظم البروتينات)، ولهذا فإن الكريات الحمر هي المسؤولة عن معظم قدرات الدم كله على الدرء.[4]
- المقوية الوعائية: عندما تتعرض كريات الدم الحمراء للضغط من قبل الأوعية المتقبضة، فإنها تطلق الأدينوسين ثلاثي الفوسفات ATP، مؤدياً إلى استرخاء وتمدد جدران الوعاء مما يعزز التدفق الطبيعي للدم.[57] وعندما يتم إزالة الأكسجين من جزيئات الهيموغلوبين، تفرز كريات الدم الحمراء S-nitrosothiols، والذي يعمل أيضاً على تمدد الأوعية الدموية،[58] وبالتالي توجيه المزيد من الدم إلى مناطق الجسم ناقصة الأكسجة. كذلك يمكن لكريات الدم الحمراء تصنيع أكسيد النيتريك أنزيمياً، باستخدام L-أرجينين كركيزة، كما تفعل الخلايا البطانية.[59] إذ إن تعرض كريات الدم الحمراء لمستويات فيزيولوجية من قوى الضغط ينشط تركيب أكسيد النيتريك،[60] مما قد يسهم في تنظيم المقوية الوعائية.[15] ويمكن لكريات الدم الحمراء أيضاً إنتاج كبريتيد الهيدروجين، وهو غاز يؤدي إلى ارتخاء جدران الأوعية الدموية. حيث يُعتقد أن التأثيرات القلبية للثوم ترجع إلى قيام كريات الدم الحمراء بتحويل مركبات الكبريت إلى كبريتيد الهيدروجين.[61]
- الاستجابة المناعية: تلعب كريات الدم الحمراء أيضاً دوراً في الاستجابة المناعية للجسم، عندما يتم حلها بواسطة العوامل الممرضة مثل البكتيريا، مما يُطلق خضاب الكريات محرراً جذور حرة، تعمل على تحطيم جدار وغشاء الخلية الممرضة، مما يؤدي إلى قتلها.[62][63]
العمليات الخلوية
لا تستخدم الكريات الحمراء أياً من الأكسجين الذي تنقله نظراً لعدم احتوائها على متقدرات، بدلاً من ذلك، تنتج الأدينوسين ثلاثي الفوسفات ATP عن طريق تحلل الجلوكوز وتخمير حمض اللبنيك منتجةً البيروفات.[64][65][15] علاوة على ذلك، يلعب مسار فوسفات البنتوز دوراً مهماً في الكريات الحمراء، انظر عوز نازعة هيدروجين غلوكوز -6- فوسفات لمزيد من المعلومات.
يفترض حالياً أن الاصطناع الحيوي للبروتين غائباً في الكريات الحمراء نتيجة غياب النواة. كما أن الكريات الحمر الناضجة لا تحتوي على الحمض النووي الريبي منقوص الأكسجين DNA ولا يمكنها تصنيع الحمض النووي الريبوزي RNA بسبب غياب النوية والعضيات الخلوية وبالتالي لا تملك القدرة على الانقسام وكذلك فإن إمكانية الإصلاح الخلوي محدودة.[66]
إن عدم القدرة على اصطناع البروتين يجعل الكريات الحمراء الخاصة بالثدييات غير مستهدفة من قبل أي فيروس.[67] ومع ذلك، يمكن أن تؤثر الإصابة بالفيروسة الصغيرة parvovirus (مثل فيروس صغير ب 19) على سلائف الأرومة الحمراء، حيث لوحظ وجود سلائف أرومة حمراء عملاقة مع جزيئات فيروسية ومشتملات، وبالتالي تستنفذ بشكل مؤقت الشبكيات وتسبب فقر الدم.[68]
دورة الحياة
التشكُّل

تُنتج خلايا الدم المحيطية من خلايا جذعية بعملية تدعى تكوّن الدم (بالإنجليزية: Hematopoiesis) حيث Hemo تعني دم أما poiesis تعني تكوّن،[11] والتي تستغرق حوالي 7 أيام.[69] جميع أنواع الخلايا الجذعية لها وظيفتان أساسيتان: التجدد الذاتي والتمايز. أثناء التطور، تُنتَج كريات الدم في مواقع مختلفة من الجسم. في البداية، يوفر كيس المح كريات دم حمراء حاملة للأكسجين، ثم تقوم عدة مواقع جنينية بإنتاج الخلايا الدموية. حيث تُنتج الكريات الحمر من قبل الكبد ثم في الثلث الثاني من الحمل تُنتج في نقي العظم والطحال. مع تغير موقع الخلايا الجذعية، تتغير قدرة الخلايا الجذعية أيضاً بشكل تدريجي، إذ تزداد أنواع الخلايا المُنتَجة تعقيداً بالإضافة لتلك البسيطة الحاملة للأكسجين تُنتج الصفيحات الدموية والخلايا المناعية أخيراً.[11]
يولد نقي كل العظام كريات دم حمراء حتى عمر الخامسة ليصبح نقي العظام بعد ذلك شحمياً، ما عدا الأقسام العلوية لعظمي العضد والظنبوب، ثم تتولد معظم خلايا الدم بعد سن العشرين من نقي العظام الغشائية كالفقرات، الأضلاع، القص والحرقفة.[4] ومع تقدم السن يقل إنتاج نقي العظم للخلايا الدموية.[4]
عند البالغين، الخلية الأولى التي يمكن تمييزها من سلسلة خلايا الدم الحمراء هي سليفة الأرومة الحمراء التي تتولد بأعداد كبيرة من الخلايا الجذعية، تنقسم سليفة الأرومات الحمر لتشكل الأرومات الحمر القعدة -تتلون بالملونات القاعدية- التي تحوي كميات قليلة من الخضاب الذي تتمتلئ به في الأجيال اللاحقة كما تتكاثف النواة إلى حجم صغير وتطرح بقاياها الأخيرة إلى خارج الخلية، ويعاد في الوقت نفسه امتصاص الشبكة الهيولية الباطنية لتسمى الخلية في هذه المرحلة بالخلية الشبكية لأنها مازالت تحوي كمية صغيرة من المادة القاعدية التي تتكون من بقايا جهاز غولجي والمتقدرات والقليل من عضيات الهيولى الأخرى، تصل الخلايا الشبكية إلى الشعيرات الدموية بعملية الانسلال (تشكل الخلايا الشبكية 1% من تركيز كريات الدم الحمراء)، حيث تختفي خلال يوم أو يومين بقية المواد القاعدية من الخلايا الشبكية لتتحول إلى كرية حمراء ناضجة.[4] تعيش كريات الدم الحمراء عند الفرد السليم في الدورة الدموية حوالي 100 إلى 120 يوماً[70][4] (و 80 إلى 90 يوماً في الرضيع).[71]
التحطُّم
مع تقدم عمر الكرية الحمراء، تصبح العمليات الاستقلابية فيها أقل نشاطاً مما يجعل غشاء الكرية هشاً مؤدياً لتحطم الكرية أثناء مرورها في مناطق ضيقة من الدوران، إذ تتشظى العديد من الكريات الحمراء في لب الطحال حيث تكون سعة الأحياز بين الترابيق حوالي 3 ميكرومتر فقط مقارنةً مع 8 ميكرومتر "قطر الكرية الحمراء السوية".[4][72][73] وعند استئصال الطحال تزداد الكريات الحمراء الشاذة والهرمة في الدوران.[4][74]
تبلعم البلاعم الخضاب مباشرة بعد تحريره من الكريات الحمر في عدة أقسام من الجسم، خاصة في الكبد (خلايا كوبفر) والطحال ونقي العظم، ثم تحرر البلاعم الحديد إلى الدم ثانية لينقل بواسطة الترانسفيرين إلى نقي العظم ليعاد استخدامه مجدداً لتصنيع كريات حمراء جديدة أو إلى الكبد والأنسجة الأخرى ليُخزَّن على شكل فيريتين، أما جزء البورفيرين تحوله البلاعم إلى بيليروبين يحرر في الدم ليطرح في الصفراء أخيراً.[4]
بعض الأمراض التي تصيب خلية الدم الحمراء
هناك أمراض كثيرة تصيب الدم و خلايا الدم الحمراء خصوصا و منها :
1- فقر الدم.
2- مرض فقر الدم المنجلي.
6- الأنيميا الفسيولوجية.
لماذا عمر خلايا الدم الحمراء قصير؟
الاسم العلمي الأجنبي لكريّات الدم الحمراء هو: (بالإنجليزية: erythrocytes). تلك الخلايا ليس لها نواة ولذلك فهي لا تستطيع الانقسام أو التكاثر، وكذلك ليس لها بعض التجهيزات الخلوية الأخرى التي تمكّنها من إصلاح نفسها في حال تلف جزء منها أو هَرِم، وبالتالي يكون عمرها قصير جداً قياساً بعمر الإنسان مثلاً، فليس لديها عوامل ذاتية للبقاء طويلا والاستمرار. يُعتبر عمر خلايا الدم الحمراء قصير بالنسبة لعمر الكائن الذي تدور في أوعيته الدموية لعدم قدرتها على البقاء طويلاً. خلال فترة 120 يوماً تظل تلك الخلايا تعمل على نقل الأكسجين خلال أجسام "الفقاريات" حتى تضعف وتهترئ. في كل ثانية يموت حوالي 2-3 مليون خلية دم حمراء، ويقوم الطحال بإخراج الخلايا البالية والهرمة والميتة[75].
تُنتَج خلايا الدم الحمراء عن طريق عملية اسمها: تكون الكريات الحمر (بالإنجليزية: erythropoesis) يتم فيها تقدير تركيز كمية خلايا الدم الصالحة في الدم لكي يتم إنتاج خلايا جديدة بمعدل يفي باحتياج الجسم. تقوم الكُلى بمراقبة مستوى الأكسجين في الدم، وإذا وُجد قليلا، تقوم الكُلى بافراز هرمون اسمه إريثروبويتين (بالإنجليزية: erythropoetin). خلايا النخاع الأحمر في العظم هي الوحيدة التي تملك مستقبلات ذلك الهرمون فتستجيب له، أما باقي خلايا الجسم فلا تستجيب بحال لهذا الهرمون. يستحث ذلك الهرمون إنتاج خلايا الدم الحمراء في نخاع العظم، والتي تترك النخاع وتنطلق في مسار الدم لتبدأ دورتها، وعندها يتزايد مستوى الأكسجين، وتستشعره الكُلى، فتُبطئ من افراز الهرمون. وبذلك يظل تعداد خلايا الدم الحمراء في الجسم ثابت تقريباً، وتظل سعة نقل الأكسجين في الدم دائما تكفي احتياج الجسم.
انظر أيضًا
المراجع
- ^ Vinay Kumar؛ Abul K. Abbas؛ Nelson Fausto؛ Richard N. Mitchell (2007). Robbins Basic Pathology (ط. 8th). Saunders.
- ^ أ ب ت ث F. C. Garg (2005). Experimental Microbiology (بالإنجليزية) (first edition ed.). CBS Publishers & Distributors. p. 48. Archived from the original on 2020-04-11.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (help) and يحتوي الاستشهاد على وسيط غير معروف وفارغ:|بواسطة=(help) - ^ "Blood Cells". مؤرشف من الأصل في 2016-07-23.
- ^ أ ب ت ث ج ح خ د ذ ر ز س C. Guyton, M.D؛ John E. Hall, Ph.D (1996). "32". في translated to arabic by The world Health Organization (المحرر). Textbook of Medical physiology [المرجع في الفيزيولوجيا الطبية] (ط. ninth edition).
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة) ويحتوي الاستشهاد على وسيط غير معروف وفارغ:|بواسطة=(مساعدة) - ^ Li، He؛ Lykotrafitis، George (5 أغسطس 2014). "Erythrocyte Membrane Model with Explicit Description of the Lipid Bilayer and the Spectrin Network". Biophysical Journal. ج. 107 ع. 3: 642–653. DOI:10.1016/j.bpj.2014.06.031. ISSN:0006-3495. PMID:25099803. مؤرشف من الأصل في 2020-04-11.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Erich Sackmann, Biological Membranes Architecture and Function., Handbook of Biological Physics, (ed. R.Lipowsky and E.Sackmann, vol.1, Elsevier, 1995
- ^ أ ب J. A. Blom (15 ديسمبر 2003). Monitoring of Respiration and Circulation. CRC Press. ص. 27. مؤرشف من الأصل في 2020-01-12.
- ^ Sender، Ron؛ Fuchs، Shai؛ Milo، Ron (19 أغسطس 2016). "Revised Estimates for the Number of Human and Bacteria Cells in the Body". PLoS Biology. DOI:10.1371/journal.pbio.1002533.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Laura Dean. Blood Groups and Red Cell Antigens نسخة محفوظة 9 يونيو 2007 على موقع واي باك مشين.
- ^ أ ب Pierigè F, Serafini S, Rossi L, Magnani M (يناير 2008). "Cell-based drug delivery". Advanced Drug Delivery Reviews. ج. 60 ع. 2: 286–95. DOI:10.1016/j.addr.2007.08.029. PMID:17997501.
- ^ أ ب ت Dan L. (22 Sep 2016). Harrison's Hematology and Oncology, 3E (بالإنجليزية). McGraw Hill Professional. ISBN:978-1-259-83582-7.
- ^ أ ب Gulliver، G. (1875). "On the size and shape of red corpuscles of the blood of vertebrates, with drawings of them to a uniform scale, and extended and revised tables of measurements". Proceedings of the Zoological Society of London. ج. 1875: 474–495.
- ^ Ruud JT (مايو 1954). "Vertebrates without erythrocytes and blood pigment". Nature. ج. 173 ع. 4410: 848–50. Bibcode:1954Natur.173..848R. DOI:10.1038/173848a0. PMID:13165664.
- ^ Carroll, Sean (2006). The Making of the Fittest. W.W. Norton.
- ^ أ ب ت ث ج ح خ Alexander Fridman؛ Gary Friedman. Plasma Medicine. مؤرشف من الأصل في 2020-04-11.
{{استشهاد بكتاب}}: يحتوي الاستشهاد على وسيط غير معروف وفارغ:|بواسطة=(مساعدة) - ^ Maton، Anthea؛ Jean Hopkins؛ Charles William McLaughlin؛ Susan Johnson؛ Maryanna Quon Warner؛ David LaHart؛ Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. مؤرشف من الأصل في 2019-12-15.
- ^ Dentalman. United States. Bureau of Naval Personnel. 1969. ص. 27. مؤرشف من الأصل في 2020-04-11.
{{استشهاد بكتاب}}: يحتوي الاستشهاد على وسيط غير معروف وفارغ:|بواسطة=(مساعدة) - ^ أ ب ت ث Giuseppe Lippi; Gianfranco Cervellin; J. Favaloro, Emmanuel; Plebani, Mario (16 Jul 2012). In Vitro and In Vivo Hemolysis: An Unresolved Dispute in Laboratory Medicine (بالإنجليزية) (1 edition ed.). De Gruyter. Archived from the original on 2020-04-11.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (help) and يحتوي الاستشهاد على وسيط غير معروف وفارغ:|بواسطة=(help) - ^ Anthis، Nick (17 أبريل 2008). "Why Are Veins Blue?". Scienceblogs. مؤرشف من الأصل في 2018-11-02. اطلع عليه بتاريخ 2015-04-23.
- ^ Robin R. Preston; Thad E. Wilson (2013). Physiology (بالإنجليزية). p. 293. Archived from the original on 2020-04-11.
{{استشهاد بكتاب}}: يحتوي الاستشهاد على وسيط غير معروف وفارغ:|بواسطة=(help) - ^ Snyder، Gregory K.؛ Sheafor، Brandon A. (1999). "Red Blood Cells: Centerpiece in the Evolution of the Vertebrate Circulatory System". Integrative and Comparative Biology. ج. 39 ع. 2: 189. DOI:10.1093/icb/39.2.189.
- ^ "BBC Bitesize – GCSE Biology – Blood – Revision 2". www.bbc.co.uk (بالإنجليزية البريطانية). Archived from the original on 2017-12-20. Retrieved 2017-11-26.
- ^ Gregory TR (2001). "The bigger the C-value, the larger the cell: genome size and red blood cell size in vertebrates". Blood Cells, Molecules & Diseases. ج. 27 ع. 5: 830–43. CiteSeerX:10.1.1.22.9555. DOI:10.1006/bcmd.2001.0457. PMID:11783946.
- ^ Goodman SR, Kurdia A, Ammann L, Kakhniashvili D, Daescu O (ديسمبر 2007). "The human red blood cell proteome and interactome". Experimental Biology and Medicine. ج. 232 ع. 11: 1391–408. DOI:10.3181/0706-MR-156. PMID:18040063.
- ^ Stewart، Ian B.؛ McKenzie، Don C. (2002). "The human spleen during physiological stress". Sports Medicine (Auckland, N.Z.). ج. 32 ع. 6: 361–369. DOI:10.2165/00007256-200232060-00002. ISSN:0112-1642. PMID:11980500. مؤرشف من الأصل في 2020-04-11.
- ^ Mary Louise Turgeon (2004). Clinical Hematology: Theory and Procedures. Lippincott Williams & Wilkins. ص. 100. مؤرشف من الأصل في 2020-03-02.
- ^ McLaren CE, Brittenham GM, Hasselblad V (أبريل 1987). "Statistical and graphical evaluation of erythrocyte volume distributions". Am. J. Physiol. ج. 252 ع. 4 Pt 2: H857–66. CiteSeerX:10.1.1.1000.348. DOI:10.1152/ajpheart.1987.252.4.H857. PMID:3565597.
- ^ Bianconi، Eva؛ Piovesan، Allison؛ Facchin، Federica؛ Beraudi، Alina؛ Casadei، Raffaella؛ Frabetti، Flavia؛ Vitale، Lorenza؛ Pelleri، Maria Chiara؛ Tassani، Simone (1 نوفمبر 2013). "An estimation of the number of cells in the human body". Annals of Human Biology. ج. 40 ع. 6: 463–471. DOI:10.3109/03014460.2013.807878. ISSN:0301-4460. PMID:23829164.
- ^ Hillman، Robert S.؛ Ault، Kenneth A.؛ Rinder، Henry M. (2005). Hematology in Clinical Practice: A Guide to Diagnosis and Management (ط. 4). McGraw-Hill Professional. ص. 1.
- ^ D’Alessandro، Angelo (2017). "Red blood cell proteomics update: is there more to discover?". Blood Transfusion. ج. 15 ع. 2: 182–187. DOI:10.2450/2017.0293-16. PMC:5336341. PMID:28263177.
- ^ Iron Metabolism, University of Virginia Pathology. Accessed 22 September 2007. نسخة محفوظة 4 مارس 2016 على موقع واي باك مشين.
- ^ Iron Transport and Cellular Uptake by Kenneth R. Bridges, Information Center for Sickle Cell and Thalassemic Disorders. Accessed 22 September 2007. نسخة محفوظة 17 أغسطس 2019 على موقع واي باك مشين.
- ^ Cohen، W. D. (1982). "The cytomorphic system of anucleate non-mammalian erythrocytes". Protoplasma. ج. 113: 23–32. DOI:10.1007/BF01283036.
- ^ Wingstrand KG (1956). "Non-nucleated erythrocytes in a teleostean fish Maurolicus mülleri (Gmelin)". Zeitschrift für Zellforschung und Mikroskopische Anatomie. ج. 45 ع. 2: 195–200. DOI:10.1007/BF00338830 (غير نشط 22 يناير 2020). PMID:13402080.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: وصلة دوي غير نشطة منذ 2020 (link) - ^ Gregory، T. R. (2001). "The Bigger the C-Value, the Larger the Cell: Genome Size and Red Blood Cell Size in Vertebrates". Blood Cells, Molecules and Diseases. ج. 27 ع. 5: 830–843. CiteSeerX:10.1.1.22.9555. DOI:10.1006/bcmd.2001.0457. PMID:11783946.
- ^ أ ب ت Yazdanbakhsh K, Lomas-Francis C, Reid ME (أكتوبر 2000). "Blood groups and diseases associated with inherited abnormalities of the red blood cell membrane". Transfusion Medicine Reviews. ج. 14 ع. 4: 364–74. DOI:10.1053/tmrv.2000.16232. PMID:11055079.
- ^ Ways، Peter؛ Reed، Claude F.؛ Hanahan، Donald J. (1 أغسطس 1963). "RED-CELL AND PLASMA LIPIDS IN ACANTHOCYTOSIS*". Journal of Clinical Investigation. ج. 42 ع. 8: 1248–1260. DOI:10.1172/jci104810. ISSN:0021-9738. مؤرشف من الأصل في 2020-04-22.
- ^ Steck، Theodore L. (1 يوليو 1974). "THE ORGANIZATION OF PROTEINS IN THE HUMAN RED BLOOD CELL MEMBRANE". The Journal of Cell Biology. ج. 62 ع. 1: 1–19. DOI:10.1083/jcb.62.1.1. ISSN:1540-8140.
- ^ أ ب ت Dr Erhabor; Dr Adias (2013). Essentials of Blood Transfusion Science (بالإنجليزية). Archived from the original on 2020-04-22.
{{استشهاد بكتاب}}: يحتوي الاستشهاد على وسيط غير معروف وفارغ:|بواسطة=(help) - ^ أ ب N.; Harris, J. Robin (6 Dec 2012). Endoplasmic Reticulum (بالإنجليزية). Springer Science & Business Media. Archived from the original on 2020-04-22.
- ^ Daleke، David L (2008-05). "Regulation of phospholipid asymmetry in the erythrocyte membrane". Current Opinion in Hematology. ج. 15 ع. 3: 191–195. DOI:10.1097/moh.0b013e3282f97af7. ISSN:1065-6251. مؤرشف من الأصل في 2020-04-22.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Wiedmer، Therese؛ Sims، Peter (2001). "Unraveling the Mysteries of Phospholipid Scrambling". Thrombosis and Haemostasis. ج. 86 ع. 07: 266–275. DOI:10.1055/s-0037-1616224. ISSN:0340-6245. مؤرشف من الأصل في 2020-04-22.
- ^ Hankins، Hannah M.؛ Baldridge، Ryan D.؛ Xu، Peng؛ Graham، Todd R. (يناير 2015). "Role of Flippases, Scramblases and Transfer Proteins in Phosphatidylserine Subcellular Distribution". Traffic. ج. 16 ع. 1: 35–47. DOI:10.1111/tra.12233. PMC:4275391. PMID:25284293.
- ^ Kuypers، Frans A.؛ Yuan، Jie؛ Lewis، Rachel A.؛ Snyder، L. Michael؛ Kiefer، Charles R.؛ Bunyaratvej، Ahnond؛ Fucharoen، Suthat؛ Ma، Lisa؛ Styles، Lori (15 أبريل 1998). "Membrane Phospholipid Asymmetry in Human Thalassemia". Blood. ج. 91 ع. 8: 3044–3051. DOI:10.1182/blood.v91.8.3044.3044_3044_3051. ISSN:1528-0020.
- ^ Setty، B. N. Yamaja؛ Kulkarni، Surekha؛ Stuart، Marie J. (1 مارس 2002). "Role of erythrocyte phosphatidylserine in sickle red cell–endothelial adhesion". Blood. ج. 99 ع. 5: 1564–1571. DOI:10.1182/blood.v99.5.1564. ISSN:1528-0020.
- ^ أ ب Manno، S.؛ Takakuwa، Y.؛ Mohandas، N. (5 فبراير 2002). "Identification of a functional role for lipid asymmetry in biological membranes: Phosphatidylserine-skeletal protein interactions modulate membrane stability". Proceedings of the National Academy of Sciences. ج. 99 ع. 4: 1943–1948. DOI:10.1073/pnas.042688399. ISSN:0027-8424. مؤرشف من الأصل في 2020-04-23.
- ^ Salzer، Ulrich؛ Prohaska، Rainer (15 فبراير 2001). "Stomatin, flotillin-1, and flotillin-2 are major integral proteins of erythrocyte lipid rafts". Blood. ج. 97 ع. 4: 1141–1143. DOI:10.1182/blood.v97.4.1141. ISSN:1528-0020.
- ^ Murphy، Sean C.؛ Samuel، Benjamin U.؛ Harrison، Travis؛ Speicher، Kaye D.؛ Speicher، David W.؛ Reid، Marion E.؛ Prohaska، Rainer؛ Low، Philip S.؛ Tanner، Michael J. (1 مارس 2004). "Erythrocyte detergent-resistant membrane proteins: their characterization and selective uptake during malarial infection". Blood. ج. 103 ع. 5: 1920–1928. DOI:10.1182/blood-2003-09-3165. ISSN:0006-4971.
- ^ أ ب ت Mohandas N, Gallagher PG (نوفمبر 2008). "Red cell membrane: past, present, and future". Blood. ج. 112 ع. 10: 3939–48. DOI:10.1182/blood-2008-07-161166. PMC:2582001. PMID:18988878.
- ^ Rodi PM, Trucco VM, Gennaro AM (يونيو 2008). "Factors determining detergent resistance of erythrocyte membranes". Biophysical Chemistry. ج. 135 ع. 1–3: 14–8. DOI:10.1016/j.bpc.2008.02.015. PMID:18394774.
- ^ Hempelmann E، Götze O (1984). "Characterization of membrane proteins by polychromatic silver staining". Hoppe-Seyler's Z Physiol Chem. ج. 365: 241–242.
- ^ أ ب ت ث ج ح خ د Osaro; Adias, Teddy (31 May 2012). Transfusion Medicine Made Easy For Students of Biomedical Science, Allied Medical Sciences and Medicine (بالإنجليزية). BoD – Books on Demand. Archived from the original on 2020-04-23.
- ^ Iolascon A, Perrotta S, Stewart GW (مارس 2003). "Red blood cell membrane defects". Reviews in Clinical and Experimental Hematology. ج. 7 ع. 1: 22–56. PMID:14692233.
- ^ Bruce، L. J. (16 يناير 2003). "A band 3-based macrocomplex of integral and peripheral proteins in the RBC membrane". Blood. ج. 101 ع. 10: 4180–4188. DOI:10.1182/blood-2002-09-2824. ISSN:0006-4971.
- ^ Denomme GA (يوليو 2004). "The structure and function of the molecules that carry human red blood cell and platelet antigens". Transfusion Medicine Reviews. ج. 18 ع. 3: 203–31. DOI:10.1016/j.tmrv.2004.03.006. PMID:15248170.
- ^ Tokumasu F, Ostera GR, Amaratunga C, Fairhurst RM (2012) Modifications in erythrocyte membrane zeta potential by Plasmodium falciparum infection. Exp Parasitol
- ^ Wan J, Ristenpart WD, Stone HA (أكتوبر 2008). "Dynamics of shear-induced ATP release from red blood cells". Proceedings of the National Academy of Sciences of the United States of America. ج. 105 ع. 43: 16432–7. Bibcode:2008PNAS..10516432W. DOI:10.1073/pnas.0805779105. PMC:2575437. PMID:18922780.
- ^ Diesen DL, Hess DT, Stamler JS (أغسطس 2008). "Hypoxic vasodilation by red blood cells: evidence for an s-nitrosothiol-based signal". Circulation Research. ج. 103 ع. 5: 545–53. DOI:10.1161/CIRCRESAHA.108.176867. PMC:2763414. PMID:18658051.
- ^ Kleinbongard P؛ Schutz R؛ Rassaf T؛ وآخرون (2006). "Red blood cells express a functional endothelial nitric oxide synthase". Blood. ج. 107 ع. 7: 2943–51. DOI:10.1182/blood-2005-10-3992. PMID:16368881.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Ulker P, Sati L, Celik-Ozenci C, Meiselman HJ, Baskurt OK (2009). "Mechanical stimulation of nitric oxide synthesizing mechanisms in erythrocytes". Biorheology. ج. 46 ع. 2: 121–32. DOI:10.3233/BIR-2009-0532. PMID:19458415.
- ^ Benavides، Gloria A؛ Victor M Darley-Usmar؛ Mills، R. W.؛ Patel، H. D.؛ Isbell، T. S.؛ Patel، R. P.؛ Darley-Usmar، V. M.؛ Doeller، J. E.؛ Kraus، D. W. (13 نوفمبر 2007). "Hydrogen sulfide mediates the vasoactivity of garlic". Proceedings of the National Academy of Sciences of the United States of America. ج. 104 ع. 46: 17977–17982. Bibcode:2007PNAS..10417977B. DOI:10.1073/pnas.0705710104. PMC:2084282. PMID:17951430.
- ^ Kesava، Shobana (1 سبتمبر 2007). "Red blood cells do more than just carry oxygen; New findings by NUS team show they aggressively attack bacteria too" (PDF). The Straits Times. مؤرشف من الأصل (PDF) في 2020-04-03. اطلع عليه بتاريخ 2013-03-26.
- ^ Jiang N, Tan NS, Ho B, Ding JL (أكتوبر 2007). "Respiratory protein-generated reactive oxygen species as an antimicrobial strategy". Nature Immunology. ج. 8 ع. 10: 1114–22. DOI:10.1038/ni1501. PMID:17721536.
- ^ Jr، Jeremy M. Berg, John L. Tymoczko, Lubert Stryer; with Gregory J. Gatto (2012). Biochemistry (ط. 7th). New York: W.H. Freeman. ص. 455, 609.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Tilton، WM؛ Seaman، C؛ Carriero، D؛ Piomelli، S (أغسطس 1991). "Regulation of glycolysis in the erythrocyte: role of the lactate/pyruvate and NAD/NADH ratios". The Journal of Laboratory and Clinical Medicine. ج. 118 ع. 2: 146–52. PMID:1856577.
- ^ Kabanova S, Kleinbongard P, Volkmer J, Andrée B, Kelm M, Jax TW (2009). "Gene expression analysis of human red blood cells". International Journal of Medical Sciences. ج. 6 ع. 4: 156–9. DOI:10.7150/ijms.6.156. PMC:2677714. PMID:19421340.
- ^ Zimmer، Carl (27 مارس 2007). "Scientists Explore Ways to Lure Viruses to Their Death". The New York Times. مؤرشف من الأصل في 2020-04-07. اطلع عليه بتاريخ 2013-03-26.
- ^ Erik D. Heegaard؛ Kevin E. Brown (يوليو 2002). "Human parvovirus B19". Clin Microbiol Rev. ج. 15 ع. 3: 485–505. DOI:10.1128/CMR.15.3.485-505.2002. PMC:118081. PMID:12097253.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|lastauthoramp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Alexander; Friedman, Gary (19 Dec 2012). Plasma Medicine (بالإنجليزية). John Wiley & Sons. ISBN:978-1-118-43765-0.
- ^ Mollison، PL (1994-06). "The genetic basis of the Rh blood group system". Transfusion. ج. 34 ع. 6: 539–541. DOI:10.1046/j.1537-2995.1994.34694295073.x. ISSN:0041-1132.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|date=(مساعدة) - ^ HARRISON، K. L. (1979-06). "Fetal Erythrocyte Lifespan". Journal of Paediatrics and Child Health. ج. 15 ع. 2: 96–97. DOI:10.1111/j.1440-1754.1979.tb01197.x. ISSN:1034-4810.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|date=(مساعدة) - ^ Chen، Li-Tsun؛ Weiss، Leon (1 أبريل 1973). "The Role of the Sinus Wall in the Passage of Erythrocytes Through the Spleen". Blood. ج. 41 ع. 4: 529–537. DOI:10.1182/blood.v41.4.529.529. ISSN:0006-4971.
- ^ Jung، F. (1958-01). "Das Schicksal toxisch veränderter roter Blutzellen in der Milz". Klinische Wochenschrift ع. 2: 63–66. DOI:10.1007/bf01486245. ISSN:0023-2173.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|date=(مساعدة) - ^ Drenckhahn, D. (1988). Platt, Dieter (ed.). "Removal of Old and Abnormal Red Blood Cells from Circulation: Mechanical and Immunologic Mechanisms". Blood Cells, Rheology, and Aging (بالإنجليزية). Berlin, Heidelberg: Springer: 62–72. DOI:10.1007/978-3-642-71790-1_7. ISBN:978-3-642-71790-1.
- ^ Biological sciences, Blood Cells [وصلة مكسورة] نسخة محفوظة 24 يوليو 2016 على موقع واي باك مشين.
وصلات خارجية
- Blood Groups and Red Cell Antigens by Laura Dean. Searchable and downloadable online textbook in the public domain.
- Database of vertebrate erythrocyte sizes.
- Red Gold, بي بي إس site containing facts and history
| في كومنز صور وملفات عن: خلية دم حمراء |

