جرمانيوم: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
| سطر 87: | سطر 87: | ||
== الخواص الكيميائية == |
== الخواص الكيميائية == |
||
[[أكسدة (كيمياء)|يتأكسد]] عنصر الجرمانيوم ببطء في الهواء عند |
ينتمي الجرمانيوم كيميائياً إلى مجموعة عناصر [[شبه فلز|أشباه الفلزات]]؛ وهو لا يتأكسد بأكسجين الهواء عند درجة حرارة الغرفة. إنما [[أكسدة (كيمياء)|يتأكسد]] عنصر الجرمانيوم ببطء في الهواء عند التسخين إلى درجات حرارة تتجاوز 250 °س، مشكلاً بذلك ثنائي أكسيد الجرمانيوم GeO<sub>2</sub>.<ref>{{cite journal|doi=10.1016/S0169-4332(98)00251-7|title=KRXPS study of the oxidation of Ge(001) surface|date=1998|author=Tabet, N|journal=Applied Surface Science|volume=134|issue=1–4|pages=275–282|bibcode = 1998ApSS..134..275T|last2=Salim|first2=Mushtaq A. }}</ref> لا ينحل الجرمانيوم عند إلقائه في [[حمض|الأحماض]] الممددة وكذلك في [[محلول قلوي|المحاليل القلوية]] الممددة، لكنه يذوب ببطء في الأحماض [[تركيز (كيمياء)|المركزة]] الساخنة، مثل [[حمض الكبريتيك]] أو [[حمض النتريك]]؛ كما يتفاعل بعنف مع مصهور [[هيدروكسيد|هيدروكسيدات]] الفلزات القلوية ليعطي مركبات [[جرمانات|الجرمانات]] الموافقة. |
||
غالباً ما يوجد الجرمانيوم في [[حالة الأكسدة]] الرباعية +4 في [[مركب كيميائي|مركباته الكيميائية]]، بالرغم مع ذلك، فإنه توجد بعض المركبات في حالة الأكسدة الثنائية +2.<ref name = "Greenwood">{{Greenwood&Earnshaw}}</ref> أما حالات الأكسدة المتبقية (مثل +3 أو+1)، فهي نادرة جداً.<ref>{{cite journal|doi=10.1016/S0368-2048(98)00451-4|title=XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates|first3=A. L.|last3=Al-Oteibi|first2=M. A.|date=1999|last2=Salim|author=Tabet, N|journal=Journal of Electron Spectroscopy and Related Phenomena|volume=101–103|pages=233–238}}</ref> يمكن العثور على أنيونات الجرمانيوم متعددة الذرات {{#tag:ref|Germanium cluster anions|group="ط"}} من نمط [[طور زنتل|زنتل]] {{#tag:ref|Zintl|group="ط"}} في الأنواع الكيميائية <sub>4</sub><sup>2−</sup>Ge أو <sub>9</sub><sup>4−</sup>Ge أو <sub>9</sub><sup>2−</sup>Ge أو <sup>6−</sup>[<sub>2</sub>(Ge<sub>9</sub>)]؛ والتي يمكن استحصالها من السبائك الحاوية على [[فلز قلوي|الفلزات القلوية]] والجرمانيوم في [[أمونيا|الأمونيا]] السائلة بوجود [[ثنائي أمين الإيثيلين]] {{#tag:ref|ethylenediamine|group="ط"}} أو [[كريبتاند]] {{#tag:ref|Cryptand|group="ط"}}.<ref name = "Greenwood" /><ref>{{cite journal|title=Oxidative Coupling of Deltahedral [Ge<sub>9</sub>]<sup>4−</sup> Zintl Ions|first1 = Li|last1 = Xu|last2=Sevov| first2=Slavi C.|journal=J. Am. Chem. Soc.|date = 1999|volume = 121| issue = 39|pages = 9245–9246|doi = 10.1021/ja992269s}}</ref> |
غالباً ما يوجد الجرمانيوم في [[حالة الأكسدة]] الرباعية +4 في [[مركب كيميائي|مركباته الكيميائية]]، بالرغم مع ذلك، فإنه توجد بعض المركبات في حالة الأكسدة الثنائية +2.<ref name = "Greenwood">{{Greenwood&Earnshaw}}</ref> أما حالات الأكسدة المتبقية (مثل +3 أو+1)، فهي نادرة جداً.<ref>{{cite journal|doi=10.1016/S0368-2048(98)00451-4|title=XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates|first3=A. L.|last3=Al-Oteibi|first2=M. A.|date=1999|last2=Salim|author=Tabet, N|journal=Journal of Electron Spectroscopy and Related Phenomena|volume=101–103|pages=233–238}}</ref> يمكن العثور على أنيونات الجرمانيوم متعددة الذرات {{#tag:ref|Germanium cluster anions|group="ط"}} من نمط [[طور زنتل|زنتل]] {{#tag:ref|Zintl|group="ط"}} في الأنواع الكيميائية <sub>4</sub><sup>2−</sup>Ge أو <sub>9</sub><sup>4−</sup>Ge أو <sub>9</sub><sup>2−</sup>Ge أو <sup>6−</sup>[<sub>2</sub>(Ge<sub>9</sub>)]؛ والتي يمكن استحصالها من السبائك الحاوية على [[فلز قلوي|الفلزات القلوية]] والجرمانيوم في [[أمونيا|الأمونيا]] السائلة بوجود [[ثنائي أمين الإيثيلين]] {{#tag:ref|ethylenediamine|group="ط"}} أو [[كريبتاند]] {{#tag:ref|Cryptand|group="ط"}}.<ref name = "Greenwood" /><ref>{{cite journal|title=Oxidative Coupling of Deltahedral [Ge<sub>9</sub>]<sup>4−</sup> Zintl Ions|first1 = Li|last1 = Xu|last2=Sevov| first2=Slavi C.|journal=J. Am. Chem. Soc.|date = 1999|volume = 121| issue = 39|pages = 9245–9246|doi = 10.1021/ja992269s}}</ref> |
||
=== المركبات الكيميائية === |
|||
;الأكاسيد |
|||
هناك [[أكسيد|أكسيدان]] معروفان للجرمانيوم؛ الأول هو [[أكسيد الجرمانيوم الرباعي]] GeO<sub>2</sub> (المعروف أيضاً باسم ثنائي أكسيد الجرمانيوم)؛ أما الآخر فهو [[أكسيد الجرمانيوم الثنائي]] GeO (المعروف أيضاً باسم أحادي أكسيد الجرمانيوم).<ref name="HollemanAF">{{cite book|last = Holleman|first = A. F.|author2=Wiberg, E.|author3=Wiberg, N.|title=Lehrbuch der Anorganischen Chemie|edition=102nd|publisher=de Gruyter|date=2007|isbn=978-3-11-017770-1|oclc = 145623740}}</ref> يوجد ثنائي أكسيد الجرمانيوم GeO<sub>2</sub> على هيئة مسحوق بلوري أبيض، وهو ضعيف الانحلال بالماء، ويستحصل من تحميص [[كبريتيد الجرمانيوم الرباعي]] (ثنائي كبريتيد الجرمانيوم) GeS<sub>2</sub>. يؤدي تفاعل ثنائي الأكسيد مع القلويات إلى الحصول على مركبات [[جرمانات|الجرمانات]].<ref name="HollemanAF" /> من ناحية أخرى، يستحصل على أحادي أكسيد الجرمانيوم من تسخين ثنائي أكسيد الجرمانيوم مع عنصر الجرمانيوم عند درجات حرارة مرتفعة.<ref name="HollemanAF" /> يتميز الزجاج المصنوع من أكسيد الجرمانيوم والجرمانات بأنها تمتلك قيمة [[معامل الانكسار|قرينة انكسار]] (معامل انكسار {{#tag:ref|refractive index|group="ط"}}) مرتفعة في الضوء المرئي، لكنها شفافة بالنسبة [[الأشعة تحت الحمراء|للأشعة تحت الحمراء]] {{#tag:ref|infrared|group="ط"}}.<ref>{{cite journal|doi = 10.1111/j.1151-2916.2002.tb00594.x|title = Infrared Transparent Germanate Glass-Ceramics|first = Shyam S.|last = Bayya|author2=Sanghera, Jasbinder S.|author3=Aggarwal, Ishwar D.|author4=Wojcik, Joshua A.|journal = Journal of the American Ceramic Society|volume = 85|issue = 12|pages= 3114–3116|date = 2002}}</ref><ref>{{cite journal|doi = 10.1007/BF00614256|title = Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products|date = 1975 |last1 = Drugoveiko|first1 = O. P.|journal = Journal of Applied Spectroscopy|volume = 22|issue = 2|pages = 191–193|last2 = Evstrop'ev|first2 = K. K.|last3 = Kondrat'eva|first3 = B. S.|last4 = Petrov|first4 = Yu. A.|last5 = Shevyakov|first5 = A. M.|bibcode=1975JApSp..22..191D|s2cid = 97581394}}</ref> |
|||
== الدور الحيوي == |
== الدور الحيوي == |
||
نسخة 20:50، 10 ديسمبر 2023
| |||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أبيض رمادي
| |||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | جرمانيوم، 32، Ge | ||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | شبه فلز | ||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 14، 4، p | ||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 72.64 غ·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d10 4s2 4p2] | ||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 4 (صورة) | ||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 5.323 غ·سم−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 5.60 غ·سم−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1211.40 ك، 938.25 °س، 1720.85 °ف | ||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3106 ك، 2833 °س، 5131 °ف | ||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 36.94 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 334 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 23.222 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 4, 3, 2, 1, 0, -1, -2, -3, -4 أكاسيده تذبذب) | ||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 2.01 (مقياس باولنغ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 762 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1537.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3302.1 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 122 بيكومتر | ||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 122 بيكومتر | ||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 211 بيكومتر | ||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | بنية الألماس المكعّبة | ||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 1 أوم·متر (20 °س) | ||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 60.2 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 6.0 ميكرومتر/(م·كلفن) | ||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 5400 متر/ثانية (20 °س) | ||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 103[2] غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 41[2] غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 75[2] غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.26[2] | ||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-56-4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| طاقة فجوة النطاق عند 300 كلفن | 0.67 eV | ||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الجرمانيوم | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
الجرمانيوم عنصرٌ كيميائي رمزه Ge وعدده الذرّي 32، ويقع في المرتبة الثالثة ضمن عناصر المجموعة الرابعة عشرة في الجدول الدوري، والمعروفة باسم «مجموعة الكربون». يصنّف الجرمانيوم كيميائياً ضمن أشباه الفلزات.
يوجد الجرمانيوم في الظروف القياسية من الضغط ودرجة الحرارة على هيئة صلب هش ذي لون لامع بين الأبيض والرمادي، وهو يشبه السيليكون في منظره وخواصه. لا يوجد عنصر الجرمانيوم بشكله الحر في الطبيعة، ولكن يوجد غالباً مرتبطاً مع الأكسجين في مركبات مختلفة. من النادر العثور على تراكيز مرتفعة من خامات الجرمانيوم؛ فهو يقع حوالي المرتبة الخمسين بالنسبة للوفرة الطبيعية للعناصر الكيميائية في القشرة الأرضية.
اكتشف هذا العنصر في أواخر القرن التاسع عشر، وكان ضمن العناصر التي توقعها ديميتري مندلييف، وأطلق عليه اصطلاحاً اسم «إيكاسيليكون»؛ إلى أن تمكن الكيميائي كليمنس فنكلر من اكتشاف هذا العنصر، والذي أسماه بالجرمانيوم نسبة إلى موطنه ألمانيا. يستخرج الجرمانيوم أثناء معالجة خام السفاليريت، الخام الرئيس للزنك؛ بالإضافة إلى استحصاله من خامات الفضة والرصاص والنحاس. يستخدم الجرمانيوم بشكل واسع في صناعة أشباه الموصلات، وخاصة في صناعة الترانزستورات والمكونات الإلكترونية المختلفة. كما يستخدم حالياً في صناعة الألياف البصرية والخلايا الشمسية والثنائيات الباعثة للضوء. لا يوجد دور حيوي معروف للجرمانيوم بالنسبة للإنسان.
التاريخ وأصل التسمية


كان هذا العنصر ضمن العناصر التي توقّعها ديميتري مندلييف [ط 1] في سنة 1869، وأطلق حينها عليه التسمية المؤقّتة إيكاسيليكون [ط 2] نظراً لموقعه في الجدول الدوري في مجموعة الكربون تحت عنصر السيليكون وفوق عنصر القصدير.[3] كما خمن أن تكون الكتلة الذرية النسبية لهذا العنصر 70، وهي قريبة من القيمة الفعلية (72).[4]

في سنة 1885 اكتشف معدن جديد في منجم في مدينة فرايبرغ [ط 3] الألمانية، والذي أطلق عليه اسم آرجيروديت [ط 4].[5] وُكّل الكيميائي كليمنس فنكلر [ط 5] العامل في جامعة فرايبيرغ التكنولوجية [ط 6] بتحليل هذا المعدن، والذي تبين أنه مكون من الفضة والكبريت، بالإضافة إلى وجود عنصر جديد. لم يتمكن فنكلر في البداية من عزله، وبعد محاولات كثيفة استمرت عدة أشهر، تمكن فنكلر في سنة 1886 من عزل كبريتيد [ط 7] أبيض، والذي أدى اختزاله إلى الحصول على العنصر الجديد. نظراً لشبهه بالإثمد (الأنتيموان) [ط 8]، ظن فنكلر بشكل أولي أن العنصر الجديد قد يكون إيكاأنتيموان [ط 9]، إلا أن بعد التحقق وجد أنه عنصر إيكاسيليكون بالفعل.[6][7][8] قرر فنكلر، قبل أن يقوم بنشر نتائج أبحاثه عن العنصر الجديد، بأن يسميه نبتونيوم [ط 10]، وذلك لأن كوكب نبتون، المكتشف حديثاً حينها في سنة 1846، كان قد مر بشكل مشابه بتخمينات رياضية تنبات بوجوده قبل اكتشافه أيضاً. إلا أن تسمية نبتونيوم كانت محجوزة لتسمية عنصر محتمل في ذلك الوقت.[ملاحظة 1] عوضاً عن ذلك، أطلق فنكلر على العنصر الجديد اسم «جرمانيوم»، نسبةً إلى وطنه الأم ألمانيا.[7] بعد استخراج كميات كافية من معدن الآرجيروديت، قام فنكلر بدراسة الخواص الكيميائية لهذا العنصر مؤكداً الكثير من توقعات مندلييف المسبقة؛[6][7][13] كما تمكن أيضاً من تحضير العديد من المركبات الكيميائية لهذا العنصر.[6]
| الخاصة | إيكاسيليكون متوقعة |
الجرمانيوم محددة |
|---|---|---|
| الكتلة الذرية | 72.64 | 72.63 |
| الكثافة (غ/سم3) | 5.5 | 5.35 |
| نقطة الانصهار (°س) | مرتفعة | 947 |
| اللون | رمادي | رمادي |
| نمط الأكسيد | ثنائي أكسيد حراري | ثنائي أكسيد حراري |
| كثافة الأكسيد (غ/سم3) | 4.7 | 4.7 |
| خواص الأكسيد الكيميائية | قاعدي ضعيف | قاعدي ضعيف |
| نقطة غليان الكلوريد (°س) | دون 100 | 86 (GeCl4) |
| كثافة الكلوريد (غ/سم3) | 1.9 | 1.9 |
حتى أواخر ثلاثينيات القرن العشرين، كان يعتقد أن الجرمانيوم فلز سيء الموصلية؛[14] إلا أن استخداماته المهمة بدأت بالتزايد بشكل تدريجي، إذ في الحرب العالمية الثانية استخدم الجرمانيوم على نطاق صغير في الأجهزة الإلكترونية، وخاصة ثنائيات المساري [ط 11].[15][16] وكان أول تطبيق رئيسي له دخوله في تركيب ثنائي مساري شوتكي [ط 12] المستخدم في أجهزة الرادار أثناء الحرب.[14] إلا أن أهميته الاقتصادية ازدادت بشكل كبير بعد الحرب، عندما اكتشفت خواصه شبه الموصلة، إذ قبل سنة 1945 كانت الكميات المنتجة من الجرمانيوم لا تتجاوز بضعة مئات من الكيلوغرامات سنوياً، والتي كانت تنتج في مصاهر الفلزات [ط 13]؛ ولكن بالمقابل بلغ الإنتاج السنوي من الجرمانيوم نهاية خمسينيات القرن العشرين قرابة 40 مليون طن.[17]
كانت الأشكال الأولى من الترانزستور معتمدة بشكل كامل على الجرمانيوم؛[18] وأدى ذلك التطوير إلى فتح الباب على مصراعيه لتطبيقات غير منتهية لإلكترونيات الجوامد [ط 14].[19][20] استحصلت الأشكال الأولى من سبائك السيليكون والجرمانيوم [ط 15] في أواسط الخمسينيات؛[21] وحتى أوائل سبعينيات القرن العشرين كان هناك طلب متزايد على الجرمانيوم في صناعة أشباه الموصلات، إلى أن حل السيليكون مرتفع النقاوة محل الجرمانيوم في المكونات الإلكترونية مثل الترانزستورات وثنائيات المساري والمقوّمات [ط 16].[22]
الوفرة الطبيعية

يتشكل الجرمانيوم في الكون من تفاعلات الانصهار النجمي [ط 17]، وغالباً وفق عملية التقاط النيوترون البطيئة [ط 18] في مناطق العماليق المقاربة [ط 19].[23] وقد برهن على وجود الجرمانيوم في الغلاف الجوي لكوكب المشتري؛[24] وكذلك في عدد من النجوم سحيقة البعد في الكون.[25]
يأتي الجرمانيوم حوالي المرتبة الخمسين بين العناصر في القشرة الأرضية، وتبلغ الوفرة الطبيعية له فيها قرابة 1.6 جزء في المليون [ط 20].[26] هناك بضعة معادن فقط حاوية على كميات معتبرة من الجرمانيوم، مثل: الآرجيروديت [ط 21] والبريارتيت [ط 22] والجرمانيت [ط 23] والرينيريت [ط 24] والسفاليريت [ط 25].[22][27]
الاستخراج
من النادر العثور على كميات كبيرة مجدية للاستخراج من معادن الجرمانيوم.[28][29][30] بالمقابل؛ يمكن العثور على كميات كافية من الجرمانيوم في بعض توضعات خامات الزنك أو النحاس أو الرصاص، بحيث تكون عملية الاستخراج مجدية اقتصادياً.[26] في حالات خاصة، قد تحدث عمليات تخصيب طبيعية تؤدي إلى إثراء الخامات بالجرمانيوم في مناجم الفحم، وتلك ظاهرة اكتشفها فكتور غولدشميت [ط 26] أثناء قيامه بعمليات مسح عن توضعات الجرمانيوم الجيولوجية.[31][32] وردت تقارير عن العثور على كميات معتبرة من الجرمانيوم في مناجم في مقاطعة نورثمبرلاند [ط 27] الإنجليزية؛[31][32] وكذلك بالقرب من مدينة شيلينهوت [ط 28] في منطقة منغوليا الداخلية في الصين.[26]
الإنتاج
أنتج في سنة 2011 حوالي 118 طن من الجرمانيوم عالمياً، كانت للصين الحصة الأكبر منه (80 طن)، ثم روسيا (5 طن)، ثم الولايات المتحدة (3 طن).[22] بينت دراسة أن كمية تقارب 10 آلاف طن على الأقل من الجرمانيوم قابلة للاستخراج من احتياطات الزنك، خاصة من توضعات الكربونات المستضيفة لخامات الزنك والرصاص.[ط 29]، في حين أن حوالي 112 ألف طن موجود في احتياطات الفحم في العالم.[33][34] من جهة أخرى، بلغت كمية الجرمانيوم المستحصلة من إعادة التدوير نسبة 35%.[26]
يستحصل على الجرمانيوم على هيئة ناتج ثانوي أثناء معالجة السفاليريت خام الزنك، حيث يركز بنسبة تصل إلى 0.3%؛[35] وخاصة من التوضعات الجيولوجية الغنية بفلزات الزنك والرصاص والنحاس والباريوم.[36] هناك مصدر آخر للجرمانيوم، وهو من الرماد المتطاير [ط 30] من مداخن محطات الطاقة العاملة على الفحم الحاوي على الجرمانيوم؛ وهذا الأسلوب من استحصال الجرمانيوم مستخدم بشكل واسع في روسيا والصين.[37] تقع توضعات الجرمانيوم الجيولوجية من الفحم الحاوي على الجرمانيوم في روسيا في حزيرة سخالين [ط 31] في أقصى الشرق؛ في حين أن توضعات الصين المناظرة توجد في مناجم الفحم البني (الليغنيت) [ط 32] في مقاطعة يونان [ط 33]، وكذلك في منطقة منغوليا الداخلية.[26]
يوجد الجرمانيوم المستخرج من الخامات على هيئة كبريتيد، والذي يؤكسد بأكسجين الهواء إلى الأكسيد الموافق بعملية تحميص [ط 34]:
يبقى بعض من الجرمانيوم في الغبار؛ في حين أن المتبقي يتحول إلى جرمانات [ط 35]، ثم يخضع مع الزنك إلى عملية تصويل [ط 36] بواسطة حمض الكبريتيك. بعد إجراء عملية تعديل [ط 37] للوسط، يبقى الزنك في المحلول، في حين يترسب الجرمانيوم والفلزات المرافقة في الخامة. يزال الزنك وفق عملية فيلز [ط 38]، أما الراسب فيعالج مع غاز الكلور أو حمض الهيدروكلوريك حيث ينتج كلوريد الجرمانيوم الرباعي (رباعي كلوريد الجرمانيوم):
يخضع رباعي كلوريد الجرمانيوم بعد ذلك إما لعملية حلمهة [ط 39] إلى الأكسيد (GeO2)، أو ينقى بعملية تقطير بالتجزئة [ط 40] ثم يحلمه لاحقاً.[37] بذلك يستحصل على ثنائي أكسيد الجرمانيوم، وتعتمد الخطوة اللاحقة على درجة نقاوة الأكسيد، فمن أجل صناعة أشباه الموصلات، يجب أن يكون الجرمانيوم مرتفع النقاوة، لذلك تجرى عملية الاختزال للمادة الأولية النقية بالهيدروجين:
أما الجرمانيوم المستخدم في صناعة السبائك والعمليات الصناعية الأخرى، فغالباً ما تجرى عملية الاختزال باستخدام الكربون:[38]
النظائر
لعنصر الجرمانيوم خمسة نظائر طبيعية، وهي: جرمانيوم-70 70Ge، وجرمانيوم-72 72Ge، وجرمانيوم-73 73Ge، وجرمانيوم-74 74Ge، وجرمانيوم-76 76Ge. يعد النظير 74Ge أكثر نظائر الجرمانيوم انتشاراً، فالوفرة الطبيعية له مقدارها حوالي 36%؛ بالمقابل، فإن النظير 76Ge أقلها وفرة بنسبة 7%.[39] للنظير الأخير المذكور جرمانيوم-76 76Ge نشاط إشعاعي طفيف، إذ يضمحل وفق اضمحلال بيتا المضاعف [ط 41] بعمر نصف مقداره 1.78×1021 سنة. يؤدي قذف النظير 72Ge بجسيمات ألفا إلى الحصول على نظير السيلينيوم 77Se، وتحرر هذه العملية إلكترونات مرتفعة الطاقة؛[40] ولهذا السبب فإنه يستخدم إلى جانب الرادون من أجل البطاريات الذرية [ط 42].[40]
هناك 27 نظيراً مشعاً للجرمانيوم على الأقل، وتتراوح كتلها الذرية من 58 إلى 89؛ أكثرها استقراراً النظير 68Ge، والذي يضمحل وفق عملية التقاط إلكترون [ط 43] بعمر نصف يقارب 271 يوماً؛ أما أقلها استقراراً هو النظير 60Ge بعمر نصف مقداره 30 ملي ثانية. تضمحل أغلب نظائر الجرمانيوم المشعة وفق اضمحلال بيتا [ط 44]؛ في حين أن النظيرين 84Ge و87Ge يضمحلان وفق عملية انبعاث البوزيترون [ط 45] وكذلك وفق انبعاث النيوترون [ط 46].[39]
الخواص الفيزيائية

يوجد الجرمانيوم في الظروف القياسية من الضغط ودرجة الحرارة على هيئة مادة صلبة شبيهة بالفلزات وذات لون أبيض فضّي.[41] يدعى هذا الشكل المتآصل [ط 47] باسم الشكل ألفا (α)، وله بريق فلزّي وبنية تشبه بنية الألماس المكعّبة [ط 48].[22] وعند ضغوط تفوق 120 كيلوبار، يصبح الجرمانيوم على الشكل بيتّا (β)، والذي لخ بنية مشابهة لبنية الشكل بيتا للقصدير.[42] ينتمي الجرمانيوم إلى عدد قليل من العناصر (السيليكون والغاليوم والبزموت والإثمد) والتي تتمدد عند تصلبها، أي عندما تتجمد من حالتها المصهورة فإن كثافتها تزداد مثل الماء.[42]
إن الجرمانيوم من المواد شبه موصلة [ط 49]، وله فجوة نطاق غير مباشرة [ط 50] مثل السيليكون البلوري. مكنت تقنيات الصهر النطاقي [ط 51] من إنتاج الجرمانيوم البلوري من أجل تطبيقات أشباه الموصلات وذلك بنقاوة مرتفعة جداً،[43] مما يجعله واحداً من أنقى المواد المنتجة.[44] وجد أيضاً أن لسبيكة من سبائك الجرمانيوم (مع اليورانيوم والروديوم) موصلية فائقة [ط 52] بوجود حقل مغناطيسي قوي للغاية.[45]
يخضع الجرمانيوم النقي عند تطبيق جهد ميكانيكي إلى عملية تغير في المواقع في البنية البلورية، مما يؤدي إلى انبثاق زوائد طويلة على هيئة براغي [ط 53]، والتي يشار إليها أيضاً باسم شعيرات الجرمانيوم [ط 54]. كانت هذه الظاهرة أحد الأسباب الرئيسية لفشل ثنائيات المساري والترانزستورات القديمة المصنوعة من الجرمانيوم، لأن تلك الشعيرات كانت تؤدي إلى حدوث دائرة قصر [ط 55].[46]
الخواص الكيميائية
ينتمي الجرمانيوم كيميائياً إلى مجموعة عناصر أشباه الفلزات؛ وهو لا يتأكسد بأكسجين الهواء عند درجة حرارة الغرفة. إنما يتأكسد عنصر الجرمانيوم ببطء في الهواء عند التسخين إلى درجات حرارة تتجاوز 250 °س، مشكلاً بذلك ثنائي أكسيد الجرمانيوم GeO2.[47] لا ينحل الجرمانيوم عند إلقائه في الأحماض الممددة وكذلك في المحاليل القلوية الممددة، لكنه يذوب ببطء في الأحماض المركزة الساخنة، مثل حمض الكبريتيك أو حمض النتريك؛ كما يتفاعل بعنف مع مصهور هيدروكسيدات الفلزات القلوية ليعطي مركبات الجرمانات الموافقة.
غالباً ما يوجد الجرمانيوم في حالة الأكسدة الرباعية +4 في مركباته الكيميائية، بالرغم مع ذلك، فإنه توجد بعض المركبات في حالة الأكسدة الثنائية +2.[48] أما حالات الأكسدة المتبقية (مثل +3 أو+1)، فهي نادرة جداً.[49] يمكن العثور على أنيونات الجرمانيوم متعددة الذرات [ط 56] من نمط زنتل [ط 57] في الأنواع الكيميائية 42−Ge أو 94−Ge أو 92−Ge أو 6−[2(Ge9)]؛ والتي يمكن استحصالها من السبائك الحاوية على الفلزات القلوية والجرمانيوم في الأمونيا السائلة بوجود ثنائي أمين الإيثيلين [ط 58] أو كريبتاند [ط 59].[48][50]
المركبات الكيميائية
- الأكاسيد
هناك أكسيدان معروفان للجرمانيوم؛ الأول هو أكسيد الجرمانيوم الرباعي GeO2 (المعروف أيضاً باسم ثنائي أكسيد الجرمانيوم)؛ أما الآخر فهو أكسيد الجرمانيوم الثنائي GeO (المعروف أيضاً باسم أحادي أكسيد الجرمانيوم).[42] يوجد ثنائي أكسيد الجرمانيوم GeO2 على هيئة مسحوق بلوري أبيض، وهو ضعيف الانحلال بالماء، ويستحصل من تحميص كبريتيد الجرمانيوم الرباعي (ثنائي كبريتيد الجرمانيوم) GeS2. يؤدي تفاعل ثنائي الأكسيد مع القلويات إلى الحصول على مركبات الجرمانات.[42] من ناحية أخرى، يستحصل على أحادي أكسيد الجرمانيوم من تسخين ثنائي أكسيد الجرمانيوم مع عنصر الجرمانيوم عند درجات حرارة مرتفعة.[42] يتميز الزجاج المصنوع من أكسيد الجرمانيوم والجرمانات بأنها تمتلك قيمة قرينة انكسار (معامل انكسار [ط 60]) مرتفعة في الضوء المرئي، لكنها شفافة بالنسبة للأشعة تحت الحمراء [ط 61].[51][52]
الدور الحيوي
وقد اكتسب الجرمانيوم شعبية في السنوات الأخيرة لقدرتها على تحسين سمعته الطيبة على وظيفة نظام المناعة لدى مرضى السرطان. وهي متاحة في الولايات المتحدة كملحق صفة الغذائية في كبسولات أو أقراص عن طريق الفم، وكحل أدنى يمكن حقنه. وفي وقت سابق أدت الأشكال غير العضوية، ولا سيما الملح سيترات إلى عدد كبير من حالات الفشل الكلوي، التنكيس الدهني الكبدي والاعتلال العصبي في الأفراد الذين يستخدمون ما سبق على أساس التداوي من الأمراض المزمنة السابقة إلا أن تركيز الجرمانيوم في البلازما والبول لهؤلاء المرضى كان بنسبة كبيرة، أدت إلى وفاة العديد منهم.[53]
الاستخدامات
تم استخدام الجرمانيوم في عدة مجالات من بينها: البصريات، إلكترونيات وفي مجالات أخرى.
في البصريات
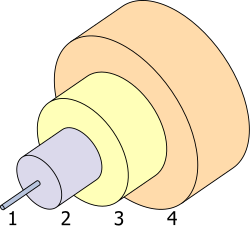
1.- قلب 8 µm
2.- الكسور 125 µm
3.- المصد 250 µm
4.- الحامي 400 µm
الاستخدامات الرئيسية للجرمانيوم في عام 2007 م، في جميع أنحاء العالم تشير التقديرات إلى أن استعماله بنسبة 35 ٪ لأنظمة الألياف الضوئية والبصريات والأشعة تحت الحمراء تمثل 30 ٪، 15 ٪ للمحفزات البلمرة، و 15 ٪ لتطبيقات الالكترونيات والكهرباء من الطاقة الشمسية. 5 ٪ الباقية تستعمل في استخدامات أخرى مثل فوسفورات والمعادن. الجرمانيوم يستخدم في شبكات الألياف البصرية والاتصالات والأشعة تحت الحمراء لأنظمة الرؤية الليلية. ولاستخدامه في هذه الغاية مثل 85 ٪ من استهلاك الجرمانيوم في جميع أنحاء العالم في عام2000.مما جعله مفيدا بشكل خاص لعدسات الزاوية الواسعة. [57] [58] وفي نهاية عام 2002 صناعة الألياف البصرية مثلت 6 ٪ من استخدام الجرمانيوم السنوية في الولايات المتحدة. والجرمانيوم يستخدم لتغيير الخصائص البصرية، كما هو الحال في أقراص الفيديو الرقمية لإعادة الكتابة فيها. [60] لأن الجرمانيوم شفاف في الأشعة تحت الحمراء ومهم جدا في المواد البصرية بالأشعة تحت الحمراء، والتي تمكن بسهولة من صقل العدسات والنوافذ. وتستخدم بوجه خاص باعتبارها أساس البصريات في كاميرات التصوير الحراري التي تعمل من 8 إلى 14 ميكرون، والذي يمثل مدى الطول الموجي للتصوير الحراري السلبي والساخن في الكشف عن العمليات العسكرية وتطبيقات مكافحة الحرائق. [56] كما أنه يستخدم في المطيافية ومعدات بصرية أخرى التي تتطلب حساسية للكشف عن الأشعة تحت الحمراء. [58]
عن إلكترونيات
والجرمانيوم من أَكثر المواد استخدامًا بوصفه شبه موصل شبه الموصل. وهو شبه موصل جيد لأنّه لا يحتوي على خواص فلزية قوية. ويستخدم الجرمانيوم في صناعة الأَجهزة شبْه الموصلة مثل الصِّمامات الثنائية، وبطاريات الطاقة الشمسية، والترانزستورات.
تستخدم فيها أيضا سبائك السيليكون الجرمانيوم -التي تتحول إلى مادة أشباه الموصلات - في الدوائر المتكاملة العالية السرعة.[54] السيليكون الجرمانيوم جدير بالاستعمال في أجهزة الاتصالات اللاسلكية. كما هو الحال عن رقائق SiGe التي تتميز بسرعة عالية وخصائص مميزة مع التكلفة المنخفضة لهذه التطبيقات، وتقنيات إنتاج راسخة من هذا المعدن.
زرنيخيد الجاليوم الخلية الجرمانيوم
هو بداية ليحل محل عنصر زرنيخيد الغاليوم (الغاليوم). لأن الجرمانيوم وزرنيخيد الغاليوم وثوابت شعرية مشابهة جدا، يمكن أن تستخدم في الخلايا الشمسية.[55] وهناك استخدامات أخرى في مجال الالكترونيات وتشمل فوسفورات مصابيح الفلورسنت.[56] ويعتبر الجرمانيوم القاعدة الصلبة لدولة الثنائيات الباعثة للضوء أي المصابيح. وإلى حد الآن لا تزال تستخدم ترانزستورات الجرمانيوم في بعض دواسات الآثار من قبل الموسيقيين الذين يرغبون في استنساخ الطابع المميز للدرجة اللونية.[57]
استخدامات أخرى الجرمانيوم
يمكن استخدامه في أحد كاشفات الكريستال بالضبط لتحديد مصادر الإشعاع، على سبيل المثال في أمن المطارات.[58] الجرمانيوم معدن مفيد لحيود الأشعة السينية.[59] وللكشف عن طيف أشعة غاما والبحث عن المادة المظلمة.[60]
طالع أيضاً
الهوامش
- ملحوظات
- ^ في بحث نشر سنة 1877 أعلن أحد الكيميائيين اكتشافه لعنصر جديد تحت التانتالوم في الجدول الدوري، وأطلق عليه اسم نبتونيوم نسبة إلى إله البحار والمحيطات الإغريقي.[9][10] ولكن تبين لاحقاً أنه ليس بعنصر جديد، إنما سبيكة من عنصري النيوبيوم والتانتالوم.[11] على أي حال، فقد استخدمت التسمية لاحقاً لعنصر اصطناعي اكتشف في سنة 1940، وهو عنصر النبتونيوم.[12]
- مصطلحات
- ^ Dmitri Mendeleev
- ^ ekasilicon
- ^ Freiberg
- ^ argyrodite
- ^ Clemens Winkler
- ^ Universität Bergakademie Freiberg
- ^ Sulfide
- ^ antimony
- ^ eka-antimony
- ^ neptunium
- ^ diodes
- ^ Schottky diode
- ^ smelters
- ^ solid state electronics
- ^ Silicon–germanium
- ^ rectifiers
- ^ stellar nucleosynthesis
- ^ s-process
- ^ asymptotic giant branch
- ^ Parts per million (ppm)
- ^ argyrodite
- ^ briartite
- ^ germanite
- ^ renierite
- ^ sphalerite
- ^ Victor Goldschmidt
- ^ Northumberland
- ^ Xilinhot
- ^ Carbonate-hosted lead-zinc ore deposits
- ^ Fly ash
- ^ Sakhalin
- ^ lignite
- ^ Yunnan
- ^ Roasting
- ^ germanates
- ^ leaching
- ^ Neutralization
- ^ Waelz process
- ^ Hydrolysis
- ^ fractional distillation
- ^ Double beta decay
- ^ nuclear batteries
- ^ Electron capture
- ^ Beta decay
- ^ Positron emission
- ^ Neutron emission
- ^ allotrope
- ^ Diamond cubic
- ^ semiconductor
- ^ indirect bandgap
- ^ Zone melting
- ^ Superconductivity
- ^ screw dislocations
- ^ germanium whiskers
- ^ electrical short
- ^ Germanium cluster anions
- ^ Zintl
- ^ ethylenediamine
- ^ Cryptand
- ^ refractive index
- ^ infrared
المراجع
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ ا ب ج د "Properties of Germanium". Ioffe Institute.
- ^ Kaji، Masanori (2002). "D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry" (PDF). Bulletin for the History of Chemistry. ج. 27 ع. 1: 4–16. مؤرشف من الأصل (PDF) في 2008-12-17. اطلع عليه بتاريخ 2008-08-20.
- ^ van der Krogt، Peter. "Elementymology & Elements Multidict: Germanium". اطلع عليه بتاريخ 2008-08-20.
- ^ Argyrodite – Ag8GeS6 (PDF) (Report). Mineral Data Publishing. مؤرشف (PDF) من الأصل في 2016-03-03. اطلع عليه بتاريخ 2008-09-01.
- ^ ا ب ج Winkler, Clemens (1887). "Mittheilungen über des Germanium. Zweite Abhandlung". J. Prak. Chemie (بالألمانية). 36 (1): 177–209. DOI:10.1002/prac.18870360119. Archived from the original on 2012-11-03. Retrieved 2008-08-20.
- ^ ا ب ج Winkler, Clemens (1887). "Germanium, Ge, a New Nonmetal Element". Berichte der Deutschen Chemischen Gesellschaft (بالألمانية). 19 (1): 210–211. DOI:10.1002/cber.18860190156. Archived from the original on 2008-12-07.
- ^ "Germanium, a New Non-Metallic Element". The Manufacturer and Builder: 181. 1887. مؤرشف من الأصل في 2008-12-19. اطلع عليه بتاريخ 2008-08-20.
- ^ Sears، Robert (يوليو 1877). Scientific Miscellany. ج. 24. ص. 131. ISBN:978-0-665-50166-1. OCLC:16890343.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة) - ^ "Editor's Scientific Record". Harper's New Monthly Magazine. ج. 55 ع. 325: 152–153. يونيو 1877. مؤرشف من الأصل في 2012-05-26. اطلع عليه بتاريخ 2008-09-22.
- ^ van der Krogt، Peter. "Elementymology & Elements Multidict: Niobium". مؤرشف من الأصل في 2010-01-23. اطلع عليه بتاريخ 2008-08-20.
- ^ Westgren، A. (1964). "The Nobel Prize in Chemistry 1951: presentation speech". Nobel Lectures, Chemistry 1942–1962. Elsevier. مؤرشف من الأصل في 2008-12-10. اطلع عليه بتاريخ 2008-09-18.
- ^ Brunck, O. (1886). "Obituary: Clemens Winkler". Berichte der Deutschen Chemischen Gesellschaft (بالألمانية). 39 (4): 4491–4548. DOI:10.1002/cber.190603904164. Archived from the original on 2020-08-01. Retrieved 2020-06-07.
- ^ ا ب Haller, E. E. (14 يونيو 2006). "Germanium: From Its Discovery to SiGe Devices" (PDF). Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley. مؤرشف (PDF) من الأصل في 2019-07-10. اطلع عليه بتاريخ 2008-08-22.
- ^ W. K. (10 مايو 1953). "Germanium for Electronic Devices". The New York Times. مؤرشف من الأصل في 2013-06-13. اطلع عليه بتاريخ 2008-08-22.
- ^ "1941 – Semiconductor diode rectifiers serve in WW II". Computer History Museum. مؤرشف من الأصل في 2008-09-24. اطلع عليه بتاريخ 2008-08-22.
- ^ Halford، Bethany (2003). "Germanium". Chemical & Engineering News. American Chemical Society. مؤرشف من الأصل في 2008-05-13. اطلع عليه بتاريخ 2008-08-22.
- ^ Bardeen، J.؛ Brattain, W. H. (1948). "The Transistor, A Semi-Conductor Triode". Physical Review. ج. 74 ع. 2: 230–231. Bibcode:1948PhRv...74..230B. DOI:10.1103/PhysRev.74.230.
- ^ "Electronics History 4 – Transistors". National Academy of Engineering. مؤرشف من الأصل في 2007-10-20. اطلع عليه بتاريخ 2008-08-22.
- ^ Teal، Gordon K. (يوليو 1976). "Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit". IEEE Transactions on Electron Devices. ED-23 ع. 7: 621–639. Bibcode:1976ITED...23..621T. DOI:10.1109/T-ED.1976.18464. S2CID:11910543.
- ^ "SiGe History". University of Cambridge. مؤرشف من الأصل في 2008-08-05. اطلع عليه بتاريخ 2008-08-22.
- ^ ا ب ج د U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. مؤرشف من الأصل في 2008-09-16. اطلع عليه بتاريخ 2008-08-28.
Select 2008
- ^ Sterling، N. C.؛ Dinerstein, Harriet L.؛ Bowers, Charles W. (2002). "Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer". The Astrophysical Journal Letters. ج. 578 ع. 1: L55–L58. arXiv:astro-ph/0208516. Bibcode:2002ApJ...578L..55S. DOI:10.1086/344473. S2CID:119395123.
- ^ Kunde، V.؛ Hanel, R.؛ Maguire, W.؛ Gautier, D.؛ Baluteau, J. P.؛ Marten, A.؛ Chedin, A.؛ Husson, N.؛ Scott, N. (1982). "The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio". Astrophysical Journal. ج. 263: 443–467. Bibcode:1982ApJ...263..443K. DOI:10.1086/160516.
- ^ Cowan، John (1 مايو 2003). "Astronomy: Elements of surprise". Nature. ج. 423 ع. 29: 29. Bibcode:2003Natur.423...29C. DOI:10.1038/423029a. PMID:12721614. S2CID:4330398.
- ^ ا ب ج د ه Höll، R.؛ Kling, M.؛ Schroll, E. (2007). "Metallogenesis of germanium – A review". Ore Geology Reviews. ج. 30 ع. 3–4: 145–180. DOI:10.1016/j.oregeorev.2005.07.034.
- ^ Frenzel، Max (2016). "The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)". ResearchGate. Unpublished. DOI:10.13140/rg.2.2.20956.18564. مؤرشف من الأصل في 2018-10-06. اطلع عليه بتاريخ 2017-06-10.
- ^ Roberts، Andrew C.؛ وآخرون (ديسمبر 2004). "Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia". The Canadian Mineralogist. ج. 42 ع. 6: 1771–1776. Bibcode:2004CaMin..42.1771R. DOI:10.2113/gscanmin.42.6.1771. مؤرشف من الأصل في 2023-07-07.
- ^ "Archived copy" (PDF). مؤرشف (PDF) من الأصل في 2018-10-06. اطلع عليه بتاريخ 2018-10-06.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link) - ^ "Archived copy" (PDF). مؤرشف (PDF) من الأصل في 2020-03-20. اطلع عليه بتاريخ 2018-10-06.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link) - ^ ا ب Goldschmidt، V. M. (1930). "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. مؤرشف من الأصل في 2018-03-03. اطلع عليه بتاريخ 2008-08-25.
- ^ ا ب Goldschmidt، V. M.؛ Peters, Cl. (1933). "Zur Geochemie des Germaniums". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. مؤرشف من الأصل في 2008-12-01. اطلع عليه بتاريخ 2008-08-25.
- ^ Frenzel، Max؛ Ketris، Marina P.؛ Gutzmer، Jens (29 ديسمبر 2013). "On the geological availability of germanium". Mineralium Deposita. ج. 49 ع. 4: 471–486. Bibcode:2014MinDe..49..471F. DOI:10.1007/s00126-013-0506-z. ISSN:0026-4598. S2CID:129902592.
- ^ Frenzel، Max؛ Ketris، Marina P.؛ Gutzmer، Jens (19 يناير 2014). "Erratum to: On the geological availability of germanium". Mineralium Deposita. ج. 49 ع. 4: 487. Bibcode:2014MinDe..49..487F. DOI:10.1007/s00126-014-0509-4. ISSN:0026-4598. S2CID:140620827.
- ^ Bernstein, L (1985). "Germanium geochemistry and mineralogy". Geochimica et Cosmochimica Acta. ج. 49 ع. 11: 2409–2422. Bibcode:1985GeCoA..49.2409B. DOI:10.1016/0016-7037(85)90241-8.
- ^ Frenzel، Max؛ Hirsch، Tamino؛ Gutzmer، Jens (يوليو 2016). "Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis". Ore Geology Reviews. ج. 76: 52–78. Bibcode:2016OGRv...76...52F. DOI:10.1016/j.oregeorev.2015.12.017.
- ^ ا ب Naumov، A. V. (2007). "World market of germanium and its prospects". Russian Journal of Non-Ferrous Metals. ج. 48 ع. 4: 265–272. DOI:10.3103/S1067821207040049. S2CID:137187498.
- ^ Moskalyk, R. R. (2004). "Review of germanium processing worldwide". Minerals Engineering. ج. 17 ع. 3: 393–402. Bibcode:2004MiEng..17..393M. DOI:10.1016/j.mineng.2003.11.014.
- ^ ا ب Audi، Georges؛ Bersillon، Olivier؛ Blachot، Jean؛ Wapstra، Aaldert Hendrik (2003)، "The NUBASE evaluation of nuclear and decay properties"، Nuclear Physics A، ج. 729: 3–128، Bibcode:2003NuPhA.729....3A، DOI:10.1016/j.nuclphysa.2003.11.001
- ^ ا ب Perreault, Bruce A. "Alpha Fusion Electrical Energy Valve", US Patent 7800286, issued September 21, 2010. PDF copy في Wayback Machine (نسخة محفوظة أكتوبر 12, 2007)
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعnbb - ^ ا ب ج د ه Holleman، A. F.؛ Wiberg, E.؛ Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (ط. 102nd). de Gruyter. ISBN:978-3-11-017770-1. OCLC:145623740.
- ^ "Germanium". Los Alamos National Laboratory. مؤرشف من الأصل في 2011-06-22. اطلع عليه بتاريخ 2008-08-28.
- ^ Chardin, B. (2001). "Dark Matter: Direct Detection". في Binetruy, B (المحرر). The Primordial Universe: 28 June – 23 July 1999. Springer. ص. 308. ISBN:978-3-540-41046-1.
- ^ Lévy، F.؛ Sheikin، I.؛ Grenier، B.؛ Huxley، A. (أغسطس 2005). "Magnetic field-induced superconductivity in the ferromagnet URhGe". Science. ج. 309 ع. 5739: 1343–1346. Bibcode:2005Sci...309.1343L. DOI:10.1126/science.1115498. PMID:16123293. S2CID:38460998.
- ^ Givargizov، E. I. (1972). "Morphology of Germanium Whiskers". Kristall und Technik. ج. 7 ع. 1–3: 37–41. DOI:10.1002/crat.19720070107.
- ^ Tabet, N؛ Salim، Mushtaq A. (1998). "KRXPS study of the oxidation of Ge(001) surface". Applied Surface Science. ج. 134 ع. 1–4: 275–282. Bibcode:1998ApSS..134..275T. DOI:10.1016/S0169-4332(98)00251-7.
- ^ ا ب Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- ^ Tabet, N؛ Salim، M. A.؛ Al-Oteibi، A. L. (1999). "XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates". Journal of Electron Spectroscopy and Related Phenomena. 101–103: 233–238. DOI:10.1016/S0368-2048(98)00451-4.
- ^ Xu، Li؛ Sevov، Slavi C. (1999). "Oxidative Coupling of Deltahedral [Ge9]4− Zintl Ions". J. Am. Chem. Soc. ج. 121 ع. 39: 9245–9246. DOI:10.1021/ja992269s.
- ^ Bayya، Shyam S.؛ Sanghera, Jasbinder S.؛ Aggarwal, Ishwar D.؛ Wojcik, Joshua A. (2002). "Infrared Transparent Germanate Glass-Ceramics". Journal of the American Ceramic Society. ج. 85 ع. 12: 3114–3116. DOI:10.1111/j.1151-2916.2002.tb00594.x.
- ^ Drugoveiko، O. P.؛ Evstrop'ev، K. K.؛ Kondrat'eva، B. S.؛ Petrov، Yu. A.؛ Shevyakov، A. M. (1975). "Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products". Journal of Applied Spectroscopy. ج. 22 ع. 2: 191–193. Bibcode:1975JApSp..22..191D. DOI:10.1007/BF00614256. S2CID:97581394.
- ^ Baselt, R. (2008). Disposition of Toxic Drugs and Chemicals in Man (ط. 8). Foster City, CA: Biomedical Publications. ص. 693–694.
- ^ Washio، K. (2003). "SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems". IEEE Transactions on Electron Devices. ج. 50 ع. 3: 656. DOI:10.1109/TED.2003.810484.
- ^ Bailey، Sheila G.؛ Raffaelle، Ryne؛ Emery، Keith (2002). "Space and terrestrial photovoltaics: synergy and diversity". Progress in Photovoltaics Research and Applications. ج. 10 ع. 6: 399. DOI:10.1002/pip.446.
- ^ Crisp، D. (2004). "The performance of gallium arsenide/germanium solar cells at the Martian surface". Progress in Photovoltaics Research and Applications. ج. 54 ع. 2: 83–101. DOI:10.1016/S0094-5765(02)00287-4.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Szweda, Roy (2005). "Germanium phoenix". III-Vs Review. ج. 18 ع. 7: 55. DOI:10.1016/S0961-1290(05)71310-7.
- ^ "Germanium". American Cancer Society. مؤرشف من الأصل في 2010-06-28. اطلع عليه بتاريخ 2008-08-31.
- ^ Ahmed, F. U. (1996). "Optimization of Germanium for Neutron Diffractometers". International Journal of Modern Physics E. ج. 5 ع. 1: 131. DOI:10.1142/S0218301396000062.
- ^ Diehl، R.؛ Prantzos، N؛ Vonballmoos، P (2006). "Astrophysical constraints from gamma-ray spectroscopy". Nuclear Physics A. ج. 777: 70. DOI:10.1016/j.nuclphysa.2005.02.155.
| في كومنز صور وملفات عن: جرمانيوم |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||





