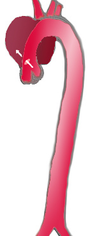
تسلخ الأبهر
| تسلخ الأبهر | |
|---|---|
 تسلخ الجزء الهابط من الشريان الأبهر (3)، والذي يبدأ من شريان تحت الترقوة الأيسر، ويمتد إلى الشريان الأورطي البطني (4). وذلك لا يشمل الأبهر الصاعد (1) أو قوس الأبهر (2).
| |
| معلومات عامة | |
| الاختصاص | جراحة أوعية، جراحة القلب والصدر |
| من أنواع | تسلخ، ومرض الأبهر ، ومرض |
| الموقع التشريحي | أبهر |
| تعديل مصدري - تعديل | |
تسلخ الأبهر (بالإنجليزية: Aortic dissection) ويسمى أيضاً: أم الدم المسلخة أو تشرح الشريان الأورطي عبارة عن تمزق يصيب جدار الشريان الأبهر مما يؤدي إلى تدفق الدم بين الطبقات المكونة لجدار الشريان الأبهر ويجبر هذه الطبقات على التباعد عن بعضها البعض.[1] هو تمزق في جدار الشريان الأبهر يؤدي إلى تدفق الدم بين طبقاته وانفصالها عن بعضها، وتسلخ الأبهر هو من حالات الطوارئ التي قد تؤدي إلى الوفاة العاجلة حتى مع تقديم أفضل وأكمل العلاجات المتوفرة، ويعتبر تسلخ الأبهر حالة طبية طارئة يمكن أن تؤدي سريعًا إلى وفاة المريض، حتى وإن تلقى أفضل سبل العلاج الممكنة. أما إذا تمكن التسلخ من تمزيق الشريان الأبهر تمامًا واختراقه (عبر الجدران الثلاثة للشريان كلها)، يؤدي ذلك إلى حدوث نزيف دموي غزير وسريع. يتسبب التمزق الناتج عن تسلخ الأبهر في حدوث معدل وفاة تبلغ نسبته %80 بينما تلقى نسبة %50 من المرضى المصابين بتسلخ الأبهر حتفها حتى قبل أن تصل إلى المستشفى للعلاج. فإذا وصل التسلخ إلى ستة سنتيمترات في جدار الشريان الأبهر، فيجب أن يتم إجراء جراحة طارئة للمريض.[2]
الأصل اللغوي
[عدل]تسلخ الأبهر: كلمة سلخ تعني في اللغة العربية كشط، أما الأبهر فقد جاء في لسان العرب:
| الأَبْهَرُ عِرْقٌ إِذا انقطع مات صاحبه؛ وهما أَبْهَرانِ يخرجان من القلب ثم يتشعب منهما سائر الشَّرايين. |
وجاء في المعجم الطبي الموحد ترجمة كلمة (aorta) بالشريان الأبهر، وترجمة (aortic dissection) ب: تسلخ الأبهر أو أم الدم المُسَلِّخَة
نظرة عامة على تركيب الشريان الأبهر
[عدل]
مثل باقي الشرايين الأخرى، يتكون الشريان الأبهر من ثلاث طبقات، وهي: بطانة الشريان والطبقة الوسطى والطبقة الخارجية. أما الطبقة التي تتصل اتصالاً مباشرًا بمجرى الدم فهي الطبقة الداخلية المعروفة باسم tunica intima، والتي يطلق عليها اسمًا شائع الاستخدام وهو بطانة الشريان . وتتكون هذه الطبقة بصفة أساسية من الخلايا البطانية. أما الطبقة التالية للطبقة الداخلية فهي الطبقة الوسطى أو الطبقة العضلية المعروفة باسم tunica media. وتتكون هذه الطبقة من مزيج من الخلايا العضلية الملساء والألياف المرنة. أما آخر الطبقات من الجهة الخارجية فهي الطبقة المعروفة باسم tunica adventitia أو الطبقة الخارجية. وتتكون هذه الطبقة من نسيج ضام.
وفي حالة الإصابة بتسلخ الأبهر، يخترق الدم بطانة الشريان ليدخل إلى الطبقة الوسطى. ويتسبب الضغط الشديد لتيار الدم المتدفق في تمزيق نسيج الطبقة الوسطى على طول امتداد سطح التجويف الشرياني فاصلاً ثلثي البطانة الداخلية للشريان وثلث الطبقة الخارجية له عن الطبقة الوسطى للشريان.[بحاجة لمصدر] ويمكن أن يمتد هذا التمزق على طول امتداد الشريان الأبهر لمسافات مختلفة في اتجاه امتداده ناحية الأمام أو ناحية الخلف. ويطلق اسم anterograde dissections (التسليخات التقدمية) على التسليخات التي تمتد في اتجاه تفرعات الشريان الحرقفي (ويكون ذلك في اتجاه تدفق الدم)، أما التسليخات التي تحدث في اتجاه جذر الشريان الأبهر (أي في الاتجاه المعاكس لتدفق الدم) فيطلق عليها اسم retrograde dissections (التسليخات الرجوعية). وعادةً ما يحدث التمزق الأولي خلال 100 ملليمتر من الصمام الأبهري، لذا يكون من السهل أن يؤثر التسلخ الرجوعي على التامور ويتسبب في الإصابة بالحالة المعروفة باسم hemocardium. وقد تنتشر التسليخات الرجوعية على طول المسافة الممتدة في اتجاه تفرعات الشريان الحرقفي للشريان الأبهر فتسبب في تمزق جدار الشريان الأبهر أو تتسبب في توليد قنوات في تجويف هذا الوعاء الدموي؛ الأمر الذي يؤدي إلى مضاعفة حجم الجزء الأسطواني في الشريان الأبهر. وتعمل مضاعفة حجم التجويف الأسطواني للشريان الأبهر على تخفيف ضغط تيار الدم المتدفق على جدار الشريان وتقليل احتمالية الإصابة بالتمزق الشرياني. ويؤدي التمزق إلى حدوث نزيف داخل أحد التجويفات الجسدية. أما التكهن بتطور الحالة المرضية فيعتمد على الجزء الذي تعرض للتمزق. ويمكن - أيضًا - أن يتعرض المريض للتمزقات في المنطقة الواقعة خلف الصفاق وفي منطقة التامور.
التصنيف
[عدل]تم استخدام العديد من نظم التصنيف المختلفة لوصف حالات تسلخ الأبهر. وتعتمد النظم شائعة الاستخدام على التركيب التشريحي للتسلخ أو على الفترة الزمنية الفاصلة بين بداية الإصابة بالمرض وظهور الأعراض على المريض.
تصنيف DeBakey
[عدل]وقد تم إطلاق اسم تصنيف DeBakey على هذا النظام نسبةً إلى الجراح Michael E. DeBakey الذي كان يعاني شخصيًا من تسلخ الأبهر. ويعتبر هذا النظام وصفًا للتركيب التشريحي لحالة تسلخ الأبهر. ويقوم هذا النظام بتصنيف التسلخ وفقًا للمكان الأساسي الذي بدأ فيه التمزق البطاني والمدى الذي وصل إليه التسلخ (والذي يتمركز إما في الأبهر الصاعد أو في الأبهر الهابط أو يصيب كلاً من الأبهر الصاعد والأبهر الهابط).[3]
- Type I : ينشأ في الأبهر الصاعد وينتشر ليصل إلى قوس الأبهر - على الأقل. وعادةً ما يمتد إلى ما هو أبعد من قوس الأبهر.
- Type II : ينشأ داخل الأبهر الصاعد ويقتصر وجوده على هذا المكان.
- Type III : ينشأ في الأبهر الهابط، ونادرًا ما يمتد ليصل إلى المناطق القريبة منه ولكنه يمتد ليصل إلى الأماكن البعيدة عنه.
تصنيف Stanford
[عدل]ينقسم هذا التصنيف إلى مجموعتين؛ وهما A وB، ويتوقف ذلك على ما إذا كانت الإصابة ممتدة إلى الأبهر الصاعد من عدمه.[4]
- المجموعة A : ترتبط بإصابة الأبهر الصاعد، ولكنها لا تقتصر عليه فقط بالضرورة. ويمكن أن ينشأ التمزق في الأبهر الصاعد أو في قوس الأبهر أو - في بعض الحالات الأكثر ندرة - في الأبهر الهابط.[5] وتشتمل هذه المجموعة على النوعين DeBakey type I وDeBakey type II وكذلك على التسلخ الرجوعي type III[6] (وهو تسلخ ينشأ في الأبهر الهابط أو قوس الأبهر ولكنه يمتد إلى الأبهر الصاعد).
- المجموعة B : تتعلق بقوس الأبهر و/أو الأبهر الهابط، ولا تتعلق بإصابة الأبهر الصاعد.[5] وتشتمل هذه المجموعة على حالات الإصابة DeBakey type III التي لا تمتد فيها الإصابة بشكل رجوعي لتصل إلى الأبهر الصاعد.
ويرتبط تصنيف Stanford ارتباطًا وثيقًا بالممارسة الإكلينيكية حيث يتطلب علاج تسلخ الأبهر من النوع A - بصفة عامة - التدخل الجراحي كإجراء علاجي أولي بينما يتم علاج تسلخ الأبهر من النوع B - بصفة عامة - باستخدام العقاقير كإجراء علاجي مبدئي بينما يتم إرجاء التدخل الجراحي في حالة حدوث مضاعفات.[7]
العلامات والأعراض
[عدل]تعاني نسبة %96 من المصابين بتسلخ الأبهر من ألم حاد يصيبهم بشكل مفاجئ. ويمكن وصف الألم الذي يعاني منه مريض تسلخ الأبهر بأنه يشبه التمزق في طبيعته أو بأنه ألم تغلب عليه سمة الحدة أو الشعور بوخز طعنة.[8] وتشعر نسبة %17 من المصابين بانتقال الألم في داخل أجسادهم بينما يمتد التسلخ لأسفل داخل تجويف الشريان الأبهر. ويرتبط مكان الألم بالموضع الذي يحدث فيه التسلخ. ويرتبط الإحساس بألم الصدر الأمامي بالتسلخ الذي يصيب الأبهر الصاعد. أما الألم الذي يشعر به المريض بين الكتفين (ناحية الظهر) فيقترن بالتسلخ الذي يصيب الأبهر الهابط. فإذا كان المصاب يعاني من ألم في التجويف البلوري المحيط بالرئتين، فقد يكون ناتجًا عن التهاب التامور الحاد الناتج عن النزيف الحادث داخل كيس التامور. وتنطوي مثل هذه الحالة على احتمالية كبيرة لتعرض المريض للخطر لأن هذا الألم قد يكون نذيرًا بأن المريض يوشك على الإصابة بحالة اندحاس التامور.
وبينما يمكن أن يحدث خلط بين الألم الناتج عن الحالة السابقة وبين الألم الناتج عن احتشاء عضلة القلب (النوبة القلبية)، يمكن تمييز تسلخ الأبهر بكونه غير مرتبط - عادةً - بالأعراض الأخرى للإصابة باحتشاء عضلة القلب؛ والتي تتضمن قصور القلب والتغيرات التي يمكن رصدها لنشاط عضلة القلب باستخدام مخطط القلب الكهربائي (Electrocardiography؛ الذي تتم الإشارة إليه اختصارًا بالحروف ECG). أيضًا، عادةً لا يعاني المصابون بتسلخ الأبهر من حالة الإفراط في إفراز العرق (التعرق الغزير).
أما المصابون بتسلخ الأبهر ممن لا تظهر عليهم أعراض الألم فهم يعانون من التسلخ المزمن.
وتشمل الأعراض الأقل شيوعًا والتي يمكن أن تصاحب الإصابة بتسلخ الأبهر ما يلي: قصور القلب الاحتقاني (ويحدث في نسبة %7 من حالات الإصابة) والتعرض لحالة الإغماء (ويحدث في نسبة %9 من حالات الإصابة) والسكتة الدماغية (تحدث في نسبة تتراوح ما بين %3 و%6 من حالات الإصابة) واعتلال الأعصاب المحيطية الإقفاري والشلل السفلي والسكتة القلبية والتعرض للموت المفاجئ. أما إذا أصيب المريض بالنوبات الإغمائية، يكون النزيف الذي يصيب التامور هو سبب حدوث ذلك في ما يقرب من نصف عدد حالات الإغماء؛ وهو ما يؤدي بالتالي إلى الإصابة باندحاس التامور.
أما المضاعفات العصبية الناتجة عن تسلخ الأبهر (أي الإصابة بحادث وعائي دماغي (الذي يُشار إليه اختصارًا بالحروف CVA) وكذلك الشلل) فتنتج عن إصابة واحد أو أكثر من الشرايين المغذية لأجزاء من الجهاز العصبي المركزي.
فإذا كان تسلخ الأبهر مرتبطًا بإصابة الأبهر البطني، فيحتمل أن يمتد خطر الإصابة إلى فروع الأبهر البطني. وفي حالات تسلخ الأبهر البطني، يمكن أن يمتد الخطر إلى أحد الشرايين الكلوية أو كليهما (وهو ما يحدث في نسبة تتراوح ما بين %5 و%8 من حالات الإصابة). كذلك، تصاب نسبة تتراوح ما بين %3 و%5 بحالة نقص تروية الأمعاء بالدم (إقفار الأمعاء الغليظة).
التغيرات التي تطرأ على ضغط الدم
[عدل]بينما يشير التاريخ المرضي للعديد من المصابين بتسلخ الأبهر إلى إصابتهم بمرض فرط ضغط الدم، يتغير قياس ضغط الدم بشكل متفاوت في حالة مرضى تسلخ الأبهر الحاد، ويميل ضغط الدم إلى الارتفاع بشكل أكبر في حالة الإصابة بتسلخ الأبهر القاصي. أما في حالات الإصابة بتسلخ الأبهر الداني، تظهر أعراض الإصابة بمرض فرط ضغط الدم في نسبة %36 من المصابين بينما تظهر أعراض الإصابة بحالة انخفاض ضغط الدم في نسبة %25 من الحالات. أما في حالات تسلخ الأبهر القاصي، تصاب نسبة %70 من المرضى بفرط ضغط الدم بينما تصاب %4 من الحالات بانخفاض ضغط الدم.
أما انخفاض ضغط الدم الشديد الذي يصيب المريض عند ظهور أعراض المرض فهو مؤشر مهم للغاية لتشخيص الإصابة بتسلخ الأبهر. وغالبًا ما يرتبط انخفاض ضغط الدم الشديد بالإصابة بحالات: اندحاس التامور أو القصور الأبهري الشديد أو التمزق الأبهري. ومن المهم في هذه الحالة أن يتم قياس ضغط الدم بشكل دقيق. أما انخفاض ضغط الدم الكاذب (الحالة المعروفة باسم Pseudohypotension أو Osler's sign؛ التي تكون فيها قراءة ضغط الدم المنخفضة كاذبة الدلالة) فقد تحدث نتيجة لإصابة الشريان العضدي الرأسي (وهو الشريان المغذي للذراع الأيمن) أو الشريان تحت الترقوي الأيسر (المغذي للذراع الأيسر).
القصور الأبهري
[عدل]يحدث القصور الأبهري (الذي تتم الإشارة إليه اختصارًا بالحرفين AI) في نصف أو ثلثي حالات الإصابة بتسلخ الأبهر الصاعد. أما اللغط (النفخة الأبهرية) الناتج عن القصور الأبهري فيكون مسموعًا في نسبة تقترب من %32 من حالات الإصابة بتسلخ الأبهر الداني. وتتوقف شدة اللغط (علو صوته) على ضغط الدم، وقد تكون غير مسموعة الصوت في حالة الإصابة بانخفاض ضغط الدم.
تتعدد المسببات المرضية للقصور الأبهري في سياق حالات تسلخ الأبهر الصاعد. فقد يتسبب التسلخ في تمدد فوهة الصمام الأبهري مما يجعل شرفات الصمام عاجزة عن الالتئام. وثمة آلية أخرى يمكن أن تتسبب في الإصابة بالقصور الأبهري ألا وهي أن التسلخ قد يمتد إلى جذر الأبهر مباعدًا بين شرفات الصمام الأبهري. وتتمثل الآلية الثالثة في حالة حدوث تمزق بطاني ممتد، حيث تتدلى السديلة البطانية داخل مسار تدفق الدم داخل البطين الأيسر (LV) وتتسبب في انغماد بطاني داخل الصمام الأبهري مما يعوق الانقباض السليم للصمام الأبهري.
احتشاء عضلة القلب
[عدل]يحدث احتشاء عضلة القلب (النوبة القلبية) في نسبة تتراوح ما بين %1 و%2 من حالات الإصابة بتسلخ الأبهر. ويتعلق المسبب المرضي للاحتشاء بالدور الذي تلعبه الشرايين التاجية (الشرايين المغذية للقلب) في الإصابة بتسلخ الأبهر. وترتبط هذه الحالة بالشريان التاجي الأيمن أكثر من ارتباطها بالشريان التاجي الأيسر. فإذا تم علاج احتشاء عضلة القلب باستخدام علاج مذيب للتجلط ترتفع معدلات الوفيات إلى ما يزيد عن %70، وينتج معظمها عن النزيف الذي يحدث داخل كيس التامور مسببًا اندحاس التامور.
ولأن تسلخ الأبهر قد يتشابه في ظاهره مع احتشاء عضلة القلب أمام طبيب غرفة الطوارئ، ينبغي على الطبيب أن يتوخى الحذر في تشخيص الحالة بالشكل السليم قبل أن يبدأ في تقديم العلاج المناسب لاحتشاء عضلة القلب لأن النظام العلاجي الخاص باحتشاء عضلة القلب قد يتسبب في وفاة الشخص الذي يعاني من أعراض الإصابة بتسلخ الأبهر.
الارتشاح البلوري
[عدل]يمكن أن ينتج الارتشاح البلوري (تجمع السوائل في المنطقة الواقعة بين الرئة وجدار الصدر أو الحجاب الحاجز) عن الدم الناتج عن التمزق المتنقل عبر الشريان الأبهر أو السائل الناتج عن تفاعل التهابي في المنطقة المحيطة بالشريان الأبهر. فإذا كان الارتشاح البلوري ناتجًا عن تسلخ الأبهر، فعادةً ما يصيب شق الصدر الأيسر أكثر من إصابته لشق الصدر الأيمن.
الأسباب
[عدل]يرتبط تسلخ الأبهر بالإصابة بمرض فرط ضغط الدم (ارتفاع ضغط الدم) وكذلك بالعديد من الاضطرابات التي تصيب النسيج الضام. ونادرًا ما يقترن التهاب الأوعية الدموية (وهو الالتهاب الذي يصيب أحد الشرايين) بتسلخ الأبهر. ويمكن أن ينتج تسلخ الأبهر - أيضًا - عن رضوض الصدر. وتظهر الإصابة بفرط ضغط الدم في التاريخ المرضي الخاص بالمريض في نسبة تتراوح ما بين %72 و%80 من حالات الإصابة بتسلخ الأبهر.
وتنتشر أعلى معدلات الإصابة بتسلخ الأبهر بين الأفراد الذين تتراوح أعمارهم ما بين الخمسين والسبعين عامًا. وتبلغ معدلات إصابة الذكور ضعف معدلات إصابة الإناث (أي أن نسبة إصابة الذكور إلى الإناث هي اثنان إلى واحد). وتحدث نصف حالات تسلخ الأبهر بين الإناث قبل سن الأربعين خلال فترة الحمل (وعادةً ما يكون ذلك في فترة الثلاثة أشهر الثالثة من فترة الحمل الكلية أو في مرحلة مبكرة من فترة ما بعد الولادة).
تصاب نسبة تتراوح ما بين %7 و%14 من مرضى تسلخ الأبهر بمرض الصمام الأبهري ثنائي الشرف (وهو مرض قلبي خِلقي يصيب الصمام الأبهري). ويكون هؤلاء الأشخاص عرضة للإصابة بتسلخ الأبهر الصاعد. ولا ترتبط زيادة احتمالية الإصابة بتسلخ الأبهر لدى المصابين بمرض الصمام الأبهري ثنائي الشرف بدرجة ضيق الصمام.
وقد لوحظ إصابة نسبة تتراوح ما بين %5 و%9 من الأشخاص الذين يعانون من تسلخ الأبهر بمتلازمة مارفان. وفي إطار هذه المجموعة الفرعية من مرضى تسلخ الأبهر، تتزايد معدلات الإصابة بين الشباب من هؤلاء المرضى. ويعد المصابون بمتلازمة مارفان أكثر عرضة لإصابة شريانهم الأبهر بمرض تمدد الأوعية الدموية، كما يكونون أكثر عرضة للإصابة بتسلخ الأبهر الداني.
وتزيد متلازمة تيرنر أيضًا من احتمالية الإصابة بتسلخ الأبهر، وذلك بسبب تمدد جذر الأبهر.[9]
ويمكن تقسيم رضوض الصدر التي تؤدي إلى الإصابة بتسلخ الأبهر إلى مجموعتين وفقًا للمسبب المرضي: المجموعة التي تنتج عن الإصابات غير نافذة في منطقة الصدر (وعادةً ما تنتج عن حوادث السيارات) ومجموعة علاجية المنشأ. وتشتمل الأسباب علاجية المنشأ على الرضوض التي يمكن أن يتعرض لها المريض عند إجراء قسطرة القلب أو استخدام مضخة بالونية داخل الأبهر.
ويمكن أن يحدث تسلخ الأبهر كنتيجة ثانوية متأخرة الحدوث بعد جراحة القلب. وقد تبين أن نسبة %18 من الأشخاص الذين ظهرت عليهم أعراض تسلخ الأبهر الحاد قد سبق لهم إجراء عملية للقلب المفتوح. أما المرضى الذين استبدلوا صمامهم الأبهري بسبب إصابتهم بمرض القصور الأبهري فتزيد لديهم احتمالية الإصابة بتسلخ الأبهر بشكل كبير. ويكون السبب وراء ذلك أن القصور الأبهري يتسبب في زيادة تدفق الدم داخل الأبهر الصاعد. ويمكن أن يتسبب ذلك في تمدد وإضعاف جدران الأبهر الصاعد.
وعادةً لا يتسبب الزهري في الإصابة بتسلخ الأبهر. وفي المرحلة الثالثة للإصابة بالزهري (الزهري المتقادم) - وهي المرحلة التي تظهر فيها المضاعفات القلبية الوعائية - تتم إزالة أوعية العروق للأبهر (الأوعية المغذية لجدار الأبهر) ويتسبب ذلك في تليف الطبقة الوسطي من جدار الشريان الأبهر. وبدءًا من هذه المرحلة، يمكن أن يتعرض مرضى الزهري الثالثي للإصابة بتمددات وعائية بالشريان الأبهر بالصدر مما قد يتسبب في تمزق الشريان. وفي المقابل، لا يجد التسلخ مسارًا داخل شرياني في جدار الأبهر يمكن أن يسلكه.
الفسيولوجيا المرضية
[عدل]
|

| |
An تخطيط صدى القلب displaying the true lumen and false lumen of an aortic dissection. In the image to the left, the intimal flap can be seen separating the two lumens. In the image to the right, color flow during ventricular انقباض القلب suggests that the upper lumen is the true lumen.
| ||
تبدأ أولى مراحل الإصابة بتسلخ الأبهر بالتمزق الذي يصيب الطبقة الداخلية المبطنة للشريان الأبهر. وبسبب الضغط الشديد الذي يتعرض له الشريان الأبهر من الداخل، يدخل الدم إلى الطبقة الوسطى من جدار الشريان عند النقطة التي تعرضت للتمزق. وتتسبب قوة الدماء المتدفقة إلى الطبقة الوسطى في امتداد هذا التمزق. ويمكن أن يمتد التمزق إلى نقطة قريبة (أي إلى مكان قريب من القلب) أو بعيدة (أي بعيدًا عن القلب) أو يمتد في الاتجاهين كليهما. تنتقل الدماء عبر الطبقة الوسطى من جدار الشريان الأبهر لينتج عنها تجويف شرياني كاذب (ممر كاذب) (بينما يكون التجويف الشرياني الحقيقي هو المجرى الطبيعي لتدفق الدم داخل الشريان الأبهر). وينفصل التجويف الشرياني الكاذب عن التجويف الشرياني الحقيقي بواسطة طبقة من نسيج الطبقة المبطنة للشريان. ويطلق على هذا النسيح اسم السديلة البطانية.
وتنشأ الغالبية العظمى من حالات تسلخ الأبهر بسبب تمزق بطاني في الأبهر الصاعد (وهو ما يحدث في نسبة %65 من حالات الإصابة) أو في قوس الأبهر (وهو ما يحدث في نسبة %10 من حالات الإصابة) أو في مكان بعيد عن الرباط الشرياني داخل الأبهر الصدري الهابط (وهو ما يحدث في نسبة %20 من حالات الإصابة).
وبينما يتدفق الدم أسفل التجويف الشرياني الكاذب يمكن أن يتسبب في تمزقات ثانوية للطبقة الداخلية المبطنة للشريان الأبهر. وعبر هذه التمزقات الثانوية، يمكن أن يعاود الدم تدفقه إلى داخل التجويف الشرياني الحقيقي.
وعلى الرغم من غموض سبب التمزق البطاني لجدار الشريان الأبهر في بعض حالات الإصابة، فإن الأمر عادةً ما يكون له علاقة بانحلال الكولاجين والإيلاستين؛ الذين يكونان الطبقة الوسطى لجدار الشريان الأبهر. ويطلق على هذه الحالة اسم النخر المتوسط الكيسي (داء ايردهايم). وعادةً ما تقترن هذه الحالة بالإصابة بحالة متلازمة مارفان. كما يمكن - أيضًا - أن تقترن بالإصابة بحالة متلازمة إهلرز-دانلوس (Ehlers-Danlos syndrome).
ولا يوجد دليل على حدوث تمزق بطاني في نسبة %13 من حالات الإصابة بتسلخ الأبهر. ومن المعتقد أن السبب الذي يكمن وراء الإصابة في هذه الحالات هو حدوث ورم دموي داخل الجدار الشرياني (يتسبب فيه النزيف الذي يصيب الطبقة الوسطى من جدار الشريان). وحيث أنه لا وجود اتصال مباشر بين التجويف الشرياني الحقيقي والتجويف الشرياني الكاذب في مثل هذه الحالات، يصعب تشخيص الإصابة بتسلخ الأبهر باستخدام طريقة تصوير الأبهر الظليل في حالة كون المسبب المرضي للتسلخ هو الورم الدموي الحادث داخل الجدار الشرياني. وينبغي أن يتم علاج تسلخ الأبهر الذي يصاب به المريض كنتيجة ثانوية لوجود ورم دموي داخل الجدار الشرياني بالطريقة نفسها التي يتم استخدامها مع تسلخ الأبهر الناتج عن التمزق البطاني.
التشخيص
[عدل]يصعب أحيانًا التوصل إلى التشخيص السليم لحالة تسلخ الأبهر بسبب تنوع الأعراض والعلامات نتيجة لاختلاف الموضع الذي بدأ فيه التمزق البطاني والمدى الذي وصل إليه التسلخ.
ففي حالة المريض الذي يشعر بألم في الصدر يتشعب حتى يصل إلى ظهره، يجب أن يؤخذ بعين الاعتبار التفريق بين الحالات التالية:
- تسلخ الأبهر
- احتشاء عضلة القلب
- القصور الأبهري الحاد
- التمدد الوعائي للشريان الأبهر غير التسلخي
- التهاب التامور
- الألم الذي يصيب الجهاز العضلي الهيكلي
- الأورام المنصفية
وعلى الرغم من أن التعرف على التاريخ المرضي للحالة بشكل دقيق قد يكون مفيدًا للغاية في تشخيص الإصابة بتسلخ الأبهر، فإنه لا يمكن دائمًا الوصول إلى التشخيص السليم عن طريق التاريخ المرضي والعلامات الجسمية وحدهما. وعادةً ما يتم التشخيص عن طريق إظهار السديلة البطانية باستخدام اختبار الأشعة التشخيصية. وتشمل الاختبارات شائعة الاستخدام لتشخيص الإصابة بتسلخ الأبهر فحص الأشعة المقطعية بالكمبيوتر للصدر مع استخدام مادة تباين يودي وكذلك استخدام تصوير القلب الصدوي عبر المريء. أما الاختبارات الأخرى التي يمكن استخدامها، فتشمل تصوير الأبهر أو التصوير بالرنين المغناطيسي للأوعية الدموية (الذي تتم الإشارة إليه اختصارًا بالحروف MRA) والذي يتم استخدامه لفحص الشريان الأبهر. ولكل من هذه الاختبارات مميزاته وعيوبه المتنوعة كما تختلف كل من درجة خاصيتي الحساسية والنوعية لكل اختبار يتم استخدامه لتشخيص الإصابة بتسلخ الأبهر.
وبوجه عام، تتوقف تقنية التصوير التي يتم استخدامها لفحص المريض على الاحتمالية القائمة للتشخيص قبل الإجراء الفعلي للاختبار وكذلك على الوسائل والأدوات المتاحة للفحص وعلى استقرار الحالة الصحية للمريض وأخيرًا على درجة خاصيتي الحساسية والنوعية التي يتميز بهما الاختبار المستخدم.
فحص الصدر بأشعة اكس
[عدل]
يتميز اختبار الكشف عن اتساع منطقة وسط الصدر (اتساع المنصف) باستخدام أشعة اكس لفحص الصدر بدرجة متوسطة لخاصية الحساسية (تبلغ نسبتها %67)، وذلك عند تشخيص تسلخ الأبهر الصاعد.[10] وعلى الرغم من ذلك، يتميز هذا الإجراء بدرجة منخفضة لخاصية النوعية؛ وذلك لأن العديد من الحالات المرضية الأخرى يمكن أن تتسبب في حدوث اتساع المنصف الذي يظهر عند فحص الصدر بأشعة أكس.
يرجح وجود الدليل المرضي الذي يعبر عنه ظهور الكالسيوم عند فحص الصدر باستخدام أشعة اكس أن الشخص الذي يتم فحصه مصابًا بتسلخ الأبهر. وينتج ذلك عن انفصال التكلس البطاني لجدار الشريان الأبهر عن حافة النسيج الأبهري الرخو بمقدار 10 ملليمترات.
وقد تظهر ارتشاحات بلورية عند فحص الصدر بأشعة اكس. وعادةً ما تظهر تلك الارتشاحات في حالات تسلخ الأبهر الهابط. فإذا ما ظهرت الارتشاحات في صور الأشعة، فإنها عادةً ما تظهر في شق الصدر الأيسر.
أما النتائج الأخرى التي يمكن اكتشافها باستخدام أشعة اكس على الصدر، فهي: انطماس الظل الخاص بقوس الأبهر على صورة الأشعة (aortic knob) اختفاء العقدة الأبهرية وهبوط الشعب الهوائية اليسرى، واختفاء الخطوط المجاورة للرغامي، وانحراف الرغامي.
وتظهر صورة فحص الصدر بأشعة اكس «طبيعية» في نسبة تتراوح ما بين %12 و%20 من المصابين بتسلخ الأبهر.
مخطط القلب الكهربائي
[عدل]لا تظهر علامات مميزة للإصابة بتسلخ الأبهر في مخطط القلب الكهربائي للحالة التي يتم فحصها. وفي ثلث عدد الحالات التي يتم فحصها باستخدام مخطط القلب الكهربائي تظهر دلائل على تضخم البطين الأيسر؛ الأمر الذي يرجع إلى الفترة الطويلة التي عانت فيها الحالة موضع الفحص من فرط ضغط الدم. أما في ثلث آخر من الحالات موضع الفحص، يوضح مخطط القلب الكهربائي أن نتيجة الفحص «طبيعية». أما إذا أظهر مخطط القلب الكهربائي إصابة الحالة موضع الفحص بحالة نقص التروية القلبية في سياق الإصابة بتسلخ الأبهر، فيجب عندئذ وضع احتمالية إصابة الشرايين التاجية في الحسبان.
علامات كيميائية حيوية
[عدل]على الرغم من عدم توفر اختبارات لفحص الدم في الوقت الحالي تساعد على تشخيص تسلخ الأبهر بدقة، فقد أجريت أبحاث على القياسات التسلسلية التي يتم إجراؤها لرصد الأضداد وحيدة النسيلة التي تخص السلاسل الثقيلة لبروتين الميوزين في العضلات الملساء (monoclonal antibodies to smooth muscle myosin heavy chains). وقد جاءت نتيجة هذه الأبحاث جيدة من حيث خاصيتي الحساسية والنوعية في الكشف عن حالات الإصابة بتسلخ الأبهر.[11] بلغت نسبة خاصية الحساسية لهذا النوع من الاختبارات %90 تقريبًا بينما بلغت نسبة خاصية النوعية %97؛ وذلك خلال فترة 12 ساعة في بداية حدوث التسلخ. ويمكن لهذا الفحص أن يميز بدقة بين حالتي احتشاء عضلة القلب وتسلخ الأبهر. هذا الاختبار ليس متوفرًا في الوقت الحالي من ضمن وسائل الفحص الإكلينيكية المستخدمة لتشخيص تسلخ الأبهر.
تخطيط صدى القلب عبر المريء
[عدل]يعتبر تخطيط صدى القلب عبر المريء (الذي يُشار إليه اختصارًا بالحروف TEE) من الاختبارات التي تحقق نتائج جيدة نسبيًا في تشخيص الإصابة بتسلخ الأبهر، حيث تصل نسبة خاصية الحساسية الخاصة بهذا الاختبار إلى %98 أما خاصية النوعية فتبلغ نسبتها %97. وينتمي هذا الاختبار - نسبيًا - إلى الاختبارات غير الجراحية، حيث يجب على الشخص الخاضع للاختبار أن يبتلع مجس تخطيط صدى القلب. يعد هذا الاختبار دقيقًا ولاسيما عند تقييم مدى قصور الأبهري في إطار حالة تسلخ الأبهر الصاعد، وتحديد ما إذا كانت فوهات (جذور) الشرايين التاجية مصابة أم لا. في حين أن العديد من المؤسسات الطبية تقوم بتخدير المريض في حالة إجراء تخطيط صدى القلب عبر المريء لتوفير أقصى قدر من الراحة للمريض، إلا أن الأشخاص الذين يظهرون قدرًا أكبر من التعاون يمكن أن يتم إجراء الاختبار لهم دون استخدام التخدير. تتمثل عيوب تخطيط صدى القلب عبر المريء في عجزه عن توضيح صورة الشريان الأبهر القاصي الصاعد (بداية قوس الأبهر)، والشريان الأبهر البطني الهابط الذي يقع أسفل المعدة. قد يصعب من الناحية الفنية إجراء تخطيط لصدى القلب عبر المريء للمصابين بتضيق المريء أو دوالي المريء.
تصوير الأبهر الظليل
[عدل]يتطلب تصوير الأبهر وضع قسطرة بداخله، وحقن مادة تباين عند تصويره بأشعة اكس. ويعرف هذا الإجراء باسم تصوير الأبهر الظليل.
تصوير الأوعية الدموية بالأشعة المقطعية بالكمبيوتر
[عدل]
|

|
| الأشعة المقطعية بالكمبيوتر (CT) | الصورة الرمزية |
| تسلخ الأبهر لحالة تنتمي للمجموعة A في تصنيف Stanford 1 الأبهر الصاعد، التجويف الشرياني الأصلي - 2 التجويف الشرياني الكاذب - 3 الشريان الرئوي 4 الأبهر الهابط - 5 فقرة صدرية | |
يعد تصوير الأوعية الدموية بالأشعة المقطعية بالكمبيوتر من الاختبارات السريعة غير الجراحية التي من شأنها توفير صورة دقيقة ثلاثية الأبعاد للأبهر. يتم التقاط هذه الصور عن طريق أخذ صور مجزأة رقيقة وسريعة للصدر والبطن، والجمع بينها باستخدام الكمبيوتر لتكوين شرائح مستعرضة. لتصوير الأبهر بالدقة اللازمة للوصول إلى التشخيص السليم، يتم حقن مادة تباين معالجة باليود في أحد الأوردة المحيطية (الطرفية). تُحقن مادة التباين وتُجرى الأشعة باستخدام تقنية تتبع الدفقة (Bolus Tracking method). يعد هذا نوعًا من الأشعة المتزامنة مع الحقن بهدف التقاط صورة مادة التباين حال دخولها إلى الشريان الأبهر. ستقوم الأشعة بعدئذ بتتبع مادة التباين أثناء تدفقها عبر الوعاء الدموي.
تتراوح نسبة خاصية الحساسية لهذه الأشعة ما بين %96 و%100، وتتراوح نسبة خاصية النوعية ما بين %96 و%100. من ضمن عيوب هذه الأشعة ضرورة توفر مادة تباين معالجة باليود إضافةً إلى عدم القدرة على تحديد موقع الجزء المتمزق من البطانة الداخلية للشريان.
أشعة الرنين المغناطيسي (MRI)
[عدل]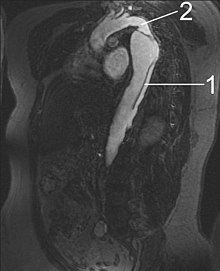
تعد أشعة الرنين المغناطيسي (التصوير بالرنين المغناطيسي) حاليًا هي أفضل اختبار للكشف عن تسلخ الأبهر وتقييم حالته، حيث تبلغ نسبتي خاصيتي الحساسية والنوعية لهذا الاختبار %98. يقدم التصوير بالرنين المغناطيسي صورة تركيبية ثلاثية الأبعاد للشريان الأبهر، مما يسمح للطبيب أن يحدد موقع الجزء المتمزق من البطانة الداخلية للشريان، ومدى إصابة الأوعية الدموية الفرعية، ويحدد ما إذا كانت هناك أية أجزاء ثانوية أخرى تعرضت للتمزق. تعد هذه الأشعة من الاختبارات غير الجراحية، ولا تتطلب استخدام مواد تباين معالجة باليود، إضافة إلى قدرتها على تحديد درجة قصور الأبهري بدقة بالغة.
يتمثل العيب الوحيد لاستخدام أشعة الرنين المغناطيسي في الكشف عن تسلخ الأبهر في عدم توفرها بالقدر الكافي الذي يسمح لكافة الحالات المصابة بتسلخ الأبهر باستخدامها حيث أن جهاز أشعة الرنين المغناطيسي - في كثير من الأحيان - لا يوجد إلا في المستشفيات الكبرى، إضافةً إلى أن إجراء أشعة الرنين المغناطيسي يستغرق وقتًا طويلاً نسبيًا. ونظرًا للكثافة العالية للمجالات المغناطيسية المستخدمة في أثناء التصوير بأشعة الرنين المغناطيسي، فإن التصوير بالرنين المغناطيسي لا يصلح لمن لديهم أجهزة أو أجزاء معدنية مزروعة في أجسادهم نتيجة لإصابات أو إجراء جراحات أو ما شابه. علاوةً على ذلك، يعاني الكثيرون من الخوف من المناطق المغلقة في أثناء وضعهم في داخل أنبوب جهاز أشعة الرنين المغناطيسي.
العلاج
[عدل]ترتفع احتمالية التعرض للوفاة بسبب تسلخ الأبهر إلى أقصى درجاتها في الساعات القليلة الأولى التالية لبداية حدوث التسلخ، ثم تبدأ في التراجع لاحقًا. لهذا، تختلف الاستراتيجيات العلاجية التي يتم استخدامها لعلاج حالات الإصابة بتسلخ الأبهر الحاد مقارنةً بحالات التسلخ المزمن. يشير التسلخ الحاد إلى الحالة التي تظهر فيها الأعراض على المريض خلال الأسبوعين الأولين من بداية حدوث التسلخ. فإذا نجح الفرد في تخطي هذه الفترة الحرجة التي تفصل بين بداية حدوث الإصابة وتشخيصها الفعلي (window period)، ستتجه مراحل تطور المرض نحو الأفضل. وتظهر أعراض تسلخ الأبهر على نسبة %66 تقريبًا من إجمالي الحالات المصابة في المرحلة الحادة؛ والتي تمثل الأيام القليلة الأولى لبداية الإصابة بالمرض (acute phase).
بالنسبة للمصابين بتسلخ الأبهر كلهم، يجب استخدام العقاقير للتحكم في ضغط الدم المرتفع - في حالة وجوده.
في حالة الإصابة بتسلخ الأبهر الحاد، وبمجرد التأكد من التشخيص، فإن اختيار العلاج المناسب يعتمد على موضع التسلخ في الشريان. فبالنسبة لتسلخ الأبهر الصاعد، تكون الأولوية للتدخل الجراحي قبل استخدام العقاقير. من ناحية أخرى، في حالات تسلخ الأبهر القاصي غير الحرجة (بما في ذلك حالات تسلخ الأبهر البطني)، يكون من الأفضل أن يتم استخدام العقاقير بدلاً من اللجوء للتدخل الجراحي.[12]
ويقال أن الأفراد الذين تظهر عليهم الأعراض بعد مرور أسبوعين من بداية التسلخ مصابون بتسلخ الأبهر المزمن. ويكون هؤلاء الأفراد قد نجحوا في تخطي المرحلة الحادة من الإصابة بالمرض، والتي تم فيها ما يشبه الانتقاء الذاتي، ومن ثم يمكن أن يبدأوا في تلقي العلاج الطبي المناسب طالما كانت حالتهم الصحية مستقرة.
ويكون استخدام العقاقير مناسبًا في حالة الأشخاص الذين يعانون من تسلخ الأبهر القاصي غير الحرج، وتسلخ الأبهر مستقر الحالة البعيد عن قوس الأبهر، وكذلك للمصابين بالتسلخ المزمن المستقر. ويكون اختيار المريض نفسه لاستخدام العقاقير في علاجه أمرًا في غاية الأهمية. ويظل الاحتمال قائمًا بالنسبة للأشخاص ذوي الحالة المستقرة والمصابين بتسلخ الأبهر القاصي الحاد (والذين يتم علاجهم عادةً باستخدام العقاقير) لأن يكونوا ضمن نسبة %8 من مثل هذه الحالات التي تلقى حتفها في غضون ثلاثين يومًا.
VIDEO-What is New in the Treatment of Type B Aortic Dissection? الطبيب Girma Tefera يحاضر في جامعة ويسكنسن - مدرسة الطب والصحة العامة.
العلاج باستخدام العقاقير
[عدل]يهتم أسلوب علاج تسلخ الأبهر باستخدام العقاقير في المقام الأول بالتحكم الدقيق في ضغط الدم. ويهدف العلاج إلى الوصول إلى متوسط ضغط دم شرياني (MAP) يتراوح ما بين 60 و70 ملليمتر زئبقي. وثمة هدف آخر لاستخدام هذا العلاج؛ ألا وهو الحد من إجهاد التمزق (shear-force)؛ أي خفض الضغط الانقباضي وقوة تقلّص العضلة القلبية (dp/dt) (وهي قوة ضخ الدم من البطين الأيسر).
وللحد من إجهاد القص (أو إجهاد التمزق)، يجب استخدام مادة موسعة للأوعية الدموية مثل نتروبروسيد الصوديوم مع أحد حاصرات بيتا مثل إسمولول، أو بروبرانولول، أو لابيتالول. وتجعل خصائص عقار لابيتالول التي تعمل على تثبيط مستقبلات ألفا من استخدام هذا العقار بالتحديد للعلاج أمرًا مرغوبًا فيه.
ويمكن استخدام محصرات قنوات الكالسيوم في علاج تسلخ الأبهر، وخاصةً إذا كانت هناك موانع طبية لاستخدام مثبطات مستقبلات بيتا. يعد فيرابميل وديلتيازيم من أكثر محصرات قنوات الكالسيوم شيوعًا، لأنهما يجمعان بين خاصيتي توسيع الشرايين والحد من تقلص عضلة القلب.
وفي حالة الإصابة بارتفاع التوتر الشرياني المعند (وهو ارتفاع ضغط الدم المستمر على الرغم من تناول الحد الأقصى من الجرعات من ثلاث فئات مختلفة من عوامل خفض ضغط الدم المرتفع)، يجب الأخذ بعين الاعتبار تأثر الشرايين الكلوية بتسلخ الأبهر.
التدخل الجراحي
[عدل]تتضمن الحالات التي تقتضي علاج تسلخ الأبهر بالتدخل الجراحي الحاد الإصابة بتسلخ الأبهر الداني الحاد والإصابة بتسلخ الأبهر القاصي الحاد مع ظهور واحد أو أكثر من المضاعفات على المريض. تشمل المضاعفات إعاقة عمل أحد الأجهزة الحيوية، وتمزق الشريان الأبهر الفعلي أو قرب تمزقه، إصابة الأبهر الصاعد بتسلخ رجوعي، وإصابة المريض سابقًا بمتلازمة مارفان أو متلازمة إيهلير دانلوس.
يتمثل هدف التدخل الجراحي في حالة الإصابة بتسلخ الأبهر في بتر (إزالة) الأجزاء الأكثر تضررا من الشريان الأبهر، ومنع دخول الدم إلى التجويف الكاذب (سواءً في الجزء المتمزق الأساسي من البطانة الداخلية للشريان أو أية أجزاء ثانوية أخرى متمزقة بطول الشريان).[13][14][15][16] على الرغم من إمكانية استئصال الجزء المتمزق من البطانة الداخلية للشريان، فإن ذلك قد لا يؤثر بشكل ملحوظ في نسبة الوفيات الناتجة عن الإصابة بتسلخ الأبهر.
تتضمن بعض طرق العلاج ما يلي:
- استبدال الجزء التالف من الشريان برقعة (طعم) مُصنعة (يتم صنعها في كثير من الأحيان من ألياف الداكرون) وذلك في حالة عدم إصابة الصمام الأبهري.
- Bentall procedure - والتي يجري فيها استبدال الجزء التالف من الشريان الأبهر واستبدال الصمام الأبهري كذلك.
- David procedure - والتي يجري فيها استبدال الجزء التالف من الشريان الأبهر وإجراء عملية لإعادة زرع الصمام الأبهري.
- فتح أو تركيب دعامة داخل الوعاء الدموي (قالب مغطى)، كما يحدث في عملية TEVAR وهي اختصار لمصطلح (thoracic endovascular aortic repair). ويتم إجراء تلك العملية عادةً في ظل إشراف طبي مستمر.
- استبدال الجزء التالف من الشريان الأبهر برقعة (طعم) مصنوعة من ألياف الداكرون ومقواة بحلقة؛ وذلك دون عمل غرز جراحية.[17]
وهناك عدد من الحالات المرضية المتزامنة مع الإصابة بتسلخ الأبهر والتي تزيد من خطورة التدخل الجراحي في مثل هذه الحالة. وتتضمن هذه الحالات:
- طول فترة التقييم السابقة لإجراء العملية الجراحية (زيادة المدة الزمنية قبل الجراحة)
- تقدم السن
- الحالات المرضية المتزامنة (مثل: مرض الشريان التاجي)
- تمدد الأوعية الدموية الناتج عن حدوث ترشيح بين حجرات القلب
- تجمع السوائل حول عضلة القلب (الاندحاس القلبي)
- الإصابة بصدمة
- الإصابة السابقة باحتشاء عضلة القلب أو بحادث وعائي دماغي
- الإصابة بحالة الفشل الكلوي (سواءً أكان فشلاً كلويًا مزمنًا أو حادًا)
متابعة الحالة
[عدل]تهدف المتابعة طويلة المدى للأفراد الذين لم يلقوا حتفهم من جراء الإصابة بتسلخ الأبهر إلى محاولة التحكم الدقيق على ضغط الدم. تزيد الاحتمالية النسبية للإصابة بتمزق متأخر ناجم عن تمدد وعائي بالشريان الأبهر بمقدار عشر مرات لدى المصابين بفرط ارتفاع ضغط الدم غير القابل للسيطرة عليه مقارنةً مع من يعانون من ضغط انقباضي يقل عن 130 ملليمتر زئبقي.
وتصل احتمالية حدوث الوفاة إلى أعلى مستوياتها في أول سنتين بعد المرحلة الحادة من الإصابة بتسلخ الأبهر، ويجب أن تستمر متابعة المصابين عن كثب خلال هذه الفترة الزمنية. وتنجم نسبة %29 من حالات الوفاة التي تحدث في وقت لاحق وبعد التدخل الجراحي لعلاج الحالة عن التمزق الذي يتعرض له إما الوعاء الدموي المتمدد الذي أصيب بالتسلخ أو أي وعاء دموي آخر. بالإضافة إلى ذلك، هناك احتمالية تتراح ما بين %17 و%25 لتكوُّن أوعية دموية متمددة جديدة. وينجم هذا عادةً عن توسع التجويف الشرياني الكاذب المتبقي. وتعد هذه الأوعية الدموية المتمددة الجديدة أكثر عرضة للتمزق، وذلك لأن جدرانها رقيقة بدرجة كبيرة.
ويفضل في هذه الحالة التقاط صور متسلسلة للشريان الأبهر، ويفضل استخدام تقنية التصوير بالرنين المغناطيسي، المعروفة اختصارًا بطريقة MRI.
تطور المرض
[عدل]| احتمالية أن يؤدي عدم علاج تسلخ الأبهر إلى وفاة المرضى | |||
|---|---|---|---|
| تحدث نسبة 25% من حالات الوفاة في غضون 24 ساعة من بداية التسلخ | |||
| ونسبة 50% منها في الأسبوع الأول من بداية التسلخ | |||
| ونسبة 75% منها في الشهر الأول | |||
| ونسبة 90% من حالات الوفاة في السنة الأولى | |||
ترتفع النسبة الخاصة باحتمالية تطور الحالة إلى الوفاة في حالة عدم علاج تسلخ الأبهر. وفي حين ترتفع النسبة للغاية في فترة 24 ساعة من بداية الإصابة بالتسلخ، يظل من ينجو من المرحلة الأولى من المرض معرضًا ليكون ضمن معدلات مرتفعة للوفيات في حالة المقارنة مع مجموعات تحكم تماثل المصابين في العمر والنوع. في حالة الإصابة بتسلخ الأبهر الصاعد، تلقى نسبة %75 من الحالات التي لم تتلقَ علاجًا حتفها في غضون الأسبوعين الأولين.[18] وفي حالة تلقي علاجًا مكثفًا، قد ترتفع نسبة البقاء على قيد الحياة لثلاثين يومًا للمصابين بتسلخ الأبهر الصدري إلى %90 تقريبًا.[18]
أشهر ضحايا تسلخ الأبهر
[عدل]- أشهر حالات الوفاة نتيجة الإصابة بتسلخ الأبهر
- الملك جورج الثاني؛ ملك بريطانيا العظمى[18]
- Liese Prokop وزيرة الداخلية النمساوية وصاحبة الميدالية الفضية الأولمبية
- Lucille Ball، الممثلة والمغنية الاستعراضية
- الممثل Ted Bessell
- Flo Hyman لاعب الكرة الطائرة
- Jonathan Larson ملحن أغنية Rent
- الممثل John Ritter
- الممثل Richard Biggs
- الكاتب الفكاهي الأمريكي Mike Wieringo
- Jim Murray الكاتب الرياضي الأمريكي في مجلة Los Angeles Times، وقد استمر يكتب في المجلة في الفترة ما بين عامي 1961 و1998
- Lux Interior (المعروف أيضًا باسم Erick Lee Purkhiser) عضو الفرقة الموسيقية الأمريكية The Cramps
- Smitu Kothari، الناشط والباحث الاجتماعي والبيئي
- John Lennon عضو فرقة البيتلز (والذي أصيب برصاصة استقرت في الشريان الأبهر مما أصابه بتسلخ الأبهر)
- أشهر الناجين من الوفاة الناجمة عن الإصابة بتسلخ الأبهر
- الدكتور Michael E. DeBakey، الذي ابتكر جراحة لتعديل الشريان الأبهر (فضلاً عن غيرها من التقنيات المستخدمة في علاج أمراض القلب الوعائية وأمراض الأوعية الدموية). نال الدكتور DeBakey أيضًا شهرة واسعة لكونه أكبر المرضى سنًا الذين خضعوا لإجراء هذه الجراحة؛ حيث كان يبلغ 97 عامًا عند إجراء الجراحة التي تمت في يومي التاسع والعاشر من شهر فبراير من عام 2006. وقد بقي الدكتور DeBakey على قيد الحياة، وعلى الرغم من أنه كان يتلقى العلاج الطبيعي على أيدي متخصصين ليستطيع أن يمشي بمفرده مرةً أخرى دون تلقي مساعدة بعد معاناته من عدم تكيف (deconditioning)العضلات الناجم عن انعدام النشاط البدني لفترة طويلة خلال فترة الاستشفاء من الجراحة، إلا أنه استعاد كافة قدراته العقلية وعاد إلى قدرته على أداء عمله طوال ساعات يوم العمل الكامل تقريبًا حتى وفاته بسبب أسباب طبيعية في الحادي عشر من يوليو من عام 2008. (انظر [1] المنشورة في 25 من ديسمبر 2006، في مجلة نيويورك تايمز).
- Daniel Dennett الفيلسوف الأمريكي
- Gérard Houllier المدير السابق لناديي Liverpool Football Club وOlympique Lyonnais
- Jose Miguel Arroyo زوج رئيسة الفلبين Gloria Macapagal-Arroyo
معرض صور
[عدل]انظر أيضاً
[عدل]المراجع
[عدل]- ^ Diseases and Conditions في مستشفى Mount Sinai Hospital نسخة محفوظة 8 يناير 2009 على موقع واي باك مشين. "نسخة مؤرشفة". مؤرشف من الأصل في 2020-05-26. اطلع عليه بتاريخ 2020-09-12.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Isselbacher، EM (1997). "Diseases of the aorta". في Braunwald E (المحرر). Heart disease: a textbook of cardiovascular medicine (ط. 5th). Philadelphia: WB Saunders. ص. 1546–81.
{{استشهاد بكتاب}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) والوسيط غير المعروف|isbn-10=تم تجاهله (مساعدة) - ^ DeBakey ME, Henly WS, Cooley DA, Morris GC Jr, Crawford ES, Beall AC Jr (يناير 1965). "Surgical management of dissecting aneurysms of the aorta". J Thorac Cardiovasc Surg. ج. 49: 130–49. PMID:14261867.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Daily PO, Trueblood HW, Stinson EB, Wuerflein RD, Shumway NE (سبتمبر 1970). "Management of acute aortic dissections". Ann Thorac Surg. ج. 10 ع. 3: 237–47. DOI:10.1016/S0003-4975(10)65594-4. PMID:5458238.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ا ب University of Ottawa: Meds 2008> Surgery Objectives نسخة محفوظة 10 مارس 2012 على موقع واي باك مشين.
- ^ Antero-Lateral Thoracotomy with Partial Sternotomy for Retrograde DeBakey III Type Closing Aortic Dissection Accession number;06A0069173 المؤلفون;SUESHIRO MASAFUMI, HAYASHI SAIHO, KOBAYASHI HIRONORI عنوان المجلة؛ Japanese Journal of Cardiovascular Surgery كود المجلة: Y0192A رقم التسلسلي المعياري الدولي:0285-1474 طبعة.35;إصدار.1;صفحة.21-24 (عام 2006) نسخة محفوظة 05 أكتوبر 2018 على موقع واي باك مشين.
- ^ von Segesser LK, Killer I, Ziswiler M؛ وآخرون (أكتوبر 1994). "Dissection of the descending thoracic aorta extending into the ascending aorta. A therapeutic challenge". J. Thorac. Cardiovasc. Surg. ج. 108 ع. 4: 755–61. PMID:7934113. مؤرشف من الأصل في 2012-10-30. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) وExplicit use of et al. in:|مؤلف=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Slater، E.؛ DeSanctis، RW (1976). "The clinical recognition of dissecting aortic aneurysm". The American Journal of Medicine. ج. 60 ع. 5: 625–33. DOI:10.1016/0002-9343(76)90496-4. PMID:1020750.
- ^ Practice Committee of the American Society for Reproductive Medicine (نوفمبر 2006). "Increased maternal cardiovascular mortality associated with pregnancy in women with Turner syndrome". Fertil Steril. ج. 86 ع. 5 Suppl: S127–8. DOI:10.1016/j.fertnstert.2006.08.082. PMID:17055808.
- ^ von Kodolitsch Y, Nienaber C, Dieckmann C, Schwartz A, Hofmann T, Brekenfeld C, Nicolas V, Berger J, Meinertz T (2004). "Chest radiography for the diagnosis of acute aortic syndrome". Am J Med. ج. 116 ع. 2: 73–7. DOI:10.1016/j.amjmed.2003.08.030. PMID:14715319.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Suziku، Toru (سبتمبر 1999). "Biochemical diagnosis of aortic dissection: from bench to bedside". Japanese Heart Journal. ج. 40 ع. 5: 527–534. DOI:10.1536/jhj.40.527. PMID:10888373. مؤرشف من الأصل (PDF) في 2009-01-13. اطلع عليه بتاريخ 2006-07-01.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Suzuki T, Mehta RR, Ince H, Nagai R, Sakomura Y, Weber F, Sumiyoshi T, Bossone E, Trimarchi S, Cooper J, Smith D, Isselbacher E, Eagle K, Nienaber C (2003). "Clinical profiles and outcomes of acute type B aortic dissection in the current era: lessons from the International Registry of Aortic Dissection (IRAD)". Circulation. ج. 108 ع. Suppl 1: II312–7. DOI:10.1161/01.cir.0000087386.07204.09. PMID:12970252.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Foundation Alexis Carrel نسخة محفوظة 12 أبريل 2018 على موقع واي باك مشين.
- ^ Nazari S, Salvi S, Aluffi A, Visconti E, Rescigno G, Buniva P (نوفمبر 1997). "Prosthesis for aortic arch substitution". Ann Thorac Surg. ج. 64 ع. 5: 1339–44. DOI:10.1016/S0003-4975(97)00991-0. PMID:9386701.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Aluffi A, Berti A, Buniva P, Rescigno G, Nazari S (2002). "Improved device for sutureless aortic anastomosis applied in a case of cancer". Tex Heart Inst J. ج. 29 ع. 1: 56–9. PMC:101273. PMID:11995854.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Stefano Nazari: Expandable device type III for easy and reliable approximation of dissection layers in sutureless aortic anastomosis. Ex vivo experimental study. Interact CardioVasc Thorac Surg 2010;10:161-164. doi:10.1510/icvts.2009.216291
- ^ Jeng Wei, Chung-Yi Chang, Yi-Cheng Chuang, Sung-Hou Sue, Kuo-Chen Lee, David Tung (2009): A new vascular ring connector in surgery for aortic dissection. The Journal of Thoracic and Cardiovascular Surgery. 138: 674-7
- ^ ا ب ج Woo KM, Schneider JI (نوفمبر 2009). "High-risk chief complaints I: chest pain--the big three". Emerg. Med. Clin. North Am. ج. 27 ع. 4: 685–712, x. DOI:10.1016/j.emc.2009.07.007. PMID:19932401.
مصادر خارجية
[عدل]- Aorticdissection
- Aortic Dissection
- Classification of aortic dissection
- American Heart Association
- aorticdissection.com
- aorticdissection.co.uk
- CT scans of Aortic Dissection MedPix medical images