أكسجة غشائية خارج الجسم
| أكسجة غشائية خارج الجسم | |
|---|---|
 |
|
| معلومات عامة | |
| من أنواع | تقنية الجسم الخارجية |
| تعديل مصدري - تعديل | |
الأكسجة الغشائية خارج الجسم (بالإنجليزية: extracorporeal membrane oxygenation) أو اختصارا ECMO، والمعروفة أيضا باسم دعم الحياة خارج الجسم، هي تقنية طبية تدور أطوارها خارج جسم المريض، تهدف إلى تقديم الدعم لوظائف القلب و/أو الجهاز التنفسي لفترات طويلة للأشخاص الذين يعانون من حالات صحية خاصة لا يستطيع معها قلبهم ورئتهم توفير كميات كافية من التبادلات الغازية أو التروية الضرورية للحفاظ على الحياة. استخدمت هذه التقنية لأول مرة مع الأطفال، لكنها سرعان ما تزايدت شعبيتها مع البالغين.
اشتقت هذه التكنولوجيا إلى حد كبير من تقنية المجازة القلبية الرئوية، الذي يوفر دعما للجسم على المدى القصير. تعمل تقنية الأكسجة الغشائية خارج الجسم عن طريق استخراج الدم القليل الأكسجين والغني بثاني أكسيد الكربون من جسم المريض عبر قبل قنوات بقطر كبير نسبيا وتمريره من خلال غشاء يعمل على إزالة غاز ثاني أكسيد الكربون قبل أكسجته، وبالتالي التشكيل الاصطناعي للتبادلات الغازية السنخية، قبل إعادة حقنه مرة أخرى في الدورة الدموية لجسم المريض.
يمكن للأكسجة الغشائية خارج الجسم توفير الأوكسجين الكافي للجسم لعدة أيام إلى أسابيع أو شهور، الشئ الذي يوفر الوقت الكافي لشفاء الرئة دون الحاجة إلى تهوية ميكانيكية عنيفة. مع ذلك، ونظرا للمتطلبات التقنية والبشرية التي تتطلبها عملية تنفيذها على المرضى، والتكلفة العالية بالإضافة إلى ارتفاع مخاطر الإصابة بمضاعفات (النزف أساسا)، تعتبر الأكسجة الغشائية خارج الجسم ملاذا علاجيا أخيرا للمرضى في حالة قصور القلب و/أو الجهاز التنفسي، شديد أو مزمن.
تاريخ[عدل]
يرجع الفضل في ظهور هذه التقنية إلى الدكتور جون هيشام جيبون، الذي بدء في وقت مبكر من سنوات الثلاثينيات في فيلادلفيا عمله على تقنيات الدورة الدموية الخارجية (خارج الجسم)، حيث أدت أبحاثه في نهاية المطاف إلى تطوير آلة القلب والرئة التي استخدمت بشكل ناجح في سنة 1953 خلال جراحة القلب المفتوح. لكن التطبيق الفعلي الناجح لهذه التقنية تطلب بعض الوقت، إلى غاية سنة 1971، أين تم استخدامها سريريا على المرضى لمحاكات وظيفة الرئة والقلب. قبل ذلك، لم تتمكن هذه الآلات «المؤكسجة» من أداء وظيفتها المتمثلة في فصل الغازات عن الدم، حيث لم يصمد المرضى إلا ساعات قليلة قبل أن تتطوير عندهم اضطرابات دم قاتلة (انحلال الدم، قلة الصفيحات والإعتلال الخثري).
بحلول سنة 1975، تمكن الدكتور روبرت بارتليت رفقة فريقه من إنقاذ مولود يعاني من التهاب ذات الرئة الشفطي ناتج عن استنشق عقي باستخدام هذه التقنية، فكانت تلك هي البداية الحقيقية لاستخدام هذه التقنية. تميزت فترة السبعينات بتطور كبير في طب الحالات الحرجة: من إنشاء وحدات العناية المركزة واستخدام تقنية غسيل الكلى وصولا إلى الفهم الأفضل لظواهر التهوية الميكانيكية. وبحلول العقد التالي، أظهرت العديد من الدراسات معدلات نجاح كبيرة لتقنية الأكسجة الغشائية خارج الجسم على الأطفال الذين يعانون من متلازمة الضائقة التنفسية الحادة. مع ذلك، عندما تعلق الأمر بالبالغين فإن نفس الدراسات التي تم إجراؤها بشكل عشوائية بقيت غير متفائلة، حيث تم الإبلاغ عن نسبة وفيات في هذه الحالة بلغت 90 في المائة.[1] نتيجة لهذه الدراسات، تم تقريبا التخلي عن استخدام هذه التقنية على البالغين، في الوقت ذاته امتد استخدامها على الأطفال (في سنة 1986، ذكرت بعض الدراسات أن معدل البقاء على قيد الحياة قد بلغ حوالي ال 50 في المائة [2][3]).
شهدت سنوات التسعينات إنشاء منظمة دعم الحياة خارج الجسم المعروفة اختصارا باسم إلسو (ELSO)، بالموازات مع ذلك تطورة موجة جديدة من الدراسات التي تسعى إلى إعادة تعميم تقنية الأكسجة الغشائية خارج الجسم لتشمل من جديد البالغين، بصفة خاصة بمساعدة المعاهد الصحية الوطنية الأمريكية.[4] سمح التقدم التكنولوجي بشكل عام الذي عرفه مجال طب الإنعاش بتطوير هذه التقنية حتى أصبح معدل الوفيات مختلفا بشكل كبير عن ذات المعدل خلال فترة السبعينيات.
تؤكد الدراسات الحديثة أن هذه يمكن استعمالاها في حالات طبية أخرى، حيث أنه وبالإضافة إلى استعمالها «التقليدي» في حالات فشل القلب والرئة، يمكن استخدامها أيضا في تحفيز الإنعاش القلبي الرئوي في حالات السكتة القلبية وعلاج حالات الانصمام الرئوي، انخفاض درجة الحرارة، الغرق، الجرعات الزائدة، عوائق مجرى الهواء واختلالات الكهارل الشديدة.
المبدأ[عدل]
يقوم مبدأ عمل تقنية الأكسجة الغشائية خارج الجسم على وضع القلب أو الرئتين (أو كلاهما معا) في وضعية راحة بشكل كامل أو شبه كامل في أثناء انتظار الشفاء (أو التدخل جراحي لاستبدال الأعضاء). وبالتالي، يتم بشكل عام تهدئة المرضى وإرخاء عضلاتهم للسماح بإراحة أعضائهم، تشمل هذه العملية أيضا تنبيبا رغاميا وحدا أدنى من المساعدة عن طريق التهوية الميكانيكية.

يشبه مسار دائرة الأكسجة الغشائية خارج الجسم ذلك الموجود في تقنية المجازة القلبية الرئوية المستخدمة في عمليات جراحة القلب. تتم هذه العملية أساسا عن طريق إدخال قنية طبية في وعاء دموي (عادة ما يكون وريدا كبيرا) يسمح بتدفق كبير للدم. بحيث يتم امتصاص الدم الوريدي غير المؤكسج الغني بغاز ثاني أكسيد الكربون بواسطة مضخة طرد مركزي مدمجة في الدائرة (تدور عند حوالي 3000 دورة في الدقيقة، لتحريك إجمالي حجم الدم يصل إلى غاية 5 لتر في دقيقة).
بتدفقه إلى خارج الجسم، يدور الدم باستمرار عبر أنابيب بلاستيكية متخصصة، مغلفة من الداخل بمضاد للتجلط (الهيبارين مثلا) لمنع تشكل تخثر في الدائرة. يمر الدم خلال عبوره المضخة من خلال «مؤكسج بغشاء»، يحاكي عملية التبادلات الغازية التي تحدث بشكل طبيعي في الحويصلات الهوائية الرئوية: بحيث يستخرج غاز ثاني أكسيد الكربون من الدم ويقوم بحقن الأكسجين فيه. ثم يتم إعادة الدم المؤكسج مرة أخرى إلى جسم المريض عن طريق قنية وريدية أو شريانية. قبل أن يعاد حقن الدم بالجسم، يمر الدم عبر جهاز تدفئة بغرض معادلة درجة حرارته مع درجة الحرارة الطبيعية للجسم (37 درجة).
استعمال مضاد التخثر هو أمر ضروري جدا للحفاظ على تدفق سليم للدم ومنع حدوث تخثر في وقت مبكر على مستوى الغشاء.
الأنواع[عدل]
هناك العديد من الأنواع المختلفة لتقنية الأكسجة الغشائية خارج الجسم، أكثرها شيوعا هي: الأكسجة الغشائية خارج الجسم من الوريد إلى الشريان (VA ECMO) والأكسجة الغشائية خارج الجسم من الوريد إلى الوريد (VV ECMO).[5] في كلتا الحالتين، تتم أكسجة الدم المستخرج خارج الجسم انطلاقا من النظام الوريدي. في الحالة الأولى (أي من الوريد إلى الشريان) يتم إعادة الدم المؤكسد مجددا عبر النظام الشرياني، بينما في الحالة الأخرى (أي من الوريد إلى الوريد)، تنتهي هذه العملية على مستوى النظام الوريدي.[6] باختصار، توفر الأكسجة الغشائية خارج الجسم من الوريد إلى الشريان دعما قلبيا تنفسيا، في حين توفر الأكسجة الغشائية خارج الجسم من الوريد إلى الوريد دعما تنفسيا فقط.
من الوريد إلى الشريان[عدل]
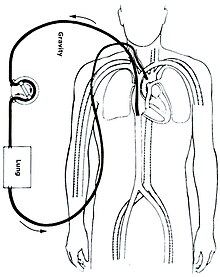
في الأكسجة الغشائية خارج الجسم من الوريد إلى الشريان، يتم وضع قنية ورينية لخروج الدم في واحدة من الأوردة الكبيرة (في الغالب الوريد الفخذيأو الوريد الوداجي الباطن)، في نفس الوقت يتم إدخال قنية شريانية لعودة الدم إلى الجسم في واحدة من الشرايين الكبيرة (غالبا الشريان الفخذي أو الشريان السباتي الباطن). يجب أن يصل طرف القنية الوريدية إلى تقاطع الوريد الأجوف السفلي والأذين الأيمن، في حين يكون طرف القنية الشريانية في الشريان الأبهر الصاعد أو الحرقفي.[7]
يتم أحيانا الإشارة إلى الأكسجة الغشائية خارج الجسم من الوريد إلى الشريان باسم دعم الحياة خارج الجسم (ECLS)، للتمييز بينها وبين الأكسجة الغشائية خارج الجسم من الوريد إلى الوريد التي تسمى اختصارا باسم الأكسجة الغشائية خارج الجسم (ECMO).
في حالة قنية الشريان الفخذي، وبسبب ارتفاع خطر نقص تروية الأطراف المصاحب لوجود قنية قطرها كبير في الشريان الموردة للساق، يتم غالبا إدخال قسطرة لدخه عميقا في نفس الوقت الذي تدخل فيه القنية الشريانية.[8]
من الوريد إلى الوريد[عدل]

يتم في هذه الحالة، إدخال قنية وريدية في الوريد الفخذي ويتم إدخال قنية وريدية أخرى لعودة الدم في الوريد الوداجي الداخلي. في بعض الأحيان تتم الأكسجة الغشائية خارج الجسم بالموازات مع إقحام قسطرة مزدوجة التجويف في الوريد الوداجي الداخلي، تعمل على سحب الدم من الوريد الأجوف العوي والسفلي الأجوف وتعيده إلى الأذين الأيمن.[9]
انظر أيضا[عدل]
مراجع[عدل]
- ^ Warren M. Zapol; et al. (1979). Journal of American Medical Association (ed.). "Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study" (بالإنجليزية). Archived from the original on 2016-06-02. Retrieved 2018-03-06.
{{استشهاد ويب}}: Explicit use of et al. in:|مؤلف=(help) - ^ Luciano Gattinoni; et al. (1986). Journal of American Medical Association (ed.). "Low-Frequency Positive-Pressure Ventilation With Extracorporeal CO2 Removal in Severe Acute Respiratory Failure" (بالإنجليزية). Archived from the original on 2016-06-02. Retrieved 2018-03-07.
{{استشهاد ويب}}: Explicit use of et al. in:|مؤلف=(help) - ^ P. Pearl O'Rourke; et al. (Dec 1989). Pediatrics (ed.). "Extracorporeal Membrane Oxygenation and Conventional Medical Therapy in Neonates With Persistent Pulmonary Hypertension of the Newborn: A Prospective Randomized Study" (بالإنجليزية). Archived from the original on 2019-12-08. Retrieved 2018-03-07.
{{استشهاد ويب}}: Explicit use of et al. in:|مؤلف=(help) - ^ Eunice Kennedy Shriver National Institute of Child Health and Human Development, ed. (1993). "Diffusion of ECMO Technology -- Extracorporeal Membrane Oxygenation (Report of the Workshop)". National Institutes of Health (بالإنجليزية). Archived from the original on 2017-10-05. Retrieved 2018-03-07.
- ^ Guillermo Martinez et Alain Vuylsteke (2012). British Journal of Anaesthetists (ed.). "Extracorporeal Membrane Oxygenation in Adults". MedScape (بالإنجليزية). Archived from the original on 2017-09-11. Retrieved 2018-03-07. نسخة محفوظة 11 سبتمبر 2017 على موقع واي باك مشين.
- ^ Frederik Stöhr; et al. (19 Jan 2011). Interactive CardioVasc Thoracic Surgery (ed.). "Extracorporeal membrane oxygenation for acute respiratory distress syndrome: is the configuration mode an important predictor for the outcome?". Oxford Journals (بالإنجليزية). Archived from the original on 2020-08-22. Retrieved 2018-03-07.
{{استشهاد ويب}}: Explicit use of et al. in:|مؤلف=(help) - ^ Navid Madershahian (Mar 2006). Journal of Cardiac Surgery (ed.). "A Simple Technique of Distal Limb Perfusion During Prolonged Femoro-Femoral Cannulation". Wiley Online Library (بالإنجليزية). Archived from the original on 2018-03-12. Retrieved 2018-03-08.
- ^ Service de chirurgie thoracique et cardio-vasculaire (المحرر). "ECMO". Groupe hospitalier Pitié-Salpétrière. مؤرشف من الأصل في 2018-08-29. اطلع عليه بتاريخ 2018-03-08.
- ^ D. Wang, JB. Zwischenberger; et al. (Dec 2008). American Society for Artificial Internal Organs (ed.). "Wang-Zwische double lumen cannula-toward a percutaneous and ambulatory paracorporeal artificial lung". PubMed (بالإنجليزية). Archived from the original on 2018-07-23. Retrieved 2018-03-08.
{{استشهاد ويب}}: Explicit use of et al. in:|مؤلف=(help)
| في كومنز صور وملفات عن: أكسجة غشائية خارج الجسم |
