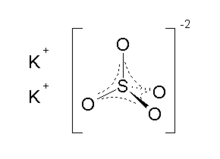
كبريتات البوتاسيوم
المظهر
(بالتحويل من Potassium sulfate)
| كبريتات البوتاسيوم | |
|---|---|
Arcanite
| |
| أسماء أخرى | |
Potassium sulphate |
|
| المعرفات | |
| رقم CAS | 7778-80-5 |
| بوب كيم (PubChem) | 24507 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | K2SO4 |
| الكتلة المولية | 174.259 غ/مول |
| المظهر | صلب أبيض |
| الرائحة | عديم الرائحة |
| الكثافة | 2.66 غ/سم3[1] |
| نقطة الانصهار | 1069 °س، 1342 °ك، 1956 °ف |
| نقطة الغليان | 1689 °س، 1962 °ك، 3072 °ف |
| الذوبانية في الماء | 111 غ/ل (20 °س) 120 غ/ل (25 °س) 240 غ/ل (100 °س) |
| الذوبانية | ينحل جزئياً في الغليسرول غير منحل في الأسيتون والكحول وثنائي كبريتيد الكربون |
| حموضة (pKa) | ~7 |
| معامل الانكسار (nD) | 1.495 |
| البنية | |
| البنية البلورية | نظام بلوري معيني قائم |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
كبريتات البوتاسيوم[2] مركب كيميائي صيغته K2SO4، ويوجد على شكل صلب أبيض اللون. عُرف المركب منذ أوائل القرن 14، وعكف على دراسته جلاوبر وبويل.
التحضير
[عدل]يحضر المركب من تفاعل كلوريد البوتاسيوم مع حمض الكبريتيك المركز والساخن:[3]
الخواص
[عدل]يوجد المركب في الشروط القياسية على شكل صلب أبيض اللون، وهو قابل للانحلال في الماء، لكنه لا ينحل في الكحول.
الاستخدامات
[عدل]يستخدم أساسا كبريتات البوتاسيوم سماداً؛ كما يستخدم الملح الخام في بعض الأحيان في صناعة الزجاج.
معرض صور
[عدل]مراجع
[عدل]- ^ Patnaik، Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN:0-07-049439-8.
- ^ قاموس مصطلحات الفلاحة (بالعربية والفرنسية). الجزائر العاصمة: المجلس الأعلى للغة العربية بالجزائر. 2018. ص. 212. ISBN:978-9931-681-42-7. OCLC:1100055505. QID:Q121071043.
- ^ H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). "Potassium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a22_039.
في كومنز صور وملفات عن Potassium sulfate.