ثيازول
| ثيازول | |
|---|---|
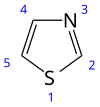 |
 |
 |
 |
| الاسم النظامي (IUPAC) | |
1,3-Thiazole |
|
| المعرفات | |
| رقم CAS | 288-47-1 |
| بوب كيم (PubChem) | 9256 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | C3H3NS |
| كتلة مولية | 85.13 غ.مول−1 |
| نقطة الانصهار | -33.0 درجة حرارة مئوية[2] |
| نقطة الغليان | 116 - 118 °س، 271 °ك، -64 °ف |
| حموضة (pKa) | 2.5 (of conjugate acid) [1] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثيازول هو مركب حلقي غير متجانس يحتوي على كل من الكبريت والنيتروجين.[3][4] الثيازول نفسه هو سائل أصفر شاحب مع البيريدين - مثل الرائحة والصيغة الجزيئية ويشير مصطلح الثيازول أيضاً إلى عائلة واسعة من المشتقات.[5] ويلاحظ أن حلقة الثيازول عنصراً من فيتامين الثيامين «B1».
الخواص
[عدل]هو سائل عديم اللون أصفر أو شاحب مع رائحة كريهة. قليل الذوبان في الماء. استنشاق أو ملامسة المادة قد تهيج أو تحرق الجلد والعينين. عند الحريق قد تنتج غازات مزعجة، أكالة و / أو سامة. قد يسبب دوخة أو الأبخرة قد تسبب الاختناق.[6]
الجزيئ والتركيب الإلكتروني
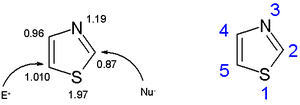
[عدل]Thiazoles أعضاء في آزولات حلقات غير متجانسة تضم imidazoles وoxazoles. ثيازول يمكن أيضا أن يعتبر مجموعة وظيفية. أكسازول والمركبات ذات الصلة، مع الكبريت يحل محلها الأكسجين. Thiazoles تشبه بنيويا الإميدازول ات، مع الثيازول الكبريت يحل محله النيتروجين.
وجود أملاح الثيازولات والثيازوليوم
[عدل]تم العثور على الثيازولات في مجموعة متنوعة من المنتجات المتخصصة، وغالبا ما تنصهر مع مشتقات البنزين، ما تسمى البنزوثيازولات. بالإضافة إلى فيتامينB1
التخليق العضوي
[عدل]توجد طرق معملية متعددة للالتخليق العضوي للثيازولات. تم تحضير العديد من مركبات الثيازول
التفاعلات
[عدل]والقابلية للتفاعل من يمكن تلخيصها على النحو التالي:
اقرأ أيضاً
[عدل]المراجع
[عدل]- ^ Zoltewicz, J. A.; Deady, L. W. (1978). "Quaternization of Heteroaromatic Compounds. Quantitative Aspects". Advances in Heterocyclic Chemistry. Advances in Heterocyclic Chemistry. ج. 22: 71–121. DOI:10.1016/S0065-2725(08)60103-8. ISBN:9780120206223.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Jean-Claude Bradley; Antony John Williams; Andrew S.I.D. Lang (2014). "Jean-Claude Bradley Open Melting Point Dataset". Figshare (بالإنجليزية). DOI:10.6084/M9.FIGSHARE.1031637.V2. QID:Q69644056.
- ^ Thiazole - Wikipedia, the free encyclopedia
- ^ [1,3]Thiazolo[5,4-d][1,3]thiazole | C4H2N2S2 | ChemSpider نسخة محفوظة 29 يناير 2020 على موقع واي باك مشين.
- ^ Eicher, T.; Hauptmann, S. (2003). The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ NCBI - WWW Error Blocked Diagnostic نسخة محفوظة 19 مايو 2017 على موقع واي باك مشين.
| ثيازول في المشاريع الشقيقة: | |
| |