فينول
| فينول | |
|---|---|
 |
 |
 |
 |
| الاسم النظامي (IUPAC) | |
Phenol |
|
| أسماء أخرى | |
هيدروكسي البنزين |
|
| المعرفات | |
| رقم CAS | 108-95-2 |
| بوب كيم (PubChem) | 996 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | C6H6O |
| كتلة مولية | 94.11 غ.مول−1 |
| المظهر | بلورات صلبة شفافة |
| الكثافة | 1.07 g/cm3 |
| نقطة الانصهار | 40.5 °س، 314 °ك، 105 °ف |
| نقطة الغليان | 181.7 °س، 455 °ك، 359 °ف |
| الذوبانية في الماء | 8.3 g/100 mL (20 °C) |
| حموضة (pKa) | 9.95 (in water), 29.1 (in acetonitrile)[2] |
| λmax | 270.75 nm[1] |
| عزم جزيئي ثنائي القطب | 1.7 ديباي |
| المخاطر | |
| رمز الخطر وفق GHS |    [3] [3] |
| بيانات الخطر وفق GHS | H301, H311, H314, H331, H341, H373[3] |
| بيانات وقائية وفق GHS | P261, P280, P301+310, P305+351+338, P310[3] |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
|
| نقطة الوميض | 79 °C |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
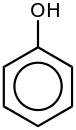
الفينول أو الفنيك أو حامض الكربوليك[4] هو مركب صلب بلوري عديم اللون ذو رائحة قاريّة لطيفة، وغالبًا ما يشار إليها برائحة المشافي. صيغته الكيميائية المجملة C6H6O، والتي يمكن أن تكتب بالشكل المفصل C6H5OH. وبنيته عبارة عن زمرة الهيدروكسيل مرتبطة بحلقة فينيل، فهو مركب عطري.
الفينولات
[عدل]تستخدم كلمة الفينول أيضا للإشارة إلى أي مركب يحتوي على حلقة عطرية ذات ست عناصر، مرتبطة مباشرة إلى زمرة الهيدروكسيل (-OH). في الواقع، تعتبر الفينولات فئة من المركبات العضوية التي تحتوي الفينول كعضو أساسي.
الخواص
[عدل]
الفينول محدود الذوبان في الماء (8.3 غ/100مل). وهو حامضي بعض الشيء. ولجزيء الفينول ميل ضعيف لفقد شاردة H+ من زمرة الهيدروكسيل، معطيًا شادرة الفينوكسيد العالية الذوبان في الماء C6H5O−. بالمقارنة مع الكحول الأليفاتي، يظهر الفينول حموضة أعلى من الكحول بكثير، بل ويتفاعل مع محلول NaOH ليفقد H+، في حين أن الكحول الأليفاتي لا يتفاعل. إحدى التفسيرات لزيادة الحموضة هي استقرار الرنين (resonance stabilization) لأنيون الفينوكسيد في الحلقة العطرية. وبهذه الطريقة، الشحنة السلبية على الأكسجين تتقاسمها ذرات الكربون الأرثو والنظيرة (para).[5] بتفسير آخر، زيادة الحموضة هي نتيجة لتداخل المدارات بين زوج الأكسجين الوحيد والنظام العطري.[6] درجة الحرارة الحرجة الخاصة بمحلول الفينول والماء هي 66.8°م.
محاذير التعامل مع المركب
[عدل]من أشهر خصائص الفينول أنه مادة سامة وآكالة ولذلك لابد من ارتداء اللباس الواقي أثناء الاستخدام والحرص الشديد على عدم اللمس والاستنشاق نظرا لخطورته الشديدة على الجلد والجهاز التنفسي والعيون والتعرض لتركيز عالي منه يسبب حروقا خطيرة. كما تستخدم مادة الفينول في الحد من انتشار نيماتودا تعقد الجذور في زراعات الموز.
اقرأ أيضا
[عدل]المراجع
[عدل]- ^ https://web.archive.org/web/20170702044111/http://omlc.ogi.edu/spectra/PhotochemCAD/html/phenol.html. مؤرشف من الأصل في 2017-07-02.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - ^ Kütt, A.; Movchun, V.; Rodima, T.; Dansauer, T.; Rusanov, E. B.; Leito, I.; Kaljurand, I.; Koppel, J.; Pihl, V.; Koppel, I.; Ovsjannikov, G.; Toom, L.; Mishima, M.; Medebielle, M.; Lork, E.; Röschenthaler, G.-V.; Koppel, I. A.; Kolomeitsev, A. A. Pentakis(trifluoromethyl)phenyl, a Sterically Crowded and Electron-withdrawing Group: Synthesis and Acidity of Pentakis(trifluoromethyl)benzene, -toluene, -phenol, and -aniline. J. Org. Chem. 2008, 73, 2607-2620. دُوِي:10.1021/jo702513w
- ^ ا ب ج قالب:SigmaLink
- ^ محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 114، OCLC:4769982658، QID:Q126042864
- ^ Organic Chemistry 2nd Ed. John McMurry ISBN 0-534-07968-7
- ^ "the acidity of phenol". ChemGuide. Jim Clark. مؤرشف من الأصل في 2018-10-09. اطلع عليه بتاريخ 2007-08-05.
| في كومنز صور وملفات عن: فينول |

