مستخدم:Ayako 88/Molecular symmetry

التماثل الجزيئي في الكيمياء هو وصف التماثل الموجود في الجزيئات وتصنيف الجزيئات وفقًا لتماثلها. التماثل الجزيئي هو مفهوم أساسي في الكيمياء ، حيث يمكن استخدامه للتنبؤ أو شرح العديد من الخواص الكيميائية للجزيء ، مثل الثنائية القطبية والتحولات الطيفية. [1]
ان ما يمكننا من دراسة التماثل الجزيئي هو نظرية المجموعة . التماثل مفيد في دراسة المدارات الجزيئية ، مع تطبيقات مثل طريقة Hückel و نظرية ligand field وفي نطاق أوسع يستخدام التماثل في أنظمة الكريستال لوصف التماثل البلوري في المواد السائبة.
هناك العدد من التقنيات التي يمكن من خلالها معرفة التماثل الجزيئي، منها دراسة البلورات بالأشعة السينية وأشكال مختلفة من التحليل الطيفي . يعتمد الترميز الطيفي على الاعتبارات التماثلية.
مفاهيم التماثل[عدل]
دراسة التماثل في الجزيئات يتطلب استخدام نظرية المجموعة .
| دوراني محور (C ن ) |
العناصر الدورانية غير السليم ( S n ) | ||
|---|---|---|---|
| غير متناظر لا S ن |
الكيرالية مستوى مرآة S 1 = σ |
الكيرالية مركز انعكاس S 2 = أنا | |
| ج 1 | 
|

|

|
| ج 2 | 
|

|

|
عناصر[عدل]
يمكن وصف التماثل لجزيء بـ 5 أنواع من عناصر التماثل .
- محور التماثل : وهو محور يدور حوله الدوران النتائج في جزيء لا يمكن تمييزه عن الأصل. ويسمى هذا أيضًا محور الدوران n أضعاف وتختصر بالرمز( C n ). ومن الأمثلة على ذلك المحور C 2 في الماء والمحور C 3 في الأمونيا . يمكن أن يحتوي الجزيء على أكثر من محور تماثل ؛ يُسمى المحور ذو أعلى n المحور الرئيسي ، ويتم بالتوازي مع المحور z في نظام الإحداثيات الديكارتية .
- مستوى التماثل : مستوى من الانعكاس يتم من خلاله إنشاء نسخة مطابقة من الجزيء الأصلي. يُطلق على هذا أيضًا اسم مستوى المرآة والمختصرة σ (sigma = Greek "s" ، من مرآة "Spiegel" الألمانية). [2] يحتوي الماء على اثنين منها: واحد في مستوى الجزيء نفسه وواحد عمودي عليه. يُسمى المستوى التماثلي الموازي للمحور الرئيسي رأسياً (σ v ) وواحد عمودي عليه أفقي (σ h ). يوجد نوع ثالث من مستوي التناظر في حالة إذا كان مستوى التناظر العمودي (σ v ) ينصف الزاوية الواقعة بين محورين الدوران الاثنين العموديان على المحور الرئيسي ، فيتم تسمية المستوى ثنائي السطح (σ d ). يمكن أيضًا تحديد مستوى التماثل بواسطة اتجاهه على المستوى الديكارتي ، على سبيل المثال ، (xz) أو (yz).
- مركز التماثل أو الانعكاس ، ويدل عليه بالرمز( i ). يحتوي الجزيء على مركز تناظر عندما توجد ذرة متطابقة تمامًا مقابل هذا المركز ، بالنسبة لأي ذرة في الجزيء ، على بعد مسافة متساوية منه. بمعنى آخر ، يكون للجزيء مركز تناظر عندما تتوافق النقاط (س ، ص ، ع) و (−س، −-ص ، −ع) مع كائنات متطابقة. على سبيل المثال ، إذا كانت هناك ذرة أكسجين في نقطة ما (س ، ص ، ع) ، فهناك ذرة أكسجين في النقطة (− ، −ص -ع,). قد تكون أو لا تكون هناك ذرة في مركز الانعكاس نفسه. من الأمثلة على ذلك: tetrafluoride زينون حيث يوجد مركز الانعكاس عند ذرة Xe ، والبنزين (C 6 H 6 ) حيث يوجد مركز الانعكاس في وسط الحلقة.
- محور الدوران - الانعكاس : محور حوله الدوران ، يتبعه انعكاس في مستوى عمودي عليه ، يترك الجزيء دون تغيير. ودعا أيضا ن أضعاف محور دوران غير لائق، فإنه يختصر S ن. توجد أمثلة في رباعي فلوريد السيليكون رباعي السطوح ، بثلاثة محاور S 4 ، والتشكيل المذهل للإيثان مع محور S 6 . يتوافق محور S 1 مع مستوى معكوس σ ومحور S 2 هو مركز انعكاس i . جزيء ليس له محور S n لأي قيمة لـ n هو جزيء chiral .
- الهوية ، والمختصرة إلى E ، من "Einheit" الألمانية تعني الوحدة. [3] يتكون عنصر التناظر هذا ببساطة من أي تغيير: كل جزيء له هذا العنصر. على الرغم من أن هذا العنصر يبدو تافهًا ماديًا ، إلا أنه يجب إدراجه في قائمة عناصر التناظر بحيث تشكل مجموعة رياضية ، يتطلب تعريفها تضمين عنصر الهوية. ويسمى ذلك لأنه مشابه للضرب بواحد (الوحدة). بمعنى آخر ، E هي خاصية يحتاجها أي كائن بغض النظر عن خصائص التناظر الخاصة به. [4]
العمليات[عدل]

ارتبطت عناصر التناظر الخمسة بها خمسة أنواع من عملية التناظر ، والتي تترك الجزيء في حالة يتعذر تمييزها عن حالة البداية. يتم تمييزها في بعض الأحيان عن عناصر التناظر بواسطة علامة إقحام أو محيط . وهكذا ، Ĉ n هو دوران جزيء حول محور و Ê هو عملية الهوية. يمكن أن يحتوي عنصر التماثل على أكثر من عملية تماثل مرتبطة به. على سبيل المثال، محور C 4 من مربع رابع فلوريد الزينون (XeF 4) ويرتبط جزيء مع اثنين من Ĉ 4 دورات (90 درجة) في اتجاهين متعاكسين وتناوب Ĉ 2 (180 درجة). بما أن Ĉ 1 مكافئة لـ Ê و Ŝ 1 إلى σ و Ŝ 2 إلى î ، يمكن تصنيف جميع عمليات التناظر على أنها عمليات تدوير مناسبة أو غير لائقة.
مجموعات التماثل[عدل]
المجموعات (groups)[عدل]
تشكل عمليات التماثل لجزيء (أو كائن آخر) مجموعة . في الرياضيات ، المجموعة عبارة عن مجموعة ذات عملية ثنائية ترضي الخصائص الأربعة المذكورة أدناه.
في مجموعة التناظر ، تكون عناصر المجموعة هي عمليات التناظر (وليس عناصر التناظر) ، والجمع الثنائي يتكون من تطبيق أول عملية تناظر ثم الأخرى. مثال على ذلك ، تسلسل دوران C 4 حول المحور z وانعكاس في المستوى xy ، يُشار إلى σ (xy) C 4 . حسب ترتيب العمليات من اليمين إلى اليسار.
تطبق مجموعة التناظر الخصائص المميزة لأي مجموعة.
ترتيب المجموعة هو عدد العناصر في المجموعة. بالنسبة لمجموعات الطلبات الصغيرة ، يمكن التحقق من خصائص المجموعة بسهولة من خلال النظر في جدول التكوين الخاص بها ، وهو جدول تتوافق الصفوف والأعمدة مع عناصر المجموعة والتي تتوافق إدخالاتها مع منتجاتها.
مجموعات النقطة ومجموعات الانقلاب[عدل]

يكون للتطبيق (أو التركيب ) المتعاقب لواحد أو أكثر من عمليات التناظر لجزيء ما يعادل تأثير بعض عمليات التماثل الفردي للجزيء. على سبيل المثال، ينظر إلى دوران C 2 تليها انعكاس σ ضد أن يكون σ الخامس 'عملية التماثل: σ الخامس * C 2 = σ الخامس'. ("العملية A متبوعة B إلى النموذج C" مكتوبة BA = C). [4] علاوة على ذلك ، فإن مجموعة جميع عمليات التناظر (بما في ذلك عملية التكوين هذه) تطيع جميع خصائص المجموعة ، المذكورة أعلاه. لذا ( S ، * ) هي مجموعة ، حيث S هي مجموعة من جميع عمليات التناظر لبعض الجزيئات ، و * تشير إلى التكوين (التطبيق المتكرر) لعمليات التناظر.
تُسمى هذه المجموعة المجموعة النقطية لهذا الجزيء ، لأن مجموعة عمليات التناظر تترك نقطة واحدة على الأقل ثابتة (على الرغم من أن بعض التماثلات يظل المحور بأكمله أو مستوى الطائرة بالكامل ثابتًا). بمعنى آخر ، المجموعة النقطية هي مجموعة تلخص جميع عمليات التناظر التي تمتلكها جميع الجزيئات في تلك الفئة. [4] تناظر البلورة ، على النقيض من ذلك ، يوصف بواسطة مجموعة فضاء من عمليات التناظر ، والتي تشمل الترجمات في الفضاء.
يمكن للمرء تحديد عمليات التماثل لمجموعة النقاط لجزيء معين من خلال النظر في التماثل الهندسي للنموذج الجزيئي. ومع ذلك ، عندما يستخدم أحدهم مجموعة نقاط ، فلن يتم تفسير العمليات التي تتم بها بنفس الطريقة. بدلاً من ذلك ، يتم تفسير العمليات على أنها تدور و / أو تعكس إحداثيات vibronic (الاهتزاز الإلكتروني) وتنتقل هذه العمليات مع هاميلتون vibronic. إنها "عمليات التناظر" لهذا هاميلتون هاميلتون. يتم استخدام المجموعة نقطة لتصنيف بالتناظرية eigenstates vibronic. يتطلب تصنيف التناظر للمستويات الدورانية ، أي التراكيب الكاملة لعصارة هاميلتون الكاملة (الدوران النووي الروفونيك) ، استخدام مجموعة التقليب الانقلابي المناسبة كما قدمتها Longuet-Higgins [5] . ويفسر العلاقة بين الجماعات نقطة والجماعات التقليب انعكاس في هذا الملف قوات الدفاع الشعبي وصلة .
أمثلة على point groups[عدل]
تعيين كل جزيء تقوم مجموعة نقطية بتصنيف الجزيئات إلى فئات ذات خصائص تناظر متشابهة. على سبيل المثال ، تشترك كل من PCl 3 و POF 3 و XeO 3 و NH 3 في عمليات مطابقة متماثلة. [6] كلهم يمكن الخضوع لعملية هوية E، C مختلفين 3 عمليات التناوب، وثلاثة انعكاسات طائرة σ ضد مختلفة دون تغيير هوياتهم، لذلك يتم وضعها في مجموعة واحدة نقطة، C 3V، مع النظام 6. [7] وبالمثل، الماء (H 2 O) وكبريتيد الهيدروجين (H 2 S) كما يتقاسم عمليات التماثل متطابقة. كلاهما يخضع لعملية هوية E، C واحد 2 التناوب، واثنين من انعكاسات σ الخامس دون تغيير هوياتهم، لذلك هم على حد سواء وضعت في مجموعة نقطة واحدة، C 2V، مع النظام 4. [8] هذا نظام تصنيف يساعد العلماء لدراسة الجزيئات بكفاءة أكبر ، نظرًا لأن الجزيئات المرتبطة كيميائيًا في نفس المجموعة النقطية تميل إلى إظهار مخططات الترابط المتشابهة ، ومخططات الترابط الجزيئي ، والخصائص الطيفية. [4]
اكثر ال point groups شيوعاً[عدل]
يحتوي الجدول التالي على قائمة بمجموعات النقاط المصنفة باستخدام تدوينات Schoenflies ، وهو أمر شائع في الكيمياء والتحليل الجزيئي. يتضمن وصف الهيكل الأشكال الشائعة للجزيئات ، والتي يمكن تفسيرها بواسطة نموذج VSEPR .
| Point group | Symmetry operations | Simple description of typical geometry | Example 1 | Example 2 | Example 3 | |
| C1 | E | no symmetry, chiral |  bromochlorofluoromethane (both enantiomers shown) |
 lysergic acid |
 L-leucine and most other α-amino acids except glycine | |
| Cs | E σh | mirror plane, no other symmetry |  thionyl chloride |
 hypochlorous acid |
 chloroiodomethane | |
| Ci | E i | inversion center |  meso-tartaric acid |
 mucic acid (meso-galactaric acid) |
(S,R) 1,2-dibromo-1,2-dichloroethane (anti conformer) | |
| C∞v | E 2C∞ ∞σv | linear |  hydrogen fluoride (and all other heteronuclear diatomic molecules) |
 nitrous oxide (dinitrogen monoxide) |
 hydrocyanic acid (hydrogen cyanide) | |
| D∞h | E 2C∞ ∞σi i 2S∞ ∞C2 | linear with inversion center |  oxygen (and all other homonuclear diatomic molecules) |
 carbon dioxide |
 acetylene (ethyne) | |
| C2 | E C2 | "open book geometry," chiral |  hydrogen peroxide |
 hydrazine |
 tetrahydrofuran (twist conformation) | |
| C3 | E C3 | propeller, chiral |  triphenylphosphine |
 triethylamine |
 phosphoric acid | |
| C2h | E C2 i σh | planar with inversion center, no vertical plane |  trans-1,2-dichloroethylene |
 trans-dinitrogen difluoride |
 trans-azobenzene | |
| C3h | E C3 C32 σh S3 S35 | propeller |  boric acid |
 phloroglucinol (1,3,5-trihydroxybenzene) |
||
| C2v | E C2 σv(xz) σv'(yz) | angular (H2O) or see-saw (SF4) or T-shape (ClF3) |  water |
 sulfur tetrafluoride |
 chlorine trifluoride | |
| C3v | E 2C3 3σv | trigonal pyramidal |  ammonia |
 phosphorus oxychloride |
 cobalt tetracarbonyl hydride, HCo(CO)4 | |
| C4v | E 2C4 C2 2σv 2σd | square pyramidal |  xenon oxytetrafluoride |
 pentaborane(9), B5H9 |
 nitroprusside anion [Fe(CN)5(NO)]2− | |
| C5v | E 2C5 2C52 5σv | 'milking stool' complex |  Ni(C5H5)(NO) |
 corannulene |
||
| D2 | E C2(x) C2(y) C2(z) | twist, chiral |  biphenyl (skew conformation) |
 twistane (C10H16) |
cyclohexane twist conformation | |
| D3 | E C3(z) 3C2 | triple helix, chiral |  Tris(ethylenediamine)cobalt(III) cation |
 tris(oxalato)iron(III) anion |
||
| D2h | E C2(z) C2(y) C2(x) i σ(xy) σ(xz) σ(yz) | planar with inversion center, vertical plane |  ethylene |
 pyrazine |
 diborane | |
| D3h | E C3 3C2 σh 2S3 3σv | trigonal planar or trigonal bipyramidal |  boron trifluoride |
 phosphorus pentachloride |
 cyclopropane | |
| D4h | E 2C4 C2 2C2' 2C2i 2S4 σh 2σv 2σd | square planar |  xenon tetrafluoride |
 octachlorodimolybdate(II) anion |
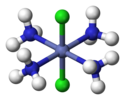 Trans-[CoIII(NH3)4Cl2]+ (excluding H atoms) | |
| D5h | E 2C5 2C52 5C2 σh 2S5 2S53 5σv | pentagonal |  cyclopentadienyl anion |
 ruthenocene |
 C70 | |
| D6h | E 2C6 2C3 C2 3C2' 3C2‘’ i 2S3 2S6 σh 3σd 3σv | hexagonal |  benzene |
 bis(benzene)chromium |
 coronene (C24H12) | |
| D7h | E C7 S7 7C2 σh 7σv | heptagonal |  tropylium (C7H7+) cation |
|||
| D8h | E C8 C4 C2 S8 i 8C2 σh 4σv 4σd | octagonal |  cyclooctatetraenide (C8H82−) anion |
 uranocene |
||
| D2d | E 2S4 C2 2C2' 2σd | 90° twist |  allene |
 tetrasulfur tetranitride |
 diborane(4) (excited state) | |
| D3d | E 2C3 3C2 i 2S6 3σd | 60° twist |  ethane (staggered rotamer) |
 dicobalt octacarbonyl (non-bridged isomer) |
 cyclohexane chair conformation | |
| D4d | E 2S8 2C4 2S83 C2 4C2' 4σd | 45° twist |  sulfur (crown conformation of S8) |
 dimanganese decacarbonyl (staggered rotamer) |
 octafluoroxenate ion (idealised geometry) | |
| D5d | E 2C5 2C52 5C2 i 3S103 2S10 5σd | 36° twist |  ferrocene (staggered rotamer) |
|||
| S4 | E 2S4 C2 |  tetraphenylborate anion |
||||
| Td | E 8C3 3C2 6S4 6σd | tetrahedral |  methane |
 phosphorus pentoxide |
 adamantane | |
| Th | E 4C3 4C32 i 3C2 4S6 4S65 3σh | pyritohedron | ||||
| Oh | E 8C3 6C2 6C4 3C2 i 6S4 8S6 3σh 6σd | octahedral or cubic |  sulfur hexafluoride |
 molybdenum hexacarbonyl |
 cubane |
|
| Ih | E 12C5 12C52 20C3 15C2 i 12S10 12S103 20S6 15σ | icosahedral or dodecahedral |  Buckminsterfullerene |
 dodecaborate anion |
 dodecahedrane |
يمكن تمثيل عمليات التماثل بعدة طرق . تمثيل مناسب هو المصفوفات . بالنسبة لأي متجه يمثل نقطة في إحداثيات الديكارتية ، فإن الضرب الأيسر يعطي الموقع الجديد للنقطة التي حولتها عملية التناظر. تكوين العمليات يتوافق مع الضرب المصفوفة. داخل مجموعة نقطية ، يؤدي تكاثر مصفوفات عمليتي التناظر إلى مصفوفة لعملية تماثل أخرى في نفس المجموعة النقطية. [4] على سبيل المثال ، في المثال C 2v هذا:
على الرغم من وجود عدد لا حصر له من هذه التمثيلات ، إلا أن التمثيلات غير القابلة للاختزال (أو "الشوائب") للمجموعة شائعة الاستخدام ، حيث يمكن وصف جميع العروض الأخرى للمجموعة على أنها مزيج خطي من العروض غير القابلة للاختزال.
Character tables جداول الشخصية[عدل]
لكل مجموعة من النقاط ، يلخص جدول الشخصية character table معلومات عن عمليات التماثل الخاصة به وعن تمثيلاته غير القابلة للاختزال. نظرًا لوجود أعداد متساوية دائمًا من التمثيلات غير القابلة للاختزال وفئات عمليات التناظر ، تكون الجداول مربعة.
يتكون الجدول نفسه من أحرف تمثل كيف يتحول تمثيل معين غير قابل للاختزال عند تطبيق عملية تماثل معينة. أي عملية تماثل في مجموعة نقاط الجزيء تعمل على الجزيء نفسه ستتركه دون تغيير. ولكن ، بالنسبة للعمل على كيان عام ، مثل ناقل أو مداري ، فإن هذا ليس بالضرورة هو الحال. يمكن أن يغير المتجه الإشارة أو الاتجاه ، ويمكن للمدار تغيير النوع. بالنسبة للمجموعات النقطية البسيطة ، تكون القيم إما 1 أو − 1: 1 تعني أن الإشارة أو الطور (من المتجه أو المداري) لا تتغير عن طريق عملية التناظر ( متماثل ) و − 1 يدل على تغيير الإشارة ( غير متماثل ).
يتم تمييز التمثيلات وفقًا لمجموعة من الاتفاقيات:
- A ، عندما يكون الدوران حول المحور الرئيسي متماثل
- B ، عندما يكون الدوران حول المحور الرئيسي غير متماثل
- E و T تمثيلان متضاعفان وثلاثيهما على التوالي
- عندما يكون لدى المجموعة النقطية مركز انعكاس ، يكون g ( (بالألمانية: gerade) أو حتى) لا يشير إلى أي تغيير في العلامة ، أما u ( ungerade أو uneven) في تغيير في الإشارة ، فيما يتعلق بالانعكاس.
- مع مجموعات النقاط C ∞v و D ∞h يتم استعارة الرموز من وصف الزخم الزاوي : Σ و Π و Δ .
تحتوي الجداول أيضًا على معلومات حول كيفية تحوّل الأسس الديكارتية ، والتناوب عنها ، والوظائف التربيعية لها عن طريق عمليات التناظر للمجموعة ، من خلال الإشارة إلى أي تمثيل غير قابل للاختزال يتحول بالطريقة نفسها. هذه المؤشرات هي تقليديا على الجانب الأيمن من الجداول. هذه المعلومات مفيدة لأن المدارات المهمة كيميائياً (وخاصة المدارات p و d ) لها نفس التماثلات التي تتمتع بها هذه الكيانات.
فيما يلي جدول الشخصيات لمجموعة نقاط التماثل C 2v :
| C2v | E | C2 | σv(xz) | σv'(yz) | ||
|---|---|---|---|---|---|---|
| A1 | 1 | 1 | 1 | 1 | z | x2, y2, z2 |
| A2 | 1 | 1 | −1 | −1 | Rz | xy |
| B1 | 1 | −1 | 1 | −1 | x, Ry | xz |
| B2 | 1 | −1 | −1 | 1 | y, Rx | yz |
تأمل مثال الماء (H 2 O) ، الذي يحتوي على تناظر C 2v الموصوف أعلاه. 2 ص س المداري من الأوكسجين B 1 التماثل كما هو الحال في الصف الرابع من الجدول حرف أعلاه، مع x في العمود السادس). يتم توجيهه بشكل عمودي إلى مستوى الجزيء وتبديل العلامة بعلامة C 2 وعملية y v '(yz) ، لكنها تظل دون تغيير مع العمليتين الأخريين (من الواضح أن طابع عملية الهوية دائمًا +1). مجموعة الأحرف المدارية هذه هي {1 ، − 1 ، 1 ، − 1} ، المقابلة للتمثيل غير القابل للاختزال B 1 . وبالمثل ، يُرى أن المدار 2 p z له تناظر التمثيل غير القابل للاختزال A 1 ( أي : لا تغير أي من عمليات التناظر ذلك) ، 2 p y B 2 ، والمدار المداري 3 d xy A 2 . تتم الإشارة إلى هذه المهام وغيرها في أقصى عمودين من الجدول.
خلفية تاريخية[عدل]
استخدم هانز بيتي شخصيات عمليات المجموعة النقطية في دراسته لنظرية حقل ليجند في عام 1929 ، واستخدم يوجين فينر نظرية المجموعة لشرح قواعد الانتقاء في التحليل الطيفي الذري . [9] تم تجميع جداول الأحرف الأولى بواسطة László Tisza (1933) ، فيما يتعلق بالأطياف الاهتزازية. كان روبرت موليكن أول من نشر جداول الشخصيات باللغة الإنجليزية (1933) ، واستخدمها برايت ويلسون في عام 1934 للتنبؤ بتماثل الأوضاع الطبيعية الاهتزازية. [10] تم نشر المجموعة الكاملة المكونة من 32 مجموعة نقاط بلورية في عام 1936 من قبل روزنتال ومورفي. [11]
عدم الجزيئية الجزيئية[عدل]
تعد مجموعات النقاط مفيدة لوصف الجزيئات الصلبة التي تخضع فقط لتذبذبات صغيرة حول هندسة توازن واحدة ، والتي يمكن تجاهل الآثار المشوهة للدوران الجزيئي ، بحيث تتوافق جميع عمليات التناظر مع العمليات الهندسية البسيطة. ومع ذلك ، قدمت Longuet-Higgins نوعًا أكثر عمومية من مجموعة التناظر المناسبة ليس فقط للجزيئات الجامدة ولكن أيضًا للجزيئات غير الجامدة التي تنفق بين الأشكال الهندسية المكافئة (تسمى الإصدارات ) والتي يمكن أن تسمح أيضًا بتأثيرات الدوران الجزيئي المشوهة. [5] [12] تُعرف هذه المجموعات باسم مجموعات الانقلاب التقليبي ، لأن عمليات التناظر فيها هي عمليات تبادلية مجدية حيوية للنواة المتطابقة ، أو الانعكاس فيما يتعلق بمركز الكتلة ، أو مزيج من الاثنين.
على سبيل المثال ، يحتوي الإيثان (C 2 H 6 ) على ثلاثة مطابقات متداخلة مكافئة. يحدث النفق بين المطابقات في درجات الحرارة العادية عن طريق الدوران الداخلي لمجموعة الميثيل بالنسبة إلى المجموعة الأخرى. هذا ليس دوران الجزيء بأكمله حول محور C 3 . على الرغم من أن كل التشكل يحتوي على تناظر ثلاثي الأبعاد ، كما في الجدول أعلاه ، فإن وصف الدوران الداخلي والحالات الكمومية المرتبطة ومستويات الطاقة يتطلب مجموعة الانقلاب التقليب الأكثر اكتمالًا G 36 .
وبالمثل ، تحتوي الأمونيا (NH 3 ) على مطابقة هرمانية مكافئة (C 3v ) والتي يتم تحويلها بينياً من خلال العملية المعروفة باسم انعكاس النيتروجين . ليس هذا انعكاسًا بالمعنى المستخدم في عمليات تماثل المجموعة النقطية للجزيئات الصلبة (أي انعكاس التشريدات الإهتزازية والإحداثيات الإلكترونية في مركز الكتلة) لأن NH 3 لا يوجد به مركز انعكاس. بدلاً من ذلك ، يكون انعكاس كل النوى والإلكترونات في مركز الكتلة (قريبًا من ذرة النيتروجين) ، والذي يحدث ليكون مجديًا بنشاط لهذا الجزيء. مجموعة التقليب الانعكاسية المناسبة التي يجب استخدامها في هذه الحالة هي D 3h (M) وهي متجانسة مع المجموعة النقطية D 3h .
بالإضافة إلى ذلك ، على سبيل المثال ، تحتوي جزيئات الميثان (CH 4 ) و H 3 + على هياكل توازن متناظرة للغاية مع تناسق مجموعة نقاط T d و D 3h على التوالي ؛ إنهم يفتقرون إلى لحظات ثنائية القطب دائمة ولكن لديهم طيف دوران نقي ضعيف للغاية بسبب تشويه الطرد المركزي الدوراني. [13] [14] مجموعات الانقلاب - الانعكاس المطلوبة للدراسة الكاملة لـ CH 4 و H 3 + هي T d (M) و D 3h (M) ، على التوالي.
الطريقة الثانية والأقل عمومية في تماثل الجزيئات غير المتجمدة ترجع إلى التمان. [15] [16] في هذا النهج ، تُعرف مجموعات التناظر باسم مجموعات شرودنجر الفائقة وتتألف من نوعين من العمليات (ومجموعاتها): (1) عمليات التناظر الهندسي (دوران ، انعكاسات ، انعكاسات) للجزيئات الصلبة ، و ( 2) العمليات الديناميكية ، والتي تأخذ جزيء غير جامد إلى شكل مكافئ بقوة من خلال عملية معقولة جسديا مثل الدوران حول رابطة واحدة (كما هو الحال في الإيثان) أو الانقلاب الجزيئي (كما هو الحال في الأمونيا).
أنظر أيضا[عدل]
- Point groups in three dimensions
- Symmetry of diatomic molecules
- Symmetry in quantum mechanics
المراجع[عدل]
- ^ G. L. Miessler and D. A. Tarr Inorganic Chemistry (2nd ed., Pearson/Prentice Hall 1998) (ردمك 0-13-841891-8), chap.4.
- ^ "Symmetry Operations and Character Tables". University of Exeter. 2001. اطلع عليه بتاريخ 2018-05-29.
- ^ LEO Ergebnisse für "einheit"
- ^ أ ب ت ث ج Pfenning، Brian (2015). Principles of Inorganic Chemistry. John Wiley & Sons. ISBN:9781118859025.
- ^ أ ب Longuet-Higgins، H.C. (1963). "The symmetry groups of non-rigid molecules". Molecular Physics. ج. 6 ع. 5: 445–460. Bibcode:1963MolPh...6..445L. DOI:10.1080/00268976300100501.
- ^ Pfennig، Brian. Principles of Inorganic Chemistry. Wiley. ص. 191. ISBN:978-1-118-85910-0.
- ^ pfennig، Brian. Principles of Inorganic Chemistry. Wiley. ISBN:978-1-118-85910-0.
- ^ Miessler، Gary. Inorganic Chemistry. Pearson. ISBN:9780321811059.
- ^ Group Theory and its application to the quantum mechanics of atomic spectra, E. P. Wigner, Academic Press Inc. (1959)
- ^ Correcting Two Long-Standing Errors in Point Group Symmetry Character Tables Randall B. Shirts J. Chem. Educ. 2007, 84, 1882. Abstract
- ^ Rosenthal، Jenny E.؛ Murphy، G. M. (1936). "Group Theory and the Vibrations of Polyatomic Molecules". Rev. Mod. Phys. ج. 8: 317–346. Bibcode:1936RvMP....8..317R. DOI:10.1103/RevModPhys.8.317.
- ^ Philip R. Bunker and Per Jensen (2005), Fundamentals of Molecular Symmetry (Institute of Physics Publishing) (ردمك 0-7503-0941-5)
- ^ Watson، J.K.G (1971). "Forbidden rotational spectra of polyatomic molecules". Journal of Molecular Spectroscopy. ج. 40 ع. 3: 546–544. Bibcode:1971JMoSp..40..536W. DOI:10.1016/0022-2852(71)90255-4.
- ^ Oldani، M. (1985). "Pure rotational spectra of methane and methane-d4 in the vibrational ground state observed by microwave Fourier transform spectroscopy". Journal of Molecular Spectroscopy. ج. 110 ع. 1: 93–105. Bibcode:1985JMoSp.110...93O. DOI:10.1016/0022-2852(85)90215-2.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|displayauthors=تم تجاهله يقترح استخدام|إظهار المؤلفين=(مساعدة) - ^ Altmann S.L. (1977) Induced Representations in Crystals and Molecules, Academic Press
- ^ Flurry, R.L. (1980) Symmetry Groups, Prentice-Hall, (ردمك 0-13-880013-8), pp.115-127
روابط خارجية[عدل]
[[تصنيف:كيمياء نظرية]] [[تصنيف:تناظر]]


