أكسيد النيتروس
| أكسيد النيتروس | |
|---|---|
| المعرفات | |
| رقم CAS | 10024-97-2 |
| بوب كيم (PubChem) | 948 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | N2O |
| الكتلة المولية | 44.0128 g/mol |
| المظهر | colorless gas |
| الكثافة | 1222.8 kg m-3 (liquid) 1.8 kg m-3 (gas STP) |
| نقطة الانصهار | -90.86 °س، 182 °ك، -132 °ف |
| نقطة الغليان | -88.48 °س، 185 °ك، -127 °ف |
| البنية | |
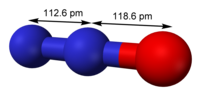
| البنية الجزيئية | linear |
| عزم جزيئي ثنائي القطب | 0.166ديباي |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
+82.05 |
| إنتروبيا مولية قياسية S |
219.9 جول لكل مول كلفن[3] |
| علم الأدوية | |
| طريق التناول | شهيق |
| الاستقلاب | 0.004% |
| Elimination half-life |
5 minutes |
| إخراج | جهاز تنفسي |
| الوضع القانوني | {{{legal_status}}} |
| المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
|
| مركبات متعلقة | |
| مركبات ذات علاقة | أحادي أكسيد النيتروجين، ثنائي أكسيد النيتروجين، ثلاثي أكسيد ثنائي النتروجين، رباعي أكسيد ثنائي النتروجين، خماسي أكسيد ثنائي النتروجين، حمض النتريك، حمض النتروز |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
أكسيد النيتروس (بالإنجليزية: Nitrous oxide) يعرف أيضا بأكسيد النيتروجين الثنائي أو أحادي أكسيد ثنائي النيتروجين وهو مشهور باسم غاز الضحك لأثاره المنشطة عند استنشاقه، وهو مركب كيميائي بالصيغة الكيميائية N2O، في الحالة الطبيعية هو غاز عديم اللون، غير قابل للاشتعال، له رائحة محببة للنفس، شبه حلوة. يستخدم في الجراحة وطب الأسنان لأثاره المسكنة والمخدرة. ويستعمل أكسيد النيتروس كوسيلة لتفعيل فترات قصيرة من الأداء الفائق في محركات الحرق الداخلي في السيارات، وذلك يتم بإدخال أكسجين إضافي إلى الشحنة الداخلة والذي بالتالي يسمح بدخول كمية أكبر من الوقود الذي يتم حرقه وزيادة الكمية الناتجة من الطاقة بشكل مطرد، مؤدياً إلى زيادة القوة التي ينتجها المحرك. أكسيد النيتروس موجود في الهواء ويعد من غازات الدفيئة.
التواجد[عدل]

أكسيد النيتروز تطلقه بكتريا في التربة وفي المحيطات، ولذلك فهو جزء من الغلاف الجوي للأرض لحقب طويلة. الزراعة هي المصدر الرئيسي لأكسيد النيتروز المنتج بشرياً: زرع التربة، واستخدام الأسمدة النيتروجينية، والتعامل مع مخلفات الحيوانات، كلهم يمكنهم أن ينشطوا البكتريا المتواجدة طبيعياً لأن تنتج المزيد من أكسيد النيتروز. قطاع المواشي (بالذات الأبقار، والدجاج والخنازير) ينتج 65% من أكسيد النيتروز المرتبط بالبشر.[4]
تاريخ اكتشافه[عدل]
اُكْتُشِفَ الغاز من قبل جوزيف بريستلي في 1772. اختبر همفري دافي الغاز على نفسه وبعض من أصدقائه في العام 1790.[5] نشر اكتشافه في تجارب الكتاب والملاحظات على «مختلف أنواعها من الهواء» (1775)، حيث أنه وصف لكيفية إنتاج الإعداد من «تقلص الهواء النيتروز»، بتدفئة برادة الحديد مبللة بحمض النتريك حمض النتريك.[6]
هو أحد مواد التخدير الغازية في العمليات الجراحية، عديم اللون ولهُ رائحة مميزة وغريبة وتوصف بشكل غريب أيضا بــ (طعمها حلو !). غاز الضحك مفعوله فوري ويشمل الشعور بالبهجة والتنميل في الجسم والضحك غير المتحكم فيه ولذلك يسمى غاز الضحك. يحس من يتعرض للغاز بشعور بالخفة والطفو وأحيانا ما يشبه الهلاوس ولكن ليس بشكل كامل أو واضح. بعض المستخدمين يشعرون بالقلق بل بنوبات الهلع. كل تأثيرات غاز الضحك مؤقتة وتزول خلال دقائق معدودة بعد التوقف عن استنشاقه.
استعماله الطبي الأساسي كمادة مساعدة في التخدير للعمليات الجراحية واستخدامه وحده لا يكفي لإحداث تخدير بينما مزجه مع الأوكسجين يسكن الألم بشكل كبير. له استخدامات أخرى لأطباء الأسنان والنساء والولادة. كما أن له استخدامات صناعية غير طبية كمادة تضاف لزيادة أداء محرك المركبات.
تكمن خطورة غاز الضحك عند استخدامه غير القانوني في الوفيات التي من الممكن أن يسببها حيث يعمل على إزاحة الأوكسجين من الرئتين. كما أن من أسباب الوفيات الأخرى هو عدم انتظام ضربات القلب المفاجئة عندما يجري استنشاق المادة بتركيز 100% من كيس مليء به مثلا.
هناك خطورة أخرى وهو التعرض المستمر والزمن لهذه المادة في أماكن العمل كالمستشفيات والورش الصناعية حيث يرتبط بحدوث تشوه للأجنة.
يعرف القليل بشأن الاعتمادية على هذه المادة ولكن الخطورة موجودة بسبب سهولة الحصول عليها واستنشاقها.
النيتروس Nitrous Oxide System NOS
استخدامه في السيارات[عدل]
فكره عمله تعتمد على وجود انبوبة بها غاز الاكسيد نيتروجين وعندما تريد ان تزيد من قدرة السيارة تقوم بفتح صمام الخروج الذي يؤدي إلى إنفاق غاز الأكسيد نيتروجين.
إلى غرفة الاحتراق فيعمل الأكسجين على زيادة نسبة الانضغاط وبالتالى زيادة قدرة السيارة.
ويعمل النيتروجين على تبريد غرفة الاحتراق لأن الحرارة تزداد جدا بسبب قوة عملية الاحتراق.
مميزاته[عدل]
- يقدر ثمن غاز النيتروس بـ 165 دولار لعبوة سعتها 60 لتر أي أنه يعد رخيص الثمن.
- يتم تركيبة على جميع أنواع السيارات (ديزل _ بنزين).
- يزيد قدرة المحرك بنسبة 60 %.
- التحكم في عملية زيادة القدرة عند فتح أو غلق صمام الغاز.
- سهولة التركيب.
عيوبه[عدل]
- تعتبر عملية زيادة القدرة محدودة بحجم الأنبوبة المركبة بالسيارة لأن عند انتهائها يتوقف عمل النظام كله.
- نوعا ما غير أمن لاحتمال تسرب الغازات أو انفجار الأنبوبة.
المراجع[عدل]
- ^ أ ب nitrous oxide (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ https://chem.libretexts.org/Bookshelves/General_Chemistry/Book%3A_ChemPRIME_(Moore_et_al.)/16%3A_Entropy_and_Spontaneous_Reactions/16.06%3A_Standard_Molar_Entropies. اطلع عليه بتاريخ 2019-01-25.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة) والوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة) - ^ H. Steinfeld, P. Gerber, T. Wassenaar, V. Castel, M. Rosales, C. de Haan (2006). "Livestock's long shadow -- Environmental issues and options". مؤرشف من الأصل في 2014-08-06. اطلع عليه بتاريخ 2008-02-02.
{{استشهاد ويب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Keys TE (1941). "The_Development_of_Anesthesia". American Scientist. ج. 2: 552–574. Bibcode:1982AmSci..70..522D. مؤرشف من الأصل في 2014-01-12.
{{استشهاد بدورية محكمة}}: الوسيط|عمل=و|صحيفة=تكرر أكثر من مرة (مساعدة) - ^ Priestley J (1776). "Experiments and Observations on Different Kinds of Air (vol.2, sec.3)". مؤرشف من الأصل في 2019-05-17.
| في كومنز صور وملفات عن: أكسيد النيتروس |
- أدوية أساسية حسب منظمة الصحة العالمية
- أدوية تخدير عام
- أكاسيد
- دوافع هوائية
- دورة النيتروجين
- سموم عصبية
- غازات دفيئة
- غازات صناعية
- كيمياء لاعضوية
- مركبات الأكسجين
- مركبات النيتروجين
- مركبات نتروجين لاعضوية
- مسببات الابتهاج
- مسببات التفارق
- مضافات رقم إي
- معدلات تفارغية موجبة لمستقبل غابا أ
- مناهضات مستقبل ن-مثيل-د-أسبارتات
- مناهضات نيكوتينية
- ناهضات مستقبل الغلايسين
- نظافة مهنية