متلازمة غيلان باريه: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
←السائل الشوكي: توسيع |
فاطمة الزهراء (نقاش | مساهمات) ←الألم: توسيع |
||
| سطر 79: | سطر 79: | ||
===الفشل التنفسي=== |
===الفشل التنفسي=== |
||
===الألم=== |
===الألم=== |
||
يُعد الألم أمرًا شائعًا لدى الأشخاص الذين يعانون من متلازمة غيلان باريه، فإن الدراسات التي تقارن بين الأنواع المختلفة من مسكنات الألم غير كافية لتقديم توصية بشأن الأدوية المناسبة للاستخدام <ref>{{cite journal|last1=Liu|first1=J|last2=Wang|first2=LN|last3=McNicol|first3=ED|title=Pharmacological treatment for pain in Guillain–Barré syndrome.|journal=The Cochrane Database of Systematic Reviews|date=20 October 2013|volume=10|issue=10|pages=CD009950|doi=10.1002/14651858.CD009950.pub2|pmid=24142399}}</ref>. |
|||
===إعادة التأهيل=== |
===إعادة التأهيل=== |
||
نسخة 13:30، 28 يونيو 2020
هذه مقالة أو قسم تخضع حاليًّا للتوسيع أو إعادة هيكلة جذريّة. إذا كانت لديك استفسارات أو ملاحظات حول عملية التطوير؛ فضلًا اطرحها في صفحة النقاش قبل إجراء أيّ تعديلٍ عليها. فضلًا أزل القالب لو لم تُجرَ أي تعديلات كبيرة على الصفحة في آخر شهر. لو كنت أنت المحرر الذي أضاف هذا القالب وتُحرر المقالة بشكلٍ نشطٍ حاليًّا، فضلًا تأكد من استبداله بقالب {{تحرر}} في أثناء جلسات التحرير النشطة. آخر من عدل المقالة كان فاطمة الزهراء (نقاش | مساهمات) منذ 3 سنين (تحديث) |
| متلازمة غيلان باريه | |
|---|---|
| Guillain–Barré syndrome | |
| النطق | UK: /ˈɡiːjæ̃ ˈbæreɪ/ US: /ɡiˈjæn bəˈreɪ/ نطق فرنسي: [ɡilɛ̃ baʁe] |
| معلومات عامة | |
| الاختصاص | طب الجهاز العصبي |
| من أنواع | مرض مناعي ذاتي في الجهاز العصبي الطرفي ، واضطراب مناعي، ومرض التهابي عصبي نادر ، واعتلال عصبي متعدد مزيل للميالين التهابي حاد ودون الحاد ، ومرض |
| الموقع التشريحي | جهاز عصبي محيطي[1] |
| الأسباب | |
| الأسباب | مجهول[2] |
| المظهر السريري | |
| البداية المعتادة | سريعًا (ساعات لأسابيع)[2] |
| الأعراض | ضعفٌ في العضلات يبدأ في القدمين واليدين[2] |
| المضاعفات | صعوياتٌ في التنفس، ومشاكلٌ في القلب وضغط الدم[3][2] |
| الإدارة | |
| التشخيص | اعتمادًا على الأعراض، ودراسات توصيل العصب، والبزل القطني[2] |
| العلاج | علاجٌ داعمٌ بمعالجة الأعراض، معالجة وريدية بالغلوبيولين المناعي، استخراج البلازما |
| المآل | يحتاجُ للشفاء أسابيع لسنواتٍ[2] |
| الوبائيات | |
| انتشار المرض | 2 لكل 100,000 شخص سنويًا[2][4] |
| الوفيات | 7.5% من المصابين[3] |
| التاريخ | |
| سُمي باسم | جورج غيلان، وجان ألكسندر باري |
| تعديل مصدري - تعديل | |
متلازمة غيلان باريه (اختصارًا GBS) هي ضعفٌ عضليٌ سريعُ الظهور؛ يحدث نتيجةٍ لضررٍ في الجهاز العصبي المُحيطي يُسببه الجهاز المناعي.[2] تكون الأعراض الأوليةُ عادةً تغيراتٍ في الإحساس أو الألم مع ضعفٍ في العضلات، بدءًا من القدمين واليدين، وغالبًا ما تمتدُ نحو الذراعين والجزء العلوي من الجسم، وتكون الإصابةُ في كلا الجانبين.[2] قد تتفاقم الأعراضُ خلال ساعاتٍ إلى عدة أسابيع.[2] يُشكل المرض في مرحلته الحادة خطرًا على حياة المُصاب، حيثُ يحدثُ ضعفٌ في عضلات التنفس في حوالي 15% من الأشخاص، وبالتالي يحتاجون إلى تهويةٍ ميكانيكية.[3] يحدثُ لدى البعض تغيراتٍ في وظيفة الجهاز العصبي الذاتي، والتي قد تؤدي إلى شذوذاتٍ خطيرةٍ في معدل ضربات القلب وضغط الدم.[2]
يُعتبر سبب حدوث متلازمة غيلان باريه مجهولًا، ولكن على الرغم من هذا، إلا أنَّ الآلية الكامنة للمتلازمةِ تتضمنُ اضطرابًا مناعيًا ذاتيًا، حيثُ عن طريق الخطأ يُهاجم الجهازُ المناعي للجسم الأعصاب الطرفية ويُتلف عزل الميالين.[2] يُحفزُ حدوث هذا الخلل الوظيفي المناعي أحيانًا بسبب عدوًى ما، أو أقل شيوعًا بسبب جراحةٍ مُعينة، أو نادرًا بسبب تلقيحٍ طبي.[3][2] يعتمدُ تشخيص متلازمة غيلان باريه عادةً على الأعراض والعلامات، عبر استبعاد الأسباب الأُخرى لها، ويُدعّم التشخيص باختباراتٍ مثل دراسات توصيل العصب وفحص السائل الدماغي الشوكي.[2] تُوجد عدةُ أنواعٍ فرعيةٍ للمتلازمة، وذلك اعتمادًا على مناطق الضعف، ونتائج دراسات توصيل العصب، ووجود أجسامٍ مُضادةٍ مُعينة.[5] تُصنف متلازمة غيلان باريه على أنها اعتلالُ أعصابٍ مُتعدد حاد.[3]
يُؤدي العلاجُ المُستعجل بالغلوبيولين المناعي وريديًا أو استخراج البلازما، بالإضافة إلى الرعاية الداعمة بمعالجة الأعراض، إلى شفاءٍ جيدٍ في معظم الأشخاص الذين يُعانون من ضعفٍ شديد.[2] قد يستغرق الشفاء عدة أسابيعٍ إلى سنواتٍ، مع حدوث ضعفٍ دائمٍ في حوالي ثلث الحالات.[2] تحدث الوفاة في حوالي 7.5% من المصابين على مستوى العالم.[3] تُعد متلازمة غيلان باريه نادرةً، حيثُ تحدثُ حالةٌ واحدةٌ أو حالتين لكل 100,000 شخصٍ سنويًا.[2][4] يكون حدوث المرض متساويًا في الجنسين، كما أنَّ مُعدل حدوث المرض متشابهٌ في جميع أنحاء العالم.[3][2] سميت المتلازمة نسبةً لأطباء الأعصاب الفرنسيين جورج غيلان وجان ألكسندر باريه، اللذين وصفوا الحالة عام 1916 مع الطبيب الفرنسي أندريه ستروهل.[6][7]
الأعراض والعلامات
تبدأ مُتلازمة غيلان باريه بظهور الأعراض الأولية والتي تتضمنُ تنملًا ونخزًا وألمًا، وقد تكون هذه الأعراض مُفردةً أو معًا. تُتبع بضعفٍ في الساقين والذراعين متساوٍ في كلا الجانبين، ويتفاقم مع مرور الوقت.[8][9] قد يصلُ الضعف إلى أقصى شدةٍ لهُ خلال نصف يومٍ أو أسبوعين على الأكثر، وبعدها يُصبح ثابتًا.[9] يحدث في شخصٍ من بين كل خمسة أشخاصٍ، أن يستمر تفاقم الضعف لمدةٍ تصل إلى أربعة أسابيع.[5] قد تتأثر أيضًا عضلات الرقبة، وتتأثر الأعصاب القحفية التي تُعصب الرأس والوجه في حوالي نصف الأشخاص، مما يؤدي إلى ضعفٍ في عضلات الوجه، وصعوباتٍ في البلع، وأحيانًا ضعف في عضلات العين.[5] يحدثُ في 8% فقط من المُصابين، أن يكون الضعف في الساقين فقط (شلل أو خزل سفلي).[5] يعتبر تأثر العضلات المُتحكمة بالمثانة والشرج أمرًا غير معتادٍ.[9] يكون حوالي ثلث المصابين بمتلازمة غيلان باريه قادرين على المشي بشكلٍ عام.[5] عند تُوقف تفاقم الضعف الحاصل، فإنه يستمر بشكلٍ ثابتٍ قبل حدوث التحسن، وقد تستغرق مرحلة الثبات ما بين يومين إلى ستة أشهرٍ، ولكن عادةً ما تستغرق أسبوعًا واحدًا.[5] تؤثر الأعراض المُرتبطة بالألم على أكثر من نصف المُصابين، وتتضمن ألمًا في الظهر، ونخزًا مؤلمًا، وألمًا في العضلات، وألمًا في الرأس والعنق والذي يرتبط بتهيجٍ في بطانة الدماغ.[5]
يُعاني العديد من المصابين بمتلازمة غيلان باريه من علاماتِ وأعراضِ الإصابة بعدوىً في فترة 3-6 أسابيع قبل ظهور الأعراض العصبية، وقد تتضمن عدوى الجهاز التنفسي العلوي (التهاب الأنف والحلق) أو الإسهال.[9] قد يكون التشخيص صعبًا في الأطفال، خاصةً الذين تقل أعمارهم عن ست سنواتٍ، وغالبًا ما يكون التشخيص خاطئًا في البداية (أحيانًا حتى أسبوعين) نتيجةص للأسباب الأخرى للألم وصعوبة المشي، والتي تشمل العداوى الفيروسية،[5] أو اضطرابات العظام والمفاصل.[10]
تُوجد سماتٌ مميزةٌ لمتلازمة غيلان باريه أثناء الفحص العصبي، وتتضمن انخفاض قوة العضلات، وانخفاض أو اختفاء منعكسات الأوتار (ضعف أو فقدُ المُنعكسات)، ولكن على الرغم من هذا، إلا أنَّ نسبةً قليلةً يكون لديهم منعكساتٌ طبيعيةٌ في الأطراف المُتأثرة قبل حدوث فقد المُنعكسات، كما أنَّ بعضهم قد يكون لديهم فرطٌ في المنعكسات.[5] تظهرُ ثلاثيةٌ من السمات في متلازمة ميلر فيشر (نوعٌ فرعي من متلازمة غيلان باريه)، وهي ضعفٌ في عضلات العين واضطراباتٌ في التنسيق وفقدٌ للمنعكسات.[9] عادةً لا يتأثر مستوى الوعي في متلازمة غيلان باريه، ولكنَّ قد يحدثُ نعاسٌ أو وَسَنٌ أو غيبوبةٌ في النوع الفرعي التهاب جذع الدماغ لبيكرستاف.[6][11]
الفشل التنفسي
يُعاني ربع المُصابين بمتلازمة غيلان باريه من ضعفٍ في عضلات التنفس، مما يؤدي إلى فشلٍ تنفسي، أي عدمُ القدرة على التنفس بشكل كافٍ للحفاظ على مستوياتٍ صحيةٍ من الأكسجين و/أو ثاني أكسيد الكربون في الدم.[5][9][12] تكون هذه الحالة مهددةً لحياة الشخص، وتتعقدُ بسبب مشاكل طبيةٍ أُخرى مثل الالتهاب الرئوي، والالتهابات الشديدة، وتخثرات الدم في الرئتين، والنزيف في الجهاز الهضمي في حوالي 60% من الأفراد الذين يحتاجون إلى تهويةٍ اصطناعية.[9]
خلل الوظائف الذاتية
يتأثرُ الجهاز العصبي الذاتي أو اللاإرادي في ثُلثي المصابين بمتلازمة غيلان باريه بشكلٍ مُتفاوت، ويُعد الجهاز العصبي الذاتي مشاركًا في التحكم في وظائف الجسم مثل معدل ضربات القلب وضغط الدم.[5] قد يُعاني 20% من تقلباتٍ شديدةٍ في ضغط الدم مع عدم انتظام ضربات القلب، وقد تصل أحيانًا إلى توقف ضربات القلب، وبالتالي يحتاج الشخص إلى علاجٍ يعتمد على جهاز تنظيم ضربات القلب.[9] تحدث أيضًا مشاكلٌ أُخرى مُصاحبة، وتشملُ تعرقًا وتغيراتٍ في استجابة الحدقتين. يُمكن أنَّ يتأثر الجهاز العصبي الذاتي في المُصابين الذين ليس لديهم ضعفٌ عضليٌ شديد.[6]
الأسباب
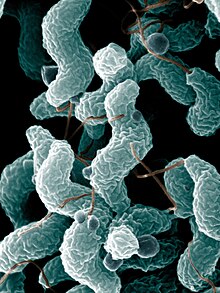
يُعاني ثلثا الأشخاص المُصابين بمتلازمة غيلان باريه من عدوىً قبل ظهور أعراض المتلازمة لديهم، وتُعد نوبات التهاب المعدة والأمعاء أو عدوى الجهاز التنفسي الأكثر شيوعًا. ويُمكن في كثيرٍ من الحالات تأكيد طبيعة العدوى.[5] تحدث حوالي 30% من الحالات بتأثير البكتيريا العَطيفَة الصائمية (الاسم العلمي: Campylobacter jejuni) والتي تُسبب الإسهال. كما تُعزى 10% من الحالات الأخرى إلى الفيروس البشري المُضخم للخلايا [الإنجليزية] (الاسم العلمي: Human cytomegalovirus). ولكن على الرغم من هذا، إلا أنَّ عددًا قليلًا جدًا من الأشخاص المُصابين بعدوى العَطيفَة أو الفيروس المضخم للخلايا يُصابون بمتلازمة غيلان باريه (العَطيفَة: 0.25-0.65 لكل 1000 نوبة، المُضخم للخلايا: 0.6-2.2 لكل 1000 نوبة).[9] قد يُحدد خطر الإصابة بالمتلازمة اعتمادًا على سلالة العَطيفة الحاصلة، حيث تحتوي الأشكال المختلفة من البكتيريا على عديدات سكاريد شحمية مُختلفة على سطحها، وقد يُسبب بعضها المرض أما البعض الآخر لن يُسبب ذلك.[5]
يُعد ارتباط متلازمة غيلان باريه مع العداوى الأُخرى غير مؤكدٍ. يرتبط بالمتلازمة نوعان آخران من فيروسات الهربس (فيروس إبشتاين-بار وفيروس جدري الماء النطاقي)، بالإضافة إلى بكتيريا المفطورة الرئوية.[9] كما ترتبط العدوى الفيروسية المدارية بحمى الضنك وفيروس زيكا مع نوباتٍ من متلازمة غيلان باريه.[13][14] وُجد أنَّ العدوى السابقة بفيروس التهاب الكبد الوبائي إي تكون أكثر شيوعًا لدى الأشخاص الذين يعانون من متلازمة غيلان باريه.[5][7]
قد تحدث بعض حالات متلازمة غيلان باريه بسبب فيروس الإنفلونزا وأحيانًا لقاح الإنفلونزا. حصلت زيادةٌ في معدل الإصابة بمتلازمة غيلان باريه بعد التلقيح ضد الإنفلونزا أثناء تفشي إنفلونزا الخنازير 1976، حيث حصلت المضاعفات في 8.8 حالة لكل مليون (0.0088 لكل 1000) مُتلقٍ للتقليح. منذ ذلك الوقت، أظهرت المتابعة الدقيقة للحالات التي تُعزى إلى التلقيح أنَّ الإنفلونزا نفسها قد تُحفز حدوث متلازمة غيلان باريه. كما لُوحظت زيادةٌ طفيفةٌ في الإصابة في حملات التلقيح اللاحقة، ولكن بنسبةٍ أقل.[15] لم يسبب لقاح وباء الإنفلونزا لعام 2009 (ضد فيروس إنفلونزا الخنازير الوبائي H1N1/PDM09) زيادةً كبيرةً في الحالات.[9] ويُعتقد أنَّ فوائد التلقيح في الوقاية من الإنفلونزا تفوق المخاطر الطفيفة لحدوث متلازمة غيلان باريه بعد التلقيح.[16] ولكن في الواقع، تُعد عدوى الإنفلونزا الطبيعية عامل خطرًا أقوى لحدوث متلازمة غيلان باريه من التلقيح ضد الإنفلونزا، كما أنَّ التلقيح يُقلل عمومًا من خطر الإصابة بالمتلازمة عن طريق تقليل خطر الإصابة بالإنفلونزا.[17] وحتى الأشخاص الذين عانوا سابقًا من متلازمة غيلان باريه يُمكنهم تلقي اللقاح بشكلٍ آمنٍ في المستقبل.[5] وعلى الرغم من هذا، إلا أنه في الولايات المتحدة تُدرج متلازمة غيلان باريه التي تحدث بعد التلقيح ضد الإنفلونزا الموسمية على جدول الحكومة الفيدرالية لإصابات اللقاح[18] وقد يكون التعويض متاحًا عبر البرنامج الوطني للتعويض عن إصابات اللقاح [الإنجليزية].[19] لا يُوجد ارتباطٌ بين اللقاحات الأخرى، مثل لقاح شلل الأطفال أو الكزاز أو الحصبة، مع خطر الإصابة بمتلازمة غيلان باريه.[10]
حصل تفشٍ لمتلازمة غيلان باريه في البيرو عام 2018، كما أُعلنت حالة الطوارئ، وظهر ارتباطهُ بالفيروس المعوي.[20] وُثقت حالاتٌ لارتباط متلازمة غيلان باريه مع مرض فيروس كورونا 2019 (كوفيد-19)،[21][22] وأنه قد يكون من المضاعفات العصبية المُحتملة للعدوى.[23]
آلية الحدوث
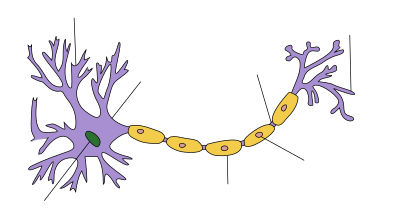
| عصبون |
|---|

يحدث الخلل الوظيفي العصبي في متلازمة غيلان باريه نتيجةً لهجومٍ مناعيٍ على الخلايا العصبية للجهاز العصبي المحيطي وهياكلها الداعمة. تمتلك الخلايا العصبية جسمًا في الحبل الشوكي ومحورًا طويلًا يحملُ النبضات العصبية الكهربائية إلى الموصل العصبي العضلي حيث تُنقل النبضات إلى العضلات. تُحاط المحاور العصبية بغلافٍ من خلايا شوان، والتي تحتوي على الميالين، كما تُوجد فجواتٌ (عقد رانفييه) بين خلايا شوان، حيثُ يكون فيها المحور مكشوفًا.[9] تتميزُ الأنواع المختلفة من متلازمة غيلان باريه بأنواعٍ مختلفةٍ من الهجمات المناعية، حيثُ يتميز النوع المزيل للميالين بحدوث تلفٍ في غمد الميالين بواسطة خلايا الدم البيضاء (الخلايا الليمفاوية التائية والخلايا البلعمية الكبيرة)، وتُسبق هذه العملية بتنشيط مجموعةٍ من بروتينات الدم تُعرف باسم المتممات. أما النوع المحوري فيحدث بواسطة الأجسام المضادة للغلوبيولين المناعي ج والمتممات، حيثُ تهاجم غشاء الخلية الذي يُغطي المحور دون تدخلٍ مباشرٍ من الخلايا الليمفاوية.[9]
وُثقت أجسامٌ مضادةٌ مختلفةٌ موجهةٌ إلى الخلايا العصبية في متلازمة غيلان باريه. ثبت في النوع المحوري أنَّ هذه الأجسام المضادة مرتبطةٌ بالغانغليوزيدات، وهي مجموعةٌ من المواد تتواجد في الأعصاب الطرفية، ويُعد الغانغليوزيد جزيئًا يتكون من سيراميد مرتبطٌ بمجموعةٍ صغيرةٍ من السكريات من نوع هكسوز، كما يحتوي على أعدادٍ مختلفةٍ من مجموعات N-أستيل حمض النيورأمينيك. وُصفت الأجسام المضادة لمضاد أربعةِ غانغليوزيدات رئيسيةٍ وهي GM1 وGD1a وGT1a وGQ1b، وتمتلك بعض الأجسام المضادة لمضاد الغانغليوزيد سماتٍ خاصةٍ، فمثلًا، ترتبط الأجسام المضادة لGQ1b مع متلازمة ميلر فيشر (نوعٌ فرعيٌ من متلازمة غيلان باريه) ومع أشكالٍ مرتبطةٍ تتضمن التهاب جذع الدماغ لبيكرستاف.[9] قد يكونُ إنتاجُ هذه الأجسام المُضادة بعد العدوى ناتجًا عن محاكاةٍ جزيئية، حيث يتفاعل الجهاز المناعي مع المواد الميكروبية، ولكنَّ الأجسام المضادة الناتجة تتفاعل أيضًا مع المواد التي تتكون طبيعيًا في الجسم.[9][24] بعد العدوى ببكتيريا العَطيفة، يُنتج الجسم أجسامًا مضادة من فئة الغلوبيولين المناعي أ (IgA)، وهناك نسبةٌ قليلةٌ من الأشخاص تنتج لديهم أيضًا الأجسام المضادة من فئة الغلوبيولين المناعي ج (IgG) ضد مواد جدار خلية المادة البكتيرية (مثل عديدات السكاريد الشحمي) والتي تتفاعلُ مع غانغليوزيدات الخلايا العصبية البشرية. من غير المعروف حاليًا كيف تُفلت هذه العملية من التحمل المناعي المركزي للغانغليوزيدات، والتي تهدف إلى كبت إنتاج الأجسام المضادة ضد مواد الجسم نفسها.[25] لا تُسبب جميع الأجسام المضادة لمضادات الغانغليوزيد المرض، وقد اقترح مؤخرًا أنَّ بعض الأجسام المضادة ترتبط بأكثر من نوعٍ واحد من الحاتمة في نفس الوقت (ارتباطٌ غير متجانس) وهذا الذي يُحدد الاستجابة. كما أنَّ تطوير الأجسام المضادة المسببة للأمراض قد يعتمدُ على وجود سلالاتٍ أُخرى من البكتيريا في الأمعاء.[25]
التشخيص
يعتمدُ تشخيص متلازمة غيلان باريه على وجود بعض العلامات، والتي تتضمن سرعة حدوث شلل العضلات، وغياب المُنعكسات، وغياب الحُمى، ووجود سببٍ محتملٍ للحالة. يُعد تحليل السائل الدماغي الشوكي (عبر بزلٍ شوكيٍ قطنيٍ ودراسات توصيل العصب) فحوصاتٍ داعمةٍ تُجرى عادةً في متلازمة غيلان باريه.[5][7][9] يُجرى عادةً فحص الأجسام المضادة لمضاد الغانغليوزيد، ولكنَّ دورها محدودٌ في التشخيص.[5] أما فحوصات الدُم فتجرى عمومًا لاستثناء الأسباب الأخرى المُحتملة للضعف، مثل نقص بوتاسيوم الدم.[9] أما نقص صوديوم الدم فيحدثُ غالبًا في متلازمة غيلان باريه؛ ويُعزى ذلك إلى إفرازٍ غير ملائمٍ للهرمون المضاد لإدرار البول، مما يؤدي إلى احتباسٍ نسبيٍ للماء.[26]
يستعمل التصوير بالرنين المغناطيسي للحبل الشوكي في العديد من الحالات، بهدف التمييز بين متلازمة غيلان باريه وغيرها من الحالات التي تثسبب ضعفًا في الأطراف، مثل انضغاط الحبل الشوكي [الإنجليزية].[5][9] إذا أظهر التصوير بالرنين المغناطيسي تعزيزًا في جذور الأعصاب، فإنه يُعد مؤشرًا على متلازمة غيلان باريه.[5] تظهر هذه السمة في 95% من التصوير في الأطفال، لذلك تُعد غير خاصةٍ بمتلازمة غيلان باريه، وبالتالي يجب إجراء تأكيداتٍ أُخرى للتشخيص.[10]
السائل الشوكي
يُحيط السائل الدماغي الشوكي بالدماغ والحبل الشوكي، ويُمكن الحصول على كميةٍ صغيرةٍ منه بالبزل القطني، وذلك بإدخال إبرةٍ بين الفقرات القطنية. تظهر سماتٌ مميزةٌ في متلازمة غيلان باريه، وتتضمن ارتفاعًا في مستوى البروتين، حيثُ يكون عادةً أكبر من 0.55 غم/لتر، ويكون هُناك أقل من 10 خلايا دم بيضاء لكل مليمتر مُكعب من السائل (تفكك ألبوميني خلوي).[27] يُعد هذا النمط مميزًا لمتلازمة غيلان باريه عن غيرها من الحالات الأُخرى (مثل اللمفوما وشلل الأطفال)، حيثُ يكون فيها كلٌ من البروتين وعدد الخلايا مرتفعًا. تكون مستويات بروتين السائل الدماغي الشوكي مرتفعةً في حوالي 50% من المرضى في الأيام الثلاثة الأولى بعد ظهور الضَعف، والتي تزداد إلى 80% بعد الأسبوع الأول.[5]
لا يُنصح بتكرار البزل القطني أثناء فترة المرض، وأيضًا قد ترتفع مستويات البروتين بعد إعطاء العلاج.[5]
الفيزيولوجيا العصبية
الأنواع الفرعية السريرية
العلاج
المعالجة المناعية
الفشل التنفسي
الألم
يُعد الألم أمرًا شائعًا لدى الأشخاص الذين يعانون من متلازمة غيلان باريه، فإن الدراسات التي تقارن بين الأنواع المختلفة من مسكنات الألم غير كافية لتقديم توصية بشأن الأدوية المناسبة للاستخدام [28].
إعادة التأهيل
المآل
الوبائية
التاريخ
الأبحاث
الهوامش
المراجع
باللغة الإنجليزية
- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع "Guillain–Barré Syndrome Fact Sheet". NIAMS. 1 يونيو 2016. مؤرشف من الأصل في 2016-08-05. اطلع عليه بتاريخ 2016-08-13.
- ^ أ ب ت ث ج ح خ Ferri, Fred F. (2016). Ferri's Clinical Advisor 2017: 5 Books in 1 (بالإنجليزية). Elsevier Health Sciences. p. 529. ISBN:9780323448383. Archived from the original on 2016-08-21.
- ^ أ ب Sejvar، James J.؛ Baughman، Andrew L.؛ Wise، Matthew؛ Morgan، Oliver W. (2011). "Population incidence of Guillain–Barré syndrome: a systematic review and meta-analysis". Neuroepidemiology. ج. 36 ع. 2: 123–133. DOI:10.1159/000324710. PMC:5703046. PMID:21422765.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق van den Berg، Bianca؛ Walgaard، Christa؛ Drenthen، Judith؛ Fokke، Christiaan؛ Jacobs، Bart C.؛ van Doorn، Pieter A. (15 يوليو 2014). "Guillain–Barré syndrome: pathogenesis, diagnosis, treatment and prognosis". Nature Reviews Neurology. ج. 10 ع. 8: 469–482. DOI:10.1038/nrneurol.2014.121. PMID:25023340.
- ^ أ ب ت van Doorn، Pieter A؛ Ruts، Liselotte؛ Jacobs، Bart C (أكتوبر 2008). "Clinical features, pathogenesis, and treatment of Guillain–Barré syndrome". The Lancet Neurology. ج. 7 ع. 10: 939–950. DOI:10.1016/S1474-4422(08)70215-1. PMID:18848313.
- ^ أ ب ت Eldar AH، Chapman J (أبريل 2014). "Guillain Barré syndrome and other immune mediated neuropathies: diagnosis and classification". Autoimmunity Reviews. ج. 13 ع. 4–5: 525–30. DOI:10.1016/j.autrev.2014.01.033. PMID:24434363.
- ^ Willison، Hugh J؛ Jacobs، Bart C؛ van Doorn، Pieter A (مارس 2016). "Guillain–Barré syndrome". The Lancet. ج. 388 ع. Online first: 717–27. DOI:10.1016/S0140-6736(16)00339-1. PMID:26948435.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع Yuki، Nobuhiro؛ Hartung، Hans-Peter (14 يونيو 2012). "Guillain–Barré Syndrome". New England Journal of Medicine. ج. 366 ع. 24: 2294–2304. DOI:10.1056/NEJMra1114525. PMID:22694000.
- ^ أ ب ت Ryan، Monique M. (ديسمبر 2013). "Pediatric Guillain–Barré syndrome". Current Opinion in Pediatrics. ج. 25 ع. 6: 689–693. DOI:10.1097/MOP.0b013e328365ad3f. PMID:24240288.
- ^ Shahrizaila، N.؛ Yuki، N. (15 سبتمبر 2012). "Bickerstaff brainstem encephalitis and Fisher syndrome: anti-GQ1b antibody syndrome". Journal of Neurology, Neurosurgery & Psychiatry. ج. 84 ع. 5: 576–583. DOI:10.1136/jnnp-2012-302824. PMID:22984203.
- ^ van Doorn PA، Kuitwaard K، Walgaard C، وآخرون (مايو 2010). "IVIG treatment and prognosis in Guillain–Barré syndrome". Journal of Clinical Immunology. 30 Suppl 1: S74–8. DOI:10.1007/s10875-010-9407-4. PMC:2883091. PMID:20396937.
- ^ Carod-Artal FJ، Wichmann O، Farrar J، Gascón J (سبتمبر 2013). "Neurological complications of dengue virus infection". The Lancet Neurology. ج. 12 ع. 9: 906–19. DOI:10.1016/S1474-4422(13)70150-9. PMID:23948177.
- ^ Kohl، Alain؛ Gatherer، Derek (18 ديسمبر 2015). "Zika virus: a previously slow pandemic spreads rapidly through the Americas" (PDF). Journal of General Virology. ج. 97 ع. 2: 269–73. DOI:10.1099/jgv.0.000381. PMID:26684466.
- ^ Lehmann HC، Hartung HP، Kieseier BC، Hughes RA (سبتمبر 2010). "Guillain–Barré syndrome after exposure to influenza virus". The Lancet Infectious Diseases. ج. 10 ع. 9: 643–51. DOI:10.1016/S1473-3099(10)70140-7. PMID:20797646.
- ^ Rinaldi، Simon (يونيو 2013). "Update on Guillain–Barré syndrome". Journal of the Peripheral Nervous System. ج. 18 ع. 2: 99–112. DOI:10.1111/jns5.12020. PMID:23781958.
- ^ DeStefano، F؛ Bodenstab، HM؛ Offit، PA (فبراير 2019). "Principal Controversies in Vaccine Safety in the United States". Clinical Infectious Diseases. ج. 69 ع. 4: 726–731. DOI:10.1093/cid/ciz135. PMID:30753348.
- ^ "Vaccine Injury Table - HRSA" (PDF). HRSA. 22 مارس 2017. اطلع عليه بتاريخ 2019-10-23.
{{استشهاد ويب}}: صيانة الاستشهاد: url-status (link) - ^ "National Vaccine Injury Compensation Program". www.hrsa.gov (بالإنجليزية). 11 May 2017. Retrieved 2019-10-24.
- ^ Díaz-Soto، S؛ Chavez، Karen؛ Chavez، Alex؛ Alanya، Joseff؛ Tirado-Hurtado، Indira (فبراير 2019). "Outbreak of Guillain-Barre syndrome in Peru". eNeurologicalSci. ج. 14: 89–90. DOI:10.1016/j.ensci.2019.02.001. PMC:6369118. PMID:30788441.
- ^ Toscano G، Palmerini F، Ravaglia S، Ruiz L، Invernizzi P، Cuzzoni MG، Franciotta D، Baldanti F، Daturi R، Postorino P، Cavallini A، Micieli G (2020). "Guillain-Barré Syndrome Associated with SARS-CoV-2". New England Journal of Medicine. DOI:10.1056/NEJMc2009191. PMC:7182017. PMID:32302082.
- ^ Zhao H، Shen D، Zhou H، Liu J، Chen S (2020). "Guillain-Barré syndrome associated with SARS-CoV-2 infection: causality or coincidence?". Lancet. Neurology. ج. 19 ع. 5: 383–384. DOI:10.1016/S1474-4422(20)30109-5. PMC:7176927. PMID:32246917.
- ^ Carod-Artal FJ (2020). "Neurological complications of coronavirus and COVID-19". Revista de Neurologia (بSpanish; Castilian). 70 (9): 311–322. DOI:10.33588/rn.7009.2020179. PMID:32329044.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ Kuwabara S، Yuki N (ديسمبر 2013). "Axonal Guillain–Barré syndrome: concepts and controversies". The Lancet Neurology. ج. 12 ع. 12: 1180–8. DOI:10.1016/S1474-4422(13)70215-1. PMID:24229616. S2CID:35101547.
- ^ أ ب Willison، Hugh J.؛ Goodyear، Carl S. (سبتمبر 2013). "Glycolipid antigens and autoantibodies in autoimmune neuropathies". Trends in Immunology. ج. 34 ع. 9: 453–459. DOI:10.1016/j.it.2013.05.001. PMID:23770405.
- ^ Spasovski G، Vanholder R، Allolio B، وآخرون (25 فبراير 2014). "Clinical practice guideline on diagnosis and treatment of hyponatraemia". European Journal of Endocrinology. ج. 170 ع. 3: G1–47. DOI:10.1530/EJE-13-1020. PMID:24569125.
- ^ Ropper، Allan H. (23 أبريل 1992). "Current Concepts - The Guillain–Barré Syndrome". New England Journal of Medicine. ج. 326 ع. 17: 1130–1136. DOI:10.1056/NEJM199204233261706. PMID:1552914.
- ^ Liu، J؛ Wang، LN؛ McNicol، ED (20 أكتوبر 2013). "Pharmacological treatment for pain in Guillain–Barré syndrome". The Cochrane Database of Systematic Reviews. ج. 10 ع. 10: CD009950. DOI:10.1002/14651858.CD009950.pub2. PMID:24142399.
باللغة العربيَّة
مراجع إضافية
- Steinberg، Gareth J.؛ Joel S. Parry (2006). Guillain–Barré syndrome: from diagnosis to recovery. New York, N.Y.: Demos; ANN Press (American Academy of Neurology). ISBN:9781932603569.
وصلات خارجية
| متلازمة غيلان باريه في المشاريع الشقيقة: | |
| |