التهاب
| التهاب | |
|---|---|
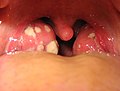
قدم ملتهبة لاحظ علامات الالتهاب الاحمرار والتورم الحرارة والآلم
| |
| معلومات عامة | |
| الاختصاص | علم المناعة |
| من أنواع | مرض، وعلامة سريرية، وعرض |
| الأسباب | |
| الأسباب | عدوى بكتيرية أو فيروسية أو طفيلية، إصابة جسدية، اضطرابات المناعة الذاتية |
| المظهر السريري | |
| الأعراض | حرارة، ألم ، احمرار ، تورم، فقدان للوظيفة |
| المدة | الحاد : أيام قليلة المزمن : تصل إلى عدة أشهر ، أو سنوات |
| المضاعفات | أمراض المناعة الذاتية، تدمر النسيج وفقدان للوظيفة، تجرثم الدم، تأخر التئام الجرح،التحول إلى مزمن |
| الإدارة | |
| أدوية | فلوربيبروفين، وسولينداك، وكورتيزول، وبيتاميثازون، وتريامسينولون، وفلوروميثولون، وبيروكسيكام، وبريدنيكاربات، ونابروكسين، وديكساميثازون، وفلودروكسيكورتيد، وإندوميتاسين، وبريدنيزون، وبريدنيزولون، وميثيلبريدنيزولون، وإيبوبروفين، وديسوكسيميتازون، ونابوميتون، وديزونيد، وفلوسينونيد، ولوتيبريدنول، وديكلوفيناك، وهالسينونيد، وأسبرين، وحمض ميكلوفيناميك
|
| التاريخ | |
| وصفها المصدر | الموسوعة السوفيتية الكبرى |
| تعديل مصدري - تعديل | |
الالتهاب[1][2] (بالإنجليزية: Inflammation) هو استجابة نسيجية ووعاية ضد مسببات العدوى وتلف الأنسجة يحدث فيها خروج لخلايا وجزيئات من الدورة الدموية إلى موقع الضرر للقضاء على العوامل الممرضة. على الرغم من أن كلمة الالتهاب تستخدم طبيًا للإشارة إلى ضرر في الجسم، إلا أنها في الواقع استجابة مناعية ضد مسببات الأمراض وتعد ضرورية للبقاء على قيد الحياة. يتركز دور الاستجابة الالتهابية على القضاء على العوامل الممرضة مثل الميكروبات والسموم وغيرها ثم التخلص من نواتج الإصابة من تدمير وموت للخلايا. تشمل الاستجابة الالتهابية كل من الخلايا البلعمية والأجسام المضاد والبروتينات المتممة. تتواجد معظمها بشكل طبيعي في الدم ولكن يمكن استدعائها بسرعة في أي مكان في الجسم في حال حدوث اصابة. توجد أيضًا بعض الخلايا المشاركة في الاستجابة الالتهابية بشكل دائم في الأنسجة حيث تعمل كجهاز إنذار أولي عند مواجه أي تهديد.[3]
أسباب الالتهاب
[عدل]- جرثومية
تكون بسبب البكتيريا، الفيروسات.
- ميكانكية
الصدمات، الجروح، الخدوش
- كميائية
مختلف المواد الكميائية، كالاحماض
- الأورام
السرطانات، أورام روماتيزم
- فيزيائية
مثل الزيادة في درجة الحرارة بشكل كبير أو الانخفاض الشديد في الحرارة.
الالتهاب الحاد
[عدل]
الالتهاب الحاد يُعد استجابة أولية ضد مسببات الأمراض وبالتالي فهو يمثل آلية مناعية فطرية (Innate immune) غير محددة لنوع معين من مسببات الأمراض، على عكس المناعة المتخصصة (Acquired Immune) التي تتميز بالتخصص لنوع معين من مسببات الأمراض. يحدث الالتهاب الحاد من خلال سلسلة من الأحداث البيوكيميائية تتمثل في زيادة تدفق بلازما الدم، وكريات الدم البيضاء إلى مكان تواجد العامل الممرض. تحصل هذه الاستجابة بتكاتف كلٍ من الجهاز الوعائي، والجهاز المناعي، والخلايا الالتهابية المختلفة داخل الأنسجة المصابة. تعمل العديد من الوسائط الالتهابية مثل السيتوكينات والكيموكينات على تحفيز هجرة الخلايا المتعادلة والخلايا البلعمية إلى موقع الالتهاب. تعد العوامل الممرضة مثل البكتيريا والطفيليات والفيروسات، وبعض المواد المسببة للحساسية والسموم من الأسباب النموذجية للالتهاب الحاد. يحدث الالتهاب الحاد استجابة مناعية فورية، تستمر في الحالات الطبيعية لبضعة أيام، فيما الالتهاب الذي يتميز بفترة التهابية طويلة قد تصل من أشهر إلى سنوات يُطلق عليه بالالتهاب المزمن.
آلية الالتهاب الحاد
[عدل]يمكن اعتبار الالتهاب الحاد بمثابة خط الدفاع الأول ضد الإصابة حيث تبدأ عملية الالتهاب الحاد بتنشيط الخلايا المناعية الموجودة في الأنسجة المصابة، لا سيما الخلايا التغصنية، والخلايا البلعمية، والخلايا البدينة. تمتلك هذه الخلايا مستقبلات سطحية تعرف باسم مستقبلات التعرف على الأنماط (PRRs)، والتي ترتبط مع فئتين فرعيتين من الجزيئات: الفئة الأولى تُسمى الأنماط الجزيئية المرتبطة بالعامل الممرض (PAMPs) والتي هي عبارة عن مركبات توجد في العامل الممرض وتختلف عن تلك الموجودة في جسم الكائن الحي، بينما الفئة الأخرى تُسمى الأنماط الجزيئية المرتبطة بالضرر (DAMPs) التي هي جزئيات تطلق من الخلايا النسيجية التي تعرضت للضرر. يؤدي ارتباط مستقبلات التعرف على الأنماط (PRRs) بالجزيئات المرتبطه بالعامل الممرض (PAMP)، والجزئيات المرتبطة بالضرر (DAMP) إلى تحفيز الخلايا المناعية فتُطلق الخلايا جزيئات متعددة يُطلق عليها الوسائط الالتهابية (chemical mediator) وهي المسؤوله عن العلامات السريرية للالتهاب، أيضًا تحفز هذه الوسائط العديد من الآليات الفيسيولوجية التي من شأنها أن تُحدث استجابة مناعية على مستوى عالٍ من التنسيق. تعمل الوسائط الالتهابية على توسع الأوعية الدموية وزيادة تدفق الدم إلى المنطقة المصابة وهذا ما يُفسر الاحمرار ووزيادة درجة حرارة المنطقة الملتهبة. كما تؤدي زيادة نفاذية الأوعية الدموية إلى تسرب السوائل من بلازما الدم تُسمى النضحة(Exudate) حاملةً معها الخلايا المناعية إلى منطقة الالتهاب. بالإضافة إلى تسرب الخلايا المناعية؛ يحدث تسرب لبروتينات بلازمية مثل الفيبرينوجين الذي سيُحوط منطقة الالتهاب وبالتالي يحد مع إنتشار الضرر إلى المناطق المجاورة كذالك يحدث تسرب للتمائم (Complement System) التي يطلقها الكبد، وأجسام مضادة أخرى، والتي ستلعب في ما بعد دورًا محوريًا في محاصرة العامل الممرض وتغليفه وجعله هدفًا سهلاً للخلايا البالعة. يجدر الإشارة هنا إلى أن هذا التدفق الحاصل هو ما يُفسر التورم الملاحظ في المنطقة الملتهبة. أيضًا تعمل بعض الوسائط الالتهابية مثل البراديكينين، والبروستاجلاندين على تهييج النهايات العصبية المحيطة بالمنطقة ما يسفر عن ألآم متفاوته. تتطلب الاستجابة الالتهابية الحادة تحفيزًا مستمرًا ليكون مستدامًا. ولما كانت الوسائط الالتهابية قصيرة المفعول فأن الاتهاب الحاد سرعان ما يختفي باختفائها.
يمكن تقسيم مراحل الالتهاب الحاد إلى مرحلتين، مرحلة وعائية يحدث فيها توسع للأوعية الدموية وزيادة نفاذيتها، تليها مرحلة خلوية تتوسطها الخلايا المناعية.
المرحلة الوعائية
[عدل]عند ارتباط الجزيئات المتعلقة بالعامل الممرض (PAMPs) على الخلايا البلعمية أو الخلايا البدينة المتواجدة في الأنسجة _تقوم بإطلاق العديد من موسعات الأوعية مثل الهيستامين والسيروتونين، والبروستاجلاندين، والانترليوكين بي4 ، وأكسيد النيتريك التي تعمل على توسيع الأوعية الدموية عن طريق التسبب في انقباض للخلايا المبطنة للوعاء الدموي، يخلق هذا الانقباض ثقوب بين خلايا البطانة الوعائية مؤديًا إلى رشح السوائل البلازمية من الأوعية الدموية إلى الأنسجة تُسمى هذه السوائل بالنضحة (Exudate) وبالتالي تتجمع السوائل في الأنسجة. تحتوي هذه السوائل على العديد من الوسائط الالتهابية مثل: المتممات (complement) مثل C5a,C3a,C3b والأجسام المضادة مثل IgG ، تعمل هذه البروتينات على تثبيت المايكروب وتغليفه بعملية (Opsonization) ليصبح صيدًا سهلًا للخلايا البلعمية تمهيدًا للمرحلة الخلوية. يؤدي هذا التوسع الملحوظ في الأوعية الدموية إلى زيادة تركز الدم في المنطقة المتوسعة، مما ينتج عنه بطء في حركة الدم (Stasis) يسمح هذه البطء في تيار الدم للخلايا المناعية بالتحرك بمحاذاة البطانة الوعائية بدلًا من المركز وهي عملية فعالة تسمح بالتصاق الخلايا المناعية بجدار الوعاء الدموي (Pavementation) وهو ما لا يحدث في حالات التدفق الطبيعي للدم لأن قوة دفع الدم تُجبر الخلايا المناعية على البقاء في مركز التيار وبالتالي ليس لها من فرصة للالتصاق على البطانة الوعائية.
المرحلة الخلوية
[عدل]تشمل المرحلة الخلوية كريات الدم البيضاء التي تتواجد عادة في الدم ويجب أن تنتقل إلى الأنسجة الملتهبة عن طريق الأوعية المتوسعة للقضاء على مسببات المرض، تعمل بعضها كبالعات تبتلع البكتيريا والفيروسات، والحطام الخلوي. فيما تُطلق البعض الآخر حبيبات إنزيمية تساهم في عملية تحليل المايكروبات، بالإضافة إلى إطلاق بعض الوسائط الالتهابية التي تنظم عملية الالتهاب. يجدر الإشارة إلى أن الالتهاب الحاد تتوسطه الخلايا المحببة خوصصًا العادلات، في حين تتوسط الخلايا وحيدة النواة والخلايا الليمفاوية الالتهاب المزمن. يمكن حصر الأحداث الخلوية بالآتي:
١- خروج الخلايا البيضاء إلى موقع الالتهاب:
تشارك الكريات البيض المختلفة، وخاصة الخلايا العادلة بشكل فعال في عملية الالتهاب. حيث تنتقل من موقعها الرئيسي في الدم إلى مكان الالتهاب خارج الوعاء الدموي ويحدث ذلك بعدة خطوات:
أ-التحول إلى طرف البطانة الوعائية (Margiration): يؤدي التوسع في الأوعية الدموية إلى زيادة تركز الدم في هذه المنطقة المتوسعة، مما ينتج عنه بطء في حركة الدم (Stasis) يسمح هذه البطء في تيار الدم للخلايا المناعية بالتحرك بمحاذاة البطانة الوعائية بدلًا من المركز[5] وهو ما لا يحدث في حالات التدفق الطبيعي للدم حيث تجبر قوة دفع الدم الخلايا المناعية على البقاء في مركز التيار. تقوم الخلايا المناعية المتواجدة في موقع الالتهاب باطلاق السيتوكينات مثل (IL-1 و TNFα) التي ترتبط بالبروتيوغليكانات الموجودة على أسطح الخلايا البطانية مؤدية إلى تحفيز مستقبلات السيليكتين (E-selectin). ترتبط الخلايا المناعية بشكل ضعيف على هذه المستقبلات لتبدأ بعدها سلسلة من الارتباط والانفكاك مسببه تدحرجها على طول البطانة الوعائية. تحفز السيتوكينات أيضًا مستقبلات الإنتجرين (Integrine) الموجودة على أسطح البطانة الوعائية مثل (ICAM-1)، و (VCAM-1)، والتي تعمل هي الأخرى على الارتباط بجزئيات الإنتجرين الموجودة على أسطح الخلايا المناعية لكن الارتباط هنا يكون أكثر قوة من سابقتها.[بحاجة لمصدر]
ب-هجرة الخلايا المناعية (Emigration) : تحفز الكيموكينيات المنطلقة من موقع الالتهاب -الكريات البيض الملتصقة بالبطانة الوعائية على التحرك بين الخلايا البطانية في الوعاء الدموي. حيث تبدأ الخلايا المناعة بشق طريقها بين خلايا البطانة مستخدمة بذلك بعض إنزيمات مثل إنزيم الكولاجينيز الذي يحلل الغشاء القاعدي المبطن للبطانة الوعائية.[6]
جـ-الجذب الكيميائى (Chemotaxis): بعد أن تمكنت الخلايا المناعية من المرور عبر البطانة الوعائية إلى خارج الوعاء الدموي، يجب أن تخضع لعملية جذب يحصل بموجبها توجيه الخلايا المناعية إلى مكان تواجد المايكروب أو إلى موقع الالتهاب. يتم تحفيز هذه العملية بواسطة مجموعة متنوعة من الجزيئات الكيميائية التي تعمل كجاذبات للخلايا المناعية عبر ارتباطها بمستقبلات معينة على أسطحها ومن هذه الجاذبات C3a ,C5a, C3b بالإضافة إلى بعض السموم أو الذيفانات التي تطلقها البكتيريا يمكن أن تعمل أيضًا كجاذبات للخلايا المناعية نحو موقع الالتهاب.[7]
٢- عملية البـلعمــة(Phagocytosis): حال وصول الخلايا العادلة المتسربة في المرحلة الخلوية إلى موقع الالتهاب تبدأ عملية ابتلاع المايركوبات ومخلفات الالتهاب ويحدث ذلك عندما ترتبط مستقبلات التعرف الخلوي الموجودة على أسطح الخلايا البلعمية (PRRs) بالجزيئات المرتبطة بالعامل الممرض (PAMPs).يؤدي هذا الارتباط إلى إعادة ترتيب الهيكل الخلوي للأكتين والميوسين الخاص بالخلية البلعمية مسببًا تكوين انبعاجات في غشاء البلازما تعمل على إحاطة العامل الممرض بفجوة وإدخالها إلى داخل الخلية البلعمية. في داخل الخلية البلعمية تندمج هذه الفجوة المحتوية على المايكروب بجسيمات داخل الخلية يُطلق عليها الجسيمات الحالة التي تحوي على إنزيمات متعددة وبعض أنواع الأكسجين التفاعلية التي تؤدي إلى تدمير المايكروب. يجد الإشارة هنا بأن عملية البلعمية يتم تعزيزها بواسطة بعض الجزيئات مثل (C3b, IgG)التي خرجت مع السوائل أثناء المرحلة الوعائية حيث ترتبط هذا الجزيئات بالمستضدات الميكروبية وتغلفها بعملية تسمى (Opsonization). تزيد هذه العلمية من فاعلية البلعمة، مما يعزز القضاء على العامل الممرض.
أعراض الالتهاب الحاد
[عدل]الالتهاب الحاد هو عملية قصيرة المدى، تظهر عادة في غضون بضع دقائق أو ساعات من حدوث الإصابة أو الضرر وتتوقف عندما يتخلص الجسم من مصدر الضرر.[8] وتحدث الاستجابة الالتهابية على مستوى عالٍ من التنسيق بين الجهاز المناعي، والجهاز الوعائي، والجهاز الغُدي، والجهاز العصبى.[9] في حالة الاستجابة الالتهابية الطبيعية تحدث عملية الالتهاب الحاد لفترة وجيزة وما إن يتم التخلص من العامل الممرض حتى تبدأ عملية إصلاح الانسجة التالفة وإعادة الأمور إلى نصابها، ويمكن حصر العلامات أو الأعراض المرافقة للالتهاب الحاد في الألم، والحرارة، والاحمرار، والتورم، وفقدان للوظيفة. يرجع الاحمرار والحرارة إلى زيادة تدفق الدم في موقع الالتهاب، فيما يحدث التورم بسبب تراكم السوائل حول المنطقة الملتهبة نتيجة زيادة نفاذية الاوعية الدموية القريبة، أما الألم فيحدث بسبب إطلاق مواد كيميائية من الخلايا المناعية المتواجدة في النسيج الملتهب مثل البراديكينين والبروستاجلاندين التي تحفز النهايات العصبية الحسية.[10]
الالتهاب المزمن
[عدل]هو استجابة مناعية طويلة الأمد قد تستمر من أسابيع إلى سنوات. بعكس الالتهاب الحاد الذي عادة ما يستمر لفترة قصيرة وله أعراض طبية واضحه مثل الألم، والاحمرار، والتورم _تكون الأعراض في الالتهاب المزمن أعراض مستمرة لفترة طويلة قد تستمر لسنوات، كذالك يتميز عن الالتهاب الحاد بوجود تخّرب نسيجي واضح يلحق ضرر بالغ بالأنسجة المصابة؛[11] بسبب الإنزيمات التي تنتجها الخلايا الالتهابية، ويترافق مع عملية تدمير الأنسجة _ بناء نسيج ليفي يحلّ مكان النسيج الأصلي المدمر، وتدعى هذه العملية بالتلُّيف (Fibrosis). تتوسط الاستجابة الالتهابية المزمنة بالخلايا البلعمية،[12] والخلايا الليمفاوية، والخلايا البلازمية [13] على عكس الالتهاب الحاد الذي تتوسطه الخلايا العادلة. يعد مرض التصلب العصيدي،[14] والتهاب المفاصل الروماتويدي،[15] وأمراض المناعة الذاتية الأخرى أمثلة على الالتهاب المزمن.
أسباب الالتهاب المزمن
[عدل]يمكن أن يكون الالتهاب المزمن تطوّراً من الالتهاب الحاد، أو قد يبدأ مزمنًا بشكل بطيء دون وجود أعراض ظاهرة.
تطور الالتهاب من حاد إلى مزمن
[عدل]يمكن تلخيص الأسباب التي من شأنها أن تحول الالتهاب الحاد إلى مزمن في الأتي:
- استمرار تواجد العامل الممرض، وعدم مقدرة الجسم على التخلص منه، كما في حالة السل الرئوي.[16]
- تداخل عوامل تعيق عملية شفاء النسيج المدمر كما في حالة الجروح الملوثة.
- استخدام بعض الأدوية مثل الكورتيزون الذي يثبط عملية ترميم الأنسجة التالفه.[17]
- الإصابة المتكررة بالالتهابات الحادة.
بدء الالتهاب مزمنًا دون المرور بطور الالتهاب الحاد
[عدل]يمكن أن يتطور الالتهاب إلى شكله المزمن دون المرور بطور الالتهاب الحاد في الحالات التالية:
- التعّرض طويل الأمد لبعض المواد السُمّية يسبب التهابات مزمنة، مثل تعرض عمال مصانع الإسمنت لغبار السيليكا الذي يسبب بما يُعرف داء السيليكا المزمن.[19]
- الارتفاع المزمن للشحميات في الجسم يؤدي إلى ترسبه في جدران الأوعية الدموية محدثًا بذالك ضرر في البطانة الوعائية يتبعه استجابة التهابية وقد تتطور الحالة إلى تصلب عصيدي.[20]
أعراض الالتهاب المزمن
[عدل]العلامات والأعراض الشائعة التي تظهر أثناء الالتهاب المزمن هي:
- تليف الأنسجة الملتهبة، قد يؤدي في نهاية المطاف إلى فقدان كلي أو جزئي لوظيفة العضو كما في بعض حالات تليف الكبد.[21]
- ألآم الجسم، وألآم المفاصل، وألآم الظهر.
- حمى، وفقدان للشهية، وغيرها من الأعراض التي تختلف بأختلاف سبب ومكان الإصابة.
الفرق بين الالتهاب الحاد والمزمن
[عدل]| حاد | مزمن | |
|---|---|---|
| السبب | عدوى بكتيرية ، جروح الأنسجة | يتطور من الالتهاب الحاد ، عدوى فيروسية ،أمراض المناعة الذاتية ، وجود جسم غريب في الجسم لفترة طويلة |
| الخلايا الالتهابية | الخلايا العادلة (الرئيسية)، الخلايا القاعدية، الخلايا الحامضة (في حالة العدوى الطفيلية) الخلايا وحيدة النوى, الخلايا البالعة | الخلايا البالعة(الرئيسية) ، الخلايا الليمفاوية، الخلايا البلازمية ، الخلايا اليفية |
| الوسائط الالتهابية | كثيرة منها الهيستامين، البروستاجلاندين | انترفيرون جاما ، سيتوكينات، عوامل النمو ، أنواع الأكسجين التفاعلية ، إنزيمات محللة |
| الحدوث | بشكل سريع | بشكل بطيء |
| المدة | صغيرة | طويلة قد تصل إلى سنين |
| المآل | الشفاء، التحول إلى التهاب مزمن ، تكوين خراجات مزمنة | تدمر الأنسجة، تليف |
الأنماط الشكلية للالتهاب
[عدل]- الالتهاب الحبيبي(Granuloma): ويطلق عليه أيضًا الورم الحبيبي وهو نوع من الالتهابات المزمنة التي تتميز بتجمع خلايا التهابية عملاقة على هيئة كتل تشبه الورم ومن هنا جاء الاسم. يظهر في بعض الحالات كما في السل، والجذام، والساركويد، والزهري.[22]
- الالتهاب الليفي (Fibrinous inflammation): هو نوع من الالتهابات الحادة الذي يحدث فيها تراكم كبير للفيبرين في منطقة الالتهاب نتيجة الزيادة الكبيرة في نفاذية الأوعية الدموية. يظهر هذا النوع من الالتهابات بصورة رئيسية في التهابات التجاويف المصلية كما في حالات الانصباب البلوري في الرئة، والانصباب التأموري في القلب. يمكن أن يتحول الرشح الزائد من الفيبرين إلى ندبة(Scar) على جدران الأغشية المصلية مما يحد من وظيفتها.[23]
- الالتهاب الصديدي (Suppurative Inflammation): وهو نوع من الالتهابات الحادة، يحدث فيه تكون قيح نتيجة الإنزيمات المحلله التي تطلقها للخلايا العادلة ضد العامل الممرض. تُعد عدوى البكتيريا القيحية مثل المكورات العنقودية من أكثر العوامل الممرضة سببًا لهذا النوع من الالتهاب. يُرى هذا في حالات الخراجات (abscess)، والتهاب النسيج الخلوي (Cellulitis)، والدمل(Furuncle)
- الالتهاب المصلي (Serous inflammation): هو نوع من الالتهابات الحادة يشبه الالتهاب الليفي ولكن أخف منه حده. يحدث فيه ارتشاح للسائل المصلي، الذي يرشح من بلازما الدم ويحدث غالبًا في الحالات المتوسطة من الإنصباب الجنبي في الرئة، والانصباب التأموري في القلب كما يُرى في حالة فقاعات الحروق (Blister)، وبثور هربس الشفة (Herpes labialis).[24]
- الالتهاب التقرحي (Ulcerative inflammation): هو نوع من الالتهابات الحادة التي يحدث فيها تقرح للخلايا الظهارية التي تبطن الأسطح الداخلية أو الخارجية كما في حالات التقرحات القولونية (Ulcerative colitis).[25]
الاظطرابات المرافقة للالتهاب
[عدل]يمكن أن يتسبب الالتهاب بمجموعة كبيرة من الاضطرابات التي تصيب الإنسان. غالبًا ما تحدث مع اضطرابات الجهاز المناعي التي تؤدي إلى التهابات غير طبيعي، كما هو حاصل في بعض أمراض ردود الفعل التحسسية وبعض الاعتلالات العضلية وتصلب الشرايين.
التصلب العصيدي
[عدل]كان يُعتقد سابقًا أن التصلب العصيدي مرتبط بزيادة الدهون فقط، إلا أنه في الواقع ينطوي على استجابة التهابية مستمرة ناتجة عن الضرر الحاصل في البطانة الوعائية (Intima) نتيجة لترسب الدهون والكليسترول. تبين هذه العلاقة بين الالتهاب وآليات تصلب الشرايين. الارتفاع الملحوظ في العلامات الالتهابية يمكن أن تكون مؤشرًا مبكرًا للأشخاص الذين يعانون من متلازمات الشريان التاجي الحادة . بالإضافة إلى ذلك قد تكون مستويات بروتين سي التفاعلية مؤشرًا مستقبليًا لخطر التعرض لأمراض تصلب الشرايين .[26]
الحساسية
[عدل]رد الفعل التحسسي، المعروف أيضًا بفرط الحساسية، ما هو إلا نتيجة لاستجابة مناعية مفرطة يطلقها الجسم ضد مسببات الحساسية، تؤدي إلى توسع الأوعية، وانخفاض في ضغط الدم، وتهيج الأعصاب. ومن الأمثلة الشائعة على ذالك صدمة الحساسية، التي تنتج عن استجابة شديدة للخلايا البدينة ضد مسببات الحساسية. تحدث الاستجابة عندما ترتبط المواد المسببة للحساسية بالجسم المضاد IgE الذي يرتبط بدوره على أسطح الخلايا البدينة التي تُطلق الهستامين. يُحدث الهستامين استجابة التهابية مفرطة تتميز بتوسيع الأوعية الدموية، وإنتاج الجزيئات مؤيدة للالتهابات، وإطلاق السيتوكين واستثارة الكريات البيض.
الاعتلال العضلي
[عدل]يحدث الاعتلال العضلي الالتهابي بسبب مهاجمة الجهاز المناعي لعضلات الجسم الطبيعية، بواسطة إنتاج أجسام مضادة تعمل على تدمير النسيج العضلي مثل الوهن العضلي الوبيل، وغيره من الاعتلالات العظلية المرتبطة.
السرطان
[عدل]ينظم الالتهاب البيئة الخلوية المحيطة بالورم .[27] تساهم العديد من خلايا الجهاز المناعي في كبح السرطان[28] إلا أن بعض التغيرات الجزيئية على مستقبلات الهرمونات الستيرويدية التي تلعب دورًا هامًا في التطور الخلوي، وعوامل النسخ - يمكن أن تؤدي إلى تأثيرات التهابية على الخلايا السرطانية.[29] من المحتمل أن تؤثر قدرة العوامل الالتهابية التي تنظم فعالية الهرمونات الستيرويدية على خلايا التسرطن. من ناحية أخرى، نظرًا للطبيعة المعيارية للعديد من مستقبلات الهرمونات الستيرويدية، قد يوفر هذا التفاعل فرصة لتطور السرطان من خلال استهداف بروتينات معينة على أسطح الخلايا. قد تساعد مثل هذه التفاعلات في الحفاظ على الوظائف الحيوية في الكائن الحي. وفقًا لمراجعة عام 2009، تشير البيانات الحديثة إلى أن الالتهاب المرتبط بالسرطان (CRI) قد يؤدي إلى تراكم التغيرات الجينية العشوائية في الخلايا السرطانية.ففي عام 1863 افترض رودولف فيرشو أن أصل السرطان كان في مواقع الالتهاب المزمن.[30][31] يُقدر حاليًا أن الالتهاب المزمن يساهم في ما يقرب من 15٪ إلى 25٪ من حالات السرطان .[31][32]
الوسائط الالتهابية وتلف الحمض النووي
[عدل]بالرغم من أن الوسائط الالتهابية تعمل على الأوعية الدموية والخلايا المناعية لتعزيز الاستجابة الالتهابية، إلا أنها قد تشارك في انتشار وبقاء السرطان وتشمل البروستاجلاندين، والسيتوكينات (IL-1β , TNF-α , IL-6 , IL-15) والكيموكينات (IL-8 , GRO-alpha).[33] يمكن أن يتسبب الالتهاب أيضًا في تلف الحمض النووي بسبب تحفيره لبعض أنواع الأكسجين التفاعلية (ROS) بواسطة هذه الوسائط الالتهابية داخل الخلايا. بالإضافة إلى ذلك، فإن الكريات البيض والخلايا البلعمية الأخرى التي تنجذب إلى موقع الالتهاب قد تسبب تلفًا للحمض النووي في الخلايا المتكاثرة من خلال انتاجها لأنواع من النيتروجين التفاعلية (RNS). عادة ما يتم إنتاج ROS و RNS بواسطة الخلايا البلعمية لمحاربة العدوى.تتسبب أنواع الأكسجين التفاعلية وحدها أكثر من 20 نوعًا مختلفًا من حالات تلف الحمض النووي.[34] قد تصبح الخلية الطبيعية سرطانية إذا تعرضت بشكل متكرر لتلف الحمض النووي خلال فترات طويلة من الالتهاب المزمن. تتسبب أضرار الحمض النووي في حدوث طفرات جينية، أيضًا قد تتسبب الأخطاء في عملية إصلاح الحمض النووي في حدوث تغييرات جينية.[31][35][36] توفر هذه الطفرات والتغيرات الجينية بيئة انتقائية لتحول الخلايا الطبيعية إلى سرطانية. تكشف التحليلات على مستوى الجينوم لأنسجة السرطانات البشرية أن خلية سرطانية نموذجية واحدة قد تمتلك ما يقرب من 100 طفرة في مناطق الترميز، 10-20 منها طفرات متحركة (driver mutations) تساهم في تطور السرطان. ومع ذلك، فإن الالتهاب المزمن قد يسب أيضًا تغيرات جينية مثل ميثلة الحمض النووي [37][38]، والتي غالبًا ما تكون أكثر شيوعًا من الطفرات. عادة يتم ميثلة عدة مئات إلى آلاف من الجينات في خلية سرطانية واحدة. يمكن لمواقع الضرر التأكسدي الحاصله في الكروماتين استثارة ميثيل ترانسفيرازات الحمض النووي (DNMTs)، وهيستون ديستيلاز (SIRT1)، وهستون ميثيل ترانسفيراز (EZH2)، وبالتالي تحفيز مثيلة الحمض النووي.[37] غالبًا ما يتم تعطيل جينات إصلاح الحمض النووي عن طريق المثيلة في العديد من السرطانات.
الإيدز
[عدل]من المعروف أن الإصابة بفيروس نقص المناعة البشرية لا تتميز فقط بتطور نقص المناعة الشديد ولكن أيضًا بالالتهاب المستمر وتنشيط المناعة.[39][40][41] تشير مجموعة كبيرة من الأدلة إلى أن الالتهاب المزمن هو المحرك الأساسي لضعف المناعة، والظهور المبكر للأمراض المرتبطة بالشيخوخة، ونقص المناعة[42] لا يعتبر الكثيرون الآن عدوى فيروس العوز المناعي البشري مجرد نقص مناعي ناجم عن الفيروس، ولكن أيضًا مرض التهابي مزمن.[43] حتى بعد إدخال العلاجات الفعالة بمضادات الفيروسات القهقرية (ART) والمثبطات الفعالة لفيروسات الدم لدى الأفراد المصابين بفيروس نقص المناعة البشرية -يستمر الالتهاب المزمن. أوضحت دراسات أجريت على الحيوانات أيضًا العلاقة بين التنشيط المناعي ونقص المناعة الخلوي التدريجي. إن تحديد كيفية انخفاض كفائة الخلايا التائية المساعدة (CD4 T) وعلاقتها بالالتهاب المزمن وتنشيط المناعة- يكمن في صميم فهم التسبب في الإصابة بفيروس نقص المناعة البشرية، وهو أحد أهم أولويات أبحاث فيروس نقص المناعة البشرية التي أجراها مكتب أبحاث الإيدز والمعهد الوطني لصحة. أوضحت الدراسات الحديثة أن الكاسبيز 1 الذي يساهم في حدوث الموت الخلوي الالتهابي المبرمج (Pyroptosis) وهو شكل شديد من موت الخلايا المبرمج الذي يسببه الالتهابات، بالإضافة إلى انخفاض كفائة الخلايا التائية CD4 - هما الحدثان المميزان اللذان يدفعان بتطور مرض فيروس نقص المناعة البشرية إلى الإيدز.[44] يبدو أن الموت الخلوي الالتهابي المبرمج يسبب موت الخلايا التائية CD4 والخلايا المناعية أخرى العادلات والبالعات ولا تقف الأمور عند هذ الحد بل تُطلق إشارات التهابية لتجذب المزيد من الخلايا المناعية إلى الأنسجة اللمفاوية المصابة لتموت هي الأخرى.[44] إن تحديد آلية الموت الخلوي الالتهابي المبرمج باعتباره الآلية السائدة التي تسبب انخفاض وموت الخلايا التائية CD4 الحاصله في مرضى الإيدز -قد يوفر فرصًا علاجية جديدة، عن طريق مثبطات الكاسبايز -1 الذي يتحكم في مسار الموت الخلوي الالتهابي المبرمج. وعلى هذا النحو، يمكن منع الانخفاض والموت في الخلايا التائية CD4 T ، وإفراز السيتوكينات المفاقمة للالتهابات مثل (IL-1β , IL-18)في الأنسجة اللمفاوية المصابة بفيروس نقص المناعة البشرية عن طريق إضافة مثبطات الكاسبايز (1 VX-765)، والذي سبق أن ثبت أنها آمنة وجيدة في المرحلة الثانية من التجارب السريرية. قد تدفع هذه النتائج إلى تطوير فئة جديدة تمامًا من مضادات الإيدز التي تعمل من خلال استهداف المضيف وتثبيط الآلية الإمراضية بدلاً من استهداف الفيروس نفسه.[45]
الاكتئاب
[عدل]هناك أدلة على وجود صلة بين الالتهاب والاكتئاب.[46] يمكن أن تحدث العمليات الالتهابية عن طريق الإدراك السلبي، مثل التوتر أو العنف أو الحرمان. وبالتالي، يمكن أن يتسبب الإدراك السلبي التهابًا يمكن أن يؤدي بدوره إلى الاكتئاب.[47][48] بالإضافة إلى ذلك، هناك أدلة متزايدة على أن الالتهاب يمكن أن يسبب الاكتئاب بسبب زيادة السيتوكينات، مما يجعل الدماغ في وضع المرض .[49] تظهر الأعراض الكلاسيكية للمرض الجسدي، مثل الخمول، تداخلًا كبيرًا في السلوكيات التي تميز الاكتئاب. تميل مستويات السيتوكينات إلى الزيادة بشكل حاد خلال نوبات الاكتئاب للأشخاص المصابين بالاضطراب ثنائي القطب وتنخفض خلال الفترات الطبيعية.[50] علاوة على ذلك، فقد ثبت في التجارب السريرية أن الأدوية المضادة للالتهابات التي يتم تناولها مع مضادات الاكتئاب لا تحسن من الأعراض بشكل كبير فحسب، بل تزيد أيضًا من نسبة الأشخاص الذين يستجيبون بشكل إيجابي للعلاج.[51] يمكن أن تحدث الالتهابات التي تؤدي إلى الاكتئاب الشديد بسبب العدوى الشائعة مثل تلك التي يسببها فيروس أو بكتيريا أو حتى طفيليات.[52]
آلية انهاء الاستجابة الالتهابية
[عدل]تحدث إنهاء الاستجابة الالتهابية عندما لا تعود هناك حاجة للالتهاب، كما يمكن أن يؤدي الالتهاب المستمر لفترات طويلة دون كبح- إلى التهاب مزمن يحدث ضرر بالغ بالأنسجة. تشير الدلائل إلى أن عملية حل الاستجابة الالتهابية تبدأ في الساعات القليلة الأولى بعد بدء الاستجابة الالتهابية. بعد دخول الأنسجة تعمل الخلايا المحببة على تحويل البروستاجلاندينات والليوكوترينات المشتقة من حمض الأراكيدونيك إلى ليبوكسينات، والتي تبدأ سلسلة إنهاء الاستجابة الالتهابية. وهكذا يتوقف استثارة العادلات إلى موقع الالتهاب، ويتم تشغيل الموت المبرمج للخلايا التي مضى عليها أكثر من 24 ساعة من بدء طور الالتهاب الحاد . تتزامن هذه الأحداث مع التخليق الحيوي للأحماض الدهنية المتعددة غير المشبعة (أوميغا 3)، والتي تحد بشكل حاسم من ارتشاح العدلات عن طريق بدء موت الخلايا المبرمج ثم تخضع بعدها العادلات لعملية بلعمة بواسطة الخلايا البلعمية مما يؤدي إلى إزالتها تمامًا . يلي ذالك إطلاق سيتوكينات مضادة للالتهابات مثل عامل النمو (TFGFB-1).
يمكن حصر الآليات التي من شأنها أن تعمل على إنهاء الاستجابة الالتهابية في التالي:
- نصف العمر القصير للوسائط الالتهابية في الجسم، حيث يحدث لها تحلل وتصبح غير فعالة لاستمرار الاستجابة الالتهابية.
- إطلاق عامل النمو بيتا (TGFB-1) من الخلايا البلعمية.
- إطلاق انترلوكين 10 (IL-10).
- إنتاج مواد متخصصه في كبح الالتهاب، مثل الليفوكسين والريسولفين والمارسين والبروتكتين العصبي من الجسم.
- تقليل الجزيئات التي تزيد من للالتهابات، مثل الليكوترين
- تنظيم الجزيئات المضادة للالتهابات مثل مضادات مستقبلات الإنترلوكين 1 أو مستقبلات عامل نخر الورم (TNFR).
- موت الخلايا الالتهابية المبرمج التي في موقع للالتهابات.
التأثيرات الجهازية للالتهاب
[عدل]الانتشار
[عدل]يمكن للعامل الممرض الافلات من الأنسجة والدخول عبر الجهاز الدوري أو الجهاز اللمفاوي، حيث ينتشر إلى أجزاء أخرى من الجسم مسببًا مضاعفات خطيرة .إذا لم يُحْتَوَى العامل الممرض فقد يتمكن من الوصول إلى الجهاز اللمفاوي عبر الأوعية الليمفاوية القريبة مسببًا التهاب الأوعية الليمفاوية(Lymphangitis) أو يصل إلى العقد الليمفاوية مسببًا التهاب العقدة الليمفاوية(Lymphadenitis). كذالك قد ينتشر عبر مجرى الدم مسببًا بما يُعرف بتعفن الدم (Septicemia) التي تتمثل بتواجد العامل الممرض والسموم التي ينتجها في الدم ويعد من الحالات الخطيرة التي تتطلب تدخل طبي طارئ، ويعد توسع الأوعية وفشل وظائف الأعضاء من المضاعفات الخطيرة المرتبطة بالإنتان أو تعفن الدم التي قد تؤدي إلى صدمة إنتانية ووفاة.[53]
بروتينات الطور الحاد
[عدل]يتميز الالتهاب أيضًا بمستويات عالية من بروتينات المرحلة الحادة. في حالات الالتهاب الحاد، بالرغم من أن هذه البروتينات مفيدة في عملية الاستجابة الالتهابية؛ الا أنها في الالتهابات المزمنة يمكن أن تسهم في مضاعفات خطيرة .[54] تشمل هذه البروتينات بروتين سي التفاعلي (CRP)، وأميلويد مصل الدم (Serum Amyloid-A)، التي تسبب مجموعة من التأثيرات الجهازية بما في ذلك: الداء النشواني، وإرتفاع في ضغط الدم، وقلة التعرق، وتوعك وفقدان للشهية.
أعداد كريات الدم البيضاء
[عدل]يؤثر الالتهاب على عدد الكريات البيض الموجودة في الجسم .
- كثرة الكريات البيض (Leucocytosis): غالبًا ما يُلاحظ كثرة الكريات البيضاء أثناء الالتهاب الناجم عن العدوى، حيث يؤدي إلى زيادة كبيرة في كمية الكريات البيض في الدم، وخاصة الخلايا غير الناضجة. في الحلات الطلبعة لا تتجاوز عدد خلايا الدم البيضاء (4,000-11,000/ميكروليتر)، بينما قد يزداد هذا الرقم إلى (15,000-20,000/ميكروليتر)، وقد يصل في الحالات القصوى إلى 100,000 خلية لكل ميكروليتر. تختلف نوع الخلايا البيضاء المرتفعة باختلاف نوع المرض، ففي حالات الالتهابات البكتيرية نلحظ ارتفاع في الخلايا العادلة(Neutrophilia)، بينما في حالات الاصابات الفيروسية نلحظ ارتفاع في الليمفاويات (Lymphocytosis)، أما في حالات الاصابات الطفيلية وأمراض الحساسية نلحظ ارتفاع في الخلايا الحامضية (Eosinophilia). كذالك يحدث الارتفع في بعض حالات سرطان الدم الوكيميا (Leukemia).
- قلة الكريات البيض (Leucopenia): يمكن أن تحدث قلة الكريات البيض في بعض الأمراض، مثل الريكتسيا، والتيفود وبعض الطفيليات مثل الليشمانيا والسل وبعض أنواع السرطان.
مآل الالتهاب
[عدل]تحديد النتيجة يعتمد على نوع الالتهاب وشدته وحجم الضرر الذي لحق بالانسجة. فيما يلي بعض النتائج المحتملة للالتهاب:
- الشفاء (Resolution): يتم انهاء عملية الاستجابة الالتهابية ، حيث يتم ايقاف توسع الأوعية ، وإنتاج الوسائط الالتهابية ، وتسلل الكريات البيض ، يتبعها تتجدد واصلاح للأنسجة التالفة.
- التليف(Fibrosis): عندما تصبح عملية إعادة ترميم الأنسجة بأنسجة طبيعية من نفس النوع -صعبة بسبب الضرر البالغ الذي لحق بالانسجة، يقوم الجسم باصلاح التالف من الأنسجة بكتلة ليفية مصمتة أو ما يُسمى بالندبة(Scar) تكون أساسًا من الكولاجين ولا تحتوي على أي خلايا أو أوعية دموية وبالتالي في حالات حدوث هذا النواع من الإصلاح في الأعضاء الحيوية مثل الكبد، والرئة قد يؤدي إلى فقدان كلي أو جزئي للوظيفة.
- تشكيل الخراج (Abscess): يتكون تجويف يحتوي على صديد ، وهو سائل معتم يحتوي على خلايا دم بيضاء ميتة وبكتيريا مع حطام الخلايا المدمرة.
- التحول إلى التهاب مزمن (Chronic Inflammation): في حالة الالتهاب الحاد ، إذا لم يستطيع الجسم التخلص من العامل الممرض ، فسيتحول الالتهاب إلى التهاب مزمن.[55] الذي قد يستمر لعدة أيام أو شهور أو حتى سنوات . يتميز الالتهاب المزمن بوجود الخلايا البلعمية رغم أنها عامل دفاعي قوي وفعال في للجسم ، إلا أن الانزيمات والوسائط الالتهابية التي تطلقها - بما في ذلك أنواع الأكسجين التفاعلية (ROS) - التي تسبب ضرر بالغ بأنسجة الكائن الحي، لهذا السبب يصاحب الالتهاب المزمن دائمًا تدمير الأنسجة.
انظر أيضًا
[عدل]- الجهاز المناعي
- استجابة مناعية
- ذيفان تأقي
- مضاد التهاب
- التئام
- التهاب الشيخوخة
- سيتوكين محرض على الالتهاب
- إنترلوكين
- التهاب عصبي المنشأ
المراجع
[عدل]- ^ مصطفى الشهابي (2003). أحمد شفيق الخطيب (المحرر). معجم الشهابي في مصطلحات العلوم الزراعية (بالعربية والإنجليزية واللاتينية) (ط. 5). بيروت: مكتبة لبنان ناشرون. ص. 825. ISBN:978-9953-10-550-5. OCLC:1158683669. QID:Q115858366.
- ^ محمد مرعشي (2003). معجم مرعشي الطبي الكبير (بالعربية والإنجليزية). بيروت: مكتبة لبنان ناشرون. ص. 89. ISBN:978-9953-33-054-9. OCLC:4771449526. QID:Q98547939.
- ^ Robbins BASIC PATHOLOGY (ط. 10the education). ص. 57.
{{استشهاد بكتاب}}: الوسيط|مؤلف1-الأول=يفتقد|مؤلف1-الأخير=(مساعدة)، الوسيط|مؤلف2-الأول=يفتقد|مؤلف2-الأخير=(مساعدة)، والوسيط|مؤلف3-الأول=يفتقد|مؤلف3-الأخير=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Robbins S، Cotran R، Kumar V، Abbas A، Aster J (2020). Pathologic basis of disease (ط. 10th). Philadelphia, PA: Saunders Elsevier.
- ^ Herrington S (2014). Muir's Textbook of Pathology (ط. 15th). CRC Press. ص. 59. ISBN:978-1444184990.
- ^ "Leukocyte Migration - an overview | ScienceDirect Topics". www.sciencedirect.com. مؤرشف من الأصل في 2021-10-30. اطلع عليه بتاريخ 2022-10-29.
- ^ "Leukocyte Chemotaxis and Migration / Anesthesiology / American Society of Anesthesiologists". pubs.asahq.org. مؤرشف من الأصل في 2021-12-04. اطلع عليه بتاريخ 2022-10-29.
- ^ Hannoodee S، Nasuruddin DN (2020). "Acute Inflammatory Response". إي ميديسين. PMID:32310543. مؤرشف من الأصل في 2022-06-15.
- ^ Stedman's Medical Dictionary (ط. Twenty-fifth). Williams & Wilkins. 1990.
- ^ Abbas AB، Lichtman AH (2009). "Ch.2 Innate Immunity". في Saunders (Elsevier) (المحرر). Basic Immunology. Functions and disorders of the immune system (ط. 3rd). ISBN:978-1-4160-4688-2.
- ^ Altibbi.com. "التهاب مزمن". الطبي (بar-YE). Archived from the original on 2022-10-29. Retrieved 2022-10-29.
{{استشهاد ويب}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ Parisi, Luca; Gini, Elisabetta; Baci, Denisa; Tremolati, Marco; Fanuli, Matteo; Bassani, Barbara; Farronato, Giampietro; Bruno, Antonino; Mortara, Lorenzo (2018). "Macrophage Polarization in Chronic Inflammatory Diseases: Killers or Builders?". Journal of Immunology Research (بالإنجليزية). 2018: 1–25. DOI:10.1155/2018/8917804. ISSN:2314-8861. Archived from the original on 2022-10-30.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Chronic Inflammation - Granulomas - Lymphocytes". TeachMeSurgery. مؤرشف من الأصل في 2022-11-18. اطلع عليه بتاريخ 2022-10-29.
- ^ Kobiyama, Kouji; Ley, Klaus (26 Oct 2018). "Atherosclerosis". Circulation Research (بالإنجليزية). 123 (10): 1118–1120. DOI:10.1161/CIRCRESAHA.118.313816. ISSN:0009-7330. Archived from the original on 2022-10-30.
- ^ "Rheumatoid arthritis - Symptoms and causes". Mayo Clinic (بالإنجليزية). Archived from the original on 2022-11-15. Retrieved 2022-10-30.
- ^ Muefong, Caleb N.; Sutherland, Jayne S. (27 May 2020). "Neutrophils in Tuberculosis-Associated Inflammation and Lung Pathology". Frontiers in Immunology (بالإنجليزية). 11. DOI:10.3389/fimmu.2020.00962. ISSN:1664-3224. Archived from the original on 2022-10-30.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Anstead، G. M. (1998-10). "Steroids, retinoids, and wound healing". Advances in Wound Care: The Journal for Prevention and Healing. ج. 11 ع. 6: 277–285. ISSN:1076-2191. PMID:10326344. مؤرشف من الأصل في 30 أكتوبر 2022.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Duan، Lihua؛ Rao، Xiaoquan؛ Sigdel، Keshav Raj (28 فبراير 2019). "Regulation of Inflammation in Autoimmune Disease". Journal of Immunology Research. ج. 2019: 7403796. DOI:10.1155/2019/7403796. ISSN:2314-8861. PMID:30944837. مؤرشف من الأصل في 2022-10-30.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Pollard، Kenneth Michael (2016). "Silica, Silicosis, and Autoimmunity". Frontiers in Immunology. ج. 7. DOI:10.3389/fimmu.2016.00097/full. ISSN:1664-3224. مؤرشف من الأصل في 2022-08-08.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Libby، Peter (2012-9). "History of Discovery: Inflammation in Atherosclerosis". Arteriosclerosis, thrombosis, and vascular biology. ج. 32 ع. 9: 2045–2051. DOI:10.1161/ATVBAHA.108.179705. ISSN:1079-5642. PMID:22895665. مؤرشف من الأصل في 29 أكتوبر 2022.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Koyama, Yukinori; Brenner, David A. (3 Jan 2017). "Liver inflammation and fibrosis". The Journal of Clinical Investigation (بالإنجليزية). 127 (1): 55–64. DOI:10.1172/JCI88881. ISSN:0021-9738. Archived from the original on 2022-10-30.
- ^ Olivia (2022). Granuloma. Treasure Island (FL): StatPearls Publishing. PMID:32119473. مؤرشف من الأصل في 2022-11-18.
{{استشهاد بكتاب}}: الوسيط|مؤلف1=و|مؤلف=تكرر أكثر من مرة (مساعدة) - ^ "fibrinous inflammation - General Practice notebook". gpnotebook.com. مؤرشف من الأصل في 2022-10-30. اطلع عليه بتاريخ 2022-10-30.
- ^ "serous inflammation - General Practice notebook". gpnotebook.com. مؤرشف من الأصل في 2022-10-30. اطلع عليه بتاريخ 2022-10-30.
- ^ dussa vamshikrishna Dr.Vamshikrishna (23 فبراير 2020). "Morphology of-acute-inflammation". مؤرشف من الأصل في 2022-10-30.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ Libby P (19–26 ديسمبر 2002). "Inflammation in atherosclerosis". Nature. ج. 420 ع. 6917: 868–74. Bibcode:2002Natur.420..868L. DOI:10.1038/nature01323. PMID:12490960. S2CID:407449.
- ^ Ungefroren H، Sebens S، Seidl D، Lehnert H، Hass R (سبتمبر 2011). "Interaction of tumor cells with the microenvironment". Cell Communication and Signaling. ج. 9: 18. DOI:10.1186/1478-811X-9-18. PMC:3180438. PMID:21914164.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Gunn L، Ding C، Liu M، Ma Y، Qi C، Cai Y، وآخرون (سبتمبر 2012). "Opposing roles for complement component C5a in tumor progression and the tumor microenvironment". Journal of Immunology. ج. 189 ع. 6: 2985–94. DOI:10.4049/jimmunol.1200846. PMC:3436956. PMID:22914051.
- ^ Copland JA، Sheffield-Moore M، Koldzic-Zivanovic N، Gentry S، Lamprou G، Tzortzatou-Stathopoulou F، وآخرون (يونيو 2009). "Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?". BioEssays. ج. 31 ع. 6: 629–41. DOI:10.1002/bies.200800138. PMID:19382224. S2CID:205469320.
- ^ Coussens LM، Werb Z (2002). "Inflammation and cancer". Nature. ج. 420 ع. 6917: 860–7. Bibcode:2002Natur.420..860C. DOI:10.1038/nature01322. PMC:2803035. PMID:12490959.
- ^ ا ب ج Chiba T، Marusawa H، Ushijima T (سبتمبر 2012). "Inflammation-associated cancer development in digestive organs: mechanisms and roles for genetic and epigenetic modulation" (PDF). Gastroenterology. ج. 143 ع. 3: 550–563. DOI:10.1053/j.gastro.2012.07.009. hdl:2433/160134. PMID:22796521. S2CID:206226588. مؤرشف من الأصل (PDF) في 2022-08-29.
- ^ Mantovani A، Allavena P، Sica A، Balkwill F (يوليو 2008). "Cancer-related inflammation" (PDF). Nature. ج. 454 ع. 7203: 436–44. Bibcode:2008Natur.454..436M. DOI:10.1038/nature07205. hdl:2434/145688. PMID:18650914. S2CID:4429118. مؤرشف من الأصل (PDF) في 2022-10-30.
- ^ Larsen GL، Henson PM (1983). "Mediators of inflammation". Annual Review of Immunology. ج. 1: 335–59. DOI:10.1146/annurev.iy.01.040183.002003. PMID:6399978.
- ^ Yu Y، Cui Y، Niedernhofer LJ، Wang Y (ديسمبر 2016). "Occurrence, Biological Consequences, and Human Health Relevance of Oxidative Stress-Induced DNA Damage". Chemical Research in Toxicology. ج. 29 ع. 12: 2008–2039. DOI:10.1021/acs.chemrestox.6b00265. PMC:5614522. PMID:27989142.
- ^ Nishida N، Kudo M (2013). "Oxidative stress and epigenetic instability in human hepatocarcinogenesis". Digestive Diseases. ج. 31 ع. 5–6: 447–53. DOI:10.1159/000355243. PMID:24281019.
- ^ Ding N، Maiuri AR، O'Hagan HM (2017). "The emerging role of epigenetic modifiers in repair of DNA damage associated with chronic inflammatory diseases". Mutation Research. ج. 780: 69–81. DOI:10.1016/j.mrrev.2017.09.005. PMC:6690501. PMID:31395351.
- ^ ا ب O'Hagan HM، Wang W، Sen S، Destefano Shields C، Lee SS، Zhang YW، وآخرون (نوفمبر 2011). "Oxidative damage targets complexes containing DNA methyltransferases, SIRT1, and polycomb members to promoter CpG Islands". Cancer Cell. ج. 20 ع. 5: 606–19. DOI:10.1016/j.ccr.2011.09.012. PMC:3220885. PMID:22094255.
- ^ Maiuri AR، Peng M، Podicheti R، Sriramkumar S، Kamplain CM، Rusch DB، وآخرون (يوليو 2017). "Mismatch Repair Proteins Initiate Epigenetic Alterations during Inflammation-Driven Tumorigenesis". Cancer Research. ج. 77 ع. 13: 3467–3478. DOI:10.1158/0008-5472.CAN-17-0056. PMC:5516887. PMID:28522752.
- ^ Deeks SG (1 يناير 2011). "HIV infection, inflammation, immunosenescence, and aging". Annual Review of Medicine. ج. 62: 141–55. DOI:10.1146/annurev-med-042909-093756. PMC:3759035. PMID:21090961.
- ^ Klatt NR، Chomont N، Douek DC، Deeks SG (يوليو 2013). "Immune activation and HIV persistence: implications for curative approaches to HIV infection". Immunological Reviews. ج. 254 ع. 1: 326–42. DOI:10.1111/imr.12065. PMC:3694608. PMID:23772629.
- ^ Salazar-Gonzalez JF، Martinez-Maza O، Nishanian P، Aziz N، Shen LP، Grosser S، وآخرون (أغسطس 1998). "Increased immune activation precedes the inflection point of CD4 T cells and the increased serum virus load in human immunodeficiency virus infection". The Journal of Infectious Diseases. ج. 178 ع. 2: 423–30. DOI:10.1086/515629. PMID:9697722.
- ^ Ipp H، Zemlin A (فبراير 2013). "The paradox of the immune response in HIV infection: when inflammation becomes harmful". Clinica Chimica Acta; International Journal of Clinical Chemistry. ج. 416: 96–9. DOI:10.1016/j.cca.2012.11.025. PMID:23228847.
- ^ Nasi M، Pinti M، Mussini C، Cossarizza A (أكتوبر 2014). "Persistent inflammation in HIV infection: established concepts, new perspectives". Immunology Letters. ج. 161 ع. 2: 184–8. DOI:10.1016/j.imlet.2014.01.008. PMID:24487059.
- ^ ا ب Doitsh G، Greene WC (مارس 2016). "Dissecting How CD4 T Cells Are Lost During HIV Infection". Cell Host & Microbe. ج. 19 ع. 3: 280–91. DOI:10.1016/j.chom.2016.02.012. PMC:4835240. PMID:26962940.
- ^ "Study of VX-765 in Subjects With Treatment-resistant Partial Epilepsy - Full Text View - ClinicalTrials.gov". clinicaltrials.gov. 19 ديسمبر 2013. مؤرشف من الأصل في 2022-09-26. اطلع عليه بتاريخ 2016-05-21.
- ^ Berk M، Williams LJ، Jacka FN، O'Neil A، Pasco JA، Moylan S، وآخرون (سبتمبر 2013). "So depression is an inflammatory disease, but where does the inflammation come from?". BMC Medicine. ج. 11: 200. DOI:10.1186/1741-7015-11-200. PMC:3846682. PMID:24228900.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Cox WT، Abramson LY، Devine PG، Hollon SD (سبتمبر 2012). "Stereotypes, Prejudice, and Depression: The Integrated Perspective". Perspectives on Psychological Science. ج. 7 ع. 5: 427–49. DOI:10.1177/1745691612455204. PMID:26168502. S2CID:1512121.
- ^ Kiecolt-Glaser JK، Derry HM، Fagundes CP (نوفمبر 2015). "Inflammation: depression fans the flames and feasts on the heat". The American Journal of Psychiatry. ج. 172 ع. 11: 1075–91. DOI:10.1176/appi.ajp.2015.15020152. PMC:6511978. PMID:26357876.
- ^ Williams C (4 يناير 2015). "Is depression a kind of allergic reaction?". The Guardian. مؤرشف من الأصل في 2022-10-21.
- ^ Brietzke E، Stertz L، Fernandes BS، Kauer-Sant'anna M، Mascarenhas M، Escosteguy Vargas A، وآخرون (أغسطس 2009). "Comparison of cytokine levels in depressed, manic and euthymic patients with bipolar disorder". Journal of Affective Disorders. ج. 116 ع. 3: 214–7. DOI:10.1016/j.jad.2008.12.001. PMID:19251324.
- ^ Müller N، Schwarz MJ، Dehning S، Douhe A، Cerovecki A، Goldstein-Müller B، وآخرون (يوليو 2006). "The cyclooxygenase-2 inhibitor celecoxib has therapeutic effects in major depression: results of a double-blind, randomized, placebo controlled, add-on pilot study to reboxetine". Molecular Psychiatry. ج. 11 ع. 7: 680–4. DOI:10.1038/sj.mp.4001805. PMID:16491133.
- ^ Canli T (2014). "Reconceptualizing major depressive disorder as an infectious disease". Biology of Mood & Anxiety Disorders. ج. 4: 10. DOI:10.1186/2045-5380-4-10. PMC:4215336. PMID:25364500.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Ramanlal، Riddhi؛ Gupta، Vikas (2021)، "Physiology, Vasodilation"، StatPearls، Treasure Island (FL): StatPearls Publishing، PMID:32491494، مؤرشف من الأصل في 2021-05-11، اطلع عليه بتاريخ 2021-09-22
- ^ "Acute Phase Protein - an overview | ScienceDirect Topics". www.sciencedirect.com. مؤرشف من الأصل في 2022-10-30. اطلع عليه بتاريخ 2022-10-30.
- ^ Creative, Lifeboat. "Chronic Inflammation Test". Chronic Inflammation Test (بالإنجليزية). Archived from the original on 2022-10-30. Retrieved 2022-10-30.
وصلات خارجية
[عدل]- Inflammation في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).