ميثان: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
Cyclone605 (نقاش | مساهمات) إضافة مترجمة من النسخة الإنجليزية |
Cyclone605 (نقاش | مساهمات) إضافة مترجمة من النسخة الإنجليزية |
||
| سطر 118: | سطر 118: | ||
| url-status = live |
| url-status = live |
||
}}</ref> |
}}</ref> |
||
== تفاعلات كيميائية == |
|||
التفاعلات الكيميائية الأولية للميثان هي [[احتراق|الاحتراق]] و<nowiki/>[[إصلاح البخار]] إلى [[غاز الاصطناع]] و<nowiki/>[[هلجنة|الهلجنة]]. بشكل عام من الصعب التحكم في تفاعلات الميثان. |
|||
=== الأكسدة الانتقائية === |
|||
من الصعب أكسدة الميثان جزئيًا لتحويله إلى [[ميثانول]] (وهو وقود سائل أكثر ملاءمة)، لأن التفاعل عادة ما يستمر إلى حين تكون [[ثنائي أكسيد الكربون|ثاني أكسيد الكربون]] والماء حتى في حالة عدم وجود ما يكفي من [[أكسجين|الأكسجين]]. يعمل إنزيم {{وإو|الميثان أحادي أوكسيجيناز|Methane monooxygenase}} على إنتاج الميثانول من الميثان، ولكن لا يمكن استخدامه للتفاعلات على نطاق صناعي.<ref>{{cite journal |
|||
| doi = 10.1021/cr950244f |
|||
| title = Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase |
|||
| year = 2003 |
|||
| last1 = Baik |
|||
| first1 = Mu-Hyun |
|||
| last2 = Newcomb |
|||
| first2 = Martin |
|||
| last3 = Friesner |
|||
| first3 = Richard A. |
|||
| last4 = Lippard |
|||
| first4 = Stephen J. |
|||
| journal = Chemical Reviews |
|||
| volume = 103 |
|||
| issue = 6 |
|||
| pages = 2385–419 |
|||
| pmid = 12797835 |
|||
}}</ref> حدثت بعض التطورات في كل من الأنظمة المحفزة غير المتجانسة والمتجانسة، ولكن لا زال لكل منها عيوب كبيرة. تعمل هذه الأنظمة بشكل عام عن طريق توليد منتجات محمية من الأكسدة الزائدة، ومن الأمثلة على ذلك نظام كاتاليتيكا، و<nowiki/>[[زيوليت|الزيوليت]] النحاسي، والزيوليت الحديدي الذي يعمل على تثبيت موقع تفاعل {{وإو|ألفا-أكسجين|Alpha-oxygen}} النشط،<ref>{{Cite journal |
|||
| last1 = Snyder |
|||
| first1 = Benjamin E. R. |
|||
| last2 = Bols |
|||
| first2 = Max L. |
|||
| last3 = Schoonheydt |
|||
| first3 = Robert A. |
|||
| last4 = Sels |
|||
| first4 = Bert F. |
|||
| last5 = Solomon |
|||
| first5 = Edward I. |
|||
| date = December 19, 2017 |
|||
| title = Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes |
|||
| journal = Chemical Reviews |
|||
| volume = 118 |
|||
| issue = 5 |
|||
| pages = 2718–2768 |
|||
| doi = 10.1021/acs.chemrev.7b00344 |
|||
| pmid = 29256242 |
|||
| url = https://lirias.kuleuven.be/handle/123456789/627682 |
|||
}}</ref> في حالة عدم وجود الأكسجين، تعمل أحد أنواع [[بكتيريا|البكتيريا]] على تحفيز ما يسمى بـ {{وإو|الأكسدة اللاهوائية للميثان|Anaerobic oxidation of methane}} باستخدام [[نتريت|النتريت]] كعامل مؤكسد.<ref>{{cite book |
|||
| first1 = Joachim |
|||
| last1 = Reimann |
|||
| first2 = Mike S.M. |
|||
| last2 = Jetten |
|||
| first3 = Jan T. |
|||
| last3 = Keltjens |
|||
| editor = Peter M.H. Kroneck and Martha E. Sosa Torres |
|||
| title = Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases |
|||
| series = Metal Ions in Life Sciences |
|||
| volume = 15 |
|||
| year = 2015 |
|||
| publisher = Springer |
|||
| chapter = Chapter 7 ''Metal Enzymes in “Impossible” Microorganisms Catalyzing the Anaerobic Oxidation of Ammonium and Methane'' |
|||
| pages = 257–313 |
|||
| doi = 10.1007/978-3-319-12415-5_7 |
|||
| pmid = 25707470 |
|||
| isbn = 978-3-319-12414-8 |
|||
}}</ref> |
|||
=== التفاعلات الحمضية والقاعدية === |
|||
== مصادر الميثان == |
== مصادر الميثان == |
||
نسخة 23:33، 6 ديسمبر 2022
| ميثان | |
|---|---|
 |
 |
 |
 |
| الاسم النظامي (IUPAC) | |
ميثان |
|
| أسماء أخرى | |
غاز المستنقعات |
|
| المعرفات | |
| رقم CAS | 74-82-8 |
| بوب كيم (PubChem) | 297 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | CH4 |
| الكتلة المولية | 16.042 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 0.717 كغ/م3 غاز |
| نقطة الانصهار | - 182.5 °س |
| نقطة الغليان | - 161.6 °س |
| الذوبانية في الماء | 3.5 مغ/100 مل ماء عند 17 °س |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| نقطة الوميض | - 188 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الميثان، هو مركب كيميائي له الصيغة الكيميائية CH4 (ذرة كربون واحدة مرتبطة بأربع ذرات هيدروجين). ويصنف ضمن مجموعة 14 هيدريد [الإنجليزية]، وهو أبسط شكل للألكان والمكون الرئيسي للغاز الطبيعي. الميثان النقي ليس له رائحة، ولكن عند استخدامه تجاريا يتم خلطه بكميات ضئيلة من مركبات الكبريت ذات الرائحة المميزة مثل إيثيل مركبتان، مما يمكن من تتبع أثار الميثان في حالة حدوث تسريب.
إن الوفرة النسبية للميثان على الأرض تجعله وقودًا مهمُا اقتصاديًا، على الرغم من أن التقاطه وتخزينه يمثل تحديات تقنية بسبب حالته الغازية في ظل الظروف العادية لدرجة الحرارة والضغط. يتواجد غاز الميثان الطبيعي تحت الأرض وتحت قاع البحر وينتج عن عمليات جيولوجية وبيولوجية مختلفة. يقع أكبر خزان للميثان تحت قاع البحر على شكل هيدرات الميثان. عندما يصل الميثان إلى السطح والغلاف الجوي يُعرف باسم الميثان الجوي. منذ عام 1750 زاد تركيز غاز الميثان في الغلاف الجوي للأرض بنحو 150٪، وهو يمثل 20٪ من إجمالي التأثير الإشعاعي العالمي من جميع غازات الدفيئة والمختلطة. كما اكتشف الميثان على كواكب أخرى بما في ذلك المريخ مما كان له أثر كبير على أبحاث علم الأحياء الفلكية.
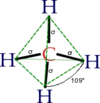
الخصائص والترابط
الميثان هو غاز له بنية جزيئية رباعية السطوح مع أربعة روابط هيدروجين-أكسجين [الإنجليزية] متكافئة. يوصف هيكله الإلكتروني بأربعة مدارات جزيئية رابطة ناتجة عن تداخل مداري التكافؤ على ذرات الكربون و الهيدروجين.
المدارات الجزيئية التي لها أدنى طاقة ناتجة عن تداخل المدار 2s على الكربون مع مدارات 1s على ذرات الهيدروجين الأربعة، فوق مستوى الطاقة هذا توجد مجموعة متدرجة ثلاثياً من المدارات الجزيئية التي تتضمن تداخل مدارات 2p على الكربون مع مجموعات خطية مختلفة من مدارات 1s على الهيدروجين، يتوافق مخطط الترابط الناتج مع القياسات الطيفية الكهروضوئية.
الميثان هو غاز عديم الرائحة ويبدو أنه عديم اللون،[3] يمتص الضوء المرئي خاصة عند الطرف الأحمر من الطيف بسبب النطاقات المفرطة [الإنجليزية] لكن التأثير يكون ملحوظًا فقط إذا كان مسار الضوء طويلًا جدًا، وهو ما يعطي كوكبي أورانوس ونبتون ألوانهما الزرقاء أو الخضراء المزرقة، حيث يمر الضوء عبر غلافهما الجوي المحتوي على الميثان ثم يتشتت مرة أخرى.[4]
كإجراء احترازي للسلامة، تُضاف الروائح التي عادةً ما تحتوي على مادة ثلاثي بوتيل ثيول إلى الغاز الطبيعي المستخدم في المنازل لخلق رائحة مألوفة. تبلغ درجة غليان الميثان 161.5 درجة مئوية عند ضغط جوي واحد، وهو غاز قابل للاشتعال بتركيزات مختلفة في الهواء (5.4-17٪) عند الضغط القياسي.
هناك أشكال مختلفة من الميثان الصلب، تسعة منها معروفة حتى الآن.[5] تبريد الميثان عند ضغط مساوي للضغط الجوي ينتج الميثان 1 . تتبلور هذه المادة في النظام المكعب (زمرة فراغية Fm3m). يحتوي الميثان I على مواقع ذرات هيدروجين غير ثابتة، مما يسمح لجزيئات الميثان بالدوران بحرية، لذا فهي تعتبر بلورات بلاستيكية.[6]
تفاعلات كيميائية
التفاعلات الكيميائية الأولية للميثان هي الاحتراق وإصلاح البخار إلى غاز الاصطناع والهلجنة. بشكل عام من الصعب التحكم في تفاعلات الميثان.
الأكسدة الانتقائية
من الصعب أكسدة الميثان جزئيًا لتحويله إلى ميثانول (وهو وقود سائل أكثر ملاءمة)، لأن التفاعل عادة ما يستمر إلى حين تكون ثاني أكسيد الكربون والماء حتى في حالة عدم وجود ما يكفي من الأكسجين. يعمل إنزيم الميثان أحادي أوكسيجيناز [الإنجليزية] على إنتاج الميثانول من الميثان، ولكن لا يمكن استخدامه للتفاعلات على نطاق صناعي.[7] حدثت بعض التطورات في كل من الأنظمة المحفزة غير المتجانسة والمتجانسة، ولكن لا زال لكل منها عيوب كبيرة. تعمل هذه الأنظمة بشكل عام عن طريق توليد منتجات محمية من الأكسدة الزائدة، ومن الأمثلة على ذلك نظام كاتاليتيكا، والزيوليت النحاسي، والزيوليت الحديدي الذي يعمل على تثبيت موقع تفاعل ألفا-أكسجين [الإنجليزية] النشط،[8] في حالة عدم وجود الأكسجين، تعمل أحد أنواع البكتيريا على تحفيز ما يسمى بـ الأكسدة اللاهوائية للميثان [الإنجليزية] باستخدام النتريت كعامل مؤكسد.[9]
التفاعلات الحمضية والقاعدية
مصادر الميثان
المصادر الطبيعية
يتم استخراج الميثان من الرواسب الجيولوجية حيث يكون مصاحبا لأنواع الوقود الهيدروكربوني الأخرى. كما يمكن الحصول عليه من المصادر الطبيعية:
- تحلل المخلفات العضوية.
- المصادر الطبيعية: المستنقعات 23%
- وقود حفريات 20%
- عملية الهضم في الحيوانات (ماشية) 17%
- قاع البحر توجد كميات ضخمة من الغاز الطبيعي متجمدة تحت قاع البحر. ويقدر الخبراء أن احتياطي هيدرات الميثان الموجودة تحت قاع محيطات وبحار العالم، تبلغ حوالي 3000 غيغاطن، أي حوالي 3 مليار كيلوغرام. وهذا بدوره يعادل ضعف احتياطيات الطاقة المتوفرة في جميع المصادر التقليدية للطاقة كالفحم والنفط والغاز الطبيعي. لذا تتجه بعض الدول مثل الصين واليابان وكوريا الجنوبية والهند والبرازيل والولايات المتحدة، إلى استخراج هيدرات الميثان من أعماق البحار لسد حاجتها المتزايدة من الطاقة.

- البكتريا التي تتواجد أثناء زراعة الأرز.
- تسخين أو حرق الكتلة الحيوية لاهوائيا.
60% من الانبعاثات التي تنتج الميثان ناتجة من الأنشطة البشرية، وخاصة الأنشطة الزراعية. وخلال 200 سنة السابقة، تضاعف تركيز الغاز في الغلاف الجوي من 0.8 إلى 1.6 جزء في المليون.
كما أن الميثان يصنف على أنه كتلة حيوية لأنه يمكن أن ينتج من الحرق اللاهوائي لبعض المواد العضوية.
المصادر الصناعية
يمكن تصنيع الميثان واستخدامه صناعيا وذلك عن طريق التفاعلات الكيميائية مثل تفاعل ساباتيه (Sabatier reaction) أو عملية فيشر-تروبش (Fischer-Tropsch process).
- وطبقا لتقديرات أحد المصادر فإن الميثان الموجود في شكل رسوبي في المحيط يقدر بـعشرة آلاف مليار طن.[10] وتقترح النظريات أن هذه الكميات الضخمة من الميثان يمكن أن تنطلق فجأة مرة أخرى، وتسبب ارتفاعا في درجات الحرارة.
أبسط الهيدروكربونات، الميثان وهو غاز، له الصيغة الكيميائية CH4. الميثان النقي ليس له رائحة، ولكن عند استخدامه تجاريا يتم خلطه بكميات ضئيلة من الكبريت القوي الرائحة. المركبات مثل إثيل مركبتان تمكن من تتبع أثار الميثان في حالة حدوث تسريب.
وكمكون رئيسي للغاز الطبيعي، فإن الميثان أحد أنواع الوقود المهمة. وحرق جزيء واحد من الميثان في وجود الأكسجين ينتج جزيء من ثاني أكسيد الكربون CO2, و2 جزيء من الماء H2O.
CH4 + 2O2 → CO2 + 2H2O الميثان أيضا أحد غازات الصوبة الزجاجية وله عزم تدفئة عام يبلغ 21. ويبلغ المتر المكعب من الميثان 717 جرام.
تفاعلات الميثان

تفاعل احتراق الميثان؛ حيث توجد 4 ذرات هيدروجين و4 ذرات أكسجين و1 ذرة كربون قبل التفاعل وبعده. الكتلة الكلية بعد التفاعل هي نفسها التي كانت قبل التفاعل. - الاحتراق
يوجد عديد من الخطوات عند احتراق الميثان: يتحول الميثان إلى الجذر ميثيل CH3، والذي يتحول إلى فورمالدهيد (HCHO أو H2CO). ويتحول الفورمالدهيد إلى الجذر فورمال HCO، والذي بدوره يكون أول أكسيد الكربون CO. وهذه العملية يطلق عليها تحلل حراري تأكسدي:
- CH4 + O2 → CO + H2 + H2O
بعد عملية انحلال حراري تاكسدية يتأكسد H2 مشكلاً H2O، ويطلق حرارة. ويحدث هذا بسرعة جدا، في وقت أقل من ميلي ثانية.
- H2 + ½ O2 → H2O
وأخيرا، يتأكسد CO ليكون CO2 وينطلق مزيد من الحرارة. وهذه العملية أبطأ الخطوات وتحتاج بضع ميلي ثواني لتكتمل:
- CO + ½ O2 → CO2
- تنشيط الهيدروجين
إن الرابطة التساهمية القوية بين الكربون-الهيدروجين في الميثان هي واحدة من أقوى الروابط الهيديروجينية، وعلى ذلك فإن استخدامها كمادة اولية في صناعة البتروكيمياويات محدود. ولايزال البحث جاريا عن عامل حفز مناسب لتكسير الرابطة بين C-H في الميثان والألكانات المنخفضة الأخرى.
يتفاعل الميثان مع الهالوجينات المختلفة حسب المعادلة العامة:
- CH4 + X2 → CH3X + HX
ولكن ذلك في الضوء الشمس غير المباشر ويكون هذا التفاعل تفاعل استبدال
الميثان خارج الكرة الأرضية
يُعتقد أن الميثان تم تحديد وجوده في أماكن عديدة في النظام الشمسي. ويعتقد أنه تكوّن خلال العمليات غير العضوية التي كانت تصاحب تطور النظام الشمسي.
- كوكب المشتري؛ يحوي غلافه الجوي على 0.3 % ميثان.
- كوكب المريخ؛ يحوي 10 جزء من البليون. (10 ppb)
- كوكب زحل؛ يحوي غلافه الجوي على 0.4 % ميثان.
- كوكب نيبتون
- كوكب أورانوس
- مذنب هالي
- مذنب هياكوتاكي
كما توجد آثار لغاز الميثان في طبقة رقيقة على القمر التابع للأرض. كما أن هناك بعض الاكتشافات حول وجود الميثان في السحابات الموجودة بين النجوم.
استخدامات الميثان
إن المصادر الممكن استعادة واستعمال غاز الميثان منها كطاقة مجدية اقتصادياً تتضمن مناجم الفحم الحجري، وأنظمة الزيت والغاز، ومواقع ردم النفايات، وسماد الحيوانات.
- مناجم الفحم
- من أجل خفض مخاطر الانفجارات، تتم إزالة غاز الميثان من المناجم الموجودة تحت الأرض، قبل، وخلال، أو بعد التعدين. أما الاستعمالات الممكنة والمربحة للميثان من مناجم الفحم فهي: حقن غاز المناجم في شبكات أنابيب توزيع الغاز الطبيعي، أو استعماله لتوليد الطاقة الكهربائية، أو كوقود للمركبات/السيارات.
- مناطق ردميات النفايات
- الطريقة الرئيسية لخفض انبعاثات الميثان من مواقع طمر النفايات تتضمن جمع وحرق أو إعادة استعمال الغاز الناتج عن مواقع ردميات النفايات. تتركز تكنولوجيا استعمال غاز مناطق الردميات على توليد الطاقة الكهربائية والاستعمال المباشر للغاز. يتم توليد الطاقة الكهربائية من خلال توزيع الميثان المجمع بواسطة شبكات الأنابيب كوقود للمحركات أو التوربينات. كما تستعمل تكنولوجيا الاستعمال المباشر غاز مواقع الردميات مباشرة كوقود. بينما تتطلب التكنولوجيات الأخرى تحسين الغاز وتوزيعه على شبكات أنابيب توزيع الغاز الطبيعي.
- أنظمة الزيوت والغاز الطبيعي
- تقع نشاطات تخفيض الانبعاثات هنا في ثلاث فئات: التكنولوجيات أو تحسين المعدات التي تخفض أو تزيل تهوية المعدات والانبعاثات الأخرى، ورفع مستوى الأساليب الإدارية والإجراءات التشغيلية، إضافةً إلى تعزيز الوسائل الإدارية بالاستفادة من التحسينات التكنولوجية. في جميع هذه الحالات، فإن خفض انبعاثات الميثان يوفر غازا أكثر للبيع والاستعمال.
استعمالات أخرى:
- تحضر منه الكثير من المركبات العضوية مثل الكلوروفورم ورابع كلوريد الكربون الذي يستخدم في إطفاء الحرائق وكمذيب أيضا، كما يدخل في صناعات كثيرة مثل صناعة البلاستيك والنايلون والكحولات والفورمالدهيد.
- يكوّن حوالي 80% من الغاز الطبيعي المستخدم كوقود.
- يستخدم في الاحتراق للحصول على الطاقة، فالكيلو جرام منه يعطي 13300 سعر ما يعادل 55594 كيلوجول.
- يحضر منه النيتروميثان الذي يستخدم في عمل العقاقير الطبية والمبيدات الحشرية والمفرقعات.
- يستخدم في تحضير غاز الاصطناع.
- غاز الطبخ أو الغاز الطبيعي يتكون 90% من غاز الميثان مع عدد آخر من غازات أخرى.
انظر أيضًا
- قائمة الدول حسب انبعاث غازات الدفيئة
- قائمة الدول حسب انبعاثات ثاني أكسيد الكربون
- الألكانات. أحد أنواع الهيدروكربونات والتي يكون الميثان أبسط أعضائها.
- كلاثيرات ميثان، نوع من أنواع الثلج يحتوى على الميثان.
- مجموعة ميثيل، مجموعة فعالة تشبه الميثان.
- إنتاج الميثان من الفحم
المراجع
- ^ ا ب ج methane (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Hensher, David A.؛ Button, Kenneth J. (2003). Handbook of transport and the environment. Emerald Group Publishing. ص. 168. ISBN:978-0-08-044103-0. مؤرشف من الأصل في 2015-03-19. اطلع عليه بتاريخ 2016-02-22.
- ^ P.G.J Irwin؛ وآخرون (12 يناير 2022). "Hazy Blue Worlds: A Holistic Aerosol Model for Uranus and Neptune, Including Dark Spots" (PDF). Journal of Geophysical Research: Planets. ج. 127 ع. 6: e2022JE007189. arXiv:2201.04516. DOI:10.1029/2022JE007189. PMC:9286428. PMID:35865671. S2CID:245877540.
- ^ Bini، R.؛ Pratesi، G. (1997). "High-pressure infrared study of solid methane: Phase diagram up to 30 GPa". Physical Review B. ج. 55 ع. 22: 14800–14809. Bibcode:1997PhRvB..5514800B. DOI:10.1103/physrevb.55.14800.
- ^ Wendelin Himmelheber. "Crystal structures". مؤرشف من الأصل في 2020-02-12. اطلع عليه بتاريخ 2019-12-10.
- ^ Baik، Mu-Hyun؛ Newcomb، Martin؛ Friesner، Richard A.؛ Lippard، Stephen J. (2003). "Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase". Chemical Reviews. ج. 103 ع. 6: 2385–419. DOI:10.1021/cr950244f. PMID:12797835.
- ^ Snyder، Benjamin E. R.؛ Bols، Max L.؛ Schoonheydt، Robert A.؛ Sels، Bert F.؛ Solomon، Edward I. (19 ديسمبر 2017). "Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes". Chemical Reviews. ج. 118 ع. 5: 2718–2768. DOI:10.1021/acs.chemrev.7b00344. PMID:29256242.
- ^ Reimann، Joachim؛ Jetten، Mike S.M.؛ Keltjens، Jan T. (2015). "Chapter 7 Metal Enzymes in "Impossible" Microorganisms Catalyzing the Anaerobic Oxidation of Ammonium and Methane". في Peter M.H. Kroneck and Martha E. Sosa Torres (المحرر). Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. Springer. ج. 15. ص. 257–313. DOI:10.1007/978-3-319-12415-5_7. ISBN:978-3-319-12414-8. PMID:25707470.
- ^ BBC نسخة محفوظة 28 أغسطس 2017 على موقع واي باك مشين.
وصلات خارجية
| ميثان في المشاريع الشقيقة: | |
| |



