جسم مضاد
| صنف فرعي من | |
|---|---|
| جزء من | |
| الأسباب | |
| الشركة المصنعة | |
| دوره |

في علم المناعة، مضاد مناعي أو جسم مضاد[3][4][5][6][7](بالإنجليزية: Antibody)[8] أو الغلُوبولين المَناعِيّ [9] (بالإنجليزية: immunoglobulin) أو الكُرَيين المناعي [10] (حيث كلمة كُرَيين ترجمة لكلمة globulin المشتقة من الكلمة اللاتينية globus والتي تعني كرة)، هو بروتين على شكل حرف Y الإنكليزي ويتواجد في الدم والسوائل الجسمية الأخرى في الفقاريات، ويتم استخدامه من قبل جهاز المناعة للتعرف على الأجسام الأجنبية وتحييدها مثل البكتيريا والفيروسات.[11]
تكوين الضد وتحدده
[عدل]تتكون الجسيمات المضادة مثل بقية البروتينات من وحدات ثانوية تدعى الأحماض الأمينية. وهناك 20 نوعاً من هذه الأحماض التي يمكن ربطها معاً بمختلف الارتباطات لتكوين سلسلة بروتينية أكبر حجما.[12] إن مكونات السلسلة من الأحماض الامينية والتتابع الذي تترتب فيه تلك الأحماض على طول السلسلة يحدد كيفية التفاف السلسلة في هيئة ثلاثية الأبعاد وربما ترتبط بسلاسل أخرى.
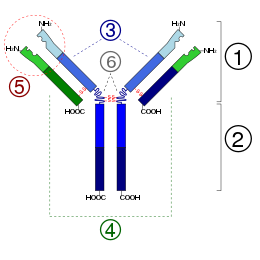
الكريينات المناعية هي جزيئات الأضداد التي لها مظهر تركيبي يعكس وظيفتها. تتكون جزيئة الضد من نوعين من سلاسل البروتين القريبة من بعضها توصف إحداها بالخفيفة والأخرى بالثقيلة.[13]
عندما قورنت تتابعات الأحماض الأمينية للسلاسل الخفيفة من مختلف الأضداد في آخر عقدين من القرن العشرين، وجد نوربيرت هيلشمان، الذي كان في حينها يعمل في معهد روكفلر للبحوث الطبية، أن تلك السلاسل ذات خواص غريبة. إذ أن تتابع السلاسل من الأضداد المختلفة يختلف من سلسلة لأخرى لكن الاختلافات تعزى إلى النصف الأول من كل سلسلة، أما بقية السلسلة ففيها نفس التتابع في جميع الأضداد العائدة لنوع معين.
الجزيئة ذات الوظيفتين
[عدل]| الاسم | الأنواع | الوصف | مجمعات الأجسام المضادة |
| غلوبيولين مناعي A | 2 | يوجد في المناطق المخاطية مثل الأمعاء، المجاري التنفسية والمجارية البولية، وتحمي هذه المناطق من الاستعمار من قِبل المكروبات.[14] | 
|
| غلوبيلين مناعي د | 1 | يعمل بصورة أساسية كمستقبل مستضدات على سطح الخلايا البائية.[15] وظيفته معروفة بصورة أقل من الأنواع الأخرى. | |
| كريين مناعي هـ | 1 | يرتبط بالمستأرجات ويحفز إطلاق الهستامين من الخلايا البدينة، وله دور في الحساسية. أيضاً يحمي ضد الديدان الطفيلية.[16] | |
| IgG | 4 | بأشكاله الأربع، يوفر أغلبية المناعة المبنية على الأجسام المضادة ضد المكروبات الغازية.[16] | |
| كريين مناعي م | 1 | متواجد على سطح الخلايا البائية ويتم إفرازه بغزارة عالية جدا. يقضي على المكروبات عند بداية نشوئها في المناعة المتوسطة للخلايا البائية قبل أن يكون هناك IgG بما فيه الكفاية.[15][16] |
يعتبر وجود التغاير والثبات في جزيئة البروتين ذا أهمية وظيفية قيمة، وفي الواقع فإن جزيئة الضد مزدوجة الوظيفة فكل سلسلة فيها منطقة متغايرة، تشكل حوالي نصف السلسلة الخفيفة وربع السلسلة الثقيلة، ومنطقة أخرى ثابتة. والمناطق المتغايرة من السلاسل هي التي تنطوي في الفراغ لتشكل موقع ارتباط الجسم الضد من المستضد وهو الموقع الذي يرتبط بمستضد معين يوجه الضد نحوه، وإن تغيير تتابع الأحماض الأمينية في المنطقة المتغايرة يتغير التركيب الكيميائي لمواقع الارتباط وبذلك تتغير كفاءة تعامل الضد مع أي مستضد، مثل تغيير بروز في الجزء المسنن في مفتاح يؤدي إلى جعل المفتاح يناسب قفلاً آخر. أما المنطقة الثابتة للسلاسل الخفيفة للضد فهي مثل رأس المفتاح الذي يكون متطابقا من مفتاح لأخر لعلامة تجارية معينة ونوع معين ويؤدي وضيفة مشتركة لكل المفاتيح.
تؤدي المنطقة الثابتة في جزيئة الضد لنوع معين نفس الوظيفة، ففي كل جزيئة ضد من ذلك النوع، فمثلاً هناك نوعان من السلاسل الخفيفة في معظم الحيوانات الفقارية يُطبق عليهما «كابّا ولامدا» وكل جزيئة ضد يجب أن تحتوي على سلاسل خفيفة من هذا النوع أو ذاك، وفي أي نوع من الكائنات تتماثل المنطقة الثابتة للسلاسل الخفيفة (كابّا ولامدا) مع المنطقة الثابتة للسلاسل الأخرى العائدة لنفس النوع، وأكثر من ذلك فإن كل جزيئة ضد تمتلك نوعا واحداً من خمسة أنواع من السلاسل الثقيلة وهي: ألفا، غامّا، إبسيلون، ميو، ودلتا، وإن نوع السلسلة الثقيلة يحدد صنف الكريين المناعي بأنه غلوبيولين مناعي A، كريين مناعي ج، كريين مناعي هـ، كريين مناعي م، جسم مضاد. وعلى سبيل المثال، عند جميع السلاسل الثقيلة يكون للأضداد من صنف IgM نفس تتابع المنطقة الثابتة ميو، كما يكون لجميع السلاسل الخفيفة نفس تتابع المناطق الثابتة «كابّا ولامدا»، لكن من جهة أخرى تختلف المناطق المتغايرة من ضد لآخر لتعكس خواصها الوراثية المختلفة.[17]
تقوم المناطق الثابتة للسلاسل الثقيلة بتحديد الفعالية الوظيفية للضد وكيف يؤدي الضد مهمته المناعية في الجسم، فمثلاً عند النظر إلى ضد منطقته المتغايرة متخصصة بمستضد يوجد على حبوب اللقاح، فإن الضد الذي ستكونه هذه المنطقة هو IgD الذي سيبقى مرتبطا بسطح الخلية التي تكونه، إذا كانت السلسلة الثقيلة من نوع دلتا، وإذا كانت المنطقة الثقيلة غامّا فإن الضد الناتج سيكون IgG ويتوقع أن يدور في الدم وإذا كانت المنطقة الثقيلة إبسيلون فالضد هو IgE ويمكن أن يرتبط بسطح خلية معينة تفرز الهستامين الذي يسبب أعراض حمى القش أو الربو، وعندها يتدخل الضد ليتفاعل مع مستضد حبوب اللقاح. إن جميع الأضداد متخصصة نوعيا لنفس المستضد وخصوصاً مستضد حبوب اللقاح، وأكثر من ذلك فإن نفس الوظائف توجد في الأضداد الموجهة ضد مستضدات أخرى، لذلك فإن الوظيفة المؤثرة للضد لا تعتمد على المنطقة المتغايرة.
فرضية دراير وبينيت
[عدل]لقد وفرت المظاهر التركيبية للأضداد أولى الحلول للأصل الوراثي لتنوعها فقد شخّص وليم ج. دراير وج.كلود بينيت، اللذان كانا يعملان في المعهد التكنولوجي في كاليفورنيا في منتصف ستينات القرن العشرين، بأن مليونا من الأضداد المختلفة يمكن تكوينها بدمج 1000 سلسلة خفيفة مختلفة مع 1000 سلسلة ثقيلة مختلفة. ومع ذلك فأنهما تساءلا حول إمكانية تشخيص المعلومات الوراثية لهذا التنوع في البروتينات وماهو التنظيم الذي ينتسب إليه التركيب الغريب (المتغاير والثابت) في كل سلسلة.
الوظيفة
[عدل]بسبب كون الأضداد متواجدة بصورة حرة في مجرى الدم، فإنه يتم تصنيفها ضمن «جهاز المناعة الخلطي»، أي الذي يحوي الأخلاط الأربعة: الدم والبلغم والصفراء والسوداء، التي زعم القدماء أنها تقرر صحة المرء ومزاجه.[18] يتم صنع الأجسام المضادة المتواجدة في الدم من قبل الخلايا البائية المنسوخة التي تحمل مستضدا على سطحها قادرا على تمييز فقط شكل واحد معين من المادة، مثل قطعة بروتين محددة متواجدة على غلاف الفيروس.[19]
تساهم الأضداد في المناعة بعدة طرق: منع الجراثيم من الدخول إلى الخلايا أو منع نشاطها عن طريق الالتصاق بها؛ أو تقوم بتحفيز عملية إزالة جرثومة معينة بتحفيز البلاعم وخلايا أخرى تبتلع الجرثومة؛ كما وتستطيع أيضاً بدأ عملية تدمير الجرثومة بصورة مباشرة عن طريق تحفيز حواس مناعية أخرى مثل الجهاز المتمم، أو عن طريق الالتصاق بمستقبلات الأضداد على سطح بعض خلايا المناعة مثل الخلايا البدينة والتي تقوم بإفراز مواد ذات خاصية مناعية تقوم بتحفيز خلايا مناعية أخرى أو تسميم الجرثومة.
المعادلة
[عدل]
ينبغي أن تدخل الفيروسات والبكتيريا الداخلية الخلية لبدأ عملية النسخ؛ ويتمكن كل منها من الدخول إلى الخلية عن طريق الاتصال بجزيئات معينة على سطح الأخيرة. تقوم الأضداد التي تتعرف على الفيروسات بحجز قابلية هذا على الاتصال بالجزيئة المفضلة عن طريق الاتصال المباشر بها. ولا يستطيع الفيروس المحجوز أن يدخل الخلية بالتالي.[20] بعض الأضداد، مثل أجسام غلوبيولين مناعي A، تستطيع أن تتصل مباشرة بالمكروب في الغشاء المخاطي لمنع استعمار الأغشية المخاطية. وبعض الأضداد للسموم تقوم بمعادلة الأخيرة بعد الاتصال بها وحجزها.[21]
تستطيع بعض الفيروسات أن تتملص من الجهاز المناعي عندما لا يمكن معادلتها من قِبل الأضداد. فبعض الفيروسات مثل فيروس نقص المناعة البشري، لا يمكن تغطيتها بصورة كاملة من قبل ضد معادل، حيث أن في بعض الأحيان قد تقوم هذه الأضداد بمساعدة الإصابة بالفيروس بدل منعه؛ يفضل فيروس نقص المناعة البشري إصابة الخلايا التي تتصل بالأضداد.[16] خلال بعض الأمراض مثل الهربس، فإن الالتهاب يتم معالجته بصورة سريعة من قبل الجهاز المناعي، ولكن بعض الخلايا يبقى جزء من الفيروس فيها الأمر الذي يؤدي إلى بدأ الالتهاب مرة أخرى وظهور الأعراض من جديد؛ وبالتالي فلا يمكن أن يتم القضاء على الالتهاب بصورة تامة.[16]
تشغيل الجهاز المتمم
[عدل]
تقوم الأضداد التي تلتصق بسطح المستضدات، مثل البكتيريا، بجذب مكونة الجهاز المتمم أولاً عن طريق جزء «المنطقة قابلة التبلور المفتتة» (بالإنجليزية: Fragment crystallizable region, Fc region) منها والبدأ بتشغيل الجهاز المتمم التقليدي.[19] وينجم عن هذا قتل البكتيريا بطريقتين.[16] الأولى، هي عن طريق التصاق الضد والجزيئات المتممة، مما يؤشر للمكروب لأن يُبتلع من قِبل البلعميات في عملية تدعى الطهاية؛ وتُجذب هذه البلعميات من قبل بعض الجزيئات المتممة التي تتكون في الجهاز المتمم. أما الطريقة الثانية، فتكون عن طريق بعض مكونات الجهاز المتمم، التي تقوم بصنع نظام مهاجم للغشاء لمساعدة الأضداد على القضاء على البكتيريا مباشرة.[22]
تشغيل الخلايا المؤثرة
[عدل]تقوم الأضداد بالالتصاق بالجراثيم لربطها مع بعضها البعض، من أجل مقاومة تلك التي تستنسخ نفسها منها خارج الخلايا، مما يجعلها تلتصق. ولأن الأضداد لها طرفان، فإن الضد الواحد يستطيع أن يربط أكثر من مستضد واحد مع الآخر بالالتصاق مع نفس الموقع على سطح المستضد. تقوم الأضداد، عند تغليف المكروب، بلعب دور المؤثر ضد المكروب في الخلايا التي تميز جزء المنطقة قابلة التبلور المفتتة الخاص بها.[16]
يكون للخلايا التي تتعرف على مسببات الأمراض المغطاة مستقبلات للمنطقة قابلة التبلور المفتتة التي، كما يقترح الاسم، تتعرف على جزء تلك المنطقة لكل من الأضداد غلوبيولين مناعي A، كريين مناعي ج، كريين مناعي هـ. وعند ارتباط ضد معين مع أحد المستقبلات على خلية معينة، يتم تحفيز دور المؤثر لتلك الخلية؛ فالخلايا البلعمية تبدأ بالبلع، والخلايا البدينة والعدلة تبدأ بخسارة التحبب، والخلايا الفاتكة الطبيعية تبدأ بإطلاق السايتوكينات وجزيئات سم الخلايا؛ التي تنتج في النهاية بتدمير المكروب المصاب به. تكون مستقبلات المنطقة قابلة التبلور المفتتة محددة بالأبدال، وذلك يعطي مرونة كبيرة للجهاز المناعي، حيث تساعده على إطلاق استجابات مناعية محددة للمكروبات المختلفة.[23]
الاستخدامات
[عدل]الاستخدامات الطبية
[عدل]تستخدم الأضداد في تشخيص عدد من الأمراض ومعالجتها، بالإضافة إلى استخدامها في البحوث الطبية وتطبيقات عديدة أخرى.
تشخيص الأمراض
[عدل]بحال تم التقاط تركيز معين من ضد في الدم، فهذا يعطي مؤشر على إصابة الجسم بعدوى جرثومية، فيروسية، أو طفيلية، حالية أو سابقة، حيث أن تواجد المكروب (المستضد) يحفز على إنتاج الأضداد له بصورة أكبر وهذا قد يساعد الأطباء على إتخاذ الإجراءات اللازمة لمعالجة الشخص المصاب.[24] ولكن تواجد هذه الأضداد قد يستمر مدة طويلة بعد حتى بعد الشفاء من العدوى قد تمتد حتى عدة سنوات ولذلك يجب التمييز بين الأضداد الناتجة عن العدوى الحالية وبين تلك الناتجة عن عدوى سابقة بالاعتماد على عدة أمور منها تركيز الأضداد بالمصل ونوعها وتاريخ الحالة المرضية والمطابقة بين الأعراض الظاهرة على المريض ونوع المكروب المحفز على إنتاج تلك الأضداد.
معالجة الأمراض
[عدل]حقق استخدام الأضداد المستنسخة الموجهة نجاحا في معالجة أمراض مثل التهاب المفاصل الرثياني، [25] مرض التصلب اللويحي،[26] الصداف،[27] والعديد من السرطانات مثل سرطان القولون والمستقيم، سرطانات الرأس والرقبة وسرطان الثدي.[28]
الاستخدام في البحوث
[عدل]
يتم إنتاج الأضداد المحددة عن طريق حقن الثديات بالمستضد، مثل الفئران أو الجرذان أو الأرانب، في حالة الإنتاج قليل الكمية للأضداد، أو الماعز، الخرفان أو الأحصنة في حالة الإنتاج الكبير الكمية للأضداد. يحتوي الدم المعزول من هذه الحيوانات على عدة أضداد تستطيع كلها أن تتعرف على نفس المستضد، وهي تسمى بالأضداد متعددة النسخ، وتوضع في المصل، الذي يُسمّى في هذه الحالة بالمصل المضاد. يمكن حقن المستضدات في الدجاج لتكوين أضداد في صفار البيض.[29]
ينبغي عزل الخلايا اللمفاوية التي تنتج الأضداد، من أجل الحصول على ضد محدد لحاتمة من المستضد، ويتم تخليدها بدمجها مع خلية سرطانية. تدعى الخلايا المدمجة «ورما هجينا»، والتي تظل خالدة وتنمو وتنتج الأضداد في بيئة زرع الخلايا. يتم عزل الورم الهجين مفردا عن طريق الاستنساخ المخفف، لتكوين مستنسخات خلوية تنتج كلها نفس الضد؛ وعندها يتم إطلاق اسم «الضد المستنسخ» على هذه الأضداد.[30] يتم تصفية كل من الأضداد متعددة النسخ والأضداد المستنسخة باستخدام عملية فصل المواد على بروتين أ/ج مرتبط بالمستضد.[31]
الاستخدام
[عدل]تستخدم الأضداد المصفاة في الأبحاث، في العديد من التطبيقات . فهي تُستخدم لتحديد هوية ومكان البروتينات داخل وخارج الخلية. كما تستخدم في جهاز عد الخلايا للتفريق بين أنواع الخلايا من البروتينات الذي يظهر في المختبرات؛ تُظهر مختلف أنواع الخلايا مجموعات مختلفة من البروتينات أو جزيئات التمايز عن السطح، ويتم التعرف على مختلف البروتينات داخل الخلية والتي يتم إفرازها.[32] ويتم أيضاً استخدامها في الترسيب المناعي لفصل البروتينات عن أي شيء آخر ملتصق بها (الترسيب المناعي المشارك) من جزيئات أخرى في الخلية،[33] في تحاليل البلوت الغربي للتعرف على البروتينات المفصولة كهربائياً.[34] وكذلك في كيمياء الأنسجة المناعية أو التألق المناعي لفحص وجود البروتين في أقسام نسيجية أو لتحديد مكان البروتين دخل الخلاية بمساعدة المجهر.[32][35] كما يمكن أيضاً اكتشاف البروتين وتحديده مع الأضداد، باستخدام تقنية «فحص المناعي المرتبطة بالإنظيم» (بالإنجليزية: Enzyme-linked immunosorbent assay, ELISA) وتقنية «بقعة المناعي المرتبطة بالإنظيم» (بالإنجليزية: Enzyme-linked immunosorbent spot, ELISPOT).[36][37]
تاريخ
[عدل]تمّ استخدام كلمة «ضد» لأول مرة في مقالة نشرها «بول إرليخ» في أكتوبر 1891. وقد ظهرت كلمة "Antikörper" الألمانية (بمعنى جسم مضاد) في خاتمة مقالته، حيث قال: «إن كانت مادتين قد أبرزتا جسمين مضادين مختلفين إلى حيّز الوجود، فلا بد وأن تكونا أيضا مختلفتين بدورهما».[38] إلا أن هذه الكلمة لم تعتمد وتُقبل مباشرة من قبل المجتمع العلمي، حيث تم اقتراح عدد من الكلمات الأخرى.[38] إن كلمة «جسم مضاد» تعتبر مرادفة رسميا لكلمة «ترياق»، وهي ذات مفهوم مماثل لكلمة «Immunkörper - مناعي» الألمانية.[38]

بدأت دراسة الأضداد عام 1890 عندما قام «إميل فون بيرنج» و«شيباسابورو كيتاساتو» بوصف فعالية ضد سموم الكزاز والدفتيريا.وضع هذان العالمان نظرية «المناعة الخلطية»، مقترحين أن هناك متوسط في المصل الذي قد يتفاعل مع المستضد الأجنبي.[42][43] وقد دفعت فكرتهما العالم الألماني «بول إرليخ» ليقترح نظرية «السلسة الجانبية»، عام 1897، لتفسر طبيعة التفاعل بين الضد والمستضد، وفي هذه النظرية يفترض إرليخ أن المستقبلات (التي وصفها على أنها «سلاسل جانبية») الواقعة على سطح الخلايا تستطيع أن ترتبط بالذيفان المحدد الذي لا يمكن لسواه أن يرتبط بها – وذلك في علاقة «المفتاح والقفل»، وأن هذا الارتباط هو ما يحفز على إنتاج الأضداد.[44] وبالمقابل، قال باحثون أخرون أن الأضداد تتواجد بصورة حرة في مجرى الدم، وفي عام 1904، اقترح عالم البكتيريا البريطاني، السير «ألمروث رايت»، أن الأضداد القابلة للذوبان تقوم بتغليف البكتيريا وإرسالها إلى البلعمة حيث يتم القضاء عليها في عملية تدعى «الطهاية».[45]
خلال عقد العشرينات من القرن العشرين، لاحظ عالم المناعة الأمريكي، مايكل هايدلبرغر والباحث الكندي - الأمريكي أوزوالد آفري، أن الأضداد يمكن أن تقوم بترسيب وتكثيف المستضدات، وقإلا أن الأولى مكونة من البروتين.[46] تمّ إجراء أبحاث بشكل أكثر دقة على الخصائص الكيميائية الأحيائية لتفاعل ارتباط الأضداد بالمستضدات في أواخر عقد الثلاثينات من قبل البروفيسور «جون مراك».[47] أما التطور الأكبر التالي في هذا المجال، فقد حصل في عقد الأربعينات، عندما أكد الكيميائي الأمريكي «لينوس باولنغ» صحة نظرية «المفتاح والقفل» التي قال بها «بول إرليخ»، وذلك عن طريق إظهاره أن التفاعلات بين الأضداد والمستضدات تعتمد على شكلها بشكل أكبر من اعتمادها على تركيبتها الكيميائية.[48] وفي عام 1948، اكتشف «أستريد فاغريوس» أن الخلايا البائية، ذات الشكل البلازمي، هي المسؤولة عن إنتاج الأضداد.[49]
ركزت الأبحاث اللاحقة على مسألة تحديد وتمييز بنى بروتينات الأجسام المضادة. ومن أبرز التقدمات التي تحققت في هذا المجال، الاكتشاف الذي تم على يد عالم الأحياء الأمريكي «جيرالد إدلمان» و«جوزيف غالي» للسلسلة الخفيفة للضد،[50] واستنتاجهما أن هذا البروتين هو نفسه «بروتين بنس جونز» الذي وُصف عام 1845 بواسطة الكيميائي الإنكليزي «هنري بينز جونز».[51] اكتشف «إدلمان» أيضا أن الأضداد تتكون من روابط كبريتيدية متصلة بسلاسل خفيفة وثقيلة، وفي نفس الوقت تمّ تعريف مناطق ملزمات الأضداد والمنطقة قابلة التبلور المفتتة من قبل عالم الكيمياء الأحيائية الإنكليزي «رودني بورتر».[52] وقد استطاع هذان العالمان سويا أن يكملا جدلية أجسام الكريين مناعي ج الحمضية الأمينية، واستنتجا بنيتها، الأمر الذي جعلهما يفوزان سويّا بجائزة نوبل للطب لعام 1972.[52] وعلى الرغم من أن معظم هذه الدراسات الأولية ركزت على أجسام الكريين مناعي م والكريين مناعي ج (IgM وIgG)، فإن جزيئات الكريينات المناعية الأخرى تم اكتشافها وتعريفها في عقد الستينات من القرن العشرين:[53] فقد اكتشف «طوماس توماسي» الكريين مناعي أ (IgA)، كما اكتشف العالم الأمريكي «ديفيد رو» و«جون فاهاي» أجسام الكريين مناعي د (IgD)، كما اكتشف علماء أخرون الكريين مناعي هـ (IgE) على أنها طائفة من الأضداد المخصصة للدفاع عن الجسد ضد العوامل المسببة للحساسية.[54][55] حددت الدراسات الوراثية أساس التنوع الكبير لبروتينات الأضداد هذه عندما تمت إعادة تركيب أجسام مورثات الكريينات المناعية من قبل العالم الياباني «سوسومو تونيغاوا» عام 1976.[56]
النماذج
[عدل]قد يُطلق على الشكل المرتبط بالغشاء من الجسم المضاد اسم الغلوبولين المناعي السطحي (sIg) أو الغشاء المناعي الغشائي (mIg).إنه جزء من مستقبل الخلية البائية (BCR)، والذي يسمح للخلية البائية باكتشاف وجود مستضد معين في الجسم ويؤدي إلى تنشيط الخلايا البائية.يتكون BCR من أجسام مضادة IgD أو IgM مرتبطة بالسطح ومغايرات Ig-α وIg-غير المتجانسة، والتي تكون قادرة على نقل الإشارة.تحتوي الخلية البائية البشرية النموذجية على 50000 إلى 100000 جسم مضاد مرتبط بسطحها.عند ارتباط المستضد، تتجمع في بقع كبيرة، يمكن أن يتجاوز قطرها ميكرومتر واحد، على مجموعات دهنية تعزل BCRs عن معظم مستقبلات إشارات الخلايا الأخرى.قد تحسن هذه البقع من كفاءة الاستجابة المناعية الخلوية.في البشر، يكون سطح الخلية مكشوفًا حول مستقبلات الخلايا البائية لعدة مئات من النانومترات، مما يزيد من عزل BCRs عن التأثيرات المتنافسة.
تفاعلات الجسم المضاد مع المستضد
[عدل]تتفاعل الأجسام المضادة مع مستقبلات الأجسام المضادة.يحتوي المستضد عادةً على مستقبلات مختلفة على طول سطحه مرتبة بشكل متقطع، وتسمى المستقبلات السائدة على مستضد معين محددات.
يتفاعل الجسم المضاد والمستضد عن طريق التكامل المكاني (القفل والمفتاح).تعتبر القوى الجزيئية المشاركة في تفاعل حاتمة-fab ضعيفة وغير محددة - على سبيل المثال القوى الكهروستاتيكية، والروابط الهيدروجينية، والتفاعلات الكارهة للماء، وقوى فان در والز.هذا يعني أن الارتباط بين الجسم المضاد والمستضد يمكن عكسه، وأن تقارب الجسم المضاد تجاه مولد الضد نسبي وليس مطلق.يعني الارتباط الضعيف نسبيًا أيضًا أنه من الممكن لجسم مضاد للتفاعل المتبادل مع مستضدات مختلفة ذات تقارب نسبي مختلف.
في كثير من الأحيان، بمجرد ارتباط الجسم المضاد والمستضد، يصبحان معقدًا مناعيًا، يعمل ككائن موحد ويمكن أن يعمل كمستضد في حد ذاته، في مواجهة أجسام مضادة أخرى.وبالمثل، فإن الناشئة عبارة عن جزيئات صغيرة لا تثير أي استجابة مناعية من تلقاء نفسها، ولكن بمجرد ارتباطها بالبروتينات، يكون الناتج المركب أو الناشئ الناقل هو مستضدي.
الأنماط
[عدل]يمكن أن تأتي الأجسام المضادة في أنواع مختلفة تعرف باسم الأنماط أو الفئات.يوجد في الثدييات المشيمية خمسة أنواع من الأجسام المضادة تُعرف باسم IgA وIgD وIgE وIgG وIgM.يتم تسميتها ببادئة "Ig" التي تعني الغلوبيولين المناعي (وهو اسم يستخدم أحيانًا بالتبادل مع الجسم المضاد) ويختلف في الخصائص البيولوجية والمواقع الوظيفية والقدرة على التعامل مع المستضدات المختلفة، كما هو موضح في الجدول.تشير اللواحق المختلفة للأنماط المتجانسة للجسم المضاد إلى الأنواع المختلفة من السلاسل الثقيلة التي يحتوي عليها الجسم المضاد، مع تسمية كل فئة سلسلة ثقيلة أبجديًا: α (ألفا)، γ (جاما)، δ (دلتا)، ε (إبسيلون)، و μ (مو) يؤدي ذلك إلى ظهور IgM,IgE,IgD,IgG,IgA على التوالي.
| الوصف | الفئة الفرعية | الفئة |
| يوجد في الأنسجة المخاطية، في الجهاز التنفسي، الأمعاء والجهاز البولي التناسلي لمنع تجمع المستضدات، كما أنه يوجد في اللعاب،الدموع وحليب الثدي. | 2 | IgA |
| يعمل بشكل أساسي كمستقبل للخلايا البائية التي لم تتعرض لمستضد من قبل.وثبت أنه ينشط الخلايا القاعدية والخلايا الصارية على إنتاج عوامل مضادة للميكروبات | 1 | IgD |
| يرتبط بمسببات الحساسية، ويحفز الخلايا الصارية والخلايا القاعدية على إفراز الهيستامين كرد فعل للحساسية، يشارك في الحساسية ويحارب الديدان الطفيلية. | 1 | IgE |
| في أشكاله الأربعة، يشكل الغالبية العظمى من المناعة القائمة على الأجسام المضادة ضد الممرضات الغازية. هو الجسم المضاد الوحيد القادر على عبور المشيمية لمنح الجنين مناعة سلبية. | 4 | IgG |
| يتم التعبير عنه على سطح الخلايا البائية (مونومر) وفي صور مفرزة (خماسي) بنشافة عالية جدا. يزيل مسببات الأمراض في المراحل المبكرة من المناعة الخلطية بواسطة الخلايا البائية قبل أن يكون هناك ما يكفي من IgG. | 1 | IgM |
يتغير النمط المتماثل للجسم المضاد للخلية البائية أثناء تطور الخلية وتنشيطها.تعبر الخلايا البائية غير الناضجة، والتي لم تتعرض أبدًا لمستضد، عن النمط النظري IgM فقط في شكل مرتبط بسطح الخلية.تُعرف الخلايا الليمفاوية البائية، في هذا الشكل الجاهز للاستجابة، باسم «الخلايا الليمفاوية البائية الساذجة».تعبر الخلايا الليمفاوية البائية الساذجة عن كل من IgM السطحي وIgD.إن التعبير المشترك لكل من هذين النسقين المناعيين يجعل الخلية البائية جاهزة للاستجابة للمستضد.يتبع تنشيط الخلية البائية ارتباط جزيء الجسم المضاد المرتبط بالخلية مع مستضد، مما يتسبب في انقسام الخلية والتمايز إلى خلية منتجة للأجسام المضادة تسمى خلية بلازمية.في هذا الشكل المنشط، تبدأ الخلية البائية في إنتاج الجسم المضاد بشكل مفرز بدلاً من شكل مرتبط بالغشاء.تخضع بعض الخلايا الوليدة للخلايا البائية المنشطة لتبديل نمط متساوي، وهي آلية تؤدي إلى تغيير إنتاج الأجسام المضادة من IgM أو IgD إلى أنماط نظيرية أخرى من الأجسام المضادة، مثل IgE أو IgA أو IgG ، والتي لها أدوار محددة في الجهاز المناعي
| الوصف | الفئة |
|---|---|
| يوجد في الطيور والزواحف، مرتبط بالغلوبيولين المناعي ج في الثدييات. | IgY |
| يوجد في أسماك القرش والزلاجات، مرتبط بالغلوبيولين المناعي د في الثدييات. | IgW |
البنية
[عدل]الأجسام المضادة هي بروتينات بلازما كروية ثقيلة (150 كيلو دالتون).يبلغ حجم جزيء الجسم المضاد حوالي 10 نانومتر.لديهم سلاسل سكر (جليكانات) مضافة إلى بقايا الأحماض الأمينية المحفوظة.بمعنى آخر، الأجسام المضادة هي بروتينات سكرية.الجليكانات المرفقة لها أهمية حاسمة في بنية ووظيفة الجسم المضاد.من بين أشياء أخرى، يمكن للجليكانات المعبر عنها تعديل ألفة الجسم المضاد لـ (FcR (s المقابلة.
الوحدة الوظيفية الأساسية لكل جسم مضاد هي مونومر الغلوبولين المناعي (Ig) (يحتوي على وحدة Ig واحدة فقط)؛ يمكن أيضًا أن تكون الأجسام المضادة المُفرزة قاتمة مع وحدتين Ig كما هو الحال مع IgA ، أو رباعي مع أربع وحدات Ig مثل IgM في الأسماك العظمية، أو مخموسا بخمس وحدات Ig ، مثل IgM للثدييات.
الأجزاء المتغيرة من الجسم المضاد هي مناطقه V ، والجزء الثابت هو المنطقة C.
مجالات الغلوبيولين المناعي
[عدل]مونومر Ig هو جزيء على شكل "Y" يتكون من أربع سلاسل متعددة الببتيد ؛ سلسلتان ثقيلتان متطابقتان وسلاسل خفيفة متطابقة متصلة بواسطة روابط ثاني كبريتيد.تتكون كل سلسلة من مجالات هيكلية تسمى مجالات الغلوبولين المناعي. تحتوي هذه المجالات على حوالي 70-110 من الأحماض الأمينية ويتم تصنيفها إلى فئات مختلفة (على سبيل المثال، متغير أو IgV ، وثابت أو IgC) وفقًا لحجمها ووظيفتها.لديهم طية الغلوبولين المناعي المميزة حيث تخلق صفحتان بيتا شكل «شطيرة»، متماسكين معًا من خلال التفاعلات بين السيستين المحفوظة والأحماض الأمينية المشحونة الأخرى.
السلاسل الثقيلة
[عدل]انظر للمقالة الأصلية : سلسلة ثقيلة ( مناعيات )
هناك خمسة أنواع من السلسلة الثقيلة Ig للثدييات يُشار إليها بالأحرف اليونانية: α وδ وε وγ وμ.يحدد نوع السلسلة الثقيلة الموجودة فئة الجسم المضاد ؛ تم العثور على هذه السلاسل في الأجسام المضادة IgA و IgD و IgE و IgG و IgM ، على التوالي.سلاسل ثقيلة مميزة تختلف في الحجم والتكوين ؛ تحتوي α وγ على ما يقرب من 450 من الأحماض الأمينية، بينما تحتوي μ و ε على ما يقرب من 550 حمض أميني.
كل سلسلة ثقيلة لها منطقتان، المنطقة الثابتة والمنطقة المتغيرة.المنطقة الثابتة متطابقة في جميع الأجسام المضادة من نفس النمط، ولكنها تختلف في الأجسام المضادة من الأنماط النظيرية المختلفة.السلاسل الثقيلة γ و α وδ لها منطقة ثابتة تتكون من ثلاثة نطاقات ترادفية (في خط) Ig ومنطقة مفصلية لمزيد من المرونة ؛ السلاسل الثقيلة μ وε لها منطقة ثابتة تتكون من أربعة نطاقات غلوبولين مناعي.تختلف المنطقة المتغيرة للسلسلة الثقيلة في الأجسام المضادة التي تنتجها الخلايا البائية المختلفة، ولكنها واحدة بالنسبة لجميع الأجسام المضادة التي تنتجها خلية بائية واحدة أو نسخة خلية بائية.يبلغ طول المنطقة المتغيرة لكل سلسلة ثقيلة حوالي 110 من الأحماض الأمينية وتتكون من مجال Ig واحد.
السلاسل الخفيفة
[عدل]انظر للمقالة الأصلية : سلسلة خفيفة (مناعيات)
يوجد في الثدييات نوعان من سلسلة الغلوبيولين المناعي الخفيفة تسمى لامدا (λ) وكابا (κ).تحتوي السلسلة الخفيفة على مجالين متتاليين: مجال واحد ثابت ومجال متغير واحد.يبلغ الطول التقريبي للسلسلة الخفيفة من 211 إلى 217 حمضًا أمينيًا.يحتوي كل جسم مضاد على سلسلتين خفيفتين متطابقتين دائمًا ؛ يوجد نوع واحد فقط من السلاسل الخفيفة ، κ أو λ ، لكل جسم مضاد في الثدييات.توجد أنواع أخرى من السلاسل الخفيفة ، مثل سلسلة إيوتا (ι)، في الفقاريات الأخرى مثل أسماك القرش (Chondrichthyes) والأسماك العظمية (Teleostei).
مناطق Fab,CDRs,Fv,Fc
[عدل]للأجزاء المختلفة من الجسم المضاد وظائف مختلفة.على وجه التحديد ، تحتوي «الأذرع» (التي تكون متطابقة بشكل عام) على مواقع يمكن أن ترتبط بجزيئات معينة ، مما يتيح التعرف على مستضدات معينة.تسمى هذه المنطقة من الجسم المضاد منطقة Fab (جزء ، ربط مستضد).وهو يتألف من مجال واحد ثابت وآخر متغير من كل سلسلة ثقيلة وخفيفة من الجسم المضاد.يتم تشكيل المستوقع عند الطرف الأميني لمونومر الجسم المضاد بواسطة المجالات المتغيرة من السلاسل الثقيلة والخفيفة.يُشار أيضًا إلى المجال المتغير باسم منطقة FV وهي المنطقة الأكثر أهمية للارتباط بالمستضدات. لكي تكون محددًا ، فإن الحلقات المتغيرة من الخيوط ، ثلاثة في كل منها على السلاسل الخفيفة (VL) والثقيلة (VH) مسؤولة عن الارتباط بمولد الضد.يشار إلى هذه الحلقات على أنها مناطق تحديد التكامل (CDRs).تم تجميع هياكل CDRs وتصنيفها بواسطة Chothia et al.ومؤخرا بواسطة North et al.ونيكولوديس وآخرون.في إطار نظرية الشبكة المناعية، تسمى CDRs أيضًا أنماطًا ذاتية.وفقًا لنظرية الشبكة المناعية ، يتم تنظيم جهاز المناعة التكيفي من خلال التفاعلات بين الأنماط الذاتية. تلعب قاعدة Y دورًا في تعديل نشاط الخلايا المناعية.تسمى هذه المنطقة منطقة Fc (جزء ، قابل للتبلور)، وتتكون من سلسلتين ثقيلتين تساهمان في مجالين أو ثلاثة مجالات ثابتة اعتمادًا على فئة الجسم المضاد.وهكذا ، تضمن منطقة Fc أن كل جسم مضاد يولد استجابة مناعية مناسبة لمولد ضد معين ، من خلال الارتباط بفئة معينة من مستقبلات Fc ، وجزيئات مناعية أخرى ، مثل البروتينات التكميلية.من خلال القيام بذلك ، يتوسط التأثيرات الفسيولوجية المختلفة ، بما في ذلك التعرف على الجسيمات غير المتجانسة (الارتباط بـ FcγR)، وتحلل الخلايا (الارتباط بالمكمل)، وتحلل الخلايا الصارية، والخلايا القاعدية، والخلايا الحمضية (الارتباط بـ FcεR).
باختصار ، تحدد منطقة Fab من الجسم المضاد خصوصية المستضد بينما تحدد منطقة Fc من الجسم المضاد تأثير فئة الجسم المضاد.نظرًا لأن المجالات الثابتة للسلاسل الثقيلة فقط هي التي تشكل منطقة Fc من الجسم المضاد ، فإن فئات السلسلة الثقيلة في الأجسام المضادة تحدد تأثيرات فئتها. تشمل الفئات المحتملة من السلاسل الثقيلة في الأجسام المضادة alpha و gamma و delta و epsilon و mu ، وهي تحدد الأنماط النظيرية للجسم المضاد IgA و G و D و E و M على التوالي.وهذا يعني أن الأنماط المتشابهة المختلفة للأجسام المضادة لها تأثيرات فئة مختلفة بسبب ارتباط مناطق Fc المختلفة بها وتنشيط أنواع مختلفة من المستقبلات.تشمل التأثيرات الصنفية المحتملة للأجسام المضادة ما يلي: أبسونين، التراص، انحلال الدم، تنشيط المكمل ، تحلل الخلايا الصارية ، والمتعادلة (على الرغم من أن تأثير الفئة هذا يمكن توسطه بواسطة منطقة Fab بدلاً من منطقة Fc).كما يشير أيضًا إلى أن التأثيرات التي تتم بوساطة Fab موجهة إلى الميكروبات أو السموم، بينما يتم توجيه التأثيرات الوسيطة Fc إلى خلايا المستجيب أو جزيئات المستجيب (انظر أدناه).
الوظيفة
[عدل]تشمل الفئات الرئيسية لعمل الجسم المضاد ما يلي:
- التحييد، حيث تقوم الأجسام المضادة المعادلة بسد أجزاء من سطح الخلية البكتيرية أو الفيروس لجعل هجومها غير فعال.
- التراص، حيث «تلتصق» الأجسام المضادة بالخلايا الغريبة معًا في كتل تكون أهدافًا جذابة للبلعمة.
- الترسيب، حيث تلتصق الأجسام المضادة مع المستضدات القابلة للذوبان في المصل ، مما يجبرها على الخروج من المحلول في التكتلات التي تعتبر أهدافًا جذابة للبلعمة.
- تنشيط المكمل (التثبيت)، حيث تقوم الأجسام المضادة الملتصقة بخلية أجنبية بتشجيع المكمل لمهاجمتها بمركب هجوم الغشاء، مما يؤدي إلى ما يلي:
- تحلل الخلية الغريبة.
- تحفيز الالتهاب عن طريق الجذب الكيميائي للخلايا الالتهابية.
تتمايز الخلايا البائية المنشطة إلى خلايا منتجة للأجسام المضادة تسمى الخلايا البلازمية التي تفرز الأجسام المضادة القابلة للذوبان أو خلايا الذاكرة التي تعيش في الجسم لسنوات بعد ذلك للسماح لجهاز المناعة بتذكر مستضد والاستجابة بشكل أسرع عند التعرض في المستقبل.
في مراحل الحياة قبل الولادة وحديثي الولادة ، يتم توفير وجود الأجسام المضادة عن طريق التمنيع السلبي من الأم.يختلف إنتاج الأجسام المضادة الداخلية في وقت مبكر باختلاف أنواع الأجسام المضادة ، وعادة ما تظهر خلال السنوات الأولى من الحياة.نظرًا لوجود الأجسام المضادة بحرية في مجرى الدم ، يُقال إنها جزء من جهاز المناعة الخلطي.يتم إنتاج الأجسام المضادة المنتشرة بواسطة الخلايا البائية المستنسخة التي تستجيب بشكل خاص لمولد ضد واحد فقط (مثال على ذلك جزء بروتين قفيصة الفيروس).تساهم الأجسام المضادة في المناعة بثلاث طرق: تمنع مسببات الأمراض من دخول الخلايا أو إتلافها عن طريق الارتباط بها ؛ أنها تحفز إزالة مسببات الأمراض عن طريق الخلايا البلعمية والخلايا الأخرى عن طريق ترميز الممرض ؛ وتؤدي إلى تدمير مسببات الأمراض عن طريق تحفيز الاستجابات المناعية الأخرى مثل المسار التكميلي.ستؤدي الأجسام المضادة أيضًا إلى تحلل الأمين النشط في الأوعية للمساهمة في المناعة ضد أنواع معينة من المستضدات (الديدان الطفيلية ومسببات الحساسية).
تغعيل المكمل
[عدل]ستجذب الأجسام المضادة التي ترتبط بالمستضدات السطحية (على سبيل المثال ، البكتيريا) المكون الأول من السلسلة التكميلية مع منطقة Fc الخاصة بها وتبدأ تنشيط النظام التكميلي «الكلاسيكي».هذا يؤدي إلى قتل البكتيريا بطريقتين.أولاً ، إن ارتباط الجسم المضاد والجزيئات التكميلية يميز الميكروب عن طريق البلعمة في عملية تسمى طمس؛ تنجذب هذه البالعات بواسطة جزيئات مكملة معينة تم إنشاؤها في السلسلة التكميلية.ثانيًا ، تشكل بعض مكونات النظام التكميلي مركب هجوم غشائي لمساعدة الأجسام المضادة على قتل البكتيريا مباشرة (تحليل البكتيريا).
تفعيل الخلايا المنشطة
[عدل]لمكافحة مسببات الأمراض التي تتكاثر خارج الخلايا ، ترتبط الأجسام المضادة بمسببات الأمراض لربطها معًا ، مما يؤدي إلى تراصها. نظرًا لأن الجسم المضاد يحتوي على اثنين من الحواتم على الأقل ، فيمكنه ربط أكثر من مستضد واحد عن طريق ربط حواتم متطابقة محمولة على أسطح هذه المستضدات.عن طريق طلاء العامل الممرض ، تحفز الأجسام المضادة وظائف المستجيب ضد العامل الممرض في الخلايا التي تتعرف على منطقة Fc الخاصة بها. الأجسام المضادة IgE و IgA,IgG.يؤدي ارتباط جسم مضاد معين بمستقبل Fc في خلية معينة إلى تشغيل وظيفة المستجيب لتلك الخلية ؛ البلاعم سوف تتحلل ، الخلايا البدينة والعدلات سوف تتحلل ، الخلايا القاتلة الطبيعية ستطلق السيتوكينات والجزيئات السامة للخلايا ؛ سيؤدي في النهاية إلى تدمير الميكروب الغازي.يؤدي تنشيط الخلايا القاتلة الطبيعية بواسطة الأجسام المضادة إلى بدء آلية سامة للخلايا تُعرف باسم السمية الخلوية المعتمدة على الخلايا المعتمدة على الجسم المضاد (ADCC) - قد تفسر هذه العملية فعالية الأجسام المضادة أحادية النسيلة المستخدمة في العلاجات البيولوجية ضد السرطان.تكون مستقبلات Fc خاصة بالنمط المتماثل ، مما يمنح مرونة أكبر للجهاز المناعي ، ويستدعي فقط آليات المناعة المناسبة لمسببات الأمراض المتميزة.
الأجسام المضادة الطبيعية
[عدل]ينتج البشر والرئيسيات العليا أيضًا «أجسامًا مضادة طبيعية» موجودة في مصل الدم قبل العدوى الفيروسية.تم تعريف الأجسام المضادة الطبيعية على أنها أجسام مضادة يتم إنتاجها دون أي إصابة سابقة أو تلقيح أو التعرض لمستضد غريب آخر أو تحصين سلبي.يمكن لهذه الأجسام المضادة تنشيط المسار التكميلي الكلاسيكي الذي يؤدي إلى تحلل جزيئات الفيروس المغلفة قبل وقت طويل من تنشيط الاستجابة المناعية التكيفية.يتم توجيه العديد من الأجسام المضادة الطبيعية ضد ثنائي السكاريد جالاكتوز ألفا (1,3) -جالاكتوز (α-Gal)، والذي يوجد كسكر نهائي على بروتينات سطح الخلية الجليكوزيلاتي، ويتم إنتاجه استجابةً لإنتاج هذا السكر بواسطة البكتيريا الموجودة في أمعاء الإنسان.يُعتقد أن رفض الأعضاء المزروعة بالأكسجين ناتج جزئيًا عن وجود أجسام مضادة طبيعية تنتشر في مصل المستلم وترتبط بمولدات المضادات α-Gal المعبر عنها في نسيج المتبرع.
تنوع الغلوبولين المناعي
[عدل]يمكن لجميع الميكروبات تقريبًا أن تؤدي إلى استجابة الجسم المضاد.يتطلب التعرف على العديد من الأنواع المختلفة من الميكروبات والقضاء عليها بنجاح تنوعًا بين الأجسام المضادة ؛ يختلف تكوين الأحماض الأمينية الخاصة بهم مما يسمح لهم بالتفاعل مع العديد من المستضدات المختلفة.تشير التقديرات إلى أن البشر يولدون حوالي 10 مليارات من الأجسام المضادة المختلفة ، كل منها قادر على ربط حاتمة مميزة لمولد ضد.على الرغم من أن ذخيرة ضخمة من الأجسام المضادة المختلفة يتم إنشاؤها في فرد واحد ، فإن عدد الجينات المتاحة لصنع هذه البروتينات محدود بحجم الجينوم البشري.تطورت العديد من الآليات الجينية المعقدة التي تسمح للخلايا البائية الفقارية بتوليد مجموعة متنوعة من الأجسام المضادة من عدد صغير نسبيًا من جينات الجسم المضاد.
تقلبية المجالات
[عدل]المنطقة الكروموسومية التي تشفر الجسم المضاد كبيرة وتحتوي على عدة مواضع جينية مميزة لكل مجال من مجالات الجسم المضاد - توجد منطقة الكروموسوم التي تحتوي على جينات ثقيلة السلسلة (IGH) في الكروموسوم 14 ، والمواقع التي تحتوي على جينات السلسلة الخفيفة لامدا وكابا (IGL وIGK) موجودان في الكروموسومات 22 و2 في البشر.يُطلق على أحد هذه المجالات اسم المجال المتغير، الموجود في كل سلسلة ثقيلة وخفيفة من كل جسم مضاد ، ولكن يمكن أن يختلف في الأجسام المضادة المختلفة المتولدة من الخلايا البائية المميزة.توجد الاختلافات ، بين المجالات المتغيرة ، في ثلاث حلقات تُعرف باسم المناطق شديدة التغير (HV-1 وHV-2 وHV-3) أو مناطق تحديد التكامل (CDR1 وCDR2 وCDR3).يتم دعم CDRs داخل المجالات المتغيرة بواسطة مناطق إطار العمل المحفوظة.يحتوي موضع السلسلة الثقيلة على حوالي 65 جينًا مختلفًا للنطاق المتغير تختلف جميعها في CDR الخاصة بها.يؤدي دمج هذه الجينات مع مجموعة من الجينات لمجالات أخرى من الجسم المضاد إلى تكوين سلاح كبير من الأجسام المضادة بدرجة عالية من التباين.هذا المزيج يسمى إعادة التركيب V (D) J الذي تمت مناقشته أدناه.
إعادة تركيب V (D) J
[عدل]يتضمن إعادة التركيب الجسدي للجلوبيولين المناعي ، المعروف أيضًا باسم إعادة التركيب V (D) J ، إنتاج منطقة متغيرة فريدة من الجلوبيولين المناعي.يتم ترميز المنطقة المتغيرة لكل سلسلة ثقيلة أو خفيفة من الجلوبيولين المناعي في عدة أجزاء - تُعرف باسم المقاطع الجينية (الجينات الفرعية).تسمى هذه المقاطع المتغيرة (V) والتنوع (D) والانضمام (J).تم العثور على مقاطع V و D و J في سلاسل Ig الثقيلة ، ولكن تم العثور على مقاطع V و J فقط في سلاسل Ig الخفيفة.توجد نسخ متعددة من شرائح الجينات V و D و J ، ويتم ترتيبها جنبًا إلى جنب في جينومات الثدييات.في نخاع العظم، ستجمع كل خلية بائية نامية منطقة متغيرة من الجلوبيولين المناعي عن طريق الاختيار العشوائي والجمع بين جزء واحد من الجين V و D و J واحد (أو جزء واحد V و J واحد في السلسلة الخفيفة).نظرا لوجود نسخ متعددة من كل نوع مقاطع الجينات، ويمكن استخدام مجموعات مختلفة من مقاطع الجينات لتوليد كل منطقة متغيرة من الجلوبولين المناعي، فإن هذه العملية تولد عددا كبيرا من الأجسام المضادة، لكل منها حواتم مختلفة، وبالتالي خصائص مستضد مختلفة.يقترن إعادة ترتيب العديد من الجينات الفرعية (مثل عائلة V2) للغلوبولين المناعي لسلسلة لامدا الخفيفة مع تنشيط microRNA miR-650، مما يؤثر بشكل أكبر على بيولوجيا الخلايا البائية.
تلعب بروتينات RAG دورًا مهمًا في إعادة التركيب V (D) J في قطع الحمض النووي في منطقة معينة.بدون وجود هذه البروتينات، لن يحدث إعادة التركيب V (D) J.
بعد أن تنتج الخلية البائية جينًا وظيفيًا للجلوبيولين المناعي أثناء إعادة التركيب V (D) J ، لا يمكنها التعبير عن أي منطقة متغيرة أخرى (عملية تُعرف باسم الاستبعاد الأليلي) وبالتالي يمكن لكل خلية بائية إنتاج أجسام مضادة تحتوي على نوع واحد فقط من السلسلة المتغيرة.
انظر أيضًا
[عدل]المصادر
[عدل]- ^ مذكور في: نظام فهرسة المواضيع الطبية. مُعرِّف نظام فهرسة المواضيع الطبية (MeSH): D000906. الوصول: 12 نوفمبر 2020. لغة العمل أو لغة الاسم: الإنجليزية. المُؤَلِّف: المكتبة الوطنية لعلم الطب.
- ^ مذكور في: نظام فهرسة المواضيع الطبية. مُعرِّف نظام فهرسة المواضيع الطبية (MeSH): D007136. الوصول: 15 مارس 2018. لغة العمل أو لغة الاسم: الإنجليزية. المُؤَلِّف: المكتبة الوطنية لعلم الطب.
- ^ المعجم الموحد لمصطلحات علم الأحياء، سلسلة المعاجم الموحدة (8) (بالعربية والإنجليزية والفرنسية)، تونس: مكتب تنسيق التعريب، 1993، ص. 30، OCLC:929544775، QID:Q114972534
- ^ قاموس المورد، البعلبكي، بيروت، لبنان.
- ^ كتاب الأحياء للصف الثاني ثانوي علمي، المملكة الأردنية الهاشمية، طبعة عام 1997، صفحة 247
- ^ المعاني، تاريخ الولوج 26 نوفمبر 2014 نسخة محفوظة 17 يناير 2015 على موقع واي باك مشين.
- ^ جامعة أم القرى، تاريخ الولوج 26 نوفمبر 2014 نسخة محفوظة 14 أبريل 2015 على موقع واي باك مشين.
- ^ نزار مصطفى الملاح، معجم الملاح في مصطلحات علم الحشرات (بالعربية والإنجليزية)، الموصل: جامعة الموصل، ص. 68، QID:Q118929029
- ^ المعجم الطبي الموحد
- ^ Litman GW, Rast JP, Shamblott MJ (1993). "Phylogenetic diversification of immunoglobulin genes and the antibody repertoire". Mol. Biol. Evol. ج. 10 ع. 1: 60–72. PMID:8450761.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Eleonora Market, F. Nina Papavasiliou (2003) V(D)J Recombination and the Evolution of the Adaptive Immune System PLoS Biology1(1): e16. نسخة محفوظة 16 فبراير 2008 على موقع واي باك مشين.
- ^ Mattu T, Pleass R, Willis A, Kilian M, Wormald M, Lellouch A, Rudd P, Woof J, Dwek R (1998). "The glycosylation and structure of human serum IgA1, Fab, and Fc regions and the role of N-glycosylation on Fc alpha receptor interactions". J Biol Chem. ج. 273 ع. 4: 2260–72. DOI:10.1074/jbc.273.4.2260. PMID:9442070.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Woof J, Burton D (2004). "Human antibody-Fc receptor interactions illuminated by crystal structures". Nat Rev Immunol. ج. 4 ع. 2: 89–99. DOI:10.1038/nri1266. PMID:15040582.
- ^ Underdown B, Schiff J, Immunoglobulin A: strategic defense initiative at the mucosal surface. Annu Rev Immunol 4 389-417.1986 PMID=3518747
- ^ ا ب Geisberger R, Lamers M, Achatz G, The riddle of the dual expression of IgM and IgD. Immunology 118 4 429-37. 2006. ببمد: 16895553
- ^ ا ب ج د ه و ز Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 1-55581-246-5.
- ^ Goding J (1978). "Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation". Contemp Top Immunobiol. ج. 8: 203–43. PMID:357078.
- ^ قاموس المورد، منير البعلبكي، 1994، دار العلم للملايين، صفحة: 438
- ^ ا ب Ravetch J, Bolland S (2001). "IgG Fc receptors". Annu Rev Immunol 19: 275-90.
- ^ Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunol Res. ج. 33 ع. 2: 103–12. DOI:10.1385/IR:33:2:103. PMID:16234578.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Chippaux J, Goyffon M (1998). "Venoms, antivenoms and immunotherapy". Toxicon 36 (6): 823-46
- ^ Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunol Res 33 (2): 103-12. ببمد: 16234578.
- ^ Janeway CA, Jr et al (2001). Immunobiology., 5th ed., Garland Publishing. ISBN 0-8153-3642-X.
- ^ Stern P (2006). "Current possibilities of turbidimetry and nephelometry" (PDF). Klin Biochem Metab. ج. 14 ع. 3: 146–151. مؤرشف من الأصل (PDF) في 2008-02-27.
- ^ Feldmann M, Maini R (2001). "Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned?". Annu Rev Immunol 19: 163-96. ببمد: 11244034
- ^ Doggrell S (2003). "Is natalizumab a breakthrough in the treatment of multiple sclerosis?". Expert Opin Pharmacother 4 (6): 999-1001. ببمد: 12783595.
- ^ Krueger G, Langley R, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley L, Lebwohl M (2007). "A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis". N Engl J Med 356 (6): 580-92. ببمد: 17287478.
- ^ Vogel C, Cobleigh M, Tripathy D, Gutheil J, Harris L, Fehrenbacher L, Slamon D, Murphy M, Novotny W, Burchmore M, Shak S, Stewart S (2001). "First-line Herceptin monotherapy in metastatic breast cancer". Oncology 61 Suppl 2: 37-42. ببمد: 11694786.
- ^ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M (2002). "Generation and application of chicken egg-yolk antibodies". Comp. Biochem. Physiol., Part A Mol. Integr. Physiol. 131 (3): 569-74. ببمد: 11867282.
- ^ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC (1984). "Human monoclonal antibodies". Mol. Cell. Biochem. 62 (2): 109-20. ببمد: 6087121.
- ^ Kabir S (2002). "Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis". Immunol Invest 31 (3-4): 263-78. ببمد: 12472184.
- ^ ا ب Brehm-Stecher B, Johnson E (2004). "Single-cell microbiology: tools, technologies, and applications". Microbiol Mol Biol Rev 68 (3): 538-59. ببمد: 15353569.
- ^ Williams N (2000). "Immunoprecipitation procedures". Methods Cell Biol 62: 449-53. ببمد: 10503210.
- ^ Kurien B, Scofield R (2006). "Western blotting". Methods 38 (4): 283-93. ببمد: 16483794.
- ^ Scanziani E. "Immunohistochemical staining of fixed tissues". Methods Mol Biol 104: 133-40. ببمد: 9711649.
- ^ Reen DJ. (1994). "Enzyme-linked immunosorbent assay (ELISA).". Methods Mol Biol. 32: 461-6. ببمد: 7951745.
- ^ Kalyuzhny AE (2005). "Chemistry and biology of the ELISPOT assay". Methods Mol Biol. 302: 15-31. ببمد: 15937343.
- ^ ا ب ج Lindenmann, Jean (1984). "Origin of the Terms 'Antibody' and 'Antigen'". Scand. J. Immunol. ج. 19 ع. 4: 281–5. PMID:6374880. مؤرشف من الأصل في 2020-03-27. اطلع عليه بتاريخ 2008-11-01.
- ^ "New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus". مؤرشف من الأصل في 2019-01-14. اطلع عليه بتاريخ 2008-12-12.
- ^ Padlan، Eduardo (1994). "Anatomy of the antibody molecule". Mol. Immunol. 31(3): 169–217. DOI:10.1016/0161-5890(94)90001-9.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|شهر=تم تجاهله يقترح استخدام|تاريخ=(مساعدة) - ^ "Protein sculpture inspired by Vitruvian Man". مؤرشف من الأصل في 2019-05-10. اطلع عليه بتاريخ 2008-12-12.
- ^ Emil von Behring - Biography. Retrieved on 2007-06-05.
- ^ "The Late Baron Shibasaburo Kitasato". Canadian Medical Association Journal: 206.
- ^ Winau F, Westphal O, Winau R (2004). "Paul Ehrlich--in search of the magic bullet". Microbes Infect. ج. 6 ع. 8: 786–9. DOI:10.1016/j.micinf.2004.04.003. PMID:15207826.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Silverstein AM (2003). "Cellular versus humoral immunology: a century-long dispute". Nat. Immunol. ج. 4 ع. 5: 425–8. DOI:10.1038/ni0503-425. PMID:12719732.
- ^ Van Epps HL (2006). "Michael Heidelberger and the demystification of antibodies" (PDF). J. Exp. Med. ج. 203 ع. 1: 5. DOI:10.1084/jem.2031fta. PMC:2118068. PMID:16523537. مؤرشف من الأصل في 2008-08-09.
- ^ Marrack، JR (1938). Chemistry of antigens and antibodies (ط. 2nd). London: His Majesty's Stationery Office. OCLC:3220539.
- ^ "The Linus Pauling Papers: How Antibodies and Enzymes Work". مؤرشف من الأصل في 2019-05-08. اطلع عليه بتاريخ 2007-06-05.
- ^ Silverstein AM (2004). "Labeled antigens and antibodies: the evolution of magic markers and magic bullets" (PDF). Nat. Immunol. ج. 5 ع. 12: 1211–7. DOI:10.1038/ni1140. PMID:15549122. مؤرشف من الأصل (PDF) في 2012-02-06. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Edelman GM, Gally JA (1962). "The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins". J. Exp. Med. ج. 116: 207–27. DOI:10.1084/jem.116.2.207. PMC:2137388. PMID:13889153.
- ^ Stevens FJ, Solomon A, Schiffer M (1991). "Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology". Biochemistry. ج. 30 ع. 28: 6803–5. DOI:10.1021/bi00242a001. PMID:2069946.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ا ب Raju TN (1999). "The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85)". Lancet. ج. 354 ع. 9183: 1040. PMID:10501404.
- ^ Tomasi TB (1992). "The discovery of secretory IgA and the mucosal immune system". Immunol. Today. ج. 13 ع. 10: 416–8. DOI:10.1016/0167-5699(92)90093-M. PMID:1343085.
- ^ Johansson SG (2006). "The discovery of immunoglobulin E". Allergy and asthma proceedings : the official journal of regional and state allergy societies. ج. 27 ع. 2 Suppl 1: S3–6. PMID:16722325.
- ^ Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E (2000). "Structural and functional properties of membrane and secreted IgD". Mol. Immunol. ج. 37 ع. 15: 871–87. DOI:10.1016/S0161-5890(01)00006-2. PMID:11282392.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Hozumi N, Tonegawa S (1976). "Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions". Proc. Natl. Acad. Sci. U.S.A. ج. 73 ع. 10: 3628–32. DOI:10.1073/pnas.73.10.3628. PMC:431171. PMID:824647.
وصلات خارجية
[عدل]- غلوبيولين مايك المناعي/دالة الصفحة في جامعة كامبريدج.
- الأجسام المضادة كجزيئ الشهر لبنك معلومات البروتين مناقشة بُنى الأجسام المضادة في بنك معلومات البروتين.
- موقع حول علم الأحياء المجهري وعلم المناعة في جامعة كارولاينا الجنوبية.
- قرن من العلاج بستخدام الأجسام المضادة تاريخ وتطبيقات العلاج باستخدام الأجسام المضادة في جامعة أوكسفورد.
- كيفية إنتاج الخلايا اللمفية للأضداد من الخلايا الحية!
- تطبيقات الأضداد مكتبة الصور الفلورية للأجسام المضادة، جامعة بيرمنغهام.