أسيتات الصوديوم: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
تم حذف المحتوى تمت إضافة المحتوى
Mr.Ibrahembot (نقاش | مساهمات) ط بوت: تعريب |
تعديل وصلة |
||
| سطر 67: | سطر 67: | ||
* عند [[درجة حرارة]] قدرها 123°س يفقد المركب [[جزيء|جزيئات]] الماء المرتبطة به. |
* عند [[درجة حرارة]] قدرها 123°س يفقد المركب [[جزيء|جزيئات]] الماء المرتبطة به. |
||
== التحضير == |
== التحضير == |
||
يحضر هذا الملح من [[تعديل]] [[حمض خليك|حمض الخل]] ب[[كربونات صوديوم|كربونات الصوديوم]] ثم بتبخير المحلول الناتج |
يحضر هذا الملح من [[تفاعل تعديل]] [[حمض خليك|حمض الخل]] ب[[كربونات صوديوم|كربونات الصوديوم]] ثم بتبخير المحلول الناتج |
||
<center>2H<sub>3</sub>C - COOH + Na<sub>2</sub>CO<sub>3</sub> → 2H<sub>3</sub>C - COO <sup>-</sup> Na <sup>+</sup> + CO<sub>2</sub> + H<sub>2</sub>O |
<center>2H<sub>3</sub>C - COOH + Na<sub>2</sub>CO<sub>3</sub> → 2H<sub>3</sub>C - COO <sup>-</sup> Na <sup>+</sup> + CO<sub>2</sub> + H<sub>2</sub>O |
||
نسخة 20:17، 7 سبتمبر 2017
| أسيتات الصوديوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
أسيتات صوديوم |
|
| أسماء أخرى | |
خلات صوديوم إيثانوات صوديوم |
|
| المعرفات | |
| رقم CAS | 127-09-3? 6131-90-4 (خماسي هيدرات) |
| بوب كيم | 517045 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | CH3COO - Na + .3H2O |
| الكتلة المولية | 82.04 غ/مول (بلاماء) 136.08 غ/مول (ثلاثي هيدرات) |
| المظهر | مسحوق أبيض متسيل |
| الكثافة | 1.53 غ/سم3 |
| نقطة الانصهار | 324 °س |
| نقطة الغليان | يتفكك |
| الذوبانية في الماء | 76 غ/100 مل ماء عند 0 °س
125 غ/100 مل ماء عند 20 °س 170 غ/100 مل ماء عند 100 °س |
| المخاطر | |
| توصيف المخاطر | لا يوجد |
| تحذيرات وقائية | لا يوجد |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
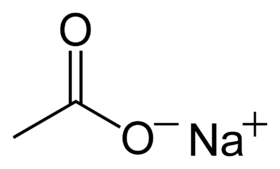
خلات الصوديوم أو أسيتات الصوديوم مركب كيميائي له الصيغة المجملة C2H3NaO2 ، ويكتب عادة بالصيغة CH3COO - Na + .3H2O ، أو يمكن كتابتها بالشكل التالي Na(CH3COO) · 3 H2O.
الخواص
- يترسب من المحلول على شكل بلورات شفافة عديمة اللون، منحلة بالماء 125 غ / 100 مل ، لكنها منحلة بشكل أقل في الإيثانول 5 غ / 100 مل .
- يتشرد هذا الملح بشكل تام في المحاليل المائية، ومحلول 0.1 مولي يكون له أس هيدروجيني مقداره 8.9 .
- عند درجة حرارة قدرها 123°س يفقد المركب جزيئات الماء المرتبطة به.
التحضير
يحضر هذا الملح من تفاعل تعديل حمض الخل بكربونات الصوديوم ثم بتبخير المحلول الناتج
الاستخدامات
- له العديد من التطبيقات المخبرية في الكيمياء التحليلية، على سبيل المثال في محاليل موقية (buffer) وذلك لضبط أس هيدروجيني الوسط.
- يستخدم بشكله اللامائي كمادة ساحبة للماء في الاصطناع العضوي.
- له تطبيق في الوسائد الحرارية ، والتي تحوي محلول فوق مشبع من هذا الملح والذي يمتاز بأن له القدرة على التبرد السريع لدرجة حرارة الغرفة دون أن يشكل بلورات.
بالضغط على قرص معدني في الوسادة تتشكل نواة تبلور مما يؤدي إلى تبلور المحلول بكامله. وبما أن عملية بلورة هذا الملح ناشرة للحرارة نحصل على الحرارة المطلوبة.
- يستخدم كمادة منظمة للحموضة في الإضافات الغذائية E 262 .

المصادر
- ^ أ ب ت Sodium acetate (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
| في كومنز صور وملفات عن: أسيتات الصوديوم |