فيروس: الفرق بين النسختين
| [مراجعة غير مفحوصة] | [مراجعة غير مفحوصة] |
| سطر 543: | سطر 543: | ||
===علم المواد والتكنولوجيا النانوية=== |
===علم المواد والتكنولوجيا النانوية=== |
||
=== الأسلحة === |
=== الأسلحة === |
||
{{مقال تفصيلي|سلاح بيولوجي}} |
|||
قدرة الفيروسات على خلق [[وباء|أوبئة مدمرة]] في المجتمعات البشرية أدت إلى القلق من اٍستخدامها لصنع [[سلاح بيولوجي|اسلحة بيولوجية]]. علاوة على القلق بعد اٍعادة التخليق الناجحة لفيروس أنفلونزا 1918 المشين في المختبر. <ref>Shors p. 331</ref> فيروس ال[[جدري]] دمر العديد من المجتمعات على مر التاريخ قبل القضاء عليه. رسميا هناك مركزين فقط في العالم تبقي على مخزونات فيروس الجدري '''المختبر الروسي للنواقل''' و '''مراكز الولايات المتحدة للسيطرة على الأمراض'''.<ref name="pmid18844596">{{cite journal | author = Artenstein AW, Grabenstein JD | title = Smallpox vaccines for biodefense: need and feasibility | journal = Expert Review of Vaccines | volume = 7 | issue = 8 | pages = 1225–37 | year = 2008 | month = October | pmid = 18844596 | doi = 10.1586/14760584.7.8.1225 | url = http://www.future-drugs.com/doi/abs/10.1586/14760584.7.8.1225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dncbi.nlm.nih.gov | issn = | accessdate = 12 July 2009}}</ref> لكن المخاوف من أنها يمكن أن تستخدم كسلاح لا أساس لها على الاطلاق.<ref name="pmid18844596"/> لقاح الجدرى ليس آمن--خلال سنوات قبل اٍستئصال مرض الجدري أصبح المزيد من الناس مصابين جديا نتيجة التطعيم<ref name="pmid12911836">{{cite journal |
|||
|author=Aragón TJ, Ulrich S, Fernyak S, Rutherford GW |
|||
|title=Risks of serious complications and death from smallpox vaccination: a systematic review of the United States experience, 1963–1968 |
|||
|journal=BMC public health |
|||
|volume=3 |
|||
|page=26 |
|||
|year=2003 |
|||
|pmid=12911836 |
|||
|doi=10.1186/1471-2458-3-26 |
|||
|pages=26}}</ref>--والتطعيم ضد الجدري لم يعد يمارس عالميا.<ref name="pmid15578369">{{cite journal |
|||
|author=Weiss MM, Weiss PD, Mathisen G, Guze P |
|||
|title=Rethinking smallpox |
|||
|journal=Clin. Infect. Dis. |
|||
|volume=39 |
|||
|issue=11 |
|||
|pages=1668–73 |
|||
|year=2004 |
|||
|pmid=15578369 |
|||
|doi=10.1086/425745}}</ref> وبالتالي ، فإن الكثير من البشر الحديثين (المولودين بعد اٍستئصال المرض) يكادون لا يملكون أي مناعة ضد مرض الجدري.<ref name="pmid18844596"/> |
|||
== المراجع == |
== المراجع == |
||
<div class="reflist4" style="height: 220px; overflow: auto; padding: 3px" > |
<div class="reflist4" style="height: 220px; overflow: auto; padding: 3px" > |
||
نسخة 11:55، 11 ديسمبر 2009
لا يزال النص الموجود في هذه الصفحة في مرحلة الترجمة إلى العربية. |
الفيروسات | |
|---|---|
| المرتبة التصنيفية | نطاق |
| تصنيف الفيروسات | |
| المجموعة: | I–VII |
| الاسم العلمي | |
| Virus | |
| المجموعات | |
| I: فيروسات ذات الدنا ثنائي السلسلة II: فيروسات ذات الدنا أحادي السلسلة |
|
| تعديل مصدري - تعديل | |
الفيروسات أو الحُمَات مفردها فيروس أو حُمَة (بالإنكليزية: Virus) و تعني فيروس في اليونانية (ذيفان أو سم) وهو عامل ممراض صغير لا يمكنه التكاثر اٍلا داخل خلايا كائن حي آخر. الفيروسات صغيرة جدا ولا يمكن مشاهدتها بالمجهر الضوئي. تصيب الفيروسات جميع أنواع الكائنات الحية، من الحيوانات و النباتات اٍلى البكتيريا و العتائق.[1] منذ الاٍكتشاف الأولي لفيروس تبرقش التبغ من قبل مارتينوس بيجيرينك عام 1898،[2] وصفت حوالي 5.000 من الفيروسات بالتفصيل،[3] على الرغم من أن هناك الملايين من الأنواع المختلفة.[4] الفيروسات موجودة تقريبا في كل النظم الإيكولوجية على الأرض ، وتعتبر هذه الهياكل الدقيقة (الفيروسات) الكيان البيولوجي الأكثر وفرة في الطبيعة.[5][6] دراسة الفيروسات معروفة بعلم الفيروسات ، و هو تخصص فرعي في علم الأحياء الدقيقة.
خلافا للبريونات و أشباه الفيروسات، تتكون الفيروسات من جزئين أو ثلاثة: كل الفيروسات لها مورثات مكونة من دنا أو رنا، (جزيئات طويلة تحمل المعلومات الجينية) كما لها غلاف بروتيني يحمي هذه الجينات; وبعضها محاطة بغلاف دهني يحيط بها عندما تكون خارج الخلية المضيفة. أشباه الفيروسات لا تملك غلافا بروتينيا و البريونات ليس لها دنا أو رنا. تختلف أشكال الفيروسات من بسيطة كالولبية و عشرونية الوجوه، اٍلى بنى معقدة جدا. معظم الفيروسات أصغر من البكتيريا المتوسطة بحوالي مائة مرة. يبقى أصل الفيروسات في تاريخ تطور الحياة غير واضح، بعضها ربما تطور من البلازميدات (جزيئات من الدنا يمكنها الاٍنتقال من خلية لأخرى) في حين يمكن لأخرى أن تكون تطورة من البكتيريا. في التطور، الفيروسات جزء مهم في نقل الجينات الأفقي، مما يزيد التنوع الجيني.[7]
تنتشر الفيروسات بالعديد من الطرق، تنتقل فيروسات النبات من نبات إلى آخر غالبا عن طريق الحشرات التي تتغذى على النسغ، مثل المن، في حين أن فيروسات الحيوان يمكن أن يحملها دم الحشرات الماصة. هذه الكائنات الحية الحاملة للمرض هي المعروفة باسم النواقل. فيروس الاٍنفلونزا ينتشر عن طريق السعال والعطس. الفيروسة العجلية تسبب التهاب المعدة والأمعاء الفيروسي، تنتقل عبر الطريق الفموي الشرجي وتنتقل كذلك من شخص إلى آخر عن طريق الاتصال، وتدخل الجسم مع الطعام أو الماء. فيروس نقص المناعة البشرية هو واحد من الفيروسات المنقولة عن طريق الجنس، أو التعرض لدم مصاب بالعدوى (مثلا عن طريق الحقن).
العدوى الفيروسية لدى الحيوانات تثير الاٍستجابة المناعية التي عادة ما تقضي على هذا الفيروس المعدى. هذه الاٍستجابة المناعية يمكن أيضا أن تكون ناتجة عن اللقاحات و التي تمنح حصانة ضد الإصابة بفيروس معين. ومع ذلك ، بعض الفيروسات بما فيها فيروس نقص المناعة البشرية و تلك التي تسبب الاٍلتهاب الكبدي الفيروسي يمكنها التملص من هذه الاٍستجابة المناعية ، و تسبب التهابات مزمنة. الكائنات المجهرية أيضا تملك دفاعات ضد العدوى الفيروسية، مثل نظم تعديل القيد.
المضادات الحيوية ليس لها أي تأثير على الفيروسات. لكن تم تطوير بضعة أدوية مضادة للفيروسات. هناك عدد قليل منها نسبيا لأن هناك عدد قليل من الأهداف لهذه العقاقير لتتداخل معها. هذا لأن الفيروس يعيد برمجة خليته المضيفة لاٍنتاج فيروسات جديدة ، وجعل تقريبا كل البروتينات المستعملة في هذه العملية جزء طبيعي من الجسم، مع عدد قليل فقط من البروتينات الفيروسية.
أصل الكلمة
الكلمة من اللاتينية virus تشير اٍلى السم وغيره من المواد الضارة، أول اٍستعمال لها في الاٍنجليزية كان في 1392.[8] ومعناها "العامل المسبب للأمراض المعدية" لأول مرة في 1728، [8] وذلك قبل اكتشاف الفيروسات من قبل ديمتري إيفانوفسكي في عام 1892. صفة viral (فيروسي) تعود لعام 1948.[9] مصطلح virion (فيريون) يستخدم أيضا للدلالة على الجسم الفيروسي المعدي الوحيد. ومجموعها فيروسات.
تاريخ علم الفيروسات

اكتشفت الفيروسات صدفه في أثناء اجراء العالم أدولف ماير سنة 1883، بحوثا على تبرقش أوراق التبغ، فتوصل إلى وجود دقائق أصغر من البكتيريا تسبب المرض. عام 1884، قام عالم الأحياء الدقيقة الفرنسي شارل شمبرلند اٍخترع مصفاة (تعرف اليوم بمصفاة شمبرلند أو مصفاة شمبرلند-باستور) مع مسام أصغر من البكتيريا. وبالتالي ، يمكنه تمرير محلول يحتوي على البكتيريا و تصفيته وإزالتها تماما منه.[10] ثم تبعه العالم الروسي ديمتري ايفانوفسكي سنة 1892م ، الذي تمكن من تصفية عصارة أوراق التبغ المصابة باستخدام مرشحات خاصة لا تسمح للبكتيريا بالمرور، و مسح بها اوراق غير مصابة فلاحظ اصابتها. و هو أول من أطلق عليها اسم فايرس، ويعني باللاتينية السم و هي عبارة عن جزيئات بسيطة و صغيرة في الحجم، تعتبر الفيروسات إحدى أهم المعضلات التي تواجه التصنيف الحيوي فهي لا تمثل كائنات حية لذلك توصف غالبا بالجسيمات المعدية infectious particles لكنها بالمقابل تبدي بعض خصائص الحياة مثل القدرة على التضاعف و التكاثر بالاستعانة بخلايا المضيف التي تم السيطرة عليها من قبل الفيروس . تقوم الفيروسات بالاستعانة بآليات الخلايا الحيوية عن طريق دس الدنا أو الرنا الفيروسي ضمن المادة الوراثية للخلايا الحية . لكن بالمقابل الفيروسات لا تتحرك و لا تقوم بعمليات استقلاب أو تحلل من تلقاء نفسها ، إنها في منطقة وسطى بين الحياة و اللاحياة .
و يبقى تعريف الحياة نفسه غير محدد بدقة ، فبعض الجسيمات مثل ريكتسيا rickettsia تبدي مظاهر الحياة و اللاحياة .
و أكتشف أول فيروس يصيب الفقاريات و هو فيروس القدم و الفم foot and mouth disease virus في عام 1898 م كل من العالم لوفلر Loeffler و العالم فروش frosch و العالم كوخ koch .
و أكتشف العالم ريد reed و العالم كارول carrol أول فيروس يصيب الإنسان و هو فيروس الحمى الصفراء yellow fever virus .
الأصل و المنشأ
توجد الفيروسات حيث توجد الحياة، وربما تكون قد وجدت منذ تطور الخلايا الحية الأولى.[11] أصل الفيروسات غير واضح لأنها لم تشكل حفريات، لذلك فالتقنيات الجزيئية كانت وسيلة مفيدة للغاية للتحقيق في كيفية نشوئها.[12] هذه التقنيات تعتمد على توافر الدنا أو الرنا الفيروسي القديم، لكن لسوء الحظ فإن معظم الفيروسات التي تم حفظها وتخزينها في المختبرات تعود لأقل من 90 عاما.[13][14] هناك ثلاث فرضيات رئيسية تحاول تفسير نشأة الفيروسات :[15][16]
فرضية التقهقر
وتنص على أنه ربما كانت الفيروسات خلايا صغيرة تتطفل على الخلايا الأكبر. بمرور الوقت، فقدت الجينات التي لا تحتاج إليها في التطفل. يدعم هذه الفرضية بكتيريا الريكتسيا و الكلاميديا التي هي خلايا حية يمكنها التكاثر فقط داخل خلية مضيفة مثل الفيروسات. واعتمادها على التطفل من المحتمل أن يكون هو سبب خسارة الجينات التي تمكنها من البقاء على قيد الحياة خارج الخلية. هذا ما يسمى أيضا فرضية الانحطاط.[17][18]
أي أن الفيروسات نشأت نتيجة تطور رجعي لكائنات دقيقة كانت تعيش معيشة حرة . فكانت كائنات حية دقيقة خلوية و تطورت رجعيا لتفقد أشكالها و تراكيبها الأصليه ثم أصبحت جزيئات متطفلة إجبارياً على كائنات أخرى ( فيروسات ) .
فرضية المنشأ الخلوي
و تنص على أن بعض الفيروسات قد تطورت من أجزاء "ناجية" من الدنا أو الرنا لجينات وراثية لكائنات أكبر. الدنا الناجي يمكن أن يأتي من البلازميدات (قطعة من الدنا المجرد التي يمكن أن تنتقل بين الخلايا) أو من ينقولات (جزيئات الدنا التي تتكرر و تنتقل بين أماكن مختلفة داخل جينات الخلية)[19]. الينقولات هي مثال على العناصر الوراثية المتحركة و يمكن أن تكون أصل لبعض الفيروسات، سميت أولا "جينات القفز". اٍكتشفت في الذرة من قبل بربرة مكلنتوك عام 1950.[20] وهذا مايسمى أحيانا فرضية التشرد.[17][21]
أي أن الفيروسات مشتقة من المكونات الطبيعية للخلايا ( مثل : الميتوكندريا - الكلوروبلاست - أجسام جولجي - ... ) أو جزء من المادة الوراثية ( كروموسوم أو مجموعة من الجينات ) . بحيث إستطاعت هذه العضيات الإستقلال بذاتها عن الخلية ثم إتخذت بعد ذلك خلية العائل موضعاً لنشاطها وتضاعفها .
فرضية التطور المشترك
وتنص على أنه قد تكون الفيروسات تطورت من جزيئات معقدة من البروتين و الأحماض النووية في نفس الوقت الذي ظهرت للمرة الأولى الخلايا على سطح الأرض، و اٍعتمدت على الحياة الخلوية لعدة ملايين من السنين. أشباه الفيروسات هي جزيئات الرنا التي لا تصنف على أنها فيروسات لأنها تفتقر لغشاء بروتيني، ومع ذلك ، لديها الخصائص التي تشترك فيها العديد من الفيروسات وغالبا ما تسمى عوامل شبه فيروسية.[22] أشباه الفيروسات هي المسبب الرئيسي للأمراض لدى النباتات،[23] هي لا تشفر للبروتينات لكن تتفاعل مع الخلايا المضيفة و تستعمل آلية المضيف من أجل تكرارها (تكاثرها).[24] فيروس التهاب الكبد د البشري له جينوم رنا مماثل لأشباه الفيروسات لكن له غشاء بروتيني مشتق من فيروس التهاب الكبد ب، اٍذا فهو فيروس معيب ولا يمكنه التكرار اٍلا بمساعدة فيروس التهاب الكبد ب.[25] بالمثل، الفيروس الآكل 'سبوتنيك' يعتمد على الفيروس المحاكي، الذي يصيب أوالي المتحولة المشوكة الكاستيلانية.[26] هذه الفيروسات التي تعتمد على وجود أنواع أخرى من الفيروسات في الخلايا المضيفة تسمى توابع وربما تمثل مرحلة تطورية وسيطة بين أشباه الفيروسات و الفيروسات.[27][28]
أي بمعنى أن الفيروسات نوع من أنواع الكائنات الحية التي ظهرت في مرحلة سابقة لنشأة الخلية . وهذه النظرية غير واقعية حيث أن الفيروسات تعتمد في وجودها وتكاثرها على خلايا العائل إعتمادا كلياً .
الميكروبيولوجيا و خصائص الفيروسات
خصائص الحياة ( الخصائص البيولوجية )
اٍختلفت الآراء حول كون الفيروسات كائنات حية أو بنى عضوية تتفاعل معها. فتم وصفها ب الكائنات على حافة الحياة، [29] نظرا لأنها تشبه الكائنات الحية باٍمتلاكها جينات وتتطور عن طريق الانتقاء الطبيعي،[30] وتتكاثر عن طريق اٍنشاء نسخ متعددة لنفسها بواسطة التجميع الذاتي. على الرغم من أن لها جينات اٍلا أنها لا تملك بنية الخلية، التي غالبا ما ينظر إليها على أنها الوحدة الأساسية للحياة. ليس للفيروسات أيض خاص بها، بل تتطلب خلية مضيفة لاٍنتاج مواد جديدة. لذلك لا يمكن استنساخها خارج الخلية المضيفة (أنواع من البكتيريا مثل الكلاميديا و الركتسيات تعتبر كائنات حية رغم كونهما يشتركان مع الفيروسات في هذه الخاصية). أشكال الحياة المقبولة تستخدم الانقسام الخلوي للتكاثر، في حين أن الفيروسات تتجمع عفويا داخل الخلايا. تختلف عن النمو الذاتي للبلورات لأنها ترث طفرات جينية في حين تخضع للاٍنتقاء الطبيعي. التجميع الداتي للفيروس داخل الخلية المضيفة له تأثير على دراسة أصل الحياة، فهو يضفي مزيدا من المصداقية على الفرضية القائلة بأن الحياة قد بدأت بتجميع ذاتي للجزيئات عضوية.[1]
البنية

تتألف الفيروسات من مجموعة واسعة من الأشكال و الأحجام، تسمى المورفولوجيا. عموما الفيروسات أصغر بكثير من البكتيريا. معظم الفيروسات التي خضعت للدراسة يتراوح قطرها بين 10 و 300 نانومتر. بعض الفيروسات الخيطية لها طول اٍجمالي يصل إلى 1400 نانومتر; أقطارها فقط حوالي 80 نانومتر.[31] لا يمكن رؤية الفيروسات بالمجهر الضوئي لذا اٍستخدم المجهر الإلكتروني لرؤيتها.[32] لزيادة التباين بين الفيروسات والخلفية، تستخدم كثافة الاٍلكترون. هذه هي حلول أملاح المعادن الثقيلة، مثل تنجستن الذي يبعثر الاٍلكترونات من المناطق المغطات بالتلوين. تبقى التفاصيل الدقيقة غامضة عندما تغطى الفيروسات بالتلوين (التلوين الاٍيجابي). التلوين السلبي يتغلب على هذه المشكلة بتلوين الخلفية فقط.[33]
جزيئ الفيروس الكامل يعرف باٍسم فيريون، يتكون من حمض نووي محاط بغلاف واقي بروتيني يسمى القفيصة، هذه الأخيرة مكونة من وحدات بروتينية متماثلة تسمى القسيمات القفيصية.[34] الفيروسات يمكن أن يكون لها "غلاف" دهني مستمد من غشاء الخلية المضيفة. القفيصة مصنوعة من البروتينات المشفرة بواسطة الجينوم الفيروسي و شكلها يستعمل كأساس للتمييز المورفولوجي بين الفيروسات.[35][36] الوحدات البروتينية المشفرة فيروسيا تتجمع ذاتيا لتشكيل القفيصة، عموما تتطلب وجود الجينوم الفيروسي. مركب فيروسي يشفر البروتينات التي تساعد في بناء القفيصة. البروتينات المرتبطة بالأحماض النووية تعرف بالبروتينات النووية، و الاٍرتباط بين بروتينات القفيصة الفيروسية و الحمض النووي الفيروسي تسمى القفيصة المنواة. يمكن دراسة القفيصة وكافة بنية الفيروس شكليا باٍستعمال مجهر الطاقة الذرية.[37][38] عموما ، هناك أربعة أنواع رئيسية لمورفولوجية الفيروس:


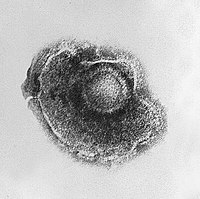
حلزونية هذه الفيروسات مكونة من نوع وحيد من القسيمات القفيصية المكدسة حول محور مركزي لتشكل بنية حلزونية، قد يكون لها تجويف مركزي، أو بشكل أنبوب مجوف. هذا الترتيب ينتج فيريونات بشكل قضيبي أو خيطي: يمكن أن تكون قصيرة و صلبة أو طويلة ومرنة للغاية. المادة الوراثية، عموما رنا وحيد السلسلة لكن الدنا أحادي السلسلة في بعض الأحيان ينضم للبروتين الحلزوني الشكل بواسطة التفاعلات بين الحمض النووي السلبي و البروتين الموجب. اٍجمالا، طول القفيصة الحلزونية مرتبط بطول الحمض النووي بداخلها و طولها يعتمد على حجم وترتيب القسيمات القفيصية. و دراسة فيروس تبرقش التبغ هو مثال على الفيروسات الحلزونية.[39]
عشرونية الوجوه معظم فيروسات الحيوانات عشرونية الوجوه أو شبه كروية مع تناظر عشروني الوجوه. عشروني الوجوه العادي هو السبيل الأمثل لتشكيل هيكل مغلف من الوحدات المتطابقة. الحد الأدنى لعدد القسيمات القفيصية المطلوب هو اٍثنا عشر، وكل واحدة مكونة من 5 تحت وحدات متطابقة. العديد من الفيروسات ، مثل فيروس الروتا، له أكثر من 12 قسيم قفيصي ويبدو كرويا. القسيم القفيصي في القمم تحيط به خمسة قسيمات قفيصية أخرى تسمى بنتونات. القسيم القفيصي على وجوهه الثلاثة محاط ب 6 قسيمات قفيصية أخرى تسمى هيكسونات
مغلفة بعض الأنواع من الفيروسات تغلف نفسها بأحد الأغشية الخلوية المعدلة، اٍما الغشاء الخرجي المحيط بالخلية المصابة أو الأغشية الداخلية مثل الغشاء النووي و الشبكة الهيولية، هذا ما يكسبها طبقة دهنية ثنائية خارجية تعرف بالغلاف الفيروسي. هذا الغشاء مرصع ببروتينات مشفرة بواسطة جينوم الفيروس وجينوم الخلية المضيفة; الغشاء الدهني و كل الكربوهيدرات تنبع من المضيف. فيروس الانفلونزا وفيروس نقص المناعة البشرية يستخدمان هذه الاستراتيجية. معظم الفيروسات المغلفة تعتمد على الغلاف لنقل العدوى.[40]
معقدة هذه الفيروسات تمتلك قفيصة ليست محض حلزونية ولا محض عشرونية الوجوه، قد تمتلك هياكل إضافية مثل الذيول البروتينية أو جدار خارجي معقد. بعض العواثي مثل عاثية الأمعاء T4 لها بنية معقدة مكونة من رأس عشروني الوجوه و ذيل حلزوني، التي قد يكون لها قاعدة لوحة سداسية مع ألياف ذيل بروتينية بارزة. عمل بنية الذيل هته يشبه حقنة جزيئية (الاٍرتباط بالبكتيريا ومن ثم حقن الجينوم الفيروسي داخل الخلية).[41]
الفيروسات الجدرية كبيرة، معقدة و لها مورفولوجيا غير عادية. الجينوم الفيروسي مرتبط ببروتينات داخل بنية قرص مركزي يعرف بالنوواني. النوواني محاط بغشاء و جسيمين جانبيين مجهولي الوظيفة. الفيروس له غشاء خارجي مرصع بطبقة سميكة من البروتينات على سطحه. الفيريون عموما له شكل معوج قليلا ، يتراوح من الشكل البيضوي اٍلى شكل اللبنة.[42]
الفيروسات المحاكية هي أكبر الفيروسات المعروفة، يبلغ قطر قفيصتها 400 نانومتر. طول خيوط البروتين 100 نم، تبدو تحت المجهر الاٍلكتروني سداسية الشكل لذلك فالقفيصة على الأرجح عشرونية الوجوه.[43]
بعض الفيروسات التي تصيب العتائق لها بنى معقدة غير مرتبطة بأي شكل من أشكال الفيروسات، مع طائفة واسعة من الأشكال غير العادية، تتباين من هياكل مغزلية الشكل حتى الفيروسات التي تشبه قضبان التوصيل، القطرة أو القارورة. فيروسات عتائق أخرى تشبه العواثي المذيلة، ويمكن أن يكون لها هياكل متعددة للذيل.[44]
الجينوم
| صفة | المعلمات |
|---|---|
| الحمض النووي |
|
| الشكل |
|
| السلسلة |
|
| الاٍتجاه |
|
يمكن أن نرى التنوع الكبير للهياكل الجينومية من خلال الأنواع الفيروسية؛ فهي كمجموعة تحتوي على تنوع جينومي هيكلي أكبر من النباتات، الحيوانات، العتائق أو البكتيريا. هناك الملايين من أنواع الفيروسات المختلفة؛[4] فقط حوالي 5،000 منها وصفت بالتفصيل.[3] تحتوي الفيروسات اٍما على دنا أو رنا وتسمى فيروسات الدنا أو فيروسات الرنا على التوالي. حتى الآن معظم الفيروسات هي ذات رنا. الفيروسات النباتية تميل لاٍمتلاك رنا أحادي السلسلة و العواثي تميل لاٍمتلاك دنا ثنائي سلسلة.[45]
جينومات الفيروسات يمكن أن تكون حلقية كما هو الحال في الفيروسات التورامية، خطية كما في الفيروسات الغدانية. نوع الحمض النووي لا صلة له بشكل الجينوم.
بين فيروسات الرنا، الجينوم في كثير من الأحيان مقسم إلى أجزاء منفصلة داخل الفيريون ويسمى مجزأ، عموما كل جزء يشفر بروتين واحد و عادتا ما تكون (الأجزاء) موجودة في قفيصة واحدة معا.
دورة النسخ
لا تتكاثر الفيروسات عن طريق الاٍنقسام الخلوي، لأنها كائنات لا خلوية. بذلا من ذلك تستخدم التمثيل الغذائي للخلية المضيفة لإنتاج نسخ متعددة، و تقوم بتجميعها داخل الخلية.
دورة حياة الفيروس تختلف بشكل كبير بين الأنواع لكن هناك 6 مراحل قاعدية لدورة حياة الفيروسات.
تأثيراته على الخلية المضيفة
تصنيف الفيروسات
يسعى التصنيف لوصف تنوع الفيروسات عن طريق تسميتها و تقسيمها اٍلى مجموعات على أساس التشابه. عام 1962 أندريه لووف، روبرت هورني و بول تورنيي كانوا أول من وضع وسائل لتصنيف الفيروسات، اٍستنادا على نظام التسلسل الهرمي.[46] هذا النظام يستند في تصنيفه على الشعبة، الطائفة، الرتبة، الفصيلة، الجنس و النوع. صنفت الفيروسات وفقا لخصائصها المشتركة (ليس تلك المتعلقة بمضيفيهم) و نوع الحمض النووي المشكل لجينومها.[47] فيما بعد أسست اللجنة الدولية لتصنيف الفيروسات.
تصنيف اللجنة الدولية لتصنيف الفيروسات
طورت اللجنة الدولية لتصنيف الفيروسات نظام التصنيف الحالي وكتبت المبادئ التوجيهية التي ركزت على بعض خصائص الفيروسات للحفاظ على وحدة الفصيلة. تم وضع التصنيف الموحد (نظام عالمي لتصنيف الفيروسات) في التقرير السابع للجنة الدولية لتصنيف الفيروسات للمرة الأولى وأعتبرت الأنواع الفيروسية أدنى مرتبة في التصنيف الهرمي الفيروسات.[48] ومع ذلك فقط جزء صغير من مجموع الفيروسات تمت دراسته، التحاليل التي أجريت على عينات من البشر وجدت أن حوالي 20 ٪ من متواليات الفيروسات المسترجعة لم ترى من قبل. في حين عينات من البيئة، مثل مياه البحر ورواسب المحيطات، وجدت أن الأغلبية العظمى من المتواليات جديدة تماما.[49]
الهيكل العام للتصنيف هو على النحو التالي:
في تصنيف عام 2008 للجنة الدولية لتصنيف الفيروسات وضعت خمس رتب هي الفيروسات الذنبية، الفيروسات الهربسية، الفيروسات السلبية الأحادية، الفيروسات العشية و الفيروسات البيكورناوية. اللجنة الرسمية لم تميز بين التحت أنواع، السلالات و العزلات. في المجموع هناك 5 رتب، 82 فصيلة، 11 تحت فصيلة، 307 جنس، 2،083 نوع و حوالي 3،000 نوع غير مصنفة بعد.[50][51]
تصنيف بلتيمور
ديفيد بلتيمور العالم البيولوجي الحائز على جائزة نوبل اٍبتكر نظام تصنيف بلتيمور.[52][53] نظام تصنيف اللجنة الدولية لتصنيف الفيروسات يستعمل بالموازات مع تصنيف بلتيمور في تصنيف الفيروسات الحديث.[54][55][56]
يعتمد نظام تصنيف بلتيمور على طريقة صنع الرنا المرسال. الفيروسات يجب أن تولد mRNAs من جينومها لاٍنتاج البروتينات وتكرار نفسها، لكن تستخدم آليات مختلفة لتحقيق هذا في كل عائلة من الفيروسات. الجينوم الفيروسي يمكن أن يكون أحادي أو ثنائي سلسلة الدنا أو الرنا، ويمكن أن تستخدم أو لا المنسخة العكسية. بالاٍضافة لذلك، الفيروسات أحادية سلسلة الرنا اٍما أن يكون اٍتجاهها (+) أو معاكس للاٍتجاه (-). هذا التصنيف يضع الفيروسات في سبع مجموعات:
- فيروسات ذات الدنا ثنائي السلسلة ( فيروسات غدانية، فيروسات هربسية، فيروسات جدرية)
- فيروسات ذات الدنا أحادي السلسلة (فيروسات صغيرة)
- فيروسات ذات الرنا ثنائي السلسلة (فيروسات جرمية)
- فيروسات اٍيجابية ذات الرنا أحادي السلسلة (فيروسات بيكورناوية، فيروسات طخائية)
- فيروسات سلبية ذات الرنا أحادي السلسلة (أورثوميكسوفيريداي، فيروسات ربدية)
- فيروسات النسخ العكسي ذات الرنا أحادي السلسلة (فيروس قهقري)
- فيروسات النسخ العكسي ذات الدنا ثنائي السلسلة (فيروسات كبدية)
كمثال على تصنيف الفيروسات، فيروس الحماق و الفيروس النطاقي الحماقي، ينتميان لرتبة الفيروسات الهربسية، عائلة الفيروسات هربسية.
الفرق بين الفيروسات و البكتيريا و الأوليات
في الجدول التالي نلاحظ بعض الفروق و الإختلافات بين الفيروسات Viruses و الكائنات الدقيقة غير مميزة النواة Procaryotes ( مثل : البكتيريا bacteria ) و الكائنات الدقيقة مميزة النواة Eucaryotes ( مثل : الأوليات protozoa )
| وجه المقارنة | الفيروسات | البكتيريا | الأوليات |
|---|---|---|---|
| متوسط الحجم ( ميكرومتر ) | 0,001 | 1 | 1000 |
| القدرة على تخليق البروتين بإستعمال الريبوزومات و الـ trna | لا يوجد | يوجد | يوجد |
| تعقيدات الكروموسوم ( وجود هستون و سنترومير و القدرة على الإنقسام ) | لا يوجد | لا يوجد | يوجد |
| وجود الغشاء النووي و العضيات الخلوية المعقدة ( مثل : ميتوكندريا - شبكة إندوبلازمية - ... ) | لا يوجد | لا يوجد | يوجد |
الفرق بين الفيروسات و الكائنات الحية الدقيقة غير مميزة النواة ( تفصيل )
بشكل أكبر يصف الجدول التالي الإختلاف بين الفيروسات Viruses و كل من البكتيريا bacteria و الريكيتسيا rickettsia و الكلامديا chlamydia و الميكوبلازما Mycoplasmi
| صفة المقارنة | فيروسات | بكتيريا | ميكوبلازما | ريكيتسيا | كلامديا |
|---|---|---|---|---|---|
| قطرها أكبر من 300 nm | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| الإنقسام الثنائي | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| وجود RNA و DNA معاً | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| وجود ريبوزومات | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| وجود الأيض metabolism | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| الحساسية للمضادات الحيوية | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| النمو على وسط غير حي | غير متحقق | متحقق | متحقق | غير متحقق | غير متحقق |
| وجود حامض نووي معدي بمفرده | متحقق | غير متحقق | غير متحقق | غير متحقق | غير متحقق |
الفيروسات و أمراض الاٍنسان
الوبائية
الأوبئة و الجوائح
السرطان
الفيروسات هي أحد أسباب نشوء السرطان لدى الاٍنسان و أنواع أخرى. السرطانات الفيروسية لا تحدث إلا في أقلية من الأشخاص المصابين (أو الحيوانات). الفيروسات السرطانية تأتي من مجموعة من عائلات الفيروسات، تضم كل من فيروسات الدنا و فيروسات الرنا، ولذا لا يوجد نوع واحد من الفيروسات الورمية (مصطلح يستعمل في الأصل للتحويلات الحادة للفيروسات القهقرية). تطور السرطان يتحدد بمجموعة متنوعة من العوامل مثل حصانة المضيف[57] و الطفرات التي تحدث لديه.[58] تبين أن الفيروسات تسبب السرطانات البشرية وتشمل بعض الأنماط الجينية من فيروس الورم الحليمي البشري، فيروس التهاب الكبد الفيروسي ب، فيروس التهاب الكبد الفيروسي ج فيروس إبشتاين-بار و سرطان كابوزيس-المرتبط بفيروس الهربس. و آخر ما أكتشف من الفيروسات المسرطنة لدى البشر هو الفيروس التورامي (فيروس خلية ميركل التورامي) الذي يسبب معظم حالات الشكل النادر من سرطان الجلد المسمى سرطان خلية ميركل. [59] فيروسات التهاب الكبد يمكن أن تتطور اٍلى عدوى فيروسية مزمنة تؤدي الى سرطان الكبد.[60][61] الاٍصابة بفيروس تي- الليمفاوي البشري تتطور اٍلى الخزل السفلي التشنجي المداري و الابيضاض التائي الخلايا في البالغين.[62]فيروسات الأورام الحليمية البشرية هي مسبب نشوء سرطان عنق الرحم، الجلد، الشرج و القضيب.[63] بما في ذلك الفيروسات الهربسية، سرطان كابوزيس-المرتبط بفيروس الهربس تسبب سرطان كابوزيس و ليمفوما تجويف الجسم، و فيروس إبشتاين-بار يسبب ورم بوركيتس اللمفي، لمفومة هودجكين، مرض التكاثر الليمفاوي البائي و السرطانة الأنفية البلعومية.[64] فيروس خلية ميركل التورامي يتصل اٍتصالا وثيقا بSV40 و فيروسات الفئران التورامية قد استخدمت كنماذج حيوانية لفيروسات مرض السرطان لأكثر من 50 عاما.[65]
آليات دفاع المضيف
الوقاية و العلاج
اللقاحات
العقارات المضادة للفيروسات
العدوى في أنواع أخرى
النباتات

هناك العديد من الأنواع من فيروسات النباتات، لكن غالبا تسبب فقط خسارة عائد الاٍنتاج الزراعي، وليس من الجدي اٍقتصاديا محاولة السيطرة عليها. تنتقل فيروسات النباتات غالبا من نبات لآخر عن طريق كائنات حية، المعروفة باٍسم النواقل. عادة ما تكون حشرات، لكن بعض الفطور، الديدان الأسطوانية و الأوالي تبين أنها نواقل. عندما تكون السيطرة على العدوى الفيروسية النباتية مجدية اٍقتصاديا، لدى الفاكهة المعمرة على سبيل المثال، تتركز الجهود على قتل الناقل وإزالة المضيف البديل مثل الاعشاب الضارة.[66] فيروسات النباتات غير ضارة للبشر، الحيوانات وغيرها لأنها يمكن أن تتكاثر فقط في الخلايا النباتية.[67]
طورة النباتات آليات دفاع ضد الفيروسات. واحد من أكثر الطرق فعالية هو وجود ما يسمى مقاومة (R) الجينات. كل جين R يعطي مناعة لفيروس معين عن طريق اٍثارت مجموعة من الخلايا الميتة حول الخلية المصابة، و التي يمكن مشاهدتها بالعين المجردة كبقع كبيرة. هذا يوقف اٍنتشار العدوى.[68] تداخل الرنا هو أحد آليات دفاع النباتات.[69] عندما تكون مصابة، غالبا ما تنتج النباتات مطهرات قاتلة للفيروسات، مثل حمض ساليسيليك، أحادي أكسيد النيتروجين و أنواع الاكسجين التفاعلية.[70]
البكتيريا

العواثي هي مجموعة مشتركة ومتنوعة من الفيروسات، هي الأكثر وفرة من بين الكيانات البيولوجية في البيئات المائية. هناك ما يفوق بأكثر من عشر مرات من هذه الفيروسات في المحيطات من البكتيريا.[71] تصل لمستوى 250.000.000 عاثية في مليلتر واحد من ماء البحر.[72] تصيب هذه الفيروسات بكتيريا خاصة وذلك بالاٍرتباط بالمستقبلات الغشائية ومن ثم الدخول اٍلى الخلية. في غضون فترة زمنية قصيرة، في بعض الحالات دقائق فقط، بوليميراز البكتيري يبدأ بترجمة الرنا الفيروسي اٍلى بروتين. هذه البروتينات تصبح فيريونات داخل الخلية، البروتينات المساعدة، التي تساعد على تجميع الفيريونات، أو البروتينات المشاركة في تحلل الخلية. الأنزيمات الفيروسية تساعد على هدم جدار الخلية، في حالة عاثية T4، بعد عشرين دقيقة بقليل من الحقن يمكن تحرير ثلاثمئة عاثية.[73]
الطريقة الأكبر التي تدافع بها البكتيريا عن نفسها من العواثي هي اٍنتاج أنزيمات مدمرة للدنا الأجنبي. هذه الأنزيمات، تسمى إنزيمات الاقتطاع، تقطع الدنا الذي تحقنه العواثي داخل الخلايا البكتيرية.[74] البكتيريا تحتوي أيضا على نظام يستخدم متواليات كريسبر (CRISPR) للاٍبقاء على أجزاء من جينومات الفيروسات التي كان للبكتيريا تماس معها في الماضي، مما يسمح لها بمنع الفيروس من التكرار من خلال شكل من تداخل الرنا.[75][76] هذا النظام يوفر للبكتيريا مناعة مكتسبة ضد العدوى.
العتائق
بعض الفيروسات تتكاثر داخل العتائق: هي فيروسات غير عادية ذات الدنا ثنائي السلسلة و أحيانا بأشكال فريدة.[5][44] هذه الفيروسات درست بتفصيل أكثر في العتائق المحبة للحرارة، لا سيما رتبتي سيلفولوبل (Sulfolobales) و تيرموبروتيال (Thermoproteales). ا .[77] المناعة ضد هذه الفيروسات تستعمل تداخل الرنا من تكرار سلسلة الدنا داخل جينوم العتيقة المرتبط بجينات الفيروس.[78][79]
التطبيقات
الطب و علم الأحياء
الفيروسات هامة لدراسة البيولوجيا الجزيئية و الخلوية لأنها توفر أنظمة بسيطة يمكن اٍستخدامها في التحقيق في وظائف الخلايا.[80] و قد وفرت دراسة واستخدام الفيروسات معلومات قيمة حول جوانب البيولوجيا الخلوية.[81] على سبيل المثال ، أفادة الفيروسات في دراسة علم الوراثة و ساعدة في فهمنا للآليات الأساسية لعلم الوراثة الجزيئي، مثل تنسخ الدنا، النسخ، معالجة الرنا، الترجمة، نقل البروتين و المناعة.
يستعمل علماء الوراثة الفيروسات كنواقل لاٍدخال الجينات للخلايا التي يقومون بدراستها. وهذا مفيد لجعل خلايا تنتج مادة غريبة أو لدراسة تأثير إدخال جينات جديدة في الجينوم. بطريقة مماثلة، علاج الفيروسات تستخدم الفيروسات كنواقل لعلاج أمراض مختلفة، لأنها يمكن أن تستهدف بشكل خاص الخلايا و الدنا. و تظهر استخدامات واعدة في علاج السرطان و العلاج الجيني. اٍستخدم علماء أوروبا الشرقية العلاج بالعاثية كبديل للمضادات الحيوية لبعض الوقت، وتزداد الفائدة في هذا النهج بسبب اٍرتفاع مستوى المقاومة للمضادات الحيوية لدى بعض البكتيريا الممرضة.[82]
علم المواد والتكنولوجيا النانوية
الأسلحة
قدرة الفيروسات على خلق أوبئة مدمرة في المجتمعات البشرية أدت إلى القلق من اٍستخدامها لصنع اسلحة بيولوجية. علاوة على القلق بعد اٍعادة التخليق الناجحة لفيروس أنفلونزا 1918 المشين في المختبر. [83] فيروس الجدري دمر العديد من المجتمعات على مر التاريخ قبل القضاء عليه. رسميا هناك مركزين فقط في العالم تبقي على مخزونات فيروس الجدري المختبر الروسي للنواقل و مراكز الولايات المتحدة للسيطرة على الأمراض.[84] لكن المخاوف من أنها يمكن أن تستخدم كسلاح لا أساس لها على الاطلاق.[84] لقاح الجدرى ليس آمن--خلال سنوات قبل اٍستئصال مرض الجدري أصبح المزيد من الناس مصابين جديا نتيجة التطعيم[85]--والتطعيم ضد الجدري لم يعد يمارس عالميا.[86] وبالتالي ، فإن الكثير من البشر الحديثين (المولودين بعد اٍستئصال المرض) يكادون لا يملكون أي مناعة ضد مرض الجدري.[84]
المراجع
- ^ أ ب Koonin EV, Senkevich TG, Dolja VV (2006). "The ancient Virus World and evolution of cells". Biol. Direct. ج. 1: 29. DOI:10.1186/1745-6150-1-29. PMC:1594570. PMID:16984643. اطلع عليه بتاريخ 2008-09-14.
{{استشهاد بدورية محكمة}}: الوسيط|pages=و|page=تكرر أكثر من مرة (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعDimmock - ^ أ ب Dimmock p. 49
- ^ أ ب Breitbart M, Rohwer F (2005). "Here a virus, there a virus, everywhere the same virus?". Trends Microbiol. ج. 13 ع. 6: 278–84. DOI:10.1016/j.tim.2005.04.003. PMID:15936660.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة) - ^ أ ب Lawrence CM, Menon S, Eilers BJ؛ وآخرون (2009). "Structural and functional studies of archaeal viruses". J. Biol. Chem. ج. 284 ع. 19: 12599–603. DOI:10.1074/jbc.R800078200. PMID:19158076.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|author=(مساعدة) والوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Edwards RA, Rohwer F (2005). "Viral metagenomics". Nat. Rev. Microbiol. ج. 3 ع. 6: 504–10. DOI:10.1038/nrmicro1163. PMID:15886693.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة) - ^ Canchaya C, Fournous G, Chibani-Chennoufi S, Dillmann ML, Brüssow H (2003). "Phage as agents of lateral gene transfer". Curr. Opin. Microbiol. ج. 6 ع. 4: 417–24. DOI:10.1016/S1369-5274(03)00086-9. PMID:12941415.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب "virus". The Online Etymology Dictionary. اطلع عليه بتاريخ 2008-09-12.
- ^ "viral, a." The Oxford English Dictionary — Online. اطلع عليه بتاريخ 2008-09-12.
- ^ Shors pp. 76–77
- ^ Iyer LM, Balaji S, Koonin EV, Aravind L (2006). "Evolutionary genomics of nucleo-cytoplasmic large DNA viruses". Virus Res. ج. 117 ع. 1: 156–84. DOI:10.1016/j.virusres.2006.01.009. PMID:16494962. اطلع عليه بتاريخ 2008-09-14.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Liu Y, Nickle DC, Shriner D, et al. (2004). "Molecular clock-like evolution of human immunodeficiency virus type 1". Virology. 10;329(1):101–8, PMID 15476878
- ^ Shors p. 16
- ^ Collier pp. 18–19
- ^ Shors pp. 14–16
- ^ Collier pp. 11–21
- ^ أ ب Dimmock p. 16
- ^ Collier p. 11
- ^ Shors p. 574
- ^ McClintock، B. (1950). "The origin and behavior of mutable loci in maize". Proc Natl Acad Sci U S A. ج. 36 ع. 6: 344–55. DOI:10.1073/pnas.36.6.344. PMID:15430309.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة) - ^ Collier pp. 11–12
- ^ Dimmock p. 55
- ^ Shors 551–3
- ^ Tsagris EM, de Alba AE, Gozmanova M, Kalantidis K (2008). "Viroids". Cell. Microbiol. ج. 10 ع. 11: 2168. DOI:10.1111/j.1462-5822.2008.01231.x. PMID:18764915. اطلع عليه بتاريخ 2008-09-19.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Shors p. 492–3
- ^ La Scola B, Desnues C, Pagnier I, Robert C, Barrassi L, Fournous G, Merchat M, Suzan-Monti M, Forterre P, Koonin E, Raoult D (2008). "The virophage as a unique parasite of the giant mimivirus". Nature. ج. 455 ع. 7209: 100–4. DOI:10.1038/nature07218. PMID:18690211.
{{استشهاد بدورية محكمة}}: الوسيط|accessdateبحاجة لـ|مسار=(مساعدة) والوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Collier p. 777
- ^ Dimmock p. 55–7
- ^ Rybicki EP (1990) "The classification of organisms at the edge of life, or problems with virus systematics." S Aft J Sci 86:182–186
- ^ Holmes EC (2007). "Viral evolution in the genomic age". PLoS Biol. ج. 5 ع. 10: e278. DOI:10.1371/journal.pbio.0050278. PMC:1994994. PMID:17914905. اطلع عليه بتاريخ 2008-09-13.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Collier pp. 33–55
- ^ Collier pp. 33–37
- ^ Kiselev NA, Sherman MB, Tsuprun VL (1990). "Negative staining of proteins". Electron Microsc. Rev. ج. 3 ع. 1: 43–72. DOI:10.1016/0892-0354(90)90013-I. PMID:1715774.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Collier p. 40
- ^ Caspar DL, Klug A (1962). "Physical principles in the construction of regular viruses". Cold Spring Harb. Symp. Quant. Biol. ج. 27: 1–24. PMID:14019094.
- ^ Crick FH, Watson JD (1956). "Structure of small viruses". Nature. ج. 177 ع. 4506: 473–5. DOI:10.1038/177473a0. PMID:13309339.
- ^ Falvo، M.R. (مارس 1997). "Manipulation of individual viruses: friction and mechanical properties". Biophysical Journal. ج. 72 ع. 3: 1396–1403. DOI:10.1016/S0006-3495(97)78786-1. اطلع عليه بتاريخ 2009-05-08.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|coauthors=تم تجاهله يقترح استخدام|author=(مساعدة) - ^ Kuznetsov، Yu. G. (1 سبتمبر 2001). "Imaging of viruses by atomic force microscopy". J Gen Virol. ج. 82 ع. 9: 2025–2034. اطلع عليه بتاريخ 2009-04-19.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|coauthors=تم تجاهله يقترح استخدام|author=(مساعدة) - ^ Collier p. 37
- ^ Collier pp. 42–43
- ^ Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG (2004). "The bacteriophage T4 DNA injection machine". Curr. Opin. Struct. Biol. ج. 14 ع. 2: 171–80. DOI:10.1016/j.sbi.2004.02.001. PMID:15093831.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Long GW, Nobel J, Murphy FA, Herrmann KL, Lourie B (1970). "Experience with electron microscopy in the differential diagnosis of smallpox". Appl Microbiol. ج. 20 ع. 3: 497–504. PMC:376966. PMID:4322005.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Suzan-Monti M, La Scola B, Raoult D (2006). "Genomic and evolutionary aspects of Mimivirus". Virus Research. ج. 117 ع. 1: 145–155. DOI:10.1016/j.virusres.2005.07.011. PMID:16181700.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Prangishvili D, Forterre P, Garrett RA (2006). "Viruses of the Archaea: a unifying view". Nat. Rev. Microbiol. ج. 4 ع. 11: 837–48. DOI:10.1038/nrmicro1527. PMID:17041631.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Collier pp. 96–99
- ^ Lwoff A, Horne RW, Tournier P (1962). "A virus system". C. R. Hebd. Seances Acad. Sci. (بالفرنسية). 254: 4225–7. PMID:14467544.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Lwoff A, Horne R, Tournier P (1962). "A system of viruses". Cold Spring Harb. Symp. Quant. Biol. ج. 27: 51–5. PMID:13931895.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Fields p. 27
- As defined therein, "a virus species is a polythetic class of viruses that constitute a replicating lineage and occupy a particular ecological niche". A “polythetic" class is one whose members have several properties in common, although they do not necessarily all share a single common defining one. Members of a virus species are defined collectively by a consensus group of properties. Virus species thus differ from the higher viral taxa, which are “universal” classes and as such are defined by properties that are necessary for membership.
- ^ Delwart EL (2007). "Viral metagenomics". Rev. Med. Virol. ج. 17 ع. 2: 115–31. DOI:10.1002/rmv.532. PMID:17295196.
- ^ Virus Taxonomy 2008. International Committee on Taxonomy of Viruses. Retrieved on September 15, 2008.
- ^ ICTV Master Species List 2008
- This Excel file contains the official ICTV Master Species list for 2008. This spreadsheet lists all approved virus taxa and supersedes the previous taxonomy published as a part of the ICTV VIIIth Report. Produced by the International Committee on Taxonomy of Viruses. Retrieved on September 15, 2008
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعpmid4348509 - ^ Baltimore D (1974). "The strategy of RNA viruses". Harvey Lect. 70 Series: 57–74. PMID:4377923.
- ^ van Regenmortel MH, Mahy BW (2004). "Emerging issues in virus taxonomy". Emerging Infect. Dis. ج. 10 ع. 1: 8–13. PMID:15078590.
- ^ Mayo MA (1999). "Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses". Arch. Virol. ج. 144 ع. 8: 1659–66. DOI:10.1007/s007050050620. PMID:10486120.
- ^ de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (2004). "Classification of papillomaviruses". Virology. ج. 324 ع. 1: 17–27. DOI:10.1016/j.virol.2004.03.033. PMID:15183049.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Einstein MH, Schiller JT, Viscidi RP, Strickler HD, Coursaget P, Tan T, Halsey N, Jenkins D (2009). "Clinician's guide to human papillomavirus immunology: knowns and unknowns". The Lancet Infectious Diseases. ج. 9 ع. 6: 347–56. DOI:10.1016/S1473-3099(09)70108-2. PMID:19467474.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Shuda M, Feng H, Kwun HJ, Rosen ST, Gjoerup O, Moore PS, Chang Y (2008). "T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus". Proceedings of the National Academy of Sciences of the United States of America. ج. 105 ع. 42: 16272–7. DOI:10.1073/pnas.0806526105. PMC:2551627. PMID:18812503.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Pulitzer MP, Amin BD, Busam KJ (2009). "Merkel cell carcinoma: review". Advances in Anatomic Pathology. ج. 16 ع. 3: 135–44. DOI:10.1097/PAP.0b013e3181a12f5a. PMID:19395876.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Koike K (2007). "Hepatitis C virus contributes to hepatocarcinogenesis by modulating metabolic and intracellular signalling pathways". J. Gastroenterol. Hepatol. 22 Suppl 1: S108–11. DOI:10.1111/j.1440-1746.2006.04669.x. PMID:17567457.
- ^ Hu J, Ludgate L (2007). "HIV-HBV and HIV-HCV coinfection and liver cancer development". Cancer Treat. Res. ج. 133: 241–52. DOI:10.1007/978-0-387-46816-7_9. PMID:17672044.
- ^ Bellon M, Nicot C (2007). "Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia". Cancer genomics & proteomics. ج. 4 ع. 1: 21–5. PMID:17726237.
- ^ Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S (2007). "Human papillomavirus and cervical cancer". Lancet. ج. 370 ع. 9590: 890–907. DOI:10.1016/S0140-6736(07)61416-0. PMID:17826171.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Klein E, Kis LL, Klein G (2007). "Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions". Oncogene. ج. 26 ع. 9: 1297–305. DOI:10.1038/sj.onc.1210240. PMID:17322915.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ zur Hausen H (2008). "Novel human polyomaviruses—re-emergence of a well known virus family as possible human carcinogens". International Journal of Cancer. Journal International Du Cancer. ج. 123 ع. 2: 247–50. DOI:10.1002/ijc.23620. PMID:18449881.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة) - ^ Shors p. 584
- ^ Shors pp. 562–587
- ^ Dinesh-Kumar SP, Wai-Hong Tham, Baker BJ (2000). "Structure—function analysis of the tobacco mosaic virus resistance gene N". PNAS 97, 14789-94 PMID 11121079
- ^ Shors pp. 573–576
- ^ Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP (2005). "Mechanisms of plant resistance to viruses". Nat. Rev. Microbiol. 3, pp. 789–98 PMID 16132037
- ^ Wommack KE, Colwell RR (2000). "Virioplankton: viruses in aquatic ecosystems". Microbiol. Mol. Biol. Rev. ج. 64 ع. 1: 69–114. DOI:10.1128/MMBR.64.1.69-114.2000. PMC:98987. PMID:10704475.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة) - ^ Bergh O, Børsheim KY, Bratbak G, Heldal M (1989). "High abundance of viruses found in aquatic environments". Nature. ج. 340 ع. 6233: 467–8. DOI:10.1038/340467a0. PMID:2755508.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Shors pp. 595–97
- ^ Bickle TA, Krüger DH (1993). "Biology of DNA restriction". Microbiol. Rev. ج. 57 ع. 2: 434–50. PMC:372918. PMID:8336674.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|day=تم تجاهله (مساعدة) والوسيط غير المعروف|month=تم تجاهله (مساعدة) - ^ Barrangou R, Fremaux C, Deveau H؛ وآخرون (2007). "CRISPR provides acquired resistance against viruses in prokaryotes". Science (journal). ج. 315 ع. 5819: 1709–12. DOI:10.1126/science.1138140. PMID:17379808.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|author=(مساعدة) والوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Brouns SJ, Jore MM, Lundgren M؛ وآخرون (2008). "Small CRISPR RNAs guide antiviral defense in prokaryotes". Science (journal). ج. 321 ع. 5891: 960–4. DOI:10.1126/science.1159689. PMID:18703739.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|author=(مساعدة) والوسيط غير المعروف|month=تم تجاهله (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Prangishvili D, Garrett RA (2004). "Exceptionally diverse morphotypes and genomes of crenarchaeal hyperthermophilic viruses". Biochem. Soc. Trans. ج. 32 ع. Pt 2: 204–8. DOI:10.1042/BST0320204. PMID:15046572.
- ^ Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria E (2005). "Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements". J. Mol. Evol. ج. 60 ع. 2: 174–82. DOI:10.1007/s00239-004-0046-3. PMID:15791728.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Makarova KS, Grishin NV, Shabalina SA, Wolf YI, Koonin EV (2006). "A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action". Biol. Direct. ج. 1: 7. DOI:10.1186/1745-6150-1-7. PMID:16545108.
{{استشهاد بدورية محكمة}}: الوسيط|pages=و|page=تكرر أكثر من مرة (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Collier p.8
- ^ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James.Viruses:Structure, Function, and Uses Retrieved on September 16, 2008
- ^ Matsuzaki S, Rashel M, Uchiyama J؛ وآخرون (2005). "Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases". J. Infect. Chemother. ج. 11 ع. 5: 211–9. DOI:10.1007/s10156-005-0408-9. PMID:16258815.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|author=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Shors p. 331
- ^ أ ب ت Artenstein AW, Grabenstein JD (2008). "Smallpox vaccines for biodefense: need and feasibility". Expert Review of Vaccines. ج. 7 ع. 8: 1225–37. DOI:10.1586/14760584.7.8.1225. PMID:18844596. اطلع عليه بتاريخ 2009-07-12.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|month=تم تجاهله (مساعدة) - ^ Aragón TJ, Ulrich S, Fernyak S, Rutherford GW (2003). "Risks of serious complications and death from smallpox vaccination: a systematic review of the United States experience, 1963–1968". BMC public health. ج. 3: 26. DOI:10.1186/1471-2458-3-26. PMID:12911836.
{{استشهاد بدورية محكمة}}: الوسيط|pages=و|page=تكرر أكثر من مرة (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Weiss MM, Weiss PD, Mathisen G, Guze P (2004). "Rethinking smallpox". Clin. Infect. Dis. ج. 39 ع. 11: 1668–73. DOI:10.1086/425745. PMID:15578369.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
وصلات خارجية
- نطاق فيروسي المعهد السويسري لموارد المعلوماتية الحيوية حول كل عائلات الفيروسات، يوفر المعلومات العامة، الجزيئية و الوبائية.
قالب:وصلة مقالة مختارة قالب:وصلة مقالة مختارة قالب:وصلة مقالة مختارة قالب:وصلة مقالة مختارة قالب:وصلة مقالة مختارة