دوبامين: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
ط تنسيق |
|||
| سطر 111: | سطر 111: | ||
تتواجد مجموعة إضافية من العصبونات المفرِزة للدوبامين في [[شبكية]] العين.<ref name=Witkovsky/> هذه العصبونات هي [[خلية أماكرين|خلايا أماكرين]] ويعني ذلك أنها لا تملك [[محوار]]ات،<ref name=Witkovsky/> وتحرر الدوبامين إلى الوسط خارج الخلوي وهي نشطة بشكل خاص خلال ساعات النهار وتصبح ساكتة في الليل.<ref name=Witkovsky/> يعمل هذا الدوبامين الشبكي على تحسين نشاط [[خلية مخروطية|الخلايا المخروطية]] في الشبكية مع تثبيط [[خلية عصوية|الخلايا العصوية]] من أجل زيادة التحسس للألوان و[[تباين (بصريات)|التباين]] في حالة الضوء الساطع، على حساب تحسس منخفض حين يكون الضوء خافتا.<ref name=Witkovsky>{{cite journal | vauthors = Witkovsky P | title = Dopamine and retinal function | journal = Documenta Ophthalmologica. Advances in Ophthalmology | volume = 108 | issue = 1 | pages = 17–40 | date = January 2004 | pmid = 15104164 | doi = 10.1023/B:DOOP.0000019487.88486.0a | url = https://zenodo.org/record/891239 }}</ref> |
تتواجد مجموعة إضافية من العصبونات المفرِزة للدوبامين في [[شبكية]] العين.<ref name=Witkovsky/> هذه العصبونات هي [[خلية أماكرين|خلايا أماكرين]] ويعني ذلك أنها لا تملك [[محوار]]ات،<ref name=Witkovsky/> وتحرر الدوبامين إلى الوسط خارج الخلوي وهي نشطة بشكل خاص خلال ساعات النهار وتصبح ساكتة في الليل.<ref name=Witkovsky/> يعمل هذا الدوبامين الشبكي على تحسين نشاط [[خلية مخروطية|الخلايا المخروطية]] في الشبكية مع تثبيط [[خلية عصوية|الخلايا العصوية]] من أجل زيادة التحسس للألوان و[[تباين (بصريات)|التباين]] في حالة الضوء الساطع، على حساب تحسس منخفض حين يكون الضوء خافتا.<ref name=Witkovsky>{{cite journal | vauthors = Witkovsky P | title = Dopamine and retinal function | journal = Documenta Ophthalmologica. Advances in Ophthalmology | volume = 108 | issue = 1 | pages = 17–40 | date = January 2004 | pmid = 15104164 | doi = 10.1023/B:DOOP.0000019487.88486.0a | url = https://zenodo.org/record/891239 }}</ref> |
||
==== العقد القاعدية ==== |
==== العقد القاعدية ==== |
||
[[ملف:Basal ganglia circuits.svg|300px|تصغير|يسار|المسارات الرئيسية [[عقد قاعدية|للعقد القاعدية]]. المسار دوباميني الفعل من [[جزء مكتنز|الجزء المكتنز]] في [[مادة سوداء (تشريح)|المادة السوداء]] إلى [[جسم مخطط|الجسم المخطط]] موضَّحٌ بأزرق فاتح.]] |
|||
أكبر وأهم مصادر الدوبامين في الفقاريات هي المادة السوداء والمنطقة السقيفية البطنية، ولهاتين البُنيتين صلة وثيقة ببعضهما ودور وظيفي متماثل في العديد من النواحي.<ref name=Bjorklund/> فكلاهما مكوِّن من مكونات العقد القاعدية والتي هي شبكة معقدة من البُنى المتواجدة أساسا في قاعدة [[دماغ أمامي|الدماغ الأمامي]].<ref name=Bjorklund/> أكبر مكون للعقد القاعدية هو الجسم المخطط.<ref name=brs>{{cite book |vauthors=Fix JD| title = Neuroanatomy (Board Review Series) |edition=4th |location=Baltimore |publisher=Wulters Kluwer & Lippincott Wiliams & Wilkins |chapter=Basal Ganglia and the Striatal Motor System |year=2008 |pages=274–81 |isbn=978-0-7817-7245-7}}</ref> ترسل المادة السوداء امتدادات دوبامينية الفعل إلى الجسم المخطط الظهري، في حين ترسل المنطقة السقيفية البطنية امتدادا دوباميني الفعل من نوع مماثل إلى الجسم المخطط البطني.<ref name=Bjorklund/> |
|||
التقدم في فهم وظائف العقد القاعدية كان بطيئا. <ref name="brs"/> تقترح أشهر الفرضيات -المصرح بها على نطاق واسع- أن القعد القاعدية تلعب دورا رئيسيا في [[اختيار الفعل]].<ref name=chakravarthy>{{cite journal | vauthors = Chakravarthy VS, Joseph D, Bapi RS | title = What do the basal ganglia do? A modeling perspective | journal = Biological Cybernetics | volume = 103 | issue = 3 | pages = 237–53 | date = September 2010 | pmid = 20644953 | doi = 10.1007/s00422-010-0401-y | url = https://www.researchgate.net/publication/45276082 }}</ref> تقترح نظرية اختيار الفعل في أبسط هيئاتها أنه حين يكون شخص أو حيوان في وضعية يجب عليه فيها القيام بفعل من عدة أفعال ممكنة، يحدد النشاط في العقد القاعدية أيّ فعل سيتم تنفيذه عبر تحرير ذلك الفعل من التثبيط مع الاستمرار في منع أنظمة الفعل الأخرى التي إن تم تنشيطها ستقوم بتوليد أفعال منافِسة.<ref name=Floresco>{{cite journal | vauthors = Floresco SB | title = The nucleus accumbens: an interface between cognition, emotion, and action | journal = Annual Review of Psychology | volume = 66 | pages = 25–52 | date = January 2015 | pmid = 25251489 | doi = 10.1146/annurev-psych-010213-115159 | url = https://www.researchgate.net/publication/266085689 }}</ref> وعليه فالعقد القاعدية -في هذا المفهوم- مسؤولة على بدء التصرفات والأفعال لكن ليس على تفاصيل طريقة تنفيذها، بعارة أخرى تشكل العقد القاعدية نظام اتخاذ قرار.<ref name=Floresco/> |
|||
يمكن تقسيم العقد القاعدية إلى عدة قطاعات، لكل واحد منها دور في التحكم بنوع معين من الأفعال.<ref name=Balleine>{{cite journal |vauthors=Balleine BW, Dezfouli A, Ito M, Doya K |year=2015 |title=Hierarchical control of goal-directed action in the cortical–basal ganglia network |journal=Current Opinion in Behavioral Sciences |volume=5 |pages=1–7 |doi=10.1016/j.cobeha.2015.06.001}}</ref> تعمل القطاعات البطنية من العقد القاعدية (تحتوي على الجسم المخطط البطني والمنطقة السقيفية البطنية) على أعلى مستوى في [[سلسلة مراتب|الهرمية]]، وتختار الأفعال على مستوى الكائن بأكمله. |
|||
<ref name=Floresco/> أما القطاعات الظهرية (تحتوي على الجسم المخطط الظهري والمادة السوداء) فتعمل على مستويات منخفضة وتختار عضلات وحركات محددة تُستخدم لتنفيذ نمط سلوك معين.<ref name=Balleine/> |
|||
يساهم الدوبامين في عملية اختيار الفعل على الأقل بطريقتين مهمتين. الأولى، أنه يحدد "العتبة" لبدء الأفعال.<ref name=chakravarthy/> كلما كان نشاط الدوبامين أعلى كلما قل الدافع المطلوب لاستثارة تصرف معين.<ref name=chakravarthy/> كنتيجة لذلك، تقود مستويات الدوبامين المرتفعة إلى مستويات مرتفعة من النشاط الحركي [[اندفاعية|والسلوك الاندفاعي]]، أما المستويات المنخفظة من الدوبامين فتقود إلى [[سبات|فتور]] وردات فعل بطيئة.<ref name=chakravarthy/> يتميز [[مرض باركنسون]] -الذي تكون فيه مستويات الدوبامين في مسار المنطقة السوداء منخفظة بشكل كبير- بالتيبس وصعوبة في بدء الحركة، لكن حين يواجه الأشخاص المصابين به محفزا قويا مثل خطر كبير فإن تصرفاتهم يمكن أن تكون قوية ونشيطة كنظيراتها لدى الأصحاء.<ref name=Jankovic/> عكسيا، يمكن للعقارات التي تزيد إفراز الدوبامين مثل الكوكايين أو ال[[أمفيتامين]] أن تنتج مستويات نشاط حادة -بما في ذلك عند الدرجات القصوى- [[هيجان نفسي حركي]] و[[نمطية|حركات نمطية]].<ref name=Patti>{{cite journal | vauthors = Pattij T, Vanderschuren LJ | title = The neuropharmacology of impulsive behaviour | journal = Trends in Pharmacological Sciences | volume = 29 | issue = 4 | pages = 192–99 | date = April 2008 | pmid = 18304658 | doi = 10.1016/j.tips.2008.01.002 | url = https://www.researchgate.net/publication/5547125 }}</ref> |
|||
التأثير الثاني المهم للدوبامين هو أنه يعمل كإشارة "تعليم".<ref name=chakravarthy/> حين تتبع فعلا ما زيادةٌ في نشاط الدوبامين فذلك يعني أن مسار العقد القاعدية تم تعديله بطريقة تجعل نفس الاستجابة أسهل للاستثارة حين تحدث وضعيات مماثلة في المستقبل.<ref name=chakravarthy/> هذا نوع من [[إشراط استثابي|الإشراط الاستثابي]] ويلعب فيه الدوبامين دور إشارة المكآفأة.<ref name=Floresco/> |
|||
==== المكآفأة ==== |
|||
=== خارج الجهاز العصبي === |
=== خارج الجهاز العصبي === |
||
نسخة 10:47، 9 سبتمبر 2019
هذه مقالة أو قسم تخضع حاليًّا للتوسيع أو إعادة هيكلة جذريّة. إذا كانت لديك استفسارات أو ملاحظات حول عملية التطوير؛ فضلًا اطرحها في صفحة النقاش قبل إجراء أيّ تعديلٍ عليها. فضلًا أزل القالب لو لم تُجرَ أي تعديلات كبيرة على الصفحة في آخر شهر. لو كنت أنت المحرر الذي أضاف هذا القالب وتُحرر المقالة بشكلٍ نشطٍ حاليًّا، فضلًا تأكد من استبداله بقالب {{تحرر}} في أثناء جلسات التحرير النشطة. آخر من عدل المقالة كان Momas (نقاش | مساهمات) منذ 4 سنين (تحديث) |
| دوبامين | |
|---|---|
| الاسم النظامي (IUPAC) | |
4-(2-aminoethyl)benzene-1,2-diol |
|
| أسماء أخرى | |
2-(3,4-dihydroxyphenyl)ethylamine; |
|
| المعرفات | |
| رقم CAS | 51-61-6? 62-31-7 (hydrochloride) |
| بوب كيم (PubChem) | 681 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C8H11NO2 |
| الكتلة المولية | 153.178 |
| نقطة الانصهار | 128 °س، 401 °ك، 262 °ف |
| الذوبانية في الماء | 60.0 g/100 ml |
| المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الدوبامين (بالإنجليزية: Dopamine) مادة كيميائية تتفاعل في الدماغ لتؤثر على كثير من الأحاسيس والسلوكيات بما في ذلك الانتباه، والتوجيه وتحريك الجسم. ويؤدي الدوبامين دوراً رئيسياً في الإحساس بالمتعة والسعادة والإدمان. إن الدوبامين أحد المجموعات الكيميائية التي تسمى النواقل العصبية التي تحمل المعلومات من عصبون (خلية عصبية)، إلى آخر.
وتنتج شبكة من الخلايا العصبية في الدماغ الدوبامين أو تستجيب له. وتوجد في العمق الداخلي للدماغ مجموعتان صغيرتان من الخلايا المنتجة للدوبامين تتواجدان في الدماغ المتوسط وفي النواة القاعدية. وهذه الخلايا تحتوي على مسار كيميائي يغير الحمض الأميني المسمى تيروسين إلى مادة كيميائية تسمى: ل-دوبا، ومن ثم إلى دوبامين.. وتوجد على سطح العصبونات التي تستجيب للدوبامين تركيبات تسمى: مستقبلات الدوبامين.
وهناك خمسة أنواع من مستقبلات الدوبامين. وتعتمد تأثيرات الدوبامين على المكان الذي تُطلق فيه، والكمية التي يتم إطلاقها، وكذلك على أنواع المستقبلات التي جرى تنشيطها.
وتكون مستويات الدوبامين في الدماغ عالية في مراحل الطفولة الأولى وتنخفض بمرور الزمن وتقدم الحياة.
تسبب الزيادة الكبيرة أو الانخفاض الكبير في الدوبامين كثيراً من الأمراض البدنية والعقلية. فعلى سبيل المثال، ترفع أدوية الإدمان من مستويات الدوبامين إلى نفس مستوى وجوده في الدماغ. وتؤدي زيادة الدوبامين لدى أولئك الذين يعانون من الإدمان إلى تغيرات طويلة الأجل أو دائمة في خلايا الدماغ. وتسبب مستويات الدوبامين غير العادية بعض أمراض الحركة مثل مرض باركنسون. ويؤدي اختلال مستوى الدوبامين دوراً كبيراً في أمراض أخرى مثل: فصام (الشيزوفرينيا)، وقصور الانتباه، ومتلازمة توريت, كذلك انعدام التلذذ ,و عدم القدرة على الإحساس بالمتعة عند مزاولة نشاطات عادةً ماتكون ممتعة عند الضحك أو غيرها .
البنية
الكيمياء الحيوية
الوظائف
التأثيرات الخلوية
| العائلة | المستقبل | الجين | النوع | الآلية |
|---|---|---|---|---|
| مماثل لـD1 | D1 | DRD1 | مقترن بـGs | زيادة المستويات داخل الخلوية لـcAMP عبر تنشيط محلِّقة الأدينيلات. |
| D5 | DRD5 | |||
| مماثل لـD2 | D2 | DRD2 | مقترن بـGi | تخفيض المستويات داخل الخلوية لـcAMP عبر تثبيط محلِّقة الأدينيلات. |
| D3 | DRD3 | |||
| D4 | DRD4 | |||
| TAAR | TAAR1 | TAAR1 | مقترن بـGs مقترن بـGq |
زيادة المستويات داخل الخلوية لـcAMP وتركيز الكالسيوم داخل الخلوي |
يمارس الدوبامين تأثيراته عبر الارتباط بـ وتنشيط المستقبلات الغشائية.[5] لدى البشر، للدوبامين ألفة ارتباط عالية مع مستقبلات الدوبامين والمستقبل المرتبط بالأمين النزر 1 البشري (hTAAR1).[3][4] لدى الثدييات، تم تحديد خمس أنواع فرعية من مستقبلات الدوبامين، وسميت من D1 حتى D5.[5] وجميعها تعمل كمستقبلات تحولية، وكمستقبلات مقترنة بالبروتين ج، أي أنها تمارس تأثيراتها عبر نظام رسول ثانٍ معقد.[6] يمكن تقسيم هذه المستقبلات إلى عائلتين تعرف باسم: مماثل لـD1 ومماثل لـD2.[5] بالنسبة للمستقبلات المتواجدة على العصبونات في الجهاز العصبي، التأثير النهائي لتنشيط المستقبلات المماثلة لـD1 (وهي D1 وD5) يمكن أن يكون استثارة (عبر فتح قنوات الصوديوم) أو تثبيطا (عبر فتح قنوات البوتاسيوم)، أما التأثير النهائي لتنشيط المستقبلات المماثلة لـD2 (وهي D3 ،D2 وD4) هي عادة تثبيط العصبون المستهدف.[6] بناء على ذلك، من الخاطئ وصف الدوبامين في حد ذاته كمركب استثاري أو تثبيطي: فتأثيره على العصبون المستهدف يعتمد على أنواع المستقبلات المتواجدة على غشاء ذلك العصبون وعلى الاستجابات الداخلية لذلك العصبون بالنسبة للرسول الثاني cAMP.[6] مستقبلات D1 هي أكثر مستقبلات الدوبامين عددا في الجهاز العصبي البشري، تليها مستقبلات D2، أما المستقبلات D4، D3 وD5 فهي متواجدة بأعداد منخفضة بشكل معتبر.[6]
التخزين، التحرير والاسترداد
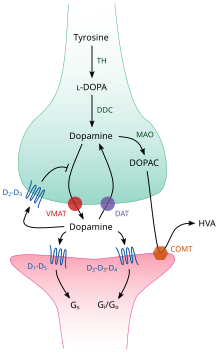
TH: هيدروكسيلاز التيروزين
DOPA: ليفودوبا
DAT: ناقل الدوبامين
DDC: نازعة كربوكسيل دوبا
VMAT: ناقل أحادي الأمين حويصلي 2
MAO: أكسيداز أحادي الأمين
COMT: ناقل كاتيكول-و-مثيل
HVA: حمض الهوموفانيليك
داخل الدماغ، يعمل الدوبامين كناقل عصبي ومعدل عصبي ويتم التحكم فيه عبر مجموعة من الآليات الشائعة عند جميع النواقل العصبية أحادية الأمين.[5] بعد التخليق، يُنقل الدوبامين من العصارة الخلوية في حويصلات مشبكية عبر ناقل مذاب وهو الناقل أحادي الأميني الحويصلي VMAT2.[7] يُخزن الدوبامين في هذه الحويصلات حتى يُطرح في الشق المشبكي. في معظم الحالات، يحدث تحرير الدوبامين عبر عملية تسمى الإيماس والتي تحدث بسبب جهود الفعل، لكن يمكن أن يحدث كذلك بسبب نشاط مستقبل مرتبط بحمض نزر،TAAR1.[4] مستقبل الـTAAR1 ذو ألفة عالية للدوبامين، الأمينات النزرة وبعض مستبدلات الأمفيتامين المتواجدة على طول الأغشية في الوسط داخل الخلوي الخاص بالعصبون قبل المشبكي،[4] يمكن أن يُعدِّل تنشيط المستقبل تأشير الدوبامين عبر إحداث تثبيط استرداد الدوبامين ونقل عكسي له وكذلك تثبيط النشاط العصبوني عبر آليات متنوعة.[4][8]
عندما يبلغ الدوبامين المشبك، يرتبط بمستقبلات الدوبامين وينشطها.[9] يمكن أن تكون هذه الأخيرة مستقبلات دوبامين بعد-مشبكية تتواجد في الزائدة الشجرية (العصبون بعد المشبكي)، أو مستقبلات ذاتية قبل مشبكية (مثل مستقبِلي: D2sh وD3 قبل المشبكي) تتواجد على غشاء محوار طرفي (العصبون قبل الشبكي).[5][9] بعد أن يحصل العصبون بعد المشبكي على جهد فعل، تفك جزيئات الدوبامين بسرعة ارتباطها بالمستقبلات ويُعاد امتصاصها إلى العصبون قبل المشبكي عبر استردادٍ بواسطة ناقل الدوبامين أو ناقل الغشاء البلازمي أحادي الأمين.[10] حين يعود الدوبامين إلى العصارة الخلوية، إما أن يفكك بواسطة أكسيداز أحادي الأمين أو يعاد شحنه في حويصلات بواسطة VMAT2 من أجل توفيره لإفرازات مستقبلية.[7]
في الدماغ، يتم التحكم بمستوى الدوبامين خارج الخلوي عبر آليتين: انتقال طوري وتوتري.[11] يحدث تحرير (إفراز) الدوبامين الطوري -كما هو الحال عند تحرير معظم النواقل العصبية بالجهار العصبي- مباشرة بفعل بالجهود في العصبونات المحتوية على الدوبامين.[11] ويحدث انتقال الدوبامين التوتري حين تُحرَّر كميات صغيرة من الدوبامين من دون أن تسبقها جهود فعل قبل مشبكية.[11] يُنظَّم الانتقال التوتري بواسطة عوامل متنوعة منها: نشاط عصبونات أخرى واسترداد الناقل العصبي.[11]
الجهاز العصبي
داخل الدماغ، يلعب الدوبامين أدوارا مهمة في وظائف تنفيذية، التحكم في الحركة، التحفيز، التيقظ، التعزيز والمكافأة، وكذلك في الوظائف منخفضة المستوى مثل: إفراز الحليب، الارتضاء الجنسي، والغثيان. مسارات ومجموعات الخلية الدوبامينية تشكل نظام الدوبامين وهو نظام تعديلي عصبي
العصبونات دوبامينية الفعل ( الخلايا العصبونية المنتجة للدوبامين) قليلة العدد نسبيا (حوالي 400 ألف في الدماغ البشري[12]) وأجسامها الخلوية محصورة في مجموعات بمناطق معدودة وصغيرة نسبيا في الدماغ.[13] لكن محواراتها تمتد إلى عدة مناطق أخرى من الدماغ وتمارس تأثيرات قوية على أهدافها.[13] تمت موضعة (تحديد موضع) هذه الخلايا دوبامينية الفعل أول مرة سنة 1964 بواسطة أنيكا دالستروم وكجيل فوكس اللذان رمزا لها بحروف A (إشارة إلى aminergic أي أمين الفعل أو تنتج أمينات).[14] في مخططهما، تحتوي المواقع من A1 حتى A7 على الناقل العصبي نورإبينفرين، بينما تحتوي المناطق A8 حتى A14 على الدوبامين. المناطق الدوبامينية الفعل التي تم تحديدها هي: المادة السوداء (المجموعتين 8 و9)، منطقة البطيني السقيفي (المجموعة 10)، تحت المهاد الخلفي (المجموعة 11)، النواة المقوسة (مجموعة 12)، المنطقة العائرة (المجموعة 13) والنواة المحيطة بالبطين (المجموعة 14).

المادة السوداء هي منطقة صغيرة وسط الدماغ وأحد مكونات العقد القاعدية، وتتكون من جزئين منطقة إدخال تسمى الجزء المكتنز ومنطقة إخراج تسمى الجزء الشبكي. تتواجد العصبونات المنتجة للدوبامين بشكل أساسي في الجزء المكتنز (مجموعة الخلية A8) وبجوارها (المجموعة A9).[13] لدى البشر، تعلب العصبونات المنتجة للدوبامين الممتدة من المادة السوداء إلى الجسم المخطط الظهري عبر المسار السودائي المخططي دورا معتبرا في وظيفة الحركة وفي تعلم مهارات حركية جديدة.[15] هذه العصبونات حساسة ومعرضة بشكل خاص للتضرر، وينتج عن موت كمية كبيرة منها متلازمة باركنسونية.[16]
منطقة البطيني السقيفي (VTA) هي منطقة أخرى في وسط الدماغ، تمتد أبرز مجموعات عصبونات VTA المنتجة للدوبامين إلى القشرة الجبهية الأمامية عبر المسار الوسط قشري، كما تمتد مجموعة أخرى صغيرة إلى النواة المتكئة عبر المسار الوسط طرفي. يسمى هذان المساران معا الامتداد الوسط قشري طرفي.[13][15] ترسل الـVTA كذلك امتدادات دوبامينية الفعل نحو اللوزة الدماغية، التلفيف الحزامي، الحصين والبصلة الشمية.[13][15] تلعب العصبونات الوسط قشرية طرفية دورا في المكآفأة وجوانب تحفيز أخرى.[15]
يملك تحت المهاد الخلفي عصبونات دوبامينية تمتد إلى الحبل الشوكي لكن وظيفتها غير معروفة جيدا.[17] توجد بعض الأدلة على أن الاضطرابات في هذه المنطقة تلعب دورا في متلازمة تململ الساقين وهي حالة يعاني فيها المرضى من صعوبةٍ في النوم بسبب شعور قسري عارم لتحريك أجزاء الجسم باستمرار وخاصة القدمين.[17]
تملك النواة المقوسة والنواة المحيطة بالبطين في تحت المهاد عصبونات دوبامينية تشكل امتداد مهما عبر المسار الأحدوبي القمعي إلى الغدة النخامية، أين يؤثر على إفراز هرمون البرولاكتين.[18] الدوبامين هو المثبط العصبي الصماوي الأساسي لإفراز البرولاكتين من الغدة النخامية الأمامية.[18] يُفرَزالدوبامين المخلَّق بواسطة العصبونات في النواة المقوسة داخل الجهاز النخامي البوابي الخاص بالبارزة الناصفة، التي تزود الغدة النخامية.[18] الخلايا المفرزة للبرولاكتين وفي غياب الدوبامين تُفرز البرولاكتين باستمرار، ويقوم الدوبامين بتثبيط هذه العملية.[18] في سياق تنظيم إفراز البرولاكتين، يسمى الدوبامين عامل تثبيط البرولاكتين، الهرمون المثبط للبرولاكتين، أو برولاكتوستاتين (مثبط البرولاكتين).[18]
تمتد المنطقة العائرة الواقعة بين النواة المقوسة والنواة المحيطة بالبطين إلى عدة مناطق من تحت المهاد وتشارك في التحكم بالهرمون المطلق للغونادوتروبين الضروري لتنشيط نمو الأجهزة التناسلية الذكرية والأنثوية.[18]
تتواجد مجموعة إضافية من العصبونات المفرِزة للدوبامين في شبكية العين.[19] هذه العصبونات هي خلايا أماكرين ويعني ذلك أنها لا تملك محوارات،[19] وتحرر الدوبامين إلى الوسط خارج الخلوي وهي نشطة بشكل خاص خلال ساعات النهار وتصبح ساكتة في الليل.[19] يعمل هذا الدوبامين الشبكي على تحسين نشاط الخلايا المخروطية في الشبكية مع تثبيط الخلايا العصوية من أجل زيادة التحسس للألوان والتباين في حالة الضوء الساطع، على حساب تحسس منخفض حين يكون الضوء خافتا.[19]
العقد القاعدية

أكبر وأهم مصادر الدوبامين في الفقاريات هي المادة السوداء والمنطقة السقيفية البطنية، ولهاتين البُنيتين صلة وثيقة ببعضهما ودور وظيفي متماثل في العديد من النواحي.[13] فكلاهما مكوِّن من مكونات العقد القاعدية والتي هي شبكة معقدة من البُنى المتواجدة أساسا في قاعدة الدماغ الأمامي.[13] أكبر مكون للعقد القاعدية هو الجسم المخطط.[20] ترسل المادة السوداء امتدادات دوبامينية الفعل إلى الجسم المخطط الظهري، في حين ترسل المنطقة السقيفية البطنية امتدادا دوباميني الفعل من نوع مماثل إلى الجسم المخطط البطني.[13]
التقدم في فهم وظائف العقد القاعدية كان بطيئا. [20] تقترح أشهر الفرضيات -المصرح بها على نطاق واسع- أن القعد القاعدية تلعب دورا رئيسيا في اختيار الفعل.[21] تقترح نظرية اختيار الفعل في أبسط هيئاتها أنه حين يكون شخص أو حيوان في وضعية يجب عليه فيها القيام بفعل من عدة أفعال ممكنة، يحدد النشاط في العقد القاعدية أيّ فعل سيتم تنفيذه عبر تحرير ذلك الفعل من التثبيط مع الاستمرار في منع أنظمة الفعل الأخرى التي إن تم تنشيطها ستقوم بتوليد أفعال منافِسة.[22] وعليه فالعقد القاعدية -في هذا المفهوم- مسؤولة على بدء التصرفات والأفعال لكن ليس على تفاصيل طريقة تنفيذها، بعارة أخرى تشكل العقد القاعدية نظام اتخاذ قرار.[22]
يمكن تقسيم العقد القاعدية إلى عدة قطاعات، لكل واحد منها دور في التحكم بنوع معين من الأفعال.[23] تعمل القطاعات البطنية من العقد القاعدية (تحتوي على الجسم المخطط البطني والمنطقة السقيفية البطنية) على أعلى مستوى في الهرمية، وتختار الأفعال على مستوى الكائن بأكمله. [22] أما القطاعات الظهرية (تحتوي على الجسم المخطط الظهري والمادة السوداء) فتعمل على مستويات منخفضة وتختار عضلات وحركات محددة تُستخدم لتنفيذ نمط سلوك معين.[23]
يساهم الدوبامين في عملية اختيار الفعل على الأقل بطريقتين مهمتين. الأولى، أنه يحدد "العتبة" لبدء الأفعال.[21] كلما كان نشاط الدوبامين أعلى كلما قل الدافع المطلوب لاستثارة تصرف معين.[21] كنتيجة لذلك، تقود مستويات الدوبامين المرتفعة إلى مستويات مرتفعة من النشاط الحركي والسلوك الاندفاعي، أما المستويات المنخفظة من الدوبامين فتقود إلى فتور وردات فعل بطيئة.[21] يتميز مرض باركنسون -الذي تكون فيه مستويات الدوبامين في مسار المنطقة السوداء منخفظة بشكل كبير- بالتيبس وصعوبة في بدء الحركة، لكن حين يواجه الأشخاص المصابين به محفزا قويا مثل خطر كبير فإن تصرفاتهم يمكن أن تكون قوية ونشيطة كنظيراتها لدى الأصحاء.[24] عكسيا، يمكن للعقارات التي تزيد إفراز الدوبامين مثل الكوكايين أو الأمفيتامين أن تنتج مستويات نشاط حادة -بما في ذلك عند الدرجات القصوى- هيجان نفسي حركي وحركات نمطية.[25]
التأثير الثاني المهم للدوبامين هو أنه يعمل كإشارة "تعليم".[21] حين تتبع فعلا ما زيادةٌ في نشاط الدوبامين فذلك يعني أن مسار العقد القاعدية تم تعديله بطريقة تجعل نفس الاستجابة أسهل للاستثارة حين تحدث وضعيات مماثلة في المستقبل.[21] هذا نوع من الإشراط الاستثابي ويلعب فيه الدوبامين دور إشارة المكآفأة.[22]
المكآفأة
خارج الجهاز العصبي
الاستخدامات الطبية
أمراض، اضطرابات، وصيدلانية
علم أحياء وتطور مقارن
التاريخ والتطوير
انظر أيضاً
المراجع
- ^ أ ب dopamine (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ أ ب "Dopamine: Biological activity". IUPHAR/BPS guide to pharmacology. International Union of Basic and Clinical Pharmacology. مؤرشف من الأصل في 2018-09-16. اطلع عليه بتاريخ 2016-01-29.
- ^ أ ب ت ث ج Grandy DK، Miller GM، Li JX (فبراير 2016). ""TAARgeting Addiction" – The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug and Alcohol Dependence. ج. 159: 9–16. DOI:10.1016/j.drugalcdep.2015.11.014. PMC:4724540. PMID:26644139.
TAAR1 is a high-affinity receptor for METH/AMPH and DA
- ^ أ ب ت ث ج Seeman P (2009). "Chapter 1: Historical overview: Introduction to the dopamine receptors". في Neve K (المحرر). The Dopamine Receptors. Springer. ص. 1–22. ISBN:978-1-60327-333-6.
- ^ أ ب ت ث Romanelli RJ، Williams JT، Neve KA (2009). "Chapter 6: Dopamine receptor signalling: intracellular pathways to behavior". في Neve KA (المحرر). The Dopamine Receptors. Springer. ص. 137–74. ISBN:978-1-60327-333-6.
- ^ أ ب Eiden LE، Schäfer MK، Weihe E، Schütz B (فبراير 2004). "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine". Pflügers Archiv. ج. 447 ع. 5: 636–40. DOI:10.1007/s00424-003-1100-5. PMID:12827358.
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعMiller - ^ أ ب Beaulieu JM، Gainetdinov RR (مارس 2011). "The physiology, signaling, and pharmacology of dopamine receptors". Pharmacological Reviews. ج. 63 ع. 1: 182–217. DOI:10.1124/pr.110.002642. PMID:21303898.
- ^ Torres GE، Gainetdinov RR، Caron MG (يناير 2003). "Plasma membrane monoamine transporters: structure, regulation and function". Nature Reviews. Neuroscience. ج. 4 ع. 1: 13–25. DOI:10.1038/nrn1008. PMID:12511858.
- ^ أ ب ت ث Rice ME، Patel JC، Cragg SJ (ديسمبر 2011). "Dopamine release in the basal ganglia". Neuroscience. ج. 198: 112–37. DOI:10.1016/j.neuroscience.2011.08.066. PMC:3357127. PMID:21939738.
- ^ Schultz W (2007). "Multiple dopamine functions at different time courses". Annual Review of Neuroscience. ج. 30: 259–88. DOI:10.1146/annurev.neuro.28.061604.135722. PMID:17600522.
- ^ أ ب ت ث ج ح خ د Björklund A، Dunnett SB (مايو 2007). "Dopamine neuron systems in the brain: an update". Trends in Neurosciences. ج. 30 ع. 5: 194–202. DOI:10.1016/j.tins.2007.03.006. PMID:17408759.
- ^ Dahlstroem A، Fuxe K (1964). "Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons". Acta Physiologica Scandinavica. Supplementum. ج. 232: SUPPL 232:1–55. PMID:14229500.
- ^ أ ب ت ث Malenka RC، Nestler EJ، Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". في Sydor A، Brown RY (المحررون). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (ط. 2nd). New York: McGraw-Hill Medical. ص. 147–48, 154–57. ISBN:978-0-07-148127-4.
- ^ Christine CW، Aminoff MJ (سبتمبر 2004). "Clinical differentiation of parkinsonian syndromes: prognostic and therapeutic relevance". The American Journal of Medicine. ج. 117 ع. 6: 412–19. DOI:10.1016/j.amjmed.2004.03.032. PMID:15380498.
- ^ أ ب Paulus W، Schomburg ED (يونيو 2006). "Dopamine and the spinal cord in restless legs syndrome: does spinal cord physiology reveal a basis for augmentation?". Sleep Medicine Reviews. ج. 10 ع. 3: 185–96. DOI:10.1016/j.smrv.2006.01.004. PMID:16762808.
- ^ أ ب ت ث ج ح Ben-Jonathan N، Hnasko R (ديسمبر 2001). "Dopamine as a prolactin (PRL) inhibitor". Endocrine Reviews. ج. 22 ع. 6: 724–63. DOI:10.1210/er.22.6.724. PMID:11739329.
- ^ أ ب ت ث Witkovsky P (يناير 2004). "Dopamine and retinal function". Documenta Ophthalmologica. Advances in Ophthalmology. ج. 108 ع. 1: 17–40. DOI:10.1023/B:DOOP.0000019487.88486.0a. PMID:15104164.
- ^ أ ب Fix JD (2008). "Basal Ganglia and the Striatal Motor System". Neuroanatomy (Board Review Series) (ط. 4th). Baltimore: Wulters Kluwer & Lippincott Wiliams & Wilkins. ص. 274–81. ISBN:978-0-7817-7245-7.
- ^ أ ب ت ث ج ح Chakravarthy VS، Joseph D، Bapi RS (سبتمبر 2010). "What do the basal ganglia do? A modeling perspective". Biological Cybernetics. ج. 103 ع. 3: 237–53. DOI:10.1007/s00422-010-0401-y. PMID:20644953.
- ^ أ ب ت ث Floresco SB (يناير 2015). "The nucleus accumbens: an interface between cognition, emotion, and action". Annual Review of Psychology. ج. 66: 25–52. DOI:10.1146/annurev-psych-010213-115159. PMID:25251489.
- ^ أ ب Balleine BW، Dezfouli A، Ito M، Doya K (2015). "Hierarchical control of goal-directed action in the cortical–basal ganglia network". Current Opinion in Behavioral Sciences. ج. 5: 1–7. DOI:10.1016/j.cobeha.2015.06.001.
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعJankovic - ^ Pattij T، Vanderschuren LJ (أبريل 2008). "The neuropharmacology of impulsive behaviour". Trends in Pharmacological Sciences. ج. 29 ع. 4: 192–99. DOI:10.1016/j.tips.2008.01.002. PMID:18304658.
| في كومنز صور وملفات عن: دوبامين |