انصمام رئوي: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
ط بوت:عنونة مرجع غير معنون (1.3) |
Nada Mawaldi (نقاش | مساهمات) لا ملخص تعديل |
||
| سطر 194: | سطر 194: | ||
=== مضادات التخثر === |
=== مضادات التخثر === |
||
العلاج المضاد للتخثر هو الدعامة الأساسية للعلاج. لسنوات عديدة، كانت [[مضادات فيتامين ك]] ([[الوارفارين]] أو أقل شيوعاً [[أسينوكومارول]] أو [[فينوبروكومون]]) هي حجر الزاوية في العلاج. نظراً لأن مضادات فيتامين ك لا تعمل على الفور، فإن العلاج الأولي يكون بمضادات التخثر القابلة للحقن سريعة المفعول: [[هيبارين|الهيبارين غير المجزأ]] (UFH)، أو [[هيبارين منخفض الوزن الجزيئي|الهيبارين منخفض الوزن الجزيئي]] (LMWH)، أو [[فوندابارينوكس]]، في حين يتم البدء بمضادات فيتامين K الفموية ومعايرتها (عادةً كجزء من العلاج للمرضى المستشفيين) عبر [[زمن_البروثرومبين#النسبة_المعيارية_الدولية_INR|النسبة المعيارية الدولية]] INR، وهو اختبار يحدد الجرعة.<ref name=Chest2016/> فيما يتعلق بالعلاجات القابلة للحقن، قد يقلل الهيبارين منخفض الوزن الجزيئي من احتمال حدوث [[النزف]] عند الأشخاص المصابين بالانصمام الرئوي مقارنةً بالهيبارين غير المجزأ.<ref name=Robertson2017>{{cite journal | vauthors = Robertson L, Jones LE | title = Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for the initial treatment of venous thromboembolism | journal = The Cochrane Database of Systematic Reviews | volume = 2017 | pages = CD001100 | date = February 2017 | issue = 2 | pmid = 28182249 | pmc = 6464611 | doi = 10.1002/14651858.CD001100.pub4 }}</ref> وكذلك قلل الهيبارين منخفض الوزن الجزيئي من تكرر الخثار وقلل حجم الخثرة مقارنةً بالهيبارين. لم يكن هناك فرق في معدل الوفيات الإجمالي بين المعالجين بالهيبارين المنخفض الوزن منخفض الوزن الجزيئي والمعالجين بالهيبارين غير المجزأ.<ref name=Robertson2017/> تتطلب مضادات فيتامين ك تعديل الجرعة بشكل متكرر ومراقبة النسبة المعيارية الدولية (INR). في الانصمام الرئوي، تعتبر قيم INR بين 2.0 و 3.0 مثالية بشكل عام.<ref name=Chest2016/> في حالة حدوث نوبة أخرى من الانصمام الرئوي أثناء العلاج بالوارفارين، يمكن زيادة نافذة INR على سبيل المثال 2.5-3.5 (ما لم تكن هناك مضادات استطباب) أو يمكن تغيير مانع التخثر إلى نوع آخر مثل الهيبارين منخفض الوزن الجزيئي.<ref name="Chest2016" /> في السنوات الأخيرة، قُدِّمت العديد من مضادات التخثر الشبيهة بالوارفارين لكنها لا تحتاج لمعايرة INR. تُعرف باسم [[مضاد تخثر|مضادات التخثر الفموية مباشرة التأثير]]، وحالياً تفضل هذه العلاجات على مضادات فيتامين K وفقاً للإرشادات المهنية الأمريكية.<ref name=Chest2016/> اثنان منها ([[ريفاروكسيبان|ريفاروكسابان]] و[[أبيكسابان]]) لا يتطلبان علاجاً أولياً بالهيبارين أوفوندابارينكس، على خلاف [[دابيغاتران]] و[[إيدوكسابان]].<ref name=Chest2016/> وجدت مراجعة كوكرين أنه لا يوجد دليل على وجود فرق بين مانعات التخثر مباشرة التأثير الفموية (ريفاروكسابان، أبيكسابان، دابيغاتران، وإيدوكسابان) ومانعات التخثر القياسية في الوقاية من الانصمام الرئوي المتكرر.<ref>{{cite journal | vauthors = Robertson L, Kesteven P, McCaslin JE | title = Oral direct thrombin inhibitors or oral factor Xa inhibitors for the treatment of pulmonary embolism | journal = The Cochrane Database of Systematic Reviews | issue = 12 | pages = CD010957 | date = December 2015 | pmid = 26636644 | pmc = 6463831 | doi = 10.1002/14651858.CD010957.pub2 | collaboration = Cochrane Vascular Group }}</ref> |
|||
في غالبية الحالات تكون مضادات التخثر عماد العلاج، [[هيبارين|الهيبارين]] والهيبارين ذو الوزن الجزيئي المنخفض يكونان العقار المستخدم في البداية ثم يحول المريض إلى العلاج بال[[وارفارين|وارفرين]]، معظم حالات الانصمام الرئوي تستدعي الإدخال للمستشفى بهدف المراقبة والعلاج ويستوجب العلاج بالعقاقير [[مضاد تخثر|مضادة التخثر]] المتابعة عبر فحوصات سرعة تجلط الدم وعدد الصفائح الدموية والفحص العالمي المعادل [[روبية هندية]]، عند العلاج بال[[وارفارين|وارفرين]] يجب ابقاء مستوى [[روبية هندية]] بين 2-3 وبين 2.5-3.5 في حال كان المريض قد تعرض لحالة انصمام رئوي أو [[خثار وريدي عميق]] سابقاً. |
|||
* يعطى المريض [[هيبارين|الهيبارين]] داخل المستشفى في المرحلة المبكرة من العلاج. |
|||
* يتم استبدال [[هيبارين|الهيبارين]] بال[[وارفارين|وارفرين]] خلال الأيام الخمسة الأولى من العلاج. |
|||
* قد يضطر المريض إلى الاستمرار على [[هيبارين|الهيبارين]] وعدم التحويل إلى ال[[وارفارين|وارفرين]] في حالة [[حمل|الحمل]] أو الحساسية لعقار ال[[وارفارين|وارفرين]]. |
|||
* يستمر العلاج بالعقاقير [[مضاد تخثر|المضادة للتخثر]] لمدة 3-6 أشهر في حال عدم وجود إصابة سابقة بالانصمام الرئوي أو الخثار الوريدي العميق، وفي حال وجود إصابة سابقة بأي منهم يكون العلاج ب[[مضادات التخثر]] لازماً مدى الحياة. |
|||
عند مرضى السرطان الذين أصيبوا بانصمام رئوي، يُفضل العلاج بكورس من الهيبارين المنخفض الوزن الجزيئي على العلاج بالوارفارين أو مضادات التخثر الفموية الأخرى.<ref name=Chest2016/><ref name=NICECG144/> وبالمثل، تُعالج النساء الحوامل باستخدام الهيبارين منخفض الوزن الجزيئي إلى ما بعد الولادة لتجنب تأثيرات الوارفارين [[علم المسوخ|المشوهة للجنين]]، خاصة في المراحل الباكرة من الحمل،ولكن يمكن استخدامه أثناء الرضاعة الطبيعية.<ref name=RCOG37b/> |
|||
| ⚫ | |||
عادة ما يستمر العلاج بمضادات التخثر لمدة 3-6 أشهر، أو "مدى الحياة" إذا كان هناك حالات سابقة لخثار وريدي عميق أو انصامات رئوية، أو لم يكن هناك أي من عوامل الخطر العابرة المعتادة.<ref name=Chest2016/><ref name=NICECG144/> بالنسبة للمرضى بدون سبب معروف يمكن عكسه، قد يكون العلاج لمدة عامين أفضل من 6 أشهر.<ref>{{cite journal | vauthors = Mai V, Guay CA, Perreault L, Bonnet S, Bertoletti L, Lacasse Y, Jardel S, Lega JC, Provencher S | display-authors = 6 | title = Extended Anticoagulation for VTE: A Systematic Review and Meta-Analysis | journal = Chest | volume = 155 | issue = 6 | pages = 1199–1216 | date = June 2019 | pmid = 31174635 | doi = 10.1016/j.chest.2019.02.402 }}</ref> بالنسبة للمرضى المصابين بصمات رئوية صغيرة (المعروفة باسم انصمامات رئوية تحت قطعية)، فإن التأثيرات المانعة للتخثر غير معروفة لأنه لم يتم دراستها بشكل كافي حتى عام 2020.<ref>{{cite journal | vauthors = Yoo HH, Nunes-Nogueira VS, Fortes Villas Boas PJ | title = Anticoagulant treatment for subsegmental pulmonary embolism | journal = The Cochrane Database of Systematic Reviews | volume = 2 | pages = CD010222 | date = February 2020 | pmid = 32030721 | pmc = 7004894 | doi = 10.1002/14651858.CD010222.pub4 }}</ref> |
|||
| ⚫ | |||
يتم وضع مصفاة في [[وريد أجوف سفلي|الوريد الأجوف السفلي]] عندما يكون العلاج ب[[مضاد تخثر|مضادات التخثر]] غير ممكن، يتم وضع المصفاة عادة من خلال الولوج عبر [[وريد ودجي|الوريد الودجي]] أو [[وريد فخذي|الوريد الفخذي]] ويتم تثبيت المصفاة عادة في [[وريد أجوف سفلي|الوريد الأجوف السفلي]] قبل نقطة الالتقاء مع [[وريد كلوي|الوريد الكلوي]].<ref name=pmid9459643>{{استشهاد بدورية محكمة |مؤلف=Decousus H, Leizorovicz A, Parent F, Page Y, Tardy B, Girard P, Laporte S, Faivre R, Charbonnier B, Barral F, Huet Y, Simonneau G |عنوان=A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d'Embolie Pulmonaire par Interruption Cave Study Group |صحيفة=N Engl J Med |المجلد=338 |العدد=7 |صفحات=409–15 |سنة=1998 |pmid=9459643 |doi=10.1056/NEJM199802123380701}}</ref> |
يتم وضع مصفاة في [[وريد أجوف سفلي|الوريد الأجوف السفلي]] عندما يكون العلاج ب[[مضاد تخثر|مضادات التخثر]] غير ممكن، يتم وضع المصفاة عادة من خلال الولوج عبر [[وريد ودجي|الوريد الودجي]] أو [[وريد فخذي|الوريد الفخذي]] ويتم تثبيت المصفاة عادة في [[وريد أجوف سفلي|الوريد الأجوف السفلي]] قبل نقطة الالتقاء مع [[وريد كلوي|الوريد الكلوي]].<ref name=pmid9459643>{{استشهاد بدورية محكمة |مؤلف=Decousus H, Leizorovicz A, Parent F, Page Y, Tardy B, Girard P, Laporte S, Faivre R, Charbonnier B, Barral F, Huet Y, Simonneau G |عنوان=A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d'Embolie Pulmonaire par Interruption Cave Study Group |صحيفة=N Engl J Med |المجلد=338 |العدد=7 |صفحات=409–15 |سنة=1998 |pmid=9459643 |doi=10.1056/NEJM199802123380701}}</ref> |
||
نسخة 20:31، 29 سبتمبر 2021
| انصمام رئوي | |
|---|---|
 رسم توضيحي للرئة يصور الانصمام الرئوي على أنه خثرة (جلطة دموية) انتقلت من منطقة أخرى من الجسم، مسببة انسداد الشريان الرئوي القصبي، مما يؤدي إلى خثار شرياني من الفصوص العلوية والسفلية في الرئة اليسرى
| |
| معلومات عامة | |
| الاختصاص | علم الدم، طب القلب، طب الرئة |
| الأسباب | |
| عوامل الخطر | السرطان، الراحة في الفراش لفترات طويلة، التدخين، السكتة الدماغية، بعض الحالات الوراثية، الأدوية الحاوية على هرمون الاستروجين، الحمل، البدانة، بعد الجراحة[1] |
| المظهر السريري | |
| البداية المعتادة | أعمار متقدمة [1] |
| الأعراض | ضيق النفس، ألم الصدر، نفث دموي[2] |
| المضاعفات | غشي، صدمة، الموت المفاجئ[3] |
| الإدارة | |
| التشخيص | تعتمد على الأعراض، D-dimer، تصوير مقطعي محوسب للأوعية الرئوية، تصوير الرئتين بالنظائر المشعة[4] |
| العلاج | ممعيات (هيبارين، وارفارين، مميعات فموي ذات تأثير مباشر DOAC)[5] |
| أدوية | وارفارين، وأنيسينديون، وفينوبروكومون، ودالتيبارين الصوديوم، وبابافيرين، وستربتوكاينيز، وديكومارول، وأبيكسابان، وفوندابارينوكس ، وإيدوكسابان، وريفاروكسابان، وألتيبلاس، وإيدوكسابان، وهيبارين
|
| الوبائيات | |
| انتشار المرض | حوالي 450000/سنة (في الولايات المتحدة الأمريكية)، 430000 (في أوروبا)[6][7][8] |
| الوفيات | >10-12000/سنة (في الولايات المتحدة الأمريكية)،[9] >30-40000 (في أوروبا)[10] |
| تعديل مصدري - تعديل | |
الانصمام الرئوي (بالإنجليزية: Pulmonary embolism) (PE) هو انسداد في أحد شرايين الرئتين بمادة انتقلت من مكان آخر في الجسم عبر مجرى الدم (انسداد وعائي).[6] قد تشمل أعراض الانصمام الرئوي زلة تنفسية، ألم صدري خاصة عند التنفس، ونفث دموي.[2] قد تظهر أيضاً أعراض خثرة دموية في الساق، مثل ساق حمراء، دافئة، متوذمة، ومؤلمة.[2] تشمل علامات الانصمام الرئوي انخفاض مستويات الأكسجين في الدم، تسرع التنفس، تسرع القلب، وأحياناً حمى خفيفة.[11] يمكن أن تؤدي الحالات الشديدة إلى الغيبوبة، انخفاض ضغط الدم بشكل غير طبيعي، والموت المفاجئ.[3]
عادة ما يحدث الانصمام الرئوي نتيجة خثرة دموية في الساق انتقلت إلى الرئة.[6] يزداد خطر الإصابة بالخثرات الدموية عند مرضى السرطان، الراحة في الفراش لفترات طويلة، التدخين، السكتة الدماغية، بعض الحالات الوراثية، الأدوية الحاوية على هرمون الاستروجين، الحمل، البدانة، بعد الجراحة.[1] ترجع نسبة صغيرة من الحالات إلى انصمام بالهواء، أو الدهون، أو السائل الأمنيوسي.[12][13] يعتمد التشخيص على العلامات والأعراض جنباً إلى جنب مع نتائج الاختبارات.[4] إذا كان خطر الإصابة منخفضاً، فقد يستبعد الفحص الدموي المعروف باسم D-dimer الحالة.[4] وبخلاف ذلك، فإن تصوير الأوعية الرئوية المقطعي المحوسب أو تصوير الرئة بالنظائر المشعة أو الموجات فوق الصوتية للساقين قد يؤكد التشخيص.[4] يُعرف الخثار الوريدي العميق والانصمام الرئوي معاً باسم الخثار الوريدي (VTE).[14]
تشمل عوامل الوقاية من الانصمام الرئوي البدء في تحريك المريض بأسرع وقت ممكن بعد الجراحة، وتمارين الساقين أثناء فترات الجلوس، واستخدام مميعات الدم بعد بعض أنواع الجراحات.[15] يتم العلاج بمضادات التخثر مثل الهيبارين أو الوارفارين أو أحد مضادات التخثر الفموية ذات التأثير المباشر.[5] يوصى بالمميعات لمدة ثلاثة أشهر على الأقل.[5] قد تتطلب الحالات الشديدة حل الخثرة باستخدام الأدوية مثل منشط بلازمينوجين النسيجي (tPA) الذي يعطى وريدياً أو بواسطة قسطرة، وقد يتطلب البعض إجراء عملية جراحية (استئصال الخثرة الرئوية).[16] إذا كانت مميعات الدم غير مناسبة، فيمكن استخدام مرشح الوريد الأجوف المؤقت.[16]
تؤثر الصمات الرئوية على حوالي 430000 شخص كل عام في أوروبا.[8] أما في الولايات المتحدة، تصيب ما بين 300000 و 600000 شخص كل عام،[6][7] والتي تساهم في 40000 حالة وفاة على الأقل.[9] معدلات الإصابة متشابهة في الذكور والإناث.[1] تصبح أكثر شيوعاً مع تقدم الناس في السن.[1]
الأعراض والعلامات
عادة ما تظهر أعراض الانصمام الرئوي بشكل مفاجئ وقد تشمل واحد أو أكثر مما يلي: زلة تنفسية (ضيق التنفس)، تسرع التنفس (التنفس السريع)، ألم صدري جنبي "التهاب الجنبة" (يزداد سوءًا بالتنفس)، سعال، ونفث دموي (سعال مدمى).[17] أما العلامات التي قد تلاحظ في الحالات الأشد: الزرقة (اللون الأزرق، عادة في الشفاه والأصابع)، الوهط، وعدم استقرار الدورة الدموية بسبب انخفاض تدفق الدم عبر الرئتين والجانب الأيسر من القلب. حوالي 15٪ من جميع حالات الوفاة المفاجئة تُعزى إلى الانصمام الرئوي.[3] في حين أن الانصمام الرئوي قد يتظاهر بغشي، إذ أقل من 1٪ من حالات الغشي تحدث بسبب الصمة الرئوية.[18]
عند الفحص السريري، عادة ما تكون الرئتان طبيعيتان. قد يُسمع أحياناً احتكاك جنبي فوق المنطقة المصابة من الرئة (غالباً في الانصمام الرئوي مع احتشاء). يوجد أحياناً انصباب جنب الذي يكون نضحياً، ويمكن اكتشافه أثناء الفحص عبر الأصمية بالقرع، خفوت أصوات التنفس، والاهتزاز الصوتي. يمكن أن نجد علامات إجهاد بطين أيمن على شكل رفعة أيسر القص، وارتفاع صوت الجزء الرئوي من صوت القلب الثاني، و/أو ارتفاع ضغط الوريد الوداجي.[3] قد توجد حمى خفيفة، خاصة إذا كان هناك نزف أو احتشاء رئوي.[19]
نظراً لأن الصمات الرئوية الأصغر تميل إلى الاستقرار في مناطق رئوية محيطية التي تفتقر الدوران الجانبي، فمن المرجح أن تسبب احتشاء رئوي وانصباب جنب صغير (كلاهما مؤلم)، ولكن لا تسبب نقص أكسجة، زلة تنفسية، وعدم استقرار هيموديناميكي مثل تسرع القلب. عادةً ما تسبب الصمات الرئوية الأكبر، التي تميل إلى الاستقرار مركزياً، زلة تنفسية، نقص أكسجة، انخفاض ضغط الدم، تسرع القلب، والإغماء، ولكنها غالباً ما تكون غير مؤلمة لعدم وجود احتشاء رئوي لتمتعها بالدوران الدموي الجانبي. غالباً ما يتم تفويت الصمات الصغيرة لأنها تسبب ألم جنبي فقط بدون أي موجودات أخرى وأيضاً غالباً ما يتم تفويت الصمات الرئوية الكبيرة لأنها غير مؤلمة وتحاكي الحالات الأخرى التي تسبب تغيرات في تخطيط القلب الكهربائي وارتفاع طفيف في مستويات التروبونين والببتيد الدماغي المدر للصوديوم.[20]
توصف الصمات الرئوية أحياناً بأنها ضخمة، تحت ضخمة، وغير ضخمة اعتماداً على العلامات والأعراض السريرية. على الرغم من أن التعريفات الدقيقة غير واضحة، إلا أن التعريف المقبول للصمة الرئوية الضخمة هو الذي يشتمل على عدم استقرار هيموديناميكي مثل انخفاض ضغط الدم المستمر، تباطؤ معدل ضربات القلب، أو توقف النبض.[21]
عوامل الخطر

حوالي 90٪ من الصمات ناتجة عن خثار الأوردة العميقة القريبة في الساق (DVTs) أو خثار أوردة الحوض.[22] تشكل الإصابة بخثار الأوردة العميقة عامل خطر لانزلاق وهجرة الخثرات إلى الدورة الدموية الرئوية. تدعى هذه الحالات عموماً بـ الصمات الخثرية الوريدية (VTE).
تعد الصمات الخثرية الوريدية أكثر شيوعاً في الأفراد الذين يعانون من نقص المناعة وكذلك المصابين بأمراض مرافقة، حيث يعود تطور الخثار بشكل كلاسيكي إلى مجموعة من الأسباب تسمى ثالوث فيرخوف (تغيرات جريان الدم، عوامل في جدار الوعاء الدموي، وعوامل تؤثر على خصائص الدم)، وغالباً، يوجد أكثر من عامل خطر واحد.
- تغيرات جريان الدم: عدم الحركة (بعد الجراحة خاصة الجراحات العظمية في أو أسفل الورك دون وقاية من الخثرات،[23][24] أو عمليات تثبيت المفاصل خاصة مفاصل الساقين،[24] الطيران لمسافات طويلة)، الإصابة، الحمل (محفز للتخثر أيضاً)، البدانة (محفز للتخثر أيضاً)، السرطان (محفز للتخثر أيضاً).
- عوامل في جدار الوعاء الدموي: الجراحة (بسبب التلف الوريدي أثناء الجراحة[24])، القثطرة تسبب إصابة مباشرة ("إصابة بطانة الوعاء").
- العوامل المؤثرة على خصائص الدم (الحالة المحفزة للتخثر): وسائل تحديد النسل الهرمونية المحتوية على الإستروجين،[24] الحمل (نظراً لأن الجسم يضع نفسه في ما يعرف باسم "حالة فرط التخثر"، لتقليل خطر حدوث نزيف أثناء الولادة وينظم ذلك من خلال زيادة التعبير عن العامل السابع، الثامن، العاشر، عامل فون ويلبراند، والفيبرينوجين[24])، أهبة التخثر الوراثية (العامل الخامس لايدن، طفرة البروثرومبين G20210A، عوز البروتين C، عوز البروتين S، عوز أنتي الثرومبين، فرط هوموسيستين الدم واضطرابات البلازمينوجين/ انحلال الفبرين)، أهبة التخثر المكتسبة (متلازمة أضداد الفوسفوليبيد، المتلازمة الكلائية، البيلة الخضابية الليلية الانتيابية)، السرطان (مرضى سرطان البنكرياس والكولون "قد تكون أشكال السرطان الأخرى أيضاً من العوامل المؤهبة خاصة الأورام عالية الدرجة، ولكن سرطان البنكرياس والكولون أكثر شيوعاً"، هذا يرجع إلى إطلاق المواد المسببة للتخثر، ويبلغ خطر الإصابة بالصمات الخثرية الوريدية (VTE) ذروته أثناء التشخيص والعلاج، ولكنه يقل في فترة الشفاء.[24])
تشمل عوامل الخطر الأخرى: دوالي وريدية محدثة بتخرب وعائي،[23] فرط ضغط الدم الرئوي،[23] داء السكري.[23]
التشخيص

من أجل تشخيص الانصمام الرئوي، يوصى بمراجعة المعايير السريرية لتحديد الحاجة إلى الاختبارات.[25] بالنسبة لأولئك ذوي الخطورة المنخفضة: عمر أقل من 50، معدل ضربات القلب أقل من 100 نبضة في الدقيقة، مستوى الأكسجين أكثر من 94٪ في هواء الغرفة، لا يوجد وذمة ساق أو نفث دموي أو جراحة أو رض في الأسابيع الأربعة الماضية أو حوادث خثرية سابقة أو استخدام لهرمون الاستروجين، عادة لا تكون هناك حاجة لمزيد من الاختبارات.[26]
في الحالات التي يكون فيها الأفراد ذوي الخطورة العالية، هناك حاجة للمزيد من الاختبارات. يعتبر تصوير الأوعية الرئوية بالطبقي المقطعي المحوسب (CTPA) الطريقة المفضلة لتشخيص الانصمام الرئوي نظراً لسهولة إجراؤه ودقته.[27] على الرغم من أن تصوير الأوعية الرئوية بالطبقي المقطعي المحوسب مفضل، إلا أن هناك اختبارات أخرى يمكن إجراؤها.[25][28][29] على سبيل المثال، يمكن استخدام الموجات فوق الصوتية الضاغطة لاستقصاء أوردة الطرف السفلي القريبة.[27] يستخدم هذا الاختبار في المقام الأول كاختبار تأكيدي، مما يعني أنه يؤكد تحليلاً سابقاً يُظهر وجود أو اشتباه في وجود انصمام رئوي.[27] وفقاً لدراسة مقطعية، فإن التصوير بالموجات فوق الصوتية الضاغطة له حساسية 41٪ ونوعية 96٪.[27]
يعتمد تشخيص الانصمام الرئوي بشكل أساسي على مزيج من معايير سريرية مع اختبارات نوعية لأن الأعراض السريرية النموذجية للانصمام الرئوي (زلة تنفسية وألم صدري) لا يمكن تمييزها بشكل قاطع عن الأسباب الأخرى لألم الصدر والزلة التنفسية. يعتمد قرار إجراء التصوير الطبي على الحالة السريرية، أي التاريخ الطبي والأعراض ونتائج الفحص السريري، متبوعاً بتقييم الحالة وفق المعايير.[3]
اختبارات احتمالية الإصابة بالانصمام الرئوي
الطريقة الأكثر شيوعاً للتنبؤ بالاحتمالية السريرية، هي معيار ويلز، وهي قاعدة تنبؤ سريري. في عام 1995، طور فيليب ستيفن ويلز قاعدة تنبؤ لاحتمالية حدوث انصمام (بناءً على بحث في الأدبيات الطبية)، بناءً على معايير سريرية.[30] تم مراجعة قاعدة التنبؤ في عام 1998،[31] كما تمت مراجعتها في عام 2000 بشكل أكبر عندما بُسَطَت لتكون فعالة بواسطة ويلز وزملاؤه.[32]
توجد قواعد تنبؤ إضافية بالانصمام الرئوي، مثل معايير جنيف. والأهم من ذلك أن استخدام أي قاعدة يرتبط بالحد من تكرر الانصمام الخثاري المتكرر.[33]
معيار ويلز للتنبؤ بالانصمام الرئوي
| المعايير | عدد النقاط |
|---|---|
| موجودات سريرية تتوافق مع خثار وريدي عميق | 3 |
| لا يوجد تشخيص بديل يفسر الأعراض | 3 |
| تسرع قلب مع نبض أكثر من 100 نبضة/دقيقة | 1.5 |
| عدم حركة (ثلاثة أيام أو أكثر) أو جراحة خلال الأربع أسابيع السابقة | 1.5 |
| سوابق خثار وريدي عميق أو سوابق انصمام رئوي | 1.5 |
| وجود نفث دموي | 1 |
| وجود خباثة | 1 |
| عدد النقاط | احتمالية الإصابة بالانصمام الرئوي[28] | نسبة احتمال الإصابة |
|---|---|---|
| >6 | عالي | (59%) |
| 2-6 | متوسط | (29%) |
| <2 | منخفض | (15%) |
- التفسير البديل
| عدد النقاط | احتمالية الإصابة بالانصمام الرئوي | الإجراء المتبع |
|---|---|---|
| >4 | الانصمام الرئوي محتمل | يجب إجراء الاختبارات التصويرية التشخيصية |
| 4 أو أقل | الانصمام الرئوي غير محتمل | يجب إجراء D-Dimer لنفي الانصمام الرئوي |
معايير استبعاد الانصمام الرئوي
تساعد معايير استبعاد الانصمام الرئوي (PERC) في تقييم الأشخاص المشتبه بإصابتهم بالانصمام الرئوي. على عكس معايير ويلز وجنيف، وهي قواعد تنبؤ سريري تهدف إلى تقسيم خطورة الإصابة عند الأشخاص المشتبه بهم، تم تصميم قاعدة PERC لاستبعاد الانصمام الرئوي لدى الأشخاص المصنفين كفئة منخفضة الخطورة.[38][36]
الأشخاص في هذه الفئة منخفضة الخطورة دون أي من هذه المعايير قد لا يحتاجون لمزيد من الاستقصاءات للانصمام الرئوي: إشباع الأكسجين منخفض SaO2 <95٪، تورم ساق أحادية الجانب، نفث دموي، التهاب وريد خثاري عميق أو انصمام رئوي سابق، جراحة أو رض حديث، العمر> 50، استخدام هرمونات، ومعدل ضربات قلب سريعة. الأساس المنطقي وراء هذا القرار هو أن إجراء مزيد من الاختبارات (تحديداً تصوير الأوعية المقطعية المحوسبة للصدر) قد يسبب ضرر أكبر (من التعرض للإشعاع والمواد الظليلة) وأكثر خطورة من الانصمام الرئوي.[39] لقاعدة PERC حساسية 97.4٪ ونوعية 21.9٪ مع نسبة سلبية كاذبة 1.0٪ (16/1666).[38]
الفحوصات المخبرية
عند وجود شك منخفض أو معتدل بالانصمام الرئوي، يعد تركيز D-dimer الطبيعي كافياً لاستبعاد احتمال وجود انصمام رئوي خثاري، مع وجود خطر لحوادث خثرية انصمامية لثلاثة أشهر بنسبة 0.14٪.[40] إن D-dimer حساس للغاية ولكنه غير نوعي (نوعيته حوالي 50٪). أي إن إيجابية D-dimer لا تعني بالضرورة وجود انصمام رئوي، لكن سلبية D-dimer هي مؤشر على غياب الانصمام الرئوي.[41] تعتبر الاحتمالية المنخفضة قبل الاختبار ذات قيمة في استبعاد الانصمام الرئوي.[42] الحد النموذجي للاختبار هو 500 ميكروغرام/لتر، على الرغم أن هذا يختلف حسب كل مخبر وحسب طريقة إجراء الاختبار.[43] ومع ذلك، في الأشخاص الذين تزيد أعمارهم عن 50 عاماً، يوصى بتغيير القيمة الحدية إلى (عمر الشخص مضروباً بـ 10 ميكروغرام/لتر) لأنها تقلل النتائج الإيجابية الكاذبة دون فقدان أي حالات من الانصمام الرئوي.[26][43][44]
عندما يُشتبه بالانصمام الرئوي، يجب إجراء العديد من اختبارات الدم من أجل استبعاد الأسباب الثانوية الهامة للانصمام الرئوي. يتضمن ذلك تعداد الدم الكامل وحالة التخثر (PT ،aPTT، TT) وبعض اختبارات المسح (سرعة ترسب الدم، وظائف الكلية، وظيفة الكبد، الشوارد). إذا كان أحد هذه التحاليل غير طبيعية، فإن ذلك يبرر إجراء مزيد من الاستقصاءات.[45]
تزداد مستويات التروبونين (16 و 47٪) عند مرضى الانصمام الرئوي.[46]
تشخيص شعاعي
في الأشخاص النموذجيين الذين لا يُعرف أنهم معرضون لخطر عالي للانصمام الرئوي، يكون التصوير مفيد لتأكيد أو استبعاد التشخيص بعد استخدام اختبارات الخط الأول البسيطة.[25][28][47] توصي الجمعيات الطبية باختبارات مثل D-dimer لتقديم دليل داعم للحاجة إلى التصوير، ويجرى التصوير إذا أكدت الاختبارات الأخرى احتمالاً متوسطاً أو مرتفعاً لوجود دليل يدعم تشخيص الانصمام الرئوي.[28][47] تصوير الأوعية الرئوية المقطعي المحوسب هو خط التصوير التشخيصي الأول الموصى به لمعظم الناس.[48] يمكن أن تؤكد الموجات فوق الصوتية للساقين وجود انصمام رئوي ولكنها لا تنفي ذلك.[49]
تصوير الأوعية الرئوية المقطعي المحوسب
هو تصوير الأوعية الرئوية باستخدام التصوير المقطعي المحوسب (CT) مع التباين الإشعاعي بدلاً من قسطرة القلب الأيمن. وتتمثل مزاياه في أنه دقيق، غير باضع، ومتوفر في كثير من الأحيان، ويمكنه تحديد أمراض الرئة الأخرى في حالة عدم وجود انصمام رئوي.
من الصعب تقييم دقة تصوير الأوعية الرئوية المقطعي المحوسب بسبب التغيرات السريعة في عدد صفوف الكشافات المتوفرة في أجهزة التصوير المقطعي المحوسب متعدد الكاشفات (MDCT).[50] في دراسة، وجد أن التصوير المقطعي المحوسب الحلزوني ذو الشريحة الواحدة قد يساعد في تشخيص الأشخاص المشكوك بإصابتهم بالانصمام الرئوي.[51] في هذه الدراسة كانت الحساسية 69% والنوعية 84%. في هذه الدراسة كانت نسبة الكشف عنها 32٪ ، القيمة التنبؤية الإيجابية 67.0٪، والقيمة التنبؤية السلبية 85.2٪. ومع ذلك، قد تكون نتائج هذه الدراسة متحيزة بسبب التحيز المحتمل في التضمين، لأن الفحص بالأشعة المقطعية كان أداة التشخيص النهائية للأشخاص الذين يعانون من الانصمام الرئوي. لاحظ المؤلفون أن التصوير المقطعي المحوسب ذو شريحة واحدة غير كافٍ لاستبعاد الانصمام الرئوي من تلقاء نفسه. أشارت دراسة منفصلة بمزيج من 4 شرائح و 16 ماسحة ضوئية إلى حساسية 83٪ ونوعية 96٪، مما يعني أنه اختبار جيد لاستبعاد الانصمام الرئوي إذا لم يُرى في التصوير وأنه جيد جداً في تأكيد الانصمام الرئوي إذا شوهد. لاحظت هذه الدراسة أن الاختبارات الإضافية ضرورية عندما يكون الاحتمال السريري غير متوافق مع نتائج التصوير.[52] لا يعد CTPA أدنى دقة من مسح VQ، ويحدد المزيد من الصمات مقارنة بمسح VQ.[53]
-
في التصوير المقطعي المحوسب، يمكن تصنيف الصمات الرئوية وفقاً لمستوى الشجرة الشريانية.
-
الصمات الرئوية المقطعية وتحت المقطعية في كلا الجانبين
-
تصوير الأوعية الرئوية المقطعي المحوسب يُظهر "انصمام سرجي الشكل" عند تفرع الشريان الرئوي الرئيسي تأثير الجلطة في الشرايين الفُصَّية في كلا الجانبين.
-
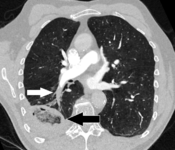
الانصمام الرئوي (السهم الأبيض) الذي استمر لفترة طويلة وتسبب في احتشاء الرئة (السهم الأسود) يُنظر إليه على أنه علامة الهالة العكسية.
اختبار نسبة التهوية إلى التروية

(أ) بعد استنشاق 20 ميللي كوري من غاز زينون-133، تم الحصول على صور الومضان في الإسقاط الخلفي، والتي تُظهر التهوية الموحدة للرئتين.
(ب) بعد الحقن الوريدي لـ 4 ميللي كوري من الألبومين الموسوم بالتيكنيسيوم-99، تظهر الصور الومضانية هنا في الإسقاط الخلفي انخفاض النشاط في مناطق متعددة.
يُظهر اختبار نسبة التهوية إلى التروية (أو مسح V/Q أو التصوير الومضاني للرئة) أن بعض مناطق الرئة يتم تهويتها لكن لا يصلها الجريان الدموي (بسبب الانسداد بالجلطة).[17] يعد هذا النوع من الفحص بدقة التصوير المقطعي المحوسب متعدد الشرائح، لكنه أقل استخداماً، نظراً لتوافر تقنية التصوير المقطعي المحوسب بشكل أكبر. وهو مفيد بشكل خاص عند الأشخاص الذين يعانون من حساسية تجاه مواد التباين اليودية أو ضعف وظائف الكلى أو الحوامل (نظراً لانخفاض تعرضه للإشعاع مقارنةً بالتصوير المقطعي المحوسب).[54][55][56] يمكن إجراء الاختبار باستخدام التصوير ثنائي الأبعاد المستوي، أو التصوير المقطعي المحوسب بإصدار فوتون واحد (SPECT) الذي يتيح التصوير ثلاثي الأبعاد. تعمل الأجهزة الهجينة التي تجمع بين (SPECT و CT) على تمكين التوصيف التشريحي لأي خلل.[57]
تصوير الأوعية الرئوية بالتنظير الفلوري
تاريخياً، كان المعيار الذهبي للتشخيص هو تصوير الأوعية الرئوية بالتنظير الفلوري، ولكنه لم يعد مستخدماً مع زيادة توافر التقنيات غير الغازية التي تقدم دقة تشخيصية مماثلة.[58]
إيكو القلب
في حالة الإصابة بصمة رئوية ضخمة وتحت ضخمة، يمكن ملاحظة خلل وظيفي في الجانب الأيمن من القلب عند إجراء الإيكو، وهو مؤشر على وجود انسداد شديد في الشريان الرئوي، والبطين الأيمن (الذي يضخ الدم بضغط منخفض) غير قادر على مطابقة الضغط. تشير بعض الدراسات إلى أن هذا قد يكون مؤشر على انحلال الخثرة. لا يحتاج كل شخص يشتبه بإصابته بانصمام رئوي إلى إجراء إيكو قلب، ولكن قد يشير الارتفاع في التروبونينات القلبية أو الببتيد المدر للصوديوم الدماغي إلى إجهاد القلب ويستدعي إجراء إيكو قلب،[59] ويكون مهماً في التشخيص.[60]
يشار إلى المظهر المحدد للبطين الأيمن في إيكو القلب بعلامة مكونيل (McConnell's sign) وهي تعذر الحركة للجدار نصف الحر للبطين الأيمن مع وجود حركة طبيعية للقمة.[61] هذه الظاهرة لها حساسية 77٪ ونوعية 94٪ لتشخيص الانسداد الرئوي الحاد في حالة ضعف البطين الأيمن.[61]
-
-
إيكو قلب يظهر علامات الانصمام الرئوي[62]
اختبارات غير تشخيصية
الاختبارات التشخيصية ذات الاحتمالية المنخفضة أو الاختبارات غير التشخيصية هي اختبارات تجرى بشكل متكرر لكنها لا تعتبر حساسة للانصمام الرئوي، ولكن يمكن أن تكون تشخيصية.
- غالباً ما يتم إجراء صورة بسيطة للصدر عند الأشخاص الذين يعانون من زلة تنفسية للمساعدة في استبعاد الأسباب الأخرى، مثل قصور القلب الاحتقاني وكسر ضلع. نادراً ما تكون الصورة البسيطة للصدر طبيعية في الانصمام الرئوي،[63] ولكنها تفتقر عادةً إلى العلامات التي تشير إلى تشخيص الانصمام الرئوي (على سبيل المثال ، علامة ويسترمارك، سنام "حدبة" هامبتون).
- التصوير بالموجات فوق الصوتية للساقين، المعروف أيضاً باسم دوبلر الساق، بحثاً عن خثار وريدي عميق (DVT). إن وجود خثار وريدي عميق بحد ذاته كافٍ لاستخدام مميعات الدم، دون الحاجة إلى فحوصات V/Q أو التصوير المقطعي الحلزوني (بسبب الارتباط القوي بين DVT و PE). قد تكون هذه مقاربة جيدة في الحمل، حيث تزيد الطرائق الأخرى خطر حدوث عيوب خلقية في الجنين. ومع ذلك، فإن الفحص السلبي لا يستبعد الانصمام الرئوي، وقد تكون هناك حاجة لفحص بجرعة منخفضة من الإشعاع إذا اُعتبرت الأم معرضة لخطر الإصابة بالانصمام الرئوي. ولذلك فإن الاستخدام الرئيسي لإيكو للساقين هو للأشخاص الذين يعانون من أعراض سريرية توجه لخثار وريدي عميق.[56]
تخطيط القلب الكهربائي

الاستخدام الأساسي لتخطيط القلب الكهربائي هو استبعاد الأسباب الأخرى لألم الصدر.[64] يتم إجراء تخطيط القلب الكهربائي (ECG) بشكل روتيني للأشخاص الذين يعانون من آلام صدرية لتشخيص سريع لاحتشاء عضلة القلب (النوبات القلبية)، وهو تشخيص تفريقي هام للألم الصدري. في حين قد تحدث تغيرات معينة في تخطيط القلب عند مرضى الانصمام الرئوي، إلا أنه لا توجد تغيرات نوعية بما يكفي للتأكيد أو حساسة بدرجة كافية لاستبعاد التشخيص.[64] قد يُظهر تخطيط القلب علامات إجهاد القلب الأيمن أو قلب رئوي حاد في حالات الصمات الرئوية الكبيرة - العلامات الكلاسيكية هي موجة S كبيرة في المسرى I، وموجة Q عميقة في المسرى III، وانقلاب موجة T في المسرى III، يُرمز لهذه التغيرات بـ (S1Q3T3). وهي تحدث في 12-50٪ من الأشخاص المشخصين، ولكنها تحدث أيضاً في 12٪ بدون انصمام رئوي.[65][66] قد تحدث هذه التغيرات أيضاً في حالات رئوية حادة أخرى، وبالتالي فإن لها قيمة تشخيصية محدودة. العلامات الأكثر شيوعاً في تخطيط القلب هي تسرع القلب الجيبي، انحراف المحور للأيمن، وحصار الحزمة اليمنى.[67] ومع ذلك، لا يزال تسرع القلب الجيبي موجوداً فقط في 8-69٪ من الأشخاص المصابين بالانصمام الرئوي.[68]
قد تشير علامات الانصمام الرئوي على تخطيط القلب إلى إنذار أسوأ بما أن الموجودات الست المرتبطة بإجهاد البطين الأيمن على التخطيط (معدل ضربات القلب> 100 نبضة في الدقيقة، S1Q3T3، موجات T معكوسة في المساري V1-V4، ارتفاع قطعة ST في aVR، حصار غصن أيمن تام، والرجفان الأذيني) تترافق مع زيادة خطر الإصابة بصدمة دورانية والموت.[69]
يشتبه بالانصمام الرئوي أو احتشاء عضلة قلبية سفلي في حال وجود موجة T منقلبة في المساري V1-3. تظهر حالات الانصمام الرئوي انقلاب موجات T في المساري II و aVF، بينما لا يظهر احتشاء عضلة القلب السفلية موجات T منقلبة في II و aVF.[70]
العلاج
العلاج المضاد للتخثر هو الدعامة الأساسية للعلاج. بشكل حاد، قد تكون هناك حاجة إلى علاجات داعمة، مثل الأكسجين أو التسكين. غالباً ما يُقبل المرضى في المستشفى في المراحل المبكرة من العلاج، ويبقون مستشفيين حتى يصل INR إلى المستويات العلاجية (إذا تم استخدام الوارفارين). ومع ذلك، يمكن علاج الحالات منخفضة الخطورة في المنزل بشكل مشابه لعلاج الإصابة بالخثار الوريدي العميق.[71][72] الأدلة لدعم مقاربة واحدة ضعيفة.[73]
مضادات التخثر
العلاج المضاد للتخثر هو الدعامة الأساسية للعلاج. لسنوات عديدة، كانت مضادات فيتامين ك (الوارفارين أو أقل شيوعاً أسينوكومارول أو فينوبروكومون) هي حجر الزاوية في العلاج. نظراً لأن مضادات فيتامين ك لا تعمل على الفور، فإن العلاج الأولي يكون بمضادات التخثر القابلة للحقن سريعة المفعول: الهيبارين غير المجزأ (UFH)، أو الهيبارين منخفض الوزن الجزيئي (LMWH)، أو فوندابارينوكس، في حين يتم البدء بمضادات فيتامين K الفموية ومعايرتها (عادةً كجزء من العلاج للمرضى المستشفيين) عبر النسبة المعيارية الدولية INR، وهو اختبار يحدد الجرعة.[5] فيما يتعلق بالعلاجات القابلة للحقن، قد يقلل الهيبارين منخفض الوزن الجزيئي من احتمال حدوث النزف عند الأشخاص المصابين بالانصمام الرئوي مقارنةً بالهيبارين غير المجزأ.[74] وكذلك قلل الهيبارين منخفض الوزن الجزيئي من تكرر الخثار وقلل حجم الخثرة مقارنةً بالهيبارين. لم يكن هناك فرق في معدل الوفيات الإجمالي بين المعالجين بالهيبارين المنخفض الوزن منخفض الوزن الجزيئي والمعالجين بالهيبارين غير المجزأ.[74] تتطلب مضادات فيتامين ك تعديل الجرعة بشكل متكرر ومراقبة النسبة المعيارية الدولية (INR). في الانصمام الرئوي، تعتبر قيم INR بين 2.0 و 3.0 مثالية بشكل عام.[5] في حالة حدوث نوبة أخرى من الانصمام الرئوي أثناء العلاج بالوارفارين، يمكن زيادة نافذة INR على سبيل المثال 2.5-3.5 (ما لم تكن هناك مضادات استطباب) أو يمكن تغيير مانع التخثر إلى نوع آخر مثل الهيبارين منخفض الوزن الجزيئي.[5] في السنوات الأخيرة، قُدِّمت العديد من مضادات التخثر الشبيهة بالوارفارين لكنها لا تحتاج لمعايرة INR. تُعرف باسم مضادات التخثر الفموية مباشرة التأثير، وحالياً تفضل هذه العلاجات على مضادات فيتامين K وفقاً للإرشادات المهنية الأمريكية.[5] اثنان منها (ريفاروكسابان وأبيكسابان) لا يتطلبان علاجاً أولياً بالهيبارين أوفوندابارينكس، على خلاف دابيغاتران وإيدوكسابان.[5] وجدت مراجعة كوكرين أنه لا يوجد دليل على وجود فرق بين مانعات التخثر مباشرة التأثير الفموية (ريفاروكسابان، أبيكسابان، دابيغاتران، وإيدوكسابان) ومانعات التخثر القياسية في الوقاية من الانصمام الرئوي المتكرر.[75]
عند مرضى السرطان الذين أصيبوا بانصمام رئوي، يُفضل العلاج بكورس من الهيبارين المنخفض الوزن الجزيئي على العلاج بالوارفارين أو مضادات التخثر الفموية الأخرى.[5][76] وبالمثل، تُعالج النساء الحوامل باستخدام الهيبارين منخفض الوزن الجزيئي إلى ما بعد الولادة لتجنب تأثيرات الوارفارين المشوهة للجنين، خاصة في المراحل الباكرة من الحمل،ولكن يمكن استخدامه أثناء الرضاعة الطبيعية.[56]
عادة ما يستمر العلاج بمضادات التخثر لمدة 3-6 أشهر، أو "مدى الحياة" إذا كان هناك حالات سابقة لخثار وريدي عميق أو انصامات رئوية، أو لم يكن هناك أي من عوامل الخطر العابرة المعتادة.[5][76] بالنسبة للمرضى بدون سبب معروف يمكن عكسه، قد يكون العلاج لمدة عامين أفضل من 6 أشهر.[77] بالنسبة للمرضى المصابين بصمات رئوية صغيرة (المعروفة باسم انصمامات رئوية تحت قطعية)، فإن التأثيرات المانعة للتخثر غير معروفة لأنه لم يتم دراستها بشكل كافي حتى عام 2020.[78]
مصفاة الوريد الأجوف السفلي
يتم وضع مصفاة في الوريد الأجوف السفلي عندما يكون العلاج بمضادات التخثر غير ممكن، يتم وضع المصفاة عادة من خلال الولوج عبر الوريد الودجي أو الوريد الفخذي ويتم تثبيت المصفاة عادة في الوريد الأجوف السفلي قبل نقطة الالتقاء مع الوريد الكلوي.[79]
انزيمات إحلال الخثرة
يتم استخدام انزيمات إحلال الخثرة في الحالات بالغة الخطورة من الانصمام الرئوي في حال كان التدخل الجراحي متعذراً أو غير ممكن، من المضاعفات الخطرة للعلاج حصول نزيف أو جلطة دماغية.[80]
العمل الجراحي
التدخل الجراحي في حالات الانصمام الرئوي الحادة يكون عبر استئصال الخثرة من شرايين الرئة وقد تراجع استخدام هذا الحل الجراحي نظراً لخطورته ونتائجه غير المشجعة، ويبقى استعمال هذا الحل مجدياً في حالات الانصمام الرئوي المزمنة والتي تسبب ارتفاع ضغط الدم الرئوي.
الوقاية من الانصمام الرئوي
تبدأ الوقايةُ من الانصمام الرئوي بالوقاية من التخثر الوريدي العميق. ومن المهمِّ معرفةُ ما إذا كان الشخص معرضاً لخطر الإصابة بالتخثر الوريدي العميق، واتِّخاذ خطوات تخفِّف من خطر الإصابة به. للوقايةِ من الإصابة بالتخثر الوريدي العميق والانصمام الرئوي، من المهمِّ تحريكُ عضلات الساقين عندَ الجلوس لفترة طويلة في أثناء السفر. ومن الضَّروري لمريض الجراحة أو لطريح الفراش النهوضُ من السرير والمشي حالما يستطيع. كما يُمكن أيضاً تناولُ أدوية تمنع حُدوثَ الخثرات بعدَ أنواع معيَّنة من الجراحة، وذلك وفقَ توصية الطبيب. ويجب الحرصُ على الالتزام بتعاليم الطبيب للتأكُّد من فعَّالية ما تقوم به في الوقاية من الخثرات. إذا كان المريضُ قد أُصيبَ من قَبلُ بالخُثار الوريدي العميق أو بالانصمام الرئوي، فمن الممكن اتِّخاذ خطوات أخرى للوقاية من تشكُّل خَثرات دموية جديدة. يجب مراجعةُ الطبيب بصورة منتظمة. كما يجب ارتداءُ الجوارب الضاغطة للوقاية من التورُّم المُزمن في الساقين بسبب الخُثار الوريدي العميق، وذلك تبعاً لتوصيات الطبيب. يجب الاتِّصالُ بالطبيب فوراً في حال ملاحظة أيِّ عرض من أعراض الانصمام الرئوي أو الخُثار الوريدي العميق.[81]
معرض صور
انظر أيضًا
المراجع
- ^ أ ب ت ث ج "Who Is at Risk for Pulmonary Embolism?". NHLBI. 1 يوليو 2011. مؤرشف من الأصل في 2016-02-15. اطلع عليه بتاريخ 2016-03-12.
- ^ أ ب ت "What Are the Signs and Symptoms of Pulmonary Embolism?". NHLBI. 1 يوليو 2011. مؤرشف من الأصل في 2016-03-09. اطلع عليه بتاريخ 2016-03-12.
- ^ أ ب ت ث ج Goldhaber SZ (2005). "Pulmonary thromboembolism". Harrison's Principles of Internal Medicine (ط. 16th). New York, NY: McGraw-Hill. ص. 1561–65. ISBN:978-0-07-139140-5.
- ^ أ ب ت ث "How Is Pulmonary Embolism Diagnosed?". NHLBI. 1 يوليو 2011. مؤرشف من الأصل في 2016-04-07. اطلع عليه بتاريخ 2016-03-12.
- ^ أ ب ت ث ج ح خ د ذ ر Kearon C، Akl EA، Ornelas J، Blaivas A، Jimenez D، Bounameaux H، وآخرون (فبراير 2016). "Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report". Chest. ج. 149 ع. 2: 315–352. DOI:10.1016/j.chest.2015.11.026. PMID:26867832.
- ^ أ ب ت ث "What Is Pulmonary Embolism?". NHLBI. 1 يوليو 2011. مؤرشف من الأصل في 2016-03-12. اطلع عليه بتاريخ 2016-03-12.
- ^ أ ب Rahimtoola A، Bergin JD (فبراير 2005). "Acute pulmonary embolism: an update on diagnosis and management". Current Problems in Cardiology. ج. 30 ع. 2: 61–114. DOI:10.1016/j.cpcardiol.2004.06.001. PMID:15650680.
- ^ أ ب Raskob GE، Angchaisuksiri P، Blanco AN، Buller H، Gallus A، Hunt BJ، وآخرون (نوفمبر 2014). "Thrombosis: a major contributor to global disease burden". Arteriosclerosis, Thrombosis, and Vascular Biology. ج. 34 ع. 11: 2363–71. DOI:10.1161/atvbaha.114.304488. PMID:25304324.
- ^ أ ب Barco S، Valerio L، Ageno W، Cohen AT، Goldhaber SZ، Hunt BJ، وآخرون (أكتوبر 2020). "Age-sex specific pulmonary embolism-related mortality in the USA and Canada, 2000-18: an analysis of the WHO Mortality Database and of the CDC Multiple Cause of Death database". The Lancet. Respiratory Medicine. DOI:10.1016/S2213-2600(20)30417-3. PMC:7550106. PMID:33058771.
- ^ Barco S، Mahmoudpour SH، Valerio L، Klok FA، Münzel T، Middeldorp S، وآخرون (مارس 2020). "Trends in mortality related to pulmonary embolism in the European Region, 2000-15: analysis of vital registration data from the WHO Mortality Database". The Lancet. Respiratory Medicine. ج. 8 ع. 3: 277–287. DOI:10.1016/S2213-2600(19)30354-6. PMID:31615719.
- ^ Tintinalli JE (2010). Emergency Medicine: A Comprehensive Study Guide (Emergency Medicine (Tintinalli)) (ط. 7). New York: McGraw-Hill Companies. ص. 432. ISBN:978-0-07-148480-0.
- ^ "What Causes Pulmonary Embolism?". NHLBI. 1 يوليو 2011. مؤرشف من الأصل في 2016-04-07. اطلع عليه بتاريخ 2016-03-12.
- ^ Pantaleo G، Luigi N، Federica T، Paola S، Margherita N، Tahir M (2014). "Amniotic fluid embolism: review". Current Pharmaceutical Biotechnology. ج. 14 ع. 14: 1163–7. DOI:10.2174/1389201015666140430161404. PMID:24804726.
- ^ "Other Names for Pulmonary Embolism". 1 يوليو 2011. مؤرشف من الأصل في 2016-03-16. اطلع عليه بتاريخ 2016-03-12.
- ^ "How Can Pulmonary Embolism Be Prevented?". NHLBI. 1 يوليو 2011. مؤرشف من الأصل في 2016-04-07. اطلع عليه بتاريخ 2016-03-12.
- ^ أ ب "How Is Pulmonary Embolism Treated?". NHLBI. 1 يوليو 2011. مؤرشف من الأصل في 2016-03-09. اطلع عليه بتاريخ 2016-03-12.
- ^ أ ب Lewis S، Dirksen S، Heitkemper M، Bucher L (2014). Medical-surgical nursing: Assessment and management of clinical problems (ط. 9). St. Louis, MO: Elsevier Mosby. ص. 552. ISBN:978-0-323-08678-3.
- ^ Oqab Z، Ganshorn H، Sheldon R (أبريل 2018). "Prevalence of pulmonary embolism in patients presenting with syncope. A systematic review and meta-analysis". The American Journal of Emergency Medicine. ج. 36 ع. 4: 551–555. DOI:10.1016/j.ajem.2017.09.015. PMID:28947223. S2CID:5012417.
- ^ Stein PD، Sostman HD، Hull RD، Goodman LR، Leeper KV، Gottschalk A، وآخرون (مارس 2009). "Diagnosis of pulmonary embolism in the coronary care unit". The American Journal of Cardiology. ج. 103 ع. 6: 881–6. DOI:10.1016/j.amjcard.2008.11.040. PMC:2717714. PMID:19268750.
- ^ Pregerson DB, Quick Essentials: Emergency Medicine, 4th edition. EMresource.org
- ^ Jaff MR، McMurtry MS، Archer SL، Cushman M، Goldenberg N، Goldhaber SZ، وآخرون (أبريل 2011). American Heart Association Council on Cardiopulmonary, Critical Care, Perioperative and Resuscitation, American Heart Association Council on Peripheral Vascular Disease, American Heart Association Council on Arteriosclerosis, Thrombosis, and Vascular Biology. "Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association". Circulation. ج. 123 ع. 16: 1788–830. DOI:10.1161/CIR.0b013e318214914f. PMID:21422387.
- ^ Ferri F (2012). Ferri's Clinical Advisor. St. Louis: Mosby's.
- ^ أ ب ت ث Toplis E، Mortimore G (يناير 2020). "The diagnosis and management of pulmonary embolism". British Journal of Nursing. ج. 29 ع. 1: 22–26. DOI:10.12968/bjon.2020.29.1.22. hdl:10545/624428. PMID:31917939.
- ^ أ ب ت ث ج ح Turetz M، Sideris AT، Friedman OA، Triphathi N، Horowitz JM (يونيو 2018). "Epidemiology, Pathophysiology, and Natural History of Pulmonary Embolism". Seminars in Interventional Radiology. ج. 35 ع. 2: 92–98. DOI:10.1055/s-0038-1642036. PMC:5986574. PMID:29872243.
- ^ أ ب ت American College of Radiology. "Five Things Physicians and Patients Should Question" (PDF). Choosing Wisely: an initiative of the اختر بحكمة. American College of Radiology. مؤرشف (PDF) من الأصل في 2012-04-16. اطلع عليه بتاريخ 2012-08-17.
- ^ أ ب Raja AS، Greenberg JO، Qaseem A، Denberg TD، Fitterman N، Schuur JD (نوفمبر 2015). "Evaluation of Patients With Suspected Acute Pulmonary Embolism: Best Practice Advice From the Clinical Guidelines Committee of the American College of Physicians". Annals of Internal Medicine. ج. 163 ع. 9: 701–11. DOI:10.7326/M14-1772. PMID:26414967.
- ^ أ ب ت ث Ullah S، Jan SU، Rehman HU، Butt NI، Rauf MA، Shah S، Jan MY (مارس 2019). "Research productivity in Pakistan heart journal from 2005 to 2018: a scientometric study". Pakistan Heart Journal. ج. 52 ع. 2. DOI:10.47144/phj.v52i2.1763 (غير نشط 20 يناير 2021).
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: وصلة دوي غير نشطة منذ 2021 (link) - ^ أ ب ت ث Stein PD، Woodard PK، Weg JG، Wakefield TW، Tapson VF، Sostman HD، وآخرون (يناير 2007). "Diagnostic pathways in acute pulmonary embolism: recommendations of the PIOPED II Investigators". Radiology. ج. 242 ع. 1: 15–21. DOI:10.1148/radiol.2421060971. PMID:17185658.
- ^ Konstantinides SV، Torbicki A، Agnelli G، Danchin N، Fitzmaurice D، Galiè N، وآخرون (نوفمبر 2014). "2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism". European Heart Journal. ج. 35 ع. 43: 3033–69, 3069a–3069k. DOI:10.1093/eurheartj/ehu283. PMID:25173341.
- ^ Wells PS، Hirsh J، Anderson DR، Lensing AW، Foster G، Kearon C، وآخرون (مايو 1995). "Accuracy of clinical assessment of deep-vein thrombosis". Lancet. ج. 345 ع. 8961: 1326–30. DOI:10.1016/S0140-6736(95)92535-X. PMID:7752753. S2CID:23107192.
- ^ Wells PS، Ginsberg JS، Anderson DR، Kearon C، Gent M، Turpie AG، وآخرون (ديسمبر 1998). "Use of a clinical model for safe management of patients with suspected pulmonary embolism". Annals of Internal Medicine. ج. 129 ع. 12: 997–1005. DOI:10.7326/0003-4819-129-12-199812150-00002. PMID:9867786. S2CID:41389736.
- ^ أ ب ت Wells PS، Anderson DR، Rodger M، Ginsberg JS، Kearon C، Gent M، وآخرون (مارس 2000). "Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer". Thrombosis and Haemostasis. ج. 83 ع. 3: 416–20. DOI:10.1055/s-0037-1613830. PMID:10744147.
- ^ Roy PM، Meyer G، Vielle B، Le Gall C، Verschuren F، Carpentier F، وآخرون (فبراير 2006). "Appropriateness of diagnostic management and outcomes of suspected pulmonary embolism". Annals of Internal Medicine. ج. 144 ع. 3: 157–64. CiteSeerX:10.1.1.1032.7193. DOI:10.7326/0003-4819-144-3-200602070-00003. PMID:16461959. S2CID:38894349.
- ^ Neff MJ (أغسطس 2003). "ACEP releases clinical policy on evaluation and management of pulmonary embolism". American Family Physician. ج. 68 ع. 4: 759–60. PMID:12952389. مؤرشف من الأصل في 2007-09-26.
- ^ Wells PS، Anderson DR، Rodger M، Stiell I، Dreyer JF، Barnes D، وآخرون (يوليو 2001). "Excluding pulmonary embolism at the bedside without diagnostic imaging: management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and d-dimer". Annals of Internal Medicine. ج. 135 ع. 2: 98–107. DOI:10.7326/0003-4819-135-2-200107170-00010. PMID:11453709. S2CID:2708155.
- ^ أ ب Yap KS، Kalff V، Turlakow A، Kelly MJ (سبتمبر 2007). "A prospective reassessment of the utility of the Wells score in identifying pulmonary embolism". The Medical Journal of Australia. ج. 187 ع. 6: 333–6. DOI:10.5694/j.1326-5377.2007.tb01274.x. PMID:17874979. S2CID:17476982.
- ^ van Belle A، Büller HR، Huisman MV، Huisman PM، Kaasjager K، Kamphuisen PW، وآخرون (يناير 2006). "Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography". JAMA. ج. 295 ع. 2: 172–9. DOI:10.1001/jama.295.2.172. PMID:16403929.
- ^ أ ب Kline JA، Courtney DM، Kabrhel C، Moore CL، Smithline HA، Plewa MC، وآخرون (مايو 2008). "Prospective multicenter evaluation of the pulmonary embolism rule-out criteria". Journal of Thrombosis and Haemostasis. ج. 6 ع. 5: 772–80. DOI:10.1111/j.1538-7836.2008.02944.x. PMID:18318689. S2CID:25488146.
- ^ Kline JA، Mitchell AM، Kabrhel C، Richman PB، Courtney DM (أغسطس 2004). "Clinical criteria to prevent unnecessary diagnostic testing in emergency department patients with suspected pulmonary embolism". Journal of Thrombosis and Haemostasis. ج. 2 ع. 8: 1247–55. DOI:10.1111/j.1538-7836.2004.00790.x. PMID:15304025. S2CID:19311896.
- ^ Carrier M، Righini M، Djurabi RK، Huisman MV، Perrier A، Wells PS، وآخرون (مايو 2009). "VIDAS D-dimer in combination with clinical pre-test probability to rule out pulmonary embolism. A systematic review of management outcome studies". Thrombosis and Haemostasis. ج. 101 ع. 5: 886–92. DOI:10.1160/TH-08-10-0689. PMID:19404542.
- ^ Schrecengost JE، LeGallo RD، Boyd JC، Moons KG، Gonias SL، Rose CE، Bruns DE (سبتمبر 2003). "Comparison of diagnostic accuracies in outpatients and hospitalized patients of D-dimer testing for the evaluation of suspected pulmonary embolism". Clinical Chemistry. ج. 49 ع. 9: 1483–90. DOI:10.1373/49.9.1483. PMID:12928229.
- ^ Crawford F، Andras A، Welch K، Sheares K، Keeling D، Chappell FM، وآخرون (Cochrane Vascular Group) (أغسطس 2016). "D-dimer test for excluding the diagnosis of pulmonary embolism". The Cochrane Database of Systematic Reviews ع. 8: CD010864. DOI:10.1002/14651858.CD010864.pub2. PMC:6457638. PMID:27494075.
- ^ أ ب Schouten HJ، Geersing GJ، Koek HL، Zuithoff NP، Janssen KJ، Douma RA، وآخرون (مايو 2013). "Diagnostic accuracy of conventional or age adjusted D-dimer cut-off values in older patients with suspected venous thromboembolism: systematic review and meta-analysis". BMJ. ج. 346: f2492. DOI:10.1136/bmj.f2492. PMC:3643284. PMID:23645857.
- ^ van Es N، van der Hulle T، van Es J، den Exter PL، Douma RA، Goekoop RJ، وآخرون (أغسطس 2016). "Wells Rule and d-Dimer Testing to Rule Out Pulmonary Embolism: A Systematic Review and Individual-Patient Data Meta-analysis". Annals of Internal Medicine. ج. 165 ع. 4: 253–61. DOI:10.7326/m16-0031. PMID:27182696. S2CID:207538572.
- ^ Werman HA، Karren K، Mistovich J (2014). "Other Conditions That Cause Respiratory Distress: Pulmonary Embolism". Prehospital Emergency Care, 10e. تعليم بيرسون, Inc. ص. 456.
- ^ Söhne M، Ten Wolde M، Büller HR (نوفمبر 2004). "Biomarkers in pulmonary embolism". Current Opinion in Cardiology. ج. 19 ع. 6: 558–62. DOI:10.1097/01.hco.0000138991.82347.0e. PMID:15502498. S2CID:39899682.
- ^ أ ب Torbicki A، Perrier A، Konstantinides S، Agnelli G، Galiè N، Pruszczyk P، وآخرون (سبتمبر 2008). "Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC)". European Heart Journal. ج. 29 ع. 18: 2276–315. DOI:10.1093/eurheartj/ehn310. PMID:18757870.
- ^ Stein PD، Freeman LM، Sostman HD، Goodman LR، Woodard PK، Naidich DP، وآخرون (ديسمبر 2009). "SPECT in acute pulmonary embolism". Journal of Nuclear Medicine (Review). ج. 50 ع. 12: 1999–2007. DOI:10.2967/jnumed.109.063958. PMID:19949025.
- ^ Da Costa Rodrigues J، Alzuphar S، Combescure C، Le Gal G، Perrier A (سبتمبر 2016). "Diagnostic characteristics of lower limb venous compression ultrasonography in suspected pulmonary embolism: a meta-analysis". Journal of Thrombosis and Haemostasis. ج. 14 ع. 9: 1765–72. DOI:10.1111/jth.13407. PMID:27377039.
- ^ Schaefer-Prokop C، Prokop M (نوفمبر 2005). "MDCT for the diagnosis of acute pulmonary embolism". European Radiology. 15 Suppl 4 ع. Suppl 4: D37–41. DOI:10.1007/s10406-005-0144-3. PMID:16479644. S2CID:6074.
- ^ Van Strijen MJ، De Monye W، Kieft GJ، Pattynama PM، Prins MH، Huisman MV (يناير 2005). "Accuracy of single-detector spiral CT in the diagnosis of pulmonary embolism: a prospective multicenter cohort study of consecutive patients with abnormal perfusion scintigraphy". Journal of Thrombosis and Haemostasis. ج. 3 ع. 1: 17–25. DOI:10.1111/j.1538-7836.2004.01064.x. PMID:15634261. S2CID:38746246.
- ^ Stein PD، Fowler SE، Goodman LR، Gottschalk A، Hales CA، Hull RD، وآخرون (يونيو 2006). "Multidetector computed tomography for acute pulmonary embolism". The New England Journal of Medicine. ج. 354 ع. 22: 2317–27. DOI:10.1056/NEJMoa052367. PMID:16738268.
- ^ Anderson DR، Kahn SR، Rodger MA، Kovacs MJ، Morris T، Hirsch A، وآخرون (ديسمبر 2007). "Computed tomographic pulmonary angiography vs ventilation-perfusion lung scanning in patients with suspected pulmonary embolism: a randomized controlled trial". JAMA. ج. 298 ع. 23: 2743–53. DOI:10.1001/jama.298.23.2743. PMID:18165667.
- ^ Scarsbrook AF، Gleeson FV (فبراير 2007). "Investigating suspected pulmonary embolism in pregnancy". BMJ. ج. 334 ع. 7590: 418–19. DOI:10.1136/bmj.39071.617257.80. PMC:1804186. PMID:17322258. مؤرشف من الأصل في 2007-09-04.
- ^ Leung AN، Bull TM، Jaeschke R، Lockwood CJ، Boiselle PM، Hurwitz LM، وآخرون (نوفمبر 2011). "An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy". American Journal of Respiratory and Critical Care Medicine. ج. 184 ع. 10: 1200–08. DOI:10.1164/rccm.201108-1575ST. PMID:22086989.
- ^ أ ب ت Thomson AJ، Greer IA (أبريل 2015). "Thrombosis and Embolism during Pregnancy and the Puerperium, the Acute Management of (Green-top Guideline No. 37b)". Royal College of Obstetricians & Gynaecologists. مؤرشف من الأصل في 2021-04-26. اطلع عليه بتاريخ 2018-06-04.
- ^ Mortensen، Jann؛ Gutte، Henrik (مايو 2014). "SPECT/CT and pulmonary embolism". European Journal of Nuclear Medicine and Molecular Imaging. 41 Suppl 1: S81–90. DOI:10.1007/s00259-013-2614-5. ISSN:1619-7089. PMC:4003400. PMID:24213621.
- ^ Konstantinides SV، Torbicki A، Agnelli G، Danchin N، Fitzmaurice D، Galiè N، وآخرون (نوفمبر 2014). "2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism". European Heart Journal. ج. 35 ع. 43: 3033–69, 3069a–69k. DOI:10.1093/eurheartj/ehu283. PMID:25173341.
Pulmonary angiography has for decades remained the 'gold standard' for the diagnosis or exclusion of PE but is rarely performed now as less-invasive CT angiography offers similar diagnostic accuracy.
- ^ Kucher N، Goldhaber SZ (نوفمبر 2003). "Cardiac biomarkers for risk stratification of patients with acute pulmonary embolism". Circulation. ج. 108 ع. 18: 2191–94. DOI:10.1161/01.CIR.0000100687.99687.CE. PMID:14597581.
- ^ Lankeit M، Jiménez D، Kostrubiec M، Dellas C، Hasenfuss G، Pruszczyk P، Konstantinides S (ديسمبر 2011). "Predictive value of the high-sensitivity troponin T assay and the simplified Pulmonary Embolism Severity Index in hemodynamically stable patients with acute pulmonary embolism: a prospective validation study". Circulation. ج. 124 ع. 24: 2716–24. DOI:10.1161/CIRCULATIONAHA.111.051177. PMID:22082681.
- ^ أ ب McConnell، Michael V؛ Solomon، Scott D؛ Rayan، Mamdouh E؛ Come، Patricia C؛ Goldhaber، Samuel Z؛ Lee، Richard T (1996-08). "Regional Right Ventricular Dysfunction Detected by Echocardiography in Acute Pulmonary Embolism". The American Journal of Cardiology. ج. 78 ع. 4: 469–473. DOI:10.1016/s0002-9149(96)00339-6. ISSN:0002-9149. مؤرشف من الأصل في 25 فبراير 2021.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ أ ب "UOTW #2 Answer - Ultrasound of the Week". Ultrasound of the Week. مؤرشف من الأصل في 2017-01-12. اطلع عليه بتاريخ 2017-05-27.
- ^ Worsley DF، Alavi A، Aronchick JM، Chen JT، Greenspan RH، Ravin CE (أكتوبر 1993). "Chest radiographic findings in patients with acute pulmonary embolism: observations from the PIOPED Study". Radiology. ج. 189 ع. 1: 133–36. DOI:10.1148/radiology.189.1.8372182. PMID:8372182.
- ^ أ ب Brown G، Hogg K (أكتوبر 2005). "Best evidence topic report. Diagnostic utility of electrocardiogram for diagnosing pulmonary embolism". Emergency Medicine Journal. ج. 22 ع. 10: 729–30. DOI:10.1136/emj.2005.029041. PMC:1726554. PMID:16189038.
- ^ Mattu A، Goyal D، المحررون (2007). Emergency medicine avoiding the pitfalls and improving the outcomes. Malden, Mass.: Blackwell Pub./BMJ Books. ص. 9. ISBN:978-0470755174. مؤرشف من الأصل في 2017-09-08.
- ^ McGinn S، White PD (1935). "Acute cor pulmonale resulting from pulmonary embolism". J Am Med Assoc. ج. 104 ع. 17: 1473–80. DOI:10.1001/jama.1935.02760170011004.
- ^ Rodger M، Makropoulos D، Turek M، Quevillon J، Raymond F، Rasuli P، Wells PS (أكتوبر 2000). "Diagnostic value of the electrocardiogram in suspected pulmonary embolism". The American Journal of Cardiology. ج. 86 ع. 7: 807–09, A10. DOI:10.1016/S0002-9149(00)01090-0. PMID:11018210.
- ^ Amal Mattu؛ Deepi Goyal؛ Barrett, Jeffrey W.؛ Joshua Broder؛ DeAngelis, Michael؛ Peter Deblieux؛ Gus M. Garmel؛ Richard Harrigan؛ David Karras؛ Anita L'Italien؛ David Manthey (2007). Emergency medicine: avoiding the pitfalls and improving the outcomes. Malden, Mass: Blackwell Pub./BMJ Books. ص. 10. ISBN:978-1-4051-4166-6.
- ^ Shopp JD، Stewart LK، Emmett TW، Kline JA (أكتوبر 2015). "Findings From 12-lead Electrocardiography That Predict Circulatory Shock From Pulmonary Embolism: Systematic Review and Meta-analysis". Academic Emergency Medicine. ج. 22 ع. 10: 1127–37. DOI:10.1111/acem.12769. PMC:5306533. PMID:26394330.
- ^ Kosuge M، Ebina T، Hibi K، Tsukahara K، Iwahashi N، Gohbara M، وآخرون (ديسمبر 2012). "Differences in negative T waves among acute coronary syndrome, acute pulmonary embolism, and Takotsubo cardiomyopathy". European Heart Journal - Acute Cardiovascular Care. ج. 1 ع. 4: 349–57. DOI:10.1177/2048872612466790. PMC:3760560. PMID:24062927.
- ^ Kearon C، Akl EA، Ornelas J، Blaivas A، Jimenez D، Bounameaux H، وآخرون (فبراير 2016). "Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report". Chest. ج. 149 ع. 2: 315–52. DOI:10.1016/j.chest.2015.11.026. PMID:26867832.
- ^ Vinson DR، Zehtabchi S، Yealy DM (نوفمبر 2012). "Can selected patients with newly diagnosed pulmonary embolism be safely treated without hospitalization? A systematic review". Annals of Emergency Medicine. ج. 60 ع. 5: 651–662.e4. DOI:10.1016/j.annemergmed.2012.05.041. PMID:22944455.
- ^ Yoo HH، Queluz TH، El Dib R (يناير 2016). "Anticoagulant treatment for subsegmental pulmonary embolism". The Cochrane Database of Systematic Reviews ع. 1: CD010222. DOI:10.1002/14651858.CD010222.pub3. PMID:26756331.
- ^ أ ب Robertson L، Jones LE (فبراير 2017). "Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for the initial treatment of venous thromboembolism". The Cochrane Database of Systematic Reviews. ج. 2017 ع. 2: CD001100. DOI:10.1002/14651858.CD001100.pub4. PMC:6464611. PMID:28182249.
- ^ Robertson L، Kesteven P، McCaslin JE، وآخرون (Cochrane Vascular Group) (ديسمبر 2015). "Oral direct thrombin inhibitors or oral factor Xa inhibitors for the treatment of pulmonary embolism". The Cochrane Database of Systematic Reviews ع. 12: CD010957. DOI:10.1002/14651858.CD010957.pub2. PMC:6463831. PMID:26636644.
- ^ أ ب اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعNICECG144 - ^ Mai V، Guay CA، Perreault L، Bonnet S، Bertoletti L، Lacasse Y، وآخرون (يونيو 2019). "Extended Anticoagulation for VTE: A Systematic Review and Meta-Analysis". Chest. ج. 155 ع. 6: 1199–1216. DOI:10.1016/j.chest.2019.02.402. PMID:31174635.
- ^ Yoo HH، Nunes-Nogueira VS، Fortes Villas Boas PJ (فبراير 2020). "Anticoagulant treatment for subsegmental pulmonary embolism". The Cochrane Database of Systematic Reviews. ج. 2: CD010222. DOI:10.1002/14651858.CD010222.pub4. PMC:7004894. PMID:32030721.
- ^ Decousus H, Leizorovicz A, Parent F, Page Y, Tardy B, Girard P, Laporte S, Faivre R, Charbonnier B, Barral F, Huet Y, Simonneau G (1998). "A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d'Embolie Pulmonaire par Interruption Cave Study Group". N Engl J Med. ج. 338 ع. 7: 409–15. DOI:10.1056/NEJM199802123380701. PMID:9459643.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Dong B, Jirong Y, Liu G, Wang Q, Wu T (2006). "Thrombolytic therapy for pulmonary embolism". Cochrane Database Syst Rev ع. 2: CD004437. DOI:10.1002/14651858.CD004437.pub2. PMID:16625603.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ موسوعة الملك عبدالله بن عبدالعزيز العربية للمحتوى الصحي
| في كومنز صور وملفات عن: انصمام رئوي |