تحلل الميالين الجسري المركزي
| تحلل الميالين الجسري المركزي | |
|---|---|
| central pontine myelinolysis | |
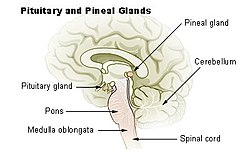 الجسر هو ذلك الانتفاخ في جذع الدماغ في أسفل يسار الصورة.
| |
| معلومات عامة | |
| الاختصاص | طب الجهاز العصبي |
| من أنواع | داء مزيل للميالين |
| تعديل مصدري - تعديل | |

تحلل الميالين الجسري المركزي (بالإنجليزية: central pontine myelinolysis) تعرف أيضا بمتلازمة إزالة الميالين التناضحية أو زوال الميالين الجسري المركزي، مرض عصبي ناتج عن تلف حاد في الغمد المياليني للخلايا العصبية بجذع الدماغ بالتحديد في منطقة الجسر أو قنطرة فارول (pons) السبب في الغالب علاجي المنشأ . يتميز بالشلل الحاد، عسر البلع (صعوبة البلع)، والتلفظ (صعوبة في الكلام)، وأعراض عصبية أخرى.
من الممكن أن يحدث أيضا خارج الجسر[1]، مصطلح متلازمة إزالة الميالين التناضحية مشابه ل تحلل الميالين الجسري المركزي ولكنه يشمل أيضا مناطق خارج الجسر.[2] يحدث كمضاعفات أثناء علاج المرضى الذين يعانون من نقص الصوديوم الحاد والمهدد للحياة.
تحدث نتيجة ارتفاع سريع في توترية مصل الدم أثناء علاج الأشخاص المصابون بنقص حاد ومزمن في صوديوم الدم حيث تأقلمت البيئة الداخلية لخلاياهم لنقص التوترية السائدة،[3] وبالتالي يجب تصحيح نقص صوديوم الدم بمعدل لا يزيد عن 8-12 مليمول/لتر من الصوديوم يوميا لمنع تحلل الميالين الجسري المركزي.[3]
على الرغم من عدم شيوعه ولكن من الممكن حدوثه في المرضى الذين لديهم تاريخ مع إدمان الكحول المزمن أو في حالات أخرى مرتبطة بنقص في وظائف الكبد. تلك الحالات لا علاقة لها بتصحيح الصوديوم أو اختلال توازن الشوارد.
الفيسيولوجيا المرضية[عدل]
تنص النظرية المُتفق عليها حالياً أن خلايا الدماغ تحاول ضبط أُسموليتها عن طريق تغيير مستويات بعض الأُسمولات مثل: الإينوزيتول، البيتائين والجلوتامين استجابة لتغير أُسمولية مصل الدم. في حالة نقص صوديوم الدم المزمن يُحاول الدماغ التعويض عن طريق خفض مستويات هذه الأُسمولات بداخل الخلايا وبالتالي تكون الخلايا متساوية التوتر نسبياً مع محيطها ولا تمتص الكثير من السوائل. العكس صحيح في حالة فرط صوديوم الدم حيث تقوم الخلايا برفع نسبة الأسمولات بداخلها وبالتالي لا تفقد الكثير من السوائل إلى خارج الخلية.
تصحيح تقص صوديوم الدم بالسوائل الوريدية يؤدي إلى زيادة التوترية خارج الخلية، تليها زيادة في التوترية داخل الخلية. عندما يكون التصحيح سريعاً جداً، فلا يوجد الوقت الكافي الذي يسمح للخلايا بالتأقلم مع التوترية الجديدة وهي عن طريق زيادة الأُسمولات المذكورة سابقاً داخل الخلية. إذا ارتفعت مستويات الصوديوم في الدم بسرعة جدا، سوف تستمر زيادة التوترية خارج الخلية بدفع الماء خارج خلايا الدماغ. يمكن أن يؤدي هذا إلى خلل في وظائف الخلايا وحدوث تحلل الميالين الجسري المركزي، حيث يتلف غمد المايلين التي يحيط بالخلايا العصبية في جزء من الدماغ الذي يسمى الجسر.[4][5]
الأسباب[عدل]

السبب الأكثر شيوعا هو التصحيح السريع جدا لنقص صوديم الدم.[6]
من المعروف أيضا أنها تحدث في المرضى الذين يعانون من أعراض انسحاب من إدمان الكحول المزمن.[7] وبالتالي حدوثها في مثل هذه الحالات لا غلاقة له إطلاقا بنقص الصوديوم في الدم أو التصحيح السريع له.
وقد لوحظ أيضا حدوثها إزاء زرع الخلايا الجذعية المكونة للدم.[8]
من الممكن حدوث تحلل الميالين الجسري المركزي في المرضى المصابين ب:
•مرض كبدي حاد.
•نقص صوديوم الدم نتيجة غسيل الكلى البريتوني.
•خلل حاد في الشوارد.
•الايدز.
التشخيص[عدل]
قد يكون من الصعب التشخيص باستخدام تقنيات التصوير التقليدية. ويكون أكثر وضوحا في صور الرنين المغناطيسي أكثر منه في الأشعة المقطعية.
الأعراض[عدل]

الأعراض السريرية لمتلازمة إزالة الميالين التناضُحية غير متجانسة وتعتمد في الاساس على أي المناطق في المخ هي المتأثرة.
الأعراض الأكثر مُلاحظة في هذا المرض هي اضطراب الوعي، تغيرات في المِشية، وانخفاض أو توقف وظيفة الجهاز التنفسي.[20][21] من الأعراض المُلاحظة في أغلب الأحيان في مثل تلك الحالة هي ضعف حاد في الجزء السفلي من الجسم أو في الأطراف الأربعة، عسر البلع، تلفظ، شفع، فقدان الوعي، وغيرها من الأعراض العصبية المرتبطة بتلف جذع الدماغ. قد يختبر المريض مُتَلاَزِمَةُ المُنْحَبِس ( شلل رباعي مع بقاء الوظائف الإدراكية سليمة)، لكن تصاب جميع العضلات بالشلل باستثناء تلك المسئولة عن طرفُ العينِ.يحدث هذا نتيجة تحلل الميالين السريع في السبيل القِشري البصلي والسبيل القِشري النٌخاعي في جذع الدماغ.[22]
الوقاية والعلاج[عدل]
لمنع حدوث متلازمة إزالة الميالين التناضحية يجب تصحيح نقص صوديوم الدم بمعدل لا يتجاوز 10 مليمول / لتر / 24 ساعة أو 0.5 مل مكافئ / لتر / ساعة. أو 18 م / مكافئ / L / 48 ساعة. وبالتالي تجنب حدوث فرط صوديوم الدم.[3] التفاصيل المتعلقة بالمسببات وتصحيح اضطرابات الشوارد مشروحة بالتفصيل في المراجع الطبية العامة.يجب أن يتناول مدمني المشروبات الكحولية فيتامينات مكمِلة وعمل تقييم رسمي مُسبَق إزاء وضعهم الغذائي.[23][24]
بمجرد بدء إزالة الميالين في الجسر لايوجد علاج أو علاج محدد. الرعاية تكون داعمة وذلك بهدف منع المضاعفات مثل الالتهاب الرئوي التنفسي أو تجلط الأوردة العميقة. عادة ما يتم إعطاء مدمني الكحوليات فيتامينات لتصحيح أوجه القصور الأخرى.
أدت الأبحاث المستمرة إالى تحسن النتائج.[25] وتشير الدراسات على الحيوانات أن الإينوزيتول يقلل من شدة متلازمة إزالة الميالين الجسري المركزي إذا ما أُعطى قبل محاولة تصحيح نقص صوديوم الدم المزمن.[26] يجب عمل المزيد من الدراسات قبل استخدام الإينوزيتول على البشر لهذا الغرض.
توقعات سير المرض[عدل]
توقعات سير المرض في العموم ضعيفة. وتشير الدراسات الأخيرة أن التوقعات في المرضى ذوي الحالات الحرجة أفضل مما هو معروف عموما،[27] على الرغم من شدة الأعراض السريرية الأولية وميل أطباء العناية المركزة إلى التقليل من أي تطور إيجابي محتمل.[28] في حين أن بعض المرضى يموتون معظمهم يبقى على قيد الحياة والناجين ثلثهم تقريبا يتعافي، وثلث آخر معاقون ولكنهم قادرون على العيش بصورة مستقلة، والثلث الآخير شديد الإعاقة.[29] وتتراوح الإعاقة الدائمة بين الارتعاشات الطفيفة والترنح إلى علامات التضرر الشديد في الدماغ، مثل الخزل الرباعي التشنجي ومتلازمة المنحبس.[30] من الممكن ملاحظة بعض التحسن في أول عدة أشهر بعد استقرار الحالة. يعتمد مدى التعافي على عدد المحاور العصبية التالفة.[4]
المراجع[عدل]
- ^ Gocht A, Colmant HJ (1987). "Central pontine and extrapontine myelinolysis: a report of 58 cases". Clin. Neuropathol. ج. 6 ع. 6: 262–70. PMID:3322623.
- ^ Lampl C, Yazdi K (2002). "Central pontine myelinolysis". Eur. Neurol. ج. 47 ع. 1: 3–10. DOI:10.1159/000047939. PMID:11803185. مؤرشف من الأصل في 2010-11-18.
- ^ أ ب ت Babar، S. (أكتوبر 2013). "SIADH Associated With Ciprofloxacin" (PDF). Annals of Pharmacotherapy. Sage Publishing. ج. 47 ع. 10: 1359–1363. DOI:10.1177/1060028013502457. ISSN:1060-0280. PMID:24259701. مؤرشف من الأصل (PDF) في 2016-01-01. اطلع عليه بتاريخ 2013-11-18.
- ^ أ ب Medana IM, Esiri MM (مارس 2003). "Axonal damage: a key predictor of outcome in human CNS diseases". Brain. ج. 126 ع. Pt 3: 515–30. DOI:10.1093/brain/awg061. PMID:12566274. مؤرشف من الأصل في 2020-03-14.
- ^ Spasovski G, Vanholder R, Allolio B, Annane D, Ball S, Bichet D, Decaux G, Fenske W, Hoorn E, Ichai C, Joannidis M, Soupart A, Zietse R, Haller M, van der Veer S, Van Biesen W, Nagler E (2014). "Clinical practice guideline on diagnosis and treatment of hyponatremia". European Journal of Endocrinology. ج. 170: G1–G47. DOI:10.1530/eje-13-1020. PMID:24569125. مؤرشف من الأصل في 2019-07-30.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Bernsen HJ, Prick MJ (سبتمبر 1999). "Improvement of central pontine myelinolysis as demonstrated by repeated magnetic resonance imaging in a patient without evidence of hyponatremia". Acta Neurol Belg. ج. 99 ع. 3: 189–93. PMID:10544728.
- ^ Yoon B, Shim YS, Chung SW (2008). "Central Pontine and Extrapontine Myelinolysis After Alcohol Withdrawal". Alcohol. ج. 43 ع. 6: 647–9. DOI:10.1093/alcalc/agn050. مؤرشف من الأصل في 2016-04-16.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Lim KH, Kim S, Lee YS؛ وآخرون (أبريل 2008). "Central pontine myelinolysis in a patient with acute lymphoblastic leukemia after hematopoietic stem cell transplantation: a case report". J. Korean Med. Sci. ج. 23 ع. 2: 324–7. DOI:10.3346/jkms.2008.23.2.324. PMC:2526450. PMID:18437020. مؤرشف من الأصل في 2020-04-14.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)[وصلة مكسورة] - ^ Singh N, Yu VL, Gayowski T (مارس 1994). "Central nervous system lesions in adult liver transplant recipients: clinical review with implications for management". Medicine (Baltimore). ج. 73 ع. 2: 110–8. DOI:10.1097/00005792-199403000-00004. PMID:8152365.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Kato T, Hattori H, Nagato M, Kiuchi T, Uemoto S, Nakahata T, Tanaka K (أبريل 2002). "Subclinical central pontine myelinolysis following liver transplantation". Brain Dev. ج. 24 ع. 3: 179–82. DOI:10.1016/S0387-7604(02)00013-X. PMID:11934516. مؤرشف من الأصل في 2019-06-06. اطلع عليه بتاريخ 2014-05-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Martinez AJ, Estol C, Faris AA (مايو 1988). "Neurologic complications of liver transplantation". Neurol Clin. ج. 6 ع. 2: 327–48. PMID:3047544. اطلع عليه بتاريخ 2014-05-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ McKee AC, Winkelman MD, Banker BQ (أغسطس 1988). "Central pontine myelinolysis in severely burned patients: relationship to serum hyperosmolality". Neurology. ج. 38 ع. 8: 1211–7. DOI:10.1212/wnl.38.8.1211. PMID:3399069.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Winkelman MD, Galloway PG (سبتمبر 1992). "Central nervous system complications of thermal burns. A postmortem study of 139 patients". Medicine (Baltimore). ج. 71 ع. 5: 271–83. DOI:10.1097/00005792-199209000-00002. PMID:1522803.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - ^ Sugimoto T, Murata T, Omori M, Wada Y (مارس 2003). "Central pontine myelinolysis associated with hypokalaemia in anorexia nervosa". J. Neurol. Neurosurg. Psychiatr. ج. 74 ع. 3: 353–5. DOI:10.1136/jnnp.74.3.353. PMC:1738317. PMID:12588925. مؤرشف من الأصل في 2019-12-14. اطلع عليه بتاريخ 2014-05-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Keswani SC (أبريل 2004). "Central pontine myelinolysis associated with hypokalaemia in anorexia nervosa". J. Neurol. Neurosurg. Psychiatr. ج. 75 ع. 4: 663, author reply 663. PMC:1739009. PMID:15026526. مؤرشف من الأصل في 2019-12-14. اطلع عليه بتاريخ 2014-05-29.
- ^ Leroy S, Gout A, Husson B, de Tournemire R, Tardieu M (يونيو 2012). "Centropontine myelinolysis related to refeeding syndrome in an adolescent suffering from anorexia nervosa". Neuropediatrics. ج. 43 ع. 3: 152–4. DOI:10.1055/s-0032-1307458. PMID:22473289. مؤرشف من الأصل في 2019-12-14. اطلع عليه بتاريخ 2014-05-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Bergin PS, Harvey P (أغسطس 1992). "Wernicke's encephalopathy and central pontine myelinolysis associated with hyperemesis gravidarum". BMJ. ج. 305 ع. 6852: 517–8. DOI:10.1136/bmj.305.6852.517. PMC:1882865. PMID:1393001.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - ^ Sutamnartpong P, Muengtaweepongsa S, Kulkantrakorn K (يناير 2013). "Wernicke's encephalopathy and central pontine myelinolysis in hyperemesis gravidarum". J Neurosci Rural Pract. ج. 4 ع. 1: 39–41. DOI:10.4103/0976-3147.105608. PMC:3579041. PMID:23546346. مؤرشف من الأصل في 2016-07-13. اطلع عليه بتاريخ 2014-05-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Kishimoto Y, Ikeda K, Murata K, Kawabe K, Hirayama T, Iwasaki Y (2012). "Rapid development of central pontine myelinolysis after recovery from Wernicke encephalopathy: a non-alcoholic case without hyponatremia". Intern. Med. ج. 51 ع. 12: 1599–603. DOI:10.2169/internalmedicine.51.7498. PMID:22728498. مؤرشف من الأصل في 2019-12-14. اطلع عليه بتاريخ 2014-05-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Musana AK, Yale SH (أغسطس 2005). "Central pontine myelinolysis: case series and review". WMJ. ج. 104 ع. 6: 56–60. PMID:16218318.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - ^ Odier C, Nguyen DK, Panisset M (يوليو 2010). "Central pontine and extrapontine myelinolysis: from epileptic and other manifestations to cognitive prognosis". J. Neurol. ج. 257 ع. 7: 1176–80. DOI:10.1007/s00415-010-5486-7. PMID:20148334.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Karp BI, Laureno R (نوفمبر 1993). "Pontine and extrapontine myelinolysis: a neurologic disorder following rapid correction of hyponatremia". Medicine (Baltimore). ج. 72 ع. 6: 359–73. DOI:10.1097/00005792-199311000-00001. PMID:8231786.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - ^ Kleinschmidt-DeMasters BK, Norenberg MD (مارس 1981). "Rapid correction of hyponatremia causes demyelination: relation to central pontine myelinolysis". Science. ج. 211 ع. 4486: 1068–70. DOI:10.1126/science.7466381. PMID:7466381.
- ^ Laureno R (1980). "Experimental pontine and extrapontine myelinolysis". Trans Am Neurol Assoc. ج. 105: 354–8. PMID:7348981.
- ^ Brown WD (ديسمبر 2000). "Osmotic demyelination disorders: central pontine and extrapontine myelinolysis". Curr. Opin. Neurol. ج. 13 ع. 6: 691–7. DOI:10.1097/00019052-200012000-00014. PMID:11148672. مؤرشف من الأصل في 2012-06-04.
- ^ Silver SM, Schroeder BM, Sterns RH, Rojiani AM (2006). "Myoinositol administration improves survival and reduces myelinolysis after rapid correction of chronic hyponatremia in rats". J Neuropathol Exp Neurol. ج. 65 ع. 1: 37–44. DOI:10.1097/01.jnen.0000195938.02292.39. PMID:16410747.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Louis G, Megarbane B, Lavoué S, Lassalle V, Argaud L, Poussel JF, Georges H, Bollaert PE (مارس 2012). "Long-term outcome of patients hospitalized in intensive care units with central or extrapontine myelinolysis*". Critical Care Medicine. ج. 40 ع. 3: 970–2. DOI:10.1097/CCM.0b013e318236f152. PMID:22036854. مؤرشف من الأصل في 2016-02-05. اطلع عليه بتاريخ 2014-05-30.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Young GB (مارس 2012). "Central pontine myelinolysis: a lesson in humility*". Critical Care Medicine. ج. 40 ع. 3: 1026–7. DOI:10.1097/CCM.0b013e31823b8e0b. PMID:22343870. مؤرشف من الأصل في 2016-02-05. اطلع عليه بتاريخ 2014-05-30.
- ^ Abbott R, Silber E, Felber J, Ekpo E (أكتوبر 2005). "Osmotic demyelination syndrome". BMJ. ج. 331 ع. 7520: 829–30. DOI:10.1136/bmj.331.7520.829. PMC:1246086. PMID:16210283.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Central Pontine Myelinolysis: Overview, Pathophysiology, Causes نسخة محفوظة 08 يناير 2009 على موقع واي باك مشين.
| تحلل الميالين الجسري المركزي في المشاريع الشقيقة: | |
| |
