قصدير
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 رمادي (الصورة إلى اليمين: النمط ألفا)، أو أبيض فضي (الصورة إلى اليسار: النمط بيتا) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | قصدير، 50، Sn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز بعد انتقالي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 14، 5، p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 118.710 غ·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Kr]; 4d10 5s2 5p2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 18, 4 (صورة) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| اللون | رمادي (النمط ألفا)، أو أبيض فضي (النمط بيتا) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | (أبيض؛ بيتا) 7.265 غ·سم−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | (رمادي؛ ألفا) 5.769 غ·سم−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 6.99 غ·سم−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 505.08 ك، 231.93 °س | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 2,875 ك، 2,602 °س | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | (أبيض) 7.03 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | (أبيض) 296.1 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | (أبيض) 27.112 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 4, 2, -4 (أكاسيده مذبذبة) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.96 (مقياس باولنغ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 708.6 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1411.8 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 2943.0 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 140 بيكومتر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±139 بيكومتر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 217 بيكومتر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري رباعي (أبيض) بنية الألماس المكعبة (رمادي) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | (رمادي)مغناطيسية معاكسة[1] (أبيض) مغناطيسية مسايرة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 66.8 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 22.0 ميكرومتر/(م·كلفن) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت | 2730 متر/ثانية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 50 غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 18 غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 58 غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 51 ميغاباسكال | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر القصدير | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
القَصْدِير هو عنصر كيميائي له الرمز Sn والعدد الذرّي 50؛ ويقع في الجدول الدوري في مجموعة الكربون (مجموعة العناصر الرابعة عشرة؛ أو المجموعة الرابعة وفق ترقيم المجموعات الرئيسية)، ويُصنَّف من الفلزات بعد الانتقالية. يتواجد بالطَّبيعة في الحالة الصّلبة، ويتشابهُ كيميائياً مع العنصرين المجاورَيْن لهُ في مجموعته، وهما الرصاص والجرمانيوم. يُستخلَص معظم القصدير الذي يستهلكه الإنسانُ من معدن الكاسيتريت، وذلك لاحتوائه على مُركَّب ثنائي أكسيد القصدير الذي يسهلُ فصلُ القصدير عنه. يحتل القصدير المرتبة التاسعة والأربعين من حيثُ وفرة انتشاره في قشرة الأرض، وبما أنَّ لهُ عشرة نظائر كيميائيَّة مستقرَّة بها أعدادٌ متفاوتة من النيوترونات، فهو يُعَدّ العنصر الذي يحظى بأكبر عددٍ من النظائر من بين جميع العناصر الكيميائية، وذلك بفضل العدد السحريّ لبروتوناته. ثمَّة هيئتان مختلفتان للقصدير في درجة حرارة الغرفة، الأولى منهما هي الهيئة المُسمَّاة بيتّا، حيث يكونُ عبارةً عن معدنٍ مرنٍ ذي لونٍ فضيّ، وأمّا الثانية (التي تتكوَّنُ في درجات الحرارة المنخفضة) فهي الهيئة ألفا، والتي يكتسبُ فيها القصدير لوناً رماديًّا ويصبح أقلَّ كثافةً، كما يتغيَّرُ فيها بناؤه الجزيئيّ. ومن سمات القصدير في هيئته المعدنيَّة - بيتّا - أنَّه لا يتأكسَدُ بسهولة.
كانت أوّل سبيكة يدخلُ في صنعها القصدير بالعالم القديم هي البرونز، إذ بدأ الإنسان بصناعة هذا المعدن من خليطٍ من النحاس والقصدير منذ ثلاث آلاف سنة قبل الميلاد. ومنذ عام 600 قبل الميلاد فصاعداً أصبحَ البشرُ قادرين على إنتاج القصدير بصورته الخام. كما شاعت منذ العصر البرونزي وحتى القرن العشرين صناعة الأواني المنزلية من سبيكةٍ أخرى تُسمَّى البُويْتَر، والتي تتألَّفُ بنسبة 85 إلى 90% من القصدير (بينما الباقي من النحاس والرصاص والإثمد). وأمّا في الزمن الحاضرِ، فإنَّ القصدير يدخلُ في صناعة الكثير من السَّبائِك، من أهمِّها سبيكة لحام القصدير (السولدر)، التي تتألَّفُ عادةً بنسبة 60% على الأقلّ من القصدير وأيضاً من الرَّصاص. ومن أهمِّ التطبيقات الصناعية لهذا العنصر هي عمليَّة القَصْدَرَة، التي يُغطَّى فيها الصلب بطبقةٍ رقيقةٍ من القصدير ليُصبِحَ مقاوماً للتآكل. وتعتبر مركَّبات القصدير غير العضويَّة آمنةً للإنسان وغير سامَّة، ولهذا السَّببِ فقد كانت الأغطية القصديريَّة تستخدمُ في تغليف الأطعمة وتخزينها داخل علب الصَّفِيح، حيث تكونُ معظم العبوة مصنوعةً من الفولاذ أو الألومنيوم، ولكنَّها مُغطَّاة بطبقةٍ قصديرية. إلّا أنَّ العلماء وجدوا أنَّ التعرّض الزائد عن اللّزوم للمواد المُصنَّعة من القصدير قد يؤثّر على صحة الإنسان، حيثُ يؤدّي إلى صعوباتٍ في امتصاص العناصر الغذائية مثل النحاس والزنك. إضافةً إلى ذلك، فإنَّ مزجَ القصدير مع مُركَّباتٍ عضويَّة (هيدروكربونية) قد يجعلهُ شديدَ السُميَّة، بل وقاتلاً للإنسان مثل السيانيد.
تأثيل
[عدل]اسمه بالعربية القَصْدِيْر أو الرصاص القلعي (أي «شديد البياض»[2]) حسب ابن البيطار، وهو عالم نبات وصيدلي عاش في الأندلس، والذي يصفهُ بأنّه ضربٌ من ضربين للرصاص (إذ يرى أن الآخر هو الزنك أو الرصاص الأسود).[3] (باللاتينية: Stannum) وبحسب معجم الدوحة التاريخي فإنَّ أوّل ذكرٍ للكلمة في اللغة العربية جاء في عام 114 هـ أو 732م.[4]
والكلمة اللاتينية للقصدير هي «stannum»، وكان معناها تاريخياً سبيكة من خليط الفضّة والرصاص، واكتسبت معنى القصدير في القرن الرابع الميلادي،[5] وأمّا قبل ذلك فسُمِّي القصدير بـ«الرصاص الأبيض» (باللاتينية: plumbum candidum)،[6] وهو نفس معنى مصطلح «الرصاص القلعي» بالعربية بحسب ما اقتُبِسَ عن ابن البيطار أعلاه. ولكلمة القصدير باللاتينية نفسُ جذر الكلمة باللغات الرومنسية الحديثة (مثل الفرنسية والإيطالية) والكلتية كذلك،[6][7] على أنّ تاريخ الجذر نفسهُ غير معروف فربّما يعود إلى لغة هندو أوروبية قديمة.[8] وأمّا في اللغات الجرمانية (وأشهرها الإنكليزية "tin" والألمانية "Zinn") فإنَّ الجذرٌ هنا مختلف، ولعلَّه نشأ من الجرمانية البدائية.[9][10] وقد ورد في لسان العرب تحت مادة «الآنُك» (الأُسْرُبُّ وهو الرَّصاصُ القَلْعِيُّ، وقال كراع: هو القزدير).
التاريخ
[عدل]
بدأ استعمال القصدير في العالم منذ بدء العصر البرونزي في نحو عام 3,000 قبل الميلاد، إذ لاحظ البعضُ أنّ النحاس المُصنَّع من خام متعدد المعادن (أي فيه أنواع عدة من المعادن) لهُ خصائص فيزيائية متفرّدة،[11] ولو أنّ أولى المُصنَّعات القصديرية احتوت نسبةً من القصدير أو الزرنيخ لا تتجاوزُ 2%، لذا يُظَنُّ أنّها سُبِكَت عَرَضاً من خامٍ نحاسيِّ غيرِ نقيّ، وليس بقصد سبكِ القصدير.[12] ويكتسبُ النحاس مزايا عدّة من خلطهِ بمعدنٍ ثانٍ مثل القصدير، ومن ذلك أن تزداد صلابته وتنخفض درجة انصهاره وتتحسن صبّته لأن صهارتهُ تُمْسي أكثر ميوعةً وتتصلَّبُ إلى معدنٍ كثيف مُركَّز،[12] ولذا ساعدَ ابتكارُ القصدير على صبِّه في صورٍ وأشكالٍ مُعقَّدة منذ العصر البرونزي. اكتُشفت أولى المُصنَّعات من خليط البرونز والزرنيخ في منطقة الشرق الأدنى، وهي بلادٌ تكثرُ فيها خامات النحاس (وهو من مكوِّنات البرونز) المختلطة بالزرنيخ، لكن صانعيها أدركوا بسرعة خطورة التسمّم بالزرنيخ، فأخذوا يبحثون عن مصادر آمنة لخام القصدير.[13] ونجح القدماء في سباكة القصدير النقي نحو عام 600 قبل الميلاد.[14]
من الغالب على الظنّ أنّ مصدر القصدير في العصور القديمة كان من معدن الكاسيتريت (SnO2 ثنائي أكسيد القصدير)، وكانت لهُ مصادر أخرى أكثر نُدْرة، منها كبريتيدات (مثل الستانيت) والتي يصعبُ صهرها. ويشيعُ أن يتراكم الكاسيتريت في قنوات الطمي فتُكوِّن رواسب مكيثة لأنها أقسى وأثقلُ وأمنعُ للتفاعل الكيميائي من الجرانيت المحيطِ بها،[12] ويتّسم الكاستيريت بلونٍ أسود أو لونٍ قاتم، لذا من السهل رؤيته على ضفاف الأنهار. ويحدثُ أن يساهم البشر بجمع أو تفريق هذه الرواسب المكيثة عرضاً بطريقة تشبهُ «غسل الذهب» (وهي وسيلة تقليدية للتنقيب عن الذهب بتصفيته في وعاء).[15]
الوفرة الطبيعية
[عدل]
ينشأ القصدير الطبيعي من التفاعلات الكيميائية في مراكز النجوم الصغيرة ومتوسّطة الحجم (ولها ما بين 0.6 إلى 10 أضعاف كتلة الشمس)، وذلك بعملية التقاط النيوترون البطيئة التي يتبعها اضمحلال نظائر الإنديوم الثقيلة وفق اضمحلال بيتا. ويتناثرُ القصدير -مثل باقي عناصر هذه النجوم- بعد انفجارها فينتشر في الفضاء ويختلطُ بما فيه، وهكذا دخل إلى السديم الذي انبثقت عنه الشمس والأرض وسائر الكواكب.[16]
ويُصنَّف القصدير بالمرتبة التاسعة والأربعين بين العناصر الكيميائية بحسب الوفرة في القشرة الأرضية، فهو يُكوِّن جُزْئَيْن في المليون من كافّة العناصر فيها، وتقارنُ هذه النسبة مع معادن أخرى منها الرصاص (14 جزءاً في المليون) والنحاس (50 ج.ف.م) والزنك (75 ج.ف.م).[17] ولا يقعُ القصدير نقيّاً وإنَّما يلزمُ استخراجه من خاماتٍ يختلطُ فيها بمعادن أخرى، ومصدره الوحيد القيّم اقتصادياً هو الكاسيتريت (SnO2)، كما تتواجدُ منه كمّيات ضئيلة في الكبريتيدات المعقّدة مثل الستانيت والسيليندريت والفرانكيت والكانفيلديت والتيليت. ولا تكادُ مركّبات القصدير تقعُ إلا في صخر الجرانيت، وعادةً ما تكون نسبة أكسيد القصدير فيها قريبةً من 1%.[18]
لثنائي أكسيد القصدير كثافة نسبية عالية، لذا فإنَّ 80% من إنتاج القصدير يستخرج من رواسب ثانوية تنجرفُ مع تيارات الماء تحت سطح الأرض من رواسب أساسية، كما يستخرجُ القصدير أحياناً حبيبات انجرفت مع تيارات الماء في الماضي إلى قيعان الأودية أو البحر. والطرق الأجدى اقتصادياً في تعدينه التجريف والضغط المائي والحفرة المفتوحة، ويُعدَّن معظم القصدير في العالم بالطريقة الأخيرة وما يشابهها من حفر الرسوبيات القريبة من سطح الأرض، وتحتوي هذه الرسوبيات نسبةً ضئيلةٍ من القصدير ربما لا تتعدّى 0.015%.[19]
عُدِّنَ في العالم نحو 310,000 طناً من القصدير في عام 2019، صُدِّرَت معظمها من الصين (85,000 طن) وإندونيسيا (80,000 طن) وبورما (54,000 طن) وبيرو (18,500 طن) وبوليفيا (17,000 طن) والبرازيل (17,000 طن).[20] وتختلفُ تقديرات إنتاج القصدير تاريخياً بحسب جدواه الاقتصادية والتقنية المتوفرة للتعدين، على أنّ التقديرات تشيرُ إلى أنّ استهلاك العالم الحالي والتطوّر التقني ينذرُ بنفاد القصدير الصالح للتعدين عالمياً قبل عام 2050.[21] ويظنّ المحلل البيئي براون أنّ مخزون العالم من القصدير سينفد خلال 20 عاماً إنِ استمرَّ استهلاكه بالنمو بمُعدَّل 2% سنوياً.[22]
ومن المصادر المهمّة للقصدير إعادة تدوير الخردة المستعملة، وهي طريقة إنتاج تنمو عالمياً بسرعة كبيرة، فالولايات المتحدة -مثلاً- لم تُعدِّن القصدير منذ عام 1993 ولم تُصنِّعهُ منذ سنة 1989، على أنّها كانت أكبرَ منتجٍ للقصدير المعاد تدويره في عام 2006 بإنتاجٍ يبلغ 14,000 طناً.[23] وقد اكتشفت احتياطيات جديدة للقصدير في منغوليا بالتسعينيات،[24] كما اكتُشِفت احتياطيات جديدة في كولومبيا سنة 2009.[25]
| العام | الاحتياطي (بملايين الأطنان) |
|---|---|
| 1965 | 4,265 |
| 1970 | 3,930 |
| 1975 | 9,060 |
| 1980 | 9,100 |
| 1985 | 3,060 |
| 1990 | 7,100 |
| 2000 | 7,100[23] |
| 2010 | 5,200[23] |
| البلد | الاحتياطي | الإنتاج |
|---|---|---|
| 1,100,000 | 85,000 | |
| 250,000 | 4,000 | |
| 110,000 | 18,500 | |
| 800,000 | 80,000 | |
| 700,000 | 17,000 | |
| 400,000 | 17,000 | |
| 350,000 | 1,400 | |
| 420,000 | 7,000 | |
| 100,000 | 54,000 | |
| أخرى | 350,000 | 1,400 |
| العالم كافة | 4,700,000 | 310,000 |
| الشركة | الدولة | 2006 | 2007 | %التغير |
|---|---|---|---|---|
| Yunnan Tin | الصين | 52,339 | 61,129 | 16.7 |
| PT Timah | إندونيسيا | 44,689 | 58,325 | 30.5 |
| Minsur | بيرو | 40,977 | 35,940 | −12.3 |
| Malay | الصين | 52,339 | 61,129 | 16.7 |
| Malaysia Smelting Corp | ماليزيا | 22,850 | 25,471 | 11.5 |
| Thaisarco | تايلند | 27,828 | 19,826 | −28.8 |
| Yunnan Chengfeng | الصين | 21,765 | 18,000 | −17.8 |
| Liuzhou China Tin | الصين | 13,499 | 13,193 | −2.3 |
| EM Vinto | بوليفيا | 11,804 | 9,448 | −20.0 |
| Gold Bell Group | الصين | 4,696 | 8,000 | 70.9 |
الإنتاج والتحضير
[عدل]يُنتَج القصدير من خلال الاختزال الكربوحراري للأكسيد الخامّ مع الكربون أو فحم الكوك. ويمكن استخدام تقنيتي الفرن العاكس وفرن القوس الكهربائي.[27][28][29]
التصنيع
[عدل]ثمَّة عشر شركات فقط أنتجت معظم صادرات العالم من القصدير لعام 2007. ومن غير الواضح أيّ من هذه الشركات هي التي تنتجُ القصدير المستخرج من منجم بيسي الواقع في جمهورية الكونغو الديمقراطية، وهو منجم هائلٌ للقصدير تتحكَّمُ به ميليشيات مُتمرّدة على الحكومة، وتستخرجُ منه 15,000 طنّ من القصدير سنوياً. وتجدر الإشارة إلى أنّ ماليزيا هي أوّل منتج للقصدير في العالم. ويُبَاع معظم قصدير العالم في بورصة لندن للمعادن، حيث تتاجرُ به 17 شركة من ثمان دول.[30]
تأسَّس في سنة 1947 مجلس عالمي للقصدير للتحكّم بأسعار القصدير حول العالم، واستمرَّ المجلسً بعمله حتى انهياره عام 1985. وفي سنة 1984، أي قبلَ انهياره بسنة، أسَّست مجموعة من الدول، هي أستراليا وإندونيسيا وبوليفيا وتايلند وماليزيا ونيجيريا، تحالفاً يعرفُ باسم اتحاد الدول المنتجة للقصدير.[ملاحظة 1][31]
الأسعار
[عدل]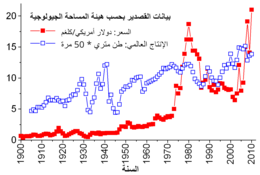
يتفرَّدُ القصدير عن سائر المعادن بأنّ التجارة فيه بين البلاد المُصدِّرة والمستوردة تُنظَِّمها اتفاقات قانونية معقّدة منذ عام 1921. وكانت أولى هذه الاتفاقات قليلة الرسمية ولم تُطبَّق بحذافيرها، لذا سُنَّت في عام 1956 «اتفاقية القصدير العالمية الأولى»، وتبعتها سلسلةٌ من الاتفاقيات الأخرى التي أُلغِيَ العمل بها في سنة 1985، وأشرفَ على إنفاذ تلك الاتفاقيات كيانٌ اسمهُ «مجلس القصدير العالمي» [ملاحظة 2]، فكان لهُ دورٌ رائدٌ في وضع أسعار الأسعار العالمية للصادرات؛ وذلك بسَنْد السِّعْر حين انخفاض الطلب بشراء فائضٍ من القصدير وتخزينه، وبكَبْح السعر حين زيادة الطلب ببَيْع الفائض المُخزَّن. على أنّ هذا الأسلوب كان متناقضاً مع مبدأ السوق الحرّ كما أن مساحات التخزين لم تكُن كافيةً، لذا فشلَ المجلس في مهمّته وارتفعت -بالنتيجة- أسعار القصدير شيئاً فشيئاً على مرّ التسع وعشرين عاماً التي نشطَ فيها (وخصوصاً بين عامي 1973 إلى 1980، حين تضخَّمت العديد من اقتصادات العالم).[32]
تعمَّدت الحكومة الأمريكية بين نهاية السبعينات ومطلع الثمانينات بيعَ القصدير بكمّيات هائلةٍ في بورصتها لاستغلال سعره المرتفع حينئذٍ، وأدّى هذا البيع المفرطُ إلى حالة ركود شديدٍ بين سنتي 1981 و1982 كانت له تداعيات شديدة على تجارة القصدير عالمياً. إذ هبطت المنافسة في السوق لأدنى الدرجات ولجأ مجلس القصدير العالمي إلى شراء كمّيات ضخمة وتخزينها لحماية السِّعْر من انهيارٍ وشيك، على أنّ المجلس اضطرَّ لأخذ قروضٍ عملاقة من البنوك وشركات المعادن لتغطية هذه التكاليف، واستمرَّ المجلس بالاقتراض حتى نهاية عام 1985 حين وصل إلى أقصى مبلغٍ يسمحُ له باقتراضه. وحُظِرَ المجلس حينها من التجارة في بورصة لندن[32]، وانتهى أمره بالإفلاس بسبب شراء فائضٍ كبيرٍ من القصدير وعدم نجاحه بكَبْح ارتفاع الأسعار.[33] وتلت انهياره «أزمة قصدير» امتدَّت في أرجاء السوق العالمي انتقل السوق بعدها إلى أسلوب التجارة الحرّ، فانهار سعر القصدير إلى 4 دولار للرطل (حوالي 9 دولارات للكيلوغرام) وظلَّ السعر في هذا النطاق على مرّ التسعينات،[32] ثمّ ارتفع قليلاً في عام 2010 (ما عدا تدنٍّ في الاستهلاك أثناء الأزمة المالية 2007-2008)، وهذا بفضلِ إعادة تعبئة المخازن تلو الأزمة وازدياد الطلب في الاقتصادات النامية.[23]
تعتبر بورصة لندن للمعادن المكان الرئيسي للتجارة بالقصدير في العالم،[23] كما أنّ له أسواقاً بالعقود في سوق كوالالمبور للقصدير وبورصة إندونيسيا للقصدير.[34] وفيما يلي سِعْر الكيلوغرام بالدولار بين سنتي 2008 و2012:
| 2008 | 2009 | 2010 | 2011 | 2012 | |
|---|---|---|---|---|---|
| السعر | 18.51 | 13.57 | 20.41 | 26.05 | 21.13 |
النظائر
[عدل]للقصدير عشرة نظائر مستقرّة تتراوح كتلها الذرية بين 112 و 114 إلى 120 و 122 و 124؛ وهو بذلك أكثر العناصر من حيث تعدّد النظائر المستقرة. ربّما قد يعود العدد الكبير من النظائر المستقرّة للقصدير إلى كون عدده الذري 50 عدداً سحرياً وفق مفاهيم الفيزياء النووية. من بين تلك النظائر يعدّ النظير قصدير-120 120Sn أكثرها وفرةً (حوالي الثلث)؛ بالمقابل فإنّ أقلّ تلك النظائر وفرةً هو النظير قصدير-115 115Sn. بالإضافة إلى النظائر المستقرّة فإنّ للقصدير 29 نظيراً غير مستقر تتراوح كتلها الذرية بين 99 إلى 137 وحدة كتل ذرية. باستثناء النظير قصدير-126 126Sn الذي له عمر نصف مقداره 230 ألف سنة، فإنّ جميع النظائر المشعة المتبقيّة لها عمر نصف أقلّ من سنة. من بين النظائر المشعّة للقصدير يوجد النظيران قصدير-100، المكتَشف سنة 1994، والذي لديه عدد سحري مضاعف، وكذلك النظير قصدير-132، بحيث يتميّز هذان النظيران رغم عدم استقرارهما بأنّ لهما نسب نيوترون/برتون مميّزة ومرتفعة تمثّل الحد الأغظمي الذي تنهار بعده الثباتية بشكل كبير وسريع.[36] يوجد أيضاً 30 مصاوغ نووي للنظائر بين 111 و 131 أكثرها استقراراً 121mSn بعمر نصف مقداره 43.9 سنة.[37]
يمكن تفسير الاختلاف في الوفرة الطبيعية النسبية لنظائر القصدير المستقرّة بالنظر إلى أنماط التشكّل المختلفة التي حدثت في تفاعلات الانصهار النجمي التخليقية للعناصر. فالنظائر من 116Sn إلى 120Sn تتشكّل وفق عملية التقاط النيوترون البطيئة في أغلب النجوم، ولذلك فإنّ تلك النظائر أكثرها وفرةً، في حين أنّ النظائر 122Sn و 124Sn تتشكّل فقط وفق عملية التقاط النيوترون السريعة في المستعرات العظمى وهي أقلّ شيوعاً. أمّا النظائر النادرة والغنية بالبروتونات 112Sn و 114Sn و 115Sn فلا يمكن أن تتشكّل بكمّيات وفيرة في عمليات التقاط النيوترون البطيئة أو السريعة، ولا تزال طريقة تشكّلها غير معروفة. من بين النظريات المقترحة لتشكّلها حدوث عملية التقاط بروتون بالإضافة إلى انحلال ضوئي، على الرغم من أنّ النظير قصدير-115 115Sn يمكن ان يتشكّل من عملية التقاط النيوترون السريعة بشكل مباشر وكناتج نويدة مضمحلة عن النويدة إنديوم-115 طويلة العمر.[38]
لا يكون للنظائر زوجية عدد الكتلة قيمة لف مغزلي، في حين أنّ الفردية منها ذات قيمة لفّ مغزلي +1/2. يعدّ القصدير بوجود نظائره الثلاثة الشائعة 116Sn و 118Sn و 120Sn، من بين أسهل العناصر الكيميائية للكشف والتحليل باستخدام مطيافية الرنين المغناطيسي النووي NMR، حيث تقيّس قيم الانزياح الكيميائي بالنسبة إلى رباعي ميثيل القصدير SnMe4.[39]
الخواصّ الفيزيائية
[عدل]
القصدير هو فلز ليِّن ٌذو لونٍ فضيّ، وله مرونة وقابليَّة للطَّرق والتشكيل. يصدر قضيب القصدير صوتاً مميزاً عندَ ثنيه،[40] وهو ينصهرُ عندَ حرارةٍ منخفضة نسبياً، لا تتعدَّى 232 درجة مئوية (وهي أقلّ درجة انصهارٍ في مجموعته من العناصر). وأمّا عندَ التعامل مع جزيئات القصدير فائقة الصغر، التي يبلغُ قطرها حوالي 11 نانومتراً أو أقلّ، فإنَّ نقطة الانصهار تنخفضُ إلى 177.3 درجة مئوية فحسب.[41]
ويمكن بسهولةٍ إعادة طرق وتشكيل القصدير عندما يكونُ بصورته العاديَّة، المعروفة بالهيئة بيتّا. وأمّا القصدير ألفا (وهو قصديرٌ في هيئته غير المعدنية وذو لونٍ رمادي)، الذي لا يستقرّ إلا في درجة 13 مئوية أو أقلّ، فيكونُ متقصِّفاً: أي أنَّ ثنيه أو تغيّر شكله صعبٌ جداً دون كسره. وتتميَّز جزيئات القصدير ألفا بتركيب بلوري ثماني الشكل، شبيهٍ بذلك الموجود في جزيئات معادن الألماس والسيليكون والجرمانيوم. كما أنَّ ذرّات هذا النوع من القصدير لها بناءٌ مُعيَّنٌ يمنعُ الإلكترونات من التحرّك بحريَّة بينها، ممَّا يفقدُهُ الخصائص المعتادة للمعادن (مثل توصيل الكهرباء). ويتّخذ القصدير ألفا شكلاً أقربَ إلى مسحوقٍ رماديّ، ومن النادر استخدامه في الصّناعة، ما عدا حالاتٍ مُعيَّنة يستفاد منه فيها كمادَّةٍ شبه موصلة.[40]
تًسمَّى الهيئات المختلفة للعنصر، مثل القصدير ألفا والقصدير بيتا في هذه الحالة، تآصلاتٍ بعلم الكيمياء. ويعرف هذان المتآصلان - في هذه الحالة - عادةً باسمي «القصدير الرمادي» (ألفا) و«القصدير الأبيض» (بيتا). كما يوجد للقصدير متآصلان آخران، يُسمَّيان غاما وسيغما، ولكن لا يمكن صنعهما إلا في وسطٍ تزيدُ درجة حرارته عن 161ْ درجة مئوية وبتطبيق ضغطٍ يعادل عدَّة وحدات باسكال.[42] مع المعلومية بأنَّ القصدير الأبيض (بيتا) قد يتحوَّلُ لقصدير رماديّ عاديّ في حال تعريضه لوسطٍ عالي البرودة،[43] ويجبُ أن يجري هذا التحوّل - عادةً - ضمنَ حرارة 13.2ْ درجة، ولكن وجود الكثير من العناصر الدخيلة على القصدير بمعظم الحالات (مثل الألومنيوم والزنك وغير ذلك) والتي يصعبُ فصلها عنها، تجعلُ حرارة التحوّل تحتَ الصفر بدرجات كثيرة. بل إنَّ إضافة بعض العناصر، مثل الإثمد والبزموت، تجعلُ التحوّل مستحيلاً تماماً.[44]
تنجحُ الفئات التجارية من القصدير (بنسبة 99.8%) بمقاومة الصدأ والتغيّر نتيجة تأثير الكميَّات الصغيرة من البزموت والإثمد والرصاص والفضة الموجودة فيها بشكل طبيعيّ، كبواقٍ من عمليات التنقية. كما تُضَاف إلى القصدير مقاديرُ من النحاس والبزموت والإثمد والفضة والكادميوم عمداً لزيادة صلابته. ولكن من السهل على القصدير أن يتحوّل، عندَ خلطه بغيره من المعادن، إلى هيئات متفتّتة وقاسية غير مرغوبة. لا يمكن للقصدير أن ينحلَّ في الكثير من العناصر الأخرى بحالته الصلبة إجمالاً، ولا يمكن سوى لعناصر قليلة أن تنحلَّ فيه، ولكنَّ له نظماً أصهرية مع البزموت والرصاص والغاليوم والثاليوم والزنك.[44]
يصبح القصدير موصلاً فائقاً عندما تنخفض درجة حرارته تحتَ 3.72 كلفن،[45] وقد كان واحداً من أولى الموصلات الفائقة التي درسها العلماء: إذ اكتشفت ظاهرة مايسنر، وهي واحدةٌ من أهمّ ميّزات الموصلات الفائقة، اكتشفت لأول مرة في بلورات القصدير.[46]
ويمكن للقصدير مقاومة التآكل عند التعرّض للماء، ولكنه يتضرَّرُ من الأحماض والقواعد. ويمكن صقلُ القصدير بدرجة فائقة بحيثُ يستخدم طبقة حامية للمعادن الأخرى.[40] وتُضَاف إلى القصدير أحياناً طبقة سطحية مؤكسدة (في عملية تُسمّى التخميل) لمنعه من التأكسد اللاحق، وذلك بطريقة مماثلة لما يستعمل مع البيوتر وباقي سبائك القصدير.[47]
الخواص الكيميائية
[عدل]بسبب وجود طبقةٍ من الأكسيد على سطحه يستطيع القصدير أن يقاومَ أثرَ الماء والأوساط الحمضية والقلوية الضعيفة، إلّا أنّ المحاليل المركّزة من الأحماض والقلويات تستطيع مهاجمته. تحمي تلك الطبقة الأكسيدية المخمّلة فلزّ القصدير من استمرار الأكسدة، الأمر المماثل الذي يحدث على سطح البيوتر وعلى سبائك القصدير الأخرى.[47]
المركبات الكيميائية
[عدل]يشكّل القصدير العديد من المركّبات الكيميائية، والتي يكون فيها القصدير غالباً برقم أكسدة +4 أو +2.
اللاعضوية
[عدل]
يمكن الحصول على مركّبات الهاليدات المستقرّة للقصدير بعددي الأكسدة الشائعين، فبالنسبة للقصدير الرباعي يتوفّر كلّ من رباعي الفلوريد SnF4 ورباعي الكلوريد SnCl4 ورباعي البروميد SnBr4 ورباعي اليوديد SnI4. من بين هذه الهاليدات الرباعية يكون للفلوريد فقط بنية بوليميرية. كما هو الحال مع القصدير الرباعي فإنّ مركّبات الهاليدات للقصدير الثنائي معروفة أيضاً، وهي تتضمّن ثنائي الفلوريد SnF2 وثنائي الكلوريد SnCl2 وثنائي البروميد SnBr2 وثنائي اليوديد SnI2. جميع هذه الهاليدات الثنائية ذات بنية بوليميرية صلبة. من بين جميع الهاليدات الثمانية المذكورة تكون اليوديدات فقط هي الملونة؛[49] أمّا أهمّ هذه الهاليدات من حيث التطبيق العملي التجاري فهو كلوريد القصدير الثنائي. لا يُحضَّر المركّب الأخير من التفاعل المباشر بين الكلور والقصدير، إذ أنّ التفاعل المذكور يعطي كلوريد القصدير الرباعي، إنّما يُحضَّر من تفاعل القصدير مع حمض الهيدروكلوريك، أو من تفاعل كلوريد القصدير الرباعي مع فلزّ القصدير في تفاعل أكسدة-اختزال خاص يدعى تفاعل تناسب مشترك.[50]
يمكن للقصدير أن يشكّل العديد من مشتقّات الكالكوجينيد مثل الأكاسيد والكبريتيدات وغيرها. يتشكّل أكسيد القصدير الرباعي (ثنائي أكسيد القصدير SnO2) عند تسخين القصدير حرارياً بوجود أكسجين الهواء؛[49] وهو أكسيد مذبذب (أمفوتيري) يتفاعل مع محاليل الأحماض والقواعد.[51] كما يوجد أيضاً أكسيد القصدير الثنائي SnO وكبريتيد القصدير الثنائي SnS وكبريتيد القصدير الرباعي SnS2.
يشكّل القصدير بعدد الأكسدة +4 مركب الهيدريد SnH4 المعروف باسم ستانان.
العضوية
[عدل]يوجد العديد من مركبات القصدير العضوية المعروفة،[52] وهي أكثر مركّبات القصدير أهميّةً تجارياً وتطبيقياً.[53] كان أوّل هذه المركّبات المكتشفة هو ثنائي يوديد ثنائي إيثيل القصدير C2H5)2SnI2) والذي وصفه إدوارد فرانكلاند سنة 1849.[54] من الأمثلة الأخرى مركّب هيدريد ثلاثي بوتيل القصدير Sn(C4H9)3H،[40] والتي تتميز بأنها قادرة على أن تحرّر جذور حرّة من ثلاثي بوتيل القصدير TBT، وهي أمثلة نادرة على القصدير الثلاثي (في حالة أكسدة +3).[55]
إنّ أغلب مركّبات القصدير العضوية هي بلّورات صلبة أو سوائل عديمة اللون، وهي ثابتة تجاه الهواء والماء، ولها بنية رباعية الوجوه. يمكن تحضير مركّبات رباعي أريل أو رباعي ألكيل القصدير (مثل رباعي ميثيل القصدير) انطلاقاً من كواشف غرينيار:[53]
كما يمكن أن يحصَل تفاعل إعادة توزيع لتحضير مركّبات ألكيل هاليدات القصدير المختلطة:
أمّا مركّبات القصدير الثنائي العضوية فهي غير شائعة، وتؤمّن الثباتية من خلال تأثير الزوج الخامل. من أمثلتها مركّبات ستانيلينات [ملاحظة 3] (مثل (R2Sn وثنائي الستانيلينات (R4Sn2) والتي تخضع إلى تفاعلات غير نمطية.[56]
الكيمياء التحليلية
[عدل]
يمكن الكشف عن أملاح القصدير نوعياً في اختبار كيميائي يعرف باسم اختبار الإضاءة. في هذا الاختبار يضاف إلى محلول العينة حمض الهيدروكلوريك بتركيز حوالي 20%، ثم يضاف مسحوق الزنك، حيث يتحرّر غاز الهيدروجين. تعمل ذرات الهيدروجين الناشئة والوليدة حديثاً على اختزال جزء من القصدير إلى الستانان SnH4. عند تعريض أنبوب الاختبار في حجرة مظلمة إلى لهب موقد بنسن غير مضيء يظهر وميض فلوري أزرق في المحلول عند احتوائه على القصدير بسبب تشكّل SnH4.[57] بعض الآراء الأخرى تعزو الوميض إلى كلوريد القصدير الثنائي SnCl2.[58]
يستخدم قياس الاستقطابية كأسلوب للتحليل الكمّي للقصدير.[59] أمّا عند وجود كميات نزرة فيمكن استخدام طرق المطيافية الذرّية، والتي يمكن أن يصل فيها حدّ الكشف عند استخدام أسلوب مطيافية الامتصاص الذري إلى 0.2 ميكروغرام/ل عند استخدام تقنية أنبوب الغرافيت؛ أمّا عند استخدام تقنية الهيدريد، والتي تتطلّب إضافة بورهيدريد الصوديوم ليتشكّل الستانان الغازي، الذي يتفكّك عند درجة حرارة حوالي 1000 °س إلى عناصره الأولية، والتي يعطي حينها القصدير خط طيفي مميّز بفضل وجود مصباح المهبط المجوف، فيكون حدّ الكشف عندئذٍ 0.5 ميكروغرام/ل.[60]
الاستخدامات
[عدل]في سنة 2006 كان حوالي نصف القصدير المنتج عالمياً يستخدم في صناعة سبيكة اللحام بالقصدير، في حين أنّ الباقي يتوزّع ما بين عملية القصدرة وإنتاج مركّبات القصدير أو سبائكه بالإضافة إلى تطبيقات ثانوية أخرى.[30]

سبيكة لحام القصدير
[عدل]تعدّ سبيكة لحام القصدير أكثر التطبيقات واسعة الانتشار التي تستهلك هذا الفلز. يشكّل القصدير مزيجاً أصهرياً مع الرصاص عند النسبة 63% قصدير و 37% رصاص، والتي عادة ما تكون مسبوكةً على شكل أسلاك لغرض اللحام، وخاصّةً في مجال الدارات الكهربائية.
منذ تفعيل العمل بالتوجيهات المتعلّقة بالنفايات الكهربائية والأجهزة الإلكترونية (WEEE) والحدّ من المواد الخطرة في الأوّل من تموز/يوليو 2006 في الاتحاد الأوروبي انخفض تركيز الرصاص في هذه السبائك، ممّا أدّى بالتالي إلى ضرورة البحث عن بدائل مناسبة، ولكن ذلك الأمر لم يخلُ من مصاعبَ ومشاكلَ تقنية،[61] من بينها ارتفاع نقطة الانصهار، وتشكّل ما يُعرَف باسم أسلاك التماس، بالإضافة إلى حدوث ظاهرة تَوَبُّؤ القصدير (أو هشيم القصدير)، التي تؤدّي إلى انقطاع الوصلات الملحومة. من بين البدائل المقترحة سبيكة من القصدير (+95%) والنحاس (0.5%) والفضّة (3.0%).[62]
القصدرة
[عدل]يرتبط القصدير بشكل سريع ووثيق على سطوح العديد من الفلزات، فهو يستخدم في قصدرة الحديد والرصاص والزنك للحدّ من التآكل. يعرف المعدن الناتج بالاسم الشائع الصفيح أو التنك، وينتشر استخدام العبوات المصتوعة منه في مجال حفظ الأغذية، ويشكّل هذا التطبيق شريحةً واسعةً من الطلب على القصدير الفلزّي في السوق. يستخدم الصفيح المُقصْدَر في صناعة العديد من الأغراض والأجهزة، ومنها صفارة القصدير، التي سُمِّيَت بهذا الاسم لأنها صنعت أوّل مرة من صفائح فولاذ مُقَصدَر.[63][64]
صنع السبائك
[عدل]

يشكّل القصدير طيفاً واسعاً من السبائك ذات التطبيقات المهمّة، وذلك مع عددٍ من الفلزّات أكثرها شيوعاً النحاس. من بين تلك السبائك الحاوية على نسبة مرتفعة من القصدير سبيكة البيوتر وهي حوالي 85–99% قصدير،[65] وكذلك النوع الخاص منها المعروف باسم معدن بريطانيا؛ بالإضافة إلى سبيكة بابت.[66][67]
يشكّل القصدير حوالي 12% من سبيكة البرونز، التي أغلبها من النحاس، كما تستخدم السبائك من النحاس والقصدير (22%) في صناعة الأجراس. ومن السبائك الحاوية على القصدير والمسماة حسب مكتشفيها كلّ من سبيكة فيلد (إثمد: 32.5%، إنديوم: 51%، قصدير: 16.5%)، وسبيكة وود (إثمد: 50%، رصاص: 26.7%، قصدير: 13.3%، كادميوم: 10%)، وسبيكة روز (إثمد: 50%، رصاص: 25–28%، قصدير: 22–25%)؛ بالإضافة إلى سبيكة غالينستان التجارية المسماة حسب العناصر المكونة لها (غاليوم: 68%، إنديوم: 22%، قصدير: 10%). لسبيكة القصدير مع الجرمانيوم أهمية تطبيقية في مجال هندسة الإلكترونيات الدقيقة لصناعة ترانزستورات موسفت؛[68][69] وفي مجال الكهرضوئيات لتوليد الليزر،[70][71] وصمامات LED.[72][73] ومن العناصر التي يستطيع القصدير تشكيل وسبائك ومركّبات بين فلزية ذات تطبيقات مهمّة أيضاً كلّ من السيليكون في مجال أشباه الموصلات،[74] والنيوبيوم في مجال الموصلية الفائقة.[75]
استخدم القصدير سابقاً في تركيب سبائك النقود، فعلى سبيل المثال استعمل فيما مضى في سبك البنسات الأمريكية،[76] والكندية.[77] تدخل نسبة صغيرة من القصدير في تركيب سبائك الزركونيوم المستخدمة في الوقود النووي.[78] يستخدم القصدير والرصاص بنسبة تصل إلى 50/50 في تصنيع الأنانبيب المعدنية في الأرغن ذو الأنابيب، ومن ضمن الميّزات التي يحصل نتيجة ذلك المظهر والتأثير على الأداء ومقاومة التآكل.[79][80]
تطبيقات أخرى
[عدل]
تعدّ الأشغال اليدوية على صفائح الفولاذ المُقصدَر من التقنيات واسعة الانتشار في الأعمال الفنية، ويحصل في النهاية على نماذج مدقوقة أو مخروزة لأغراض الديكور، ومن أمثلة ذلك صنع الفوانيس التقليدية وغيرها من المشغولات اليدوية.[81] كما يستعمل القصدير في تحضير الزجاج الطافي في عملية تسمى عملية بيلكينغتون.[82]
يدخل القصدير في تصنيع أقطاب بعض أنواع بطاريات ليثيوم-أيون، مع العلم أنّ توجه السطح البلوري له دور في كفاءة عمل البطارية.[83]
لمركّبات القصدير، العضوية واللاعضوية منها، العديد من التطبيقات. فيضاف فلوريد القصدير الثنائي مثلاً إلى مستحضرات العناية بالأسنان، ووجد أنّ له فعالية أكبر من فلوريد الصوديوم في ضبط حالة التهاب اللثة.[84] لمركّبات القصدير العضوية استعمالات واسعة الانتشار، حيث يُقدَّر أن يتجاوز الإنتاج العالمي منها 50 ألف طن.[85] تستخدم مركبات القصدير العضوية في تحضير مثبّتات بوليمير PVC (بولي فاينيل كلوريد)، حيث يعمل القصدير على التقاط وتجميع أيونات الكلوريد، ممّا يمنع فقدان HCl من البنية البوليميرية.[86] كما تستخدم تلك المركّبات عموماً في تحضير المبيدات على اختلاف أنواعها؛[86] ويستخدم أكسيد ثلاثي بوتيل القصدير في حفظ الخشب؛[87] وكانت تستخدم في صيانة السفن، قبل أن تمنع لكونها من الملوّثات العضوية الثابتة ولتأثيرها السلبي على الأحياء المائية.[86][88]
المخاطر
[عدل]لا يعدّ القصدير بحدّ ذاته فلزّاً سامّاً، حيث لا توجد حالات مسجلّة للتسمّم بالقصدير أو أكاسيده أو أحد أملاحه اللاعضوية؛ بالمقابل فإنّ لبعض مركّبات القصدير العضوية المحدّدة سمّية مقاربة لسمية السيانيد.[53]
حَدّدت إدارة السلامة والصحة المهنية الأمريكية (OSHA) الحدّ المسموح للتعرّض للقصدير الفلزّي في مكان العمل بمقدار 2 مغ/م3 خلال ثمان ساعات عمل؛ وهو نفس المقدار الذي حدّده المعهد الوطني للسلامة والصحة المهنية الأمريكي كحدٍّ موص ً به؛ أمّا عند مستويات تفوق 100 مغ/م3 فيكون القصدير الفلزي ذا خطورة فورية للحياة أو الصحة.[89]
ملاحظات
[عدل]- ^ (بالإنجليزية: Association of Tin Producing Countries)
- ^ (بالإنجليزية: International Tin Council)
- ^ (بالإنجليزية: stannylenes)
المراجع
[عدل]- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Team, Almaany. "تعريف و شرح و معنى قلعي بالعربي في معاجم اللغة العربية معجم المعاني الجامع، المعجم الوسيط ،اللغة العربية المعاصرة ،الرائد ،لسان العرب ،القاموس المحيط - معجم عربي عربي صفحة 1". www.almaany.com (بالإنجليزية). Archived from the original on 2020-05-24. Retrieved 2020-05-24.
- ^ الجامع لمفردات الأدوية والأغذية لابن البيطار نسخة محفوظة 25 فبراير 2019 على موقع واي باك مشين.
- ^ "قَصْدِير". معجم الدوحة التاريخي للغة العربية. مؤرشف من الأصل في 2020-05-24. اطلع عليه بتاريخ 2020-05-24.
- ^ Encyclopædia Britannica, 11th Edition, 1911, s.v. 'tin', citing H. Kopp
- ^ ا ب "tin". قاموس أوكسفورد الإنجليزي (ط. الثالثة). مطبعة جامعة أكسفورد. سبتمبر 2005.
- ^ "The Ancient Mining of Tin". oxleigh.freeserve.co.uk. مؤرشف من الأصل في 2009-04-03. اطلع عليه بتاريخ 2009-07-07.
- ^ قاموس التراث الأمريكي للغة الإنجليزية
- ^ "Home : Oxford English Dictionary". oed.com (بالإنجليزية). Archived from the original on 2020-05-25. Retrieved 2020-05-25.
- ^ "tin | Origin and meaning of tin by Online Etymology Dictionary". www.etymonline.com (بالإنجليزية). Archived from the original on 2020-05-07. Retrieved 2020-05-25.
- ^ Cierny، J.؛ Weisgerber، G. (2003). "The "Bronze Age tin mines in Central Asia". في Giumlia-Mair، A.؛ Lo Schiavo، F. (المحررون). The Problem of Early Tin. Oxford: Archaeopress. ص. 23–31. ISBN:978-1-84171-564-3.
- ^ ا ب ج Penhallurick، R. D. (1986). Tin in Antiquity: its Mining and Trade Throughout the Ancient World with Particular Reference to Cornwall. London: The Institute of Metals. ISBN:978-0-904357-81-3.
- ^ Charles، J. A. (1979). "The development of the usage of tin and tin-bronze: some problems". في Franklin، A. D.؛ Olin، J. S.؛ Wertime، T. A. (المحررون). The Search for Ancient Tin. Washington D.C.: A seminar organized by Theodore A. Wertime and held at the Smithsonian Institution and the National Bureau of Standards, Washington D.C. March 14–15, 1977. ص. 25–32.
- ^ "Tin Statistics and Information". www.usgs.gov. مؤرشف من الأصل في 2020-05-09. اطلع عليه بتاريخ 2020-05-25.
- ^ Dube، RK (سبتمبر 2006). "Interrelation between gold and tin: A historical perspective". Gold Bulletin. ج. 39 ع. 3: 103–113. DOI:10.1007/BF03215537.
- ^ Shu، Frank H. (1982). The physical universe: An introduction to astronomy. University Science Books. ص. 119–121. ISBN:978-0-935702-05-7. مؤرشف من الأصل في 2019-12-17.
- ^ Emsley 2001، صفحات 124, 231, 449 and 503
- ^ ا ب "Tin: From Ore to Ingot". International Tin Research Institute. 1991. مؤرشف من الأصل في 2009-03-22. اطلع عليه بتاريخ 2009-03-21.
- ^ Sutphin، David M.؛ Sabin، Andrew E.؛ Reed، Bruce L. (1 يونيو 1992). Tin – International Strategic Minerals Inventory Summary Report. ص. 9. ISBN:978-0-941375-62-7. مؤرشف من الأصل في 2016-04-28.
- ^ "Tin Data Sheet - Mineral Commodity Summaries 2020" (PDF). U.S. Geological Survey. يناير 2020. مؤرشف من الأصل (PDF) في 2020-05-25. اطلع عليه بتاريخ 2020-05-25.
- ^ Reilly، Michael (26 مايو 2007). "How Long Will it Last?". New Scientist. ج. 194 ع. 2605: 38–39. Bibcode:2007NewSc.194...38R. DOI:10.1016/S0262-4079(07)61508-5. ISSN:0262-4079.
- ^ Brown، Lester (2006). Plan B 2.0. New York: W.W. Norton. ص. 109. ISBN:978-0-393-32831-8. مؤرشف من الأصل في 2020-05-25.
- ^ ا ب ج د ه و Carlin, Jr.، James F. "Tin: Statistics and Information". United States Geological Survey. مؤرشف من الأصل في 2018-12-03. اطلع عليه بتاريخ 2008-11-23.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Kovalenko، V. I.؛ Yarmolyuk، V. V. (1995). "Endogenous rare metal ore formations and rare metal metallogeny of Mongolia". Economic Geology. ج. 90 ع. 3: 520. DOI:10.2113/gsecongeo.90.3.520. مؤرشف من الأصل في 2008-09-05.
- ^ "Seminole Group Colombia Discovers High Grade Tin Ore in the Amazon Jungle". FreePR101 PressRelease. مؤرشف من الأصل في 2014-08-26.
- ^ "International Tin Research Institute. Top Ten Tin Producing Companies". مؤرشف من الأصل في 2008-12-07. اطلع عليه بتاريخ 2009-05-05.
- ^ Schrader، George F.؛ Elshennawy، Ahmad K.؛ Doyle، Lawrence E. (يوليو 2000). Manufacturing processes and materials. ISBN:978-0-87263-517-3. مؤرشف من الأصل في 2016-05-11.
- ^ Louis، Henry (1911). Metallurgy of tin. McGraw-Hill book Company. مؤرشف من الأصل في 2016-05-31.
- ^ Knorr, Klaus (1945). Tin Under Control. Stanford University Press. ISBN:978-0-8047-2136-3. مؤرشف من الأصل في 2016-05-19.
- ^ ا ب "Tin Use Survey 2007". ITRI. مؤرشف من الأصل في 2008-12-07. اطلع عليه بتاريخ 2008-11-21.
- ^ “Agreement establishing the Association of Tin Producing Countries ATS 10 of 1984". Australasian Legal Information Institute, Australian Treaties Library. Retrieved on 14 June 2017. نسخة محفوظة 15 أبريل 2017 على موقع واي باك مشين.
- ^ ا ب ج Carlin, James F., Jr. (1998). Significant events affecting tin prices since 1958 نسخة محفوظة 2011-10-28 على موقع واي باك مشين.. USGS.
- ^ Martha، Rutsel Silvestre J. (31 مايو 2016). The Financial Obligation in International Law. Oxford University Press. ISBN:9780191055966.
- ^ "12 Januari Pemasaran Perdana INATIN". 15 ديسمبر 2011. مؤرشف من الأصل في 2012-04-26.
- ^ Helgi Library, "Archived copy". مؤرشف من الأصل في 2014-02-22. اطلع عليه بتاريخ 2014-02-10.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link), 2014-02-10 - ^ Walker، Phil (1994). "Doubly Magic Discovery of Tin-100". Physics World. ج. 7 ع. June. مؤرشف من الأصل في 2014-07-12.
- ^ Audi، Georges؛ Bersillon، O.؛ Blachot، J.؛ Wapstra، A. H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. Atomic Mass Data Center. ج. 729: 3–128. Bibcode:2003NuPhA.729....3A. DOI:10.1016/j.nuclphysa.2003.11.001.
- ^ Cameron، A. G. W. (1973). "Abundance of the Elements in the Solar System" (PDF). Space Science Reviews. ج. 15: 121–146. Bibcode:1973SSRv...15..121C. DOI:10.1007/BF00172440. مؤرشف من الأصل (PDF) في 2011-10-21.
- ^ "Interactive NMR Frequency Map". مؤرشف من الأصل في 2011-06-04. اطلع عليه بتاريخ 2009-05-05.
- ^ ا ب ج د Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Tin". Lehrbuch der Anorganischen Chemie (بالألمانية) (91–100 ed.). Walter de Gruyter. pp. 793–800. ISBN:3-11-007511-3.
- ^ Ink with tin nanoparticles could print future circuit boards, Physorg, April 12, 2011; Jo، Yun Hwan؛ Jung، Inyu؛ Choi، Chung Seok؛ Kim، Inyoung؛ Lee، Hyuck Mo (2011). "Synthesis and characterization of low temperature Sn nanoparticles for the fabrication of highly conductive ink". Nanotechnology. ج. 22 ع. 22: 225701. Bibcode:2011Nanot..22v5701J. DOI:10.1088/0957-4484/22/22/225701. PMID:21454937. نسخة محفوظة 23 ديسمبر 2011 على موقع واي باك مشين.
- ^ Molodets، A. M.؛ Nabatov, S. S. (2000). "Thermodynamic Potentials, Diagram of State, and Phase Transitions of Tin on Shock Compression". High Temperature. ج. 38 ع. 5: 715–721. DOI:10.1007/BF02755923.
- ^ Le Coureur، Penny؛ Burreson, Jay (2004). Napoleon's Buttons: 17 Molecules that Changed History. New York: Penguin Group USA., a persistent legend that probably has no background in real events. Öhrström، Lars (2013). The Last Alchemist in Paris. Oxford: Oxford University Press. ISBN:978-0-19-966109-1. Cotton، Simon (2014). "Book review: The last alchemist in Paris". Chemistry World.http://rsc.li/CW_140501 نسخة محفوظة 10 أغسطس 2014 على موقع واي باك مشين.
- ^ ا ب Schwartz، Mel (2002). "Tin and Alloys, Properties". Encyclopedia of Materials, Parts and Finishes (ط. 2nd). CRC Press. ISBN:1-56676-661-3.
- ^ Dehaas، W.؛ Deboer، J.؛ Vandenberg، G. (1935). "The electrical resistance of cadmium, thallium and tin at low temperatures". Physica. ج. 2: 453. Bibcode:1935Phy.....2..453D. DOI:10.1016/S0031-8914(35)90114-8.
- ^ Meissner، W.؛ R. Ochsenfeld (1933). "Ein neuer effekt bei eintritt der Supraleitfähigkeit". Naturwissenschaften. ج. 21 ع. 44: 787–788. Bibcode:1933NW.....21..787M. DOI:10.1007/BF01504252.
- ^ ا ب Craig، Bruce D.؛ Anderson، David S.؛ International، A. S. M. (يناير 1995). Handbook of corrosion data. ص. 126. ISBN:978-0-87170-518-1. مؤرشف من الأصل في 2016-05-11.
- ^ J. M. Leger؛ J. Haines؛ A. Atouf (1996). "The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl2". J. Phys. Chem. Solids. ج. 57 ع. 1: 7–16. Bibcode:1996JPCS...57....7L. DOI:10.1016/0022-3697(95)00060-7.
- ^ ا ب Holleman، Arnold Frederik؛ Wiberg، Egon (2001)، Wiberg، Nils (المحرر)، Inorganic Chemistry، ترجمة: Eagleson، Mary؛ Brewer، William، San Diego/Berlin: Academic Press/De Gruyter، ISBN:0-12-352651-5
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- ^ Inorganic & Theoretical chemistry, F. Sherwood Taylor, Heineman, 6th Edition (1942)
- ^ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. (ردمك 978-3-527-29390-2)
- ^ ا ب ج Graf, G. G. (2000) "Tin, Tin Alloys, and Tin Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH, Weinheim دُوِي:10.1002/14356007.a27_049
- ^ Sander H.L. Thoonen؛ Berth-Jan Deelman؛ Gerard van Koten (2004). "Synthetic aspects of tetraorganotins and organotin(IV) halides" (PDF). Journal of Organometallic Chemistry ع. 689: 2145–2157. مؤرشف من الأصل (PDF) في 2013-05-31.
- ^ Gaur، D. P.؛ Srivastava، G.؛ Mehrotra، R. C. (1973). "Organic Derivatives of Tin. III. Reactions of Trialkyltin Ethoxide with Alkanolamines". Zeitschrift für anorganische und allgemeine Chemie. ج. 398: 72. DOI:10.1002/zaac.19733980109.
- ^ Peng، Yang؛ Ellis، Bobby D.؛ Wang، Xinping؛ Fettinger، James C.؛ Power، P. P. (2009). "Reversible Reactions of Ethylene with Distannynes Under Ambient Conditions". Science. ج. 325 ع. 5948: 1668–1670. Bibcode:2009Sci...325.1668P. DOI:10.1126/science.1176443. PMID:19779193.
- ^ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ^ Gerhart Jander, Ewald Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 2006, ISBN 3-7776-1388-6, S. 499.
- ^ J. Heyrovský, J. Kůta: Grundlagen der Polarographie. Akademie-Verlag, Berlin 1965, S. 516.
- ^ K. Cammann (Hrsg.): Instrumentelle Analytische Chemie. Spektrum Akademischer Verlag, Heidelberg/ Berlin 2001, S. 4–47.(بالألمانية)
- ^ Black, Harvey (2005). "Getting the Lead Out of Electronics". Environmental Health Perspectives. ج. 113 ع. 10: A682–5. DOI:10.1289/ehp.113-a682. PMC:1281311. PMID:16203230.
- ^ Sawamura، Tadashi؛ Igarashi، Takeo (29 يونيو 2005). Alloy Comparison.pdf "Difference Between Various Sn/Ag/Cu Solder Compositions" (PDF). Almit Ltd. مؤرشف من الأصل (PDF) في 2020-06-28. اطلع عليه بتاريخ 2016-08-24.
{{استشهاد ويب}}: تحقق من قيمة|مسار أرشيف=(مساعدة) - ^ Control، Tin Under (1945). Tin Under Control. ص. 10–15. ISBN:978-0-8047-2136-3. مؤرشف من الأصل في 2020-02-17.
- ^ Panel On Tin, National Research Council (U.S.). Committee on Technical Aspects of Critical and Strategic Materials (1970). Trends in the use of tin. ص. 10–22. مؤرشف من الأصل في 2016-05-31.
- ^ Hull، Charles (1992). Pewter. Osprey Publishing. ص. 1–5. ISBN:978-0-7478-0152-8. مؤرشف من الأصل في 5 أبريل 2020. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Brakes, James (2009). "Introduction". Analysis of Babbit. BiblioBazaar, LLC. ص. 1–2. ISBN:978-1-110-11092-6. مؤرشف من الأصل في 2020-03-15.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Williams, Robert S. (2007). Principles of Metallography. Read books. ص. 46–47. ISBN:978-1-4067-4671-6. مؤرشف من الأصل في 2020-03-13.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Loo R, Vincent B, Gencarelli F, Merckling C, Kumar A, Eneman G, Witters L, Vandervorst W, Caymax M, Heyns M and Thean A 2013 Ge1-xSnx Materials: Challenges and Applications ECS J. Solid State Sci. Technol. 2 N35–40
- ^ Vincent B, Shimura Y, Takeuchi S, Nishimura T, Eneman G, Firrincieli a., Demeulemeester J, Vantomme a., Clarysse T, Nakatsuka O, Zaima S, Dekoster J, Caymax M and Loo R 2011 Characterization of GeSn materials for future Ge pMOSFETs source/drain stressors Microelectron. Eng. 88 342–6
- ^ Gallagher J D, Senaratne C L, Kouvetakis J and Menéndez J 2014 Compositional dependence of the bowing parameter for the direct and indirect band gaps in Ge1−ySny alloys Appl. Phys. Lett. 105 142102
- ^ Scientists construct the first germanium-tin semiconductor laser for silicon chips: http://phys.org/news/2015-01-scientists-germanium-tin-semiconductor-laser-silicon.html نسخة محفوظة 2017-08-14 على موقع واي باك مشين.
- ^
Gallagher J D, Senaratne C L, Sims P, Aoki T, Menéndez J and Kouvetakis (2015). "Electroluminescence from GeSn heterostructure pin diodes at the indirect to direct transition". Appl. Phys. Lett. ج. 106 ع. 9. DOI:10.1063/1.4913688.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^
C. L. Senaratne, P. M. Wallace, J. D. Gallagher, P. E. Sims, John Kouvetakis, Jose Menendez (2016). "Direct gap Ge1-ySny alloys: Fabrication and design of mid-IR photodiodes". Journal of Applied Physics. ج. 120 ع. 2. DOI:10.1063/1.4956439.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Jensen، Rasmus V S؛ Pedersen, Thomas G؛ Larsen, Arne N (31 أغسطس 2011). "Quasiparticle electronic and optical properties of the Si–Sn system". Journal of Physics: Condensed Matter. ج. 23 ع. 34: 345501. DOI:10.1088/0953-8984/23/34/345501.
- ^ Matthias، B. T.؛ Geballe, T. H.؛ Geller, S.؛ Corenzwit, E. (1954). "Superconductivity of Nb3Sn". Physical Review. ج. 95 ع. 6: 1435–1435. DOI:10.1103/PhysRev.95.1435.
- ^ "The Composition of the Cent". US Mint. مؤرشف من الأصل في 2016-06-08. اطلع عليه بتاريخ 2011-10-28.
- ^ "Composition of canadian coins" (PDF). Canadian Mint. مؤرشف من الأصل (PDF) في 2019-05-14. اطلع عليه بتاريخ 2011-10-28.
- ^ Campbell، Flake C. (2008). "Zirconium". Elements of Metallurgy and Engineering Alloys. ص. 597. ISBN:978-0-87170-867-0. مؤرشف من الأصل في 2016-05-30.
- ^ Robert Palmieri، المحرر (2006). "Pipe Metal". Encyclopedia of keyboard instruments. New York: Garland. ص. 411. ISBN:978-0-415-94174-7. مؤرشف من الأصل في 2020-03-08.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ George Ashdown Audsley (1988). "Metal Pipes: And the Materials used in their Construction". The Art of Organ Building Audsley, George Ashdown. Courier Dover Publications. ص. 501. ISBN:978-0-486-21315-6. مؤرشف من الأصل في 2020-03-08.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Bridge، Janet (سبتمبر 1996). Making & decorating picture frames. ISBN:978-0-89134-739-2. مؤرشف من الأصل في 2016-05-31.
- ^ Pilkington، L. A. B. (1969). "Review Lecture. The Float Glass Process". Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. ج. 314 ع. 1516: 1–25. Bibcode:1969RSPSA.314....1P. DOI:10.1098/rspa.1969.0212. JSTOR:2416528.
- ^ Lucas، Ivan T.؛ Syzdek، Jarosław؛ Kostecki، Robert (2011). "Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes". Electrochemistry Communications. ج. 13 ع. 11: 1271–1275. DOI:10.1016/j.elecom.2011.08.026.
- ^ Perlich، M. A.؛ Bacca، L. A.؛ Bollmer، B. W.؛ Lanzalaco، A. C.؛ McClanahan، S. F.؛ Sewak، L. K.؛ Beiswanger، B. B.؛ Eichold، W. A.؛ Hull، J. R.؛ وآخرون (1995). "The clinical effect of a stabilized stannous fluoride dentifrice on plaque formation, gingivitis and gingival bleeding: a six-month study". The Journal of Clinical Dentistry. ج. 6 ع. Special Issue: 54–58. PMID:8593194.
- ^ Ebdon، L.؛ Britain)، Royal Society of Chemistry (Great (2001). "Organotin in Industrial and Domestic Products". Trace element speciation for environment, food and health. ص. 144. ISBN:978-0-85404-459-7. مؤرشف من الأصل في 2020-02-17.
- ^ ا ب ج Atkins, Peter؛ Shriver, Duward F.؛ Overton, Tina؛ Rourke, Jonathan (2006). Inorganic chemistry (ط. 4th). W.H. Freeman. ص. 343, 345. ISBN:0-7167-4878-9.
{{استشهاد بكتاب}}: الوسيط غير المعروف|last-author-amp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)صيانة الاستشهاد: التاريخ والسنة (link) - ^ David N.-S. Hon؛ Nobuo Shiraishi، المحررون (2001). "Preservation of Wood". Wood and cellulosic chemistry. New York, NY: Dekker. ص. 799. ISBN:978-0-8247-0024-9. مؤرشف من الأصل في 2020-03-10.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Eisler، Ronald. "Tin Hazards To Fish, Wildlife, and Invertebrates: A Synoptic Review" (PDF). U.S. Fish and Wildlife Service Patuxent Wildlife Research Center. مؤرشف من الأصل (PDF) في 2012-10-07.
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Tin". www.cdc.gov. مؤرشف من الأصل في 2019-05-02. اطلع عليه بتاريخ 2015-11-24.
وصلات خارجية
[عدل]| قصدير في المشاريع الشقيقة: | |
| |
- القصدير في الجدول الدوري للفيديوهات (جامعة نوتينغهام) (بالإنجليزية)
- الجدول الخشبي للجدول الدوري لتيودور غراي: عينات قصديرية (بالإنجليزية)
- المعادن القاعدية: القصدير (بالإنجليزية)
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||



