أكسيد الروثينيوم الرباعي
| أكسيد الروثينيوم الرباعي[1] | |
|---|---|
| الاسم النظامي (IUPAC) | |
أكسيد الروثينيوم الرباعي |
|
| أسماء أخرى | |
ثنائي أكسيد الروثينيوم |
|
| المعرفات | |
| رقم CAS | 12036-10-1 |
| بوب كيم | 82848 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | RuO2 |
| الكتلة المولية | 133.07 غ/مول |
| المظهر | صلب أسود |
| الكثافة | 6.97 غ/سم3 |
| نقطة الانصهار | 1200 °س يتسامى |
| الذوبانية في الماء | غير منحل |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
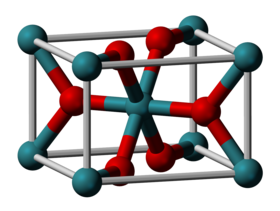
أكسيد الروثينيوم الرباعي أو ثنائي أكسيد الروثينيوم مركب كيميائي له الصيغة RuO2 ويكون على شكل بلورات سوداء. وهو أحد أكاسيد الروثينيوم. يمكن أن يوجد المركب على شكل هيدرات زرقاء اللون.
الخصائص[عدل]
- لا ينحل أكسيد الروثينيوم في الماء، وهو يتفاعل مع الكحولات.[1]
- يكون لأكسيد الروثينيوم الرباعي بنية بلورية تشابه بنية الروتيل.[3][4]
التحضير[عدل]
يمكن لأكسيد الروثينيوم الرباعي أن يحضّر بعدة طرق من بينها إجراء ترسيب كيميائي للبخار وذلك من مركبات روثينيوم متطايرة مناسبة.[5] أو بالتحلل الحراري لهاليدات الروثينيوم مثل كلوريد الروثينيوم الثلاثي على ركازة ساخنة بوجود الأكسجين.[6]
يمكن استخدام الطلي الكهربائي لتحضير RuO2 وذلك بإجراء العملية على محاليل لكلوريد الروثينيوم الثلاثي وباستخدام البلاتين كمسرى مقابل وAg/AgCl كمسرى مرجعي.[7]
الاستخدامات[عدل]
- يستخدم أكسيد الروثينيوم الرباعي في تغطية مساري التيتانيوم المستخدمة لإنتاج الكلور بالتحليل الكهربائي، كما يستخدم في تحضير المقاومات والدارات المتكاملة.[8][9]
- يمكن استخدام أكسيد الروثينيوم الرباعي كحفّاز في طريقة فيشر-تروبش، إلا أن الأكسيد يجب أن يكون حاوياً على نسبة من الهيدرات (جزيئات ماء في بنيته البلورية) ولكن ليس بشكل كامل.[10]
المراجع[عدل]
- ^ أ ب صفحة بيانات السلامة الكيميائية من Alfa [وصلة مكسورة] نسخة محفوظة 26 يناير 2020 على موقع واي باك مشين.
- ^ أ ب ت Ruthenium dioxide (بالإنجليزية), QID:Q278487
- ^ Wyckoff, R.W.G.. Crystal Structures, Vol. 1. Interscience, John Wiley & Sons: 1963.
- ^ Wells, A.F. (1975), Structural Inorganic Chemistry (4th ed.), Oxford: Clarendon Press
- ^ Pizzini, S.; Buzzancae, g.; Mat. Res. Bull., 1972, 7, 449-462.
- ^ Schafer, H., Z.an.allg. Chem. 1963, 319, 327
- ^ Leea, Se-Hee; Liu, Ping.; Solid State Ionics 2003, 165, 217-221.
- ^ De Nora,O.; Chem. Eng. Techn., 1970, 42, 222.
- ^ Iles, G.S.; Platinum Met. Rev., 1967,11,126.
- ^ Mills, A.; Davies, H.; Inorganica. Chimica. Acta., 1991, 189, 149-155
| في كومنز صور وملفات عن: أكسيد الروثينيوم الرباعي |