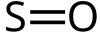أحادي أكسيد الكبريت
| أحادي أكسيد الكبريت | |
|---|---|
 |
|
| تسمية الاتحاد الدولي للكيمياء | |
Oxidosulfur[1] |
|
| أسماء أخرى | |
Sulfur monoxide |
|
| المعرفات | |
| CAS | 13827-32-2 |
| بوب كيم | 114845 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | SO |
| الكتلة المولية | 48.06 غ/مول |
| المظهر | غاز عديم اللون |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
أحادي أكسيد الكبريت هو مركب كيميائي لاعضوي يتألف من عنصري الكبريت والأكسجين، صيغته SO، وهو من أكاسيد الكبريت ويوجد على شكل غاز عديم اللون.
الوفرة والتحضير[عدل]
يوجد غاز أحادي أكسيد الكبريت في الكون في الوسط بين النجمي؛[4] كما يوجد في الغلاف الجوي لقمر آيو لكوكب المشتري.[5]
يمكن أن يحضر المركب ضمن شروط مخبرية خاصة، وذلك إما بتفاعل الكبريت مع ثنائي أكسيد الكبريت في وسط معزول وبوجود تفريغ كهربائي:
أو بأكسدة الكبريت بالأكسجين النقي تحت الفراغ.[6]
الخواص[عدل]
يوجد المركب في الشروط القياسية على شكل غاز عديم اللون. وهو غير مستقر إلا في الحالة الغازية الممددة، إذ يتحول عند ارتفاع التركيز إلى ثنائي أكسيد ثنائي الكبريت S2O2.
لجزيء SO حالة قاعية ثلاثية القمم بشكل مشابه لجزيء الأكسجين O2، أي أن كل جزيء له زوجين غير رابطين من الإلكترونات.[7] يبلغ طول الرابطة S−O مقدار 148.1 بيكومتر، وهو مشابه لما هو في أكاسيد الكبريت التحتية (تحت أكاسيد الكبريت مثل S8O)؛ ولكنها أطول من الرابطة S−O في أحادي أكسيد ثنائي الكبريت S2O وثنائي أكسيد الكبريت SO2 و ثلاثي أكسيد الكبريت SO3.[7]
يثار الجزيء بالإشعاع تحت الأحمر القريب إلى الحالة المفردة الأكثر نشاطاً كما هو الحال مع الأكسجين.[8]
طالع أيضاً[عدل]
مراجع[عدل]
- ^ "sulfur monoxide (CHEBI:45822)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. مؤرشف من الأصل في 2019-07-09.
- ^ أ ب ت Sulfur oxide (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Observations of interstellar sulfur monoxide Gottlieb, C. A.; Gottlieb,E.W.; Litvak,M.M.; Ball,J.A.; Pennfield,H. Astrophysical Journal, 1, 219, (1978),77-94 دُوِي:10.1086/155757
- ^ Io’s atmosphere: Not yet understood Lellouch, E. 1996. Icarus 124, 1–21
- ^ Egon Wiberg: Lehrbuch der Anorganischen Chemie: Mit einem Anhang: Chemiegeschichte. Walter de Gruyter, 1960, ISBN 3-11-023832-2, S. 201
- ^ أ ب Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- ^ Near-Infrared-Light-Induced Reaction of Singlet SO with Allene and Dimethylacetylene in a Rare Gas Matrix. Infrared Spectra of Two Novel Episulfoxides Salama F; Frei H J. Phys. Chem. 1989, 93, 1285-1292
| أحادي أكسيد الكبريت في المشاريع الشقيقة: | |
| |