خلية تائية
| خلية تائية | |
|---|---|
| الاسم العلمي lymphocytus T |
|
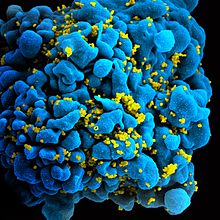
خلية تائية بشرية كما تظهر في المجهر الإلكتروني
| |
 صورة بالمجهر الإلكتروني تظهر خلية لمفية تائية (يمين)، صفيحة دموية (وسط) وخلية الدم الحمراء (يسار)
| |
| تفاصيل | |
| نظام أحيائي | الجهاز المناعي |
| نوع من | خلية لمفاوية[1] |
| جزء من | جهاز مناعي |
| ترمينولوجيا هستولوجيكا | H2.00.04.1.02007 |
| FMA | 62870[2] |
| ن.ف.م.ط. | A11.118.637.555.567.569، وA15.145.229.637.555.567.569، وA15.382.490.555.567.569 |
| ن.ف.م.ط. | D013601 |
| تعديل مصدري - تعديل | |
الخلايا التائية[3] (بالإنجليزية: T cell) تشكل مجموعة من الخلايا اللمفاوية الموجودة بالدم وهي تلعب دوراً أساسياً في المناعة الخلوية (بالإنجليزية: cell-mediated-Immunity). الخلايا التائية مع الخلايا البائية تشكلان معاً المناعة المكتسبة. وسميت بالتائية نسبة إلى مكان نضوجها في الغدة الزعترية (بالإنجليزية: Thymus) وينضج بعضها في اللوزتين بعد هجرتها من نخاع العظام.
وتتطور الخلية تي في الغدة الزعترية منتجة عدة أنواع من الخلايا التائية، وجميعها يعتبر من الخلايا اللمفاوية.
تنقسم الخلايا التائية إلى 6 أنواع:
- خلية تائية مساعدة
- خلية تائية قاتلة
- خلية تائية منظمة
- خلية تائية ذاكرة
- خلية تائية غاما دلتا
- خلية قاتلة طبيعية
التطور
[عدل]الأصل والتطور المبكر والهجرة إلى الغدة الزعترية
[عدل]تنشأ جميع الخلايا التائية من مجموعة c-kit + Sca1 + الخلايا الجذعية المكونة للدم (HSC) الموجودة في نخاع العظم. في بعض الحالات، قد يكون الأصل هو كبد الجنين أثناء التطور الجنيني.ثم يتمايز HSC إلى أسلاف متعددة القدرات (MPP) والتي تحتفظ بالقدرة على أن تصبح كلا من الخلايا النخاعية والليمفاوية.ثم تنتقل عملية التمايز إلى سلف ليمفاوي شائع (CLP)، والذي يمكن أن يتمايز فقط إلى خلايا T أو B أو NK.ثم تهاجر خلايا CLP هذه عبر الدم إلى الغدة الزعترية، حيث تتغذى. يُطلق على الخلايا الأقدم التي وصلت إلى الغدة الزعترية اسم سلبي مزدوج، لأنها لا تعبر عن مستقبلات CD4 ولا CD8.خلايا CLP التي وصلت حديثًا هي خلايا CD4 CD8 − CD44 + CD25 ckit + ، ويطلق عليها خلايا أسلاف الغدة الزعترية المبكرة (ETP)ستخضع هذه الخلايا بعد ذلك لجولة من الانقسام وتنظم مجموعة c-kit وتسمى خلايا DN1.[بحاجة لمصدر]
TCR-الإنتقاء بيتا
[عدل]في مرحلة (DN2 (CD44 + CD25 + ، تنظم الخلايا جينات إعادة التركيب RAG1 و RAG2 وتعيد ترتيب موضع TCRβ ، وتجمع بين V-D-J وجينات المنطقة الثابتة في محاولة لإنشاء سلسلة TCR T وظيفية.مع تقدم الخلية الزعترية النامية إلى مرحلة (DN3 (CD44-CD25 + ، تعبر الخلية التائية عن سلسلة α ثابتة تسمى pre-Tα جنبًا إلى جنب مع جين TCRβ.إذا تم إعادة ترتيب أزواج سلسلة β بنجاح مع سلسلة α الثابتة، يتم إنتاج إشارات توقف إعادة ترتيب السلسلة (وتسكِت الأليل البديل).على الرغم من أن هذه الإشارات تتطلب هذا pre-TCR على سطح الخلية، إلا أنها مستقلة عن ارتباط ligand بـ pre-TCR. إذا كانت أشكال ما قبل TCR ، فإن الخلية تنظم CD25 وتسمى خلية DN4 (CD25 CD44−ثم تخضع هذه الخلايا لجولة من الانتشار وتبدأ في إعادة ترتيب موضع TCRα.
(في الكيمياء، أي ذرة أو جزيء متصل بذرة مركزية، وعادة ما يكون عنصرًا معدنيًا، بتنسيق مركب معقد. : (ligand)
الإنتقاء الإيجابي
[عدل]تهاجر الخلايا التوتية الموجبة المزدوجة (CD4 + / CD8 +) إلى عمق قشرة الغدة الصعترية، حيث يتم تقديمها مع المستضدات الذاتية.يتم التعبير عن هذه المستضدات الذاتية بواسطة الخلايا الظهارية القشرية الصعترية على جزيئات معقد التوافق النسيجي الكبير على سطح الخلايا الظهارية القشرية.فقط تلك الخلايا التوتية التي تتفاعل مع MHC-I أو MHC-II ستتلقى «إشارة بقاء» حيوية. كل ما لا يستطيع (إذا لم يتفاعلوا بقوة كافية) سيموت «بالموت بالإهمال» (لا توجد إشارة للبقاء).تضمن هذه العملية أن الخلايا التائية المحددة سيكون لها تقارب معقد التوافق النسيجي الكبير يمكن أن يؤدي وظائف مفيدة في الجسم (أي يجب أن تكون الخلايا قادرة على التفاعل مع معقدات التوافق النسيجي الكبير والببتيد لإحداث استجابات مناعية). سوف تموت الغالبية العظمى من الخلايا التوتية النامية خلال هذه العملية.تستغرق عملية الاختيار الإيجابي عدة أيام.
يتم تحديد مصير الخلايا التوتية أثناء الاختيار الإيجابي.الخلايا الموجبة المزدوجة (CD4 + / CD8 +) التي تتفاعل بشكل جيد مع جزيئات معقد التوافق النسيجي الكبير من الدرجة الثانية ستصبح في النهاية خلايا CD4 + ، بينما تنضج الخلايا الزعترية التي تتفاعل جيدًا مع جزيئات معقد التوافق النسيجي الكبير من الدرجة الأولى إلى خلايا CD8 +.تصبح الخلية التائية خلية CD4 + عن طريق تنظيم التعبير عن مستقبلات سطح الخلية CD8. إذا لم تفقد الخلية إشاراتها، فسوف تستمر في تنظيم CD8 وتصبح CD4 + ، خلية واحدة إيجابية.
هذه العملية لا تزيل الخلايا التوتية التي قد تسبب المناعة الذاتية.تتم إزالة خلايا المناعة الذاتية المحتملة من خلال عملية الاختيار السلبي، والتي تحدث في لب الغدة الصعترية.
الإنتقاء السلبي
[عدل]يزيل الانتقاء السلبي الخلايا التوتية القادرة على الارتباط بقوة مع ببتيدات MHC «الذاتية».تهاجر الخلايا التوتية التي تنجو من الاختيار الإيجابي نحو حدود القشرة والنخاع في الغدة الصعترية.أثناء وجودهم في النخاع، يتم تقديمهم مرة أخرى مع مستضد ذاتي مقدم على مجمع MHC للخلايا الظهارية النخاعية الصعترية (mTECs).يجب أن تكون mTECs AIRE + للتعبير بشكل صحيح عن المستضدات الذاتية من جميع أنسجة الجسم على الببتيدات من الفئة الأولى من معقد التوافق النسيجي الكبير. يتم بلعمة بعض mTECs بواسطة الخلايا التغصنية الصعترية؛ يسمح هذا بعرض المستضدات الذاتية على جزيئات معقد التوافق النسيجي الكبير من الفئة الثانية (يجب أن تتفاعل خلايا CD4 + المختارة بشكل إيجابي مع جزيئات معقد التوافق النسيجي الكبير من الفئة الثانية، وبالتالي يجب أن تكون الخلايا APCs ، التي تمتلك معقد التوافق النسيجي الكبير من الدرجة الثانية، موجودة للاختيار السلبي لخلايا CD4 + T).تستقبل الخلايا التوتية التي تتفاعل بشدة مع المستضد الذاتي إشارة موت الخلايا المبرمج التي تؤدي إلى موت الخلية. ومع ذلك، يتم اختيار بعض هذه الخلايا لتصبح خلايا تائية منظمة. تخرج الخلايا المتبقية من الغدة الصعترية كخلايا تائية ناضجة ساذجة (تُعرف أيضًا باسم المغتربين الجدد).تعد هذه العملية مكونًا مهمًا للتسامح المركزي وتعمل على منع تكوين الخلايا التائية ذاتية التفاعل القادرة على إحداث أمراض المناعة الذاتية في المضيف.
الانتقاء-بيتا هو أول نقطة تفتيش، حيث يُسمح للخلايا التائية القادرة على تكوين ما قبل TCR وظيفي مع سلسلة ألفا غير متغيرة وسلسلة بيتا وظيفية بمواصلة التطور في الغدة الصعترية.بعد ذلك، يتحقق الاختيار الإيجابي من أن الخلايا التائية قد أعادت ترتيب موضعها TCRα بنجاح وقادرة على التعرف على مجمعات الببتيد- MHC بتقارب مناسب.يؤدي الانتقاء السلبي في النخاع إلى القضاء على الخلايا التائية التي ترتبط بشدة بالمستضدات الذاتية المعبر عنها في جزيئات معقد التوافق النسيجي الكبير.تسمح عمليات الاختيار هذه بجهاز المناعة على تحمل الذات.الخلايا التائية النموذجية التي تغادر الغدة الصعترية (عبر الوصلة القشرية النخاعية) مقيدة ذاتيًا، ومتحملة للذات، وإيجابية مفردة.
ناتج زعتري
[عدل]تموت حوالي 98٪ من الخلايا التوتية أثناء عمليات التطور في الغدة الصعترية بفشل الاختيار الإيجابي أو الاختيار السلبي، بينما تبقى 2٪ الأخرى على قيد الحياة وتترك الغدة الصعترية لتصبح خلايا تائية ذات كفاءة مناعية ناضجة.تساهم الغدة الصعترية في تقليل عدد الخلايا مع تقدم العمر.مع تقلص الغدة الصعترية بنحو 3٪ سنويًا خلال منتصف العمر، يحدث انخفاض مماثل في إنتاج الغدة الصعترية للخلايا التائية الساذجة، تاركًا توسع الخلايا التائية المحيطية وتجديدها يلعبان دورًا أكبر في حماية كبار السن.
أنواع الخلايا التائية
[عدل]يتم تجميع الخلايا التائية في سلسلة من المجموعات الفرعية بناءً على وظيفتها.يتم اختيار خلايا CD4 و CD8 التائية في الغدة الزعترية، ولكنها تخضع لمزيد من التمايز في المحيط للخلايا المتخصصة التي لها وظائف مختلفة.تم تحديد مجموعات الخلايا التائية الفرعية في البداية حسب الوظيفة، ولكن لها أيضًا أنماط التعبير الجيني أو البروتيني المرتبطة.
الخلايا التائية التكيفية التقليدية
[عدل]الخلايا التائية المساعدة (CD4+)
[عدل]تساعد الخلايا التائية المساعدة (خلايا TH) الخلايا الليمفاوية الأخرى، بما في ذلك نضوج الخلايا البائية إلى خلايا بلازمية وخلايا الذاكرة البائية، وتنشيط الخلايا التائية والضامة السامة للخلايا.تُعرف هذه الخلايا أيضًا باسم الخلايا التائية CD4 + لأنها تعبر عن CD4 على أسطحها.يتم تنشيط الخلايا التائية المساعدة عندما يتم تقديمها مع مستضدات الببتيد بواسطة جزيئات معقد التوافق النسيجي الكبير من الدرجة الثانية، والتي يتم التعبير عنها على سطح الخلايا العارضة للمستضد (APCs).بمجرد تنشيطها، تنقسم بسرعة وتفرز السيتوكينات التي تنظم الاستجابة المناعية أو تساعدها.يمكن أن تتمايز هذه الخلايا إلى نوع من عدة أنواع فرعية لها أدوار مختلفة.توجه السيتوكينات الخلايا التائية إلى أنواع فرعية معينة.
| دوره في المناعة الذاتية | دوره في الجهاز المناعي | عامل
النسخ الرئيسي |
إنتاج
السيتوكينات |
نوع
الخلية |
|---|---|---|---|---|
| MS، مرض السكري النوع 1 | تنتج استجابة التهابية، وهي مفتاح للدفاع ضد البكتيريا والفيروسات والسرطان داخل الخلايا. | Tbet | IFN-غاما | Th1 |
| الربو وامراض الحساسية الاخرى | يساعد على التمايز وإنتاج الأجسام المضادة بواسطة الخلايا البائية | GATA-3 | IL-4 | Th2 |
| التهاب المفاصل الروماتيدي، الصدفية،MS | الدفاع ضد مسببات الأمراض المعوية والحواجز المخاطية | γtRAR | IL-17 | Th17 |
| التصلب المتعدد | الدفاع ضد الديدان الطفيلية | IRF4, PU.1 | IL-9 | Th9 |
| الربو وأمراض الحساسية الأخرى | مساعدة الخلايا البائية على انتاج الاجسام المضادة | Bcl-6 | IL-21,IL-4 | Tfh |
خلايا تائية CD+8(خلايا تائية قاتلة)
[عدل]الخلايا التائية القاتلة، تدمر الخلايا المصابة بالفيروس والخلايا السرطانية، كما أنها متورطة في رفض الزرع.يتم التعرف على هذه الخلايا بالتعبير عن CD8 + على سطح الخلية.تتعرف هذه الخلايا على أهدافها من خلال الارتباط بالببتيدات القصيرة (8-11AA) المرتبطة بجزيئات معقد التوافق النسيجي الكبير من الدرجة الأولى، الموجودة على سطح جميع الخلايا المنواة.تنتج الخلايا التائية القاتلة أيضًا السيتوكينات الرئيسية IL-2 و IFNγ ، والتي تؤثر على وظائف المستجيب للخلايا الأخرى، ولا سيما الخلايا الضامة والخلايا الفاتكة الطبيعية.
خلية الذاكرة التائية
[عدل]تتضاعف الخلايا التائية الساذجة للمستضد وتتمايز في الذاكرة والخلايا التائية المستجيبة، بعد أن تصادف مستضدها المتعارف عليه في سياق جزيء معقد التوافق النسيجي الكبير على سطح خلية تقديم مستضد احترافية (مثل الخلية المتغصنة).يجب أن يكون التحفيز المشترك المناسب موجودًا في وقت مواجهة المستضد حتى تحدث هذه العملية.تاريخيًا، كان يُعتقد أن خلايا الذاكرة التائية تنتمي إما إلى المستجيب أو الأنواع الفرعية للذاكرة المركزية، ولكل منها مجموعتها المميزة من علامات سطح الخلية.بعد ذلك، تم اكتشاف مجموعات جديدة عديدة من خلايا الذاكرة التائية بما في ذلك خلايا الذاكرة التائية (Trm) المقيمة في الأنسجة وخلايا TSCM للذاكرة الجذعية وخلايا الذاكرة التائية الظاهرية.يتمثل الموضوع الموحد الوحيد لجميع الأنواع الفرعية لخلايا الذاكرة التائية في أنها طويلة العمر ويمكن أن تتضاعف بسرعة إلى أعداد كبيرة من الخلايا التائية المستجيبة عند إعادة التعرض لمستضدها المشابه.من خلال هذه الآلية، يزودون الجهاز المناعي بـ «الذاكرة» ضد مسببات الأمراض التي سبق مواجهتها.قد تكون خلايا الذاكرة التائية إما CD4 + أو CD8 + وعادة ما تعبر عن CD45RO.
الأنواع الفرعية لخلايا الذاكرة التائية:
- تعبر خلايا الذاكرة المركزية التائية (خلايا TCM) عن (CD45RO و (C-C مستقبل الكيموكين 7 (CCR7) و (L-selectin CD62L).تحتوي خلايا الذاكرة المركزية التائية أيضًا على تعبير متوسط إلى مرتفع عن CD44.يوجد هذا التجمع السكاني للذاكرة بشكل شائع في الغدد الليمفاوية وفي الدورة الدموية الطرفية.(ملاحظة- يستخدم تعبير CD44 عادةً لتمييز سذاجة الفئران عن خلايا الذاكرة التائية).
- تعبر خلايا ذاكرة المستجيبة التائية (خلايا TEM وخلايا TEMRA) عن CD45RO ولكنها تفتقر إلى التعبير عن CCR7 و L-selectin.(ملاحظة: جزيء سطح الخلية يشارك في الالتصاق المناعي وتهريب الخلايا. selectin: أي مجموعة من جزيئات سطح الخلية التي تؤثر على ارتباط وحركة خلايا الدم البيضاء بالخلايا الأخرى وبطانة الأوعية الدموية، على سبيل المثال، في الأمراض والظروف الالتهابية، selectin-P.لديهم أيضًا تعبير متوسط إلى مرتفع لـ CD44. تفتقر خلايا الذاكرة التائية هذه إلى مستقبلات توجيه العقد الليمفية وبالتالي توجد في الدورة الدموية والأنسجة المحيطية.يرمز TEMRA إلى خلايا الذاكرة المستجيبة المتمايزة نهائيًا التي تعيد التعبير عن CD45RA ، وهي علامة توجد عادةً في الخلايا التائية الساذجة.
- تحتل خلايا الذاكرة التائية المقيمة في الأنسجة (TRM) الأنسجة (الجلد والرئة، إلخ..) دون إعادة تدويرها.إحدى علامات سطح الخلية التي ارتبطت بـ TRM هي المتدرب αeβ7 ، والمعروف أيضًا باسم CD103.
- تختلف خلايا الذاكرة الظاهرية التائية عن مجموعات الذاكرة الفرعية الأخرى من حيث أنها لا تنشأ بعد حدث تضاعف نسيلي قوي.وبالتالي، على الرغم من أن هذه المجموعة ككل وفيرة في الدورة الدموية الطرفية، فإن استنساخ الخلايا التائية للذاكرة الظاهرية الفردية تتواجد عند ترددات منخفضة نسبيًا.تقول إحدى النظريات أن التكاثر الاستتبابي يؤدي إلى ظهور هذه الخلايا التائية. على الرغم من أن الخلايا التائية للذاكرة الظاهرية CD8 كانت أول من يتم وصفها، فمن المعروف الآن أن خلايا الذاكرة الظاهرية CD4 موجودة أيضًا.
الخلايا التائية المنظمة (CD4+ الخلايا التائية)
[عدل]تعتبر الخلايا التائية التنظيمية ضرورية للحفاظ على التحمل المناعي.ويتمثل دورهم الرئيسي في إيقاف المناعة التي تتوسطها الخلايا التائية في نهاية التفاعل المناعي وقمع الخلايا التائية النشطة التي أفلتت من عملية الانتقاء السلبي في الغدة الصعترية.
تم وصف الفئات الرئيسية للخلايا التائية التنظيمية CD4 + خلايا تائية تنظيمية FOXP3 +- وخلايا تائية تنظيمية FOXP3− .
يمكن أن تتطور الخلايا التائية التنظيمية إما أثناء التطور الطبيعي في الغدة الصعترية، ومن ثم تُعرف باسم الخلايا التائية التنظيمية الصعترية، أو يمكن تحفيزها المحيطي وتسمى الخلايا التائية التنظيمية المشتقة محيطيًا.كانت تسمى هاتان المجموعتان الفرعيتان سابقًا «تحدث بشكل طبيعي» و «تكيفية» أو «مستحثة» على التوالي.تتطلب كلتا المجموعتين الفرعيتين التعبير عن عامل النسخ FOXP3 والذي يمكن استخدامه لتحديد الخلايا. يمكن لطفرات جين FOXP3 أن تمنع التطور التنظيمي للخلايا التائية، مما يتسبب في مرض المناعة الذاتية القاتل IPEX.
العديد من الأنواع الأخرى من الخلايا التائية لها نشاط قمعي، لكنها لا تعبر عن FOXP3.وتشمل هذه الخلايا Tr1 وخلايا Th3 ، التي يعتقد أنها تنشأ أثناء الاستجابة المناعية وتعمل عن طريق إنتاج جزيئات قمعية.ترتبط خلايا Tr1 بـ IL-10 ، وترتبط خلايا Th3 بـ TGF-beta. في الآونة الأخيرة، تمت إضافة خلايا تائية تنظيمية 17 إلى هذه القائمة.
خلايا فطرية تشبه الخلايا التائية
[عدل]خلية فاتكة طبيعية [ انظر للمقالة الأصلية: خلية فاتكة طبيعية ]
[عدل]الخلايا التائية القاتلة الطبيعية (خلايا NKT - يجب عدم الخلط بينها وبين الخلايا القاتلة الطبيعية للجهاز المناعي الفطري) تربط نظام المناعة التكيفي بجهاز المناعة الفطري.على عكس الخلايا التائية التقليدية التي تتعرف على مستضدات الببتيد التي تقدمها جزيئات معقد التوافق النسيجي الكبير (MHC)، تتعرف خلايا NKT على مستضد الجليكوليبيد الذي يقدمه CD1d.بمجرد تنشيطها، يمكن لهذه الخلايا أداء وظائف تُنسب إلى كل من الخلايا Th و Tc (أي إنتاج السيتوكين وإطلاق جزيئات الخلايا الخلوية / قتل الخلايا).كما أنهم قادرون على التعرف على بعض الخلايا السرطانية والخلايا المصابة بفيروس الهربس والقضاء عليها.
خلايا الغشاء المخاطي المرتبطة الثابتة
[عدل]تعرض خلايا الخلايا التائية الثابتة (MAIT) المرتبطة بالغشاء المخاطي صفات فطرية تشبه المستجيبة.في البشر، توجد خلايا MAIT في الدم والكبد والرئتين والغشاء المخاطي للدفاع ضد النشاط الجرثومي والعدوى.البروتين الشبيه بالفئة الأولى من MHC ، MR1 ، مسؤول عن تقديم مستقلبات فيتامين B المنتجة بالبكتيريا إلى خلايا MAIT.يمكن أيضًا تنشيط خلايا MAIT من خلال إشارات MR1 المستقلة.بالإضافة إلى امتلاك وظائف شبيهة بالوظائف الفطرية، فإن هذه المجموعة الفرعية من الخلايا التائية تدعم الاستجابة المناعية التكيفية ولها نمط ظاهري يشبه الذاكرة.علاوة على ذلك، يُعتقد أن خلايا MAIT تلعب دورًا في أمراض المناعة الذاتية، مثل التصلب المتعدد والتهاب المفاصل ومرض التهاب الأمعاء، على الرغم من عدم نشر دليل قاطع بعد.
خلايا دلتا/غاما التائية
[عدل]تمثل خلايا جاما دلتا التائية (cells γδ T) مجموعة فرعية صغيرة من الخلايا التائية التي تمتلك γδ TCR بدلاً من αβ TCR على سطح الخلية.تعبر غالبية الخلايا التائية عن سلاسل αβ TCR. هذه المجموعة من الخلايا التائية أقل شيوعًا في البشر والفئران (حوالي 2٪ من إجمالي الخلايا التائية) وتوجد غالبًا في الغشاء المخاطي للأمعاء، ضمن مجموعة الخلايا الليمفاوية داخل الظهارة.في الأرانب والأغنام والدجاج، يمكن أن يصل عدد خلايا دلتا/غاما التائية إلى 60٪ من إجمالي الخلايا التائية.لا تزال جزيئات المستضد التي تنشط خلايا دلتا/غاما التائية مجهولة في الغالب.ومع ذلك، فإن خلايا دلتا/غاما التائية ليست مقيدة بـ MHC ويبدو أنها قادرة على التعرف على البروتينات الكاملة بدلاً من طلب الببتيدات لتقديمها بواسطة جزيئات معقد التوافق النسيجي الكبير على APCs.تتعرف بعض خلايا دلتا/غاما التائية للفئران على جزيئات معقد التوافق النسيجي الكبير من الفئة IB.تشكل خلايا دلتا/غاما التائية البشرية التي تستخدم شظايا الجين Vγ9 وVδ2 مجموعة خلايا دلتا/غاما التائية الرئيسية في الدم المحيطي، وهي فريدة من نوعها من حيث أنها تستجيب بشكل خاص وسريع لمجموعة من سلائف الأيزوبرينويد غير الببتيدية الفسفورية، والتي تسمى مجتمعة فوسفوانتيجينس، والتي يتم إنتاجها بواسطة تقريبا كل الخلايا الحية.أكثر أنواع مضادات الفوسفات شيوعًا من الخلايا الحيوانية والبشرية (بما في ذلك الخلايا السرطانية) هي بيروفوسفات إيزوبنتينيل (IPP) وأيزومير ثنائي ميثيل بيروفوسفات (DMPP).تنتج العديد من الميكروبات المركب النشط للغاية hydroxy-DMAPP (HMB-PP) وتقارن أحادي النوكليوتيد المقابل، بالإضافة إلى IPP و DMAPP.تنتج الخلايا النباتية كلا النوعين من مضادات الفسفور. تشتمل الأدوية التي تنشط الخلايا التائية البشرية Vγ9 / Vδ2 على مركبات الفسفون الاصطناعية وأمينوبيسفوسفونيت، والتي تنظم IPP / DMAPP الذاتية.
التنشيط
[عدل]
يحدث تنشيط خلايا CD4 + التائية من خلال المشاركة المتزامنة لمستقبل الخلايا التائية وجزيء التحفيز المشترك (مثل CD28 أو ICOS) على الخلية التائية بواسطة ببتيد معقد التوافق النسيجي الرئيسي (MHCII) وجزيئات التحفيز المشترك على APC .كلاهما مطلوب لإنتاج استجابة مناعية فعالة؛ في حالة عدم وجود التحفيز المشترك، تؤدي إشارات مستقبلات الخلايا التائية وحدها إلى الحساسية.عادةً ما تشغل مسارات الإشارات في اتجاه مجرى النهر من جزيئات التحفيز المشترك مسار PI3K الذي يولد PIP3 في غشاء البلازما وتجنيد مجال PH الذي يحتوي على جزيئات إشارات مثل PDK1 الضرورية لتفعيل PKC-θ ، وإنتاج IL-2 في نهاية المطاف.تعتمد الاستجابة المثلى لخلية CD8 + التائية على إشارات CD4 +.تعد خلايا CD4 + مفيدة في التنشيط الأولي للمستضد لخلايا CD8 التائية الساذجة، ودعم خلايا الذاكرة CD8 + التائية في أعقاب الإصابة الحادة.لذلك، يمكن أن يكون تنشيط خلايا CD4 + التائية مفيدًا لعمل خلايا CD8 + التائية.
يتم توفير الإشارة الأولى عن طريق ربط مستقبل الخلية التائية بالببتيد المتماثل المقدم على MHCII على APC.يقتصر MHCII على ما يسمى بالخلايا الاحترافية التي تقدم المستضد، مثل الخلايا التغصنية، والخلايا البائية، والخلايا البلعمية، على سبيل المثال لا الحصر.الببتيدات المقدمة لخلايا CD8 + التائية بواسطة جزيئات معقد التوافق النسيجي الكبير I هي 8-13 حمضًا أمينيًا في الطول. تكون الببتيدات المقدمة لخلايا CD4 + التائية بواسطة جزيئات MHC من الفئة الثانية أطول، وعادة ما يتراوح طولها بين 12 و 25 حمضًا أمينيًا، حيث تكون نهايات شق الربط لجزيء MHC من الفئة II مفتوحة.
تأتي الإشارة الثانية من التحفيز المشترك، حيث يتم تحفيز المستقبلات السطحية على APC بواسطة عدد صغير نسبيًا من المنبهات، عادة ما تكون نتاج مسببات الأمراض، ولكن في بعض الأحيان نواتج تكسير الخلايا، مثل الأجسام النخرية أو بروتينات الصدمة الحرارية.المستقبل التحفيزي المشترك الوحيد المعبر عنه بشكل أساسي بواسطة الخلايا التائية الساذجة هو CD28 ، لذا فإن التحفيز المشترك لهذه الخلايا يأتي من بروتينات CD80 و CD86 ، والتي تشكل معًا بروتين B7 ، (B7.1 و B7.2، على التوالي) على APC.يتم التعبير عن المستقبلات الأخرى عند تنشيط الخلية التائية، مثل OX40 و ICOS ، ولكنها تعتمد إلى حد كبير على CD28 للتعبير عنها. ترخص الإشارة الثانية الخلية التائية للاستجابة لمستضد.بدونها، تصبح الخلية التائية مفعمة بالطاقة، ويصبح تنشيطها أكثر صعوبة في المستقبل.تمنع هذه الآلية الاستجابات غير المناسبة للذات، حيث لا يتم عادةً تقديم الببتيدات الذاتية مع التحفيز المشترك المناسب.بمجرد تنشيط الخلية التائية بشكل مناسب (أي تلقت الإشارة الأولى والإشارة الثانية) فإنها تغير تعبير سطح الخلية لمجموعة متنوعة من البروتينات. تشمل علامات تنشيط الخلايا التائية CD69 و CD71 و CD25 (أيضًا علامة لخلايا Treg) و HLA-DR (علامة تنشيط الخلايا التائية البشرية).يتم أيضًا تنظيم تعبير CTLA-4 على الخلايا التائية المنشطة، والتي بدورها تتفوق على CD28 للارتباط ببروتينات B7. هذه آلية نقطة تفتيش لمنع التنشيط المفرط للخلية التائية.تقوم الخلايا التائية المنشطة أيضًا بتغيير ملف تعريف الارتباط بالجليكوزيل على سطح الخلية.
يوجد مستقبل الخلايا التائية كمركب من عدة بروتينات.يتكون مستقبل الخلايا التائية الفعلي من سلسلتي ببتيد منفصلين، يتم إنتاجهما من جينات مستقبلات الخلايا التائية المستقلة ألفا وبيتا (TCRα و TCRβ).البروتينات الأخرى في المركب هي بروتينات CD3: CD3εγ و CD3εδ heterodimers ، والأهم من ذلك، جهاز homodimer CD3ζ ، الذي يحتوي على ما مجموعه ستة أشكال ITAM.يمكن فسفرة أشكال ITAM الموجودة على CD3ζ بواسطة Lck وتجنيد ZAP-70 بدوره. يمكن لـ Lck و / أو ZAP-70 أيضًا فسفرة التيروزينات على العديد من الجزيئات الأخرى، ليس أقلها CD28 و LAT و SLP-76، مما يسمح بتجميع مجمعات الإشارة حول هذه البروتينات.
يقوم LAT (رابط لتفعيل الخلايا التائية) الفسفوري بتجنيد (ligand : تم ذكر معناها في فقرة الانتقاء بيتا) SLP-76 (البروتين الخلوي الليمفاوي 2) للغشاء، حيث يمكنه بعد ذلك إحضار PLC-γ (فوسفوينوتيداز فوسفوليباز سي) و VAV1 (بروتو اونكوجين vav) و Itk fv,jdk fv,jd (بروتين كيناز التيروزين) وربما PI3K . PLC-يشق PI (4,5) P2 على الدهون الثنائية للغشاء لإنشاء وسطاء نشطون لدياسيل غليسرول (DAG)، اينوسيتول-1,4,5-ثلاثي الفوسفات (IP3)؛ يعمل PI3K أيضًا على PIP2 ، فسفرته لإنتاج الفوسفاتيدلينوسيتول-3,4,5-ثلاثي الفوسفات (PIP3).تقوم DAG بربط وتنشيط بعض PKCs.الأهم في الخلايا التائية هو PKC-، وهو أمر مهم لتنشيط عوامل النسخ NF-κB و AP-1.يتم تحرير IP3 من الغشاء بواسطة PLC-وينتشر بسرعة لتنشيط مستقبلات قناة الكالسيوم على ER ، مما يؤدي إلى إطلاق الكالسيوم في العصارة الخلوية.يؤدي انخفاض الكالسيوم في الشبكة الإندوبلازمية إلى تجمع STIM1 على غشاء ER ويؤدي إلى تنشيط قنوات CRAC لغشاء الخلية التي تسمح بتدفق الكالسيوم الإضافي إلى العصارة الخلوية من الفضاء خارج الخلية. هذا الكالسيوم المتجمع العصاري الخلوي يربط الكالودولين، والذي يمكنه بعد ذلك تنشيط الكالسينيورين.يقوم كالسيونيورن بدوره بتنشيط NFAT ، والذي ينتقل بعد ذلك إلى النواة.NFAT هو عامل نسخ ينشط نسخ مجموعة من الجينات متعددة الاتجاهات، أبرزها IL-2، وهو سيتوكين يعزز التكاثر طويل الأمد للخلايا التائية المنشطة.يمكن لـ PLC-غاما أيضًا بدء مسار NF- B.تقوم DAG بتنشيط PKC-θ، الذي يؤدي بعد ذلك إلى فسفرة CARMA1 ، مما يجعله ينفتح ويعمل كسقالة.تربط مجالات العصارة الخلوية محول BCL10 عبر نطاقات CARD (تنشيط Caspase ومجالات التوظيف)؛ ثم يربط TRAF6 ، الموجود في كل مكان في K63.هذا الشكل من التواجد في كل مكان لا يؤدي إلى تدهور البروتينات المستهدفة. بدلاً من ذلك، يعمل على تجنيد NEMO و IKKα و-و TAB1-2 / TAK1.TAK 1 فسفوريلات IKK-β ، والتي تفسفر بعد ذلك IκB مما يسمح بتواجد K48 في كل مكان: يؤدي إلى تدهور البروتوزوم.يمكن بعد ذلك إدخال Rel A و p50 إلى النواة وربط عنصر استجابة NF-B. يسمح هذا إلى جانب إشارات NFAT بالتفعيل الكامل لجين IL-2.
بينما يعتمد التنشيط في معظم الحالات على التعرف على TCR للمستضد، فقد تم وصف مسارات بديلة للتنشيط.على سبيل المثال، تم إثبات تنشيط الخلايا التائية القاتلة عند استهدافها بواسطة خلايا CD8 T أخرى مما يؤدي إلى تحمل الأخير.
في ربيع عام 2014، تم إطلاق تجربة تنشيط الخلايا التائية في الفضاء (TCAS) إلى محطة الفضاء الدولية في مهمة SpaceX CRS-3 لدراسة كيفية «تأثر أوجه القصور في جهاز المناعة البشري ببيئة الجاذبية الصغرى».
يتم تعديل تنشيط الخلايا التائية بواسطة أنواع الأكسجين التفاعلية.
تمييز المستضد
[عدل]الميزة الفريدة للخلايا التائية هي قدرتها على التمييز بين الخلايا السليمة وغير الطبيعية (مثل الخلايا المصابة أو السرطانية) في الجسم.تعبر الخلايا السليمة عادةً عن عدد كبير من pMHC المشتق ذاتيًا على سطح الخلية وعلى الرغم من أن مستقبلات مستضد الخلايا التائية يمكن أن تتفاعل مع مجموعة فرعية على الأقل من هذه الخلايا السليمة، فإن الخلية التائية تتجاهل عمومًا هذه الخلايا السليمة.ومع ذلك، عندما تحتوي هذه الخلايا نفسها على كميات صغيرة من pMHC المشتق من العوامل الممرضة، فإن الخلايا التائية تكون قادرة على التنشيط وبدء الاستجابات المناعية.تُعرف قدرة الخلايا التائية على تجاهل الخلايا السليمة ولكنها تستجيب عندما تحتوي هذه الخلايا نفسها على عامل ممرض (أو سرطان) مشتق من pMHC بتمييز المستضد.الآليات الجزيئية التي تكمن وراء هذه العملية مثيرة للجدل.
الأهمية السريرية
[عدل]الخلل
[عدل]تشمل أسباب نقص الخلايا التائية قلة اللمفاويات في الخلايا التائية و / أو عيوبًا في وظيفة الخلايا التائية الفردية.يمكن أن ينتج القصور الكامل في وظيفة الخلايا التائية عن حالات وراثية مثل نقص المناعة المشترك الشديد (SCID) ومتلازمة أومين ونقص تنسج الغضروف والشعر.تشمل أسباب القصور الجزئي لوظيفة الخلايا التائية متلازمة نقص المناعة المكتسب (الإيدز)، والحالات الوراثية مثل متلازمة دي جورج (DGS)، ومتلازمات كسر الكروموسومات (CBSs)، واضطرابات الخلية البائية والخلايا التائية مثل ترنح وتوسع الشعيرات (AT).) ومتلازمة ويسكوت ألدريتش (WAS).
مسببات الأمراض الرئيسية التي تثير القلق في حالات نقص الخلايا التائية هي مسببات الأمراض داخل الخلايا، بما في ذلك فيروس الهربس البسيط والمتفطرة والليستيريا.أيضًا، العدوى الفطرية أكثر شيوعًا وشدة في نقص الخلايا التائية.
السرطان
[عدل]- يُطلق على سرطان الخلايا التائية سرطان الغدد الليمفاوية للخلايا التائية، وربما يمثل حالة واحدة من كل عشر حالات من سرطان الغدد الليمفاوية غير هودجكين.الأشكال الرئيسية لمفومة الخلايا التائية هي:
- سرطان الغدد الليمفاوية للخلايا التائية
- الأورام اللمفاوية للخلايا التائية الجلدية: متلازمة سيزاري والفطر الفطري
- سرطان الغدد الليمفاوية ذو الخلايا الكبيرة الكشمي
- سرطان الغدد الليمفاوية الخلايا التائية المناعية الوعائية
الإنهاك
[عدل]استنفاد الخلايا التائية هو حالة من خلل الخلايا التائية.يتميز بالفقدان التدريجي للوظيفة، والتغيرات في ملامح النسخ والتعبير المستمر عن المستقبلات المثبطة.في البداية، تفقد الخلايا قدرتها على إنتاج IL-2 و TNFα متبوعًا بفقدان القدرة التكاثرية العالية والقدرة على قتل الخلايا المصابة ، مما يؤدي في النهاية إلى حذفها. تشير الخلايا التائية المنهكة عادةً إلى مستويات أعلى من CD43 و CD69 والمستقبلات المثبطة جنبًا إلى جنب مع تعبير أقل عن CD62L و CD127.يمكن أن يتطور الإرهاق أثناء العدوى المزمنة والإنتان والسرطان.تحافظ الخلايا التائية المنهكة على استنفادها الوظيفي حتى بعد التعرض المتكرر للمستضد.
أثناء العدوى المزمنة والإنتان
[عدل]يمكن أن يحدث استنفاد الخلايا التائية من خلال عدة عوامل مثل التعرض المستمر للمستضد ونقص مساعدة خلايا CD4 التائية.يؤثر التعرض للمستضد أيضًا على مسار الإرهاق لأن وقت التعرض الأطول والحمل الفيروسي العالي يزيدان من شدة استنفاد الخلايا التائية.يجب التعرض لمدة 2-4 أسابيع على الأقل لإثبات الإرهاق.عامل آخر قادر على إحداث الإرهاق هو المستقبلات المثبطة بما في ذلك بروتين موت الخلية المبرمج 1 (PD1) و CTLA-4 وبروتين غشاء الخلية التائية 3 (TIM3) وبروتين الجين التنشيط اللمفاوي 3 (LAG3).الجزيئات القابلة للذوبان مثل السيتوكينات IL-10 أو TGF-قادرة أيضًا على إثارة الإرهاق.آخر العوامل المعروفة التي يمكن أن تلعب دورًا في استنفاد الخلايا التائية هي الخلايا التنظيمية.يمكن أن تكون الخلايا التائية التنظيمية مصدرًا لـ IL-10 و TGF-β وبالتالي يمكنها أن تلعب دورًا في استنفاد الخلايا التائية.علاوة على ذلك ، يتم عكس استنفاد الخلايا التائية بعد استنفاد الخلايا التائية التنظيمية والحصار المفروض على PD1.يمكن أن يحدث استنفاد الخلايا التائية أيضًا أثناء تعفن الدم نتيجة لعاصفة السيتوكين.في وقت لاحق بعد مواجهة الإنتانية الأولية ، تتولى السيتوكينات المضادة للالتهابات والبروتينات المؤيدة للاستماتة حماية الجسم من التلف.كما يحمل الإنتان حمولة عالية من المستضدات والالتهابات. في هذه المرحلة من الإنتان يزداد استنفاد الخلايا التائية.توجد حاليًا دراسات تهدف إلى الاستفادة من حاصرات المستقبلات المثبطة في علاج الإنتان.
أثناء الزرع
[عدل]بينما أثناء العدوى يمكن أن يتطور استنفاد الخلايا التائية بعد التعرض المستمر للمستضد بعد زرع عضو غير قريب لجينوم الجسم ، تنشأ حالة مماثلة مع وجود المستضد الخيفي.تبين أن استجابة الخلايا التائية تتضاءل بمرور الوقت بعد زرع الكلى.تشير هذه البيانات إلى أن استنفاد الخلايا التائية يلعب دورًا مهمًا في تحمل زرع عضو غير قريب لجينوم الجسم بشكل رئيسي عن طريق استنفاد الخلايا التائية CD8 .أظهرت العديد من الدراسات تأثيرًا إيجابيًا للعدوى المزمنة على قبول زرع عضو غير قريب لجينوم الجسم وبقائها على المدى الطويل بسبب استنفاد الخلايا التائية جزئيًا.وقد تبين أيضًا أن استنفاد الخلايا التائية المستقبلة يوفر شروطًا كافية لنقل الخلايا الفاتكة الطبيعية.في حين أن هناك بيانات تظهر أن تحريض استنفاد الخلايا التائية يمكن أن يكون مفيدًا لعملية الزرع ، إلا أنه يحمل أيضًا عيوبًا من بينها زيادة عدد الإصابات وخطر تطور الورم.
أثناء السرطان
[عدل]أثناء السرطان يلعب استنفاد الخلايا التائية دورًا في حماية الورم.وفقًا للأبحاث، يمكن لبعض الخلايا المرتبطة بالسرطان وكذلك الخلايا السرطانية نفسها أن تحفز بنشاط استنفاد الخلايا التائية في موقع الورم.يمكن أن يلعب استنفاد الخلايا التائية أيضًا دورًا في انتكاسات السرطان كما هو موضح في سرطان الدم.اقترحت بعض الدراسات أنه من الممكن التنبؤ بانتكاس اللوكيميا بناءً على التعبير عن المستقبلات المثبطة PD-1 و TIM-3 بواسطة الخلايا التائية.في السنوات الأخيرة ، كان هناك الكثير من التجارب والتجارب السريرية مع حاصرات نقاط التفتيش المناعية في علاج السرطان. تمت الموافقة على بعضها كعلاجات صالحة وتستخدم الآن في العيادات.تعد المستقبلات المثبطة التي تستهدفها تلك الإجراءات الطبية أمرًا حيويًا في استنفاد الخلايا التائية ويمكن أن يؤدي منعها إلى عكس هذه التغييرات.
تعد المستقبلات المثبطة التي تستهدفها تلك الإجراءات الطبية أمرًا حيويًا في استنفاد الخلايا التائية ويمكن أن يؤدي منعها إلى عكس هذه التغييرات.
في حين أن هناك بيانات تظهر أن تحريض استنفاد الخلايا التائية يمكن أن يكون مفيدًا لعملية الزرع ، إلا أنه يحمل أيضًا عيوبًا من بينها زيادة عدد الإصابات وخطر تطور الورم.
أظهرت العديد من الدراسات تأثيرًا إيجابيًا للعدوى المزمنة على قبول الكسب غير المشروع وبقائها على المدى الطويل بسبب استنفاد الخلايا التائية جزئيًا.
يمكن أن تكون الخلايا Treg مصدرًا لـ IL-10 و TGF-β وبالتالي يمكنها أن تلعب دورًا في استنفاد الخلايا التائية.
يمكن أن تكون الخلايا Treg مصدرًا لـ IL-10 و TGF-β وبالتالي يمكنها أن تلعب دورًا في استنفاد الخلايا التائية.
أثناء العدوى المزمنة والإنتان الأشكال الرئيسية لمفومة الخلايا التائية هي:
الأشكال الرئيسية لمفومة الخلايا التائية هي:
يمكن أن ينتج القصور الكامل في وظيفة الخلايا التائية عن حالات وراثية مثل نقص المناعة المشترك الشديد (SCID) ومتلازمة أومين ونقص تنسج الغضروف والشعر
ومع ذلك ، عندما تحتوي هذه الخلايا نفسها على كميات صغيرة من pMHC المشتق من العوامل الممرضة ، فإن الخلايا التائية تكون قادرة على التنشيط وبدء الاستجابات المناعية.
تعبر الخلايا السليمة عادةً عن عدد كبير من pMHC المشتق ذاتيًا على سطح الخلية وعلى الرغم من أن مستقبلات مستضد الخلايا التائية يمكن أن تتفاعل مع مجموعة فرعية على الأقل من هذه الخلايا السليمة ، فإن الخلية التائية تتجاهل عمومًا هذه الخلايا السليمة.
على سبيل المثال ، تم إثبات تنشيط الخلايا التائية السامة للخلايا عند استهدافها بواسطة خلايا CD8 T أخرى مما يؤدي إلى تحمل الأخير.
يتم تحرير IP3 من الغشاء بواسطة PLC-وينتشر بسرعة لتنشيط مستقبلات قناة الكالسيوم على ER ، مما يؤدي إلى إطلاق الكالسيوم في العصارة الخلوية.
البروتينات الأخرى في المركب هي بروتينات CD3: CD3εγ و CD3εδ heterodimers ، والأهم من ذلك ، جهاز homodimer CD3ζ ، الذي يحتوي على ما مجموعه ستة أشكال ITAM.
بدونها ، تصبح الخلية التائية مفعمة بالطاقة ، ويصبح تنشيطها أكثر صعوبة في المستقبل.
يقتصر MHCII على ما يسمى بالخلايا الاحترافية التي تقدم المستضد ، مثل الخلايا التغصنية ، والخلايا البائية ، والضامة ، على سبيل المثال لا الحصر.
عادةً ما تشغل مسارات الإشارات في اتجاه مجرى النهر من جزيئات التحفيز المشترك مسار PI3K الذي يولد PIP3 في غشاء البلازما وتجنيد مجال PH الذي يحتوي على جزيئات إشارات مثل PDK1 الضرورية لتفعيل PKC-θ ، وإنتاج IL-2 في نهاية المطاف.
تتعرف بعض خلايا الفئران التائية على جزيئات معقد التوافق النسيجي الكبير من الفئة IB.
تعبر غالبية الخلايا التائية عن سلاسل αβ TCR. هذه المجموعة من الخلايا التائية أقل شيوعًا في البشر والفئران (حوالي 2٪ من إجمالي الخلايا التائية) وتوجد غالبًا في الغشاء المخاطي للأمعاء ، ضمن مجموعة الخلايا الليمفاوية داخل الظهارة.
بالإضافة إلى امتلاك وظائف شبيهة بالوظائف الفطرية ، فإن هذه المجموعة الفرعية من الخلايا التائية تدعم الاستجابة المناعية التكيفية ولها نمط ظاهري يشبه الذاكرة.
كما أنهم قادرون على التعرف على بعض الخلايا السرطانية والخلايا المصابة بفيروس الهربس والقضاء عليها.
بمجرد تنشيطها ، يمكن لهذه الخلايا أداء وظائف تُنسب إلى كل من الخلايا Th و Tc (أي إنتاج السيتوكين وإطلاق جزيئات الخلايا الخلوية / قتل الخلايا).
وبالتالي ، على الرغم من أن هذه المجموعة ككل وفيرة في الدورة الدموية الطرفية ، فإن استنساخ الخلايا التائية للذاكرة الظاهرية الفردية تتواجد عند ترددات منخفضة نسبيًا.
بعد ذلك ، تم اكتشاف مجموعات جديدة عديدة من خلايا الذاكرة التائية بما في ذلك خلايا الذاكرة T (Trm) المقيمة في الأنسجة وخلايا TSCM للذاكرة الجذعية وخلايا الذاكرة الظاهرية T. تنتج خلايا CD8 + T أيضًا السيتوكينات الرئيسية IL-2 و IFNγ ، والتي تؤثر على وظائف المستجيب للخلايا الأخرى ، ولا سيما الخلايا الضامة وخلايا NK.
يتم تعريف هذه الخلايا بالتعبير عن CD8 + على سطح الخلية. يتم تنشيط الخلايا التائية المساعدة عندما يتم تقديمها مع مستضدات الببتيد بواسطة جزيئات معقد التوافق النسيجي الكبير من الدرجة الثانية ، والتي يتم التعبير عنها على سطح الخلايا العارضة للمستضد (APCs).
يؤدي الانتقاء السلبي في النخاع إلى القضاء على الخلايا التائية التي ترتبط بشدة بالمستضدات الذاتية المعبر عنها في جزيئات معقد التوافق النسيجي الكبير.
تستقبل الخلايا Thymocytes التي تتفاعل بشدة مع المستضد الذاتي إشارة موت الخلايا المبرمج التي تؤدي إلى موت الخلية. ومع ذلك ، يتم اختيار بعض هذه الخلايا لتصبح خلايا Treg. تخرج الخلايا المتبقية من الغدة الصعترية كخلايا تائية ناضجة ساذجة (تُعرف أيضًا باسم المغتربين الجدد [8]).
تتم إزالة خلايا المناعة الذاتية المحتملة من خلال عملية الاختيار السلبي ، والتي تحدث في لب الغدة الصعترية
الخلايا الموجبة المزدوجة (CD4 + / CD8 +) التي تتفاعل بشكل جيد مع جزيئات معقد التوافق النسيجي الكبير من الدرجة الثانية ستصبح في النهاية خلايا CD4 + ، بينما تنضج الخلايا الزعترية التي تتفاعل جيدًا مع جزيئات معقد التوافق النسيجي الكبير من الدرجة الأولى إلى خلايا CD8 +.
تستغرق عملية الاختيار الإيجابي عدة أيام.
على الرغم من أن هذه الإشارات تتطلب هذا pre-TCR على سطح الخلية ، إلا أنها مستقلة عن ارتباط ligand بـ pre-TCR. إذا كانت أشكال ما قبل TCR ، فإن الخلية تنظم CD25 وتسمى خلية DN4 (CD25 CD44−).
خلايا CLP التي وصلت حديثًا هي خلايا CD4 CD8 − CD44 + CD25 ckit + ، ويطلق عليها خلايا أسلاف الغدة الصعترية المبكرة (ETP).
ثم تهاجر خلايا CLP هذه عبر الدم إلى الغدة الصعترية ، حيث تتغذى. يُطلق على الخلايا الأقدم التي وصلت إلى الغدة الصعترية اسم سلبي مزدوج ، لأنها لا تعبر عن مستقبلات CD4 ولا CD8.
ثم تنتقل عملية التمايز إلى سلف ليمفاوي شائع (CLP)، والذي يمكن أن يتمايز فقط إلى خلايا T أو B أو NK.
آلية العمل
[عدل]- تكون البلاعم الكبرى أول من يكتشف وجود أنتيجين في الدم فتقوم بإبلاغ الخلايا التائية المساعدة.
- تقوم الخلايا التائية المساعدة بإرسال إشارات كيميائية لإبلاغ الخلايا البائية والخلايا التائية القاتلة.
- تبدأ الخلايا البائية بإنتاج الأجسام المضادة.
- تقوم الخلايا التائية القاتلة بالهجوم المباشر وإفراز السموم ضد الأنتيجينات.
- بعد القضاء على الأنتيجين تقوم خلية تي منظمة بكبت عمل الخلايا المقاومة حتي لا تهاجم خلايا الجسم نفسه، وتنظم نظام المناعة.
- بعد ذلك تتحول بعض خلايا تي التي اشتركت في مقاومة مستضد إلى خلية تي ذاكرة ؛ حيث تتعرف بسرعة على المستضد إذا أصاب الجسم مرة أخرى وتعمل على مقاومته على الفور - بفضل ذاكرتها.
خلية تائية مساعدة
[عدل]خلايا تي المساعدة (بالإنجليزية: Helper. T. Cells) تُسمى أيضًا CD4+ T cells ، هذه الخلايا نتيجة دورانها في الدم تكون أول من يتلقى الإشارة من البلاعم الكبرى بوجود جسم غريب فتسارع للتعرف على هذا الجسم بواسطة مستقبلاتها السطحية. ثم ترسل إشارة كيميائية منبّهة (كوستيمولاتور) تساعد على نمو الخلايا البائية، فتنتج الأجسام المضادة؛ كذلك ترسل إشارات أخرى تؤدي إلى نضج الخلايا التائية الكابتة والقاتلة.
خلية تائية قاتلة
[عدل]تقوم الخلايا تي القاتلة (Cytotoxic T cells (TC cells بتمويت الخلايا المصابة بفيروس وخلايا الأورام، وهي تشارك في عملية رفض الجسم للأعضاء الغريبة المزروعة فيه وتكون مأخوذة من شخص آخر في العمليات الجراحية . كما تعرف تلك الخلايا بأنها خلايا تي CD8+ T cells تبدي البروتين CD8 على سطحها ؛ فتتعرف على أهدافها حيث تربط نفسها بأنتيجين يكون معلما بجزيئات MHC class I والتي توجد على أسطح جميع الخلايا ذات نواة . (المعقد MHC يسمى بالعربية معقد التوافق النسيجي الكبير)
تنتج خلايا تي المنظمة الأدينوسين IL-10, adenosine وجزيئات أخرى تعمل على تنشيط خلايا تي CD8+ إلى حالة لا تضر بالجسم، إذ لو نشطت خلايا تي زيادة عن اللزوم فتظهر على الجسم أعراض مناعة ذاتية حيث تهاجم خلايا الجسم السليمة أيضا.
خلية تائية منظمة
[عدل]الخلايا تي المنظمة Regulatory T cells (Treg cells), كانت تعرف في الماضي بخلايا تي الكابتة suppressor T cells وهي ضرورية بالنسبة لتفعيل سماحية المناعة. واهميتها تتلخص في أنها تهديء من عمل خلايا تي عند نهاية عملها في القضاء على دخيل غريب عن الجسم وتكبت خلايا تي الزائدة النشاط بحيث لا تهاجم الخلايا السليمة للجسم (مناعة ذاتية؛ تلك الخلايا تي الزائدة النشاط تكون قد هربت من عملية انتقاء تتم في الغدة الزعترية بعد عمليات القضاء على مستضد .
يوجد من خلايا تي المنظمة CD4+ Treg cells بحسب البحوث الجديدة نوعان : FOXP3+ Treg cells و .... FOXP3− Treg cells .
الخلايا تي المنظمة يمكن ان تنشأ في الغدة الزعترية وتعرف عندئذ بـخلايا تي منظمة زعترية thymic Treg cells, أو في أجزاء أخرى في نظام المناعة، في تلك الحالة تسمى خلايا تي منظمة ليست زعترية peripherally derived Treg cells. ذلك النوعان كانا يعرفا في الماضي بأن الناشئة في الغدة الزعترية بأنها خلية تي طبيعية وأما الأخرى فكانت تعتبر أن مناعيتها مكتسبة .[5] وكلا النوعان يحتاج إلى معامل ترجمة جين FOXP3 يستخدم في التعرف على الخلايا . وإذا حدث وان تغير الجين FOXP3 بحيث يمنع نشأة خلايا تي المنظمة، فإن ذلك يؤدي إلى أحد أمراض المناعة الذاتية المميتة والمعروف بـ متلازمة إيبيكس IPEX Syndrome.
خلية تائية ذاكرة
[عدل](بالإنجليزية: Memory T cells) وهي المسؤولة عن حفظ الذاكرة المناعية النوعية الّتي تلي الاستجابة المناعية الأولية.
تنحدر خلية تي الذاكرة من خلية تي تصارعت مع أنتيجين معين وتحتفظ لمدة طويلة في ذاكرتها بأن هذا الأنتيجن عدو للجسم . وينمو عددها بأعداد كبيرة كخلايا تي فاعلة حين إصابة الجسم بنفس المستضد مرة أخرى فتقوم على الفور في مقاومته . يوجد من خلايا تي الذاكرة ثلاثة أنواع : خلايا تي ذاكرة مركزية (TCM cells) ونوعان فعالان أو مؤثران TEM cells و TEMRA cells).[6] تنتج خلايا تي الذاكرة إما البروتين CD4+ أو CD8+.
تبدي خلايا تي ذاكرة البروتين CD45RO على سطحها .[7]
خلية فاتكة طبيعية
[عدل]تربط خلايا تي الطبيعية Natural killer T cells (NKT cells – ولا يصح الخلط بينها وبين خلايا المناعة الطبيعية) بين نظام المناعة الطبيعية وبين نظام المناعة المكتسبة.على عكس خلايا تي العادية التي تتعرف على ببتيد أحد المستضدات يقدمه جزيء التوافق النسيجي الكبير major histocompatibility complex (معقد التوافق النسيجي الكبير أو مختصرا MHC)، فإن خلية تي الطبيعية تتعرف على غليكوليبيد لاحد المستضدات يقدمة جزيء يسمى CD1d .
وفي حالة تنشيط خلايا تي الطبيعية فهي تقوم بمهمة مشابهة لكلا من خلايا تي المساعدة Th وخلايا تي القاتلة Tc (أي تنتج سيتوكين وتنتج جزيئات قاتلة قادرة على التعرف والقضاء على خلايا بعض الاورام وخلايا مصابة بفيروس الهربس).
خلية تائية غاما دلتا
[عدل]تمثل خلايا تي غاما دلتا Gamma delta T cell (γδ T cells) فئة صغيرة من خلايا تي، وهي تتميز بوجود مستقبل TCR على سطحها . كثير من خلايا تي لها مستقبل T cell receptor (TCR) مكون من سلسلة غليكوبروتين يسمى مسلسلات α- و β- TCR . إلا أن خلايا تي غاما دلتا γδ T cells فيتكون المستقبل TCR من مسلسلتي γ-غاما و δ-دلتا. توجد تلك الأنواع من خلايا تي في الإنسان والفئران بنسبة صغيرة، نحو 2% من خلايا تي.
ولكن في الأرانب والخراف والدجاج فتوجد من خلايا تي غاما دلتا γδ T cells بنسب كبيرة قد تصل إلى نحو 60% من كل خلايا تي لديها. ولا يزال غير معروف ما هو جزيء المستضد الذي يتسبب في تنشيط الخلايا تي غاما دلتا .
ويبدو أن خلايا تي غاما دلتا لا يلزمها تقديم معقد MHC لها فهي تستطيع التعرف على بروتينات كاملة أكير من التعرف على أجزاء من الروتين يقوم جزيء MHC بتقديمه لها .
أنواع أخرى
[عدل]في محاربة الأمراض المستعصية وأمراض السرطان يكشف البحث العلمي عن خلايا جديدة تشارك في نظام المناعة. من ضمن تلك الخلايا أنواع من خلايا تي وتسمى Mucosal associated invariant T cells (MAITs)، وهي عبارة عن خلايا تي لها مستقبل Vα19-Jα33 في الفئران ومستقبل Vα7.2-Jα33 في الإنسان. ويبدو أن تلك الخلايا تي المكتشفة حديثا (2008) لها دور منظم في نظام المناعة. .[8] ولا يزال البحث جاريا في خدمة الإنسان.
أمراض متعلقة بالخلايا التائية
[عدل]عوز مناعة وراثي
[عدل]قد يكون عوز المناعة الوراثية ناشئا من خلاي تي أو خلايا بي، أي أن تكون استجابة المناعة الخلوية واستجابة المناعة متعطلة، وتسمى ذلك عوز المناعة المشترك الشديد SCID . الأطفال المصابين بهذا المرض لا بد وأن يكون رعايتهم في محيط خالي تماما من الميكروبات والجراثيم، ويكون لهم فرصة في للحياة عن طريق نقل نخاع العظام المناسب لهم .
بالنسبة إلى متلازمة دي جورج فهي تمنع تكون النسيج التحتي في الغدة الزعترية للجنين. لهذا لا تنضج الخلايا التائية في الجنين المريض، ويكون نشاط المناعة الطبيعية فيه منخفضا جدا.
كما تنشأ في بعض مرضى متلازمة اللمفاوية العارية خلايا لويكوسيت وخلايا زعترية من دون جزيئات MHC-II ، وبذلك يكون لها نقص في خلايا تي من النوع CD4+ T cells.
عوز المناعة المكتسبة
[عدل]يمكن أن تشأ عوز المناعة المكتسبة من أمراض مختلفة، فمنها ما ينشأ بسبب التغذية الغير سليمة، ومن بيئة محيطة ضارة أو بسبب علاج .
العدوى
[عدل]يصيب فيروس العوز المناعي البشري (HIV) خلايا تي CD4+ T cells , وخلايا متغصنة والخلايا الأكولة الكبيرة مما يؤدي إلى طهور مرض الإيدز. ويمكن لفيروس HTLV I وفيروس HTLV II إصابة خلايا تي في الإنسان والرئيسيات مؤدي إلى أمراض من ضمنها لويكيميا الخلايا تي، ومرض شلل سفلي تشنجي مداري.
الحساسية
[عدل]يوصف مرض الحساسية بأنه تعامل مناعة الجسم بطريقة زائدة مع خلايا الجسم، أو استجابة مناعة الجسم لدخيل لا ضرر منه، مثل غبار أو حبوب لقاح أو مادة غذائية معينة أو دواء معين . وتختص الحساسية من بين الأربعة تصنيفات طبقا للباحثين «كومبس» و «جيل» بالخلايا تي في حالتي التصنيف 1 (حساسية فورية) والحساسية، تصنيف 4 (حساسية غير فورية). في حالة الحساسية الفورية يكون رد خلايا تي2 شديدا، وفي حالة الحساسية البطيئة يكون رد خلايا تي1 شديدا أيضا ومؤديا إلى التهاب.
أمراض المناعة الذاتية
[عدل]تكون امراض المناعة الذاتية مزمنة، وهي تنشأ عن مهاجمة نظام المناعة لخلايا الجسم نفسه رغم سلامتها . فمن مرض السكري من النوع الأول تبدأ خلايا تي من نوع CD8+ T-Zellen ذات الحساسية للإنسولين في مهاجمة خلايا البنكرياس . وفي مرض التهاب المفاصل الروماتويدي يبدو أيضا مشاركة خلايا تي فيه. .[9]
وفي مرض التصلب اللويحي تبت أن النشاط الزائد لخلايا تي تتسبب فيه، حيث تهاجم الخلايا العصبية والمحاور العصبية.
تأثير دواء
[عدل]لبعض الأدوية تأثير غير مرغوب فيه يظهر عوز المناعة . فمثلا بعد عمليات نقل الأعضاء يكمن خطر عدم تقبل جسم المريض للعضو المزروع فيه، وتعمل المناعة الخلطية والمناعة الخلوية على مقاومته. وفي الغالب تعمل خلايا تي ضد عضو مزروع في المريض من شخص غريب أو ضد خلايا أو أنسجة مزروعة في المريض أتية من شخص آخر، فهي لا تتقبل جزيئات MHC الغريبة عنها . وتبين الفحوص ثلاثة احتمالات لتلك الآليات المضادة : «رفض حاد» للعضو المزروع من خلايا تي CD8+ T cells , و «الرفض المزمن» من خلايا تي CD4+ T cells, وفساد الأوعية الدموية الموصلة بالعضو المزروع . ويمكن منع رفض طرد الجسم للعضو المزروع بواسطة دواء كبت مناعة متواصلا . كما يمكن إعطاء المريض عقارات تخفض من تكاثر الخلايا مثل «سيتوستاتيكا» Zytostatica وبالعلاج بالأشعة المؤينة فهي تبطل من فاعلية جزء من الخلايا البيضاء والخلايا تي .
المراجع
[عدل]- ^ نموذج تأسيسي في التشريح، QID:Q1406710
- ^ نموذج تأسيسي في التشريح، QID:Q1406710
- ^ محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 122، OCLC:4769982658، QID:Q126042864
- ^ The NIAID resource booklet "Understanding the Immune System (pdf)". نسخة محفوظة 2009-05-08 على موقع واي باك مشين.
- ^ Abbas AK, Benoist C, Bluestone JA, Campbell DJ, Ghosh S, Hori S, Jiang S, Kuchroo VK, Mathis D, Roncarolo MG, Rudensky A, Sakaguchi S, Shevach EM, Vignali DA, Ziegler SF (2013). "Regulatory T cells: recommendations to simplify the nomenclature". Nat. Immunol. ج. 14 ع. 4: 307–8. DOI:10.1038/ni.2554. PMID:23507634.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ن Willinger T, Freeman T, Hasegawa H, McMichael AJ, Callan MF (2005). "Molecular signatures distinguish human central memory from effector memory CD8 T cell subsets". Journal of Immunology. ج. 175 ع. 9: 5895–903. DOI:10.4049/jimmunol.175.9.5895. PMID:16237082.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Akbar AN, Terry L, Timms A, Beverley PC, Janossy G (أبريل 1988). "Loss of CD45R and gain of UCHL1 reactivity is a feature of primed T cells". J. Immunol. ج. 140 ع. 7: 2171–8. PMID:2965180.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "The Role of NKT Cells in Tumor Immunity". Adv Cancer Res. ج. 101: 277–348. 2008. DOI:10.1016/S0065-230X(08)00408-9. PMC:2693255. PMID:19055947.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - ^ György Nagy, Joanna M. Clark, Edit Buzas, Claire Gorman, Maria Pasztoi, Agnes Koncz, Andras Falus and Andrew P. Cope (2008), [[1] "Nitric oxide production of T lymphocytes is increased in rheumatoid arthritis"] (in German), Immunology Letters 118 (1): pp. 55–8, [2] "نسخة مؤرشفة". مؤرشف من الأصل في 2020-04-16. اطلع عليه بتاريخ 2020-04-16.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link)

