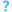فيروس إنفلونزا أ
فيروس إنفلونزا أ | |
|---|---|
هيكل فيروس الأنفلونزا أ
| |
 صورة مجهرية لفيروسات الأنفلونزا أ ملتقطة بواسطة مجهر إلكتروني نافذ
| |
| المرتبة التصنيفية | نوع[1][2] |
| تصنيف الفيروسات | |
| المجموعة: | نعم |
| المملكة: | أورثوريوفيريس [الإنجليزية] |
| الشعبة: | فيروس بالرنا وحيد السلسلة بقطبية سالبة [الإنجليزية] |
| الطائفة: | أرتيكولافيراليس [الإنجليزية] |
| الرتبة: | أرتيكولافيراليس [الإنجليزية] |
| الفصيلة: | فيروس الإنفلونزا |
| الجنس: | ألفا إنفلونزا |
| النوع: | فيروس إنفلونزا أ |
| الاسم العلمي | |
| Influenza A virus[1][2] | |
| تعديل مصدري - تعديل | |
فيروسات الإنفلونزا أ (بالإنجليزية: Influenza A virus) هي أحد أجناس فيروسات أورثوميكوفيريداي. وفيروسات الإنفلونزا أ تضم نوع واحد وهو الفيروس أ الذي تصيب الطيور وبعض أنواع الثديات. وجميع الأنواع الفرعية المعروفة من فيروسات الإنفلونزا أ تصيب بشكل خاص الطيور المائية. وانتقال العدوى من هذه الطيور إلى الطيور المستأنسة وطيور المزراع ممكن أن يؤدي إلى تفشي المرض بصورة سريعة ومن الممكن أن تؤدي إلى جائحة بين البشر. على أية حال، هناك اختلافات وراثية كبيرة بين الأنواع الفرعية التي تصيب كل من البشر والطيور.
فيروسات الإنفلونزا أ هي فيروسات رنا مجزأة وحيدة الشريطة ذات إحساس سلبي. يتم تصنيف الأنواع الفرعية العديدة وفقًا لرقم H (لنوع هيماجلوتينين) ورقم N (لنوع النورامينيداز). هناك 18 مستضد H معروفًا مختلفًا (H1 إلى H18) و 11 مستضد N معروفًا مختلفًا (N1 إلى N11).[8][9] تم عزل H17N10 من خفافيش الفاكهة في عام 2012.[10][11] تم اكتشاف H18N11 في خفاش بيروفي في عام 2013.[9]
لقد تحور كل نوع فرعي من الفيروسات إلى مجموعة متنوعة من السلالات ذات الملامح المرضية المختلفة؛ بعضها مُمْرِض لنوع واحد دون البعض الآخر، وبعضها مُمْرِض لأنواع متعددة.
لقد تم تطوير لقاح إنفلونزا A مفلتر ومنقى للبشر وقام العديد من البلدان بتخزينه للسماح بإعطاء السكان بسرعة في حالة انتشار وباء إنفلونزا الطيور. يطلق على أنفلونزا الطيور أحيانًا اسم إنفلونزا الطيور، وبالعامية إنفلونزا الطيور. في عام 2011، أبلغ الباحثون عن اكتشاف جسم مضاد فعال ضد جميع أنواع فيروس ألإنفلونزا أ.[12]
الأنواع[عدل]

فيروسات الإنفلونزا من النوع A هي فيروسات RNA مصنفة إلى أنواع فرعية بناءً على نوع البروتينين على سطح الغلاف الفيروسي:
- H = راصة دموية (بالإنجليزية: Hemagglutinin)، وهو بروتين يتسبب في تراص خلايا الدم الحمراء.
- N = نيورامينيداز (بالإنجليزية: Neuraminidase)، إنزيم يشق الروابط الجليكوسيدية لحمض السياليك أحادي السكاريد (المعروف سابقًا بحمض النورامينيك).
يعتبر الهيماجلوتينين أساسيًا للتعرف على الفيروس وربطه بالخلايا المستهدفة، وأيضًا لإصابة الخلية بعد ذلك بـ RNA. من ناحية أخرى، فإن النورامينيداز أمر بالغ الأهمية للإفراج اللاحق عن جزيئات الفيروس الابنة التي تم إنشاؤها داخل الخلية المصابة حتى تتمكن من الانتشار إلى الخلايا الأخرى.
تقوم فيروسات الأنفلونزا المختلفة بترميز بروتينات الهيماجلوتينين والنورامينيداز المختلفة. على سبيل المثال، يُعيِّن فيروس H5N1 نوعًا فرعيًا من الأنفلونزا A يحتوي على بروتين هيماجلوتينين (H) من النوع 5 وبروتين نورامينيداز من النوع 1 (N). هناك 18 نوعًا معروفًا من الهيماجلوتينين و 11 نوعًا معروفًا من النيورامينيداز، لذلك، من الناحية النظرية، هناك 198 توليفة مختلفة من هذه البروتينات ممكنة.[8][9]
يتم تحديد بعض المتغيرات وتسميتها وفقًا للعزلة التي تشبهها، وبالتالي يُفترض أنها تشترك في النسب (مثل فيروس إنفلونزا فوجيان)؛ وفقًا لمضيفهم النموذجي (على سبيل المثال فيروس الأنفلونزا البشرية)؛ وفقًا لنوعهم الفرعي (مثال H3N2)؛ ووفقًا لمدى قوتها (مثال LP، مسببة للأمراض منخفضة). لذا فإن الأنفلونزا من فيروس مشابه للعزلة A / Fujian / 411/2002 (H3N2) تسمى أنفلونزا فوجيان، والإنفلونزا البشرية، وأنفلونزا H3N2.
يتم تسمية المتغيرات أحيانًا وفقًا للأنواع (المضيف) التي تتوطن فيها السلالة أو تتكيف معها. المتغيرات الرئيسية المسماة باستخدام هذه الاتفاقية هي:
كما تم تسمية المتغيرات أحيانًا وفقًا لمدى قدرتها على الموت في الدواجن، وخاصة الدجاج:
- إنفلونزا الطيور منخفضة الضراوة (LPAI)
- إنفلونزا الطيور شديدة العدوى (HPAI)، وتسمى أيضًا الأنفلونزا القاتلة أو أنفلونزا الموت
السلالات الأكثر شهرة هي سلالات منقرضة. على سبيل المثال، لم يعد النوع الفرعي السنوي من الإنفلونزا H3N2 يحتوي على السلالة التي تسببت في إنفلونزا هونج كونج.
مواسم الإنفلونزا[عدل]
الإنفلونزا السنوية (وتسمى أيضًا «الأنفلونزا الموسمية» أو «الأنفلونزا البشرية») في الولايات المتحدة. «يؤدي إلى ما يقرب من 36000 حالة وفاة وأكثر من 200000 حالة دخول إلى المستشفى كل عام. بالإضافة إلى هذه الخسائر البشرية، تعد الإنفلونزا مسؤولة سنويًا عن تكلفة إجمالية تزيد عن 10 مليارات دولار في الولايات المتحدة»[13] تُقدر حصيلة فيروس الإنفلونزا عالميًا بحوالي 290.000-645.000 حالة وفاة سنويًا، متجاوزة التقديرات السابقة.[14]
يتكون لقاح الإنفلونزا ثلاثي التكافؤ الذي يتم تحديثه سنويًا من مكونات بروتين سكري سطحي هيماجلوتينين (HA) من فيروسات الأنفلونزا H3N2 وH1N1 وفيروس إنفلونزا ب.[15]
زادت المقاومة المقاسة للأدوية القياسية المضادة للفيروسات أمانتادين وريمانتادين في H3N2 من 1% في 1994 إلى 12% في 2003 إلى 91% في 2005.
«فيروسات الإنفلونزا البشرية المعاصرة H3N2 مستوطنة الآن في الخنازير في جنوب الصين ويمكن إعادة تكيفها مع فيروسات الطيور H5N1 في هذا المضيف الوسيط.»[16]
الجسم المضاد FI6[عدل]
تم اكتشاف F16، وهو جسم مضاد يستهدف بروتين هيماجلوتينين، في عام 2011. FI6 هو الجسم المضاد الوحيد المعروف الفعال ضد جميع الأنواع الفرعية من فيروس الأنفلونزا A.[17][18][19]
الهيكل والتركيب الجيني[عدل]


إن فيروسات الإنفلونزا من النوع A متشابهة جدًا في تركيبها مع فيروسات الأنفلونزا من الأنواع B و C و D.[22] يبلغ قطر جسيم الفيروس (ويسمى أيضًا الفيريون) 80-120 نانومترًا بحيث تتخذ أصغر الفيروسات شكلاً بيضاويًا.[21][23] يختلف طول كل جسيم اختلافًا كبيرًا، نظرًا لحقيقة أن الإنفلونزا متعددة الأشكال، ويمكن أن تتجاوز عشرات الميكرومترات، مما يؤدي إلى إنتاج فيروسات خيطية.[24] ينبع الارتباك حول طبيعة تعدد الأشكال في فيروس الإنفلونزا من ملاحظة أن السلالات المتكيفة في المختبر تفقد عادةً القدرة على تكوين خيوط[25] وأن هذه السلالات المكيفة في المختبر كانت أول ما تم تصويره بواسطة المجهر الإلكتروني.[26] على الرغم من هذه الأشكال المتنوعة، فإن فيروسات جميع فيروسات الأنفلونزا من النوع A متشابهة في التركيب. تتكون جميعها من غلاف فيروسي يحتوي على نوعين رئيسيين من البروتينات، ملفوفة حول قلب مركزي.[27]
البروتينان الكبيران الموجودان على السطح الخارجي للجزيئات الفيروسية هما هيماجلوتينين (HA) ونورامينيداز (NA). HA هو بروتين يتوسط ربط الفيروس بالخلايا المستهدفة ودخول الجينوم الفيروسي إلى الخلية المستهدفة. يشارك زمالة المدمنين المجهولين في التحرر من مواقع التعلق غير المنتجة الوفيرة الموجودة في المخاط[28] بالإضافة إلى إطلاق فيروسات النسل من الخلايا المصابة.[29] عادة ما تكون هذه البروتينات أهدافًا للأدوية المضادة للفيروسات.[30] علاوة على ذلك، فهي أيضًا بروتينات المستضد التي يمكن للأجسام المضادة للمضيف أن ترتبط بها وتحفز استجابة مناعية. يتم تصنيف فيروسات الأنفلونزا من النوع A إلى أنواع فرعية بناءً على نوع هذين البروتينين على سطح الغلاف الفيروسي. هناك 16 نوعًا فرعيًا من HA و 9 أنواع فرعية من NA معروفة، ولكن فقط H 1 و 2 و 3 و N 1 و 2 توجد بشكل شائع في البشر.[31]
يحتوي اللب المركزي للفيريون على الجينوم الفيروسي والبروتينات الفيروسية الأخرى التي تحزم وتحمي المادة الوراثية. على عكس جينومات معظم الكائنات الحية (بما في ذلك البشر والحيوانات والنباتات والبكتيريا) التي تتكون من DNA مزدوج الشريطة، فإن العديد من الجينومات الفيروسية تتكون من حمض نووي مختلف أحادي السلسلة يسمى RNA. على غير العادة بالنسبة للفيروس، فإن جينوم فيروس الأنفلونزا من النوع A ليس قطعة واحدة من الحمض النووي الريبي. بدلاً من ذلك، يتكون من قطع مجزأة من الحمض النووي الريبي ذي المعنى السلبي، تحتوي كل قطعة إما على جين واحد أو اثنين من الجينات التي ترمز لمنتج جين (بروتين).[27] مصطلح RNA ذو المعنى السلبي يعني فقط أن جينوم RNA لا يمكن ترجمته إلى بروتين مباشرة. يجب أولاً نسخها إلى RNA موجب الاتجاه قبل أن يمكن ترجمتها إلى منتجات بروتينية. تسمح الطبيعة المجزأة للجينوم بتبادل الجينات بأكملها بين السلالات الفيروسية المختلفة.[27] يبلغ طول جينوم فيروس الإنفلونزا أ بأكمله 13588 قاعدة، وهو موجود في ثمانية أجزاء من الحمض النووي الريبي التي ترمز لما لا يقل عن 10 ولكن يصل إلى 14 بروتينًا، اعتمادًا على السلالة. يمكن أن تختلف أهمية أو وجود منتجات الجينات البديلة:[32]
- الجزء 1 يشفر الوحدة الفرعية لبوليميراز الحمض النووي الريبي (PB2).
- يقوم الجزء 2 بترميز الوحدة الفرعية لبوليميراز الحمض النووي الريبي (PB1) وبروتين PB1-F2، الذي يؤدي إلى موت الخلية، باستخدام إطارات قراءة مختلفة من نفس مقطع الحمض النووي الريبي.
- يقوم الجزء 3 بتشفير الوحدة الفرعية لبوليميراز الحمض النووي الريبي (PA) وبروتين PA-X، الذي له دور في إيقاف نسخ المضيف.[33]
- الجزء 4 يشفر HA (هيماجلوتينين). هناك حاجة إلى حوالي 500 جزيء من هيماجلوتينين لصنع فيريون واحد. يحدد HA مدى وشدة العدوى الفيروسية في الكائن الحي المضيف.
- الجزء 5 يشفر NP، وهو بروتين نووي.
- الجزء 6 يشفر NA (النورامينيداز). هناك حاجة إلى حوالي 100 جزيء من النيورامينيداز لصنع فيريون واحد.
- الجزء 7 يشفر بروتينين مصفوفتين (M1 و M2) باستخدام إطارات قراءة مختلفة من نفس مقطع RNA. هناك حاجة إلى حوالي 3000 جزيء بروتين مصفوفة لصنع فيريون واحد.
- يشفر الجزء 8 بروتينين غير بنيويين متميزين (NS1 و NEP) باستخدام إطارات قراءة مختلفة من نفس مقطع RNA.

تحتوي أجزاء الحمض النووي الريبي في الجينوم الفيروسي على تسلسلات أساسية مكملة في النهايات الطرفية، مما يسمح لها بالارتباط ببعضها البعض بروابط هيدروجينية.[29] لا يمكن أن يستمر نسخ جينوم الحس الفيروسي (-) (vRNA) إلا بعد ارتباط بروتين PB2 باستضافة RNAs، مما يسمح للوحدة الفرعية PA بشق عدة نيوكليوتيدات بعد الغطاء. يعمل هذا الغطاء المشتق من المضيف والنيوكليوتيدات المصاحبة له كأساس لبدء النسخ الفيروسي. يستمر النسخ على طول vRNA حتى يتم الوصول إلى امتداد العديد من قواعد uracil، مما يؤدي إلى `` التلعثم '' حيث يكون mRNA الفيروسي الناشئ متعدد الأدينات، مما ينتج عنه نسخة ناضجة للتصدير والترجمة النووية بواسطة الآلات المضيفة.[34]
يحدث تخليق الحمض النووي الريبي في نواة الخلية، بينما يحدث تخليق البروتينات في السيتوبلازم. بمجرد أن يتم تجميع البروتينات الفيروسية في فيريونات، تغادر الفيريونات المجمعة النواة وتهاجر نحو غشاء الخلية.[35] يحتوي غشاء الخلية المضيفة على بقع من بروتينات الغشاء الفيروسي (HA و NA و M2) وطبقة أساسية من البروتين M1 والتي تساعد الفيروسات المجمعة على التبرعم عبر الغشاء، وإطلاق الفيروسات المغلفة النهائية في السائل خارج الخلية.[35]
إعادة تنشيط التعددية[عدل]
فيروس ألإنفلونزا قادر على إعادة التنشيط المتعدد بعد تعطيله بواسطة الأشعة فوق البنفسجية،[36][37] أو عن طريق الإشعاع المئين.[38] إذا كان أي من خيوط الحمض النووي الريبي الثمانية التي تشكل الجينوم يحتوي على تلف يمنع التكاثر أو التعبير عن الجين الأساسي، فإن الفيروس غير قابل للحياة عندما يصيب وحده خلية (عدوى واحدة). ومع ذلك، عندما يصيب اثنان أو أكثر من الفيروسات التالفة نفس الخلية (عدوى متعددة)، يمكن إنتاج فيروسات ذرية قابلة للحياة بشرط أن يكون كل جزء من الأجزاء الجينومية الثمانية موجودًا في نسخة واحدة على الأقل غير تألفة. أي أن إعادة تنشيط التعددية يمكن أن تحدث.
عند الإصابة، يتسبب فيروس الإنفلونزا في استجابة مضيفة تتضمن زيادة إنتاج أنواع الأكسجين التفاعلية، وهذا يمكن أن يؤدي إلى تلف جينوم الفيروس.[39] إذا كان بقاء الفيروس، في ظل الظروف الطبيعية، عرضة عادةً لتحدي الضرر التأكسدي، فمن المحتمل أن يكون تنشيط التعددية مفيدًا بشكل انتقائي كنوع من عملية الإصلاح الجينومي. لقد تم اقتراح أن إعادة تنشيط التعددية التي تتضمن جينومات RNA مجزأة قد تكون مشابهة لأقدم شكل متطور من التفاعل الجنسي في عالم الحمض النووي الريبي الذي من المحتمل أن يسبق عالم الحمض النووي.[40] (انظر أيضًا فرضية عالم RNA.)
فيروس الإنفلونزا البشرية[عدل]

يشير «فيروس الأنفلونزا البشرية» عادة إلى تلك الأنواع الفرعية التي تنتشر على نطاق واسع بين البشر. H1N1 و H1N2 و H3N2 هي الأنواع الفرعية الوحيدة المعروفة لفيروسات الإنفلونزا أ المنتشرة حاليًا بين البشر.[41]
العوامل الوراثية في التمييز بين «فيروسات الأنفلونزا البشرية» و «فيروسات أنفلونزا الطيور» تشمل:
- PB2: (RNA polymerase): موضع حمض أميني (أو بقايا) 627 في بروتين PB2 المشفر بواسطة جين PB2 RNA. حتى H5N1، كان لدى جميع فيروسات إنفلونزا الطيور المعروفة حمض الجلوتاميك في الموضع 627، بينما كانت جميع فيروسات الإنفلونزا البشرية تحتوي على ليسين.
- HA: (hemagglutinin): إنفلونزا الطيور HA تربط مستقبلات حمض السياليك ألفا 2 - 3، بينما الإنفلونزا البشرية HA تربط مستقبلات حمض السياليك ألفا 2-6. تمتلك فيروسات أنفلونزا الخنازير القدرة على ربط كلا النوعين من مستقبلات حمض السياليك.
عادة ما تشمل أعراض الإنفلونزا البشرية الحمى والسعال والتهاب الحلق وآلام العضلات والتهاب الملتحمة، وفي الحالات الشديدة، مشاكل التنفس والالتهاب الرئوي الذي قد يكون قاتلاً. ستعتمد شدة العدوى في جزء كبير منها على حالة الجهاز المناعي للشخص المصاب وما إذا كانت الضحية قد تعرضت للإجهاد من قبل، وبالتالي فهي محصنة جزئيًا. تظهر دراسات المتابعة حول تأثير الستاتينات على تكاثر فيروس الإنفلونزا أن المعالجة المسبقة للخلايا بأتورفاستاتين تثبط نمو الفيروس في المزرعة.[42]
إنفلونزا الطيور H5N1 شديدة الإمراض لدى البشر أسوأ بكثير، حيث تقتل 50% من البشر الذين يصابون بها. في إحدى الحالات، أصيب صبي مصاب بفيروس H5N1 بإسهال تلاه غيبوبة بسرعة دون ظهور أعراض تنفسية أو أعراض تشبه أعراض الإنفلونزا.[43]
الأنواع الفرعية لفيروس الإنفلونزا أ التي تم تأكيدها في البشر، مرتبة حسب عدد الوفيات الناجمة عن الجائحة البشرية المعروفة، هي:
- تسبب فيروس H1N1 في حدوث «الأنفلونزا الإسبانية» عام 1918 ووباء إنفلونزا الخنازير عام 2009.
- تسبب فيروس H2N2 في حدوث «الأنفلونزا الآسيوية» في أواخر الخمسينيات من القرن الماضي.
- تسبب فيروس H3N2 في «أنفلونزا هونج كونج» في أواخر الستينيات.
- يعتبر H5N1 تهديدًا عالميًا لجائحة الأنفلونزا من خلال انتشاره في منتصف العقد الأول من القرن الحادي والعشرين.
- H7N9 هو المسؤول عن وباء عام 2013 في الصين[44] واعتبره الدكتور مايكل جرير، مؤلف كتاب How Not to Die، أن يكون لديه أكبر تهديد وبائي من فيروسات الإنفلونزا A.[45]
- فيروس H7N7 له بعض الإمكانات الحيوانية المصدر: نادرًا ما تسبب المرض في البشر.[46][47]
- إن H1N2 مستوطن حاليًا في الخنازير ولكن ليس في البشر.[48]
- H9N2، H7N2، H7N3، H5N2، وH10N7.
H1N1[عدل]
كان H1N1 مسؤولاً عن جائحة عام 2009 في كل من البشر والخنازير. كان أحد أنواع H1N1 مسؤولاً عن وباء الإنفلونزا الإسبانية الذي قتل ما يقرب من 50 مليون إلى 100 مليون شخص في جميع أنحاء العالم على مدار عام تقريبًا في عامي 1918 و 1919.[49] تم تسمية متغير آخر بأنه تهديد وبائي في وباء إنفلونزا 2009. نشأ الجدل في أكتوبر 2005، بعد نشر جينوم H1N1 في مجلة ساينس، بسبب مخاوف من إمكانية استخدام هذه المعلومات في الإرهاب البيولوجي.[50]
H1N2[عدل]
- H1N2 حاليا متوطنة في كل من الإنسان ومجموعات الخنازير. يبدو أن سلالة H1N2 الجديدة نتجت عن إعادة تصنيف جينات السلالة الحالية انتشار الأنفلونزا H1N1 و H3N2. يشبه بروتين Hemagglutinin الخاص بفيروس H1N2 البروتين الموجود حاليًا فيروسات H1N1 المنتشرة، وبروتين النيورامينيداز مشابه لبروتين التيار ] فيروسات H3N2.
H2N2[عدل]
نشأت الأنفلونزا الآسيوية، وهي تفشي وبائي لأنفلونزا الطيور H2N2، في الصين في عام 1957، وانتشرت في جميع أنحاء العالم في نفس العام الذي تم فيه تطوير لقاح الإنفلونزا، واستمر حتى عام 1958 وتسبب في وفاة ما بين مليون وأربعة ملايين شخص.
H3N2[عدل]
- H3N2 حاليا مستوطنة في كل من البشر والخنازير. تطورت من H2N2 عن طريق التحول المستضدي وتسببت في وباء إنفلونزا هونج كونج في عام 1968 و 1969، والذي قتل ما يصل إلى 750,000.[51] قتل شكل حاد من فيروس H3N2 العديد من الأطفال في الولايات المتحدة في أواخر عام 2003.[52]
- السلالة السائدة من الأنفلونزا السنوية في يناير 2006 كانت H3N2. زادت المقاومة المقاسة للأدوية القياسية المضادة للفيروسات أمانتادين وريمانتادين في H3N2 من 1% في 1994 إلى 12% في 2003 إلى 91% في 2005.[53] فيروسات الأنفلونزا البشرية H3N2 هي الآن مستوطنة في الخنازير في جنوب الصين، حيث تنتشر مع فيروسات الطيور H5N1.[16]
H5N1[عدل]
H5N1 هو التهديد الرئيسي لجائحة الأنفلونزا في العالم.[بحاجة لمصدر]
H5N2[عدل]
- قالت وزارة الصحة اليابانية في يناير 2006 أن عمال مزارع الدواجن في محافظة إيباراكي ربما تعرضوا لـ H5N2 في عام 2005.[54] زاد عيار الأجسام المضادة H5N2 من الأمصال المقترنة لـ 13 شخصًا أربعة أضعاف أو أكثر.[55]
H5N9[عدل]
- تسببت سلالة شديدة الإمراض من فيروس H5N9 في اندلاع إنفلونزا طفيفة في عام 1966 في أونتاريو ومانيتوبا، كندا في الديوك الرومية.[56]
H7N2[عدل]
- تم العثور على شخص واحد في نيويورك في عام 2003، وشخص آخر في فرجينيا في عام 2002، لديهم أدلة مصلية على الإصابة بفيروس H7N2.[بحاجة لمصدر] كلاهما تعافى تمامًا.[57][إخفاق التحقق]
H7N3[عدل]
- في أمريكا الشمالية، تم تأكيد وجود سلالة إنفلونزا الطيور H7N3 في العديد من مزارع الدواجن في كولومبيا البريطانية في فبراير 2004. اعتبارًا من أبريل 2004، تم وضع 18 مزرعة في الحجر الصحي لوقف انتشار الفيروس. تم تأكيد حالتين من البشر مصابين بإنفلونزا الطيور في تلك المنطقة. وشملت الأعراض التهاب الملتحمة ومرض خفيف شبيه بالإنفلونزا.[58] كلاهما تعافى تماما.
H7N7[عدل]
H7N7 لديه إمكانات غير عادية للإصابة بالحيوان. في عام 2003 في هولندا، تم تأكيد إصابة 89 شخصًا بعدوى فيروس الإنفلونزا H7N7 بعد تفشي المرض في الدواجن في العديد من المزارع. تم تسجيل حالة وفاة واحدة.
H7N9[عدل]
- في 2 أبريل 2013، أكد مركز حماية الصحة (CHP) التابع لوزارة الصحة في هونغ كونغ أربع حالات أخرى في مقاطعة جيانغسو بالإضافة إلى الحالات الثلاث المبلغ عنها في البداية في 31 مارس 2013.[59] يمتلك هذا الفيروس أيضًا أكبر احتمالية لوباء الأنفلونزا بين جميع الأنواع الفرعية للإنفلونزا أ.[60]
H9N2[عدل]
- تم تأكيد الإصابة بمرض إنفلونزا الطيور A (H9N2) المنخفض في عام 1999، وفي الصين وهونج كونج لطفلين، وفي عام 2003 في هونج كونج لطفل واحد. تعافى الثلاثة بالكامل.[57][إخفاق التحقق]
H10N7[عدل]
- في عام 2004، في مصر، تم الإبلاغ عن H10N7 لأول مرة في البشر. تسبب في مرض رضيعين في مصر. كان والد أحد الأطفال تاجر دواجن.[61]
التطور[عدل]

وفقًا لجيفري توبنبرغر [الإنجليزية]:
- «جميع أوبئة الأنفلونزا أ منذ [جائحة الإنفلونزا الإسبانية]، وفي الواقع جميع حالات الإنفلونزا A في جميع أنحاء العالم تقريبًا (باستثناء الإصابات البشرية من فيروسات الطيور مثل H5N1 و H7N7)، سببها المتحدرين من فيروس عام 1918، بما في ذلك» الانجراف «فيروسات H1N1 وفيروسات H2N2 و H3N2 المعاد تصنيفها. وتتكون الأخيرة من جينات رئيسية من فيروس عام 1918، تم تحديثها لاحقًا بواسطة جينات إنفلونزا الطيور المدمجة التي ترمز لبروتينات سطحية جديدة، مما يجعل فيروس عام 1918 بالفعل» أم«جميع الأوبئة.»[62]
استخدم باحثون من المعاهد الوطنية للصحة بيانات من مشروع تسلسل جينوم الإنفلونزا وخلصوا إلى أنه خلال فترة العشر سنوات التي تم فحصها، لم يُظهر جين هيماجلوتينين في H3N2 في معظم الأوقات أي فائض كبير في الطفرات في مناطق المستضدات بينما هناك تنوع متزايد من سلالات المتراكمة. نتج عن ذلك أن أحد المتغيرات حقق في نهاية المطاف لياقة أعلى، وأصبح مهيمنًا، وفي فترة وجيزة من التطور السريع، واكتسح بسرعة السكان والقضاء على معظم المتغيرات الأخرى.[63] في التطور قصير المدى لفيروس الأنفلونزا أ، وجدت دراسة أجريت عام 2006 أن العمليات العشوائية أو العشوائية هي عوامل رئيسية.[64] يبدو أن تطور مستضد HA لفيروس الأنفلونزا A يتميز أكثر من خلال القفزات المتقطعة والمتقطعة مقابل معدل ثابت للتغير المستضدي.[65] باستخدام التحليل الوراثي لـ 413 جينومًا كاملًا من فيروسات الإنفلونزا البشرية التي تم جمعها في جميع أنحاء ولاية نيويورك، وفقًا لمؤلفي Nelson et al. كان عام 2006 قادراً على إظهار أن التنوع الجيني، وليس الانجراف المستضدي، هو الذي شكل التطور قصير المدى للإنفلونزا أ من خلال الهجرة العشوائية وإعادة التصنيف. يهيمن على تطور هذه الفيروسات الاستيراد العشوائي لسلالات فيروسية مختلفة وراثيًا من مواقع جغرافية أخرى وبدرجة أقل عن طريق الانتقاء الطبيعي. في غضون موسم معين، يكون التطور التكيفي نادرًا وله تأثير ضعيف بشكل عام كما يتضح من البيانات التي تم جمعها من 413 جينومًا. كشف التحليل الوراثي أن السلالات المختلفة مشتقة من مادة وراثية مستوردة حديثًا مقارنة بالعزلات التي كانت متداولة في نيويورك في المواسم السابقة. لذلك، كان تدفق الجينات داخل وخارج هذه المجموعة، وليس الانتقاء الطبيعي، أكثر أهمية على المدى القصير.
حيوانات أخرى[عدل]
- انظر H5N1 لمعرفة الوباء الحالي (وباء في غير البشر) وبانزوتيك (بالإنجليزية: panzootic) (مرض يصيب الحيوانات الكثير من الأنواع وخاصة على مساحة واسعة) من إنفلونزا H5N1
إنفلونزا الطيور[عدل]
يعمل الطير كناقل طبيعي لفيروسات الأنفلونزا أ بدون أعراض. قبل الحالي ] H5N1 الوبائي، سلالات من فيروس الأنفلونزا أ قد ثبت أنها تنتقل من الطيور البرية إلى الطيور والخنازير والخيول والفقمة والحيتان والبشر فقط. وفقط بين البشر والخنازير وبين البشر والطيور الداجنة؛ وليس المسارات الأخرى مثل الطيور الداجنة إلى الخيول.[49] الطيور المائية البرية هي المضيف الطبيعي لمجموعة كبيرة ومتنوعة من فيروسات الأنفلونزا أ. من حين لآخر، تنتقل الفيروسات من هذه الطيور إلى أنواع أخرى وقد تتسبب بعد ذلك في تفشي مرض مدمر في الطيور الداجنة أو تؤدي إلى انتشار وباء الإنفلونزا البشرية.[66][67] ثبت أن فيروس H5N1 ينتقل إلى النمور والفهود والقطط المنزلية التي تتغذى بالفيروس على طيور منزلية غير مطهية (دجاج). عبرت فيروسات H3N8 من الخيول وتسببت في تفشي المرض في الكلاب. أُصيبت فئران المختبر بنجاح بمجموعة متنوعة من الأنماط الجينية لإنفلونزا الطيور.[68] تنتشر فيروسات الإنفلونزا أ في الهواء وفي السماد الطبيعي، وتعيش لفترة أطول في الطقس البارد. كما يمكن أن تنتقل عن طريق الأعلاف والمياه والمعدات والملابس الملوثة؛ ومع ذلك، لا يوجد دليل على أن الفيروس يمكن أن يعيش في اللحوم المطبوخة جيدًا. تختلف الأعراض عند الحيوانات، لكن السلالات الخبيثة يمكن أن تسبب الموت في غضون أيام قليلة. فيروسات إنفلونزا الطيور أن المنظمة العالمية للصحة الحيوانية واختبار الآخرين لللأمراض الدواجن السيطرة تشمل H5N1، H7N2، H1N7، H7N3، H13N6، H5N9، H11N6، H3N8، H9N2، H5N2، H4N8، H10N7، H2N2، H8N4، H14N5، H6N5، و H12N5.
| السنة | المنطقة | أصيب بها | النوع |
|---|---|---|---|
| 1959 | اسكتلندا | الدجاج | إتش 5 إن 1 |
| 1963 | إنكلترا | ديك رومي | إنفلونزا الطيور |
| 1966 | أونتاريو - كندا | ديك رومي | فيروس الإنفلونزا أ H5N9 |
| 1976 | فيكتوريا - أستراليا | دجاج | إنفلونزا الطيور |
| 1979 | ألمانيا | دجاج | إنفلونزا الطيور |
| 1979 | إنكلترا | ديك رومي | إنفلونزا الطيور |
| 1983 | بينسلفانيا - الولايات المتحدة | دجاج - ديك رومي | إنفلونزا الطيور |
| 1983 | إيرلندا | ديك رومي | فيروس الإنفلونزا أ H5N8 |
| 1985 | فيكتوريا - أستراليا | دجاج | إنفلونزا الطيور |
| 1991 | إنكلترا | ديك رومي | إتش 5 إن 1 |
| 1992 | فيكتوريا - أستراليا | دجاج | إنفلونزا الطيور |
| 1994 | كوينزلاند - أستراليا | دجاج | إنفلونزا الطيور |
| 1994 | المكسيك | دجاج | إنفلونزا الطيور |
| 1994 | باكستان | دجاج | إنفلونزا الطيور |
| 1997 | نيو سوث ويلز - أستراليا | دجاج | فيروس الإنفلونزا أ H7N4 |
| 1997 | هونغ كونغ | دجاج | إتش 5 إن 1 |
| 1997 | إيطاليا | دجاج | إنفلونزا الطيور |
| 1999 | إيطاليا | ديك رومي | فيروس الإنفلونزا أ H7N1 |
| 2002 | هونغ كونغ | دجاج | إتش 5 إن 1 |
| 2002 | شيلي | دجاج | إنفلونزا الطيور |
| 2003 | هولندا | دجاج | إنفلونزا الطيور |
| 2013 | الصين | حمام | H9N7 |
*انتشار المرض بشكل كبير في العديد من المزارع مما أدى إلى خسائر اقتصادية كبيرة. اشتملت معظم حالات التفشي الأخرى على انتشار ضئيل أو معدوم من المزارع المصابة في البداية.
تم تسجيل أكثر من 400 حالة وفاة من فقمة الموانئ في نيو إنجلاند بين ديسمبر 1979 وأكتوبر 1980، من الالتهاب الرئوي الحاد الناجم عن فيروس الأنفلونزا، A / Seal / Mass / 1/180 (H7N7).[70]
إنفلونزا الخنازير[عدل]
الفيروسات المستوطنة في الخنازير هي H1N1 وH1N2 وH3N1 وH3N2.
إنفلونزا الحصان[عدل]
تم عزل الفيروسات المسببة لإنفلونزا الحصان مرة واحدة عام 1956 وهما H7N7 و H3N8.
إنفلونزا الكلاب[عدل]
تصيب إنفلونزا الكلاب (H3N8) كلاب الصيد بصفة خاصة. وتؤدي إلى أمراض الجهاز التنفسي وقد تفضي بموت الكلب. وعزل هذا الفيروس في فلوريدا عام 2004
H3N8[عدل]
الفيروس H3N8 مستوطن في الطيور والكلاب والحصن.
الفيروس عند البشر[عدل]
الفيروسات المعروفة في التسبب بأمراض لدى الإنسان هي:
- H1N1 - سببت وباء إنفلونزا 1918 وإنفلونزا الخنازير عام 2009.
- H2N2 - سببت إنفلونزا آسيا.
- H3N2 - سببت إنفلونزا هونغ كونغ.
- H5N1 - سببت إنفلونزا الطيور.
- H1N2 - مستوطنة لدى البشر والخنازير.
- H9N2 و H7N2 و H7N3 و H5N2 وH10N7
قائمة الأنواع الفرعية[عدل]
يحتوي فيروس الإنفلونزا أ على الأنواع الفرعية التالية:
- فيروس الإنفلونزا أ H1N1
- فيروس الإنفلونزا أ H1N2
- فيروس الإنفلونزا أ H2N2
- فيروس الإنفلونزا أ H2N3
- فيروس الإنفلونزا أ H3N1
- فيروس الإنفلونزا أ H3N2
- فيروس الإنفلونزا أ H3N8
- فيروس الإنفلونزا أ H5N1
- فيروس الإنفلونزا أ H5N2
- فيروس الإنفلونزا أ H5N3
- فيروس الإنفلونزا أ H5N6
- فيروس الإنفلونزا أ H5N8
- فيروس الإنفلونزا أ H5N9
- فيروس الإنفلونزا أ H6N1 [الإنجليزية]
- فيروس الإنفلونزا أ H6N2 [الإنجليزية]
- فيروس الإنفلونزا أ H7N1
- فيروس الإنفلونزا أ H7N2
- فيروس الإنفلونزا أ H7N3
- فيروس الإنفلونزا أ H7N4
- فيروس الإنفلونزا أ H7N7
- فيروس الإنفلونزا أ H7N9
- فيروس الإنفلونزا أ H9N2
- فيروس الإنفلونزا أ H10N7
- فيروس الإنفلونزا أ H10N8
- فيروس الإنفلونزا أ H11N2
- فيروس الإنفلونزا أ H11N9
- فيروس الإنفلونزا أ H17N10
- فيروس الإنفلونزا أ H18N11
انظر أيضًا[عدل]
المراجع[عدل]
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (30 Jun 2014), ICTV Master Species List 2013 v2 (بالإنجليزية), QID:Q18810383
- ^ أ ب ت International Committee on Taxonomy of Viruses, ed. (12 Jun 2015), ICTV Master Species List 2014 v4 (بالإنجليزية), QID:Q24716610
- ^ International Committee on Taxonomy of Viruses, ed. (26 May 2016), ICTV Master Species List 2015 v1 (بالإنجليزية), QID:Q24571893
- ^ International Committee on Taxonomy of Viruses, ed. (25 May 2017), ICTV Master Species List 2016 v1.3 (بالإنجليزية), QID:Q29000566
- ^ International Committee on Taxonomy of Viruses, ed. (13 Mar 2018), ICTV Master Species List 2017 v1 (بالإنجليزية), QID:Q51526638
- ^ International Committee on Taxonomy of Viruses, ed. (17 Oct 2018), ICTV Master Species List 2018a v1 (بالإنجليزية), QID:Q57700017
- ^ International Committee on Taxonomy of Viruses, ed. (8 Mar 2019), ICTV Master Species List 2018b.v2 (بالإنجليزية), QID:Q62075759
- ^ أ ب "Influenza Type A Viruses and Subtypes". مراكز السيطرة على الأمراض والوقاية منها. 2 أبريل 2013. مؤرشف من الأصل في 2020-12-22. اطلع عليه بتاريخ 2013-06-13.
- ^ أ ب ت "New world bats harbor diverse influenza A viruses". PLOS Pathogens. ج. 9 ع. 10: e1003657. أكتوبر 2013. DOI:10.1371/journal.ppat.1003657. PMC:3794996. PMID:24130481.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Unique new flu virus found in bats". NHS Choices. 1 مارس 2012. مؤرشف من الأصل في 2020-08-08. اطلع عليه بتاريخ 2012-05-16.
- ^ "A distinct lineage of influenza A virus from bats". Proceedings of the National Academy of Sciences of the United States of America. ج. 109 ع. 11: 4269–74. مارس 2012. Bibcode:2012PNAS..109.4269T. DOI:10.1073/pnas.1116200109. PMC:3306675. PMID:22371588.
- ^ Gallagher، James (29 يوليو 2011). "'Super antibody' fights off flu". BBC News. مؤرشف من الأصل في 2020-11-29. اطلع عليه بتاريخ 2011-07-29.
- ^ whitehouse.gov نسخة محفوظة 9 January 2009 على موقع واي باك مشين. National Strategy for Pandemic Influenza – Introduction – "Although remarkable advances have been made in science and medicine during the past century, we are constantly reminded that we live in a universe of microbes – viruses, bacteria, protozoa and fungi that are forever changing and adapting themselves to the human host and the defenses that humans create. Influenza viruses are notable for their resilience and adaptability. While science has been able to develop highly effective vaccines and treatments for many infectious diseases that threaten public health, acquiring these tools is an ongoing challenge with the influenza virus. Changes in the genetic makeup of the virus require us to develop new vaccines on an annual basis and forecast which strains are likely to predominate. As a result, and despite annual vaccinations, the US faces a burden of influenza that results in approximately 36,000 deaths and more than 200,000 hospitalizations each year. In addition to this human toll, influenza is annually responsible for a total cost of over $10 billion in the US. A pandemic, or worldwide outbreak of a new influenza virus, could dwarf this impact by overwhelming our health and medical capabilities, potentially resulting in hundreds of thousands of deaths, millions of hospitalizations, and hundreds of billions of dollars in direct and indirect costs. This Strategy will guide our preparedness and response activities to mitigate that impact."
- ^ "Estimates of global seasonal influenza-associated respiratory mortality: a modelling study". Lancet. ج. 391 ع. 10127: 1285–1300. مارس 2018. DOI:10.1016/s0140-6736(17)33293-2. PMC:5935243. PMID:29248255.
- ^ "Influenza A (H3N2) outbreak, Nepal". Emerging Infectious Diseases. ج. 11 ع. 8: 1186–91. أغسطس 2005. DOI:10.3201/eid1108.050302. PMC:3320503. PMID:16102305."The 2003–2004 influenza season was severe in terms of its impact on illness because of widespread circulation of antigenically distinct influenza A (H3N2) Fujian-like viruses. These viruses first appeared late during the 2002–2003 influenza season and continued to persist as the dominant circulating strain throughout the subsequent 2003–2004 influenza season, replacing the A/Panama/2007/99-like H3N2 viruses (1). Of the 172 H3N2 viruses genetically characterized by the Department of Defense in 2003–2004, only one isolate (from Thailand) belonged to the A/Panama-like lineage. In February 2003, the World Health Organization (WHO) changed the H3N2 component for the 2004–2005 influenza vaccine to afford protection against the widespread emergence of Fujian-like viruses (2). The annually updated trivalent vaccine consists of hemagglutinin (HA) surface glycoprotein components from influenza H3N2, H1N1, and B viruses."
- ^ أ ب Mahmoud 2005"H5N1 virus is now endemic in poultry in Asia (Table 2-1) and has gained an entrenched ecological niche from which to present a long-term pandemic threat to humans. At present, these viruses are poorly transmitted from poultry to humans, and there is no conclusive evidence of human-to-human transmission. However, continued, extensive exposure of the human population to H5N1 viruses increases the likelihood that the viruses will acquire the necessary characteristics for efficient human-to-human transmission through genetic mutation or reassortment with a prevailing human influenza A virus. Furthermore, contemporary human H3N2 influenza viruses are now endemic in pigs in southern China (Peiris et al., 2001) and can reassort with avian H5N1 viruses in this 'intermediate host.' Therefore, it is imperative that outbreaks of H5N1 disease in poultry in Asia are rapidly and sustainably controlled. The seasonality of the disease in poultry, together with the control measures already implemented, are likely to reduce temporarily the frequency of H5N1 influenza outbreaks and the probability of human infection."
- ^ Gallagher، James (29 يوليو 2011). "'Super antibody' fights off flu". BBC News. مؤرشف من الأصل في 2020-11-29.
- ^ "Scientists hail the prospect of a universal vaccine for flu". 29 يوليو 2011. مؤرشف من الأصل في 2019-08-23.
- ^ Chan، Amanda L. (28 يوليو 2011). "Universal Flu Vaccine on the Horizon: Researchers Find 'Super Antibody'". HuffPost. مؤرشف من الأصل في 2020-08-11.
- ^ "Details – Public Health Image Library(PHIL)". phil.cdc.gov (بالإنجليزية الأمريكية). Archived from the original on 2020-10-26. Retrieved 2018-04-24.
- ^ أ ب "Ultracentrifugation deforms unfixed influenza A virions". The Journal of General Virology. ج. 92 ع. Pt 11: 2485–93. نوفمبر 2011. DOI:10.1099/vir.0.036715-0. PMC:3352361. PMID:21795472.
- ^ "Influenza C and D Viruses Package Eight Organized Ribonucleoprotein Complexes". Journal of Virology. ج. 92 ع. 6: e02084–17. مارس 2018. DOI:10.1128/jvi.02084-17. PMC:5827381. PMID:29321324.
- ^ "Native morphology of influenza virions". Frontiers in Microbiology. ج. 2: 269. 2011. DOI:10.3389/fmicb.2011.00269. PMC:3249889. PMID:22291683.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Filamentous influenza viruses". The Journal of General Virology. ج. 97 ع. 8: 1755–64. أغسطس 2016. DOI:10.1099/jgv.0.000535. PMC:5935222. PMID:27365089.
- ^ "Spherical influenza viruses have a fitness advantage in embryonated eggs, while filament-producing strains are selected in vivo". Journal of Virology. ج. 87 ع. 24: 13343–53. ديسمبر 2013. DOI:10.1128/JVI.02004-13. PMC:3838284. PMID:24089563.
- ^ "Electron micrography of the virus of influenza". Nature. ج. 157 ع. 3983: 263. مارس 1946. Bibcode:1946Natur.157..263M. DOI:10.1038/157263a0. PMID:21016866.
- ^ أ ب ت "The biology of influenza viruses". Vaccine. ج. 26 ع. Suppl 4: D49–53. سبتمبر 2008. DOI:10.1016/j.vaccine.2008.07.039. PMC:3074182. PMID:19230160.
- ^ "Influenza A penetrates host mucus by cleaving sialic acids with neuraminidase". Virology Journal. ج. 10: 321. نوفمبر 2013. DOI:10.1186/1743-422x-10-321. PMC:3842836. PMID:24261589.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب "Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses". Biological & Pharmaceutical Bulletin. ج. 28 ع. 3: 399–408. مارس 2005. DOI:10.1248/bpb.28.399. PMID:15744059.
- ^ "Recent strategies in the search for new anti-influenza therapies". Current Drug Targets. ج. 4 ع. 5: 389–408. يوليو 2003. DOI:10.2174/1389450033491019. PMID:12816348.
- ^ "Influenza: evolving strategies in treatment and prevention". Seminars in Respiratory and Critical Care Medicine. ج. 28 ع. 2: 144–58. أبريل 2007. DOI:10.1055/s-2007-976487. PMID:17458769.
- ^ "At the centre: influenza A virus ribonucleoproteins". Nature Reviews. Microbiology (بالإنجليزية). 13 (1): 28–41. Jan 2015. DOI:10.1038/nrmicro3367. PMC:5619696. PMID:25417656.
- ^ "Selective Degradation of Host RNA Polymerase II Transcripts by Influenza A Virus PA-X Host Shutoff Protein". PLOS Pathogens. ج. 12 ع. 2: e1005427. فبراير 2016. DOI:10.1371/journal.ppat.1005427. PMC:4744033. PMID:26849127.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Influenza virus RNA polymerase: insights into the mechanisms of viral RNA synthesis". Nature Reviews. Microbiology (بالإنجليزية). 14 (8): 479–93. Aug 2016. DOI:10.1038/nrmicro.2016.87. PMC:4966622. PMID:27396566.
- ^ أ ب "How viruses enter animal cells". Science. ج. 304 ع. 5668: 237–42. أبريل 2004. Bibcode:2004Sci...304..237S. DOI:10.1126/science.1094823. PMID:15073366.
- ^ "The multiplication of influenza virus. II. Multiplicity reactivation of ultraviolet irradiated virus". Virology. ج. 14 ع. 4: 398–405. أغسطس 1961. DOI:10.1016/0042-6822(61)90330-0. PMID:13687359.
- ^ "Studies on host-virus interactions in the chick embryo-influenza virus system. VI. Evidence for multiplicity reactivation of inactivated virus". The Journal of Experimental Medicine. ج. 94 ع. 4: 305–22. أكتوبر 1951. DOI:10.1084/jem.94.4.305. PMC:2136114. PMID:14888814.
- ^ "Multiplicity reactivation in gamma irradiated influenza viruses". Nature. ج. 214 ع. 5094: 1235–7. يونيو 1967. Bibcode:1967Natur.214.1235G. DOI:10.1038/2141235a0. PMID:6066111.
- ^ "Oxidants and antioxidants in viral diseases: disease mechanisms and metabolic regulation". The Journal of Nutrition. ج. 127 ع. 5 Suppl: 962S–965S. مايو 1997. DOI:10.1093/jn/127.5.962S. PMID:9164274.
- ^ "Origin of sex". Journal of Theoretical Biology. ج. 110 ع. 3: 323–51. أكتوبر 1984. DOI:10.1016/S0022-5193(84)80178-2. PMID:6209512.
- ^ CDC Key Facts About Avian Influenza (Bird Flu) and Avian Influenza A (H5N1) Virus نسخة محفوظة 23 سبتمبر 2015 على موقع واي باك مشين.
- ^ "Atorvastatin restricts the ability of influenza virus to generate lipid droplets and severely suppresses the replication of the virus". The FASEB Journal. ج. 33 ع. 8: 9516–9525. أبريل 2019. DOI:10.1096/fj.201900428RR. PMC:6662987. PMID:31125254.
- ^ "Fatal avian influenza A (H5N1) in a child presenting with diarrhea followed by coma". The New England Journal of Medicine. ج. 352 ع. 7: 686–91. فبراير 2005. DOI:10.1056/NEJMoa044307. PMID:15716562. مؤرشف من الأصل في 2020-08-01.
- ^ "New bird flu strain in China "one of the most lethal" warns WHO". MercoPress (بالإنجليزية). Archived from the original on 2013-05-14. Retrieved 2020-12-06.
- ^ "The next pandemic and how to head it off: eat a plant-based diet". South China Morning Post (بالإنجليزية). 19 Oct 2020. Archived from the original on 2020-11-26. Retrieved 2020-12-06.
- ^ Boston, 677 Huntington Avenue; Ma 02115 +1495‑1000 (24 Oct 2013). "Making the leap". News (بالإنجليزية الأمريكية). Archived from the original on 2021-01-03. Retrieved 2020-12-06.
{{استشهاد ويب}}: صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) - ^ Ungchusak، Kumnuan؛ Auewarakul، Prasert؛ Dowell، Scott F.؛ Kitphati، Rungrueng؛ Auwanit، Wattana؛ Puthavathana، Pilaipan؛ Uiprasertkul، Mongkol؛ Boonnak، Kobporn؛ Pittayawonganon، Chakrarat (27 يناير 2005). "Probable Person-to-Person Transmission of Avian Influenza A (H5N1)". New England Journal of Medicine. ج. 352 ع. 4: 333–340. DOI:10.1056/NEJMoa044021. ISSN:0028-4793. PMID:15668219. مؤرشف من الأصل في 2020-08-21.
- ^ "First Human Case Of Rare H1N2 Flu Variant Reported In Canada". IFLScience (بالإنجليزية). Archived from the original on 2020-11-13. Retrieved 2020-12-06.
- ^ أ ب Mahmoud 2005
- ^ "NOVA | scienceNOW | Reviving the Virus (non-Flash) | PBS". www.pbs.org. مؤرشف من الأصل في 2020-11-21. اطلع عليه بتاريخ 2020-12-06.
- ^ Detailed chart of its evolution here نسخة محفوظة 9 May 2009 على موقع واي باك مشين. at PDF called Ecology and Evolution of the Flu
- ^ Mahmoud 2005"There is particular pressure to recognize and heed the lessons of past influenza pandemics in the shadow of the worrisome 2003–2004 flu season. An early-onset, severe form of influenza A H3N2 made headlines when it claimed the lives of several children in the United States in late 2003. As a result, stronger than usual demand for annual flu inactivated vaccine outstripped the vaccine supply, of which 10 to 20 percent typically goes unused. Because statistics on pediatric flu deaths had not been collected previously, it is unknown if the 2003–2004 season witnessed a significant change in mortality patterns."
- ^ Reason Altman، Lawrence K. (15 يناير 2006). "This Season's Flu Virus Is Resistant to 2 Standard Drugs". نيويورك تايمز. مؤرشف من الأصل في 2020-11-20.
- ^ CBS News article Dozens in Japan May Have Mild Bird Flu January 2006. نسخة محفوظة 18 مايو 2013 على موقع واي باك مشين.
- ^ "Human H5N2 avian influenza infection in Japan and the factors associated with high H5N2-neutralizing antibody titer". Journal of Epidemiology. ج. 18 ع. 4: 160–6. يوليو 2008. DOI:10.2188/jea.JE2007446. PMC:4771585. PMID:18603824. مؤرشف من الأصل في 2020-04-06.
- ^ WHO نسخة محفوظة 19 أكتوبر 2020 على موقع واي باك مشين.
- ^ أ ب CDC Avian Influenza Infection in Humans نسخة محفوظة 9 أكتوبر 2015 على موقع واي باك مشين.
- ^ "Human illness from avian influenza H7N3, British Columbia". Emerging Infectious Diseases. ج. 10 ع. 12: 2196–9. ديسمبر 2004. DOI:10.3201/eid1012.040961. PMC:3323407. PMID:15663860.
- ^ Schnirring، Lisa (2 أبريل 2013). "China reports 4 more H7N9 infections". CIDRAP News. مؤرشف من الأصل في 2013-05-17.
- ^ "Avian Influenza A (H7N9) Virus | Avian Influenza (Flu)". www.cdc.gov (بالإنجليزية الأمريكية). Archived from the original on 2020-12-21. Retrieved 2017-02-24.
- ^ niaid.nih.gov نسخة محفوظة 26 December 2005 على موقع واي باك مشين. Timeline of Human Flu Pandemics
- ^ "1918 Influenza: the mother of all pandemics". Emerging Infectious Diseases. ج. 12 ع. 1: 15–22. يناير 2006. DOI:10.3201/eid1201.050979. PMC:3291398. PMID:16494711.
- ^ Science Daily article New Study Has Important Implications For Flu Surveillance published 27 October 2006 نسخة محفوظة 28 يونيو 2020 على موقع واي باك مشين.
- ^ "Stochastic processes are key determinants of short-term evolution in influenza a virus". PLOS Pathogens. ج. 2 ع. 12: e125. ديسمبر 2006. DOI:10.1371/journal.ppat.0020125. PMC:1665651. PMID:17140286.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Mapping the antigenic and genetic evolution of influenza virus". Science. ج. 305 ع. 5682: 371–6. يوليو 2004. Bibcode:2004Sci...305..371S. DOI:10.1126/science.1097211. PMID:15218094. مؤرشف من الأصل في 2020-08-01.
- ^ Klenk، Hans-Dieter؛ Matrosovich، Mikhail؛ Stech، Jürgen (2008). "Avian Influenza: Molecular Mechanisms of Pathogenesis and Host Range". في Mettenleiter، Thomas C.؛ Sobrino، Francisco (المحررون). Animal Viruses: Molecular Biology. Caister Academic Press. ISBN:978-1-904455-22-6. مؤرشف من الأصل في 2016-08-20.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Influenza Virology: Current Topics. Caister Academic Press. 2006. ISBN:978-1-904455-06-6. مؤرشف من الأصل في 2016-10-06.
- ^ Mahmoud 2005"Interestingly, recombinant influenza viruses containing the 1918 HA and NA and up to three additional genes derived from the 1918 virus (the other genes being derived from the A/WSN/33 virus) were all highly virulent in mice (Tumpey et al., 2004). Furthermore, expression microarray analysis performed on whole lung tissue of mice infected with the 1918 HA/ NA recombinant showed increased upregulation of genes involved in apoptosis, tissue injury, and oxidative damage (Kash et al., 2004). These findings were unusual because the viruses with the 1918 genes had not been adapted to mice. The completion of the sequence of the entire genome of the 1918 virus and the reconstruction and characterization of viruses with 1918 genes under appropriate biosafety conditions will shed more light on these findings and should allow a definitive examination of this explanation. Antigenic analysis of recombinant viruses possessing the 1918 HA and NA by hemagglutination inhibition tests using ferret and chicken antisera suggested a close relationship with the A/swine/Iowa/30 virus and H1N1 viruses isolated in the 1930s (Tumpey et al., 2004), further supporting data of Shope from the 1930s (Shope, 1936). Interestingly, when mice were immunized with different H1N1 virus strains, challenge studies using the 1918-like viruses revealed partial protection by this treatment, suggesting that current[متى؟] vaccination strategies are adequate against a 1918-like virus (Tumpey et al., 2004)."
- ^ "Avian influenza A(H5N1)- update 31: Situation (poultry) in Asia: need for a long-term response, comparison with previous outbreaks". Epidemic and Pandemic Alert and Response (EPR). WHO. 2004. مؤرشف من الأصل في 2018-11-13.
Known outbreaks of highly pathogenic flu in poultry 1959-2003. - ^ "Mass mortality of harbor seals: pneumonia associated with influenza A virus". Science. ج. 215 ع. 4536: 1129–31. فبراير 1982. Bibcode:1982Sci...215.1129G. DOI:10.1126/science.7063847. PMID:7063847.
More than 400 harbor seals, most of them immature, died along the New England coast between December 1979 and October 1980 of acute pneumonia associated with influenza virus, A/Seal/Mass/1/180 (H7N7). The virus has avian characteristics, replicates principally in mammals, and causes mild respiratory disease in experimentally infected seals. Concurrent infection with a previously undescribed mycoplasma or adverse environmental conditions may have triggered the epizootic. The similarities between this epizootic and other seal mortalities in the past suggest that these events may be linked by common biological and environmental factors.
قراءة متعمقة[عدل]
- مصادر رسمية
- Avian influenza and Influenza Pandemics from the مراكز السيطرة على الأمراض والوقاية منها
- Avian influenza الأسئلة الأكثر تكرارا from the منظمة الصحة العالمية
- Avian influenza information from the منظمة الأغذية والزراعة
- U.S. Government's avian influenza information website
- European Centre for Disease Prevention and Control (المركز الأوروبي للوقاية من الأمراض) Stockholm, Sweden
- معلومات عامة
- "The Bird Flu and You" Full-color poster provided by the Center for Technology and National Security Policy at the جامعة الدفاع الوطني، in collaboration with the National Security Health Policy Center
- Influenza Report 2006 Online book. Research level quality information. Highly recommended.
- Special issue on avian flu from نيتشر
- Nature Reports: Homepage: Avian Flu
- Beigel JH، Farrar J، Han AM، Hayden FG، Hyer R، de Jong MD، Lochindarat S، Nguyen TK، Nguyen TH، Tran TH، Nicoll A، Touch S، Yuen KY (سبتمبر 2005). "Avian influenza A (H5N1) infection in humans". The New England Journal of Medicine. ج. 353 ع. 13: 1374–85. CiteSeerX:10.1.1.730.7890. DOI:10.1056/NEJMra052211. PMID:16192482.
- Pandemic Influenza: Domestic Preparedness Efforts Congressional Research Service Report on Pandemic Preparedness.
- A guide to bird flu and its symptoms from بي بي سي Health
- A Variety of Avian Flu Images and Pictures
- Mahmoud (2005). Stacey L. Knobler؛ Alison Mack؛ Mahmoud، Adel؛ Stanley M. Lemon (المحررون). The threat of pandemic influenza : are we ready? : workshop summary / prepared for Forum on Microbial Threats, Board on Global Health. The National Academies Press. ص. 285. ISBN:0-309-09504-2.
Highly pathogenic avian influenza virus is on every top ten list available for potential agricultural bioweapon agents
- Mahmoud، Adel A. F؛ Institute of Medicine؛ Knobler، Stacey؛ Mack، Alison (2005). The Threat of Pandemic Influenza: Are We Ready?: Workshop Summary. Washington, D.C: National Academies Press. ISBN:978-0-309-09504-4. مؤرشف من الأصل في 2015-09-06.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - 'The Threat of Bird Flu': HealthPolitics.com
- Is a Global Flu Pandemic Imminent? from Infection Control Today.
- Bird Flu is a Real Pandemic Threat to Humans by Leonard Crane, author of Ninth Day of Creation.
- Links to Bird Flu pictures (Hardin MD/Univ of Iowa)
- Kawaoka، Yoshihiro (2006). Influenza Virology: Current Topics. Caister Academic Pr. ISBN:978-1-904455-06-6.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - Sobrino، Francisco؛ Mettenleiter، Thomas (2008). Animal Viruses: Molecular Biology. Caister Academic Pr. ISBN:978-1-904455-22-6.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)
روابط خارجية[عدل]
- Influenza Research Database – Database of influenza genomic sequences and related information.
- Health-EU portal الاتحاد الأوروبي response to influenza
| فيروس إنفلونزا أ في المشاريع الشقيقة: | |
| |