غلوكاغون
| glucagon | |||||||
|---|---|---|---|---|---|---|---|
| معرفات | |||||||
| أسماء بديلة | GCG(53-81), glucagone, glucagon recombinant | ||||||
| معرفات خارجية | |||||||
| نمط التعبير عن الحمض النووي الريبوزي | |||||||
 |
|||||||
| المزيد من بيانات التعبير المرجعية | |||||||
| تماثلات متسلسلة | |||||||
| أنواع | الإنسان | الفأر | |||||
| أنتريه | n/a | ||||||
| Ensembl | n/a | n/a | |||||
| يونيبروت |
|
| |||||
| RefSeq (رنا مرسال.) |
|
| |||||
| RefSeq (بروتين) |
|
| |||||
| الموقع (UCSC | n/a | ||||||
| بحث ببمد | n/a | ||||||
| ويكي بيانات | |||||||
| |||||||

غلوكاغون (بالإنجليزية: Glucagon) هو عبارة عن هرمون عديد الببتيد (بروتينات)، هام لأيض الكربوهيدرات، تفرزه خلايا ألفا في جزر لانجرهانز في البنكرياس ويتم إنتاجه من البروجلوكاجون، ينتمي فصيلة السكرتين من الهرمونات.
الغلوكاغون هو هرمون ببتيد تنتجه خلايا ألفا في البنكرياس . يعمل على رفع تركيز الجلوكوز والأحماض الدهنية في مجرى الدم، ويعتبر الهرمون التقويضي الرئيسي في الجسم. [1] كما أنه يستخدم كدواء لعلاج عدد من الحالات الصحية. تأثيره معاكس لتأثير الأنسولين، الذي يخفض الجلوكوز خارج الخلية. [2] يتم إنتاجه من البروجلوكاجون، المشفر بواسطة جين GCG.
يطلق البنكرياس الغلوكاغون عندما تكون كمية الجلوكوز في مجرى الدم منخفضة للغاية. يتسبب الغلوكاغون في انخراط الكبد في عملية تحلل الجليكوجين : تحويل الجليكوجين المخزن إلى جلوكوز، والذي يتم إطلاقه في مجرى الدم. [3] من ناحية أخرى، فإن مستويات الجلوكوز المرتفعة في الدم تحفز إفراز الأنسولين. يسمح الأنسولين للأنسجة التي تعتمد على الأنسولين بتناول الجلوكوز واستخدامه. وبالتالي، فإن الغلوكاغون والأنسولين جزء من نظام التغذية المرتدة الذي يحافظ على استقرار مستويات الجلوكوز في الدم. يزيد الغلوكاغون من إنفاق الطاقة ويرفع تحت ظروف الإجهاد. [4] ينتمي الغلوكاغون إلى عائلة الإفرازات الهرمونية.
يتم إطلاقه عندما تصبح مستويات جلوكوز الدم منخفضة، لينظم نسبة السكر في الدم ويمنع حدوث انخفاض الجلوكوز في الدم في الحالة المسماة بـ "Hypoglycemia".[5][6][7] لذلك فإن عمل الغلوكاغون مضاد لعمل الإنسولين.
الغلوكاغون والأنسولين ودورهما في الحفاظ على مستوى الجلوكوز في الدم
[عدل]يفرز البنكرياس الغلوكاجون عند انخفاض مستوي السكر في الدم فيقوم الغلوكاجون بتحفيز الكبد لكي تحدث عملية تحلل الجليكوجين وفيها يتم يتم تحويل الجليكوجين المخزن إلي جلوكوز، يتم اطلاقه في الدورة الدموية. [8]
يفرز البنكرياس الإنسولين عندما يكون مستوى السكر في الدم عالي، والإنسولين يجعل الجلوكوز يُمتص بواسطة المعتمد على الإنسولين.
الوظيفة
[عدل]يرفع الغلوكاغون بشكل عام تركيز الجلوكوز في الدم عن طريق تعزيز استحداث السكر وتحلل الجليكوجين. [9] يقلل الغلوكاغون أيضًا من تخليق الأحماض الدهنية في الأنسجة الدهنية والكبد، فضلاً عن تعزيز تحلل الدهون في هذه الأنسجة، مما يؤدي إلى إطلاق الأحماض الدهنية في الدورة الدموية حيث يمكن تقويضها لتوليد الطاقة في الأنسجة مثل العضلات الهيكلية عند الحاجة. [10]
فكما ذكر يقوم الغلوكاغون برفع مستوى الجلوكوز في الدم عن طريق تحفيز عملية تحليل الجليكوجين وعملية استحداث سكر. [11]
كما أنه يقوم بتقليل تصنيع الاحماض الدهنية في الأنسجة الدهنية والكبد ويعزز عملية تحلل الدهون في هذه الانسجة وتطلق الاحماض الدهنية في الدورة الدموية حيث يمكن تقويضها لتوليد الطاقة في الأنسجة مثل العضلات الهيكلية عند الحاجة.[12]
يخزن الجلوكوز في الكبد في صورة عديد السكر جليكوجين. خلايا الكبد لديها مستقبلات الغلوكاغون حينما يرتبط الغلوكاغون بمستقبلات الغلوكاغون فإن خلايا الكبد تقوم بتحويل الجليكوجين إلى جزيئات جلوكوز حرة يتم يطلق في الدم في مجرى الدم وتعرف هذه العملية باسم تحلل الجليكوجين.
أيضاً يشجع الغلوكاغون الكبد والكلى لتصنيع الجلوكوز اضافي عن طريق عملية استحداث السكر يقوم الغلوكاغون بإيقاف تحلل السكر في الكبد، مما يتسبب في تحويل المركبات الوسيطة حال السكر إلى تكوين السكر.
ينظم الغلوكاغون أيضًا معدل إنتاج الجلوكوز من خلال تحلل الدهون، يحث الغلوكاغون على تحلل الدهون في البشر في ظل ظروف قمع الأنسولين (مثل داء السكري من النوع 1). [13]
آلية العمل
[عدل]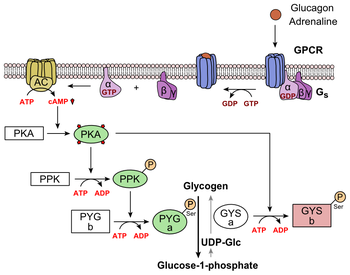
يرتبط الغلوكاغون بمستقبل الجلوكاجون، وهو مستقبل مقترن بالبروتين G، يقع في غشاء البلازما للخلية. ينشط تغيير التشكل في المستقبل البروتينات G، وهو بروتين غير متجانس مع الوحدات الفرعية α و و γ. عندما يتفاعل البروتين G مع المستقبلات، فإنه يخضع لتغيير توافق ينتج عنه استبدال جزيء الناتج المحلي الإجمالي المرتبط بالوحدة الفرعية α بجزيء GTP . ينتج عن هذا الاستبدال إطلاق الوحدة الفرعية α من الوحدتين الفرعيتين و. تقوم وحدة ألفا الفرعية على وجه التحديد بتنشيط الإنزيم التالي في سلسلة الانزيم بمحلقة الأدينيلات (adenylate cyclase).
تقوم محلقة الأدينيلات بتصنيع أدينوسين أحادي الفوسفات الدوري (AMP أو cAMP)، الذي ينشط بروتين كيناز A (بروتين كيناز المعتمد على cAMP). هذا الإنزيم، بدوره، ينشط كيناز فسفوريلاز، والذي يقوم بعد ذلك بفوسفوريلات الجليكوجين فسفوريلاز ب (PYG b)، وتحويله إلى الشكل النشط المسمى فسفوريلاز أ (PYG a). فسفوريلاز أ هو الإنزيم المسؤول عن إطلاق الجلوكوز 1- فوسفات من بوليمرات الجليكوجين. مثال على المسار سيكون عندما يرتبط الغلوكاغون ببروتين عبر الغشاء. تتفاعل بروتينات الغشاء مع Gɑβ𝛾. ينفصل Gɑ عن Gβ𝛾 ويتفاعل مع بروتين الغشاء. محلقة الأدينيلات (Adenylyl cyclase) تحفز تحويل ATP إلى cAMP. يرتبط cAMP ببروتين كيناز أ، والفوسفوريلات المعقد فسفوريلاز كيناز. [14] فسفوريلاز كيناز فسفوريلات فسفوريلاز فسفوريلاز. يقطع الفسفوريلاز الفسفوري وحدات الجلوكوز من الجليكوجين على هيئة جلوكوز 1 فوسفات. بالإضافة إلى ذلك، يتم ضبط التحكم المنسق في تحلل السكر وتكوين الجلوكوز في الكبد عن طريق حالة الفسفرة للأنزيمات التي تحفز تكوين منشط قوي لتحلل السكر يسمى الفركتوز 2،6-بيسفوسفات. [15] إن إنزيم بروتين كيناز أ (PKA) الذي تم تحفيزه بواسطة الشلال الذي بدأه الغلوكاغون سوف يفسفر أيضًا بقايا سيرين مفردة من سلسلة بولي ببتيد ثنائية الوظيفة تحتوي على إنزيمات الفركتوز 2،6-بيسفوسفاتيز و فسفوفركتوكيناز -2. ينشط هذا الفسفرة التساهمية التي بدأها الغلوكاغون الأول ويمنع الأخير. ينظم هذا التفاعل الذي يحفز الفركتوز 2،6-بيسفوسفات (منشط قوي لـ phosphofructokinase-1، الإنزيم الذي يمثل الخطوة التنظيمية الأولية لتحلل السكر) [16] عن طريق إبطاء معدل تكوينه، وبالتالي منع تدفق مسار تحلل السكر والسماح لتكوين السكر بالسيطرة. يمكن عكس هذه العملية في حالة عدم وجود الغلوكاغون (وبالتالي، وجود الأنسولين).
يؤدي تحفيز الغلوكاغون لـ PKA أيضًا إلى تعطيل إنزيم بيروفات كيناز حال السكر في خلايا الكبد. [17]
علم وظائف الأعضاء
[عدل]إنتاج
[عدل]يتم تصنيع الهرمون وإفرازه من خلايا ألفا ( خلايا ألفا) لجزر لانجرهانز الموجودة في جزء الغدد الصماء من البنكرياس. يتم كبح / تنظيم الإنتاج، الذي يتم تشغيله بشكل حر، بواسطة الأميلين، وهو هرمون ببتيد يفرز بالاشتراك مع الأنسولين من خلايا البنكرياس. [18] مع تراجع مستويات الجلوكوز في البلازما، فإن الانخفاض اللاحق في إفراز الأميلين يخفف من تثبيط خلايا ألفا، مما يسمح بإفراز الجلوكاجون.
في القوارض، توجد خلايا ألفا في الحافة الخارجية للجزيرة. هيكل جزيرة الإنسان أقل فصلًا، ويتم توزيع خلايا ألفا في جميع أنحاء الجزيرة بالقرب من خلايا بيتا. يتم إنتاج الغلوكاغون أيضًا بواسطة خلايا ألفا في المعدة. [19]
أظهرت الأبحاث الحديثة أن إنتاج الغلوكاغون قد يحدث أيضًا خارج البنكرياس، حيث تكون القناة الهضمية هي الموقع الأكثر احتمالاً لتخليق الغلوكاغون خارج البنكرياس. [20]
اللائحة
[عدل]يتم تحفيز إفراز الغلوكاغون عن طريق:
- نقص سكر الدم.
- الإبينفرين (عبر مستقبلات الأدرينالية β2 و α2 [21] و α1 [22] ).
- أرجينين.
- ألانين (غالبًا من نقل البيروفات / الغلوتامات المشتق من العضلات (انظر تفاعل ألانين ترانس أميناز ).
- أستيل كولين. [23]
- كوليسيستوكينين.
- عديد الببتيد المثبط للمعدة.
يتم منع إفراز الغلوكاغون عن طريق:
- السوماتوستاتين.
- أميلين.[18]
- الأنسولين (عبر GABA ). [24]
- PPARγ / مغاير مستقبلات الريتينويد X. [25]
- زيادة الأحماض الدهنية الحرة وأحماض الكيتو في الدم. [26]
- زيادة إنتاج اليوريا.
- الببتيد -1 يشبه الجلوكاجون.
بناء
[عدل]الغلوكاغون عبارة عن بولي ببتيد 29 حمض أميني . هيكلها الأساسي في البشر هو: NH 2 - His - Ser - Gln - Gly - Thr - Phe - Thr - Ser - Asp - Tyr - Ser - Lys - Tyr - Leu - Asp - Ser - Arg - Arg - Ala - Gln - Asp - Phe - Val - Gln - Trp - Leu - Met - Asn - Thr - COOH .
يحتوي البولي ببتيد على كتلة جزيئية تبلغ 3485 دالتون . [27] الغلوكاغون هو هرمون ببتيد (غير ستيرويد ).
يتم إنشاء الغلوكاغون من انقسام البروجلوكاجون بواسطة بروبروتين كونفرتيز 2 في خلايا البنكرياس α. في خلايا L المعوية، ينشطر البروجلوكاجون إلى المنتجات البديلة glicentin و GLP-1 (إنكرتين) و IP-2 و GLP-2 (يعزز نمو الأمعاء)). [28]
علم الأمراض
[عدل]قد تكون المستويات المرتفعة بشكل غير طبيعي من الغلوكاغون ناتجة عن أورام البنكرياس، مثل الجلوكاجونوما، والتي تشمل أعراضها الحمامي النخرية المهاجرة، [29] انخفاض الأحماض الأمينية، وارتفاع السكر في الدم . قد يحدث بمفرده أو في سياق الأورام الصماء المتعددة من النوع 1 [30]
يعتبر ارتفاع الغلوكاغون هو المساهم الرئيسي في ارتفاع نسبة الحماض الكيتوني في الدم في مرض السكري من النوع 1 غير المشخص أو المعالج بشكل سيء. مع توقف خلايا بيتا عن العمل، لم يعد الأنسولين والبنكرياس GABA موجودًا لقمع إنتاج الغلوكاغون الحر. نتيجة لذلك، يتم إطلاق الغلوكاغون من خلايا ألفا بحد أقصى، مما يؤدي إلى انهيار سريع للجليكوجين إلى جلوكوز وتكوين الكيتون السريع. [31] لقد وجد أن مجموعة فرعية من البالغين المصابين بداء السكري من النوع 1 استغرقت 4 مرات في المتوسط لمقاربة الحماض الكيتوني عند تناول السوماتوستاتين (يثبط إنتاج الجلوكاجون) بدون الأنسولين. تثبيط الغلوكاغون فكرة شائعة عن علاج مرض السكري، ومع ذلك فقد حذر البعض من أن القيام بذلك سيؤدي إلى الإصابة بمرض السكري الهش في المرضى الذين لديهم جلوكوز دم مستقر بدرجة كافية.
يُعتقد أن عدم وجود خلايا ألفا (وبالتالي الجلوكاجون) هو أحد التأثيرات الرئيسية في التقلب الشديد لجلوكوز الدم في عملية استئصال البنكرياس بالكامل.
التاريخ
[عدل]في عشرينيات القرن الماضي، درس كيمبال ومورلين مستخلصات البنكرياس، ووجدوا مادة إضافية لها خصائص ارتفاع السكر في الدم . وصفوا الغلوكاغون في عام 1923. [32] تم وصف تسلسل الأحماض الأمينية للجلوكاجون في أواخر الخمسينيات. [33] لم يتم تأسيس فهم أكثر اكتمالاً لدورها في علم وظائف الأعضاء والمرض حتى السبعينيات، عندما تم تطوير مقايسة مناعية إشعاعية معينة.
علم أصول الكلمات
[عدل]صاغ كيمبال ومورلين مصطلح الغلوكاغون في عام 1923 عندما أطلقوا على المادة في البداية اسم الجلوكوز أغون . [34]
مراجع
[عدل]- ^ Biochemistry (ط. 4th). New York: Wiley. 2011.
- ^ Biology. San Francisco: Benjamin Cummings. 2002. ISBN:978-0-8053-6624-2. مؤرشف من الأصل في 2020-10-29.
- ^ Orsay، Jonathan (2014). Biology 1: Molecules. Examkrackers Inc. ص. 77. ISBN:978-1-893858-70-1.
- ^ "Minireview: Glucagon in stress and energy homeostasis". Endocrinology. ج. 153 ع. 3: 1049–54. مارس 2012. DOI:10.1210/en.2011-1979. PMC:3281544. PMID:22294753.
- ^ Reece J، Campbell N (2002). Biology. San Francisco: Benjamin Cummings. ISBN:0-8053-6624-5. مؤرشف من الأصل في 2019-10-25.
- ^ Orsay، Jonathan (2014). Biology 1: Molecules. Examkrackers Inc. ص. 77. ISBN:978-1-893858-70-1.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ "History of glucagon - Metabolism, insulin and other hormones - Diapedia, The Living Textbook of Diabetes". www.diapedia.org (بالإنجليزية). Archived from the original on 2017-03-27. Retrieved 2017-03-26.
- ^ Orsay J (2014). Biology 1: Molecules. Examkrackers Inc. ص. 77. ISBN:978-1-893858-70-1.
- ^ Biochemistry (ط. 4th). New York: Wiley. 2011.
- ^ HABEGGER, K. M., HEPPNER, K. M., GEARY, N., BARTNESS, T. J., DIMARCHI, R. & TSCHÖP, M. H. (2010). "The metabolic actions of glucagon revisited". Nature Reviews. Endocrinology. ج. 6 ع. 12: 689–697. DOI:10.1038/nrendo.2010.187. PMC:3563428. PMID:20957001.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Voet D، Voet JG (2011). Biochemistry (ط. 4th). New York: Wiley.
- ^ HABEGGER, K. M., HEPPNER, K. M., GEARY, N., BARTNESS, T. J., DIMARCHI, R. & TSCHÖP, M. H. (2010). "The metabolic actions of glucagon revisited". Nature Reviews. Endocrinology. ج. 6 ع. 12: 689–697. DOI:10.1038/nrendo.2010.187. PMC:3563428. PMID:20957001.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Liljenquist JE، Bomboy JD، Lewis SB، Sinclair-Smith BC، Felts PW، Lacy WW، Crofford OB، Liddle GW (يناير 1974). "Effects of glucagon on lipolysis and ketogenesis in normal and diabetic men". The Journal of Clinical Investigation. ج. 53 ع. 1: 190–7. DOI:10.1172/JCI107537. PMC:301453. PMID:4808635.
- ^ "Glucose controls glucagon secretion by directly modulating cAMP in alpha cells". Diabetologia. ج. 62 ع. 7: 1212–1224. يوليو 2019. DOI:10.1007/s00125-019-4857-6. PMC:6560012. PMID:30953108.
- ^ "Role of fructose 2,6-bisphosphate in the control of glycolysis in mammalian tissues". The Biochemical Journal. ج. 245 ع. 2: 313–24. يوليو 1987. DOI:10.1042/bj2450313. PMC:1148124. PMID:2822019.
- ^ "The role of fructose 2,6-bisphosphate in the regulation of carbohydrate metabolism". Current Topics in Cellular Regulation. ج. 23: 57–86. 1984. DOI:10.1016/b978-0-12-152823-2.50006-4. ISBN:9780121528232. PMID:6327193.
- ^ "Hormonal control of pyruvate kinase activity and of gluconeogenesis in isolated hepatocytes". Proceedings of the National Academy of Sciences of the United States of America. ج. 73 ع. 8: 2762–6. أغسطس 1976. Bibcode:1976PNAS...73.2762F. DOI:10.1073/pnas.73.8.2762. PMC:430732. PMID:183209.
- ^ ا ب Zhang، Xiao-Xi (2016). "Neuroendocrine Hormone Amylin in Diabetes". World J Diabetes. ج. 7 ع. 9: 189–197. DOI:10.4239/wjd.v7.i9.189. PMC:4856891. PMID:27162583.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Glucagonocentric restructuring of diabetes: a pathophysiologic and therapeutic makeover". The Journal of Clinical Investigation. ج. 122 ع. 1: 4–12. يناير 2012. DOI:10.1172/JCI60016. PMC:3248306. PMID:22214853.
- ^ "Insulin and Glucagon: Partners for Life". Endocrinology. ج. 158 ع. 4: 696–701. أبريل 2017. DOI:10.1210/en.2016-1748. PMC:6061217. PMID:28323959.
- ^ "G-Protein-Coupled Receptors, Pancreatic Islets, and Diabetes". Nature Education. ج. 3 ع. 9: 13. 2010. مؤرشف من الأصل في 2020-11-22.
- ^ "Alpha 1- and alpha 2-adrenoceptor activation increases plasma glucagon levels in the mouse". European Journal of Pharmacology. ج. 143 ع. 1: 83–8. نوفمبر 1987. DOI:10.1016/0014-2999(87)90737-0. PMID:2891547.
- ^ "Acetylcholine stimulates insulin, glucagon, and somatostatin release in the perfused chicken pancreas". Endocrinology. ج. 107 ع. 4: 1065–8. أكتوبر 1980. DOI:10.1210/endo-107-4-1065. PMID:6105951.
- ^ "Intra-islet insulin suppresses glucagon release via GABA-GABAA receptor system". Cell Metabolism. ج. 3 ع. 1: 47–58. يناير 2006. DOI:10.1016/j.cmet.2005.11.015. PMID:16399504.
- ^ "A peroxisome proliferator-activated receptor gamma-retinoid X receptor heterodimer physically interacts with the transcriptional activator PAX6 to inhibit glucagon gene transcription". Molecular Pharmacology. ج. 73 ع. 2: 509–17. فبراير 2008. DOI:10.1124/mol.107.035568. PMID:17962386.
- ^ Johnson، Leonard R. (2003). Essential Medical Physiology. Academic Press. ص. 643–. ISBN:978-0-12-387584-6.
- ^ "Glucagon and the A cell: physiology and pathophysiology (first two parts)". The New England Journal of Medicine. ج. 304 ع. 25: 1518–24. يونيو 1981. DOI:10.1056/NEJM198106183042504. PMID:7015132.
- ^ "Pancreatic and intestinal processing of proglucagon in man". Diabetologia. ج. 30 ع. 11: 874–81. نوفمبر 1987. DOI:10.1007/BF00274797 (غير نشط 11 أكتوبر 2020). PMID:3446554.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: وصلة دوي غير نشطة منذ 2020 (link) - ^ "Glucagonoma syndrome: a review and update on treatment". Journal of the European Academy of Dermatology and Venereology. ج. 30 ع. 12: 2016–2022. ديسمبر 2016. DOI:10.1111/jdv.13752. PMID:27422767.
- ^ "Pancreatic endocrine tumors". Seminars in Oncology. ج. 37 ع. 6: 594–618. ديسمبر 2010. DOI:10.1053/j.seminoncol.2010.10.014. PMID:21167379.
- ^ "Diabetic ketoacidosis: diagnosis and management". African Journal of Medicine and Medical Sciences. ج. 37 ع. 2: 99–105. يونيو 2008. PMID:18939392.
- ^ "Aqueous extracts of pancreas III. Some precipitation reactions of insulin". J. Biol. Chem. ج. 58 ع. 1: 337–348. 1923. مؤرشف من الأصل في 2008-10-28.
- ^ "The amino acid sequence of glucagon V. Location of amide groups, acid degradation studies and summary of sequential evidence". J. Am. Chem. Soc. ج. 79 ع. 11: 2807–2810. 1957. DOI:10.1021/ja01568a038.
- ^ "History of glucagon - Metabolism, insulin and other hormones - Diapedia, The Living Textbook of Diabetes". www.diapedia.org (بالإنجليزية). Archived from the original on 2017-03-27. Retrieved 2017-03-26.
انظر أيضاً
[عدل]- أجسام كيتونية.
- الكورتيزول.
- السكرى.
- ببتيد محرر للغاسترين.
- ببتيد بيتا النشواني .
- الأنسولين.
- جزر لانغرهانس.
- البنكرياس.
- بروغلوميد.
- كيناز التيروسين.
وصلات خارجية
[عدل]- يوفر PDBe-KB نظرة عامة على جميع معلومات الهيكل المتوفرة في PDB for Human Glucagon.
