سرطان الخلايا القاعدية
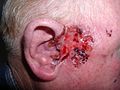
سرطان الخلايا القاعديّة(Basal-cell carcinoma) ، هو أحد أنواع سرطان الجلد، ويعد من أكثر أنواع مرض السّرطان شيوعاً في الولايات المتّحدة الأمريكيّة.[1] نادراً ما ينتشر إلى باقي الجسم أو يؤدّي إلى الموت. ومع ذلك، ما زال يعتبر هذا المرض خبيثاً؛ حيث أنّه يغزو الأنسجة المحيطة به مسبّباً دمارها وتشويهها.[2][3] إحصائيًا، في الولايات المتّحدة 3 من كل 10 أشخاص تقريباً من الشّعب القوقازيّ قد يصاب أثناء حياته بسرطان الخلايا القاعديّة.[4] ويعد الرّأس والرّقبة أكثر الأماكن عُرضة ً للإصابة، فقد تمّ العثور على هذه الخلايا السّرطانية في هذين الموقعين في 80% من الحالات.[4] وأظهرت الدّراسات أنّ هناك زيادة ملحوظة خلال السّنوات الأخيرة في الحالات المصابة بسرطان الخلايا القاعديّة في منطقة الجذع.[4]
| سرطان الخلايا القاعديّة | |
|---|---|
 A basal-cell سرطانة
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | سرطان الجلد، ومرض |
| الإدارة | |
| أدوية | |
| تعديل مصدري - تعديل | |
التّصنيف
[عدل]تم تقسيم سرطان الخلايا القاعديّة حسب النسيج
[عدل]- سرطان الخلايا القاعديّة العُقيدي أو التّقليدي

شائع في المناطق المعرّضة للشّمس من الرّأس والرّقبة.[7][8]:646–650
- سرطان الخلايا القاعديّة الكيسي: يظهر على شكل قبّة، وتظهر العقيدات الكيسيّة بلون أزرق-رمادي.[7]:748[8]:646
- سرطان الخلايا القاعديّة النّدبي أو morpheaform (morphoeic) basal-cell carcinoma: يتفاوت بعُدوانيته، ويمتاز بصفات سريريّة ونسيجيّة مميّزة.[8]:647
- سرطان الخلايا القاعديّة الارتشاحي: هو نوع عدواني، ويتميّز بالارتشاح العميق أي أنه يغزو الأنسجة المحيطة به.[8]:647
- سرطان الخلايا القاعديّة صغير العُقيدات: يمتاز بنمط نمو العُقيدات الصّغيرة.[8]:647
- سرطان الخلايا القاعديّة السّطحي أو سرطان الخلايا القاعديّة السّطحي متعدّد المراكز: يظهر غالباً في منطقة الجذع على شكل بقع حمراء على الجلد.[8]:647
- سرطان الخلايا القاعديّة المُصطبغ: يمتاز بنسبة تصبّغ عالية.[7]:748[8]:64780% من المصابين بسرطان الخلايا القاعديّة من الشّعب الصّيني تكون إصابته من هذا النّوع من المرض، وبالمقارنة مع الأشخاص ذوي البشرة البيضاء، فإنّ نسبة الإصابة بهذا النّوع تكون ضئيلة جداً.
- القَرْحة القارضة (قَرحة جاكوب):آفة جلديّة كبيرة من سرطان الخلايا القاعديّة العُقيدي حيث تمتاز بالنّخر المركزي.[7]:748[7]:748[8][8]:648 تستطيع كل أنواع مرض السّرطان تقريباً أن تنتقل وتنتشر عدا الورم الدّبقي (ورم خبيث يصيب الجهاز العصبي المركزي) والقَرحة القارضة.
- ورم بينكوس الظّهاري اللّيفي: شائع في منطقة أسفل الظّهر.[8]:648
- سرطان الخلايا القاعديّة السّليلاني: يمتاز بعُقيدات تنبت بشكل خارجي على الرّأس والرّقبة.[8]:648
- سرطان الخلايا القاعديّة المسامي: يشبه المسام الواسعة أو الحفر نجميّة الشّكل.[8]:648
- سرطان الخلايا القاعديّة الشّإذ: تكمن مشكلة هذا النّوع أنّ ليس هناك أي سبب واضح أو أي عامل مسرطن أدّى إليه، ويحدث بأماكن غريبة وغير مألوفة كالإبط، حلمة الثّدي، وعاء الخصيتين، الفرج والعِجان.[8]:648
وبشكل أبسط,
يمكن تقسيم سرطان الخلايا القاعديّة إلى 3 أنواع بناءً على موقعها وصعوبة علاجها
[عدل]- سرطان الخلايا القاعديّة السّطحي أو الموضعي:
يستجيب هذا النّوع بفعاليّة شديدة للعلاج الكيميائي الموضعي، إذ يعتبر الوحيد من أنواع سرطان الخلايا القاعديّة الذي يستجيب لمثل هذا النّوع من العلاج. ومن الأمثلة على الأدوية المستخدمة: ألدارا Aldara (imiquimod) والفلورويوراسيل fluorouracil)).
- سرطان الخلايا القاعديّة الارتشاحي:
يشمل نوعان: morpheaform وسرطان الخلايا القاعديّة صغير العُقيدات. يصعُب علاجه باستخدام طرق العلاج المحافظ مثل التّجفيف الكهربي والكشط أو باستخدام الكشط وحده.
-
سرطان الخلايا القاعديّة السّطحي
-
سرطان الخلايا القاعديّة الكيسي
-
سرطان الخلايا القاعديّة صغير العُقيدات
-
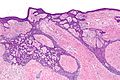
صورة مجهريّة لورم بينكوس الظّهاري اللّيفي (صبغة)H&E
العلامات والأعراض
[عدل]تظهر على المصابين بسرطان الخلايا القاعديّة عُقيدات لامعة لؤلؤيّة الشّكل. في حالة الإصابة بسرطان الخلايا القاعديّة السّطحي، قد تظهر بقع حمراء مثل التي تظهر في حالة الإصابة بالأكزيما. يزداد سمك الجلد وتظهر النُّدب (آثار الجروح) في كل من سرطان الخلايا القاعديّة الارتشاحي والنّدبي وبالتّالي يصعب التمييز بينهما دون اللّمس وعمل خزعة للجلد. وبشكل عام يصعب التمييز من خلال النّظر فقط بين سرطان الخلايا القاعديّة عن النّدب الناتجة عن حب الشّباب، وتنكّس النّسيج المرن السّفعي والتهابcryodestruction الحديث.
-
سرطان الخلايا القاعديّة العُقيدي
-
القَرْحة القارضة
في حوالي ثلثي الحالات المصابة بسرطان الخلايا القاعديّة، تكون الأماكن المصابة بالجسم هي نفسها الأماكن الأكثر تعرّضاً لأشعّة الشّمس. أمّا الثّلث الباقي، فتكون في الأماكن غير المعرّضة للشّمس، ممّا يؤكّد أنّ هناك عامل وراثي مؤثّر.
التّشخيص
[عدل]لتشخيص ودراسة الحالات المصابة بسرطان الخلايا القاعديّة يتم أخذ خزعة من الجلد، والطريقة الأكثر شيوعاً هي ال shave biopsy وتتم تحت التّخدير الموضعي، ويمكن تشخيص سرطان الخلايا القاعديّة العُقيدي سريريّاً، أمّا الأنواع الأخرى فيصعُب تمييزها عن الآفات الحميدة كالوحمة الجلديّة، الورم الغدّي الزّهمي، الحَطاطة اللّيفيّة، نُدب حب الشّباب المبكّرة والتّندّب الضّخامي.[9]
الفسيولوجيا المرضيّة
[عدل]
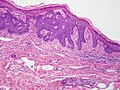
صورة مجهريّة لسرطان الخلايا القاعديّة تظهر الصّفات النّسيجيّة المميّزة (التّطويق المحيطي، سَدى مخاطيّة و (artefactual clefting باستخدام صبغة .H&E تتمايز الخلايا المصابة بسرطان الخلايا القاعديّة إلى خلايا جُرَيْبيّة، مُفْترَزة ودُهنيّة وتكوّن ما يسمّى بال trichoblast, وبالتّالي يصعب التّمييز بين هذا المرض وما يسمّى بالtrichoblastic carcinoma ؛ و هو مرض نادر وخبيث.[10] عدّ بعض العلماء سرطان الخلايا القاعديّة من أنواع ال trichoblastic carcinoma، ولكن لم يُتّفق على هذا التّصنيف إلى الآن.[11] ويُسبّب التّعرض المفرط لأشعّة الشّمس ما يسمّى بمَثْنَوي الثّايمين؛ شكل من أشكال تلف الحمض النّووي ينتج عن تكوّن روابط من نوع ثايمين-ثايمين. ويقوم الجسم عادةً بإصلاح ما يتلف من الحمض النّووي نتيجة التّعرض للأشعّة فوق البنفسجيّة، لكن لا تقوم طرق الإصلاح المختلفة بإزالة جميع الرّوابط التي تكونّت وسبّبت التّلف (مَثْنوي الثّايمين). يؤدّي تراكم التّلف إلى حدوث الطّفرة. وبصرف النّظر عن الطّفرات، التّعرض المفرط لأشعّة الشّمس يثبّط جهاز المناعة في الجسم ونتيجة لذلك فإنّ ذلك قد يقلّل من الرّقابة المناعيّة على الخلايا السّرطانيّة الجديدة. يمكن أن يتطوّر سرطان الخلايا القاعديّة نتيجة الإصابة بمتلازمة وحمة الخلايا القاعديّة (متلازمة غورلين)، وتمتاز هذه المتلازمة بتكلّس مِنْجل المُخ الذي يقع في منتصف الدماغ، تشوّه الأضلاع، إصابة الفك بأورام حميدة سنية المنشأ تسمّى keratocystic odontogenic tumors وظهور وَهْدات (انخفاضات طفيفة في الجلد) في راحة اليد وباطن القدم. وجود طفرة في جين PTCH1 وهو جين كابت يقع على كروموسوم رقم 9 وبالتّحديد على الموقع 9q22.3 و الذي يؤدّي إلى تثبيط ما يسمّى ب hedgehog signaling pathway والذي بدوره يؤدّي إلى الإصابة بالمتلازمة. ويمكن أن يصاب الإنسان بهذا السّرطان أيضاً في حال حدوث طفرة في جين SMO والذي يقوم أيضاً بتثبيط طريق الهيديهوج للإرسال hedgehog signaling pathway.[12]
الوقاية
[عدل]يُعد سرطان الخلايا القاعديّة سرطانًا جلديًا شائعًا، ويحدث بشكل كبير عند الأشخاص ذوي البشرة الفاتحة والذين يمتلكون تاريخًا عائليًا بالإصابة بهذا المرض. ولأنّ أشعّة الشّمس تُعد عاملًا مسبّبًا بثلثي الحالات، فإنّ الأطبّاء ينصحون باستخدام واقي الشّمس بحيث لا يقل عامل الوقاية الشّمسي فيه عن 30. أمّا بالثّلث الباقي من الحالات فلا علاقة للشّمس بها ممّا يدل على أنّ هناك عاملًا مسبّبًا آخر. استخدام العلاج الكيميائي مثل ألدارا Aldara (imiquimod) و فلورويوراسيل fluorouracil يُمكن أن يمنع تطوّر أي سرطان جلدي. ويُنصح الأشخاص الذين يتعرّضون لأشعّة الشّمس بشكل واسع، والذين لديهم تاريخ عائلي بالإصابة بمختلف أنواع سرطان الجلد مصابين بأي مرض جلدي قد يتحوّل إلى سرطان مثل التَّقران الشّمسي، باستخدام هذا النّوع من العلاج. ويتم تكرار هذا العلاج كل 2-3 سنين بهدف التّقليل من عُرضة الإصابة بأي سرطان جلدي. العلاج تستخدم كل من الأساليب التّإليه في علاج سرطان الخلايا القاعديّة:
1-الاستئصال الجراحي القياسي (Standard surgical excision)
[عدل]هي الطريقة الأكثر استخداماً لعلاج معظم أنواع سرطان الخلايا القاعديّة. وتتم إما من خلال تجميد النّسيج (تفحّص النسيج بعد تجميده) أو باستخدام البارافين. ويستخدم الجرّاحون المنظار الجلدي (dermatoscope) لرؤية الورم بجميع حوافّه وأجزائه التي لا يمكن رؤيتها بالعين المجردّة.[13][14] وتعتمد نسبة الشّفاء سواء أكان من قام بالعمليّة جرّاح عام، طبيب أذن وأنف وحنجرة، جرّاح متخصّص في الرّأس والرّقبة، جرّاح تجميلي، جرّاح متخصّص في الوجه والفكّين أو طبيب جلديّة، على الجزء الذي يتمّ استئصاله وإزالته من الجلد. كلّما قلّ قُطر أو عرض المنطقة المُستأصلة والتي تشمل الجلد المصاب (الورم) والجلد السّليم حوله الذي لا تظهر عليه أي أعراض (حواف الورم)، زادت احتماليّة الإصابة مرّة أخرى بالمرض.[15][16][17][18] إذا كان عرض الجلد السّليم الذي يتم إزالته في حال كان الورم صغيرًا (أقل من 6 مم) يساوي 4 مم أو 6 مم في حال كان الورم كبيرًا (أكبر من 6 مم)، تكون نسبة الشّفاء عالية جداً وقد تصل إلى 95% أو أكثر.[19][20][21][22][23][24] ولأسباب تجميليّة، يقوم بعض الجرّاحين بإزالة 1-2 مم فقط من الجلد السّليم، [25] وخاصّة إذا كانت العمليّة تشمل منطقة من الوجه. وبالتّالي يصل معدّل تكرار الإصابة إلى 38% في هذه الحالات حتى لو بيّن تقرير المرض أن الهوامش خالية من بقايا الورم، إذ يعتبر هذا التّقرير غير دقيق.[21][25][26][27] يعد الاستئصال الجراحي القياسي معيار معدّل تكرار المرض، حيث أنّه وبسبب ضعف هذا الاستئصال في علاج سرطان الخلايا القاعديّة في منطقة الوجه لأسباب تجميليّة، فإنّ معدل التّكرار وعودة المرض عالي جداً خاصّة إذا كانت الإصابة حول الجفون،[26] في منطقة الأنف والأماكن المميّزة في الوجه.[28] هناك رسم تخطيطي في صفحة 38 في بيان قام بنشره تحالف يسمّى بNational Comprehensive Cancer Network يُظهر أنّ معظم مناطق الوجه تعاني من معدّل تكرار عالٍ عدا الجبهة العليا والخد المركزي.[19][29] وفي حال عودة الإصابة بعد العمليّة الجراحيّة والاستئصال، يتم إجراء جراحة خاصّة للتّحكم بالورم يطلق عليها التقييم الكامل الكفي الطرفي والعميق Complete Circumferential Peripheral And Deep Margin [29][30])[31] Assessment أو CCPDMA وبالتّحديد عن طريق تجميد النّسيج والذي يضم جراحة موس[32][33] (Mohs surgery).
التّحكم بعرض الجلد السّليم الذي يتم التّخلص منه عن طريق دراسة النّسيج بعد تجميده (تجميد النّسيج)، يزيد من نسبة الشّفاء ويقلل من معدّل التّكرار في نفس اليوم الذي تقام به الجراحة مثل استخدام جراحة موس.[34] إذا قام بعمليّة الاستئصال القياسي جرّاح تجميلي أو طبيب جلديّة في العيادات الخاصّة فإنه يتم إرسال عيّنة من النّسيج المُستأصل إلى المختبرات الخارجيّة لتقوم بما يسمّى بال.[35] Bread Loafing Method.بهذه الطّريقة يتم تفحّص أقل من 5% من الجلد السّليم من العيّنة؛ حيث أنه يتم تقسيم النّسيج (العينّة) إلى قطع صغيرة سمك كل منها 6 ميكرومتر. من النّسيج المصاب يتم الحصول على 3-4 عيّنات، ومن العيّنة يتم الحصول على 3-4 قطع. توضع العيّنة قبل تقسيمها إلى قطع في وسط متجمّد أو في البارافين. (أنظر للشّكل 2 الموجود في المراجع[36]).
في حال ثبت وجود الورم فإن المريض في خيارين؛ إما أن يتم استئصاله عن طريق أحد طرق ال CCPDMA أو إذا كانت الإصابة بالوجه باستخدام.[19] Bread Loafing Method.وفي الحالتين يجب على أخصّائي الأمراض أن يقسم العيّنة إلى مقاطع صغيرة للتقليل من نسبة وجود الخطأ. أو ببساطة ينبغي معالجة النّسيج بطرق تشبه جراحة موس (يوجد لها شرح في معظم كتب أساسيّات علم أمراض الأنسجة أو في هذا المرجع [32] وللأسف، تعد هذه الطّرق صعبة ومملّة عندما تتجمّد العينّات. قد يحتاج الجرّاح أن ينتظر أسبوعًا على الأقل ظهور نتيجة فصح عينّات الورم بسبب استخدامه المختبرات الخارجيّة، وفي حال كان هناك بقايا للورم أو أنّ عرض المنطقة المستأصلة غير كافٍ،[37] يقوم الجرّاح بتبليغ المريض من أجل القيام بجراحة أخرى. وفي دراسة مطبوعة عن كيفيّة التّعامل مع سرطان الخلايا القاعديّة جرَت في عام 2008م، تبيّنّ أنّ الاستئصال هو أفضل حل لعلاج الأورام البدائيّة.[38]
2-جراحة موس (جراحة موس المجهريّة)
[عدل]سميّت بهذا الاسم نسبةً إلى العالم فريدريك موس الذي اكتشفها عام 1940م.[38] وتمتاز بإجراءاتها التي تتم بالعيادات الخارجيّة حيث لا يحتاج المريض إلى المكوث في المستشفى. وتعد إحدى أنواع ال CCPDMA؛ أفضل طريقة للتّخلص من أي سرطان يصيب الجلد، حيث تعتمد على تفحّص نسيج العينّات بعد تجميدها. يتم إستئصال الورم في البداية، وقبل إغلاق الجرح وإنهاء العمليّة، يجب دراسة ما تم استئصاله تحت المجهر للتّأكد من أن حواف الورم وقاعدته قد تم إزالتها بالكامل. يمكن استخدام هذه الطريقة لعلاج سرطان الخلايا الحرشفيّة، ولكن لا تكون نسبة الشّفاء وفعاليّتها كما هي في حال استخدامها في علاج سرطان الخلايا القاعديّة. وفي الدّراسة التي أُجريت في عام 2008م، تمّ العثور على أنّ جراحة موس هي الخيار الأفضل لعلاج سرطان الخلايا القاعديّة الابتدائي والذي تكون احتماليّة عودته والإصابة به مرة أخرى عالية.[38]
3-المعالجة الكيميائيّة
[عدل]تستجيب بعض أنواع السّرطان السّطحي إلى المعالجة الموضعيّة باستخدام ال 5-فلورويوراسيل 5-fluorouracil؛ وهو عامل يستخدم في العلاج الكيميائي. استخدام كريم ايميكويمود Imiquimod)) بتركيز 5% خمس مرّات بالأسبوع لمدّة ستة أسابيع كاملة كعلاج موضعي يساهم بالتّقليل أو حتى بالتّخلّص من سرطان الخلايا القاعديّة بنسبة 70-90%. وقد حصل كل من ال5-فلورويوراسيل (5-fluorouracil) والايميكويمود ((Imiquimod على موافقة ال FDA، حيث حصل الايميكويمود (Imiquimod) أيضاً على موافقة من وكالة الأدوية الأوروبية كعلاج موضعي لعلاج سرطان الخلايا القاعديّة صغير الحجم.[38] تمّ وقف استخدام ايميكويمود (Imiquimod) لعلاج سرطان الخلايا القاعديّة العُدواني الذي يغزو الجسم. ويمكن استخدام الايميكويمود (Imiquimod) قبل إجراء العمليّة الجراحيّة بهدف التّقليل من حجم السّرطان، ويجب على المريض أن يتوقّع حدوث التهاب نتيجة استخدام هذا النّوع من العلاج.[39] ولأنّ إزالة بقايا الورم السّطحيّة باستخدام العمليّات الجراحيّة يؤدي إلى ظهور عيوب جراحيّة يصعب إصلاحها أو إخفائها، يستخدم العلاج الكيميائي عادةً بعد القيام بجراحة موس للتّخلص من البقايا السّطحيّة للسّرطان بعدما تمّ إزالة الجزء المنتشر، ولكن يدعو البعض للتّخلص من الجزء السّطحي من السّرطان باستخدام الايميكويمود Imiquimod)) قبل إجراء الجراحة.[40] ويبدأ المريض إكمال العلاج باستخدام ايميكويمود (Imiquimod) أو 5-فلورويوراسيل (5-fluorouracil) بعد إجراء العمليّة بشهر على الأقل لضمان التئام الجرح. ويفضّل البعض القيام بعمليّة الكحت قبل المعالجة الكيميائيّة. هذه الإجراءات التّجريبيّة لا تمثّل الرّعاية النّموذجيّة. أكدّت الدّراسة التي جرت عام 2008م فاعليّة استخدام الايميكويمود (Imiquimod) كعلاج موضعي لسرطان الخلايا القاعديّة السّطحي الابتدائي، وبيّنت أيضاً أنّه من الممكن أن يكون لهذا الدّواء دور في علاج سرطان الخلايا القاعديّة العُقيدي الابتدائي.[38]
4-المعالجة المناعيّة
[عدل]تشير الأبحاث أنّ العلاج باستخدام عشبة الفربيون بلبوس Euphorbia peplus؛ من الأعشاب الشّائعة وإحدى أنواع عشبة الفربيون، قد تكون فعّآلة[41].وتحاول شركة تسمّى ب [42] Australian biopharmaceutical company peplin أن تطوّر العلاج باستخدام هذه العشبة بحيث يصبح علاجًا موضعيًا. استخدام الايميكويمود (Imiquimod) يعد أحد طرق المعالجة المناعيّة ولكن يتم وضعه مع المعالجة الكيميائيّة.
5-الإشعاع
[عدل]تُقسم إلى قسمين: العلاج بالإشعاع الخارجي والعلاج بالإشعاع الدّاخلي (المعالجة الكَثبيّة). يستخدم هذا النّوع لعلاج المرضى كبار السّن غير القادرين على تحمّل العمليّات الجراحيّة، في حال كان الاستئصال من مناطق قد تصاب بتشوّهات نتيجة العمليّة ويصعب إعادتها إلى ما كانت عليه كطرف الأنف (ذِروة الأنف) وحواف فتحتيه، إذا كان قد قام المريض بعمليّة استئصال سابقة ولكن كانت غير كاملة أو بيّن تقرير المرض أنّ هناك نسبة تكرار عالية وأخيراً إذا كانت العمليّة الجراحيّة ستقوم بإيذاء أجزاء مهمّة كالأعصاب. يتراوح عدد جلسات العلاج الإشعاعي من 5-25 جلسة؛ كلمّا زاد عدد الجلسات، قلّ الضّرر الذي يلحق بالأنسجة المحيطة بالورم والدّاعمة له. تصل نسبة الشّفاء إلى 95% إذا كان الورم صغيرًا، وإلى ما يقارب 80% إذا كان الورم كبير. إذا عاد الورم بعد العلاج الإشعاعي فإنه يتم التّخلص منه باستخدام الجراحة وليس الإشعاع مرّة أخرى؛ حيث أن استخدام الإشعاع سيؤدي إلى تدمير المزيد من النّسيج السّليم كما أنّه من الممكن أن يكون الورم مقاوماً للإشعاع. يُمنع استخدام العلاج الإشعاعي لعلاج متلازمة سرطان الخلايا القاعديّة الوحمانيّة (سرطان الخلايا القاعديّة الذي تطوّر عن متلازمة وحمة الخلايا القاعديّة). وفي الدّراسة التي جرت عام 2008م تبيّن أن هذا العلاج يستخدم لسرطان الخلايا القاعديّة الابتدائي أو المتكرّر، ولا يستخدم في حال عودة الورم بعد العلاج الإشعاعي.[38]
6-المعالجة الضّوئيّة
[عدل]طريقة جديدة لعلاج سرطان الخلايا القاعديّة، وتتم من خلال تسليط محسّسات ضوئيّة على المنطقة المستهدفة. يقوم الضّوء بتنشيط هذة المحسّسات فتتحوّل إلى جزيئات سامّة تقوم بتدمير الهدف. هناك دواء يسّمى ميثيل امينوفيولينيت Methyl aminolevulinate حصل على موافقة الاتحاد الأوروبي كمحسّس ضوئي في 2001م. تستخدم المعالجة الضّوئيّة أيضاً مع أنواع أخرى من سرطان الجلد.[43] بيّنت الدّراسة التي جرت في عام 2008م كل من: المعالجة الضّوئيّة تعد علاجاً مناسباً لسرطان الخلايا القاعديّة السّطحي الابتدائي، يمكن استخدامها لعلاج سرطان الخلايا القاعديّة العُقيدي قليل الخطر وتعتبر اختيارًا ضعيفًا في حالات الآفات شديدة الخطورة.[38]
7-الجراحة البرديّة (الجراحة بالبرودة الشّديدة)
[عدل]طريقة قديمة لعلاج مختلف أنواع سرطان الجلد. يمكن الحصول على درجة شفاء عالية عند استخدامها بدقّة مع مسبار درجة الحرارة وأدوات المعالجة بالبرد. ويوجد لهذا العلاج سلبيات كثيرة كصعوبة التّحكم بحواف الورم، قد يكون العلاج غير كافٍ أو زائدًا عن المطلوب، ويسبب موت النّسيج وي}دي إلى طول فترة الشّفاء. عموماً، هناك بيانات كافية تثبت أنّ الجراحة البرديّة علاج مناسب لسرطان الخلايا القاعديّة ولكن لا يوجد دراسات متوافرة قامت بالمقارنة بين الجراحة البرديّة والطّرق الأخرى للعلاج كجراحة موس، الاستئصال أو التّجفيف الكهربي والكشط، وبالتّالي لا يمكن معرفة مدى فاعليّة هذه الجراحة بالمقارنة مع الطّرق الأخرى. بالإضافة أنه لا يوجد أي دليل يوضّح مدى فاعليّة استخدام الكشط قبل القيام بهذه الجراحة لتحسين العلاج.[44] العديد من الكتب تحدّثت عن الجراحة البرديّة ولكن القليل من الأطبّاء يتّبعونها في العلاج.[45]
8-التّجفيف الكهربي والكحت
[عدل]تُعرف أيضاً باسم الكحت والكي أو عمليّة الكحت،[38] ويتم استخدام سكّين مستدير أو مِكحت لإزالة الجزء الرّخو من السّرطان. بعدها يتم حرق الجلد باستخدام تيّار كهربائي حيث بذلك يُصبح الجلد أكثر رخاوة وبالتّالي يمكن للسّكين أن تزيل الجلد المصاب على عمق أكبر (الطّبقة التّإليه من عمليّة الكحت). تُكرّر هذه الدّورة من 3-5 مرّات مع المحافظة على سلامة الجلد السّليم حول الورم من الكحت حيث يتم التّخلص فقط من 4-6 مم من الهوامش السّليمة. تعتمد نسبة الشّفاء بشكل كبير على المُستخدم (الطّبيب) بالإضافة إلى حجم ونوع الورم. يصعب التّخلص من سرطان الخلايا القاعديّة الارتشاحي وال morpheaform بهذه الطّريقة. يمكن استخدامها في المناطق المخفيّة من الجسم كالجذع بحيث لا يوجد عمليّات تجميليّة تخفي أثرها. يرى بعض الأطبّاء أنّه ومن المقبول استخدام هذه الطّريقة على وجه كبار السّن الذين تجاوزوا السبعين عاماً، ولكن مع ارتفاع متوسط العمر المتوقّع لا يمكن اعتماد هذا المعيار الموضوعي. ويمكن لنسبة الشّفاء أن تختلف اعتماداً على مدى عُدوانيّة التّجفيف الكهربي والكحت والهوامش المعالجة (كميّة الهوامش السّليمة التي يتم التّخلص منها). يؤيّد البعض استخدام الكحت وحده بدون التّجفيف الكهربي حيث أنّ نسبة الشّفاء تبقى ثابتة.[46] سيقوم الطّبيب المعالج باختيار إحدى هذه الطرق على أنّها الأفضل للعلاج تبعاً لحجم الورم، موقعه، عمر المريض وغيرها من المتغيّرات.
9- باستخدام دواء يسمّى فيسموديجيب Vismodegib))
[عدل]تمّ اعتماده في عام 2012م. Erivedge هو الاسم التّجاري له، ولقد استخدم هذا الدّواء لعلاج الحالات المتقدّمة من سرطان الخلايا القاعديّة.[47]
التّشخيص
[عدل]يعتبر تشخيص المرض ممتازاً إذا تم استخدام الطّريقة المناسبة للعلاج في المراحل الأولى لسرطان الخلايا القاعديّة (ما زال سرطانًا ابتدائيًا). أمّا إذا كان السّرطان من النّوع الذي يتكرّر، يكون علاجه صعباً واحتمال تكراره وعودته عالٍ بحيث لا تمنع طريقة العلاج تكراره. وبالرّغم من ندرة انتشار سرطان الخلايا القاعديّة إلى باقي الجسم، إلا أنّه قادر على النّمو وغزو الأنسجة المجاورة له وتدميرها. وقد يؤثر غزو السّرطان على أنسجة حيويّة ومهمّة مثل الأعصاب مسبّباً فقدان الإحساس أو فقدان الأعضاء قدرتها على القيام بوظيفتها أو يؤدي إلى الموت في حالات نادرة. في الغالبيّة العظمى من الحالات، يتم العلاج بنجاح قبل تطوّر أي مضاعفات خطيرة. تتراوح نسبة تكرار المرض في حال استخدام طرق العلاج السّابقة من 1-50% أو أقل. علم الأوبئة سرطان الخلايا القاعديّة يعد أكثر أنواع سرطان الجلد شيوعاً. إنّ الأشخاص ذو البشرة الفاتحة الذين لديهم تاريخ عائلي بالإصابة بهذا المرض هم الأكثر عرضة للإصابة، وتزداد نسبة انتشاره في المناطق القريبة من خط الاستواء والمناطق المرتفعة. وحسب دراسات قامت بها مؤسسة سرطان الجلد(Skin Cancer Foundation) ، فإن هنالك [48] 800000 حالة جديدة سنوياً في الولايات المتّحدة الأمريكيّة. 30% من الشّعب القوقازي يصاب بسرطان الخلايا القاعديّة أثناء حياته. يصاب شخص من كل 7 أشخاص في كندا بسرطان الخلايا القاعديّة، إذ يشكّل هذا النّوع ثلث الحالات التي يتم تشخيصها بالإصابة بمرض السّرطان.[4] In Canada, the most common skin cancer is basal cell carcinoma (as much as one third of all cancer diagnoses), affecting 1 in 7 individuals over a lifetime.[49][50]
معظم الإصابات المتفرّقة بسرطان الخلايا القاعديّة تظهر بعدد قليل على الجلد المعرّض للشّمس عند الأشخاص فوق سن الخمسين، ويمكن للشّباب أيضاً أن يصابوا بهذا المرض. الإصابة بسرطان الخلايا القاعديّة في عمر صغير يعد مؤشّر على وجود متلازمة سرطان الخلايا القاعديّة الوحمانيّة (متلازمة غورلين).[51]
المراجع
[عدل]- ^ Basal cell carcinoma نسخة محفوظة 05 يوليو 2016 على موقع واي باك مشين.
- ^ مدلاين بلس Basal cell carcinoma
- ^ "Basal Cell Carcinoma - Symptoms, Treatment and Prevention". مؤرشف من الأصل في 2012-12-26.
- ^ ا ب ج د Wong CS, Strange RC, Lear JT (أكتوبر 2003). "Basal cell carcinoma". BMJ. ج. 327 ع. 7418: 794–8. DOI:10.1136/bmj.327.7418.794. PMC:214105. PMID:14525881.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Drug Indications Extracted from FAERS، DOI:10.5281/ZENODO.1435999، QID:Q56863002
- ^ Inxight: Drugs Database، QID:Q57664317
- ^ ا ب ج د ه Freedberg, et al. (2003). Fitzpatrick's Dermatology in General Medicine. (6th ed.). McGraw-Hill. ISBN 0-07-138076-0.
- ^ ا ب ج د ه و ز ح ط ي يا يب يج James, William D.; Berger, Timothy G.؛ وآخرون (2006). Andrews' Diseases of the Skin: clinical Dermatology. Saunders Elsevier. ISBN:0-7216-2921-0.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Basal Cell Cancer: What Is It نسخة محفوظة 9 فبراير 2019 على موقع واي باك مشين.
- ^ Laffay L, Depaepe L, d'Hombres A, Balme B, Thomas L, De Bari B (2012). "Histological features and treatment approach of trichoblastic carcinomas: from a case report to a review of the literature". Tumori. ج. 98 ع. 2: 46e–49e. DOI:10.1700/1088.11948. PMID:22678003.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Basal Cell Carcinoma - Derm101 نسخة محفوظة 24 يوليو 2017 على موقع واي باك مشين.
- ^ Epstein EH, Shepard JA, Flotte TJ (يناير 2008). "Case records of the Massachusetts General Hospital. Case 3-2008. An 80-year-old woman with cutaneous basal-cell carcinomas and cysts of the jaws". N Engl J Med. ج. 358 ع. 4: 393–401. DOI:10.1056/NEJMcpc0707893. PMID:18216361.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Scalvenzi M, Lembo S, Francia MG, Balato A (أكتوبر 2008). "Dermoscopic patterns of superficial basal cell carcinoma". Int. J. Dermatol. ج. 47 ع. 10: 1015–8. DOI:10.1111/j.1365-4632.2008.03731.x. PMID:18986346.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Cuellar F, Vilalta A, Puig S, Palou J, Zaballos P, Malvehy J (سبتمبر 2008). "Dermoscopy of early recurrent basal cell carcinoma". Arch Dermatol. ج. 144 ع. 9: 1254. DOI:10.1001/archderm.144.9.1254. PMID:18794487.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Maloney ME؛ وآخرون (1999). Surgical Dermatopathology. Cambridge, MA: Blackwell Publishers. ص. 110. ISBN:0-86542-299-0.
- ^ Kimyai-Asadi A, Katz T, Goldberg LH؛ وآخرون (ديسمبر 2007). "Margin involvement after the excision of melanoma in situ: the need for complete en face examination of the surgical margins". Dermatol Surg. ج. 33 ع. 12: 1434–9, discussion 1439–41. DOI:10.1111/j.1524-4725.2007.33313.x. PMID:18076608.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Mosterd K, Krekels GA, Nieman FH؛ وآخرون (ديسمبر 2008). "Surgical excision versus Mohs' micrographic surgery for primary and recurrent basal-cell carcinoma of the face: a prospective randomised controlled trial with 5-years' follow-up". Lancet Oncol. ج. 9 ع. 12: 1149–56. DOI:10.1016/S1470-2045(08)70260-2. PMID:19010733.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Kimyai-Asadi A, Goldberg LH, Jih MH (سبتمبر 2005). "Accuracy of serial transverse cross-sections in detecting residual basal cell carcinoma at the surgical margins of an elliptical excision specimen". J. Am. Acad. Dermatol. ج. 53 ع. 3: 469–74. DOI:10.1016/j.jaad.2005.02.049. PMID:16112355.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ا ب ج https://web.archive.org/web/20090227133305/http://www.nccn.org/professionals/physician_gls/PDF/nmsc.pdf. مؤرشف من الأصل (PDF) في 2009-02-27.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - ^ Silverman MK, Kopf AW, Bart RS, Grin CM, Levenstein MS (يونيو 1992). "Recurrence rates of treated basal cell carcinomas. Part 3: Surgical excision". J Dermatol Surg Oncol. ج. 18 ع. 6: 471–6. DOI:10.1111/j.1524-4725.1992.tb03307.x. PMID:1592998.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ا ب Wolf DJ, Zitelli JA (March 1987). "Surgical margins for basal cell carcinoma". Arch Dermatol. ج. 123 ع. 3: 340–4. DOI:10.1001/archderm.123.3.340. PMID:3813602. مؤرشف من الأصل في 25 مايو 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Skin Malignancies, Squamous Cell Carcinoma في موقع إي ميديسين
- ^ Staub G, Revol M, May P, Bayol JC, Verola O, Servant JM (Oct 2008). "[Excision skin margin and recurrence rate of skin cancer: a prospective study of 844 cases]". Ann Chir Plast Esthet (بالفرنسية). 53 (5): 389–98. DOI:10.1016/j.anplas.2007.07.015. PMID:17961898.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "1) Basal Cell Carcinoma : BC Cancer Agency". مؤرشف من الأصل في 3 أبريل 2015. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ ا ب Griffiths RW, Suvarna SK, Stone J (2007). "Basal cell carcinoma histological clearance margins: an analysis of 1539 conventionally excised tumours. Wider still and deeper?". J Plast Reconst Aesthet Surg. ج. 60 ع. 1: 41–7. DOI:10.1016/j.bjps.2006.06.009. PMID:17126265.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ا ب Sigurdsson H, Agnarsson BA (أغسطس 1998). "Basal cell carcinoma of the eyelid. Risk of recurrence according to adequacy of surgical margins". Acta Ophthalmol Scand. ج. 76 ع. 4: 477–80. DOI:10.1034/j.1600-0420.1998.760416.x. PMID:9716337.
- ^ Hauben DJ, Zirkin H, Mahler D, Sacks M (يناير 1982). "The biologic behavior of basal cell carcinoma: analysis of recurrence in excised basal cell carcinoma: Part II". Plast. Reconstr. Surg. ج. 69 ع. 1: 110–6. DOI:10.1097/00006534-198269010-00018. PMID:7053498.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Farhi D, Dupin N, Palangié A, Carlotti A, Avril MF (أكتوبر 2007). "Incomplete excision of basal cell carcinoma: rate and associated factors among 362 consecutive cases". Dermatol Surg. ج. 33 ع. 10: 1207–14. DOI:10.1111/j.1524-4725.2007.33255.x. PMID:17903153. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ا ب https://web.archive.org/web/20130524223654/http://www.ncri.ie/atlas/Non-melanoma%20skin%20cancer.pdf. مؤرشف من الأصل (PDF) في 24 مايو 2013. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) والوسيط|title=غير موجود أو فارغ (مساعدة) - ^ http://www.nccn.org/professionals/physician_gls/PDF/nmsc.pdf pages 6 and 7 نسخة محفوظة 2009-02-27 على موقع واي باك مشين.
- ^ Dhingra N, Gajdasty A, Neal JW, Mukherjee AN, Lane CM (يونيو 2007). "Confident complete excision of lid-margin BCCs using a marginal strip: an alternative to Mohs' surgery". Br J Ophthalmol. ج. 91 ع. 6: 794–6. DOI:10.1136/bjo.2006.109892. PMC:1955612. PMID:17229804.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ ا ب Bentkover SH, Grande DM, Soto H, Kozlicak BA, Guillaume D, Girouard S (2002). "Excision of head and neck basal cell carcinoma with a rapid, cross-sectional, frozen-section technique". Arch Facial Plast Surg. ج. 4 ع. 2: 114–9. DOI:10.1001/archfaci.4.2.114. PMID:12020207. مؤرشف من الأصل في 25 مايو 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Minton TJ (أغسطس 2008). "Contemporary Mohs surgery applications". Current Opinion in Otolaryngology & Head and Neck Surgery. ج. 16 ع. 4: 376–80. DOI:10.1097/MOO.0b013e3283079cac. PMID:18626258. مؤرشف من الأصل في 2020-01-03.
- ^ Nagore E, Grau C, Molinero J, Fortea JM (مارس 2003). "Positive margins in basal cell carcinoma: relationship to clinical features and recurrence risk. A retrospective study of 248 patients". J Eur Acad Dermatol Venereol. ج. 17 ع. 2: 167–70. DOI:10.1046/j.1468-3083.2003.00535.x. PMID:12705745. مؤرشف من الأصل في 2020-03-01.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Lane JE, Kent DE (2005). "Surgical margins in the treatment of nonmelanoma skin cancer and mohs micrographic surgery". Curr Surg. ج. 62 ع. 5: 518–26. DOI:10.1016/j.cursur.2005.01.003. PMID:16125611.
- ^ Maloney ME؛ وآخرون (1999). "Determining Cancer at Surgical margin". Surgical Dermatopathology. Cambridge, MA: Blackwell Publishers. ص. 113. ISBN:0-86542-299-0.
- ^ "Physician Perceptions and Expectations of Cytology and Surgical Pathology Turn Around Time (TAT)". مؤرشف من الأصل في 2011-09-28.
- ^ ا ب ج د ه و ز ح Telfer, N R, Colver, G B and Morton, C A (2008). "Guidelines for the management of basal cell carcinoma". British Journal of Dermatology, 159 pp. 35-48.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ [1] "نسخة مؤرشفة". مؤرشف من الأصل في 2011-12-03. اطلع عليه بتاريخ 2011-06-16.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Butler DF, Parekh PK, Lenis A (يناير 2009). "Imiquimod 5% cream as adjunctive therapy for primary, solitary, nodular nasal basal-cell carcinomas before Mohs micrographic surgery: a randomized, double blind, vehicle-controlled study". Dermatol Surg. ج. 35 ع. 1: 24–9. DOI:10.1111/j.1524-4725.2008.34378.x. PMID:19018814.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "Peplin's skin cancer gel trial a success". The Age. Melbourne. 1 مايو 2006. مؤرشف من الأصل في 2017-04-25.
- ^ Peplin نسخة محفوظة 02 يناير 2014 على موقع واي باك مشين.
- ^ Peng Q, Juzeniene A, Chen J؛ وآخرون (2008). "Lasers in Medicine". Rep. Prog. Phys. ج. 71 ع. 56701: 056701. DOI:10.1088/0034-4885/71/5/056701.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Kokoszka A, Scheinfeld N (يونيو 2003). "Evidence-based review of the use of cryosurgery in treatment of basal cell carcinoma". Dermatol Surg. ج. 29 ع. 6: 566–71. DOI:10.1046/j.1524-4725.2003.291511.x. PMID:12786697.
- ^ Cryosurgery for Nonmelanoma Skin Cancer نسخة محفوظة 15 يوليو 2017 على موقع واي باك مشين.
- ^ Barlow JO, Zalla MJ, Kyle A, DiCaudo DJ, Lim KK, Yiannias JA (يونيو 2006). "Treatment of basal cell carcinoma with curettage alone". J. Am. Acad. Dermatol. ج. 54 ع. 6: 1039–45. DOI:10.1016/j.jaad.2006.01.041. PMID:16713459.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "Vismodegib, First Hedgehog Inhibitor, Approved for BCC Patients". مؤرشف من الأصل في 2019-04-16.
- ^ Skin Cancer Foundation: Basal Cell Carcinoma نسخة محفوظة 16 أكتوبر 2008 على موقع واي باك مشين.
- ^ "3a.05 Epidemiology of Skin Cancer : BC Cancer Agency". مؤرشف من الأصل في 2 يونيو 2012. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ CCO نسخة محفوظة 08 يوليو 2017 على موقع واي باك مشين.
- ^ Gorlin, R J, (2004) "Nevoid basal cell carcinoma (Gorlin) Syndrome", Genetic Medicine 6: pp. 530-539.