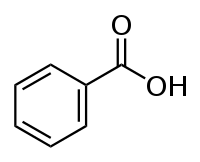
حمض البنزويك
| حمض البنزويك | |
|---|---|
| الاسم النظامي (IUPAC) | |
Benzoic acid |
|
| أسماء أخرى | |
حمض البنزويك |
|
| المعرفات | |
| رقم CAS | 65-85-0 |
| بوب كيم (PubChem) | 243 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C7H6O2 |
| الكتلة المولية | 122.12 غ/مول |
| المظهر | بلورات عديمة اللون |
| الكثافة | 1.32 غ/سم3 |
| نقطة الانصهار | 122.4 °س |
| نقطة الغليان | 249 °س |
| الذوبانية في الماء | ضعيف الانحلال في الماء |
| الذوبانية | ينحل في الكلوروفورم |
| حموضة (pKa) | 4.204 [3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض البنزويك هو حمض كربوكسيلي عطري عضوي له الصيغة الكيميائية C7H6O2 أو C6H5COOH، وهو أبسط الأحماض الكربوكسيلية العطرية.[4]
الخواص[عدل]
ينصهر في درجة 122 س، ويغلي في درجة 250.
التحضير[عدل]
صناعياً يحضر حمض البنزويك من أكسدة التولوين بوجود حفاز من الكوبالت أو من نفثينات المنغنيز.

تفاعلاته[عدل]

الاكتشاف[عدل]

اكتـُشف حمض البنزويك في القرن السادس عشر. التقطير الجاف للبنزوين الراتنجي وصفه لأول مرة نوستراداموس (1556)، ثم تبعه ألكسيوس پدمونتانوس (1560) وبليز ڤيگنير (1596). يوستوس فون لايبگ وفريدريش ڤولر حددا بنية حمض البنزويك في 1832، كما بحثا في كيفية ارتباط حمض الهيپوريك بحمض البنزويك. وفي 1875، اكتشف سالكوسكي القدرات المضادة للفطريات لحمض البنزويك، والتي اُستـُخدِمت لزمن طويل في حفظ فواكه التوت البري المحتوية على البنزوات. لقد عرف التأثير الحافظ لحمض البنزويك لأول مرة بواسطة العالم H. FLECK في عام 1875 الذي حاول إيجاد بديل لحمض الساليسيليك، وهذا العالم هو الذي ربط بين فاعلية كل من الحامضين وفاعلية الفينولات ولم يكن إنتاج حمض البنزويك بكميات كبيرة متاحاً بشكل صناعي، لذا فإن استخدامه في حفظ الأغذية بدأ فقط مع بداية القرن الماضي حيث أصبح من أكثر المواد الحافظة استخداماً على مستوى العالم بأسره. يستخدم حمض البنزويك في صورته الطبيعية ومن المعروف أن هذا الحمض يوجد بشكل طبيعي في بعض الأغذية كالتوت البري، كما يمكن استخدامه على صورة أملاح الصوديوم أو البوتاسيوم أو الكالسيوم، أما البنزوات على هيئة بارا هيدروكسي بنزوات الصوديوم فهي أكثر فعالية من أملاحه سابقة الذكر، كذلك تعد أسترات البارا هيدروكسي بنزوات ( ميثيل – بروبيل – بيوتيل ) أكثر تأثيراً من الباراهيدروكسي بنزوات.
الاستخدام الصيدلاني[عدل]
عامل حافظ مضاد للكائنات الحية الدقيقة، عامل علاجي، يستخدم حمض البنزوئيك بشكل واسع في المستحضرات التجميلية والأغذية والأشكال الصيدلانية كمادة حافظة وتظهر فعاليته العظمى في درجة PH (2.5-4.5)، واستخدم كذلك من أمد بعيد كمضاد فطري في المستحضرات موضعية التطبيق مثل مرهم وايت فيلد White field ( حمض البنزوئيك 0.66 ، حمض الساليسيليك 0.03).[5]
التأثير على صحة الجسم[عدل]
بعد تناول حمض البنزوئيك يرتبط مع الغليسرين في الكبد ليُشكل حمض بول الخيل hippuric acid الذي بدوره يُطرح مع البول فيما بعد. يُعد حمض البنزوئيك مخرشاً معوياً جلدياً خفيفاً وكذلك مخرشاً عينياً خفيفاً ومخرشاً خفيفاً للأغشية المخاطية.
حددت منظمة الصحة العالمية المدخول اليومي المقبول من حمض البنزوئيك والبنزوات الأخرى مقيسة بالنسبة لحمض البنزوئيك بحوالي 5 ملغ لكل 1 كغ من وزن الجسم والجرعة الدنيا المميتة الفموية للإنسان منه بحوالي 500 ملغ/كغ وزن الجسم.
LD50 (cat,oral) = 2 g/kg LD50 (dog,oral) = 2 g/kg LD50 (mouse,IP) = 1.46 g/kg LD50 (mouse,oral) = 1.94 g/kg LD50 (rat,oral) = 2.53 g/kg
سلامة الاستعمال[عدل]
تختلف الاحتياطات المتبعة أثناء التعامل مع المادة باختلاف الكمية وظروف التعامل معها، وقد يكون حمض البنزوئيك ضاراً إذا استنشق أو تم تناوله عن طريق الفم أو امتُص عن طريق الجلد وقد يكون مُخرشاً للأعين والجلد والأغشية المخاطية لنا ويجب التعامل معه في بيئة جيدة التهوية ويُنصح بارتداء القفازات والقناع الواقي من الغبار وحماية العين. كما يُعد حمض البنزوئيك مادة قابلة للاشتعال.[5]
التنافرات[عدل]
إن فعالية حمض البنزوئيك الوقائية يمكن أن تنقص عن طريق التفاعل مع الكاؤولان.[5]
مرادفات[عدل]
يسمى حمض البنزويك أيضاً [4] أو حمض الجاويك[6] أو حمض الصمغ الجاوي
المراجع[عدل]
- ^ أ ب ت benzoic acid (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ William Mickey Haynes, ed. (24 Jun 2016). CRC Handbook of Chemistry and Physics (بالإنجليزية) (97th ed.). Boca Raton. pp. 5–89. ISBN:978-1-4987-5428-6. OL:28039375M. QID:Q42107747.
{{استشهاد بكتاب}}: صيانة الاستشهاد: مكان بدون ناشر (link) - ^ أ ب معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 52، OCLC:931065783، QID:Q113378673
- ^ أ ب ت Handbook of Pharmaceutical Excipients SIXTH EDITION Edited by Raymond C Rowe BPharm, PhD, DSC, FRPharmS, FRSC, CPhys, MInstP Chief Scientist Intelligensys Ltd, Stokesley, North Yorkshire, UK Paul J Sheskey BSc, RPh Application Development Leader The Dow Chemical Company, Midland, MI, USA Marian E Quinn BSc, MSc Development Editor Royal Pharmaceutical Society of Great Britain, London, UK
- ^ معجم الكيمياء والصيدلة، مجمع اللغة العربية (القاهرة، مصر).
| في كومنز صور وملفات عن: حمض البنزويك |