سرطان
| مرض السرطان | |
|---|---|
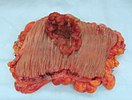
 الاشعة المقطعية الإكليلية مما يدل على ورم الظهارة المتوسطة الخبيثة
وسيلة الإيضاح: (الورم ★ الانصباب الجنبي المركزية)، 1 و3 الرئتين، 2 العمود الفقري، الأضلاع 4، 5 الشريان الأورطي، 6 الطحال، الكلى 7 و8 و9 الكبد.
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | ورم، وورم متكتل، ومرض |
| الأسباب | |
| الأسباب | أسباب السرطان، والأسباب المعدية المسببة للسرطان |
| عوامل الخطر | التدخين، السمنة، سوء التغذية، نمط الحياة الخامل، تناول الكحول، بعض الأمراض المعدية |
| المظهر السريري | |
| الأعراض | تورم، نزيف غير طبيعي، سعال طويل، فقدان وزن غير مبرر، تغير في حركات الأمعاء |
| الإدارة | |
| العلاج | الجراحة، العلاج الإشعاعي، العلاج الكيميائي، العلاج الهدفي |
| أدوية | |
| حالات مشابهة | سرطانة |
| التاريخ | |
| سُمي باسم | نوع من القشريات |
| وصفها المصدر | قاموس بروكهاوس وإفرون الموسوعي الصغير ، وقاموس بروكهاوس وإفرون الموسوعي |
| تعديل مصدري - تعديل | |

السَّرطان[1] (بالإنجليزية: Cancer) هو مجموعة من الأمراض التي تتميز خلاياها بالتوغل والانتشار (وهو النمو والانقسام الخلوي غير المحدود)، هذه الخلايا المنقسمة لها القدرة على غزو الأنسجة المجاورة وتدميرها، أو الانتقال إلى أنسجة بعيدة في عملية يُطلق عليها الانبثاث.[2][3][4] وهذه القدرات هي صفات الورم الخبيث على عكس الورم الحميد، الذي يتميز بنمو محدد وعدم القدرة على الغزو أو القدرة على الانتقال. مع ذلك يمكن أن يتطور الورم الحميد إلى سرطان خبيث في بعض الأحيان. حوالي 5-10% من السرطانات تحدث بسبب عيوب جينية وراثية من والدي الشخص ويمكن الكشف عن السرطان بعلامات وأعراض معينة أو اختبارات فحص. وبعد ذلك يتم إجراء المزيد من الاختبارات عن طريق التصوير الطبي والتأكيد بأخذ خزعة.
السرطان هو ثاني سبب رئيسي للوفاة على مستوى العالم[5][6]، وهو مسؤول عن ما يقدر بـ 9.6 مليون حالة وفاة في عام 2018.[7] على الصعيد العالمي، حوالي 1 من كل 6 حالات وفاة بسبب السرطان.[6] إن تعاطي التبغ هو سبب حوالي 22% من وفيات السرطان. 10% أخرى ترجع إلى السمنة أو سوء التغذية أو قلة النشاط البدني أو الإفراط في شرب الكحول.[8] وتشمل العوامل الأخرى بعض أنواع العدوى والتعرض للإشعاع والملوثات البيئية. في العالم النامي، 15% من السرطانات ناتجة عن عدوى مثل هيليكوباكتر بيلوري، والتهاب الكبد ب، والتهاب الكبد سي، وعدوى فيروس الورم الحليمي البشري، وفيروس إيبشتاين-بار، وفيروس نقص المناعة البشرية. تعمل هذه العوامل، جزئيًا على الأقل، عن طريق تغيير جينات الخلية. لذلك يمكن منع العديد من السرطانات من خلال عدم التدخين، والحفاظ على وزن صحي، وعدم شرب الكحول، وتناول الكثير من الخضار والفواكه والحبوب الكاملة، والتطعيم ضد بعض الأمراض المعدية، وعدم تناول الكثير من اللحوم المصنعة والحمراء وتجنب التعرض الشديد لأشعة الشمس.
أكثر أنواع السرطان شيوعًا لدى الذكور هي سرطان الرئة وسرطان القولون والمستقيم وسرطان البروستاتا ووسرطان المعدة.[9] أما في الإناث، الأنواع الأكثر شيوعًا هي سرطان الثدي وسرطان القولون والمستقيم وسرطان الرئة وسرطان عنق الرحم.[9] إذا تم إدراج سرطان الجلد بخلاف الورم الميلانيني في إجمالي حالات السرطان الجديدة كل عام، فسيكون ذلك يمثل حوالي 40% من الحالات. في الأطفال، يكون سرطان الدم الليمفاوي الحاد وأورام الدماغ أكثر شيوعًا، باستثناء أفريقيا حيث تحدث الأورام اللمفاوية غير الهودجكينية في كثير من الأحيان. في عام 2012، تم تشخيص حوالي 165,000 طفل دون سن 15 عامًا بالسرطان. يستطيع السرطان أن يصيب كل المراحل العمرية عند الإنسان حتى الأجنة، ولكن تزيد مخاطر الإصابة به كلما تقدم الإنسان في العمر.[10] ويسبب السرطان الوفاة بنسبة 13% من جميع حالات الوفاة.[11]
يعد الكشف المبكر عن طريق الفحص مفيد في سرطان عنق الرحم وسرطان القولون والمستقيم. فوائد الفحص في سرطان الثدي مثيرة للجدل. غالبًا ما يتم علاج السرطان بمزيج من العلاج الإشعاعي والجراحة والعلاج الكيميائي والعلاج الموجه. يعد التحكم في الألم والأعراض جزءًا مهمًا من الرعاية. الرعاية التلطيفية مهمة بشكل خاص للأشخاص المصابين بالمرض في حالات متقدمة. تعتمد فرصة النجاة على نوع السرطان ومدى المرض في بداية العلاج. عند التشخيص في الأطفال تحت سن 15 سنة، يبلغ معدل البقاء على قيد الحياة لمدة خمس سنوات في العالم المتقدم 80% في المتوسط. بالنسبة للسرطان في الولايات المتحدة، يبلغ متوسط معدل البقاء على قيد الحياة لمدة خمس سنوات 66٪.[12]
تعريف المرض[عدل]
السرطان عبارة عن مجموعة كبيرة من الأمراض التي تتكون من نمو غير طبيعي للخلايا مع احتمال غزوها أو انتشارها إلى أجزاء أخرى من الجسم.[6][13] هذه الخلايا تشكل مجموعة من الأورام. الورم عبارة عن مجموعة من الخلايا التي خضعت لنمو غير منظم وستشكل غالبًا كتلة، ولكن مع إمكانية توزيعها بشكل منتشر.
تظهر جميع الخلايا السرطانية السمات الستة للسرطان. هذه الخصائص مطلوبة لإنتاج ورم خبيث.
- نمو الخلايا وانقسامها بشكل شاذ عن الإشارات المناسبة
- النمو والانقسام المستمر حتى مع إعطاء إشارات متناقضة
- تجنب موت الخلايا المبرمج
- عدد لا حصر له من انقسامات الخلية
- تعزيز بناء الأوعية الدموية
- غزو الأنسجة وتشكيل الانبثاث
يتضمن التطور من الخلايا الطبيعية إلى الخلايا التي يمكن أن تشكل كتلة قابلة لتسبب السرطان خطوات متعددة تعرف بالتقدم الخبيث.
أعراض السرطان[عدل]
عندما يبدأ السرطان، لا ينتج عنه أي أعراض. تظهر العلامات والأعراض مع نمو الكتلة أو التقرحات وما يظهر قد يدل على نوع السرطان وموقعه. هناك أعراض قليلة محددة وقد يكون من الصعب تشخيص السرطان وتُقسم هذه الأعراض إلى:
أعراض موضعية[عدل]
قد تحدث الأعراض المحلية بسبب كتلة الورم أو تقرحه. على سبيل المثال، يمكن أن تؤدي التأثيرات الجماعية لسرطان الرئة إلى سد الشعب الهوائية مما يؤدي إلى السعال أو الالتهاب الرئوي ويمكن أن يسبب التقرح نزيفًا يمكن أن يؤدي إلى أعراض مثل سعال الدم (سرطان الرئة). يمكن أن يتسبب سرطان المريء في تضييق المريء، مما يجعل البلع صعبًا أو مؤلمًا[14] ؛ وسرطان القولون والمستقيم قد يؤدي إلى تضييق أو انسداد في الأمعاء، مما يؤثر على عادات الأمعاء. قد تنتج كتل الثدي أو الخصيتين كتلًا يمكن ملاحظتها. أو فقر الدم أو نزيف المستقيم (سرطان القولون)[15] أو الدم في البول (سرطان المثانة) أو نزيف مهبلي غير طبيعي (سرطان بطانة الرحم أو سرطان عنق الرحم). على الرغم من أن الألم الموضعي قد يحدث في السرطان المتقدم، إلا أن الورم الأولي عادة ما يكون غير مؤلم. يمكن أن تتسبب بعض السرطانات في تراكم السوائل داخل الصدر أو البطن.
أعراض عامة[عدل]
قد تحدث أعراض في الجسم كاستجابة لوجود للسرطان. قد يشمل ذلك التعب أو فقدان الوزن[16] أو تغيرات الجلد. يمكن أن تسبب بعض أنواع السرطان حالة التهابية جهازية تؤدي إلى فقدان العضلات وضعفها المستمر، والمعروفة باسم متلازمة الهزال.[17] بعض أنواع السرطان مثل مرض هودجكين، وسرطان الدم وسرطانات الكبد أو الكلى يمكن أن تسبب حمى مستمرة.[14]
تحدث بعض الأعراض الجهازية للسرطان بسبب الهرمونات أو الجزيئات الأخرى التي ينتجها الورم، والمعروفة باسم متلازمات الأباعد الورمية. تشمل متلازمات الأباعد الورمية الشائعة فرط كالسيوم الدم الذي يمكن أن يسبب تغير الحالة العقلية، والإمساك والجفاف، أو نقص صوديوم الدم الذي يمكن أن يسبب أيضًا تغيرًا في الحالة العقلية أو القيء أو الصداع أو النوبات.[18]
أعراض الانبثاث[عدل]
يمكن أن ينتشر السرطان من موقعه الأصلي عن طريق الانتشار المحلي، والانتشار اللمفاوي إلى العقد الليمفاوية الإقليمية أو عن طريق الانتشار الدموي عبر الدم إلى مواقع بعيدة، تعرف باسم الإنبثاث. عندما ينتشر السرطان عبر الدم، قد ينتشر عبر الجسم ولكن من المرجح أن ينتقل إلى مناطق معينة اعتمادًا على نوع السرطان[19] تعتمد أعراض سرطانات النقائل على مكان الورم ويمكن أن تشمل تضخم الغدد الليمفاوية (التي يمكن الشعور بها أو رؤيتها تحت الجلد أحيانًا وتكون صلبة عادةً) أو تضخم الكبد أو تضخم الطحال، والتي يمكن الشعور بها في البطن أو الألم أو الكسر من العظام والأعراض العصبية المصابة.
الأسباب[عدل]
معظم السرطانات، حوالي 90-95% من الحالات، ترجع إلى طفرات جينية ناتجة عن العوامل البيئية ونمط الحياة.[20] أما نسبة 5-10% المتبقية ترجع إلى الوراثة.[20] تشير البيئة إلى أي سبب غير وراثي، مثل أسلوب الحياة والعوامل الاقتصادية والسلوكية وليس مجرد التلوث.[21] تشمل العوامل البيئية الشائعة التي تساهم في الوفاة بالسرطان التبغ (25-30٪)، والنظام الغذائي والسمنة (30-35٪)، والعدوى (15-20٪)، والإشعاع (المؤين وغير المؤين 10٪)، قلة النشاط البدني والتلوث.[22] لا يبدو الإجهاد النفسي عامل خطر لحدوث السرطان، مع ذلك قد يؤدي إلى تفاقم النتائج لدى المصابين بالفعل بالسرطان.[23]
ليس من الممكن بشكل عام إثبات سبب الإصابة بسرطان معين لأن الأسباب المختلفة ليس لها بصمات محددة. على سبيل المثال، إذا كان الشخص الذي يستخدم التبغ يصاب بسرطان الرئة بشكل كبير، فمن المحتمل أن يكون سببه تعاطي التبغ، ولكن نظرًا لأن كل شخص لديه فرصة صغيرة للإصابة بسرطان الرئة نتيجة لتلوث الهواء أو الإشعاع، فقد يكون السرطان قد تطور لأحد تلك الأسباب. باستثناء حالات النقل النادرة التي تحدث مع حالات الحمل والمانحين العرضيين للأعضاء، فإن السرطان بشكل عام ليس مرضًا قابلاً للانتقال.[24]
مسرطنات كيميائية[عدل]
تم ربط التعرض لمواد معينة بأنواع معينة من السرطان. تسمى هذه المواد «المسرطنة».
تدخين السجائر، على سبيل المثال، يسبب 90% من سرطان الرئة.[25] كما أنه يسبب السرطان في الحنجرة والرأس والرقبة والمعدة والمثانة والكلى والمريء والبنكرياس. يحتوي دخان التبغ على أكثر من خمسين نوع من المواد المسرطنة المعروفة، بما في ذلك النتروزامين والهيدروكربونات العطرية متعددة الحلقات. لذلك التبغ مسؤول عن حوالي واحد من كل خمسة وفيات بسبب السرطان في جميع أنحاء العالم[26] وحوالي واحد من كل ثلاثة في العالم المتقدم.[27] عكست معدلات الوفيات بسرطان الرئة في الولايات المتحدة أنماط التدخين، مع الزيادات في التدخين تليها زيادات كبيرة في معدلات وفيات سرطان الرئة، ومؤخرا انخفاضات في معدلات التدخين منذ الخمسينيات، يليها انخفاض في معدلات وفيات سرطان الرئة لدى الرجال منذ 1990.[28][29]
في أوروبا الغربية، يرجع 10% من السرطانات عند الذكور و 3% من السرطانات عند الإناث بسبب تناول للكحول، وخاصة سرطان الكبد والجهاز الهضمي.[30]
قد يسبب السرطان من التعرض للمواد المرتبطة بالعمل ما بين 2 و 20% من الحالات،[31] مما تسبب في 200,000 حالة وفاة على الأقل.[32] يمكن أن تأتي سرطانات مثل سرطان الرئة وورم الظهارة المتوسطة من استنشاق دخان الدخان أو ألياف الأسبستوس، أو سرطان الدم من التعرض للبنزين.[32]
النظام الغذائي وممارسة الرياضة[عدل]
يرتبط النظام الغذائي والخمول البدني والسمنة بما يصل إلى 30-35% من وفيات السرطان.[33][34] يعتقد أن الخمول البدني يساهم في خطر الإصابة بالسرطان، ليس فقط من خلال تأثيره على وزن الجسم ولكن أيضًا من خلال التأثيرات السلبية على جهاز المناعة ونظام الغدد الصماء. يرجع أكثر من نصف التأثير من النظام الغذائي إلى الإفراط في التغذية (تناول الكثير)، بدلاً من تناول القليل جدًا من الخضروات أو الأطعمة الصحية الأخرى. أظهرت دراسة بريطانية تتضمن بيانات عن أكثر من 5 ملايين شخص أن مؤشر كتلة الجسم الأعلى مرتبط بعشرة أنواع على الأقل من السرطان ومسؤولة عن حوالي 12,000 حالة كل عام في ذلك البلد.[35]
ترتبط بعض الأطعمة المحددة بسرطانات معينة. النظام الغذائي الذي يحتوي على نسبة عالية من الملح مرتبط بسرطان المعدة. الأفلاتوكسين B1، وهو ملوث غذائي متكرر، يسبب سرطان الكبد. مضغ الفوفل كاتشو (الجوز) قد يسبب سرطان الفم.[36] قد تفسر الاختلافات الوطنية في الممارسات الغذائية جزئيًا الاختلافات في الإصابة بالسرطان. على سبيل المثال، يعد سرطان المعدة أكثر شيوعًا في اليابان بسبب نظامه الغذائي الذي يحتوي على نسبة عالية من الملح[37] في حين أن سرطان القولون أكثر شيوعًا في الولايات المتحدة. تعكس ملامح سرطان المهاجرين تلك الخاصة ببلدهم الجديد، غالبًا في غضون جيل واحد.[35]
إشعاع[عدل]
يعد التعرض للإشعاع مثل الأشعة فوق البنفسجية والمواد المشعة عامل خطر للإصابة بالسرطان.[38][39][40] العديد من سرطانات الجلد غيرالميلانينية ناتجة عن الأشعة فوق البنفسجية، ومعظمها من أشعة الشمس. تشمل مصادر الإشعاع المؤينة التصوير الطبي وغاز الرادون.[39]
الإشعاع المؤين ليس مطفرا قويا بالضرورة.[41] الإشعاع هو مصدر أكثر فعالية للسرطان عندما يقترن بعوامل أخرى مسببة للسرطان، مثل غاز الرادون ودخان التبغ. فالتعرض السكني لغاز الرادون، على سبيل المثال، له مخاطر مشابهة للسرطان مثل التدخين السلبي.[41] يمكن أن يسبب الإشعاع السرطان في معظم أجزاء الجسم، وفي جميع الحيوانات وفي أي عمر. من المرجح أن يصاب الأطفال بسرطان الدم الناجم عن الإشعاع بنسبة مضاعفة مقارنة بالبالغين. التعرض للإشعاع قبل الولادة له تأثيرعشرة أضعاف.[41]
الاستخدام الطبي للإشعاع المؤين هو مصدر صغير ولكنه متزايد من السرطانات التي يسببها الإشعاع. يمكن استخدام الإشعاع المؤين لعلاج سرطانات أخرى، ولكن هذا قد يؤدي في بعض الحالات إلى ظهور شكل ثانٍ من السرطان. كما يستخدم أيضًا في بعض أنواع التصوير الطبي.[42]
التعرض لفترات طويلة للأشعة فوق البنفسجية من الشمس يمكن أن يؤدي إلى سرطان الجلد والأورام الخبيثة الأخرى.[43] تشير الأدلة الواضحة إلى أن الأشعة فوق البنفسجية، وخاصة الموجة المتوسطة غير المؤينة للأشعة فوق البنفسجية، هي سبب معظم حالات سرطان الجلد غير الميلانيني، وهي أكثر أشكال السرطان شيوعًا في العالم.[43]
وقد وصفت الوكالة الدولية لبحوث السرطان التابعة لمنظمة الصحة العالمية أن إشعاع التردد الراديوي غير المؤين من الهواتف المحمولة، ونقل الطاقة الكهربائية ومصادر أخرى مماثلة هو مادة مسرطنة محتملة.[44] إلا أن الأدلة لم تدعم القلق.[45] وهذا يشمل أن الدراسات لم تجد رابطًا ثابتًا بين إشعاع الهاتف المحمول وخطر الإصابة بالسرطان.[46]
أمراض معدية[عدل]
يرتبط حوالي 18% من وفيات السرطان في جميع أنحاء العالم بالأمراض المعدية.[13] وتتراوح هذه النسبة من 25% في إفريقيا إلى أقل من 10% في العالم المتقدم.[13] الفيروسات هي العوامل المعدية المعتادة التي تسبب السرطان ولكن البكتيريا والطفيليات السرطانية قد تلعب دورًا أيضًا. ومن أهم الفيروسات المرتبطة بالسرطانات هي فيروس الورم الحليمي البشري وألتهاب كبدي الوبائي ب والتهاب كبدي وبائي سي وفيروس إيبشتاين – بار وفيروس الهربس المرتبط بساركوما كابوزي وفَيْروسُ اللَّمْفومةِ.[47] قد تم اكتشاف ارتباط بين سرطان المعدة وبكتيرية المَلوية البوابية والتي تُحدث التهاب في جدار المعدة وقد تؤدي إلى إصابتها بالسرطان.[48] تشمل العدوى الطفيلية المرتبطة بالسرطان البلهارسيا (سرطان الخلايا الحرشفية في المثانة) وتدفقات الكبد، متأخر الخصية الزبادي وسرطان القنوات الصفراوية.[49]
خلل هرموني[عدل]
تلعب بعض الهرمونات دورًا في تطور السرطان عن طريق تعزيز تكاثر الخلايا.[50] تلعب عوامل النمو الشبيهة بالأنسولين وبروتيناتها المرتبطة دورًا رئيسيًا في تكاثر الخلايا السرطانية والتمايز واستماتة الخلايا، مما يشير إلى احتمال تورطها في الإصابة بالسرطان.[51] الهرمونات تعتبر عوامل مهمة في الإصابة بالسرطان المرتبط بالجنس، مثل سرطان الثدي وبطانة الرحم والبروستاتا والمبيض والخصية وكذلك سرطان الغدة الدرقية وسرطان العظام. هناك أسباب بيولوجية وسريرية ووبائية للاعتقاد بأن إعطاء هرمون الاستروجين للنساء بعد انقطاع الطمث يزيد من خطر الإصابة بسرطان بطانة الرحم.[52] على سبيل المثال، لدى بنات النساء المصابات بسرطان الثدي مستويات أعلى بكثير من هرمون الاستروجين والبروجسترون من بنات النساء غير المصابات بسرطان الثدي. قد تفسر مستويات الهرمون المرتفعة هذه ارتفاع خطر الإصابة بسرطان الثدي، حتى في غياب جين سرطان الثدي.[50] وبالمثل، فإن الرجال من أصل أفريقي لديهم مستويات أعلى بكثير من هرمون التستوستيرون من الرجال من أصل أوروبي ولديهم مستوى أعلى من سرطان البروستاتا.[50] الرجال من أصل آسيوي، مع أدنى مستويات من تنشيط هرمون التستوستيرون وغلوكورونيد الروستانيديول، لديهم أدنى مستويات سرطان البروستاتا.[50]
أمراض المناعة[عدل]
هناك ارتباط بين مرض الاضطرابات الهضمية وزيادة خطر الإصابة بجميع أنواع السرطان. الأشخاص الذين يعانون من مرض بطني بدون علاج لديهم مخاطر أعلى، ولكن هذا الخطر يتناقص مع مرور الوقت بعد التشخيص والعلاج، وربما بسبب الاعتماد علي نظام غذائي خال من الغلوتين، والذي يبدو أن له دورًا وقائيًا ضد تطور الأورام الخبيثة لدى الأشخاص المصابين بمرض الاضطرابات الهضمية. ومع ذلك، يبدو أن التأخير في تشخيص وبدء نظام غذائي خال من الغلوتين يزيد من خطر الإصابة بالأورام الخبيثة.[53] تزداد معدلات الإصابة بسرطان الجهاز الهضمي لدى الأشخاص المصابين بداء كرون والتهاب القولون التقرحي بسبب الالتهاب المزمن. أيضا، يمكن للعلاج المناعي والعوامل البيولوجية المستخدمة لعلاج هذه الأمراض أن تعزز الإصابة بالأورام الخبيثة خارج الأمعاء.[54]
عامل الوراثة[عدل]
الغالبية العظمى من السرطانات غير وراثية (متفرقة). تحدث السرطانات الوراثية في المقام الأول بسبب خلل وراثي. أقل من 0.3% من السكان يحملون طفرة جينية لها تأثير كبير على مخاطر الإصابة بالسرطان وتسبب أقل من 3-10% من السرطان.[55] تتضمن بعض هذه المتلازمات ما يلي: بعض الطفرات الموروثة في جينات BRCA1 و BRCA2 مع خطر الإصابة سرطان الثدي أو سرطان المبيض بنسبة 75٪،[55] وسرطان القولون والمستقيم الوراثي غير السلوكي (متلازمة HNPCC أو Lynch)، والتي توجد في حوالي 3% من المصابين بسرطان القولون والمستقيم،[56] من بين آخرين.
إحصائيًا بالنسبة للسرطانات التي تسبب معظم الوفيات، فإن الخطر النسبي للإصابة بسرطان القولون والمستقيم عندما يتم تشخيص قريب من الدرجة الأولى (الوالد أو الأخ أو الطفل) به حوالي 2.[57] الخطر النسبي المقابل هو 1.5 لسرطان الرئة،[58] و 1.9 لسرطان البروستاتا.[58] بالنسبة لسرطان الثدي، فإن الخطر النسبي هو 1.8 مع وجود قريب من الدرجة الأولى قد طوره عند سن 50 عامًا أو أكثر، و 3.3 عندما طوره قريبه عندما كان أصغر من 50 عامًا.[59]
يزداد خطر الإصابة بالسرطان لدى الأشخاص الأطول لأن لديهم خلايا أكثر من الأشخاص الأقصر. نظرًا لأن الطول محدد وراثيًا إلى حد كبير، فإن الأشخاص الأطول لديهم زيادة وراثية في خطر الإصابة بالسرطان.[60]
مؤثرات بدنية[عدل]
بعض المواد تسبب السرطان في المقام الأول من خلال آثارها الجسدية، وليس الكيميائية.[61] مثال بارز على ذلك هو التعرض المطول للأسبستس، والألياف المعدنية التي تحدث بشكل طبيعي والتي هي سبب رئيسي لورم الظهارة المتوسطة (سرطان الغشاء المصلي) عادة الغشاء المصلي المحيط بالرئتين. ويعتقد أن المواد الأخرى في هذه الفئة، بما في ذلك الألياف التي تشبه الأسبست بشكل طبيعي والألياف الاصطناعية، مثل الولاستونيت والأتابولجيت والصوف الزجاجي والصوف الصخري لها تأثيرات مماثلة.[61] تشتمل المواد الجسيمية غير الليفية التي تسبب السرطان على مسحوق الكوبالت المعدني والنيكل والسيليكا المتبلور (الكوارتز والكريستوباليت والتريديت).[61] عادة، يجب أن تصل المواد المسرطنة الجسدية إلى داخل الجسم (مثل الاستنشاق) وتتطلب سنوات من التعرض للإصابة بالسرطان.[61]
الكدمات الجسدية الناتجة عن السرطان نادرة نسبيًا.[62] لم يتم إثبات الادعاءات بأن كسر العظام أدى إلى الإصابة بسرطان العظام، على سبيل المثال.[62] وبالمثل، فإن الصدمة الجسدية غير مقبولة كسبب لسرطان عنق الرحم أو سرطان الثدي أو سرطان الدماغ.[62] أحد المصادر المقبولة هو الاستخدام المتكرر للأجسام الساخنة على الجسم على المدى الطويل. من المحتمل أن الحروق المتكررة على نفس الجزء من الجسم، مثل تلك التي تنتجها مدافئ كانجر وكايرو (مدفأة الفحم)، قد تسبب سرطان الجلد، خاصة إذا كانت هناك مواد كيميائية مسرطنة.[62] كثرة تناول الشاي الساخن قد يسبب سرطان المريء. بشكل عام، يُعتقد أن السرطان ينشأ، أو يتم تشجيع السرطان الموجود مسبقًا، خلال عملية الشفاء، بدلاً من الصدمة مباشرة.[62] ومع ذلك، قد تؤدي الإصابات المتكررة في الأنسجة نفسها إلى تعزيز التكاثر المفرط للخلايا، مما قد يزيد من احتمالات حدوث طفرة سرطانية.
تم افتراض أن الالتهاب المزمن يسبب طفرة مباشرة.[62][63] يمكن أن يساهم الالتهاب في تكاثر الخلايا السرطانية وبقائها وتولد الأوعية بها وهجرتها من خلال التأثير على البيئة الدقيقة للورم.[64][65] تعمل الأورام الجينية على بناء بيئة ميكروية التهابية مؤيدة للأورام.[66]

التشخيص[عدل]
يتم التعرف على معظم السرطانات في البداية إما بسبب ظهور العلامات أو الأعراض أو من خلال الفحص. لا يؤدي أي من هذين إلى تشخيص نهائي، والذي يتطلب فحص عينة نسيج من قبل أخصائي علم الأمراض. يتم التحقيق مع الأشخاص المشتبه في إصابتهم بالسرطان من خلال الاختبارات الطبية. تتضمن هذه الاختبارات عادةً فحوصات الدم والأشعة السينية وفحوصات التصوير المقطعي المحوسب أو بـالتنظير الداخلي.
يشير تشخيص الأنسجة من الخزعة إلى نوع الخلية التي تتكاثر، ودرجها النسيجي، والتشوهات الوراثية وغيرها من الخصائص. هذه المعلومات مفيدة لتقييم التكهن واختيار أفضل علاج.
الوراثة الخلوية والكيمياء المناعية هي أنواع أخرى من اختبارات الأنسجة. توفر هذه الاختبارات معلومات حول التغيرات الجزيئية (مثل الطفرات وجينات الانصهار وتغيرات الكروموسومات العددية) وبالتالي قد تشير أيضًا إلى التشخيص وأفضل علاج.
مسميات[عدل]
- الورم : هو أي نمو أو تضخم غير طبيعي، أو ظهور كتلة غريبة في الجسم. ويعتبر الورم كمرادف لكلمة تنشؤ. والتنشؤ يمكن أن يكون صلب وينتج ورم، أو غير صلب -مثل الليوكيميا- لا تنتج أورام. الخلايا المتنشئة نوعان:
- تنشؤ/ورم خبيث : وهو ما يقصد به السرطان.
- تنشؤ/ورم حميد : وهو تنشؤ يتصف بأن نموه وتكاثره محدود، وغير غازي، ولا يتميز بالنقلية.
- ورم غازي : وهذا اللفظ مرادف آخر لكلمة سرطان. حيث يشير إلى غزو الخلايا السرطانية للأنسجة المحيطة بالسرطان.
- ورم محتمل الخباثة، ورم محتمل السرطنة، ورم غير غازي: هي مرادفات لتنشؤ غير غازي ولكن يوجد احتمال كبير لتحولها إلى تنشؤات خبيثة إذا تركت بلا علاج.وتزداد إمكانية تحول الأفة إلى سرطان كلما تدرجت الخلايا من خلايا لانمطية، ثم إلى خلايا مختلة التنسج وتنتهى بخلايا سرطانية متموضعة.
- حواف الجراحة : وهو تقييم أخصائي الباثولوجيا لحواف الورم المستئصل، لتحديد إذا ما تم إزالة الورم بالكامل (حواف سلبية) أو إذا تبقى جزء لم تتم إزالته (حواف إيجابية).
- درجة الورم : وهو رقم (في الغالب من 1 إلى 3) يعطى من أخصائي الباثولوجيا ليصف درجة التشابه بين الخلايا السرطانية والخلايا السليمة المحيطة بالسرطان.
- مرحلة الورم : وهو رقم (في الغالب من 1 إلى 4) يعطى من أخصائي الباثولوجيا ليصف درجة غزو السرطان للجسم الأنسان.
- عودة الحدوث : وهي الأورام الجديدة التي تظهر بنفس مكان الورم الأول.
- النقيلة : وهي الأورام الجديدة التي تظهر في أماكن تبعد عن الورم الأول.
- التحول : وهو تحول ورم منخفض الدرجة إلى ورم عالي الدرجة خلال وقت معين.
- التكهن بمردود العلاج : وهي احتمالية الشفاء بعد العلاج. وهي غالبا ما تقاس باحتمالية البقاء على قيد الحياة أكثر من خمسة سنين كحد أدنى بعد التشخيص.
تصنيف[عدل]
تصنف السرطانات بناء على التشابه بين الخلية السرطانية والخلية السليمة. أمثلة على أنواع السرطانات:
- سرطانة : وهي سرطانات تنبع من النسيج الطلائي وتشكل أكبر مجموعة من السرطانات عامة، وخصوصاً في سرطان الثدي والبروستاتا والرئة والبنكرياس.
- ساركومة : وهي سرطانات تنبع من النسيج الضام (أي العظام والغضاريف والدهون والأعصاب).
- ليمفوما والليوكيميا: وهما سرطانان ينبعان من الخلايا المكونة للدم.
- ورم الخلية الجنسية: وهي أورام تحدث عادة داخل الغدد التناسلية (المبيض والخصية).
- ورم أرومي: وهو ورم يشابه الأنسجة الغير ناضجة أو الأنسجة الجنينية وهو أكثر شيوعًا عند الأطفال.
-
سرطان القولون والمستقيم (المركز العلوي) في عينة استئصال القولون
-
سرطان في الثدي في القنوات (منطقة شاحبة في المنتصف) محاطة بارتفاعات بها ندبة بيضاء وأنسجة دهنية صفراء
-
سرطان الخلايا الحرشفية بالقرب من القصبة الهوائية في عينة في الرئة
-
سرطان في قنوات في عينة استئصال الثدي
وبائيات السرطان[عدل]
السرطان هو ثاني سبب رئيسي للوفاة على مستوى العالم، وهو مسؤول عن ما يقدر بـ 9.6 مليون حالة وفاة في عام 2018. على الصعيد العالمي، حوالي 1 من كل 6 حالات وفاة بسبب السرطان.
تحدث حوالي 70% من الوفيات الناجمة عن السرطان في البلدان المنخفضة والمتوسطة الدخل. ترجع حوالي ثلث الوفيات بسبب السرطان إلى المخاطر السلوكية والغذائية الرئيسية الخمسة: ارتفاع مؤشر كتلة الجسم، وانخفاض تناول الفاكهة والخضروات، وقلة النشاط البدني، وتعاطي التبغ، وتعاطي الكحول.[67] يعتبر تعاطي التبغ أهم عامل خطر للإصابة بالسرطان وهو مسؤول عن حوالي 22% من وفيات السرطان.[68]
إن السرطان الذي يسبب العدوى، مثل التهاب الكبد وفيروس الورم الحليمي البشري، مسؤول عن 25% من حالات السرطان في البلدان المنخفضة والمتوسطة الدخل.[69] من الشائع تقديم العروض المتأخرة والتشخيص والعلاج الذي يتعذر الوصول إليه. في عام 2017، أبلغت 26% فقط من البلدان منخفضة الدخل عن وجود خدمات علم الأمراض المتاحة بشكل عام في القطاع العام. أفاد أكثر من 90% من البلدان المرتفعة الدخل بأن خدمات العلاج متاحة مقارنة بأقل من 30% من البلدان منخفضة الدخل. إن التأثير الاقتصادي للسرطان كبير ومتزايد. قدرت التكلفة الاقتصادية السنوية الإجمالية للسرطان في عام 2010 بنحو 1.16 تريليون دولار أمريكي.[70] فقط 1 من كل 5 بلدان منخفضة ومتوسطة الدخل لديها البيانات اللازمة لدفع سياسة السرطان.[71]
البالغين[عدل]
في الولايات المتحدة الأمريكية، يتقدم سرطان الرئة في صدارة السرطانات التي تؤدي إلى وفاة المصاب ذكرا أو أنثى، ثم يليه سرطان البروستاتا عند المرضى الذكور وسرطان الثدي عند المرضى الإناث.[72]
| الأكثر إنتشارا | الأكثر سببا في الوفاة |
|---|---|
| سرطان البروستاتا 25% | سرطان الرئة 31% |
| سرطان الرئة 15% | سرطان البروستاتا 10% |
| سرطان القولون والمستقيم 10% | سرطان القولون والمستقيم 8% |
| سرطان المثانة 7% | سرطان البنكرياس 6% |
| سرطان الخلايا الصبغية 5% | سرطان اللوكيميا 4% |
| لمفوما لاهودجكينية 5% | سرطان الكبد 4% |
| الأكثر إنتشارا | الأكثر سببا في الوفاة |
|---|---|
| سرطان الثدي 26% | سرطان الرئة 26% |
| سرطان الرئة 14% | سرطان الثدي 15% |
| سرطان القولون والمستقيم 10% | سرطان القولون والمستقيم 9% |
| سرطان بطانة الرحم 7% | سرطان البنكرياس 6% |
| لمفوما لاهودجكينية 4% | سرطان المبيض 6% |
| سرطان الغدة الدرقية 4% | لمفوما لاهودجكينية 3% |
الأطفال[عدل]
سرطان الدم (سرطان الدم الليمفاوي الحاد)عادة هو أكثر أنواع السرطان شيوعًا في الأطفال الذين تتراوح أعمارهم بين 1-14 عامًا في الولايات المتحدة، ويليه سرطان الجهاز العصبي المركزي، وورم الأرومة العصبية، وورم ويلمز، وسرطان الغدد الليمفاوية.[73] تظهر إحصائيات المعهد الوطني للسرطان بالولايات المتحدة أن سرطانات الأطفال زادت بنسبة 19% بين عامي 1975 و 1990، ويرجع ذلك أساسًا إلى زيادة حالات الإصابة بسرطان الدم الحاد. منذ عام 1990، انخفضت معدلات الإصابة.[74]
الرضع[عدل]
يحدث سن ذروة الإصابة بالسرطان عند الأطفال خلال السنة الأولى من الحياة عند الرضع. كان متوسط الوقوع السنوي في الولايات المتحدة، 1975-1995، 233 لكل مليون رضيع.[74] توجد العديد من تقديرات الإصابة. وفقًا لـدراسة أجريت في الولايات المتحدة:
شكل الورم الأرومي العصبي 28% من حالات سرطان الأطفال وكان أكثر الأورام الخبيثة شيوعًا بين هؤلاء الأطفال الصغار (65 لكل مليون رضيع).
تمثل اللوكيميا كمجموعة (41 لكل مليون رضيع) النوع التالي الأكثر شيوعًا من السرطان، الذي يضم 17% من جميع الحالات.
شكلت الأورام الخبيثة في الجهاز العصبي المركزي 13% من سرطان الرضع، بمتوسط معدل الإصابة السنوية ما يقرب من 30 لكل مليون رضيع.
كان متوسط معدلات الإصابة السنوية للخلايا الجرثومية الخبيثة وأورام الأنسجة الرخوة الخبيثة هو نفسه بشكل أساسي عند 15 لكل مليون رضيع. تشكل كل منها حوالي 6% من سرطان الأطفال.
غالبًا ما يُشار إلى الورم المسخي (ورم الخلية الجرثومية) باعتباره الورم الأكثر شيوعًا في هذه الفئة العمرية، ولكن تتم إزالة معظم الأورام المسخية جراحيًا بينما لا تزال حميدة، وبالتالي ليس بالضرورة سرطانًا. قبل الاستخدام الروتيني الواسع لفحوصات الموجات فوق الصوتية قبل الولادة، كان معدل حدوث الأورام المسخية العصعصية التي تم تشخيصها عند الولادة من 25 إلى 29 لكل مليون ولادة. في المجمل، لدى الرضع من الذكور والإناث نفس معدلات الإصابة بالسرطان بشكل عام، وهو فرق ملحوظ مقارنة بالأطفال الأكبر سنًا ولدى الرضع البيض معدلات سرطان أعلى من الأطفال السود. شكلت اللوكيميا نسبة كبيرة من هذا الاختلاف: كان متوسط المعدل السنوي للرضع البيض (48.7 لكل مليون) أعلى بنسبة 66% من الرضع السود (29.4 لكل مليون).[74]
يعد البقاء النسبي للرضع جيدًا جدًا لورم الخلايا البدائية العصبية وورم ويلمز وورم أرومة الشبكية، وهو جيد إلى حد ما (80٪) لسرطان الدم، ولكن ليس لمعظم أنواع السرطان الأخرى.
الحامل[عدل]
يصيب السرطان حوالي 1 من كل 1000 امرأة حامل. السرطانات الأكثر شيوعًا التي يتم العثور عليها أثناء الحمل هي نفس السرطانات الأكثر شيوعًا الموجودة في النساء غير الحوامل خلال سن الإنجاب: سرطان الثدي، سرطان عنق الرحم، سرطان الدم، سرطان الغدد الليمفاوية، سرطان الجلد، سرطان المبيض وسرطان القولون والمستقيم.[75]
من الصعب تشخيص سرطان جديد في المرأة الحامل، ويرجع ذلك جزئيًا إلى أن أي أعراض يُعتقد أنها عادة ما تكون غير مريحة مرتبطة بالحمل. ونتيجة لذلك، يتم اكتشاف السرطان عادة في مرحلة لاحقة إلى حد ما من المتوسط. تعتبر بعض إجراءات التصوير، مثل التصوير بالرنين المغناطيسي (MRI)، والتصوير المقطعي، والموجات فوق الصوتية، والتصوير الشعاعي للثدي مع حماية الجنين آمنة أثناء الحمل ؛ البعض الآخر، مثل فحوصات بالتصوير مقطعي بالإصدار البوزيتروني، ليسوا كذلك.[75]
العلاج هو نفسه بشكل عام للنساء غير الحوامل. ومع ذلك، عادة ما يتم تجنب الإشعاع والأدوية المشعة أثناء الحمل، خاصة إذا كانت جرعة الجنين قد تتجاوز 100 cGy. في بعض الحالات، يتم تأجيل بعض أو كل العلاجات حتى بعد الولادة إذا تم تشخيص السرطان في وقت متأخر من الحمل. غالبًا ما تُستخدم الولادات المبكرة للمضي قدمًا في بدء العلاج. الجراحة آمنة بشكل عام، لكن جراحات الحوض خلال الثلث الأول من الحمل قد تسبب الإجهاض. بعض العلاجات، خاصة بعض أدوية العلاج الكيميائي التي تُعطى خلال الثلث الأول من الحمل، تزيد من خطر العيوب الخلقية وفقدان الحمل (الإجهاض التلقائي وحالات الإملاص).[75]
الإجهاض الاختياري غير مطلوب، وبالنسبة لأشكال ومراحل السرطان الأكثر شيوعًا، لا يحسن من بقاء الأم. في حالات قليلة، مثل سرطان الرحم المتقدم، لا يمكن استمرار الحمل، وفي حالات أخرى، قد تنهي المريض الحمل حتى تتمكن من بدء العلاج الكيميائي.[75]
يمكن أن تتداخل بعض العلاجات مع قدرة الأم على الولادة عن طريق المهبل أو الرضاعة الطبيعية.[75] قد يتطلب سرطان عنق الرحم ولادة قيصرية. الإشعاع على الثدي يقلل من قدرة هذا الثدي على إنتاج الحليب ويزيد من خطر التهاب الثدي. أيضا، عندما يتم إعطاء العلاج الكيميائي بعد الولادة، تظهر العديد من الأدوية في حليب الثدي، مما قد يضر بالطفل.[75]
الوقاية[عدل]
يتم تعريف الوقاية من السرطان على أنها تدابير فعالة لتقليل خطر الإصابة بالسرطان.[76] ترجع الغالبية العظمى من حالات السرطان إلى عوامل الخطر البيئية. العديد من هذه العوامل البيئية هي خيارات أسلوب حياة يمكن التحكم فيها. وبالتالي، يمكن الوقاية من السرطان بشكل عام.[77] ما بين 70% و 90% من السرطانات الشائعة ترجع إلى عوامل بيئية وبالتالي يمكن الوقاية منها.[78]
يمكن تفادي أكثر من 30% من وفيات السرطان بتجنب عوامل الخطر، بما في ذلك: التبغ، والوزن الزائد / السمنة، وسوء التغذية، والخمول البدني، والكحول، والأمراض المنقولة بالاتصال الجنسي، وتلوث الهواء.[67] لا يمكن السيطرة على جميع الأسباب البيئية، مثل إشعاع الخلفية الذي يحدث بشكل طبيعي والسرطانات الناتجة عن الاضطرابات الوراثية وبالتالي لا يمكن الوقاية منها عن طريق السلوك الشخصي.
النظام الغذائي[عدل]
في حين أن تم اقتراح العديد من التوصيات الغذائية للحد من مخاطر الإصابة بالسرطان، فإن الأدلة التي تدعمها ليست نهائية.[79][80] العوامل الغذائية الأساسية التي تزيد من المخاطر هي السمنة وتناول الكحول. الأنظمة الغذائية التي تحتوي على القليل من الفواكه والخضروات ونسب عالية من اللحوم الحمراء قد تكون لها عوامل ولكن الدراسات لا تصل إلى نتيجة حاسمة.[81][82] لم تجد الدراسات المنهجية لعام 2014 أي علاقة بين الفواكه والخضروات والسرطان.[83] ودراسة أخرى اقترحت أن القهوة مرتبطة بانخفاض خطر الإصابة بسرطان الكبد.[84] ربطت الدراسات الاستهلاك المفرط للحوم الحمراء أو المصنعة بزيادة خطر الإصابة بسرطان الثدي وسرطان القولون وسرطان البنكرياس، وهي ظاهرة قد تكون ناجمة عن وجود مواد مسرطنة في اللحوم المطبوخة في درجات حرارة عالية.[85] في عام 2015، ذكرت الوكالة الدولية لبحوث السرطان أن تناول اللحوم المصنعة (مثل لحم الخنزير المقدد والنقانق)، وبدرجة أقل (اللحم الأحمر) مرتبطًا ببعض أنواع السرطان.[86]
في المجمل تتضمن التوصيات الغذائية للوقاية من السرطان عادةً التركيز على الخضار والفواكه والحبوب الكاملة والأسماك وتجنب اللحوم المصنعة والحمراء (لحم البقر ولحم الخنزير ولحم الضأن) والدهون الحيوانية والأطعمة المخللة والكربوهيدرات المكررة.[79][80] وصت دراسة أسيوية أن إستراتيجيات الوقاية من السرطان في الإنسان تتمكن في زيادة استهلاك الأطعمة الوظيفية مثل الحبوب الكاملة (الأرز البني والشعير والحنطة السوداء)، وبعض الخضروات (البطيخ المر والثوم والبصل والقرنبيط والملفوف) والفطر. بالإضافة إلى ذلك، قد تكون بعض المشروبات (الشاي الأخضر والقهوة) واقية.[87]
الأدوية[عدل]
يمكن استخدام الأدوية للوقاية من السرطان في بعض الحالات. في العموم، تقلل مضادات الالتهاب غير الستيروئيدية من خطر الإصابة بسرطان القولون والمستقيم. ومع ذلك، بسبب الآثار الجانبية التي تحدث في القلب والجهاز الهضمي، فإنها تسبب ضررًا عامًا عند استخدامها للوقاية.[88] وجد أن الأسبرين يقلل من خطر الوفاة بالسرطان بنحو 7٪.[89] قد تعمل مثبطات COX-2 على تقليل معدل تكوين الاورام الحميدة في الأشخاص المصابين بداء السلائل الغدي العائلي. ومع ذلك، فهو مرتبط بنفس الآثار السلبية لمضادات الالتهاب غير الستيروئيدية.[90] الاستخدام اليومي من عقار تاموكسيفين أو رالوكسيفين يقلل من خطر الإصابة بسرطان الثدي لدى النساء المعرضات لخطورة عالية.[91] الفائدة لمثبط 5-alpha-reductase مثل فيناسترايد ليست واضحة.[92]
لا يبدو أن مكملات الفيتامينات فعالة في الوقاية من السرطان.[93] في حين أن انخفاض مستويات فيتامين د في الدم يرتبط بزيادة خطر الإصابة بالسرطان،[94][95][96]] غير واضح إذا كانت هذه العلاقة سببية أو أن ومكملات فيتامين د وقائية.[97][98] وجدت دراسة مرجعية في 2014 أن المكملات الغذائية لم يكن لها تأثير كبير على خطر الإصابة بالسرطان. خلصت مراجعة أخرى عام 2014 إلى أن فيتامين D3 قد يقلل من خطر الوفاة من السرطان (وفاة أقل في 150 شخصًا تم علاجهم على مدى 5 سنوات)، ولكن لوحظت مخاوف بشأن جودة البيانات.[99]
تزيد مكملات بيتا كاروتين من معدلات الإصابة بسرطان الرئة لدى الأشخاص المعرضين لخطر كبير.[100] مكملات حمض الفوليك غير فعالة في الوقاية من سرطان القولون وقد تزيد من السلائل القولونية. لم يثبت أن مكملات السيلينيوم تقلل من خطر الإصابة بالسرطان.
المصل[عدل]
تم تطوير لقاحات تمنع الإصابة ببعض الفيروسات المسببة للسرطان.[101] مثل لقاح فيروس الورم الحليمي البشري (المعروف باسم الجارداسيل والسيرفاريكس) والذي يقلل من خطر الإصابة بسرطان عنق الرحم. يمنع لقاح التهاب الكبد B الإصابة بفيروس التهاب الكبد B وبالتالي يقلل من خطر الإصابة بسرطان الكبد. يوصى بإعطاء لقاحات فيروس الورم الحليمي البشري والتهاب الكبد B حيثما تسمح الموارد بذلك.[102]
الفحص المبكر[عدل]
على عكس الجهود التشخيصية الناجمة عن الأعراض، فإن فحص السرطان يتضمن جهودًا للكشف عن السرطان بعد تكوينه ، ولكن قبل ظهور أي أعراض ملحوظة.[103] وقد يشمل ذلك الفحص المبكر الفحص البدني ، أو فحوصات الدم أو البول أو التصوير الطبي.[103] مع ذلك فحص السرطان غير متاح للعديد من أنواع السرطان. حتى عندما تتوفر الاختبارات ، قد لا يوصى بها للجميع. يشمل الفحص الشامل فحص الجميع .[104]
الفحص الانتقائي يحدد الأشخاص الأكثر عرضة للخطر ، مثل الأشخاص الذين لديهم تاريخ عائلي.[104] يتم النظر في العديد من العوامل لتحديد ما إذا كانت فوائد الفحص تفوق مخاطر وتكاليف الفحص.[103] تتضمن هذه العوامل:
- الأضرار المحتملة من اختبار الفحص: على سبيل المثال ، تتضمن صور الأشعة السينية التعرض للإشعاع المؤين الذي يحتمل أن يكون ضارًا. مثلا في اليابان، ربما انخفضت معدلات الوفيات من خلال إجراء فحص باستخدام التصوير الضوئي للفلور ، والذي ربما ساهم أيضًا في استمرار ارتفاع معدلات الإصابة في البلاد.[105]
- احتمال أن يحدد الاختبار السرطان بشكل صحيح
- احتمالية الإصابة بالسرطان: لا يفيد الفحص في حالات السرطان النادرة.
- الأضرار المحتملة من إجراءات المتابعة
- ما إذا كان العلاج المناسب متاحًا
- ما إذا كان الكشف المبكر يحسن نتائج العلاج
- ما إذا كان السرطان سيحتاج إلى علاج
- ما إذا كان الاختبار مقبولًا لدى الأشخاص: إذا كان اختبار الفحص مرهقًا للغاية (على سبيل المثال ، مؤلم)، فسيرفض الأشخاص الاختبار.[104]
- الكلفة

الاختبار الجيني[عدل]
الاختبار الجيني هو للأفراد المعرضين لخطر الإصابة ببعض أنواع السرطان وهو موصى به من قبل مجموعات غير رسمية.[106] قد يخضع حاملو هذه الطفرات بعد ذلك إلى مراقبة محسنة أو وقاية كيميائية أو جراحة وقائية للحد من المخاطر اللاحقة.[106] مثلا جينات ال BRCA1 و BRCA2 في سرطان الثدي والمبيض والبنكرياس، وجينات الHNPCC ، MLH1 ، MSH2 ، MSH6 ، PMS1 ، PMS2 في سرطان القولون ، الرحم ، الأمعاء الدقيقة ، المعدة ، والجهاز البولي.
طرق العلاج[عدل]
تتم معالجة مرض السرطان بالجراحة، بالعلاج الكيميائي أو بالعلاج الإشعاعي، كما يوجد أيضا العلاج المناعي، العلاج الهرموني،العلاج الموجه، والعلاج التلطيفي. يُختار مختص الأورام العلاج حسب مكان السرطان ودرجته ومرحلته وحالة المريض. يكون هدف العلاج هو إزالة السرطان من جسد المريض من غير تدمير الأعضاء السليمة.
العلاج الجراحي[عدل]

الجراحة هي الطريقة الأساسية لعلاج معظم السرطانات الصلبة والمعزولة وقد تلعب دورًا في السيطرة أوتسكين أعراض السرطان وإطالة البقاء على قيد الحياة. عادة ما تكون جزءًا مهمًا في التشخيص النهائي وتصنيف الأورام ، حيث عادةً تكون الخزعات مطلوبة.لذا عند إجراء العملية الجراحية يبعث الجراح عينة من حافة الجزء المزال إلى أخصائي الباثولوجيا الجراحية للتأكد من خلوها من أية خلايا مصابة، لتقليل فرص انتكاس المريض. في حالات السرطان الموضعي ، عادة ما تحاول الجراحة لإزالة الكتلة بأكملها مع ، في بعض الحالات ، العقد الليمفاوية في المنطقة. بالنسبة لبعض أنواع السرطان يكون هذا كافياً للقضاء على السرطان.[107]
العلاج الكيميائي[عدل]

العلاج الكيميائي هو علاج السرطانات بالأدوية الكيميائية (بواحد أو أكثر من أدوية سمية مضادة للسرطان) قادرة على تدمير الخلايا السرطانية. يستخدم حاليا لفظ العلاج الكيميائي للتعبيرعن أدوية سامة للخلايا ويشمل المصطلح مجموعة متنوعة من الأدوية ، والتي تنقسم إلى فئات واسعة مثل عوامل الألكلة ومضادات المستقلب.[108] تعمل عوامل العلاج الكيميائي التقليدية عن طريق قتل الخلايا التي تنقسم بسرعة ، وهي خاصية مهمة لمعظم الخلايا السرطانية.
تعتمد فعالية العلاج الكيميائي على نوع السرطان ومرحلته. بالاشتراك مع الجراحة ، أثبت العلاج الكيميائي أنه مفيد في أنواع السرطان بما في ذلك سرطان الثدي ، وسرطان القولون والمستقيم ، وسرطان البنكرياس ، وساركوما العظم العظمي ، وسرطان الخصية ، وسرطان المبيض ، وبعض أنواع سرطان الرئة.[109] العلاج الكيميائي يعتبرعلاجي لبعض أنواع السرطان ، مثل بعض أنواع اللوكيميا ، [110][111] غير فعال في بعض أورام الدماغ ، [112] ولا داعي له في حالات أخرى ، مثل معظم أنواع سرطان الجلد غير الميلانيني.[113] غالبًا ما تكون فعالية العلاج الكيميائي محدودة بسبب سميته للأنسجة الأخرى في الجسم. حتى عندما لا يوفر العلاج الكيميائي علاجًا دائمًا ، فقد يكون مفيد في تقليل الأعراض مثل الألم أو تقليل حجم الورم غير القابل للجراحة على أمل أن تصبح الجراحة ممكنة في المستقبل.
أحياناً يكون تقديم نوعين من الأدوية إلى المريض أفضل من دواء واحد، ويسمى هذا بتجميع الأدوية الكيميائية المركبة والتي لها ميزة مهمة في إحصائيًات البقاء واستجابة الورم وفي تقدم المرض في الحالات،[114] ولخصت دراسة منهجية أن هناك تفضيل للعلاج الكيميائي المركب على الدواء الواحد لعلاج سرطان الثدي النقيل. مع ذلك لا يوجد ما يجزم ما إذا كان إعطاء العلاج الكيميائي المركب يؤدي إلى نتائج صحية أفضل ، عندما يتم النظر في كل من البقاء والسمية ، وما إذا كانت معدلات الاستجابة الأفضل ومعدلات البقاء على قيد الحياة خالية من التقدم تترجم بالفعل إلى بقاء أفضل بشكل عام.[115]
العلاج الموجه هو شكل من أشكال العلاج الكيميائي الذي يستهدف الفروق الجزيئية بين السرطان والخلايا الطبيعية. أول العلاجات المستهدفة منعت جزيء مستقبلات هرمون الاستروجين ، مما يمنع نمو سرطان الثدي. مثال شائع آخر هو فئة مثبطات Bcr-Abl ، والتي تستخدم لعلاج ابيضاض المحببات المزمن. هناك أدوية أخري مثل الإماتينيب والجيفيتينب واللذان يعملان علي كبح بروتين الكيناز التيروسين ويمكن أن يكون لهم فائدة في ورم المعدي المعوي.توجد حاليًا علاجات مستهدفة لكثير من أنواع السرطان الأكثر شيوعًا ، بما في ذلك سرطان المثانة وسرطان الثدي وسرطان القولون والمستقيم وسرطان الكلى وسرطان الدم وسرطان الكبد وسرطان الرئة والأورام الليمفاوية وسرطان البنكرياس وسرطان البروستاتا وسرطان الجلد وسرطان الغدة الدرقية وكذلك أنواع السرطان الأخرى.[116]
بالنسبة للمرأة الحامل، وجد أن العلاج الكيميائي هو سبب في بعض التشوهات التي تحدث في الطفل خاصة في منطقة الوجه والحنك.[117]
العلاج الإشعاعي[عدل]
العلاج الإشعاعي يعتمد علي استخدام الإشعاع المؤين لعلاج الأعراض أو تحسينها. يعمل عن طريق إتلاف الحمض النووي للأنسجة السرطانية، وقتلها. لتجنيب الأنسجة الطبيعية (مثل الجلد أو الأعضاء ، التي يجب أن يمر عبرها الإشعاع لعلاج الورم)، يتم عمل الإشعاع من زوايا مختلفة لتتعارض مع الورم ، مما لا يعرض الأنسجة السليمة المحيطة بجرعة كبيرة من الإشعاع. كما هو الحال مع العلاج الكيميائي ، تختلف السرطانات في استجابتها للعلاج الإشعاعي كما هو الحال في العلاج الكيميائي.[118][119]
يستخدم العلاج الإشعاعي في حوالي نصف الحالات. يمكن أن يكون الإشعاع إما من مصادر داخلية (العلاج الإشعاعي الموضعي) أو من مصادر خارجية. الإشعاع هو أشعة سينية منخفضة الطاقة لعلاج سرطانات الجلد ، في حين يتم استخدام أشعة سينية ذات الطاقة الأعلى للسرطان داخل الجسم. يستخدم الإشعاع عادةً بالإضافة إلى الجراحة أو العلاج الكيميائي. في أنواع معينة من السرطان، مثل سرطان الرأس والعنق المبكر، يمكن استخدامه وحده.[107] لورم عظمي نقيل ، وجد أنه فعال في حوالي 70٪ من المرضى.[107]

العلاج بالليزر[عدل]
يستخدم العلاج بالليزرضوءًا قوي لعلاج السرطان عن طريق تقليص أو تدمير الأورام السرطانية. يستخدم الليزر بشكل شائع لعلاج السرطانات السطحية الموجودة على سطح الجسم أو بطانة الأعضاء الداخلية. يتم استخدامه لعلاج سرطان جلد الخلايا القاعدية والمراحل المبكرة جدًا من حالات سرطان عنق الرحم والقضيب والمهبل والفرج وسرطان الرئة ذو الخلايا غير الصغيرة. وغالبًا ما يتم دمجه مع علاجات أخرى ، مثل الجراحة أو العلاج الكيميائي أو العلاج الإشعاعي. يستخدم العلاج الحراري الخلالي المحرض بالليزر، أو التخثير الضوئي بالليزر الخلالي يستخدم الليزر في علاج بعض أنواع السرطان باستخدام فرط الحرارة ، والذي يستخدم الحرارة لتقليص الأورام عن طريق إتلاف الخلايا السرطانية أو قتلها. الليزر أكثر دقة من الجراحة ويسبب ضررًا وألمًا ونزيفًا وتورمًا وتندبًا أقل . العيب هو أن الجراحين يجب أن يحصلوا على تدريب متخصص وقد يكون أكثر تكلفة من العلاجات الأخرى.[120]
العلاج الديناميكي الضوئي هو نوع آخر من علاج السرطان الذي يعتمد علي الليزر. فيتم حقن محسس ضوئي في المريض وتمتصه الخلايا في جميع أنحاء جسم المريض. ثم بعد يومين ، يتم العثور على المادة في الخلايا السرطانية. ثم يتم استخدام ضوء الليزرلتنشيط المحسن الضوئي وتدمير الخلايا السرطانية. لأن المحسس الضوئي يجعل البشرة والعينين حساستين للضوء بعد ذلك ، ينصح المرضى بتجنب أشعة الشمس المباشرة والضوء الساطع خلال تلك الفترة.[120]
العلاج المناعي[عدل]
هناك مجموعة متنوعة من العلاجات التي تستخدم العلاج المناعي، لتحفيز أو مساعدة الجهاز المناعي لمحاربة السرطان، دخلت حيز الاستخدام منذ عام 1997. تشمل الأجسام المضادة، ونقل الخلايا بالتبني.[121] هناك فئات من الأدوية المستخدمة في العلاج الكيميائي للسرطان ومنها مجموعة الانتراسيكلين المستخرجة من البكتيريا المتسلسلة والتي عند وجودها علي سطح الخلية، تمكن الجهاز المناعي من التمييز بين الخلايا السرطانية والخلايا السليمة. مما يؤدي إلى استنفار الجهاز المناعي فتقوم خلاياه بالتهام الخلايا السرطانية ودفع السرطان إلى الموت وتسمى العملية بأحداث الموت المناعي.[122] مع ذلك لا يوجد أي دراسات تؤكد كفائة المادة ، بالإضافة الي ذلك، في الآونة الأخيرة ، خضع الأنثراسيكلين للتدقيق بسبب آثاره السامة للقلب.[123]
العلاج الهرموني[عدل]
انظر أيضا: معالجة هرمونية (علم الأورام)
العلاج الهرموني يعتمد على التلاعب في نظام الغدد الصماء من خلال التدخل بهرمونات معينة ، وخاصة هرمونات الستيرويد، أو الأدوية التي تمنع إنتاج أو نشاط مثل هذه الهرمونات.
الرعاية التلطيفية[عدل]
انظر أيضا: رعاية تلطيفية
الرعاية التلطيفية هي العلاج الذي يحاول مساعدة المريض في الشعور بالتحسن ويمكن دمجه مع محاولة لعلاج السرطان. تتضمن الرعاية التلطيفية إجراءات للحد من الاضطرابات الجسدية والعاطفية والروحية والنفسية والاجتماعية. على عكس العلاج الذي يهدف إلى قتل الخلايا السرطانية مباشرةً ، فإن الهدف الأساسي للرعاية التلطيفية هو تحسين جودة الحياة.[124]
عادةً ما يتلقى الأشخاص في جميع مراحل علاج السرطان نوعًا من الرعاية التلطيفية. في بعض الحالات، توصي المنظمات الطبية المتخصصة بأن يستجيب المرضى والأطباء للسرطان فقط مع الرعاية التلطيفية.[125] ينطبق هذا على المرضى الذين:[125][126]
- أداء منخفض في حالتهم، مما يترتب عليه قدرة محدودة على رعاية أنفسهم
- لم يتلق أي فائدة من العلاجات السابقة المستندة إلى الأدلة
- غير مؤهلين للمشاركة في أي تجربة سريرية مناسبة
- لا يوجد دليل قوي يشير إلى أن العلاج سيكون فعالا في حالاتهم
- تم تشخيصهم لأول مرة بمرض نقيلي، يمكن الإشارة إلى الرعاية التلطيفية على الفور
- تم تشخيصهم وهناك توقع بأن لديهم أقل من 12 شهرًا من العمر حتى مع العلاج الشديد.
قد يتم الخلط بين الرعاية التلطيفية مع الرعاية في مرحلة الاحتضار، وبالتالي يشار فقط عندما يقترب الناس من نهاية الحياة. تحاول الرعاية التلطيفية مساعدة المريض على التعامل مع احتياجاته الفورية وزيادة الراحة، ولا تتطلب الرعاية التلطيفية من الأشخاص التوقف عن العلاج الذي يستهدف السرطان، عكس الرعاية في مرحلة الاحتضار. توصي المبادئ التوجيهية الطبية الوطنية المتعددة بالرعاية التلطيفية المبكرة للمرضى الذين تسبب سرطانهم في أعراض مزعجة أو الذين يحتاجون إلى المساعدة في التعامل مع مرضهم.[127]
العلاج الجيني[عدل]
العلاج الجيني من أهم الإستراتيجيات الجديدة في مكافحة مرض السرطان. يتضمن العلاج الجيني أي إجراء يهدف إلى علاج أو تخفيف المرض عن طريق تعديل خلية المريض وراثيًا.[128] قد تكون المادة التي سيتم نقلها إلى خلايا المريض عبارة عن جينات أو أجزاء جينية أو نوكليوتيدات. يمكن إجراء العلاج الجيني بالاقتراب من الخلايا المستهدفة مباشرة ، مثل الحقن داخل الجلد، أو العلاج داخل عنق الرحم لسرطان المثانة السطحي. تشمل الآثار الجانبية الأكثر شيوعًا بعد العلاج الجيني الحمى العابرة والأعراض الشبيهة بالإنفلونزا.[129] مشكلة رئيسية أخرى في العلاج الجيني للسرطان هي مقاومة العلاج برجوع الورم وفرصة البقاء علي قيد الحياة أقصر.[130]
العلاج البديل[عدل]
العلاج المكمل والبديل نوع مختلف من العلاجات المتبعة. معظم هذا العلاج ليس له أي دليل علمي ولم يثبت بطرق علمية مثل إجراء تجارب إكلينيكية أو تجريبه على الحيوانات. وعند تجربة بعض المواد البديلة لم يتم وجود جدوى لها. ومثال على ذلك، المنتدى السنوي عام 2007 للجمعية الأمريكية لعلم الأورام الإكلينيكي قد أورد فشل تجارب المرحلة الثالثة للمقارنة بين غضروف سمك القرش في علاج سرطان الرئة.[131]
يمكن أن تكون التوصيات مثل «تعزيز المناعة» و «التطهير» مضللة للمرضى فيما يتعلق بسبب مرضهم وقد قوبلت بخوف من الأعراض الجانبية للعلاج المتبع، وللتكلفة. ومع عدم إثبات كفاءة هذا العلاجات في الوقت الحالي، يُعتبر بعض الأخصائيين الدعاية والترويج لبعض المواد المدعى بكفاءتها في علاج السرطان غير حقيقية.[132][133]
المَآل[عدل]
تختلف معدلات البقاء على قيد الحياة حسب نوع السرطان والمرحلة التي يتم فيها تشخيص المرض ، وتتراوح بين بقاء الأغلبية أو إلى الوفيات بعد خمس سنوات من التشخيص. بمجرد أن ينتقل السرطان ، يصبح التكهن عادة أسوأ. حوالي نصف المرضى الذين يتلقون علاجًا من السرطان الغازي (باستثناء السرطانة اللابدة وسرطانات الجلد غير الميلانينية) يموتون بسبب هذا السرطان أو علاجه.
قد يكون البقاء على قيد الحياة أسوأ في العالم النامي ،[134] ويعود ذلك جزئيًا إلى أن أنواع السرطان الأكثر شيوعًا هناك أصعب علاجًا من تلك المرتبطة بالدول المتقدمة.[135] أولئك الذين ينجون من السرطان يصابون بسرطان أولي ثانوي بمعدل ضعف أولئك الذين لم يتم تشخيصهم أبدًا.[136]
يعتمد التنبؤ بالبقاء على المدى القصير أو الطويل على العديد من العوامل. والأكثر أهمية هو نوع السرطان وعمر المريض وصحته العامة. أولئك الذين يعانون من مشاكل صحية أخرى لديهم معدلات بقاء أقل من الأشخاص الأصحاء.من غير المرجح أن يعيش المعمرين لمدة خمس سنوات حتى إذا نجح العلاج. يميل الأشخاص الذين يعيشون جودة حياة أعلى إلى البقاء لفترة أطول.[136] قد يتأثر الأشخاص الذين يعانون من انخفاض جودة الحياة بالاكتئاب والمضاعفات الأخرى مما يضعف جودة الحياة أو لمجرد أنهم يدركون أن حالتهم من المحتمل أن تكون قاتلة ويؤدي نهاية الي تطور المرض .[136]
يزداد خطر الإصابة بالجلطات الدموية في عروق الأشخاص المصابين بالسرطان مما قد يهدد الحياة.[137] استخدام مخففات الدم مثل الهيبارين يقلل من خطر تجلط الدم ولكن لم يثبت أنه يزيد من بقاء المصابين بالسرطان. الأشخاص الذين يتناولون مخففات الدم لديهم أيضًا خطر متزايد للنزيف.[137]
البحث العلمي[عدل]
تتم دراسة علاجات السرطان التجريبية في التجارب السريرية لمقارنة العلاج المقترح بأفضل علاج موجود. يمكن اختبار العلاجات التي نجحت في أحد أنواع السرطان مع أنواع أخرى.[138] الاختبارات التشخيصية قيد التطوير لتستهدف العلاج المناسب للمرضى المناسبين ، بناءً على بيولوجيتهم الفردية.[139]
تركز أبحاث السرطان على القضايا التالية:
- العوامل (مثل الفيروسات) والأحداث (مثل الطفرات) التي تسبب أو تسهل التغيرات الجينية في الخلايا الموجهة لتصبح سرطانية.
- الطبيعة الدقيقة للضرر الجيني والجينات المتأثرة به.
- عواقب هذه التغييرات الجينية على بيولوجيا الخلية ، سواء في توليد الخصائص المحددة للخلية السرطانية وفي تسهيل الأحداث الجينية الإضافية التي تؤدي إلى مزيد من تطور السرطان.
يبدو أن التنافس على الموارد المالية قد قلل من الإبداع والتعاون والمجازفة والتفكير الأصلي المطلوب لتحقيق الاكتشافات الأساسية، مع وجود تفضيل للبحث المنخفض المخاطرفالميول أصبحت غير داعية إلى تطورات إضافية صغيرة على البحث الأكثر خطورة وابتكارًا. يبدو أن هناك عواقب أخرى للمنافسة منها العديد من الدراسات ذات الادعاءات الدرامية التي لا يمكن تكرار نتائجها والحوافز الضارة التي تشجع المؤسسات المانحة على النمو دون القيام باستثمارات كافية في أعضاء هيئة التدريس والمرافق الخاصة بها.[140][141]
سم العقرب وعلاقته بالسرطان[عدل]
في عام 2012، نشرت دراسة إيطالية تناولت تأثير سم العقارب الزرقاء المستوطنة في كوبا علي إحدي المرضي، وجدت أن المريض أحس براحة كاملة غير متوقعة من الألم مع استعادة جيدة لقوة العضلات والطاقة الحيوية والقدرة على التأقلم مع الأنشطة اليومية مثل الوجبات والمشي والتفاعل مع الأقارب ومقدمي الرعاية.[142]
ويعد التقرير الصادر عن نتيجة للدراسة الأول الذي يشجع على الرضاعة الطبيعية. ويشير التقرير إلى أن ذلك يقلل من مخاطر الإصابة بسرطان الثدي عند الأم، كما أنها تساعد على تمتع الطفل بمقاومة حسنة ضد الحساسية، إذ يبدو أن أمراض الحساسية عند الأطفال لها علاقة بالألبان الصناعية وعدم تغذيتهم التغذية الطبيعية من لبن الأم.
التأثير العاطفي[عدل]
بعض الدراسات الأولية تقترح أن الأسرة والعلاقات الاجتماعية، وما لها من تأثير نفسي وعاطفي على المريض، قد تقلل من احتمالية وفاة المريض.[143] كما تساعد عوامل مثل الدين والتعلم في تقبل المريض لمرضه أو حتى تقبل قرب آجله. كما برزت علوم جديدة مثل علم نفسية مريض الأورام لترشد الأطباء والجراحين بتحسين التعامل مع المريض وإبداء التفهم والتعاطف مع كل حالة ومردود ذلك على صحة المريض النفسية والعاطفية. وترفض تلك الدراسات تعريف الحقيقة المؤلمة للمريض دون مواربة بإصابته بالسرطان أو بتردي حالته، وفي المقابل تؤيد تقديم حالة المرض بصورة بطيئة غير مباشرة للمريض لعدم إصابة المريض وأهله بالذعر.[144] توجد منظمات تقدم العديد من المساعدات لمرض السرطان. وقد تتمثل في تقديم الاستشارة، النصيحة، المساعدة المالية، توفير أفلام أو وسائط للتعريف بالمرض. وتكون تلك المنظمات إما حكومية أو خيرية وعملها هو مساعدة المريض لتحدي وتخطي مرض السرطان.
رهاب السرطان[عدل]
رهاب السرطان هو رهاب شائع واضطراب وقلق يتميز بالخوف المزمن من الإصابة بالسرطان. يمكن أن تظهر في مشاعر هائلة من الحزن والخوف والذعر والضيق. في بعض الحالات ، يمكن أن يكون الرهاب شديدًا لدرجة أنه يمنع الفرد من العيش حياة طبيعية. غالبًا ما يعاني الأشخاص المصابون برهاب السرطان من الاكتئاب. قد يصبح المعاناة منعزلاً ووسواسًا على صحتهم. قد يشعرون بالإرهاق ويفشلون في أداء وظائفهم المعتادة. يرتبط الخوف بنقص التخطيط المستقبلي وضعف جودة الحياة بشكل عام.[145] كما أن الناجين من مرض السرطان معرضون أيضًا للإصابة بالخوف من التكرار بسبب تجربتهم السابقة مع المرض. حوالي نصف الناجين من السرطان يبلغون عن خوف متوسط إلى مرتفع من تكرار المرض.[145] يستخدم العلاج السلوكي المعرفي في التغلب علي المخاوف والرهاب ، بما في ذلك رهاب السرطان والذي يساعد المرضى على زيادة الوعي باضطرابهم ، ويوفر طرقًا للمرضى للتعامل مع مشاعرهم.[146]
تاريخ السرطان[عدل]
السرطان موجود طوال التاريخ البشري،[147] لكن وجد أول تسجيل تاريخي مكتوب عن السرطان في عام 1600ق.م على بردية ادوين سميث المصرية والتي كانت تحتوي على تشخيص لسرطان الثدي.[147] وصف أبقراط (470 ق.م- 370 ق.م) عدة أنواع من السرطان، في أشارة اليهم اليونيانية καρκίνος karkinos ما يعني (سرطان البحر أو جراد البحر).[147] يأتي هذا الاسم من ظهور السطح الصلب من الورم الخبيث، بالإضافة إلى «أن تمدد الأوردة من جميع الجوانب يجعل للورم أقدام كالسلطعون، ومن هنا استمد اسمه».[148] وصرح جالينوس أن«سرطان الثدي يُطلق عليه ذلك للتشابه المتخيل لسرطان البحر بسبب المنظر الجانبي للورم والأوردة المنتفخة المجاورة.».[149] قام سيلسوس (25 ق.م - 50 م) بترجمة كلمة karkinos إلى السرطان اللاتيني، وهو ما يعني أيضًا سرطان البحر والجراحة الموصى بها كعلاج.
لم يوافق جالينوس (الذي عاش في القرن الثاني الميلادي) على استخدام الجراحة كعلاج للتخلص من السرطان ونصح باستخدام العلاجات المعتادة.[147] هذه التوصيات استمرت إلى حد كبير لمدة 1000 سنة.[147]
في القرن الخامس عشر والسادس عشر والسابع عشر، أصبح من المقبول بالنسبة للأطباء تشريح الجثث لاكتشاف سبب الوفاة.[150] يعتقد الأستاذ الألماني ويلهلم فابري أن سرطان الثدي ناجم عن تجلط الحليب في قناة الثدي. بينما يعتقد الأستاذ الهولندي فرانسوا دي لا بوي سيلفيوس- أحد أتباع ديكارت- أن كل الأمراض كانت نتيجة للعمليات الكيميائية أو النهج الكيميائي وأن السائل اللمفاوي الحمضي هو سبب السرطان. بينما يعتقد نيكولايس تولب أن السرطان كان سماً ينتشر ببطء وانتهى إلى أنه معدي.[151]
وضح الطبيب جون هيل أن شم التبغ سبب سرطان الأنف في عام 1761.[150] تلا ذلك تقرير عام 1775 من قبل الجراح البريطاني بيرسيفال بوت بأن سرطان منظفي المداخن- وهو سرطان كيس الصفن- كان مرضًا شائعًا بين منظفي المداخن.[152] في القرن الثامن عشر مع التطور العلمي واستخدام المجهر على نطاق واسع، تم اكتشاف أن «سم السرطان» ينتشر من الورم الرئيسي عبر الغدد الليمفاوية إلى مواقع أخرى لذلك يعتبر («ورم خبيث»). وأول من استنبط هذه المعلومة عن المرض كان الجراح الإنجليزي كامبل دي مورجان بين عامي 1871 و1874.[153]
انظر ايضًا[عدل]
المراجع[عدل]
- ^ محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 111، OCLC:4769982658، QID:Q126042864
- ^ Anisimov VN، Sikora E، Pawelec G (أغسطس 2009). "Relationships between cancer and aging: a multilevel approach". Biogerontology. ج. 10 ع. 4: 323–38. DOI:10.1007/s10522-008-9209-8. PMID:19156531.
- ^ Principles and practice of screening for disease. Geneva:منظمة الصحة العالمية. Public Health Papers, #34. نسخة محفوظة 07 فبراير 2019 على موقع واي باك مشين.
- ^ Azzoli CG، Temin S، Aliff T، Baker S، Brahmer J، Johnson DH، Laskin JL، Masters G، Milton D، Nordquist L، Pao W، Pfister DG، Piantadosi S، Schiller JH، Smith R، Smith TJ، Strawn JR، Trent D، Giaccone G (أكتوبر 2011). "2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer". Journal of Clinical Oncology. ج. 29 ع. 28: 3825–31. DOI:10.1200/JCO.2010.34.2774. PMC:3675703. PMID:21900105.
- ^ "Signs and Symptoms of Childhood Cancer: A Guide for Early Recognition". مؤرشف من الأصل في 2017-11-28.
- ^ ا ب ج "Cancer". www.who.int (بالإنجليزية). Archived from the original on 2020-03-08. Retrieved 2020-03-27.
- ^ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (10 08, 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet (London, England). ج. 388 ع. 10053: 1545–1602. DOI:10.1016/S0140-6736(16)31678-6. ISSN:1474-547X. PMC:5055577. PMID:27733282. مؤرشف من الأصل في 2020-03-27.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) و|الأخير=باسم عام (مساعدة)صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) - ^ "Risk Factors and Cancer | CDC". www.cdc.gov (بالإنجليزية الأمريكية). 29 Oct 2019. Archived from the original on 2020-01-03. Retrieved 2020-03-27.
- ^ ا ب Michael O'Dell; MD, Michael Stubblefield (22 Apr 2009). Cancer Rehabilitation: Principles and Practice (بالإنجليزية). Demos Medical Publishing. ISBN:978-1-935281-38-2. Archived from the original on 2015-04-25.
- ^ Cancer Research UK (يناير 2007). "UK cancer incidence statistics by age". مؤرشف من الأصل في 2012-08-18. اطلع عليه بتاريخ 2007-06-25.
- ^ WHO (فبراير 2006). "Cancer". World Health Organization. مؤرشف من الأصل في 2018-04-19. اطلع عليه بتاريخ 2007-06-25.
- ^ منظمة الصحة العالمية | السرطان نسخة محفوظة 12 يوليو 2017 على موقع واي باك مشين.
- ^ ا ب ج Anand، Preetha؛ Kunnumakara، Ajaikumar B.؛ Sundaram، Chitra؛ Harikumar، Kuzhuvelil B.؛ Tharakan، Sheeja T.؛ Lai، Oiki S.؛ Sung، Bokyung؛ Aggarwal، Bharat B. (2008-9). "Cancer is a Preventable Disease that Requires Major Lifestyle Changes". Pharmaceutical Research. ج. 25 ع. 9: 2097–2116. DOI:10.1007/s11095-008-9661-9. ISSN:0724-8741. PMC:2515569. PMID:18626751. مؤرشف من الأصل في 2019-11-20.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ ا ب اعراض مرض السرطان نسخة محفوظة 05 2يناير6 على موقع واي باك مشين.
- ^ Holly, Elizabeth A.; Chaliha, Indranushi; Bracci, Paige M.; Gautam, Manjushree (1 Jun 2004). "Signs and symptoms of pancreatic cancer: a population-based case-control study in the San Francisco Bay area". Clinical Gastroenterology and Hepatology (بالإنجليزية). 2 (6): 510–517. DOI:10.1016/S1542-3565(04)00171-5. ISSN:1542-3565. Archived from the original on 2020-03-27.
- ^ Arends, Jann; Bachmann, Patrick; Baracos, Vickie; Barthelemy, Nicole; Bertz, Hartmut; Bozzetti, Federico; Fearon, Ken; Hütterer, Elisabeth; Isenring, Elizabeth (1 Feb 2017). "ESPEN guidelines on nutrition in cancer patients". Clinical Nutrition (بالإنجليزية). 36 (1): 11–48. DOI:10.1016/j.clnu.2016.07.015. ISSN:0261-5614. Archived from the original on 2020-03-27.
- ^ Tisdale, Michael J. (2002-11). "Cachexia in cancer patients". Nature Reviews Cancer (بالإنجليزية). 2 (11): 862–871. DOI:10.1038/nrc927. ISSN:1474-1768. Archived from the original on 2020-03-27.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(help) - ^ Dimitriadis، Georgios K.؛ Angelousi، Anna؛ Weickert، Martin O.؛ Randeva، Harpal S.؛ Kaltsas، Gregory؛ Grossman، Ashley (06 2017). "Paraneoplastic endocrine syndromes". Endocrine-Related Cancer. ج. 24 ع. 6: R173–R190. DOI:10.1530/ERC-17-0036. ISSN:1479-6821. PMID:28341725. مؤرشف من الأصل في 29 ديسمبر 2019.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Gupta, Gaorav P.; Massagué, Joan (17 Nov 2006). "Cancer Metastasis: Building a Framework". Cell (بالإنجليزية). 127 (4): 679–695. DOI:10.1016/j.cell.2006.11.001. ISSN:0092-8674. Archived from the original on 2013-02-06.
- ^ ا ب Anand، Preetha؛ Kunnumakara، Ajaikumar B.؛ Sundaram، Chitra؛ Harikumar، Kuzhuvelil B.؛ Tharakan، Sheeja T.؛ Lai، Oiki S.؛ Sung، Bokyung؛ Aggarwal، Bharat B. (2008-9). "Cancer is a Preventable Disease that Requires Major Lifestyle Changes". Pharmaceutical Research. ج. 25 ع. 9: 2097–2116. DOI:10.1007/s11095-008-9661-9. ISSN:0724-8741. PMC:2515569. PMID:18626751. مؤرشف من الأصل في 20 نوفمبر 2019.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ K. G.; Akushevich, Igor; Kravchenko, Julia (28 Dec 2008). Cancer Mortality and Morbidity Patterns in the U.S. Population: An Interdisciplinary Approach (بالإنجليزية). Springer Science & Business Media. ISBN:978-0-387-78193-8. Archived from the original on 2020-03-27.
- ^ Islami، Farhad؛ Goding Sauer، Ann؛ Miller، Kimberly D.؛ Siegel، Rebecca L.؛ Fedewa، Stacey A.؛ Jacobs، Eric J.؛ McCullough، Marjorie L.؛ Patel، Alpa V.؛ Ma، Jiemin (01 2018). "Proportion and number of cancer cases and deaths attributable to potentially modifiable risk factors in the United States". CA: a cancer journal for clinicians. ج. 68 ع. 1: 31–54. DOI:10.3322/caac.21440. ISSN:1542-4863. PMID:29160902. مؤرشف من الأصل في 7 مارس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Cohen، Sheldon؛ Murphy، Michael L.M.؛ Prather، Aric A. (4 يناير 2019). "Ten Surprising Facts About Stressful Life Events and Disease Risk". Annual review of psychology. ج. 70: 577–597. DOI:10.1146/annurev-psych-010418-102857. ISSN:0066-4308. PMC:6996482. PMID:29949726. مؤرشف من الأصل في 2020-03-27.
- ^ Tolar, Jakub; Neglia, Joseph P. (2003-06). "Transplacental and Other Routes of Cancer Transmission Between Individuals". Journal of Pediatric Hematology/Oncology (بالإنجليزية الأمريكية). 25 (6): 430–434. ISSN:1077-4114. Archived from the original on 2020-03-27.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(help) - ^ Biesalski, Hans Konrad; Mesquita, Bas Bueno De; Chesson, Andrew; Chytil, Frank; Grimble, Robert; Hermus, R. J. J.; Köhrle, Jochen; Lotan, Reuben; Norpoth, Karl (1998). "European Consensus Statement on Lung Cancer: Risk factors and prevention. Lung Cancer Panel". CA: A Cancer Journal for Clinicians (بالإنجليزية). 48 (3): 167–176. DOI:10.3322/canjclin.48.3.167. ISSN:1542-4863. Archived from the original on 2020-03-27.
- ^ "Tobacco use and cancer causation: association by tumour type". مؤرشف من الأصل في 2020-02-05.
- ^ "Tobacco use, cancer causation and public health impact". مؤرشف من الأصل في 2020-01-28.
- ^ Thun، Michael J؛ Jemal، Ahmedin (2006-10). "How much of the decrease in cancer death rates in the United States is attributable to reductions in tobacco smoking?". Tobacco Control. ج. 15 ع. 5: 345–347. DOI:10.1136/tc.2006.017749. ISSN:0964-4563. PMC:2563648. PMID:16998161. مؤرشف من الأصل في 2020-03-27.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Dubey، Sarita؛ Powell، Charles A. (1 مايو 2008). "Update in Lung Cancer 2007". American Journal of Respiratory and Critical Care Medicine. ج. 177 ع. 9: 941–946. DOI:10.1164/rccm.200801-107UP. ISSN:1073-449X. PMC:2720127. PMID:18434333. مؤرشف من الأصل في 2020-03-27.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: تنسيق PMC (link) - ^ Schütze، Madlen؛ Boeing، Heiner؛ Pischon، Tobias؛ Rehm، Jürgen؛ Kehoe، Tara؛ Gmel، Gerrit؛ Olsen، Anja؛ Tjønneland، Anne M؛ Dahm، Christina C (7 أبريل 2011). "Alcohol attributable burden of incidence of cancer in eight European countries based on results from prospective cohort study". The BMJ. ج. 342. DOI:10.1136/bmj.d1584. ISSN:0959-8138. PMC:3072472. PMID:21474525. مؤرشف من الأصل في 2019-06-01.
- ^ Irigaray, P.; Newby, J. A.; Clapp, R.; Hardell, L.; Howard, V.; Montagnier, L.; Epstein, S.; Belpomme, D. (1 Dec 2007). "Lifestyle-related factors and environmental agents causing cancer: An overview". Biomedicine & Pharmacotherapy (بالإنجليزية). 61 (10): 640–658. DOI:10.1016/j.biopha.2007.10.006. ISSN:0753-3322. Archived from the original on 2014-01-17.
- ^ ا ب "WHO | WHO calls for prevention of cancer through healthy workplaces". WHO. مؤرشف من الأصل في 2020-02-06. اطلع عليه بتاريخ 2020-03-27.
- ^ Anand, Preetha; Kunnumakara, Ajaikumar B.; Sundaram, Chitra; Harikumar, Kuzhuvelil B.; Tharakan, Sheeja T.; Lai, Oiki S.; Sung, Bokyung; Aggarwal, Bharat B. (1 Sep 2008). "Cancer is a Preventable Disease that Requires Major Lifestyle Changes". Pharmaceutical Research (بالإنجليزية). 25 (9): 2097–2116. DOI:10.1007/s11095-008-9661-9. ISSN:1573-904X. PMC:2515569. PMID:18626751. Archived from the original on 2020-07-23.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: تنسيق PMC (link) - ^ "American Cancer Society Guidelines on Nutrition and Physical Activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity". مؤرشف من الأصل في 2020-01-13.
- ^ ا ب Bhaskaran، Krishnan؛ Douglas، Ian؛ Forbes، Harriet؛ dos-Santos-Silva، Isabel؛ Leon، David A؛ Smeeth، Liam (30 أغسطس 2014). "Body-mass index and risk of 22 specific cancers: a population-based cohort study of 5·24 million UK adults". Lancet. ج. 384 ع. 9945: 755–765. DOI:10.1016/S0140-6736(14)60892-8. ISSN:0140-6736. PMC:4151483. PMID:25129328. مؤرشف من الأصل في 2020-03-28.
- ^ "APJCP". web.archive.org. 4 سبتمبر 2011. مؤرشف من الأصل في 2020-03-28. اطلع عليه بتاريخ 2020-03-28.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Mukesh (27 Oct 2008). Cancer Epidemiology: Volume 2, Modifiable Factors (بالإنجليزية). Humana Press. ISBN:978-1-60327-491-3. Archived from the original on 2020-03-28.
- ^ "Risk Factors: Radiation". National Cancer Institute (بالإنجليزية). 29 Apr 2015. Archived from the original on 2020-02-04. Retrieved 2020-03-28.
- ^ ا ب "Risk Factors: Sunlight". National Cancer Institute (بالإنجليزية). 29 Apr 2015. Archived from the original on 2020-02-04. Retrieved 2020-03-28.
- ^ "WHO | Cancer prevention". WHO. مؤرشف من الأصل في 2020-03-07. اطلع عليه بتاريخ 2020-03-28.
- ^ ا ب ج John B. (2000). Ionizing Radiation (بالإنجليزية). BC Decker. Archived from the original on 2018-12-23.
- ^ "Computed tomography--an increasing source of radiation exposure". مؤرشف من الأصل في 2020-03-11.
- ^ ا ب "Chapter 15Ultraviolet Radiation Carcinogenesis". مؤرشف من الأصل في 2016-01-02.
- ^ "IARC CLASSIFIES RADIOFREQUENCY ELECTROMAGNETIC FIELDS AS POSSIBLY CARCINOGENIC TO HUMANS" (PDF). مؤرشف من الأصل (PDF) في 2020-03-19.
- ^ "Electromagnetic Fields and Cancer". National Cancer Institute (بالإنجليزية). 7 Jan 2019. Archived from the original on 2020-03-05. Retrieved 2020-03-28.
- ^ "Cell Phones and Cancer Risk Fact Sheet". National Cancer Institute (بالإنجليزية). 14 Jan 2019. Archived from the original on 2020-02-22. Retrieved 2020-03-28.
- ^ zur Hausen H (1991). "Viruses in human cancers". Science. ج. 254 ع. 5035: 1167–73. ببمد: 1659743.
- ^ Peter S, Beglinger C (2007). "Helicobacter pylori and gastric cancer: the causal relationship". Digestion. ج. 75 ع. 1: 25–35. ببمد: 17429205.
- ^ "Chronic bacterial and parasitic infections and cancer: a review". مؤرشف من الأصل في 2020-01-10.
- ^ ا ب ج د Brian E.; Bernstein, Leslie; Ross, Ronald K. (2000). Hormones and the Etiology of Cancer (بالإنجليزية). BC Decker. Archived from the original on 2017-09-10.
- ^ Rowlands، Mari-Anne؛ Gunnell، David؛ Harris، Ross؛ Vatten، Lars J؛ Holly، Jeff MP؛ Martin، Richard M (15 مايو 2009). "Circulating insulin-like growth factor (IGF) peptides and prostate cancer risk: a systematic review and meta-analysis". International journal of cancer. Journal international du cancer. ج. 124 ع. 10: 2416–2429. DOI:10.1002/ijc.24202. ISSN:0020-7136. PMC:2743036. PMID:19142965. مؤرشف من الأصل في 2020-03-28.
- ^ Lipsett, Mortimer B. (1979). <1967::AID-CNCR2820430704>3.0.CO;2-7 "Interaction of drugs, hormones, and nutrition in the causes of cancer". Cancer (بالإنجليزية). 43 (S5): 1967–1981. DOI:10.1002/1097-0142(197905)43:5+3.0.CO;2-7. ISSN:1097-0142. Archived from the original on 2020-03-28.
- ^ Han، Yuehua؛ Chen، Wuzhen؛ Li، Peiwei؛ Ye، Jun (25 سبتمبر 2015). "Association Between Coeliac Disease and Risk of Any Malignancy and Gastrointestinal Malignancy". Medicine. ج. 94 ع. 38. DOI:10.1097/MD.0000000000001612. ISSN:0025-7974. PMC:4635766. PMID:26402826. مؤرشف من الأصل في 2020-03-28.
- ^ Axelrad، Jordan E؛ Lichtiger، Simon؛ Yajnik، Vijay (28 مايو 2016). "Inflammatory bowel disease and cancer: The role of inflammation, immunosuppression, and cancer treatment". World Journal of Gastroenterology. ج. 22 ع. 20: 4794–4801. DOI:10.3748/wjg.v22.i20.4794. ISSN:1007-9327. PMC:4873872. PMID:27239106. مؤرشف من الأصل في 2019-10-02.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب Roukos، Dimitrios H. (1 أبريل 2009). "Genome-wide association studies: how predictable is a person's cancer risk?". Expert Review of Anticancer Therapy. ج. 9 ع. 4: 389–392. DOI:10.1586/era.09.12. ISSN:1473-7140. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Cunningham, David; Atkin, Wendy; Lenz, Heinz-Josef; Lynch, Henry T.; Minsky, Bruce; Nordlinger, Bernard; Starling, Naureen (20 Mar 2010). "Colorectal cancer". The Lancet (بالإنجليزية). 375 (9719): 1030–1047. DOI:10.1016/S0140-6736(10)60353-4. ISSN:0140-6736. PMID:20304247. Archived from the original on 2016-06-17.
- ^ Coté، Michele L.؛ Liu، Mei؛ Bonassi، Stefano؛ Neri، Monica؛ Schwartz، Ann G.؛ Christiani، David C.؛ Spitz، Margaret R.؛ Muscat، Joshua E.؛ Rennert، Gad (2012-9). "Increased risk of lung cancer in individuals with a family history of the disease: A pooled analysis from the International Lung Cancer Consortium". European journal of cancer (Oxford, England : 1990). ج. 48 ع. 13: 1957–1968. DOI:10.1016/j.ejca.2012.01.038. ISSN:0959-8049. PMC:3445438. PMID:22436981. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ ا ب Bruner, Deborah Watkins; Moore, Dirk; Parlanti, Alicia; Dorgan, Joanne; Engstrom, Paul (2003). "Relative risk of prostate cancer for men with affected relatives: Systematic review and meta-analysis". International Journal of Cancer (بالإنجليزية). 107 (5): 797–803. DOI:10.1002/ijc.11466. ISSN:1097-0215. Archived from the original on 2020-03-29.
- ^ Singletary، S. Eva (2003-4). "Rating the Risk Factors for Breast Cancer". Annals of Surgery. ج. 237 ع. 4: 474–482. DOI:10.1097/01.SLA.0000059969.64262.87. ISSN:0003-4932. PMC:1514477. PMID:12677142. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Green، Jane؛ Cairns، Benjamin J؛ Casabonne، Delphine؛ Wright، F Lucy؛ Reeves، Gillian؛ Beral، Valerie (2011-8). "Height and cancer incidence in the Million Women Study: prospective cohort, and meta-analysis of prospective studies of height and total cancer risk". The Lancet Oncology. ج. 12 ع. 8: 785–794. DOI:10.1016/S1470-2045(11)70154-1. ISSN:1470-2045. PMC:3148429. PMID:21782509. مؤرشف من الأصل في 2017-09-03.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ ا ب ج د Cesare; Minardi, Franco; Holland, James F. (2000). Physical Carcinogens (بالإنجليزية). BC Decker. Archived from the original on 2016-01-02.
- ^ ا ب ج د ه و John F. (2000). Trauma and Inflammation (بالإنجليزية). BC Decker. Archived from the original on 2016-01-02.
- ^ Colotta, Francesco; Allavena, Paola; Sica, Antonio; Garlanda, Cecilia; Mantovani, Alberto (1 Jul 2009). "Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability". Carcinogenesis (بالإنجليزية). 30 (7): 1073–1081. DOI:10.1093/carcin/bgp127. ISSN:0143-3334. Archived from the original on 2020-02-20.
- ^ Ungefroren، Hendrik؛ Sebens، Susanne؛ Seidl، Daniel؛ Lehnert، Hendrik؛ Hass، Ralf (13 سبتمبر 2011). "Interaction of tumor cells with the microenvironment". Cell Communication and Signaling : CCS. ج. 9: 18. DOI:10.1186/1478-811X-9-18. ISSN:1478-811X. PMC:3180438. PMID:21914164. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Mantovani, A. (31 May 2010). "Molecular Pathways Linking Inflammation and Cancer". Current Molecular Medicine (بالإنجليزية). Archived from the original on 2019-08-27. Retrieved 2020-03-28.
- ^ Borrello, Maria Grazia; Degl’Innocenti, Debora; Pierotti, Marco A. (28 Aug 2008). "Inflammation and cancer: The oncogene-driven connection". Cancer Letters. Inflammation and Cancer Special Issue (بالإنجليزية). 267 (2): 262–270. DOI:10.1016/j.canlet.2008.03.060. ISSN:0304-3835. Archived from the original on 2020-03-29.
- ^ ا ب "Cancer". www.who.int (بالإنجليزية). Archived from the original on 2020-03-08. Retrieved 2020-03-29.
- ^ "Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013". British Dental Journal. ج. 219 ع. 7: 329–329. 2015-10. DOI:10.1038/sj.bdj.2015.751. ISSN:0007-0610. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Plummer, Martyn; de Martel, Catherine; Vignat, Jerome; Ferlay, Jacques; Bray, Freddie; Franceschi, Silvia (2016-09). "Global burden of cancers attributable to infections in 2012: a synthetic analysis". The Lancet Global Health (بالإنجليزية). 4 (9): e609–e616. DOI:10.1016/S2214-109X(16)30143-7. Archived from the original on 2020-03-23.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(help) - ^ C.P. (2014). Encyclopedia of Toxicology. Elsevier. ص. 1067–1069. ISBN:978-0-12-386455-0. مؤرشف من الأصل في 2020-03-29.
- ^ "International agency for research on cancer: World Health Organization, Lyon, France". Cancer Genetics and Cytogenetics. ج. 10 ع. 2: 217. 1983-10. DOI:10.1016/0165-4608(83)90131-0. ISSN:0165-4608. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ (2005). "Cancer statistics, 2005". CA Cancer J Clin. ج. 55 ع. 1: 10–30. ببمد: 15661684. مؤرشف من الأصل في 2011-02-25.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Jemal, Ahmedin; Siegel, Rebecca; Ward, Elizabeth; Hao, Yongping; Xu, Jiaquan; Murray, Taylor; Thun, Michael J. (2008). "Cancer Statistics, 2008". CA: A Cancer Journal for Clinicians (بالإنجليزية). 58 (2): 71–96. DOI:10.3322/CA.2007.0010. ISSN:1542-4863. Archived from the original on 2020-03-29.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (help) - ^ ا ب ج "Cancer Incidence and Survival Among Children and Adolescents - Pediatric Monograph - SEER Publications 1975-1995". SEER (بالإنجليزية). Archived from the original on 2017-02-15. Retrieved 2020-03-29.
- ^ ا ب ج د ه و Connie; Wujcik, Debra; Gobel, Barbara Holmes (2011). Cancer Nursing: Principles and Practice (بالإنجليزية). Jones & Bartlett Learning. ISBN:978-0-7637-6357-2. Archived from the original on 2020-03-29.
- ^ "7 healthy habits that can reduce your risk of cancer". Mayo Clinic (بالإنجليزية). Archived from the original on 2019-06-08. Retrieved 2020-03-29.
- ^ Danaei, Goodarz; Hoorn, Stephen Vander; Lopez, Alan D.; Murray, Christopher JL; Ezzati, Majid (19 Nov 2005). "Causes of cancer in the world: comparative risk assessment of nine behavioural and environmental risk factors". The Lancet (بالإنجليزية). 366 (9499): 1784–1793. DOI:10.1016/S0140-6736(05)67725-2. ISSN:0140-6736. PMID:16298215. Archived from the original on 2012-07-25.
- ^ Wu، Song؛ Powers، Scott؛ Zhu، Wei؛ Hannun، Yusuf A (7 يناير 2016). "Substantial contribution of extrinsic risk factors to cancer development". Nature. ج. 529 ع. 7584: 43–47. DOI:10.1038/nature16166. ISSN:0028-0836. PMC:4836858. PMID:26675728. مؤرشف من الأصل في 2020-03-29.
- ^ ا ب "American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity". مؤرشف من الأصل في 2020-04-02.
- ^ ا ب "Diet and cancer". مؤرشف من الأصل في 2020-04-02.
- ^ "Diet, obesity and breast cancer: an update". www.bioscience.org. مؤرشف من الأصل في 2020-04-07. اطلع عليه بتاريخ 2020-04-02.
- ^ Key، T J (4 يناير 2011). "Fruit and vegetables and cancer risk". British Journal of Cancer. ج. 104 ع. 1: 6–11. DOI:10.1038/sj.bjc.6606032. ISSN:0007-0920. PMC:3039795. PMID:21119663. مؤرشف من الأصل في 2020-04-02.
- ^ Wang، Xia؛ Ouyang، Yingying؛ Liu، Jun؛ Zhu، Minmin؛ Zhao، Gang؛ Bao، Wei؛ Hu، Frank B (29 يوليو 2014). "Fruit and vegetable consumption and mortality from all causes, cardiovascular disease, and cancer: systematic review and dose-response meta-analysis of prospective cohort studies". The BMJ. ج. 349. DOI:10.1136/bmj.g4490. ISSN:0959-8138. PMC:4115152. PMID:25073782. مؤرشف من الأصل في 2020-04-02.
- ^ Larsson, Susanna C.; Wolk, Alicja (1 May 2007). "Coffee Consumption and Risk of Liver Cancer: A Meta-Analysis". Gastroenterology (بالإنجليزية). 132 (5): 1740–1745. DOI:10.1053/j.gastro.2007.03.044. ISSN:0016-5085. PMID:17484871. Archived from the original on 2020-04-02.
- ^ Zheng، Wei؛ Lee، Sang-Ah (2009). "Well-done Meat Intake, Heterocyclic Amine Exposure, and Cancer Risk". Nutrition and cancer. ج. 61 ع. 4: 437–446. DOI:10.1080/01635580802710741. ISSN:0163-5581. PMC:2769029. PMID:19838915. مؤرشف من الأصل في 2020-04-02.
- ^ "IARC Monographs evaluate consumption of red meat and processed meat". مؤرشف من الأصل (PDF) في 2020-04-11.
- ^ Zeng، Ya-Wen؛ Yang، Jia-Zheng؛ Pu، Xiao-Ying؛ Du، Juan؛ Yang، Tao؛ Yang، Shu-Ming؛ Zhu، Wei-Hua (2013). "Strategies of Functional Food for Cancer Prevention in Human Beings". Asian Pacific Journal of Cancer Prevention. ج. 14 ع. 3: 1585–1592. DOI:10.7314/APJCP.2013.14.3.1585. ISSN:1513-7368. مؤرشف من الأصل في 2020-02-28.
- ^ Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force.
- ^ Rothwell، Peter M.؛ Fowkes، F. Gerald R.؛ Belch، Jill F. F.؛ Ogawa، Hisao؛ Warlow، Charles P.؛ Meade، Tom W. (1 يناير 2011). "Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials". Lancet (London, England). ج. 377 ع. 9759: 31–41. DOI:10.1016/S0140-6736(10)62110-1. ISSN:1474-547X. PMID:21144578. مؤرشف من الأصل في 2020-04-02.
- ^ Cooper، K.؛ Squires، H.؛ Carroll، C.؛ Papaioannou، D.؛ Booth، A.؛ Logan، R. F.؛ Maguire، C.؛ Hind، D.؛ Tappenden، P. (2010-06). "Chemoprevention of colorectal cancer: systematic review and economic evaluation". Health Technology Assessment (Winchester, England). ج. 14 ع. 32: 1–206. DOI:10.3310/hta14320. ISSN:2046-4924. PMID:20594533. مؤرشف من الأصل في 2020-04-02.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Thomsen A, Kolesar JM (December 2008). "Chemoprevention of breast cancer". American Journal of Health-System Pharmacy. 65 (23): 2221–28. doi:10.2146/ajhp070663. PMID 19020189.
- ^ "5‐alpha‐reductase inhibitors for prostate cancer prevention". مؤرشف من الأصل في 2020-04-02.
- ^ "Prescrire IN ENGLISH - Spotlight: Archive Vitamins and minerals: ineffective in preventing cancer and cardiovascular disease, 1 September 2010" [en]. مؤرشف من الأصل في 2020-04-05. اطلع عليه بتاريخ 2020-04-02.
- ^ "ACS :: Vitamin D Has Role in Colon Cancer Prevention" [en]. مؤرشف من الأصل في 2006-12-04. اطلع عليه بتاريخ 2020-04-02.
- ^ "Vitamin D, Sunlight and Cancer Connection" [en] (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-02.
- ^ "Prospective study of predictors of vitamin D status and cancer incidence and mortality in men" [en]. مؤرشف من الأصل في 2020-04-05. اطلع عليه بتاريخ 2020-04-02.
- ^ "Vitamin D Status and Cancer Incidence and Mortality: Something New Under the Sun" [en] (بالإنجليزية). Archived from the original on 2020-04-07. Retrieved 2020-04-05.
- ^ https://www.thelancet.com/journals/landia/article/PIIS2213-8587(13)70212-2/fulltext
- عنصر قائمة مرقمة
- ^ https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD007470.pub3/full نسخة محفوظة 2020-04-05 على موقع واي باك مشين.
- ^ "Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis" [en] (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ "Biological Therapies for Cancer" [en] (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ "Cancer prevention in Asia: resource-stratified guidelines from the Asian Oncology Summit 2013" [English] (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ ا ب ج "Cancer Screening Overview (PDQ®)–Patient Version" [en] (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ ا ب ج https://web.archive.org/web/20110604205519/http://whqlibdoc.who.int/php/WHO_PHP_34.pdf نسخة محفوظة 2021-03-08 على موقع واي باك مشين.
- ^ "Global cancer statistics†". مؤرشف من الأصل في 2020-04-05.
- ^ ا ب "The clinical management of BRCA1 and BRCA2 mutation carriers" [en] (بالإنجليزية). Archived from the original on 2020-04-07. Retrieved 2020-04-05.
- ^ ا ب ج "Photodynamic Therapy of Cancer" [en] (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ Lind, M. J. (1 Jan 2008). "Principles of cytotoxic chemotherapy". Medicine (بالإنجليزية). 36 (1): 19–23. DOI:10.1016/j.mpmed.2007.10.003. ISSN:1357-3039. Archived from the original on 2020-04-05.
- ^ "Targeted Cancer Therapies Fact Sheet". National Cancer Institute (بالإنجليزية). 31 Mar 2020. Archived from the original on 2020-04-05. Retrieved 2020-04-04.
- ^ Flowers، Christopher؛ Sinha؛ Nastoupil (2012-04). "Treatment strategies for patients with diffuse large B-cell lymphoma: past, present, and future". Blood and Lymphatic Cancer: Targets and Therapy: 87. DOI:10.2147/blctt.s18701. ISSN:1179-9889. مؤرشف من الأصل في 2020-04-05.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Freedman*, Arnold (2012). "Follicular lymphoma: 2012 update on diagnosis and management". American Journal of Hematology (بالإنجليزية). 87 (10): 988–995. DOI:10.1002/ajh.23313. ISSN:1096-8652. Archived from the original on 2020-04-05.
- ^ Rampling، R؛ James، A؛ Papanastassiou، V (2004-6). "THE PRESENT AND FUTURE MANAGEMENT OF MALIGNANT BRAIN TUMOURS: SURGERY, RADIOTHERAPY, CHEMOTHERAPY". Journal of Neurology, Neurosurgery, and Psychiatry. ج. 75 ع. Suppl 2: ii24–ii30. DOI:10.1136/jnnp.2004.040535. ISSN:0022-3050. PMC:1765659. PMID:15146036. مؤرشف من الأصل في 2020-04-05.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Madan, Vishal; Lear, John T.; Szeimies, Rolf-Markus (20 Feb 2010). "Non-melanoma skin cancer". The Lancet (بالإنجليزية). 375 (9715): 673–685. DOI:10.1016/S0140-6736(09)61196-X. ISSN:0140-6736. PMID:20171403. Archived from the original on 2020-04-05.
- ^ Emil Frei, I. I. I.; Eder, Joseph Paul (2003). "Combination Chemotherapy". Holland-Frei Cancer Medicine. 6th edition (بالإنجليزية). Archived from the original on 2020-04-05.
- ^ "Single agent versus combination chemotherapy for metastatic breast cancer". www.cochrane.org (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-04.
- ^ "Targeted Cancer Therapies Fact Sheet". National Cancer Institute (بالإنجليزية). 31 Mar 2020. Archived from the original on 2020-04-05. Retrieved 2020-04-03.
- ^ Paskulin, Giorgio Adriano; Zen, Paulo Ricardo Gazzola; Pinto, Louise Lapagesse de Camargo; Rosa, Rafael; Graziadio, Carla (2005). "Combined chemotherapy and teratogenicity". Birth Defects Research Part A: Clinical and Molecular Teratology (بالإنجليزية). 73 (9): 634–637. DOI:10.1002/bdra.20180. ISSN:1542-0760. Archived from the original on 2020-04-05.
- ^ CK Bomford؛ , IH Kunkler, J Walter. Walter and Miller's Textbook of Radiation therapy (6th Ed),. p311.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: مكان (link) - ^ "Radiotherapy". Dr Colin Tidy. مؤرشف من الأصل في 2020-04-05. اطلع عليه بتاريخ 23 Dec 2015.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ ا ب "Lasers in Cancer Treatment" [en] (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ "What is Immunotherapy?". Cancer Research Institute (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-04.
- ^
Obeid M؛ وآخرون (2007). "Molecular determinants of immunogenic cell death: surface exposure of calreticulin makes the difference". J Mol Med. ج. 85 ع. 10: 1069–76. ببمد: 17891368.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة) - ^ van Dalen، Elvira C.؛ Raphaël، Martine F.؛ Caron، Huib N.؛ Kremer، Leontien C. M. (4 سبتمبر 2014). "Treatment including anthracyclines versus treatment not including anthracyclines for childhood cancer". The Cochrane Database of Systematic Reviews ع. 9: CD006647. DOI:10.1002/14651858.CD006647.pub4. ISSN:1469-493X. PMID:25188452. مؤرشف من الأصل في 2020-04-05.
- ^ "Palliative treatment | Treatment for cancer | Cancer Research UK". www.cancerresearchuk.org. مؤرشف من الأصل في 2020-04-05. اطلع عليه بتاريخ 2020-04-05.
- ^ ا ب Bausewein، Claudia؛ Simon، Steffen T؛ Pralong، Anne؛ Radbruch، Lukas؛ Nauck، Friedemann؛ Voltz، Raymond (2015-12). "Palliative Care of Adult Patients With Cancer". Deutsches Ärzteblatt International. ج. 112 ع. 50: 863–870. DOI:10.3238/arztebl.2015.0863. ISSN:1866-0452. PMC:4732180. PMID:26763381. مؤرشف من الأصل في 2020-04-05.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Elsayem, Ahmed; Curry III, Eardie; Boohene, Jeanette; Munsell, Mark F.; Calderon, Bianca; Hung, Frank; Bruera, Eduardo (7 May 2008). "Use of palliative sedation for intractable symptoms in the palliative care unit of a comprehensive cancer center". Supportive Care in Cancer (بالإنجليزية). 17 (1): 53. DOI:10.1007/s00520-008-0459-4. ISSN:1433-7339. Archived from the original on 2018-06-17.
- ^ "WHO | WHO Definition of Palliative Care". WHO. مؤرشف من الأصل في 2020-04-05. اطلع عليه بتاريخ 2020-04-05.
- ^ "Human molecular genetics | Titel". library.wur.nl. مؤرشف من الأصل في 2020-04-05. اطلع عليه بتاريخ 2020-04-05.
- ^ Culver, Kenneth W.; Michael Blaese, R. (1 May 1994). "Gene therapy for cancer". Trends in Genetics (بالإنجليزية). 10 (5): 174–178. DOI:10.1016/0168-9525(94)90095-7. ISSN:0168-9525. Archived from the original on 2020-04-05.
- ^ Amer، Magid H (10 سبتمبر 2014). "Gene therapy for cancer: present status and future perspective". Molecular and cellular therapies. ج. 2. DOI:10.1186/2052-8426-2-27. ISSN:2052-8426. PMC:4452068. PMID:26056594. مؤرشف من الأصل في 2020-04-05.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "ScienceDaily: Shark Cartilage Shows No Benefit As A Therapeutic Agent For Lung Cancer". مؤرشف من الأصل في 2019-04-02. اطلع عليه بتاريخ 2007-06-04.
- ^ "A Special Message to Cancer Patients Seeking "Alternative" Treatments". مؤرشف من الأصل في 2006-07-20. اطلع عليه بتاريخ 2005-12-16.
- ^ Mills، Edward؛ Ernst، Edzard؛ Singh، Rana؛ Ross، Cory؛ Wilson، Kumanan (6 أغسطس 2003). "Health food store recommendations: implications for breast cancer patients". Breast Cancer Research. ج. 5 ع. 6: R170. DOI:10.1186/bcr636. ISSN:1465-542X. PMC:314402. PMID:14580252. مؤرشف من الأصل في 2020-03-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: تنسيق PMC (link) صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Global cancer statistics". DOI:10.3322/20107. مؤرشف من الأصل في 2020-04-05.
- ^ Susan R.; Neugut, Alfred I.; Meadows, Anna T. (2000). Secondary Cancers: Incidence, Risk Factors, and Management (بالإنجليزية). BC Decker. Archived from the original on 2020-04-05.
- ^ ا ب ج Montazeri، Ali (23 ديسمبر 2009). "Quality of life data as prognostic indicators of survival in cancer patients: an overview of the literature from 1982 to 2008". Health and Quality of Life Outcomes. ج. 7: 102. DOI:10.1186/1477-7525-7-102. ISSN:1477-7525. PMC:2805623. PMID:20030832. مؤرشف من الأصل في 2020-04-05.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب Akl، Elie A؛ Kahale، Lara A؛ Hakoum، Maram B؛ Matar، Charbel F؛ Sperati، Francesca؛ Barba، Maddalena؛ Yosuico، Victor ED؛ Terrenato، Irene؛ Synnot، Anneliese (11 سبتمبر 2017). "Parenteral anticoagulation in ambulatory patients with cancer". The Cochrane Database of Systematic Reviews. ج. 2017 ع. 9. DOI:10.1002/14651858.CD006652.pub5. ISSN:1469-493X. PMC:6419241. PMID:28892556. مؤرشف من الأصل في 2020-04-05.
- ^ Sleigh, Sara H.; Barton, Cheryl L. (1 Jun 2010). "Repurposing Strategies for Therapeutics". Pharmaceutical Medicine (بالإنجليزية). 24 (3): 151–159. DOI:10.1007/BF03256811. ISSN:1179-1993. Archived from the original on 2016-08-02.
- ^ Winther, Henrik; Jørgensen, Jan Trøst (1 Dec 2010). "Drug-Diagnostic Co-Development in Cancer". Pharmaceutical Medicine (بالإنجليزية). 24 (6): 363–375. DOI:10.1007/BF03256837. ISSN:1179-1993. Archived from the original on 2020-02-08.
- ^ Alberts، Bruce؛ Kirschner، Marc W.؛ Tilghman، Shirley؛ Varmus، Harold (22 أبريل 2014). "Rescuing US biomedical research from its systemic flaws". Proceedings of the National Academy of Sciences of the United States of America. ج. 111 ع. 16: 5773–5777. DOI:10.1073/pnas.1404402111. ISSN:0027-8424. PMC:4000813. PMID:24733905. مؤرشف من الأصل في 2020-04-05.
- ^ Powell, Kendall (2016-10). "Young, talented and fed-up: scientists tell their stories". Natur (بالإنجليزية). 538 (7626): 446–449. DOI:10.1038/538446a. ISSN:0028-0836. Archived from the original on 2020-04-05.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(help) - ^ Lorenzo L.، Di؛ Chiara، Palmieri؛ Antonio، Cusano؛ Calogero، Foti (3 مايو 2012). "Cancer Pain Managment with a Venom of Blue Scorpion Endemic in Cuba, Called Rhopalurus Junceus "Escozul"". The Open Cancer Journal. ج. 5 ع. 1. مؤرشف من الأصل في 2018-06-10.
- ^
Weihs KL, Enright TM, Simmens SJ (2008). "Close relationships and emotional processing predict decreased mortality in women with breast cancer: preliminary evidence". Psychosom Med. ج. 70 ع. 1: 117–24. ببمد: 18158376. مؤرشف من الأصل في 2022-04-07.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Helft PR, Petronio S (2007). "Communication pitfalls with cancer patients: "hit-and-run" deliveries of bad news". J Am Coll Surg. ج. 205 ع. 6: 807–11. ببمد: 18035266.
- ^ ا ب Lawrence, Leah (3 Jun 2017). "Psychological Intervention Reduced Fear of Cancer Recurrence". Cancer Network (بالإنجليزية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ "Carcinophobia - Fear of Getting Cancer - Carcinophobia Treatment". The Center for Treatment of Anxiety and Mood Disorders (بالإنجليزية الأمريكية). Archived from the original on 2020-04-05. Retrieved 2020-04-05.
- ^ ا ب ج د ه "Hajdu SI (March 2011). "A note from history: landmarks in history of cancer, part 1". Cancer. 117 (5): 1097–102. doi:10.1002/cncr.25553. PMID 20960499". مؤرشف من الأصل في 2020-05-05.
- ^ Szabo، Sandor (1987-06). "NIOSH pocket guide to chemical hazards, DHEW (NIOSH) Publication No. 78-210, 5th printing, U.S. Government Printing Office, Washington, DC, 1985, $5.00". Teratology. ج. 35 ع. 3: 476–476. DOI:10.1002/tera.1420350322. ISSN:0040-3709. مؤرشف من الأصل في 2019-12-08.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Cells, tissues, and disease : principles of general pathology (ط. 2nd ed). New York: Oxford University Press. 2004. ISBN:9780199748921. OCLC:76950968. مؤرشف من الأصل في 2019-12-08.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة) - ^ ا ب "Hajdu SI (June 2011). "A note from history: landmarks in history of cancer, part 2". Cancer. 117 (12): 2811–20. doi:10.1002/cncr.25825. PMID 21656759". مؤرشف من الأصل في 2020-05-05.
- ^ A history of the breast (ط. 1st ed). New York: Alfred A. Knopf. 1997. ISBN:0679434593. OCLC:34951333. مؤرشف من الأصل في 2019-12-08.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة) - ^ "Hajdu SI (February 2012). "A note from history: landmarks in history of cancer, part 3". Cancer. 118 (4): 1155–68. doi:10.1002/cncr.26320. PMID 21751192". مؤرشف من الأصل في 2020-04-07.
- ^ "Grange JM, Stanford JL, Stanford CA (June 2002). "Campbell De Morgan's 'Observations on cancer', and their relevance today". Journal of the Royal Society of Medicine. 95 (6): 296–99. doi:10.1258/jrsm.95.6.296. PMC 1279913. PMID 12042378". مؤرشف من الأصل في 2020-01-10.
| سرطان في المشاريع الشقيقة: | |