ميتوكندريون
| صنف فرعي من | |
|---|---|
| جزء من | |
| يلقب بـ | |
| تنمو من | |
| يتفاعل مادياً مع | |
| يستعمل | |
| مُعرِّف مَكنَز المعهد القومي للسرطان (NCI) | |
| لديه جزء أو أجزاء |


المُتَقَدِّرَة[5][6][7][8] أو الميتوكندريون[9][10] أو المصورة الحيوية أو الحُبَيبَة الخَيطِيَّة[8][10] هي عضية خلوية مزدوجة الغشاء تتواجد لدى معظم الكائنات حقيقية النوى. يمكن أن لا تملك بعض الخلايا في بعض الكائنات متعددة الخلايا متقدرات (مثل خلايا الدم الحمراء الناضجة الخاصة بالثدييات). العديد من الكائنات وحيدة الخلية مثل البويغيات، ذوات الجسيم القاعدي والمتضاعفات خفّضت أو حوّلت المتقدرات الخاصة بها إلى عضيات أخرى.[11] لغاية اليوم، لا يُعرف سوى جنس حقيقات نوى وحيد فقد متقدراته كليا وهو مونوسيركومونيودات.[12] المصطلح الأجنبي ميتوكندريون من أصل إغريقي "μίτος" ميتوس، بمعنى خيط و"χονδρίον" كوندريون، بمعنى حبيبة أو حبيبي الشكل.[13] تولِّد المتقدرات معظم احتياجات الخلية من الأدينوسين ثلاثي الفوسفات (ATP) المستخدم كمصدر للطاقة الكيميائية في التفاعلات الخلوية.[14] ولهذا يطلق على المتقدرة لقب «محطة توليد الطاقة» الخلوية.[15]
تترواح مساحة المتقدرة عادة بين 0.75 و3 ميكرومتر مربع[16] لكنها تختلف بشكل معتبر في الحجم والبنية، وهي غير مرئية إلا إذا تم صبغها. فضلا عن تزويدها الخلية بالطاقة، للمتقدرة دور في وظائف أخرى مثل التأشير والتمايز الخلويين، وفي موت الخلية، وكذلك في الحفاظ على التحكم في دورة الخلية وتكاثرها.[17] يُنسَّق النشوء الحيوي للمتقدرة بدوره مع هذه العمليات الخلوية.[18][19] للمتقدرات دور في العديد من الأمراض البشرية منها: أمراض المتقدرة،[20] اختلال وظيفة القلب،[21] فشل القلب،[22] والتوحد.[23]
يمكن أن يختلف عدد المتقدرات في الخلية بشكل كبير حسب النسيج ونوع الخلية. على سبيل المثال لا تملك خلايا الدم الحمراء أية متقدرات، في حين يمكن أن تملك خلايا الكبد أزيد من 2000 متقدرة.[24][25] تتكون هذه العضية من أحياز تقوم بوظائف مخصصة، هذه الأحياز أو المناطق هي: الغشاء الخارجي، الحيز بين الغشائي، الغشاء الداخلي والنتوءات العرفية والمطرس.
رغم أن معظم دنا الخلية يتواجد في نواة الخلية، تملك المتقدرة جينومها الخاص بها الذي يُظهِر تشابها كبيرا مع الجينومات البكتيرية.[26] بروتينات المتقدرة (البروتينات التي تُنسخ من دنا المتقدرة) تختلف حسب النسيج والنوع. لدى البشر، تم تحديد 615 نوعا مميزا من البروتينات من المتقدرات القلبية،[27] أما لدى الجرذان فقد تم الإبلاغ عن 940 نوع من البروتين.[28] يُعتقد أن البروتيوم الخاص بالمتقدرة يُنظم بشكل ديناميكي.[29]
البنية[عدل]

تتكون المتقدرة من غشائين داخلي وخارجي مكونين من ليبيدات ثنائية الطبقة وبروتينات.[24] للغشائين خصائص مختلفة. بسبب هذا التنظيم ثنائي الغشاء، توجد خمس مناطق مميزة في المتقدرة هي:
- غشاء المتقدرة الخارجي.
- الفضاء بين الغشائي (الفضاء بين الغشائين الخارجي والداخلي).
- غشاء المتقدرة الداخلي.
- النؤات العرفية (الأعراف)
- المطرس (الفضاء داخل الغشاء الداخلي)
تسمى المتقدرة التي لا تحتوي على غشاء خارجي ميتوبلاست.
الغشاء الخارجي[عدل]
غشاء المتقدرة الخارجي الذي يحيط ويغلف كامل العضية سمكه من 60 إلى 70 أنغستروم. لهذا الغشاء معدل بروتين مقابل ليبيد فوسفوري مساوٍ لمعدل الغشاء الخلوي (حوالي 1:1 وزنا، أي 50% من وزنه بروتين و50% ليبيد) ويحتوي على أعداد كبيرة من البروتينات الغشائية المدمجة تسمى بورينات. أحد أهم البروتينات الناقلة به هو مشكِّل المسام قناة الأنيون المعتمدة على الفولتية (VDAC). قناة الأنيون المعتمدة على الفولتية هي الناقل الرئيسي للنوكليوتيدات، الأيونات، والمستقلبات بين العصارة الخلوية والفضاء بين الغشائي.[31][32] يتكون من براميل بيتا تمتد خلال كامل سمك الغشاء الخارجي، كما هو الحال في غشاء البكتيريا سلبية الغرام.[33] يمكن أن تُدخِل المتقدرة بروتينات أكبر إذا ارتبط تسلسل تأشيرٍ في نهاياتها الأمينية ببروتين أكبر متعدد الوحدات الفرعية يسمى ترانسلوكاز الغشاء الخارجي، والذي يقوم بعد ذلك بتحريكهم بنشاط عبر الغشاء.[34] يتم توريد الطلائع البروتينية الخاصة بالمتقدرة عبر مركبات نقل خاصة.
يحتوي الغشاء الخارجي كذلك على إنزيمات لها أدوار متنوعة مثل تمديد الأحماض الدهنية، أكسدة الإبنيفرين، وتفكيك التريبتوفان. من هذه: الإنزيمات أكسيداز أحادي الأمين، مختزلة-c NADH-سيتوكروم غير الحساسة للروتينون [ملاحظة 1] هيدروكسيلاز الكينورينين وليغاز كو-أ—حمض دهني [ملاحظة 2]. يسمح تمزيق الغشاء الخارجي للبروتينات في الفراغ بين الغشائي بالتسرب إلى العصارة الخلوية، وهذا يؤدي إلى نوع معين من موت الخلية.[35] يمكن أن يرتبط الغشاء الخارجي للمتقدرة بالشبكة الإندوبلازمية في بنية تسمى غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرة (MAM). هذا الارتباط مهم بالنسبة لتأشير الكالسيوم بين الشبكة الإندوبلازمية والمتقدرة وله دور في نقل اللبيدات بينها.[36] توجد خارج الغشاء الخارجي جسيمات صغيرة (قطرها 60 أنغستروم) تسمى الوحدات الفرعية الخاصة ببارسون.
الفضاء بين الغشائي[عدل]
فضاء المتقدرة بين الغشائي هو فضاء بين الغشاء الخارجي والداخلي. ويعرف كذلك بفضاء المتقدرة المحيطي. تكون تركيزات الجزيئات الصغيرة فيه مثل الأيونات والسكريات القادرة على النفاذ بحرية عبر الغشاء الخارجي مساوية لتركيزاتها في العصارة الخلوية.[24] مع ذلك، يجب أن يكون للبروتينات الكبيرة تسلسلات تأشير محددة لتتمكن من الانتقال عبر الغشاء الخارجي، لذلك فإن أنواع البروتينات وكمياتها في هذا الفضاء تختلف عما هو موجود في العصارة الخلوية. أحد البروتينات التي تنتقل إلى الفضاء بين الغشائي هو سيتوكروم سي.[35]
الغشاء الداخلي[عدل]
يحتوي غشاء المتقدرة الداخلي على بروتينات تقوم بخمسة أنواع من الوظائف:[24]
- البروتينات التي تقوم بتفاعلات الأخسدة الخاصة بالفسفرة التأكسدية.
- مخلقة الـATP التي تقوم بتخليق الـATP في المطرس.
- بروتينات نقل خاصة تنظم عبور المستقلبات داخل وخارج مطرس المتقدرة.
- ماكينة التوريد البروتينية.
- بروتين اندماج وانشطار المتقدرة.
يحتوي الغشاء على ما يزيد عن 151 عديد ببتيد مختلف ويملك نسبة بروتين إلى ليبيد فوسفوري عالية (أكثر من 1:3 وزنا، وهو ما يقارب بروتينا واحدا لكل 15 ليبيد فوسفوري). الغشاء الداخلي هو مقر لخُمُسِ مجموع البروتينات المتواجدة في المتقدرات.[24] فضلا عن ذلك، هذا الغشاء غني باللبيد الفوسفوري غير المعتاد كارديوليبين. اكتُشف هذا الليبيد الفوسفوري أول مرة سنة في قلوب الأبقار سنة 1942، ويكون عادة سمة مميزة لأغشية البلازما الخاصة بالمتقدرات والبكتيريا.[37] يحتوي الكارديوليبين على أربع أحماض دهنية بدل اثنين وذلك ربما يساعد في جعل الغشاء الداخلي غير قابل للنفاذية (كتيم).[24] عكس الغشاء الخارجي، لا يملك الغشاء الداخلي بورينات وهو عديم النفاذية بصفة عالية لجميع الجزيئات. جميع الأيونات والجزيئات تقريبا تتطلب ناقلات غشائية خاصة لتدخل أو تخرج من المطرس. تُنقل البروتينات إلى المطرس عبر مركب ترانسلوكاز الغشاء الداخلي (TIM) أو عبر OXA1L.[34] فضلا عن ذلك، يوجد جهد غشائي على طول الغشاء الداخلي مُتشكِّل بواسطة فعل إنزيمات سلسلة نقل الإلكترون.
النتؤات العرفية[عدل]

الغشاء الداخلي للمتقدرة مجزأ إلى عدة أحياز تعرف بالأعراف والتي تمدِّد مساحة السطح الخارجي للغشاء الداخلي، محسنة قدرته على إنتاج الـATP. في متقدرةِ كبدٍ قياسية، مساحة الغشاء الداخلي حوالي خمس أضعاف مساحة الغشاء الخارجي. هذا المعدل متغير، والحاجة إلى الـATP من المتقدرة تختلف حسب نوع الخلية، كمثال: تحتوي الخلايا العضلية على نتوءات عرفية أكثر من غيرها. هذه الطيات مرصعة بأجسام صغيرة دائرية تعرف باسم F1 أو جسيمات الأكسجين. هذه الطيات ليست طيات عشوائية بسيطة وإنما انغمادات للغشاء الداخلي، والتي يمكن أن تؤثر في مجمل وظيفة التناضح الكيميائي.[38]
اقترحت دراسة نمذجة رياضياتية حديثة أن الخصائص البصرية للنتوءات العرفية في المتقدرات الخيطية قد تؤثر على توليد وانتشار الضوء داخل النسيج.[39]
المطرس[عدل]
المطرس أو المصفوفة هو الحيز الذي يحيط به الغشاء الداخلي، ويحتوي على حوالي ثلثي مجموع البروتينات في المتقدرة.[24] المطرس مهم في إنتاج الـATP بمساعدة مخلقة الأتِباز المتواجدة في الغشاء الداخلي. تحتوي المصفوفة على خليط عالي التركيز من مئات الإنزيمات، خاصة ريبوسومات المتقدرة، الرنا الريبوسومي، وعدة نسخ من جينوم دنا المتقدرة. من الوظائف الرئيسية لهذه الإنزيمات: أكسدة أحماض البيروفيك والأحماض الدهنية، ودورة حمض الستريك.[24] جزيئات الدنا محزمة في نووانيات بواسطة بروتينات أحدها هو TFAM.[40]
للمتقدرات مادتها الوراثية الخاصة بها، ولها ماكينة لتخليق جزيئات رنا وبروتينات خاصة بها. أظهر تسلسل دنا متقدرة منشور أنه يحوي 16569 زوج قاعدي تشفِّر 37 جينا: 22 رنا ناقل، 2 رنا ريبوسومي و13 ببتيدا.[41] البيبتيدات المتقدرية الـ13 لدى البشر يتم إدماجها في الغشاء الداخلي للمتقدرة، إلى جانب بروتينات مشفَّرة بواسطة جينات تتواجد في نواة الخلية المضيفة.
غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرة[عدل]
غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرات (MAM) هو عنصر بنيوي آخر تتزايد المعرفة حول دوره الحاسم في الفيسيولوجية والاستتباب الخلويين. اعتُبر سابقا أنه عقبة تقنية في تقنيات التجزيء الخلوي، أعيد تعريف شوائب حويصلات الشبكة الإندوبلازمية التي كانت تظهر بثبات في عمليات تجزيء المتقدرات على أنها امتدادات مصدرها غشاء MAM وهو الوسيط بين المتقدرات والشبكة الإندوبلازمية.[42] الاقتران الفيزيائي بين هاتين العضيتين تمت ملاحظته سابقا بواسطة صور مجهرية إلكترونية وتم سبرها حديثا بواسطة المجهرية الفلورية.[42] تُقدِّر مثل تلك الدراسات أن عند هذه الأغشية - التي يمكن أن تشكل حتى 20% من الغشاء الخارجي للمتقدرة - المسافة بين الشبكة الإندوبلازمية والمتقدرة لا تتجاوز 10-25 نانومتر وهما محكمان معا بواسطة مركبات بروتينية رابطة.[36][42][43]
أظهرت أغشية الشبكة المرتبطة بالمتقدرة المنقاة من التجزيئات الخلوية أنها غنية بالإنزيمات التي لها دور في تبادل الليبيدات الفوسفورية بالإضافة إلى قنوات مرتبطة بتأشير الكالسيوم Ca2+.[42][43] هذه التلميحات إلى دور مهم لهذه الأغشية في تنظيم المخزونات الخلوية من اللبيدات وتوصيل الإشارة ثبتت صحتها، مع آثار مترتبة معتبرة على الظاهرة الخلوية المرتبطة بالمتقدرة. هذه الأغشية لم توفر رُؤًى للأسس الميكانيكية لمثل هذه العمليات الفيسيولوجية مثل الاستماتة الذاتية وانتشار تأشير الكالسيوم فحسب، بل تدعم نظرة أوسع بخصوص دور المتقدرات. رغم أن المتقدرات تُرى «كمحطات توليد طاقة» ساكنة ومعزولة استُغلت من أجل الأيض الخلوي بواسطة حادثة نشوء تعايشي قديمة، يؤكد تطور غشاء MAM مدى دور المتقدرات في مجمل الفيسيولوجية الخلوية، الذي يربطه اقتران فيزيائي ووظيفي حميم مع النظام الغشائي الداخلي.
انتقال الليبيد الفسفوري[عدل]
غشاء الشبكة المرتبط بالمتقدرات غني بالإنزيمات التي تقوم بتخليق الليبيدات مثل مخلِقة فوسفاتيديل سيرين على الجانب الخاص بالشبكة الإندوبلازمية ونازعة كربوكسيل فوسفاتيديل سيرين على الجانب الخاص بالمتقدرة.[44][45] لأن المتقدرات عضيات ديناميكية تخضع للانقسام والاندماج فهي تحتاج لتزويد مستمر ومنظَّم جيدا بالليبيدات الفوسفورية لسلامة الأغشية وكمالها.[46][47] المتقدرات ليست الوجهة التي ينتهي فيها تخليق الليبيدات فحسب، بل تلعب دورا كعضية وسيطة في نقل وسائط ونواتج مسارات: التخليق الحيوي لليبيدات، أيض السيراميد والكوليستيرول، وأيض الليبيدات السفنغولية السكرية.[45][47]
هذه القدرة على النقل تعتمد على غشاء MAM، الذي اتضح أنه يُسهل نقل الليبيدات بين العضيات.[44] على عكس آلية الحويصلات القياسية لنقل الليبيدات، تشير دلائلٌ إلى أن المقربة الفيزيائية بين غشائي الشبكة الإندوبلازمية والمتقدرة في غشاء MAM تسمح بانتقال الليبيدات بين الغشائين المزدوجين المتقابلين.[47] رغم أن آلية النقل هذه تبدو غير اعتيادية وغير مفضلة طاقويا إلا أنها لا تحتاج ATP.[47] في الخميرة، تم إظهار أنها تعتمد على بنية عديد بروتين رابطة تسمى بنية التقاء الشبكة الإندوبلازمية والمتقدرة (ERMES). مع ذلك، ما زال غير واضح إن كانت هذه البنية تتوسط بشكل مباشر نقل الليبيدات أو أنها مطلوبة لإبقاء الغشائين على مقربة كافية لتخفيض كمية طاقة نقل الليبيدات.[47][48]
فضلا عن دورها في النقل داخل الخلوي يُعتقد كذلك أن أغشية MAM جزء من مسار إفرازي. بشكل خاص، يبدو أن هذه الأغشية هي وجهة وسطية بين الشبكة الإندوبلازمية وجهاز غولجي في المسار الذي يقود إلى تركيب وإفراز البروتين اللبيدي منخفض الكثافة (VLDL)،[45][49] ولذلك غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرة يعمل كمركز أساسي وحاسم في أيض ونقل الليبيدات.
تأشير الكالسيوم[عدل]
عُرف دور الشبكة الإندوبلازمية الحاسم في تأشير الكالسيوم قبل أن يُعرف دور المتقدرة فيه ويلاقي قبولا واسعا، ويعود ذلك جزئيا إلى ألفة قنوات الكالسيوم المنخفضة لـ Ca2+ التي تتواجد على الغشاء الخارجي، وهذا يناقض الاستجابات المتقدرة المزعومة لتغيير تدفق الكالسيوم داخل الخلوي.[42][50] تواجدُ أغشية MAM حلَّ هذا التناقض الظاهري، فالتقارب الفيزيائي بين هاتين العضيتين ينتج عنه نطاقات ميكروية خاصة بالـCa2+ في نقاط الاتصال تسهل النقل الفعال لأيونات الكالسيوم من الشبكة الإندوبلازمية إلى المتقدرة.[42] يحدث النقل استجابة لما يُعرف «بنفائش الكالسيوم»[ملاحظة 3] المولَّدة بواسطة تكدسات تلقائية لقنوات IP3R وتنشيطها، وهي قنوات كالسيوم قياسية في الشبكة الإندوبلازمية.[36][42]
يُحدَّد مصير هذه النفائش - إن كانت ستبقى محصورة في مناطق معزولة أو تُدمج في موجات كالسيوم لتنتشر في أنحاء الخلية - بنسبة كبيرة بواسطة حركيات غشاء MAM. رغم أن استرداد أيونات الكالسيوم بواسطة الشبكة الإندوبلازمية (المصاحب لتحريره) يُعدِّل شدة النفائش، مما يعزل المتقدرة بدرجة معينة من التعرض العالي لأيونات الكالسيوم، غالبا ما يعمل غشاء MAM كجدار حماية يقوم أساسا بدرء نفائش الكالسيوم بالتصرف كبالوعة يمكن لأيونات الكالسيوم الحرة في العصارة الخلوية أن تدخل فيها.[42][51][52]
يحدث تنفيق[ملاحظة 4] الكالسيوم بسبب الألفة المنخفضة لمستقبل VDAC1 للكالسيوم، والذي أُظهِر حديثا أنه مربوط فيزيائيا بتكدسات IP3R على غشاء الشبكة الإندوبلازمية وأنه متواجد بكثرة في غشاء MAM.[36][42][53] قدرة المتقدرات في العمل كبالوعات للكالسيوم هي نتيجة للمدروج الكهروكيميائي المتولد أثناء الفسفرة التأكسدية، وهو ما يجعل تنفيق الكاتيونات عملية مطلقة للطاقة.[53] يسبب التدفق الداخلي الطبيعي والمتوسط للكالسيوم من العصارة الخلوية إلى مطرس المتقدرة إزالة استقطاب مؤقت يُصحَّح عبر ضخ البروتونات للخارج.
انتقال الكالسيوم ليس أحادي الاتجاه، ولكن يحدث في كلا الاتجاهين.[50] تسهل خصائص مضخة الكالسيوم SERCA وقناة IP3R المتواجدين على غشاء الشبكة الإندوبلازمية عملية التنظيم بالتغذية الراجعة التي تنسقها وظيفة غشاء MAM. يسمح التخلص من أيونات الكالسيوم بواسطة غشاء MAM بتنميط زماني مكاني لتأشير الكالسيوم لأن أيونات الكالسيوم تغير نشاط IP3R على شاكلة ثنائية الطور.[42] يتأثر SERCA كذلك بواسطة التغذية الراجعة من المتقدرة: يحفز امتصاص أيونات الكالسيوم بواسطة غشاء MAM إنتاج الـATP، وهذا يوفر الطاقة التي تمكن SERCA من إعادة تحميل الكالسيوم إلى الشبكة الإندوبلازمية من أجل تدفق خارجي مستمر للكالسيوم من الشبكة الإندوبلازمية في غشاء MAM.[51][53] ولهذا غشاء MAM ليس دارئا لا فاعلا لنفائش الكالسيوم، وإنما يساعد في تعديل التأشير بالكالسيوم عبر حلقات تغذية راجعة تؤثر على حركيات الشبكة الإندوبلازمية.
تنظيم تحرير الشبكة الإندوبلازمية للكالسيوم في غشاء MAM عملية حاسمة لأن مجالا محددا فقط من امتصاص أيونات الكالسيوم هو الذي يحافظ على المتقدرة ومنه الخلية في حالة التوازن والاستتباب. تأشير الكالسيوم الكافي داخل العضية مطلوب لتحفيز الأيض بواسطة إنزيمات نازعات الهيدروجين الضرورية في دورة حمض الستريك.[54] حين يتجاوز التأشير بالكالسيوم في المتقدرة عتبة محددة، فإنه يحفز مسارا ذاتيا للاستماتة بشكل جزئي عبر تقويض جهد غشاء المتقدرة المطلوب من أجل الأيض.[42] تدعم دراسات تختبر دور العوامل الداعمة والمضادة للاستماتة هذا النموذج، على سبيل المثال: تم توضيح أن العامل المضاد للاستماتة Bcl-2 يتآثر مع مستقبلات IP3R لتخفيض تعبئة الشبكة الإندوبلازمية بالكالسيوم، ما يؤدي إلى تدفق خارجي منخفض للكالسيوم في غشاء MAM وهو ما يمنع تقويض جهد غشاء المتقدرة وحدوث الاستماتة.[42] نظرا للحاجة إلى التنظيم الدقيق لتأشير الكالسيوم، فمن غير المفاجئ أن اختلال تنظيم كالسيوم المتقدرة له دور في العديد من أمراض التحلل العصبي، وكذلك وفرة بعض مثبطات الورم في غشاء MAM.[53]
الأساس الجزيئي للربط[عدل]
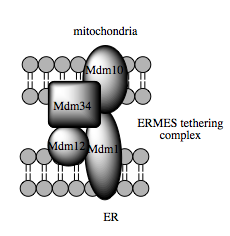
تقترح أدلة حديثة في تحديد المركبات الرابطة بين غشائي المتقدرة والشبكة الإندوبلازمية أن وظيفة السقالة الخاصة بالجزيئات المكونة لهذه المركبات ثانوية بالنسبة لوظائف غير بنيوية أخرى تقوم بها. في الخميرة، ERMES هو مركب عديدُ البروتين يتكون من بروتينات مقيمة في غشائي الشبكة الإندوبلازمية والمتقدرة، تواجده مطلوب لنقل الليبيدات في غشاء MAM وهو مثال على هذا المبدأ، أحد مكوناته على سبيل المثال هو مكون كذلك لمركبٍ بروتيني آخر مطلوب لدمج براميل بيتا عبر الغشائية في طبقة الليبيد المزدوجة.[47] مع ذلك، لم يتم حتى الآن تحديد نظير لمركب ERMES في خلايا الثدييات. من البروتينات الأخرى المساهمة في السقالة كذلك - ولها وظائف أخرى مستقلة عن الربط في غشاء MAM - نجد بروتينات ميتوفوسين المقيمة في الشبكة الإندوبلازمية والمتقدرة والتي تشكل مركبات متغايرة تعمل على تنظيم عدد مواقع الاتصال بين العضيات، رغم أنه تم تحديد دورها أول مرة في اندماج وانشطار المتقدرات.[42] البروتين المرتبط بالغلوكوز 75 (grp75) هو بروتين آخر ثنائي الوظيفة، ففضلا عن وجوده في مطرس المتقدرة، له وظيفة ثانية كشابرون يربط فيزيائيا قنوات الكالسيوم VDAC وIP3R الخاصة بالمتقدرة والشبكة الإندوبلازمية من أجل نقل فعال وكفء لأيونات الكالسيوم في غشاء MAM.[36][42] بروتينٌ رابطٌ محتملٌ آخر هو مستقبل سيغما-1 وهو مستقبل غير أفيوني يعمل على استقرار مستقبل IP3R والحفاظ على الاتصال في غشاء MAM أثناء استجابة الإجهاد الأيضي.[55][56]
غشاء MAM مركز حاسم للتأشير والأيض والنقل في الخلية ويسمح بتكامل فيسيولوجية الشبكة الإندوبلازمية والمتقدرة. اقتران هاتين العضيتين ليس بنيويا فحسب، بل وظيفي كذلك وحاسم للفيسيولوجيا العامة للخلية واستتبابها. يمنح غشاء MAM منظورا عن المتقدرة يحيد ويختلف عن النظرة التقليدية التي مفادها أن هذه العضية وحدة ساكنة تتميز بقدرتها الأيضية وإنتاج الطاقة. وبدل ذلك، يؤكد هذا الغشاء البيني بين الشبكة الإندوبلازمية والمتقدرة، اندماج واشتراك المتقدرات - التي هي ناتج نشوء تعايشي - في مختلف العمليات الخلوية.
التنظيم والتوزيع[عدل]
تتواجد المتقدرات (والعضيات الشبيهة بها) لدى جميع حقيقيات النوى (باستثناء جنس واحد من الأكسيمونيات هو مونوسيركمنيودات).[12][57] رغم تصويرها بنيتها عادة على شكل يشبه الفاصولياء، إلا أن المتقدرات تشكل شبكة عالية الحركية في معظم الخلايا التي تخضع فيها للانقسام والاندماج. تشكل جمهرة جميع المتقدرات في خلية معينة الكوندريوم.[58] تختلف المتقدرات في العدد والموقع حسب نوع الخلية. عادة ما توجد متقدرة واحدة في الكائنات وحيدة الخلية، وعدد المتقدرات في الخلايا الكبدية البشرية حوالي 1000-2000 متقدرة لكل خلية وهو ما يشكل خمس حجم الخلية.[24] محتوى الخلايا المتماثلة من المتقدرات يمكن أن يختلف بشكل كبير في حجم وجهد الغشاء،[59] مع اختلافات ناشئة من مصادر منها تجزئة غير متساوية عند انقسامات الخلية، وهذا يؤدي إلى اختلافات ذاتية في مستويات الـATP والعمليات الخلوية مع المسار.[60] يمكن أن تتواجد المتقدرات بين اللييفات العضلية الخاصة بعضلة أو ملفوفة بواسطة سوط حيوان منوي.[24] غالبا ما تشكل المتقدرات شبكة متفرعة ثلاثية الأبعاد مع الهيكل الخلوي داخل الخلية. ارتباطها مع الهيكل الخلوي يحدد شكل المتقدرات الذي يؤثر على الوظيفة كذلك:[61] مختلف بُنى شبكة المتقدرات يمكن أن يوفر لهذه المتقدرات مجموعة متنوعة من الميزات أو السلبيات الفيزيائية والكيميائية والتأشيرية.[62] المتقدرات في الخلايا موزعة دائما على طول أنيبيبات دقيقة وتوزيع هذه العضيات مرتبط كذلك بالشبكة الإندوبلازمية.[63] تقترح أدلة حديثة أن الفيمنتين - وهو أحد مكونات الهيكل الخلوي - ضروري كذلك في ارتباط المتقدرات بالهيكل الخلوي.[64]
الوظيفة[عدل]
الدور الرئيسي للمتقدرات هو إنتاج عُملة الطاقة الخاصة بالخلية وهي الأدينوسين ثلاثي الفوسفات (ATP) بفسفرة الأدينوسين ثنائي الفوسفات (ADP) عبر عملية التنفس الخلوي، وكذلك تنظيم الأيض الخلوي.[25] مجموعة التفاعلات الرئيسية التي لها دور في إنتاج الـATP تسمى جماعيا دورة حمض الستريك أو حلقة كريبس. مع ذلك للمتقدرة أدوار متعددة أخرى زيادة على إنتاج الـATP.
تحويل الطاقة[عدل]
الدور الرئيسي للمتقدرات هو إنتاج الـATP، وهو ما يتجلى في تواجد عدد كبير من البروتينات في غشائها الداخلي لهذا الغرض. يحدث ذلك عبر أكسدة منتجات الغلوكوز الرئيسية: البيروفات والناد (NAD) اللذان يُنتَجان في العصارة الخلوية.[25] يُعرف هذا النوع من التنفس الخلوي بالتنفس الهوائي وهو يعتمد على تواجد الأكسجين. حين يكون الأكسجين محدودا تُستقلب نواتج الغلوكوز بواسطة التخمر اللاهوائي وهي عملية مستقلة عن المتقدرة.[25] إنتاج الـATP من الغلوكوز أعلى بحوالي 13 مرة في التنفس الهوائي مقارنة بإنتاجه في التخمر.[65] يمكن لمتقدرات النبات كذلك إنتاج كمية محدودة من الـATP من دون الأكسجين باستخدام ركيزة بديلة هي النتريت.[66] يعبر الـATP الغشاء الداخلي بمساعدة بروتين خاص يسمى مزفي نوكليوتيد الأدينين، ويعبر الغشاء الخارجي عبر البورينات، ويرجع الـADP إلى مطرس المتقدرة عبر نفس الطريق.
البيروفات ودورة حمض الستريك[عدل]
جزيئات البيروفات الناتجة بواسطة عملية تحلل الجلوكوز تُنقل بشكل نشط عبر الغشاء الداخلي للمتقدرة إلى مطرسها حيث تتم إما أكسدتها وتجميعها مع مرافق الإنزيم-أ لتشكيل ثنائي أكسيد الكربون، أسيتيل مرافق الإنزيم-أ والناد المختزل (NADH)،[25] أو كرسلتها (بواسطة بيروفات كربوكسيلاز) لتشكيل حمض أكسالوأسيتيك. التفاعل الأخير «يملأ» كمية الأوكسالوأسيتات في دورة حمض الستريك، وبذلك هو تفاعل تصليحي، يزيد من قدرة الدورة على استقلاب مرافق الإنزيم-أ حين ترتفع حاجة النسيج (كالعضلات) إلى الطاقة فجأة عبر نشاطها.[67]
في دورة حمض الستريك، يتم توليد جميع الجزيئات الوسيطة (حمض الستريك، حمض إيزوستريك، حمض ألفا-كيتوغلوتارات، حمض السكسينيك، حمض الفوماريك، حمض التفاح وحمض أكسالوأسيتيك) خلال كل لفة من الدورة. إضافة المزيد من أي جزيء من هذه الجزيئات الوسيطة إلى المتقدرة يعني بقاء الكمية المضافة منخفضة في الدورة، زيادة أي جزيء من الجزيئات الوسيطة بصفة فردية يتم تحويله إلى الجزيئات الوسيطة الأخرى، ولذلك فإن إضافة أي واحد منها إلى الدورة له تأثير تصليحي (ملأ) وإزالته له تأثير إفراغي. تفاعلات الملأ والإفراغ هذه[ملاحظة 5] تقوم أثناء حدوث الدورة بزيادة أو تخفيض كمية حمض أكسالوأسيتيك المتوفرة التي تتفاعل مع أستيل مرافق الإنزيم-أ لتشكيل حمض الستريك، وهذا بدوره يزيد أو يخفض معدل إنتاج الـATP بواسطة المتقدرة، وبذلك توفره في الخلية للقيام بنشاطاتها.[67]
ينتج أستيل مرافق الإنزيم-أ (أسيتيل كو-أ) من أكسدة حمض البيروفيك أو الأكسدة البيتائية للأحماض الدهنية، وهو الوقود (الركيزة) الوحيد الذي يدخل دورة حمض الستريك، وفي كل لفة من الدورة يُستهلك جزيء واحد من أستيل كو-أ مقابل كل جزيء حمض أكسالوأسيتيك متواجد في مطرس المتقدرة، ولا يتم تجديده أبدا. أكسدة جزء الأسيتات من أسيتيل كو-أ هو ما يُنتِج ثنائي أكسيد الكربون والماء، مع تخزين الطاقة المحررة على شكل ATP.[67]
في الكبد، كرسلة بيروفات العصارة الخلوية إلى أوكسالوأسيتات داخل المتقدرة هو خطوة أولى في مسار استحداث الجلوكوز الذي يحول حمض اللبنيك والألانين منزوع الأمين إلى غلوكوز،[25][67] تحت تأثير مستويات عالية من الغلوكاغون و/أو الأدرينالين في الدم.[67] هنا، إضافة حمض أكسالوأسيتيك إلى المتقدرة ليس له تأثير تصليحي لأنه تتم إزالة جزيء وسيط في دورة حمض الستريك (حمض التفاح) مباشرة من المتقدرة ليتم تحويله إلى حمض أكسالوأسيتيك في العصارة الخلوية والذي يحول في النهاية إلى غلوكوز، في عملية عكسية تقريبا لتحلل الجلوكوز.[67]
تتواجد إنزيمات دورة حمض الستريك في مطرس المتقدرة باستثناء نازع هيدروجين السكسينات المرتبط بغشاء المتقدرة الداخلي كجزء من المركب 2.[68] تؤكسِد دورة حمض الستريك أستيل كو-أ إلى ثنائي أكسيد الكربون وخلال هذه العملية تُنتِج عوامل مرافقة مختزلة (ثلاث جزيئات NADH وجزيء FADH2) هي مصدر الإلكترونات في سلسلة نقل الإلكترون، وجزيء GTP الذي يحول بسهولة إلى ATP.[25]
NADH وFADH2: سلسلة نقل الإلكترون[عدل]

طاقة الخزلدة من NADH وFADH2 تُنقل إلى الأكسجين (O2) في عدة مراحل عبر سلسلة نقل الإلكترون. يُنتَج هذان الجزيئان الغنيان بالطاقة داخل المطرس عبر دورة حمض الستريك، لكنهما يُنتجان كذلك في السيتوبلازم بواسطة تحلل الجلوكوز. يمكن نقل المتكافِآت المختزِلة من السيتوبلازم عبر نظام مكوك مالات-أسبارتات من البروتينات متعاكسة التنادل أو يتم إدراجها في سلسلة نقل الإلكترون باستخدام مكوك فوسفات الغليسرول.[25] تقوم المركبات البروتينية في الغشاء الداخلي: (نازعة هيدروجين NADH (يوبيكوينون)، مختزلة الإنزيم المرافق كيو - سيتوكروم سي، وأكسيداز سيتوكروم سي) بعملية النقل وتستخدم الطاقة المحررة في ضخ البروتونات (H+) إلى الحيز بين الغشائي. هذه العملية فعالة، لكن نسبة صغيرة من الإلكترونات يمكن أن تختزل الأكسجين بشكل مُبْتسر، مشكِّلة أنواع الأكسجين التفاعلي مثل فوق الأكسيد.[25] هذا يمكن أن يُسبب إجهاد تأكسدي في المتقدرة ويمكن أن يساهم في انخفاض وظيفة المتقدرة المرتبط بتقدم السن.[69]
مع زيادة تركيز البروتون في الحيز بين الغشائي، يتشكل مدروج كهروكيميائي عبر الغشاء الداخلي. يمكن أن تعود البروتونات إلى المطرس عبر مركب مخلقة الـATP وتُستخدم طاقتها الكامنة في تخليق الـATP من الـADP والفوسفات غير العضوي (Pi).[25] تسمى هذه العملية التناضح الكيميائي ووُصفت لأول مرة بواسطة بيتر ميتشل[70][71] الذي حصل على جائزة نوبل في الكيمياء على عمله، ولاحقا حصل بول بوير وجون ووكر على جائزة نوبل للكيمياء سنة 1997 لتوضيحهما آلية عمل مخلقة الـATP.[72]
إنتاج الحرارة[عدل]
تحت ظروف معينة، يمكن للبروتونات معاودة الدخول إلى مطرس المتقدرة دون المساهمة في تخليق الـATP. تسمى هذه العملية بتسرب البروتون أو فك اقتران المتقدرة، وتحدث بسبب سهولة انتشار البروتونات إلى مطرس المتقدرة. ينتج عن هذه العملية تحرير طاقة كامنة غير مستخدمة خاصة بالمدروج الكهروكيميائي للبروتون على شكل حرارة.[25] تتوسط هذه العملية قناة بروتون تسمى ثيرموجينن أو UCP1.[73] الثيرموجينن هو بروتين وزنه الجزيئي 33 كدا واكتُشف أول مرة سنة 1973.[74] يتواجد الثيرموجينن أساسا في النسيج الدهني البني وهو مسؤول عن توليد الحرارة غير المرتبط بالارتعاد. يتواجد النسيج الدهني البني لدى الثدييات ويكون في أعلى مستوياته في بداية حياة الحيوانات السباتية. لدى البشر، يتواجد النسيج الدهني البني عند الولادة ويتناقص مع العمر.[73]
تخزين أيونات الكالسيوم[عدل]

يمكن أن تُنظِّم تراكيز الكالسيوم الحر في الخلية مجموعةً من التفاعلات وهي مهمة لتوصيل الإشارة في الخلية. يمكن للمتقدرات تخزين الكالسيوم مؤقتا وهي عملية مساهِمة في استتباب كالسيوم الخلية.[75][76] وقدرتها المتمثلة في الامتصاص السريع للكالسيوم لتحريره لاحقا تجعلها «دارئات عصارية خلوية» جيدة جدا للكالسيوم.[77][78][79] الشبكة الإندوبلازمية هي المخزن الرئيسي للكالسيوم،[50] ويوجد تآثر معتبر بين المتقدرة والشبكة الإندوبلازمية فيما يخص الكالسيوم.[80] يُمتص الكالسيوم إلى المطرس بواسطة المنادل الأحادي للكالسيوم الخاص بالمتقدرة الموجود في الغشاء الداخلي للمتقدرة،[81] ويحدث أساسا بسب جهد غشاء المتقدرة.[76] يمكن أن تحدث إعادة تحرير هذا الكالسيوم إلى داخل الخلية عبر بروتين مبادل كالسيوم-صوديوم أو عبر مسارات تحرير الكالسيوم المستحث بالكالسيوم.[81] هذا يمكن أن يولد نفائش أو موجات كالسيوم مع تغييرات كبيرة في جهد الغشاء، والتي يمكنها تنشيط سلسلة من بروتينات نظام الرسول الثاني التي يمكنها تنسيق عملياتٍ مثل تحرير النواقل العصبية في الخلايا العصبية وتحرير الهرمونات في الخلايا الصماوية.[82]
اتضح مؤخرا أن التدفق الداخلي لأيونات الكالسيوم Ca2+ إلى مطرس المتقدرة له دور في آليةٍ لتنظيم الطاقة الحيوية التنفسية عبر السماح للجهد الكهروكيميائي بين جانبي الغشاء «بالنبض» مؤقتا من سيطرة فرق الكمون الكهربائي (ΔΨ) إلى سيطرة الأس الهيدروجيني (PH) وهذا يسهل تخفيض الإجهاد التأكسدي.[83] في العصبونات، تعمل الزيادات المرافقة في كالسيوم العصارة الخلوية والمتقدرة على مزامنة النشاط العصبوني مع أيض الطاقة الخاصة بالمتقدرة. يمكن أن تصل مستويات كالسيوم مطرس المتقدرة حد عشرات ميكرو مول/ل، وهو مستوى ضروري لتنشيط نازعة هيدروجين الإيزوسيترات، وهو أحد الإنزيمات التنظيمية المفتاحية في حلقة كريبس.[84]
وظائف إضافية[عدل]
تلعب المتقدرة دورا في العديد من الوظائف الأخرى مثل:
- التأشير عبر أنواع الأكسجين التفاعلي الخاصة بالمتقدرة.[85]
- تنظيم الجهد الغشائي.[25]
- الاستماتة - موت الخلية المبرمج.[86]
- تأشير الكالسيوم (بما في ذلك الاستماتة المحدَثَة بالكالسيوم).[87]
- تنظيم الأيض الخلوي.[17]
- بعض تفاعلات تخليق الهيم،[88] (انظر بورفيرين)
- تخليق الستيرويدات.[77]
- التأشير بالهرمونات،[89] المتقدرات حساسة ومستجيبة للهرمونات، ويعود ذلك جزئيا إلى مستقبلات الإستروجين المتقدرية. تتواجد هذه المستقبلات في مختلف الأنسجة وأنواع الخلايا بما في ذلك الدماغ[90] والقلب.[91]
- التأشير المناعي.[92]
- تساهم المتقدرات العصبونية في جودة التنظيم الخلوي بالإبلاغ عن حالة العصبونات إلى الخلايا الدبقية الصغيرة عبر مواصل جسدية متخصصة.[93]
بعض وظائف المتقدرة تتم تأديتها في أنواع محددة من الخلايا، على سبيل المثال: تحتوي المتقدرات في خلايا الكبد على إنزيمات تمكنها من إزالة سمية الأمونيا، وهي فضلات من أيض البروتين. حدوث طفرات في الجينات التي تنظم هذه الوظائف يمكن أن يسبب أمراضا متقدرية.
تنظيم التكاثر الخلوي[عدل]
تمت دراسة العلاقة بين التكاثر الخلوي والمتقدرات باستخدام خلايا هيلا السرطانية العنقية. تحتاج الخلايا الورمية إلى كمية كبيرة من الـATP في سبيل تخليق المركبات النشطة حيويا مثل الليبيدات، البروتينات والنوكليوتيدات من أجل نمو الخلية السريع.[94] يُولَّد معظم الـATP في الخلايا الورمية عبر الفسفرة التأكسدية.[95] أظهر اعتراض عملية الفسفرة التأكسدية توقفا في دورة الخلية وهذا يوحي بأن المتقدرات تلعب دورا في نمو الخلية وتكاثرها.[95] إنتاج الـATP في المتقدرة حياتيٌ كذلك بالنسبة لانقسام وتمايز الخلية أثناء العدوى[96] وذلك فضلا عن أهميته بالنسبة لوظائف الخلية الأساسية بما في ذلك تنظيم حجم الخلية، تركيز المذاب ومعمارية الخلية.[97][98][99] تختلف مستويات الـATP بين مختلف مراحل دورة الخلية وهذا يشير إلى علاقة بين توفر الـATP وقدرة الخلية على الدخول في دورة خلوية جديدة.[100] دور الـATP في الوظائف الأساسية للخلية يجعل دورة الخلية حساسة للتغيرات في توافر الـATP المخلق في المتقدرة. يدعم اختلاف مستويات الـATP في المراحل المختلفة من دورة الخلية فرضية أن المتقدرات تلعب دورا مهما في تنظيم دورة الخلية. رغم أن هذه الآليات الخاصة بين المتقدرات وتنظيم دورة الخلية لم يتم فهمها بعد، أظهرت دراسات أن نقاط مراقبة دورة الخلية قليلة الطاقة تراقب قدرة الطاقة قبل الشروع في دورة أخرى من الانقسام الخلوي.[17]
الجينوم[عدل]

تحتوي المتقدرات على جينومها الخاص التي حصلت عليه من البكتيريا عن طريق التعايش الجواني. مع ذلك، جينوم المعايش الجواني السلف فقد معظم جيناته لدرجة أن جينوم المتقدرة (متقدروم) أصبح أقل الجينومات احتواء على الجينات بين الكائنات.
الجينوم المتقدري البشري هو جزيء دنا دائري يتكون من حوالي 16 ألف زوج قاعدي،[101] ويشفِّر 37 جينا: 13 وحدة فرعية من المركبات التنفسية 1 و3 و4 و5، 22 رنا ناقل متقدري (للعشرين حمض أميني القياسية بالإضافة إلى جينين إضافيين لليوسين والسيرين و2 للرنا الريبوسومي.[101] يمكن أن تحتوي متقدرة واحدة على نسختين إلى عشر نسخ من الدنا الخاص بها.[102]
لدى بدائيات النوى، توجد نسبة كبيرة من الدنا المشفِّر للبروتين وغياب للتكرارات. تُنسخ جينات المتقدرة كنسخ متعددة الجينات والتي تُقص بعدها وتُضاف إليها ذيول عديد الأدينلات لإنتاج عدة نسخ رنا رسول ناضجة. لا تُشفَّر جميع البروتينات الضرورية في المتقدرة بواسطة جينومها، بل معظمها يُشفر بواسطة جينات في نواة الخلية ويتم نقل البروتينات الناتجة إلى المتقدرة.[41] عدد الجينات الدقيق الموجودة في جينوم النواة والمتقدرة يختلف بين الأنواع. معظم جينومات المتقدرة دائرية مع وجود استثناءات تم الإبلاغ عنها.[103] بشكل عام، يفتقد دنا المتقدرة للإنترونات، كما هو الحال في جينوم المتقدرة البشري،[41] مع ذلك لوحِظ وجود الإنترونات في دنا المتقدرة الخاص ببعض حقيقيات النوى[104] مثل الخميرة[105] والطلائعيات[106] منها ديكتيوستيليوم دسكويديوم.[107] تتواجد التسلسلات المشفِّرة للرنا الناقل بين المناطق المشفِّرة للبروتين، وأثناء النسخ تتخذ جزيئات الرنا الناقل شكل حرف L الذي تتعرف عيه إنزيمات معينة وتقصه. لجينات الرنا الناقل المتقدري تسلسللات تختلف عن تسلسلات الرنا الناقل النووي، لكن تم العثور على نظائر لجزيئات الرنا الناقل المتقدرية في الكروموسومات النووية ذات تسلسل عالي التماثل.[108]
لدى الحيوانات، جينوم المتقدرة هو عادة كرموسومٌ دائريٌ وحيدٌ طوله حوالي 16 ألف زوج قاعدي ويحتوي 37 جينا. هذه الجينات عالية الانحفاظ يمكن أن تختلف في مواضعها. هذا النمط غير متواجد لدى قمل الإنسان، وبدل ذلك جينومها مرتب في 18 كروموسوم صغير، طول كل واحد منها حوالي 3-4 آلاف زوج قاعدي ويشفِّر من جين إلى ثلاث جينات.[109] هذا النمط متواجد كذلك لدى القمل الماص ولكن ليس لدى القمل العاض، وسبب هذا الاختلاف في نمط دنا المتقدرة غير معروف. لوحظ حدوث إعادة التركيب الجيني بين الكروموسومات الصغيرة.
كود جيني بديل[عدل]
| الكائن | الكودون | التشفير القياسي | تشفير المتقدرة |
|---|---|---|---|
| الثدييات | AGA, AGG | أرجنين | كودون توقف |
| الفقاريات | AGA, AGG | أرجنين | سيرين |
| الفطريات | CUA | ليوسين | ثريونين |
| جميع الأنواع بالأعلى | AUA | إيزوليوسين | ميثيونين |
| UGA | كودون توقف | تريبتوفان |
رغم التنبؤِ باختلافات طفيفة في الشيفرة الجينية القياسية سابقا،[110] إلا أنه لم يُكتشف أي منها حتى سنة 1979 حين اكتشف باحثون يدرسون جينات المتقدرة البشرية أنهم استخدموا شيفرة بديلة.[111] مع ذلك، متقدرات حقيقيات النوى - بما في ذلك معظم النبات - تستخدم الشيفرة القياسية.[112] تم اكتشاف العديد من التغيرات الطفيفة منذ ذلك الحين،[113] بما في ذلك العديد من الشيفرات البديلة في المتقدرات.[114] زيادة على ذلك، الكودونات: AUA وAUC وAUU جميعها كودونات تسمح ببدء النسخ.
يجب أن تُعتبر بعض هذه الاختلافات تغيُّرات كاذبة في الشيفرة الجينية بسبب ظاهرة تحرير الرنا الشائعة في المتقدرات. لدى النباتات العليا، يُعتقد أن الكودون CGG يشفِّر الحمض الأميني تريبتوفان وليس الأرجنين، لكن اكتُشِف أن الكودون في الرنا المعالَج هو UGG وهذا يتوافق مع الشيفرة الجينية القياسية للتريبتوفان.[115] الشيفرة الينية لمفصليات الأرجل خضعت لتطورٍ موازٍ داخل شعبة معينة، حيث تترجِم بعض الكائنات بشكل فريد الكودون AGG إلى لايسين.[116]
تطور وتنوع[عدل]
تملك جينومات المتقدرة عدد جينات أقل بكثير من جينات البكتيريا والتي يُعتقد أن المتقدرة انحدرت منها. رغم أن بعض هذه الجينات فُقِد نهائيا، تم نقل العديد من الجينات الأخرى إلى النواة مثل جينات الوحدات الفرعية للمركب التنفسي 2.[101] يُعتقد أن هذا الأمر شائع نسبيا خلال زمن التطور. تملك بعض الكائنات مثل الكريبتوسبوريديوم متقدراتٍ لا تحتوي على أية جزيئات دنا، وهذا على الأرجح لأن جميع جيناتها فُقِدت أو تم نقلها إلى النواة.[117] في الكريبتوسبوريديوم، للمتقدرات نظام تخليق ATP مختلف يجعل من هذا الكائن الطفيلي مقاوما للعديد من مثبطات المتقدرة الكلاسيكية مثل سيانيد، أزيد وأتوفاكوين.[117]
تضاعف وتوريث[عدل]
تنقسم المتقدرة بواسطة الانقسام الثنائي، بشكل مماثل لانقسام خلية البكتيريا،[118] ويختلف تنظيم هذا الانقسام بين حقيقيات النوى. يرتبط نمو وانقسام العديد من حقيقيات النوى أحادية الخلية بدورة الخلية لديها، على سبيل المثال: يمكن أن تنقسم متقدرة واحدة في وقت متزامن مع النواة، ويجب أن تُراقَب عملية الانقسام والانفصال هذه بإحكام لكي تحصل كل خلية بنت على متقدرة واحدة على الأقل. لدى حقيقيات النواة الأخرى كالثدييات مثلا، يمكن للمتقدرات مضاعفة الدنا الخاص بها والتضاعف استجابة لاحتياجات الخلية من الطاقة، بدل أن يحدث ذلك بشكل متزامن مع دورة الخلية. تنمو المتقدرات وتنقسم حين ترتفع احتياجات الخلية من الطاقة، وحين يكون استخدام الطاقة منخفضا تُفكَّك المتقدرات أو تصبح غير نشطة. لدى حقيقيات النوى هذه - وعلى عكس حقيقيات النوى وحيدة الخلية - يبدو أن تقسيم المتقدرات بين الخلايا البنت يكون عشوائيا أثناء انقسام السيتوبلازم. كشف فهمُ ديناميكية المتقدرة - التي توصف على أنها موازنة بين اندماج وانقسام المقدرة - أن التغيرات الوظيفية والبنيوية في مورفولوجية المتقدرة عوامل مهمة في أسباب الأمراض المرتبطة بالعديد من الحالات المرضية.[119]
اعتمدت فرضية الانقسام الثنائي للمتقدرة على تصويرٍ بواسطة المجهرية الفلورية وبواسطة المجهرية الإلكترونية النافذة التقليدية. دقة المجهرية الفلورية حوالي 200 نانومتر وهي غير كافية لتمييز التفاصيل البنيوية مثل غشاء المتقدرة المضاعف اثناء انقسام المتقدرة أو حتى تمييز المتقدمات فرديا حين تكون مجموعة منها على مقربة من بعضها البعض. المجهرية الإلكترونية النافذة التقليدية لديها بعض المحدوديات التقنية في التأكد من انقسام الخلية. استُخدِم التصوير المقطعي البردي الإلكتروني حديثا لتصوير انقسام المتقدرة في خلايا مجمدة مميهة سليمة، وتم اكتشاف أن المتقدرات تنقسم عبر التبرعم.[120]

جينات متقدرة واحدة لا تتم وراثتها بنفس آلية الجينات الموجودة في النواة، فعادة ما تُورث المتقدرات من أحد الوالدين فقط. لدى البشر، حين تُخصَّب بويضة بواسطة نطفة تُساهم نواة البويضة ونواة النطفة بالتساوي في المحتوى الجيني لنواة اللاقحة (الزيجوت). على عكس ذلك لدى المتقدرات عادة ما يأتي دنا المتقدرة من البويضة فقط. متقدرات النطفة تدخل البويضة لكنها لا تساهم بالمعلومات الجينية للجنين.[121] بدل ذلك، تُعلَّم متقدرات الأب بواسطة اليوبيكويتين لتحديدها لاحقا من أجل تدميرها داخل الجنين.[122] تحتوي البويضة على عدد قليل نسبيا من المتقدرات، لكن هذه المتقدرات هي من تنجو وتنقسم لتستعمر خلايا الكائن البالغ. نتيجة لذلك - وفي معظم الحالات - تورث المتقدرات من الأمهات، وهو نمط يُعرف باسم الوراثة الأمومية ويتواجد لدى معظم الكائنات بما في ذلك معظم الحيوانات. مع ذلك، يمكن أن تورَث المتقدرات لدى بعض الأجناس عن طريق الأب، وهو الحال لدى بعض النباتات المخروطية باستثناء أشجار الصنوبر والطقسوس.[123] بالنسبة لبلحيات البحر، تحدث الوراثة الأبوية فقط بين ذكور هذه الأجناس.[124][125][126] تم اقتراح أن وراثة المتقدرات من الأب لدى البشر تحدث بنسبة صغيرة جدا.[127] واقتُرح سنة 2012 في مجلة علم الأحياء الحالي أن المتقدرات التي تخفض مدة حياة الذكر تبقى في النظام لأنها تورث من الأم فقط. في المقابل يُزيل الاصطفاء الطبيعي المتقدرات التي تخفض من عمر الإناث، وعليه انتقال مثل تلك المتقدرات إلى الجيل التالي ضعيف جدا، وهذا قد يوحي بأن إناث البشر وإناث الحيوانات تميل للعيش أطول من الذكور، ويدعي كُتّاب هذه الورقة أن هذا تفسير جزئي لكون النساء تعيش متوسط عمر أكبر بخمس إلى ستة أعوام من الرجال.[128][129]
تؤدي الوراثة من أحد الأبوين فقط إلى فرصة ضعيفة لحدوث إعادة التركيب الجيني بين مختلف سلالات المتقدرات، رغم أن متقدرة واحدة يمكن أن تحتوي على 2-10 نسخة من الدنا الخاص بها.[102] لهذا السبب، يُعتقد أن دنا المتقدرة يتضاعف بواسطة انقسام ثنائي. توجد دراسات تُظهر أدلة على حدوث إعادة التركيب الجيني في دنا المتقدرة، ومن الواضح أن الإنزيمات الضرورية لهذه العملية متواجدة في خلايا الثدييات.[130] زيادة على ذلك، تقترح أدلة أنه يمكن لمتقدرات الحيوانات أن تخضع لعملية إعادة التركيب الجيني.[131] البيانات خلافية حول حدوثها لدى البشر، رغم وجود دليل غير مباشر على حدوثها.[132][133] إن كانت إعادة التركيب الجيني لا تحدث، فإن جميع تسلسل دنا المتقدرة يمثل نمطا فردانيا واحدا، وهذا أمر مفيد في دراسة التاريخ التطوري للتجمعات السكانية.
الكائنات التي تخضع للوراثة من أحد الأبوين فقط والتي يوجد فيها إعادة تركيب جيني صغير أو منعدم يمكن أن تكون عرضة لسقاطة مولر، وهي تراكمٌ غير قابل للعكس للطفرات المؤذية حتى فقدان الوظيفة. تتجنب المتقدرات لدى الحيونات هذا المصير عبر عملية تطورية تُعرف بعنق زجاجة دنا المتقدرة. يستغل عنق الزجاجة عمليات العشوائية في الخلية لزيادة اختلاف الخلية - إلى - الخلية في كمية الطافر مع تطور الكائن: تُنتِج بويضة واحدة ذات نسبة معينة من دنا المتقدرة الطافر جنينًا تملك فيه مختلف الخلايا كميات طافر مختلفة. بعد ذلك يعمل مستوى اصطفاء الخلية على إزالة الخلايا التي تحتوي على دنا المتقدرة الأكثر طفورا، وهذا يؤدي إلى استقرارٍ أو تخفيضٍ لكمية الطافر بين الأجيال. الآلية خلف عملية عنق الزجاجة محل نقاش،[134][135][136] مع وجود دراسات رياضياتية وتجريبية تلوية توفر أدلة على توليفة لتجزئة عشوائية لدنا المتقدرة أثناء الانقسام الخلوي مع تقلبِ (تجدد) جزيئات دنا المتقدرة عشوائي داخل الخلية.[137]
ترميم الدنا[عدل]
يمكن للمتقدرة ترميم الدنا المتضرر بالأكسدة بواسطة آليات مماثلة لتلك التي تحدث في نواة الخلية. تشفَّر البروتينات المستخدمة في ترميم دنا المتقدرة بواسطة الجينات النووية، ويتم نقلها إلى المتقدرات. تشمل مسارات ترميم الدنا في متقدرات الثدييات: ترميم استئصال القاعدة، ترميم شرخ السلسلة المزدوجة، العكس المباشر وترميم الدنا غير المتطابق.[138][139] يمكن تجاوز تضرر الدنا بدل إصلاحه وذلك بواسطة تخليق عبر-الرابطة. من بين مختلف المسارات المتعددة لترميم الدنا في المتقدرة، يُعتبر ترميم استئصال القاعدة أكثر المسارات التي تمت دراستها بشكل شامل.[139] يحدث ترميم استئصال القاعدة بواسطة سلسلة من الخطوات المحفَّزة إنزيميا والتي تشمل التعرف على قاعدة الدنا المتضررة وإستئصالها، إزالة الموقع اللاخطوي الناتج، إنهاء المعالجة، ملأ الفراغ والربط. أحد الأضرار الشائعة في دنا المتقدرة والذي يرمم بواسطة استئصال القاعدة هو 8-أوكسو غوانين الناتج عن أكسدة الغوانين.[140]
تُرمَّم شروخ السلسلة المزدوجة بواسطة ترميم التأشيب المتماثل في كل من دنا المتقدرة الخاص بالثدييات[141] والنبات.[142] يمكن أن ترمم كذلك شروح السلسلة المزدوجة في دنا المتقدرة بواسطة ربط النهاية المتوسط بالتنادد المكروي.[143] رغم وجود دليل على عمليات الترميم بالعكس المباشر وترميم الدنا غير المتطابق في دنا المتقدرة، لا تزال هذه العمليات غير موصوفة ومحددَّة الخصائص بشكل جيد.[139]
انعدام دنا المتقدرة[عدل]
تملك خلايا حقيقيات النوى في العادة دنا المتقدرة، لكن توجد متقدرات لا تملك دنا خاصا بها مثل تلك المتواجدة لدى الطفيليات البحرية السوطيات الدوارة من جنس أمويِبوفيرا، يملك هذا الكائن الدقيق - أ.سيراتي - متقدرات وظيفية ينعدم فيها الدنا.[144] جينوم المتقدرات الخاص بالأجناس قريبة الصلة من هذا الجنس مازال يحتوي على ثلاث جينات، لكن لدى أ.سيراتي لا يوجد سوى جين متقدرة واحد - هو الوحدة الفرعية 1 من أكسيداز السيتوكروم سي - وقد تم نقله إلى جينوم النواة.[145]
دراسات الوراثيات السكانية[عدل]

الغياب شبه التام لإعادة التركيب الجيني في دنا المتقدرة يجعله مصدرا مفيدا للمعلومات للعلماء المختصين في الوراثيات السكانية وفي علم الأحياء التطوري.[146] لأن جميع دنا المتقدرة يورث كوحدة واحدة - أو نمط فرداني - يمكن للعلاقات بين دنا المتقدرة لمختلف الأفراد أن تُمثل كشجرة جينية، ويمكن أن تُستخدم الأنماط في هذه الأشجار لاستنتاج التاريخ الطوري للجمهرات السكانية. والمثال الكلاسيكي على ذلك في علم الوراثة التطوري البشري، حيث يمكن استخدام الساعة الجزيئية لتوفير تاريخ حديث لحواء الميتوكوندرية.[147][148] يفسَّر هذا غالبا على أنه سند قوي لنظرية انتشار البشر الحديث من إفريقيا.[149] مثال بشري آخر هو سَلسَلة دنا المتقدرة من عظام النياندرتال. فُسِّر البعد التطوري الكبير نسبيا بين تسلسلات دنا المتقدرة الخاص بالنياندرتال والإنسان الحي حاليا بعدم حدوث تهجين وتزاوج بينهما.[150]
مع ذلك لا يعكس دنا المتقدرة سوى تاريخ الإناث في التجمع السكاني ولهذا يمكن أن لا يمثل تاريخ التجمع السكاني ككل. يمكن التغلب على هذا الإشكال جزئيا عبر استخدام التسلسلات الجينية الأبوية مثل المنطقة التي لا تخضع لإعادة التركيب الجيني في الكروموسوم Y.[149] بشكل عام، لا يمكن سوى للدراسات التي تشمل الدنا النووي أيضا تقديم تاريخ تطوري شامل للتجمعات السكانية.[151]
أبلغت قياسات حديثة للساعة الجزيئية لدنا المتقدرة[152] عن حدوث طفرة واحدة كل 7884 سنة منذ عهد أحدث سلف مشترك بين البشر والقرود، وهو ما يتوافق مع تقديرات معدل طفرات الدنا الصبغي الجسمي (10−8 لكل قاعدة لكل جيل).[153]
الاضطراب الوظيفي والمرض[عدل]
أمراض المتقدرة[عدل]
تضرُّرُ المتقدرات والخلل الوظيفي الناتج عن ذلك عامل مهم في مجموعة من الأمراض البشرية وذلك بسبب تأثيرها في أيض الخلية. عادة ما تتجلى الاضطرابات المتقدرية على أنها اضطرابات عصبية مثل التوحد.[23] كما يمكنها أن تتجلى على شكل: اعتلال عضلي، السكري، اعتلال الغدد الصماء المتعدد، والعديد من الاضطرابات الجهازية الأخرى.[154] تشمل الأمراض التي تحدث بسبب طفرة في دنا المتقدرة: متلازمة كيرنز ساير، متلازمة ميلاس واعتلال ليبر العصبي البصري الوراثي.[155] في معظم الحالات، تنتقل هذه الأمراض بواسطة الأم إلى أبنائها وذلك لأن اللاقحة تحصل على متقدراتها - ومنه دنا المتقدرة - من البويضة. يُعتقد أن سبب أمراضٍ مثل: متلازمة كيرنز ساير، متلازمة بيرسون وشلل العين التقدمي الخارجي المزمن يعود إلى إعادات تنظيم دنا المتقدرة واسعة النطاق، بينما أمراض أخرى مثل: متلازمة ميلاس، اعتلال ليبر العصبي البصري الوراثي، الصرع الرمعي العضلي ذو الألياف الرثة (MERRF) وأخرى سببها طفرات نقطية في دنا المتقدرة.[154]

في أمراض أخرى، تؤدي عيوب في الجينات النووية إلى الاختلال الوظيفي لبروتينات المتقدرة، وهي الحالة في: رنح فريدريخ، الشلل النصفي التشنجي الموروث وداء ويلسون.[156] تورث هذه الأمراض بطريقة سيادية، وهو ما ينطبق على معظم الأمراض الوراثية الأخرى. يمكن لمجموعة متنوعة من الاضطرابات أن تحدث بواسطة طفرات نووية لإنزيمات الفسفرة التأكسدية مثل عوز مرافق الإنزيم Q10 ومتلازمة بارث.[154] يمكن أن تتآثر المؤثرات البيئية مع الاستعدادات الوراثية وتسبب مرضا متقدريا. على سبيل المثال قد يكون هنالك رابط بين التعرض لمبيد آفات والإصابة اللاحقة بمرض باركنسون.[157][158] من الأمراض الأخرى التي من أسبابها الاختلال الوظيفي للمتقدرة: الفصام، الاضطراب ثنائي القطب، الخرف، مرض آلزهايمر،[159] مرض باركنسون، الصرع، السكتة الدماغية، الأمراض القلبية الوعائية، متلازمة التعب المزمن، التهاب الشبكية الصباغي والسكري.[160][161]
يلعب الإجهاد التأكسدي المتوسَّط بالمتقدرة دورا في اعتلال عضلة القلب في سكري النوع الثاني. زيادة توصيل الأحماض الدهنية إلى القلب تزيد من استهلاك الخلايا العضلية القلبية لها، وتنتج عن ذلك زيادةٌ في أكسدة الأحماض الدهنية في هذه الخلايا. تزيد هذه العملية من المتكافِآت المختزِلة المتوفرة لسلسلة نقل الإلكترون في المتقدرة، ما يزيد في النهاية من إنتاج أنواع الأكسجين التفاعلي (ROS). تزيد أنواع الأكسجين التفاعلي من بروتينات فك اقتران (UCP) وتقوي تسرب البروتون عبر مزفي نوكليوتيد الأدينين (ANT)، وهي توليفة تفك اقتران المتقدرات. بعد ذلك، يزيد فك الاقتران من استهلاك المتقدرات للأكسجين، ما يزيد من أكسدة الأحماض الدهنية، وهو ما يُنشِئ دورة ضارة من فك الاقتران، ورغم زيادة استهلاك الأكسجين لا يزيد إنتاج الـATP بشكل متناسب لأن المتقدرات مفكوكة الاقتران. ينتج عن التوفُّر القليل للـATP في النهاية عوز في الطاقة يتجلى في فعاليةٍ قلبيةٍ منخفضةٍ واختلال وظيفي في الانقباض. ما يزيد من تعقيد المشكل هو أن تحرير الشبكة الإندوبلازمية العضلية المعتل للكالسيوم وانخفاض استرداد المتقدرة له يحد من ذروة مستويات العصارة الخلوية من أيون مهم أثناء الانقباض. يزيد التركيز المنخفض للكالسيوم داخل المتقدرة من نشاط نازعة الهيدروجين وتخليق الـATP. لذلك بالإضافة إلى انخفاض تخليق الـATP بسبب أكسدة الأحماض الدهنية، يتعرض تخليق الـATP للاعتلال بسبب تأشير الكالسيوم الضعيف وهذا يسبب مشاكل قلبية لمرضى السكري.[162]
علاقة محتملة بالشيخوخة[عدل]
نظرا لدور المتقدرة كمركز لتوليد الطاقة في الخلية، يمكن أن يكون هنالك بعض التسرب لإلكتروناتٍ عالية الطاقة في السلسلة التنفسية لتشكيل أنواع الأكسجين التفاعلي. ويُعتقد أن هذا يمكن أن يُنتِج إجهادا تأكسديا معتبرا في المتقدرات ذات المعدل العالي في طفرات الدنا المتقدري الخاص بها.[163] فرضية وجود روابط بين الشيخوخة والإجهاد التأكسدي ليست جديدة وتم اقتراحها سابقا سنة 1956،[164] ثم ظهرت نسخة محسنة منها باسم نظرية الجذور الحرة المتقدرية للشيخوخة.[165] يُعتقد أن دورة ضارة تحدث - بينما يؤدي الإجهاد التأكسدي إلى طفرات في دنا المتقدرة - والتي يمكن أن تؤدي إلى اضطرابات إنزيمية والمزيد من الإجهاد التأكسدي.
يمكن أن يحدث عدد من التغيرات في المتقدرة أثناء عملية التشيخ.[166] تُظهر أنسجة من المرضى كبار السن انخفاضا في النشاط الإنزيمي لبروتينات السلسلة التنفسية.[167] ومع ذلك دنا المتقدرة الطافر لم يوجد سوى في 0.2% من الخلايا العتيقة جدا.[168] افتُرِض أن الحذف الكبير في جينوم المتقدرة يؤدي إلى مستويات عالية من الإجهاد التأكسدي وموت الخلايا العصبية في مرض باركنسون.[169]
في الثقافة الشعبية[عدل]
في رواية الفنتازيا العلمية لمادلين لانغل الصادرة سنة 1973 المعنونة «ريح في الباب»، متقدرات الشخصية الرئيسية تشارلز والاس موري تسكنها مخلوقات تعرف باسم «فاراندولاي». وفي الرواية كذلك تسافر شخصيات أخرى داخل متقدرات موري.
في رواية أدب الرعب «الطفيلي إيف» بواسطة الكاتب هيداكي سينا، تُصوَّر المتقدرات على أنها تملك بعض الوعي وقدرات التحكم في العقل، وتحاول استخدام هذه القدرات لتجاوز حقيقيات النوى في كونها هيئة الحياة السائدة. تم تبني هذه الرواية في فلم ولعبة فيديو ولعبة ثانية مبنية جميعها على افتراض مماثل.
في سلسلة أفلام حرب النجوم، تمنح الكائنات الدقيقة التي يشار إليها باسم «ميدي-كلوريانز» بعض الشخصيات القدرة على الإحساس بالقوة واستخدامها. جورج لوكاس مخرج فيلم 1999 حرب النجوم الجزء الأول: تهديد الشبح الذي تم فيه تقديم الميدي-كلوريانز، وصف هذه الأخيرة بأنها «تمثيل عام غير دقيق للمتقدرات».[170] البكتيريا غير الخيالية ميديكلوريا حصلت على اسمها لاحقا من الميدي-كلوريانز الخاصة بفيلم حرب النجوم.
كنتيجة لاشتهار المتقدرة في التعليم العلمي الحديث الأمريكي، أصبحت عبارة "المتقدرات هي مركز طاقة الخلية" ميم إنترنت.[171]
الأصل والتطور[عدل]
يُعتبر تطوُّر الخلايا حقيقية النواة - التي تحتوي على نواة ومناطق حيّزية مغلفة بالغشاء - واحدًا من أكثر الأحداث الغامضة في تطور الحياة على سطح الأرض. وقد شكَّل ظهور الميتوكوندريا نقلة حاسمة في هذه العملية؛ إذ يُعتقد أن هذه العضيّات قد تشكلت حين بدأت خلية بكتيرية العيشَ داخل خلية مضيفة بدائية، ما يُعَدّ أحد أشكال التعايش الداخلي، وهو بمثابة علاقة منفعة متبادلة، يعيش فيها كائن حي بداخل كائن آخر. مِن المعتقَد أن البكتيريا قد زوّدت الخلية المضيفة بكمية إضافية من الطاقة، ومن ثم نتجتْ عن التفاعل بينهما خليّة حقيقية النواة، احتوت على جينات، يعود أصلها إلى كل من الخلية البدائية، والبكتيريا. قدّم الباحثان بيتيس وجابالدون بحثهما [172] على أن الخلية المضيفة التي تطوَّرت منها حقيقيات النوى كانت تحتوي في الأصل على جينات تعود إلى مجموعة مختلفة من المصادر، وذلك قبل التعايش الداخلي للميتوكوندريا؛ ما يشير إلى أن الميتوكوندريا تطورت في وقت لاحق لعملية تطور حقيقيات النوى عما كان يُعتقد في السابق.
تاريخ البحث والاكتشاف[عدل]
نُشرت أول ملاحظات لهياكل داخل خلوية اعتُقد أنها تمثل المتقدرات في عقد 1840.[173] وفي سنة 1890 حدد ريتشارد ألتمان هذه الهياكل على أنها عضيات خلوية وسماها «بيوبلاست».[172][174] صيغ المصطلح الأجنبي «ميتوكوندريا» بواسطة كارل بيندا سنة 1898.[172][175] واكتشف ليونور ميخائيلس إمكانية استخدام خضرة يانوس بي كملون فوق حيوي للمتقدرات سنة 1900. في سنة 1904 قام فريدريش ميفيس بأول ملاحظة مسجلة للمتقدرات في خلايا نبات الزنبق الأبيض «النيلوفر الأبيض»[172][176] وفي سنة 1908 اقترح - مع كلوديوس ريغو- أنها تحتوي على بروتينات وليبيدات. بنجامين كينغسبري هو أول من ربط المتقدرات بتنفس الخلية سنة 1912، لكن بشكل شبه حصري عبر ملاحظات مورفولوجية.[172] في سنة 1913، ربط أوتو فاربورغ جسيماتٍ من مستخلصاتِ كبد الكابياء الخنزيرية بالتنفس، والتي سُميت «غرانا». فاربورغ وهاينريش فيلاند -ا لذي افترض وجود آلية مماثلة- اختلفا على الطبيعة الكيميائية للتنفس. واستغرق الأمر حتى سنة 1925 عندما اكتشف ديفيد كيلين السيتوكرومات ليتم وصف السلسلة التنفسية.[172]
أثبتت تجارب أجريت سنة 1939 باستخدام خلايا عضلية مفرومة أن التنفس الخلوي باستخدام ذرة أكسجين واحدة يمكن أن يشكل جزيئي ATP، وفي سنة 1941 طور فريتس ليبمان مفهوم أن روابط الفوسفات في الـATP هي شكل من الطاقة في الأيض الخلوي. في الأعوام التالية، أكتُشفت تفاصيل أكثر حول التنفس الخلوي، رغم أن علاقته مع المتقدرات لم تكن معروفة.[172] سمح ابتكار تجزيء النسيج بواسطة ألبير كلود بعزل المتقدرات من بقية أجزاء الخلية وإجراء الدراسات عليها وحدها، واستنتج ألبير كلود سنة 1946 أن سيتوكروم أكسيداز وإنزيمات أخرى مسؤولة عن السلسلة التنفسية تتواجد في المتقدرات. اكتشف يوجين كينيدي وألبرت ليننغر سنة 1948 أن المتقدرات هي موقع الفسفرة التأكسدية لدى حقيقيات النوى، ومع مرور الوقت تم تطوير طريقة التجزيء أكثر وتحسنت جودة المتقدرات المستخلصة وتم اكتشاف تواجد عناصر أخرى من السلسلة التنفسية في المتقدرات.[172]
ظهرت أول صورة عالية الدقة بالمجهر الإلكتروني سنة 1952، وأصبحت الطريقة الأفضل في تصوير المتقدرات بدل صباغ خضرة يانوس.[172] أدى هذا إلى تفاصيل أكثر دقة في بنية المتقدرات، بما في ذلك التأكيد على أنها محاطة بغشاء، وكشف المجهر الإلكتروني كذلك وجود غشاء ثاني داخل المتقدرات والذي يتطوى في تلافيف تقسِّم الغرفة الداخلية للمتقدرة، وأظهر أن حجم المتقدرات وشكلها يختلف من خلية إلى أخرى. صيغ المصطلح الشهير "مركز طاقة الخلية" بواسطة فيليب سيكيفيتز سنة 1957.[15] وفي سنة 1967 اكتُشف أن المتقدرات تحتوي على ريبوسومات،[177] وفي سنة 1968 طُوِّرت طرق لموضعة جينات المتقدرة، واكتملت الخريطة الجينية والفيزيائية لدنا متقدرة الخميرة سنة 1976.[172]
انظر أيضًا[عدل]
- صانعات يخضورية
- مساعد الإنزيم 10-Q
- سلسلة تنفس
- أيه تي بي سينثاز
- نازع هيدروجين السكسينات
- هيم بيروكسيداز
- سرتوين
- تجزيء خلوي
ملاحظات[عدل]
- ^ بالإنجليزية rotenone-insensitive NADH-cytochrome c-reductase
- ^ بالإنجليزية fatty-acid—CoA ligase
- ^ بالإنجليزية Ca2+ puffs
- ^ بالإنجليزية tunneling وتعني إدخال الكالسيوم في أنابيب (أنفاق) غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرة MAM
- ^ بالإنجليزية anaplerotic and cataplerotic reactions وهي تفاعلات إضافة أو إزالة المستقلبات -وهي جزيئات وسيطة- من مسارات استقلابية مثل دورة حمض الستريك
مراجع[عدل]
- ^ أ ب مذكور في: Gene Ontology release 2019-10-07. الوصول: 12 أكتوبر 2019. مُعرِّف علم وجود المورثات (GO): GO:0005739. تاريخ النشر: 7 أكتوبر 2019.
- ^ مُعرِّف النموذج التأسيسي في التشريح: 63835. مذكور في: نموذج تأسيسي في التشريح. الوصول: 1 أغسطس 2019.
- ^ مذكور في: قاموس إيربن. لغة العمل أو لغة الاسم: الإنجليزية.
- ^ مُعرِّف موسوعة بريتانيكا على الإنترنت (EBID): science/mitochondrion. الاقتباس: Introduction / The number ... / ... / Mitochondria are ... reproduce by binary fission ....
- ^ [أ] محمد هيثم الخياط (2009). المعجم الطبي الموحد: إنكليزي - فرنسي - عربي (بالعربية والإنجليزية والفرنسية) (ط. الرابعة). بيروت: مكتبة لبنان ناشرون، منظمة الصحة العالمية. ص. 1237. ISBN:978-9953-86-482-2. OCLC:978161740. QID:Q113466993.
[ب] يوسف حتي؛ أحمد شفيق الخطيب (2011). قاموس حتي الطبي الجديد: طبعة جديدة وموسعة ومعززة بالرسوم إنكليزي - عربي مع ملحقات ومسرد عربي - إنكليزي (بالعربية والإنجليزية) (ط. الأولى). بيروت: مكتبة لبنان ناشرون. ص. 541. ISBN:978-9953-86-883-7. OCLC:868913367. QID:Q112962638.
[جـ] أيمن الحسيني (1996). قاموس ابن سينا الطبي: قاموس طبي علمي مصور (بالعربية والإنجليزية). مراجعة: عز الدين نجيب. القاهرة: مكتبة ابن سينا. ص. 228. ISBN:978-977-271-202-1. OCLC:4770172048. QID:Q113472538.
[د] قاسم سارة (2013). معجم أكاديميا الطبي الجديد (بالعربية والإنجليزية) (ط. 1). أكاديميا إنترناشيونال. ص. 417. ISBN:978-9953-37-092-7. OCLC:1164356572. QID:Q112637909.
[هـ] المعجم الموحد لمصطلحات الصيدلة: (إنجليزي - فرنسي - عربي)، سلسلة المعاجم الموحدة (33) (بالعربية والإنجليزية والفرنسية)، الرباط: مكتب تنسيق التعريب، 2009، ص. 135، OCLC:949444424، QID:Q116203617
[و] معجم الصيدلة الموحد (بالعربية والإنجليزية) (ط. 2). بيروت: مكتبة لبنان ناشرون، منظمة الصحة العالمية. 2007. ص. 59. ISBN:978-9953-33-469-1. OCLC:957304728. OL:31692967M. QID:Q116275188.
[ز] معجم طب الأسنان الموحد: عربي - إنكليزي (بالعربية والإنجليزية) (ط. 1). بيروت: مكتبة لبنان ناشرون. 2004. ص. 67. ISBN:978-9953-33-468-4. OCLC:66529477. QID:Q118591856.
[ح] فتحي عبد المجيد وفا، معجم مصطلحات أمراض الفم والأسنان (بالعربية والإنجليزية)، مركز تعريب العلوم الصحية، ص. 523، QID:Q110874466
- ^ صادق الهلالي؛ سفيان العسولي (1993). معجم الوراثيات والعلوم البيولوجية والجزيئية (بالعربية والإنجليزية). الإسكندرية: منظمة الصحة العالمية. ص. 224. ISBN:978-92-9021-161-7. OCLC:717204628. QID:Q112584694.
- ^ الكلمة مشتقة من فعل تَقَدَّرَ مطاوع قَدَّرَ، يقال تقدر عليه الشيء أي جاء على مقداره وتقدر له الشيء أي تهيأ له فعله. لا يبدو وجه التسمية واضحا وعليه فالظاهر أن لفظة المتقدرة اتخذت لمواءمة لفظة الميتوكندري
- ^ أ ب محمد مرعشي (2003). معجم مرعشي الطبي الكبير (بالعربية والإنجليزية). بيروت: مكتبة لبنان ناشرون. ص. 933. ISBN:978-9953-33-054-9. OCLC:4771449526. QID:Q98547939.
- ^ علم الأحياء، بواسطة بيتر هـ. ريفن،جورج ب. جونسون،جوناثان ب. لوسوس،كينيث أ. ماسون،سوزان ر. سنجر، صفحة 568. نسخة محفوظة 30 نوفمبر 2019 على موقع واي باك مشين.
- ^ أ ب الميتوكُندري كلمة أجنبية مركبة من لفظتين إغريقيتين ميتُس "خَيط" وكُندرِيُن "حُبَيبة". و"الحبيبة الخيطية" مترجمة اقتراضية لها.
- ^ Henze K، Martin W (نوفمبر 2003). "Evolutionary biology: essence of mitochondria". Nature. ج. 426 ع. 6963: 127–128. Bibcode:2003Natur.426..127H. DOI:10.1038/426127a. PMID:14614484.
- ^ أ ب Karnkowska A، Vacek V، Zubáčová Z، Treitli SC، Petrželková R، Eme L، Novák L، Žárský V، Barlow LD، Herman EK، Soukal P، Hroudová M، Doležal P، Stairs CW، Roger AJ، Eliáš M، Dacks JB، Vlček Č، Hampl V (مايو 2016). "A Eukaryote without a Mitochondrial Organelle". Current Biology. ج. 26 ع. 10: 1274–1284. DOI:10.1016/j.cub.2016.03.053. PMID:27185558.
- ^ mitochondria. مؤرشف من الأصل في 2016-12-09.
{{استشهاد بموسوعة}}: الوسيط غير المعروف|معجم=تم تجاهله (مساعدة) - ^ Campbell، Neil A.؛ Williamson، Brad؛ Heyden، Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN:978-0-13-250882-7. مؤرشف من الأصل في 2018-11-01.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ أ ب Siekevitz P (1957). "Powerhouse of the cell". ساينتفك أمريكان. ج. 197 ع. 1: 131–140. Bibcode:1957SciAm.197a.131S. DOI:10.1038/scientificamerican0757-131.
- ^ Wiemerslage L، Lee D (مارس 2016). "Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters". Journal of Neuroscience Methods. ج. 262: 56–65. DOI:10.1016/j.jneumeth.2016.01.008. PMC:4775301. PMID:26777473.
- ^ أ ب ت McBride HM، Neuspiel M، Wasiak S (يوليو 2006). "Mitochondria: more than just a powerhouse". Current Biology. ج. 16 ع. 14: R551–60. DOI:10.1016/j.cub.2006.06.054. PMID:16860735.
- ^ Valero T (2014). "Mitochondrial biogenesis: pharmacological approaches". Current Pharmaceutical Design. ج. 20 ع. 35: 5507–9. DOI:10.2174/138161282035140911142118. hdl:10454/13341. PMID:24606795.
Mitochondrial biogenesis is therefore defined as the process via which cells increase their individual mitochondrial mass [3]. ... Mitochondrial biogenesis occurs by growth and division of pre-existing organelles and is temporally coordinated with cell cycle events [1].
- ^ Sanchis-Gomar F، García-Giménez JL، Gómez-Cabrera MC، Pallardó FV (2014). "Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches". Current Pharmaceutical Design. ج. 20 ع. 35: 5619–33. DOI:10.2174/1381612820666140306095106. PMID:24606801.
Mitochondrial biogenesis (MB) is the essential mechanism by which cells control the number of mitochondria
- ^ Gardner A، Boles RG (2005). "Is a 'Mitochondrial Psychiatry' in the Future? A Review". Curr. Psychiatry Rev. ج. 1 ع. 3: 255–271. DOI:10.2174/157340005774575064.
- ^ Lesnefsky EJ، Moghaddas S، Tandler B، Kerner J، Hoppel CL (يونيو 2001). "Mitochondrial dysfunction in cardiac disease: ischemia--reperfusion, aging, and heart failure". Journal of Molecular and Cellular Cardiology. ج. 33 ع. 6: 1065–89. DOI:10.1006/jmcc.2001.1378. PMID:11444914.
- ^ Dorn GW، Vega RB، Kelly DP (أكتوبر 2015). "Mitochondrial biogenesis and dynamics in the developing and diseased heart". Genes & Development. ج. 29 ع. 19: 1981–91. DOI:10.1101/gad.269894.115. PMC:4604339. PMID:26443844.
- ^ أ ب Griffiths KK، Levy RJ (2017). "Evidence of Mitochondrial Dysfunction in Autism: Biochemical Links, Genetic-Based Associations, and Non-Energy-Related Mechanisms". Oxidative Medicine and Cellular Longevity. ج. 2017: 4314025. DOI:10.1155/2017/4314025. PMC:5467355. PMID:28630658.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب ت ث ج ح خ د ذ ر ز Alberts، Bruce؛ Johnson، Alexander؛ Lewis، Julian؛ Raff، Martin؛ Roberts، Keith؛ Walter، Peter (1994). Molecular Biology of the Cell. New York: Garland Publishing Inc. ISBN:978-0-8153-3218-3. مؤرشف من الأصل في 2021-10-20.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ أ ب ت ث ج ح خ د ذ ر ز س Voet، Donald؛ Voet، Judith G.؛ Pratt، Charlotte W. (2006). Fundamentals of Biochemistry (ط. 2nd). John Wiley and Sons, Inc. ص. 547, 556. ISBN:978-0-471-21495-3. مؤرشف من الأصل في 2019-12-15.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Andersson SG، Karlberg O، Canbäck B، Kurland CG (يناير 2003). "On the origin of mitochondria: a genomics perspective". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. ج. 358 ع. 1429: 165–77, discussion 177–9. DOI:10.1098/rstb.2002.1193. PMC:1693097. PMID:12594925.
- ^ Taylor SW، Fahy E، Zhang B، Glenn GM، Warnock DE، Wiley S، Murphy AN، Gaucher SP، Capaldi RA، Gibson BW، Ghosh SS (مارس 2003). "Characterization of the human heart mitochondrial proteome". Nature Biotechnology. ج. 21 ع. 3: 281–6. DOI:10.1038/nbt793. PMID:12592411. مؤرشف من الأصل في 2022-04-07.
- ^ Zhang J، Li X، Mueller M، Wang Y، Zong C، Deng N، Vondriska TM، Liem DA، Yang JI، Korge P، Honda H، Weiss JN، Apweiler R، Ping P (أبريل 2008). "Systematic characterization of the murine mitochondrial proteome using functionally validated cardiac mitochondria". Proteomics. ج. 8 ع. 8: 1564–75. DOI:10.1002/pmic.200700851. PMC:2799225. PMID:18348319.
- ^ Zhang J، Liem DA، Mueller M، Wang Y، Zong C، Deng N، Vondriska TM، Korge P، Drews O، Maclellan WR، Honda H، Weiss JN، Apweiler R، Ping P (يونيو 2008). "Altered proteome biology of cardiac mitochondria under stress conditions". Journal of Proteome Research. ج. 7 ع. 6: 2204–14. DOI:10.1021/pr070371f. PMC:3805274. PMID:18484766.
- ^ "Mitochondrion – much more than an energy converter". British Society for Cell Biology. مؤرشف من الأصل في 2019-04-04. اطلع عليه بتاريخ 2013-08-19.
- ^ Blachly-Dyson E، Forte M (سبتمبر 2001). "VDAC channels". IUBMB Life. ج. 52 ع. 3–5: 113–8. DOI:10.1080/15216540152845902. PMID:11798022.
- ^ Hoogenboom BW، Suda K، Engel A، Fotiadis D (يوليو 2007). "The supramolecular assemblies of voltage-dependent anion channels in the native membrane". Journal of Molecular Biology. ج. 370 ع. 2: 246–55. DOI:10.1016/j.jmb.2007.04.073. PMID:17524423.
- ^ Zeth K (يونيو 2010). "Structure and evolution of mitochondrial outer membrane proteins of beta-barrel topology". Biochimica et Biophysica Acta. ج. 1797 ع. 6–7: 1292–9. DOI:10.1016/j.bbabio.2010.04.019. PMID:20450883.
- ^ أ ب Herrmann JM، Neupert W (أبريل 2000). "Protein transport into mitochondria". Current Opinion in Microbiology. ج. 3 ع. 2: 210–4. DOI:10.1016/S1369-5274(00)00077-1. PMID:10744987. مؤرشف من الأصل في 2020-03-01.
- ^ أ ب Chipuk JE، Bouchier-Hayes L، Green DR (أغسطس 2006). "Mitochondrial outer membrane permeabilization during apoptosis: the innocent bystander scenario". Cell Death and Differentiation. ج. 13 ع. 8: 1396–1402. DOI:10.1038/sj.cdd.4401963. PMID:16710362.
- ^ أ ب ت ث ج Hayashi T، Rizzuto R، Hajnoczky G، Su TP (فبراير 2009). "MAM: more than just a housekeeper". Trends in Cell Biology. ج. 19 ع. 2: 81–88. DOI:10.1016/j.tcb.2008.12.002. PMC:2750097. PMID:19144519.
- ^ McMillin JB، Dowhan W (ديسمبر 2002). "Cardiolipin and apoptosis". Biochimica et Biophysica Acta. ج. 1585 ع. 2–3: 97–107. DOI:10.1016/S1388-1981(02)00329-3. PMID:12531542.
- ^ Mannella CA (2006). "Structure and dynamics of the mitochondrial inner membrane cristae". Biochimica et Biophysica Acta. ج. 1763 ع. 5–6: 542–548. DOI:10.1016/j.bbamcr.2006.04.006. PMID:16730811.
- ^ Thar R، Kühl M (سبتمبر 2004). "Propagation of electromagnetic radiation in mitochondria?" (PDF). Journal of Theoretical Biology. ج. 230 ع. 2: 261–270. DOI:10.1016/j.jtbi.2004.05.021. PMID:15302557. مؤرشف من الأصل (PDF) في 2013-07-18.
- ^ Bogenhagen DF (سبتمبر 2012). "Mitochondrial DNA nucleoid structure". Biochimica et Biophysica Acta. ج. 1819 ع. 9–10: 914–20. DOI:10.1016/j.bbagrm.2011.11.005. PMID:22142616.
- ^ أ ب ت Anderson S، Bankier AT، Barrell BG، de Bruijn MH، Coulson AR، Drouin J، Eperon IC، Nierlich DP، Roe BA، Sanger F، Schreier PH، Smith AJ، Staden R، Young IG (أبريل 1981). "Sequence and organization of the human mitochondrial genome". Nature. ج. 290 ع. 5806: 457–465. Bibcode:1981Natur.290..457A. DOI:10.1038/290457a0. PMID:7219534.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص Rizzuto R، Marchi S، Bonora M، Aguiari P، Bononi A، De Stefani D، Giorgi C، Leo S، Rimessi A، Siviero R، Zecchini E، Pinton P (نوفمبر 2009). "Ca(2+) transfer from the ER to mitochondria: when, how and why". Biochimica et Biophysica Acta. ج. 1787 ع. 11: 1342–1351. DOI:10.1016/j.bbabio.2009.03.015. PMC:2730423. PMID:19341702.
- ^ أ ب de Brito OM، Scorrano L (أغسطس 2010). "An intimate liaison: spatial organization of the endoplasmic reticulum-mitochondria relationship". The EMBO Journal. ج. 29 ع. 16: 2715–2723. DOI:10.1038/emboj.2010.177. PMC:2924651. PMID:20717141.
- ^ أ ب Vance JE، Shiao YJ (1996). "Intracellular trafficking of phospholipids: import of phosphatidylserine into mitochondria". Anticancer Research. ج. 16 ع. 3B: 1333–1339. PMID:8694499.
- ^ أ ب ت Lebiedzinska M، Szabadkai G، Jones AW، Duszynski J، Wieckowski MR (أكتوبر 2009). "Interactions between the endoplasmic reticulum, mitochondria, plasma membrane and other subcellular organelles". The International Journal of Biochemistry & Cell Biology. ج. 41 ع. 10: 1805–1816. DOI:10.1016/j.biocel.2009.02.017. PMID:19703651.
- ^ Twig G، Elorza A، Molina AJ، Mohamed H، Wikstrom JD، Walzer G، Stiles L، Haigh SE، Katz S، Las G، Alroy J، Wu M، Py BF، Yuan J، Deeney JT، Corkey BE، Shirihai OS (يناير 2008). "Fission and selective fusion govern mitochondrial segregation and elimination by autophagy". The EMBO Journal. ج. 27 ع. 2: 433–446. DOI:10.1038/sj.emboj.7601963. PMC:2234339. PMID:18200046.
- ^ أ ب ت ث ج ح Osman C، Voelker DR، Langer T (يناير 2011). "Making heads or tails of phospholipids in mitochondria". The Journal of Cell Biology. ج. 192 ع. 1: 7–16. DOI:10.1083/jcb.201006159. PMC:3019561. PMID:21220505.
- ^ Kornmann B، Currie E، Collins SR، Schuldiner M، Nunnari J، Weissman JS، Walter P (يوليو 2009). "An ER-mitochondria tethering complex revealed by a synthetic biology screen". Science. ج. 325 ع. 5939: 477–481. Bibcode:2009Sci...325..477K. DOI:10.1126/science.1175088. PMC:2933203. PMID:19556461.
- ^ Rusiñol AE، Cui Z، Chen MH، Vance JE (نوفمبر 1994). "A unique mitochondria-associated membrane fraction from rat liver has a high capacity for lipid synthesis and contains pre-Golgi secretory proteins including nascent lipoproteins". The Journal of Biological Chemistry. ج. 269 ع. 44: 27494–27502. PMID:7961664.
- ^ أ ب ت Santulli G، Marks AR (2015). "Essential Roles of Intracellular Calcium Release Channels in Muscle, Brain, Metabolism, and Aging". Current Molecular Pharmacology. ج. 8 ع. 2: 206–222. DOI:10.2174/1874467208666150507105105. PMID:25966694.
- ^ أ ب Kopach O، Kruglikov I، Pivneva T، Voitenko N، Fedirko N (مايو 2008). "Functional coupling between ryanodine receptors, mitochondria and Ca(2+) ATPases in rat submandibular acinar cells". Cell Calcium. ج. 43 ع. 5: 469–481. DOI:10.1016/j.ceca.2007.08.001. PMID:17889347.
- ^ Csordás G، Hajnóczky G (أبريل 2001). "Sorting of calcium signals at the junctions of endoplasmic reticulum and mitochondria". Cell Calcium. ج. 29 ع. 4: 249–262. DOI:10.1054/ceca.2000.0191. PMID:11243933.
- ^ أ ب ت ث Decuypere JP، Monaco G، Bultynck G، Missiaen L، De Smedt H، Parys JB (مايو 2011). "The IP(3) receptor-mitochondria connection in apoptosis and autophagy". Biochimica et Biophysica Acta. ج. 1813 ع. 5: 1003–1013. DOI:10.1016/j.bbamcr.2010.11.023. PMID:21146562.
- ^ Hajnóczky G، Csordás G، Yi M (2011). "Old players in a new role: mitochondria-associated membranes, VDAC, and ryanodine receptors as contributors to calcium signal propagation from endoplasmic reticulum to the mitochondria". Cell Calcium. ج. 32 ع. 5–6: 363–377. DOI:10.1016/S0143416002001872. PMID:12543096.
- ^ Marriott KS، Prasad M، Thapliyal V، Bose HS (ديسمبر 2012). "σ-1 receptor at the mitochondrial-associated endoplasmic reticulum membrane is responsible for mitochondrial metabolic regulation". The Journal of Pharmacology and Experimental Therapeutics. ج. 343 ع. 3: 578–586. DOI:10.1124/jpet.112.198168. PMC:3500540. PMID:22923735.
- ^ Hayashi T، Su TP (نوفمبر 2007). "Sigma-1 receptor chaperones at the ER-mitochondrion interface regulate Ca(2+) signaling and cell survival". Cell. ج. 131 ع. 3: 596–610. DOI:10.1016/j.cell.2007.08.036. PMID:17981125.
- ^ The eukaryote جياردية معوية, for example, does not contain mitochondria, but does have a mitochondrial-like gene, suggesting that it once included either mitochondria or an endosymbiotic progenitor of it Roger AJ، Svärd SG، Tovar J، Clark CG، Smith MW، Gillin FD، Sogin ML (يناير 1998). "A mitochondrial-like chaperonin 60 gene in Giardia lamblia: evidence that diplomonads once harbored an endosymbiont related to the progenitor of mitochondria". Proceedings of the National Academy of Sciences of the United States of America. ج. 95 ع. 1: 229–234. Bibcode:1998PNAS...95..229R. DOI:10.1073/pnas.95.1.229. PMC:18184. PMID:9419358.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|lastauthoramp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Logan DC (يونيو 2010). "Mitochondrial fusion, division and positioning in plants". Biochemical Society Transactions. ج. 38 ع. 3: 789–95. DOI:10.1042/bst0380789. PMID:20491666.
- ^ das Neves RP، Jones NS، Andreu L، Gupta R، Enver T، Iborra FJ (ديسمبر 2010). Weissman JS (المحرر). "Connecting variability in global transcription rate to mitochondrial variability". PLoS Biology. ج. 8 ع. 12: e1000560. DOI:10.1371/journal.pbio.1000560. PMC:3001896. PMID:21179497.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Johnston IG، Gaal B، Neves RP، Enver T، Iborra FJ، Jones NS (2012). Haugh JM (المحرر). "Mitochondrial variability as a source of extrinsic cellular noise". PLoS Computational Biology. ج. 8 ع. 3: e1002416. arXiv:1107.4499. Bibcode:2012PLSCB...8E2416J. DOI:10.1371/journal.pcbi.1002416. PMC:3297557. PMID:22412363.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Rappaport L، Oliviero P، Samuel JL (1998). "Cytoskeleton and mitochondrial morphology and function". Mol. Cell. Biochem. ج. 184: 101–105. DOI:10.1023/A:1006843113166.
- ^ Hoitzing H، Johnston IG، Jones NS (يونيو 2015). "What is the function of mitochondrial networks? A theoretical assessment of hypotheses and proposal for future research". BioEssays. ج. 37 ع. 6: 687–700. DOI:10.1002/bies.201400188. PMC:4672710. PMID:25847815.
- ^ Soltys BJ، Gupta RS (1992). "Interrelationships of endoplasmic reticulum, mitochondria, intermediate filaments, and microtubules--a quadruple fluorescence labeling study". Biochemistry and Cell Biology. ج. 70 ع. 10–11: 1174–1186. DOI:10.1139/o92-163. PMID:1363623.
- ^ Tang HL، Lung HL، Wu KC، Le AH، Tang HM، Fung MC (فبراير 2008). "Vimentin supports mitochondrial morphology and organization". The Biochemical Journal. ج. 410 ع. 1: 141–146. DOI:10.1042/BJ20071072. PMID:17983357.
- ^ Rich PR (ديسمبر 2003). "The molecular machinery of Keilin's respiratory chain". Biochemical Society Transactions. ج. 31 ع. Pt 6: 1095–1105. DOI:10.1042/BST0311095. PMID:14641005.
- ^ Stoimenova M، Igamberdiev AU، Gupta KJ، Hill RD (يوليو 2007). "Nitrite-driven anaerobic ATP synthesis in barley and rice root mitochondria". Planta. ج. 226 ع. 2: 465–474. DOI:10.1007/s00425-007-0496-0. PMID:17333252.
- ^ أ ب ت ث ج ح Stryer، Lubert (1995). "Citric acid cycle.". In: Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. ISBN:0-7167-2009-4.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ King A، Selak MA، Gottlieb E (أغسطس 2006). "Succinate dehydrogenase and fumarate hydratase: linking mitochondrial dysfunction and cancer". Oncogene. ج. 25 ع. 34: 4675–4682. DOI:10.1038/sj.onc.1209594. PMID:16892081.
- ^ Huang H، Manton KG (مايو 2004). "The role of oxidative damage in mitochondria during aging: a review". Frontiers in Bioscience. ج. 9 ع. 1–3: 1100–1117. DOI:10.2741/1298. PMID:14977532.
- ^ Mitchell P، Moyle J (يناير 1967). "Chemiosmotic hypothesis of oxidative phosphorylation". Nature. ج. 213 ع. 5072: 137–139. Bibcode:1967Natur.213..137M. DOI:10.1038/213137a0. PMID:4291593.
- ^ Mitchell P (يونيو 1967). "Proton current flow in mitochondrial systems". Nature. ج. 214 ع. 5095: 1327–1328. Bibcode:1967Natur.214.1327M. DOI:10.1038/2141327a0. PMID:6056845.
- ^ Nobel Foundation. "Chemistry 1997". مؤرشف من الأصل في 2018-06-18. اطلع عليه بتاريخ 2007-12-16.
- ^ أ ب Mozo J، Emre Y، Bouillaud F، Ricquier D، Criscuolo F (نوفمبر 2005). "Thermoregulation: what role for UCPs in mammals and birds?". Bioscience Reports. ج. 25 ع. 3–4: 227–249. DOI:10.1007/s10540-005-2887-4. PMID:16283555.
- ^ Nicholls DG، Lindberg O (سبتمبر 1973). "Brown-adipose-tissue mitochondria. The influence of albumin and nucleotides on passive ion permeabilities". European Journal of Biochemistry. ج. 37 ع. 3: 523–530. DOI:10.1111/j.1432-1033.1973.tb03014.x. PMID:4777251.
- ^ Santulli G، Xie W، Reiken SR، Marks AR (سبتمبر 2015). "Mitochondrial calcium overload is a key determinant in heart failure". Proceedings of the National Academy of Sciences of the United States of America. ج. 112 ع. 36: 11389–11394. Bibcode:2015PNAS..11211389S. DOI:10.1073/pnas.1513047112. PMC:4568687. PMID:26217001.
- ^ أ ب Basic Neurochemistry (ط. 6). Lippincott Williams & Wilkins. 1999. ISBN:978-0-397-51820-3. Illustrations by Lorie M. Gavulic
{{استشهاد بكتاب}}: صيانة الاستشهاد: postscript (link) - ^ أ ب Rossier MF (أغسطس 2006). "T channels and steroid biosynthesis: in search of a link with mitochondria". Cell Calcium. ج. 40 ع. 2: 155–164. DOI:10.1016/j.ceca.2006.04.020. PMID:16759697.
- ^ Brighton CT، Hunt RM (مايو 1974). "Mitochondrial calcium and its role in calcification. Histochemical localization of calcium in electron micrographs of the epiphyseal growth plate with K-pyroantimonate". Clinical Orthopaedics and Related Research. ج. 100 ع. 5: 406–416. DOI:10.1097/00003086-197405000-00057. PMID:4134194.
- ^ Brighton CT، Hunt RM (يوليو 1978). "The role of mitochondria in growth plate calcification as demonstrated in a rachitic model". The Journal of Bone and Joint Surgery. American Volume. ج. 60 ع. 5: 630–639. DOI:10.2106/00004623-197860050-00007. PMID:681381.
- ^ Pizzo P، Pozzan T (أكتوبر 2007). "Mitochondria-endoplasmic reticulum choreography: structure and signaling dynamics". Trends in Cell Biology. ج. 17 ع. 10: 511–517. DOI:10.1016/j.tcb.2007.07.011. PMID:17851078.
- ^ أ ب Miller RJ (1 مارس 1998). "Mitochondria – the kraken wakes!". Trends Neurosci. ج. 21 ع. 3: 95–97. DOI:10.1016/S0166-2236(97)01206-X. PMID:9530913.
- ^ Santulli G، Pagano G، Sardu C، Xie W، Reiken S، D'Ascia SL، Cannone M، Marziliano N، Trimarco B، Guise TA، Lacampagne A، Marks AR (مايو 2015). "Calcium release channel RyR2 regulates insulin release and glucose homeostasis". The Journal of Clinical Investigation. ج. 125 ع. 5: 1968–1978. DOI:10.1172/JCI79273. PMC:4463204. PMID:25844899.
- ^ Schwarzländer M، Logan DC، Johnston IG، Jones NS، Meyer AJ، Fricker MD، Sweetlove LJ (مارس 2012). "Pulsing of membrane potential in individual mitochondria: a stress-induced mechanism to regulate respiratory bioenergetics in Arabidopsis". The Plant Cell. ج. 24 ع. 3: 1188–1201. DOI:10.1105/tpc.112.096438. PMC:3336130. PMID:22395486.
- ^ Ivannikov MV، Macleod GT (يونيو 2013). "Mitochondrial free Ca²⁺ levels and their effects on energy metabolism in Drosophila motor nerve terminals". Biophysical Journal. ج. 104 ع. 11: 2353–2361. Bibcode:2013BpJ...104.2353I. DOI:10.1016/j.bpj.2013.03.064. PMC:3672877. PMID:23746507.
- ^ Li X، Fang P، Mai J، Choi ET، Wang H، Yang XF (فبراير 2013). "Targeting mitochondrial reactive oxygen species as novel therapy for inflammatory diseases and cancers". Journal of Hematology & Oncology. ج. 6 ع. 19: 19. DOI:10.1186/1756-8722-6-19. PMC:3599349. PMID:23442817.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Green DR (سبتمبر 1998). "Apoptotic pathways: the roads to ruin". Cell. ج. 94 ع. 6: 695–698. DOI:10.1016/S0092-8674(00)81728-6. PMID:9753316.
- ^ Hajnóczky G، Csordás G، Das S، Garcia-Perez C، Saotome M، Sinha Roy S، Yi M (2006). "Mitochondrial calcium signalling and cell death: approaches for assessing the role of mitochondrial Ca2+ uptake in apoptosis". Cell Calcium. ج. 40 ع. 5–6: 553–560. DOI:10.1016/j.ceca.2006.08.016. PMC:2692319. PMID:17074387.
- ^ Oh-hama T (أغسطس 1997). "Evolutionary consideration on 5-aminolevulinate synthase in nature". Origins of Life and Evolution of the Biosphere. ج. 27 ع. 4: 405–412. DOI:10.1023/A:1006583601341. PMID:9249985.
- ^ Klinge CM (ديسمبر 2008). "Estrogenic control of mitochondrial function and biogenesis". Journal of Cellular Biochemistry. ج. 105 ع. 6: 1342–1351. DOI:10.1002/jcb.21936. PMC:2593138. PMID:18846505.
- ^ Alvarez-Delgado C، Mendoza-Rodríguez CA، Picazo O، Cerbón M (أغسطس 2010). "Different expression of alpha and beta mitochondrial estrogen receptors in the aging rat brain: interaction with respiratory complex V". Experimental Gerontology. ج. 45 ع. 7–8: 580–585. DOI:10.1016/j.exger.2010.01.015. PMID:20096765.
- ^ Pavón N، Martínez-Abundis E، Hernández L، Gallardo-Pérez JC، Alvarez-Delgado C، Cerbón M، Pérez-Torres I، Aranda A، Chávez E (أكتوبر 2012). "Sexual hormones: effects on cardiac and mitochondrial activity after ischemia-reperfusion in adult rats. Gender difference". The Journal of Steroid Biochemistry and Molecular Biology. ج. 132 ع. 1–2: 135–146. DOI:10.1016/j.jsbmb.2012.05.003. PMID:22609314.
- ^ Naffah et. al, https://doi.org/10.1016/j.redox.2019.101255 نسخة محفوظة 4 يوليو 2020 على موقع واي باك مشين.
- ^ Cserép et al., Science 12 Dec 2019: eaax6752 DOI: 10.1126/science.aax6752 https://science.sciencemag.org/content/early/2019/12/11/science.aax6752 نسخة محفوظة 2019-12-22 على موقع واي باك مشين.
- ^ Weinberg F، Chandel NS (أكتوبر 2009). "Mitochondrial metabolism and cancer". Annals of the New York Academy of Sciences. ج. 1177 ع. 1: 66–73. Bibcode:2009NYASA1177...66W. DOI:10.1111/j.1749-6632.2009.05039.x. PMID:19845608.
- ^ أ ب Moreno-Sánchez R، Rodríguez-Enríquez S، Marín-Hernández A، Saavedra E (مارس 2007). "Energy metabolism in tumor cells". The FEBS Journal. ج. 274 ع. 6: 1393–1418. DOI:10.1111/j.1742-4658.2007.05686.x. PMID:17302740.
- ^ Mistry JJ، Marlein CR، Moore J، Hellmich C، Wojtowicz EE، Smith JG، Macaulay I، Sun Y، Morfakis A، Patterson A، Horton RH، Divekar D، Morris CJ، Haestier A، Di Palma F، Beraza N، Bowles KM، Rushworth SA (نوفمبر 2019). "ROS-mediated PI3K activation drives mitochondrial transfer from stromal cells to hematopoietic stem cells in response to infection". PNAS. ج. 116 ع. 49: 24610–24619. DOI:10.1073/pnas.1913278116. PMID:31727843.
- ^ Pedersen PL (ديسمبر 1994). "ATP synthase. The machine that makes ATP". Current Biology. ج. 4 ع. 12: 1138–1141. DOI:10.1016/S0960-9822(00)00257-8. PMID:7704582.
- ^ Pattappa G، Heywood HK، de Bruijn JD، Lee DA (أكتوبر 2011). "The metabolism of human mesenchymal stem cells during proliferation and differentiation". Journal of Cellular Physiology. ج. 226 ع. 10: 2562–2570. DOI:10.1002/jcp.22605. PMID:21792913.
- ^ Agarwal B (يونيو 2011). "A role for anions in ATP synthesis and its molecular mechanistic interpretation". Journal of Bioenergetics and Biomembranes. ج. 43 ع. 3: 299–310. DOI:10.1007/s10863-011-9358-3. PMID:21647635.
- ^ Sweet S، Singh G (يوليو 1999). "Changes in mitochondrial mass, membrane potential, and cellular adenosine triphosphate content during the cell cycle of human leukemic (HL-60) cells". Journal of Cellular Physiology. ج. 180 ع. 1: 91–96. DOI:10.1002/(SICI)1097-4652(199907)180:1<91::AID-JCP10>3.0.CO;2-6. PMID:10362021.
- ^ أ ب ت Chan DC (يونيو 2006). "Mitochondria: dynamic organelles in disease, aging, and development". Cell. ج. 125 ع. 7: 1241–1252. DOI:10.1016/j.cell.2006.06.010. PMID:16814712.
- ^ أ ب Wiesner RJ، Rüegg JC، Morano I (مارس 1992). "Counting target molecules by exponential polymerase chain reaction: copy number of mitochondrial DNA in rat tissues". Biochemical and Biophysical Research Communications. ج. 183 ع. 2: 553–559. DOI:10.1016/0006-291X(92)90517-O. PMID:1550563.
- ^ Fukuhara H، Sor F، Drissi R، Dinouël N، Miyakawa I، Rousset S، Viola AM (أبريل 1993). "Linear mitochondrial DNAs of yeasts: frequency of occurrence and general features". Molecular and Cellular Biology. ج. 13 ع. 4: 2309–2314. DOI:10.1128/mcb.13.4.2309. PMC:359551. PMID:8455612.
- ^ Bernardi G (ديسمبر 1978). "Intervening sequences in the mitochondrial genome". Nature. ج. 276 ع. 5688: 558–559. Bibcode:1978Natur.276..558B. DOI:10.1038/276558a0. PMID:214710.
- ^ Hebbar SK، Belcher SM، Perlman PS (أبريل 1992). "A maturase-encoding group IIA intron of yeast mitochondria self-splices in vitro". Nucleic Acids Research. ج. 20 ع. 7: 1747–1754. DOI:10.1093/nar/20.7.1747. PMC:312266. PMID:1579468.
- ^ Gray MW، Lang BF، Cedergren R، Golding GB، Lemieux C، Sankoff D، Turmel M، Brossard N، Delage E، Littlejohn TG، Plante I، Rioux P، Saint-Louis D، Zhu Y، Burger G (فبراير 1998). "Genome structure and gene content in protist mitochondrial DNAs". Nucleic Acids Research. ج. 26 ع. 4: 865–878. DOI:10.1093/nar/26.4.865. PMC:147373. PMID:9461442.
- ^ Gray MW، Lang BF، Burger G (2004). "Mitochondria of protists". Annual Review of Genetics. ج. 38: 477–524. DOI:10.1146/annurev.genet.37.110801.142526. PMID:15568984.
- ^ Telonis AG، Loher P، Kirino Y، Rigoutsos I (2014). "Nuclear and mitochondrial tRNA-lookalikes in the human genome". Frontiers in Genetics. ج. 5: 344. DOI:10.3389/fgene.2014.00344. PMC:4189335. PMID:25339973.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Shao R، Kirkness EF، Barker SC (مايو 2009). "The single mitochondrial chromosome typical of animals has evolved into 18 minichromosomes in the human body louse, Pediculus humanus". Genome Research. ج. 19 ع. 5: 904–912. DOI:10.1101/gr.083188.108. PMC:2675979. PMID:19336451.
- ^ Crick FH، Orgel LE (1973). "Directed panspermia" (PDF). Icarus. ج. 19 ع. 3: 341–346. Bibcode:1973Icar...19..341C. DOI:10.1016/0019-1035(73)90110-3. مؤرشف من الأصل في 2019-02-04.
p. 344: It is a little surprising that organisms with somewhat different codes do not coexist.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|lastauthoramp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) Further discussion. - ^ Barrell BG، Bankier AT، Drouin J (نوفمبر 1979). "A different genetic code in human mitochondria". Nature. ج. 282 ع. 5735: 189–194. Bibcode:1979Natur.282..189B. DOI:10.1038/282189a0. PMID:226894.
- ^ Mitochondrial Genetic Code in Taxonomy Tree. NCBI نسخة محفوظة 22 ديسمبر 2019 على موقع واي باك مشين.
- ^ Elzanowski, Andrzej and Ostell, Jim. The Genetic Codes. NCBI نسخة محفوظة 20 أغسطس 2016 على موقع واي باك مشين.
- ^ Jukes TH، Osawa S (ديسمبر 1990). "The genetic code in mitochondria and chloroplasts". Experientia. ج. 46 ع. 11–12: 1117–1126. DOI:10.1007/BF01936921. PMID:2253709.
- ^ Hiesel R، Wissinger B، Schuster W، Brennicke A (ديسمبر 1989). "RNA editing in plant mitochondria". Science. ج. 246 ع. 4937: 1632–1634. Bibcode:1989Sci...246.1632H. DOI:10.1126/science.2480644. PMID:2480644.
- ^ Abascal F، Posada D، Knight RD، Zardoya R (مايو 2006). "Parallel evolution of the genetic code in arthropod mitochondrial genomes". PLoS Biology. ج. 4 ع. 5: e127. DOI:10.1371/journal.pbio.0040127. PMC:1440934. PMID:16620150.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب Henriquez FL، Richards TA، Roberts F، McLeod R، Roberts CW (فبراير 2005). "The unusual mitochondrial compartment of Cryptosporidium parvum". Trends in Parasitology. ج. 21 ع. 2: 68–74. DOI:10.1016/j.pt.2004.11.010. PMID:15664529.
- ^ Pfeiffer، Ronald F. (2012). Parkinson's Disease. CRC Press. ص. 583. ISBN:9781439807149. مؤرشف من الأصل في 2020-01-05.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Seo AY، Joseph AM، Dutta D، Hwang JC، Aris JP، Leeuwenburgh C (أغسطس 2010). "New insights into the role of mitochondria in aging: mitochondrial dynamics and more". Journal of Cell Science. ج. 123 ع. Pt 15: 2533–2542. DOI:10.1242/jcs.070490. PMC:2912461. PMID:20940129.
- ^ Hu GB (أغسطس 2014). "Whole cell cryo-electron tomography suggests mitochondria divide by budding". Microscopy and Microanalysis. ج. 20 ع. 4: 1180–1187. Bibcode:2014MiMic..20.1180H. DOI:10.1017/S1431927614001317. PMID:24870811.
- ^ Kimball, J.W. (2006) "Sexual Reproduction in Humans: Copulation and Fertilization," Kimball's Biology Pages (based on Biology, 6th ed., 1996) نسخة محفوظة 2 أكتوبر 2015 على موقع واي باك مشين. [وصلة مكسورة]
- ^ Sutovsky P، Moreno RD، Ramalho-Santos J، Dominko T، Simerly C، Schatten G (نوفمبر 1999). "Ubiquitin tag for sperm mitochondria". Nature. ج. 402 ع. 6760: 371–372. Bibcode:1999Natur.402..371S. DOI:10.1038/46466. PMID:10586873. Discussed in Science News نسخة محفوظة 19 ديسمبر 2007 على موقع واي باك مشين..
- ^ Mogensen HL (1996). "The Hows and Whys of Cytoplasmic Inheritance in Seed Plants". American Journal of Botany. ج. 83 ع. 3: 383–404. DOI:10.2307/2446172. JSTOR:2446172.
- ^ Zouros E (ديسمبر 2000). "The exceptional mitochondrial DNA system of the mussel family Mytilidae". Genes & Genetic Systems. ج. 75 ع. 6: 313–318. DOI:10.1266/ggs.75.313. PMID:11280005.
- ^ Sutherland B، Stewart D، Kenchington ER، Zouros E (يناير 1998). "The fate of paternal mitochondrial DNA in developing female mussels, Mytilus edulis: implications for the mechanism of doubly uniparental inheritance of mitochondrial DNA". Genetics. ج. 148 ع. 1: 341–347. PMC:1459795. PMID:9475744.
- ^ Male and Female Mitochondrial DNA Lineages in the Blue Mussel (Mytilus edulis) Species Group by Donald T. Stewart, Carlos Saavedra, Rebecca R. Stanwood, Amy 0. Ball, and Eleftherios Zouros نسخة محفوظة 18 مايو 2013 على موقع واي باك مشين.
- ^ Johns DR (أكتوبر 2003). "Paternal transmission of mitochondrial DNA is (fortunately) rare". Annals of Neurology. ج. 54 ع. 4: 422–424. DOI:10.1002/ana.10771. PMID:14520651.
- ^ Camus MF, Clancy DJ, Dowling DK (2012). "Mitochondria, maternal inheritance, and male aging". Curr Biol. ج. 22 ع. 18: 1717–21. DOI:10.1016/j.cub.2012.07.018. PMID:22863313. مؤرشف من الأصل في 14 مارس 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Fruit flies offer DNA clue to why women live longer. BBC. 2 August 2012 نسخة محفوظة 30 مايو 2019 على موقع واي باك مشين.
- ^ Thyagarajan B، Padua RA، Campbell C (نوفمبر 1996). "Mammalian mitochondria possess homologous DNA recombination activity". The Journal of Biological Chemistry. ج. 271 ع. 44: 27536–27543. DOI:10.1074/jbc.271.44.27536. PMID:8910339.
- ^ Lunt DH، Hyman BC (مايو 1997). "Animal mitochondrial DNA recombination". Nature. ج. 387 ع. 6630: 247. Bibcode:1997Natur.387..247L. DOI:10.1038/387247a0. PMID:9153388.
- ^ Eyre-Walker A، Smith NH، Smith JM (مارس 1999). "How clonal are human mitochondria?". Proceedings. Biological Sciences. ج. 266 ع. 1418: 477–483. DOI:10.1098/rspb.1999.0662. PMC:1689787. PMID:10189711.
- ^ Awadalla P، Eyre-Walker A، Smith JM (ديسمبر 1999). "Linkage disequilibrium and recombination in hominid mitochondrial DNA". Science. ج. 286 ع. 5449: 2524–2525. DOI:10.1126/science.286.5449.2524. PMID:10617471. مؤرشف من الأصل في 2020-03-01.
- ^ Cree LM، Samuels DC، de Sousa Lopes SC، Rajasimha HK، Wonnapinij P، Mann JR، Dahl HH، Chinnery PF (فبراير 2008). "A reduction of mitochondrial DNA molecules during embryogenesis explains the rapid segregation of genotypes". Nature Genetics. ج. 40 ع. 2: 249–254. DOI:10.1038/ng.2007.63. PMID:18223651.
- ^ Cao L، Shitara H، Horii T، Nagao Y، Imai H، Abe K، Hara T، Hayashi J، Yonekawa H (مارس 2007). "The mitochondrial bottleneck occurs without reduction of mtDNA content in female mouse germ cells". Nature Genetics. ج. 39 ع. 3: 386–390. DOI:10.1038/ng1970. PMID:17293866.
- ^ Wai T، Teoli D، Shoubridge EA (ديسمبر 2008). "The mitochondrial DNA genetic bottleneck results from replication of a subpopulation of genomes". Nature Genetics. ج. 40 ع. 12: 1484–1488. DOI:10.1038/ng.258. PMID:19029901.
- ^ Johnston IG، Burgstaller JP، Havlicek V، Kolbe T، Rülicke T، Brem G، Poulton J، Jones NS (يونيو 2015). "Stochastic modelling, Bayesian inference, and new in vivo measurements elucidate the debated mtDNA bottleneck mechanism". eLife. ج. 4: e07464. DOI:10.7554/eLife.07464. PMC:4486817. PMID:26035426.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Gredilla R، Garm C، Stevnsner T (2012). "Nuclear and mitochondrial DNA repair in selected eukaryotic aging model systems". Oxid Med Cell Longev. ج. 2012: 282438. DOI:10.1155/2012/282438. PMC:3462412. PMID:23050036.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب ت Saki M، Prakash A (يونيو 2017). "DNA damage related crosstalk between the nucleus and mitochondria". Free Radic. Biol. Med. ج. 107: 216–227. DOI:10.1016/j.freeradbiomed.2016.11.050. PMC:5449269. PMID:27915046.
- ^ Leon J، Sakumi K، Castillo E، Sheng Z، Oka S، Nakabeppu Y (فبراير 2016). "8-Oxoguanine accumulation in mitochondrial DNA causes mitochondrial dysfunction and impairs neuritogenesis in cultured adult mouse cortical neurons under oxidative conditions". Sci Rep. ج. 6: 22086. Bibcode:2016NatSR...622086L. DOI:10.1038/srep22086. PMC:4766534. PMID:26912170.
- ^ Dahal S، Dubey S، Raghavan SC (مايو 2018). "Homologous recombination-mediated repair of DNA double-strand breaks operates in mammalian mitochondria". Cell. Mol. Life Sci. ج. 75 ع. 9: 1641–1655. DOI:10.1007/s00018-017-2702-y. PMID:29116362.
- ^ Odahara M، Inouye T، Fujita T، Hasebe M، Sekine Y (فبراير 2007). "Involvement of mitochondrial-targeted RecA in the repair of mitochondrial DNA in the moss, Physcomitrella patens". Genes Genet. Syst. ج. 82 ع. 1: 43–51. DOI:10.1266/ggs.82.43. PMID:17396019.
- ^ Tadi SK، Sebastian R، Dahal S، Babu RK، Choudhary B، Raghavan SC (يناير 2016). "Microhomology-mediated end joining is the principal mediator of double-strand break repair during mitochondrial DNA lesions". Mol. Biol. Cell. ج. 27 ع. 2: 223–35. DOI:10.1091/mbc.E15-05-0260. PMC:4713127. PMID:26609070.
- ^ John U، Lu Y، Wohlrab S، Groth M، Janouškovec J، Kohli GS، Mark FC، Bickmeyer U، Farhat S، Felder M، Frickenhaus S، Guillou L، Keeling PJ، Moustafa A، Porcel BM، Valentin K، Glöckner G (أبريل 2019). "An aerobic eukaryotic parasite with functional mitochondria that likely lacks a mitochondrial genome". Science Advances. ج. 5 ع. 4: eaav1110. DOI:10.1126/sciadv.aav1110. PMC:6482013. PMID:31032404.
- ^ "Veritable powerhouses -- even without DNA: Parasitic algae from the dinoflagellate lineage have organized their genetic material in an unprecedented way". ScienceDaily. مؤرشف من الأصل في 2019-06-24.
- ^ Castro JA، Picornell A، Ramon M (ديسمبر 1998). "Mitochondrial DNA: a tool for populational genetics studies". International Microbiology. ج. 1 ع. 4: 327–332. PMID:10943382.
- ^ Cann RL، Stoneking M، Wilson AC (يناير 1987). "Mitochondrial DNA and human evolution". Nature. ج. 325 ع. 6099: 31–36. Bibcode:1987Natur.325...31C. DOI:10.1038/325031a0. PMID:3025745.
- ^ Torroni A، Achilli A، Macaulay V، Richards M، Bandelt HJ (يونيو 2006). "Harvesting the fruit of the human mtDNA tree". Trends in Genetics. ج. 22 ع. 6: 339–345. DOI:10.1016/j.tig.2006.04.001. PMID:16678300.
- ^ أ ب Garrigan D، Hammer MF (سبتمبر 2006). "Reconstructing human origins in the genomic era". Nature Reviews. Genetics. ج. 7 ع. 9: 669–680. DOI:10.1038/nrg1941. PMID:16921345.
- ^ Krings M، Stone A، Schmitz RW، Krainitzki H، Stoneking M، Pääbo S (يوليو 1997). "Neandertal DNA sequences and the origin of modern humans". Cell. ج. 90 ع. 1: 19–30. DOI:10.1016/S0092-8674(00)80310-4. PMID:9230299.
- ^ Harding RM، Fullerton SM، Griffiths RC، Bond J، Cox MJ، Schneider JA، Moulin DS، Clegg JB (أبريل 1997). "Archaic African and Asian lineages in the genetic ancestry of modern humans". American Journal of Human Genetics. ج. 60 ع. 4: 772–789. PMC:1712470. PMID:9106523.
- ^ Soares P، Ermini L، Thomson N، Mormina M، Rito T، Röhl A، Salas A، Oppenheimer S، Macaulay V، Richards MB (يونيو 2009). "Correcting for purifying selection: an improved human mitochondrial molecular clock". American Journal of Human Genetics. ج. 84 ع. 6: 740–759. DOI:10.1016/j.ajhg.2009.05.001. PMC:2694979. PMID:19500773.
- ^ Nachman MW، Crowell SL (سبتمبر 2000). "Estimate of the mutation rate per nucleotide in humans". Genetics. ج. 156 ع. 1: 297–304. PMC:1461236. PMID:10978293. مؤرشف من الأصل في 2019-09-14.
- ^ أ ب ت Zeviani M، Di Donato S (أكتوبر 2004). "Mitochondrial disorders". Brain. ج. 127 ع. Pt 10: 2153–2172. DOI:10.1093/brain/awh259. PMID:15358637.
- ^ Taylor RW، Turnbull DM (مايو 2005). "Mitochondrial DNA mutations in human disease". Nature Reviews. Genetics. ج. 6 ع. 5: 389–402. DOI:10.1038/nrg1606. PMC:1762815. PMID:15861210.
- ^ Chinnery PF، Schon EA (سبتمبر 2003). "Mitochondria". Journal of Neurology, Neurosurgery, and Psychiatry. ج. 74 ع. 9: 1188–1199. DOI:10.1136/jnnp.74.9.1188. PMC:1738655. PMID:12933917.
- ^ Sherer TB، Betarbet R، Greenamyre JT (يونيو 2002). "Environment, mitochondria, and Parkinson's disease". The Neuroscientist. ج. 8 ع. 3: 192–197. DOI:10.1177/1073858402008003004. PMID:12061498.
- ^ Gomez C، Bandez MJ، Navarro A (يناير 2007). "Pesticides and impairment of mitochondrial function in relation with the parkinsonian syndrome". Frontiers in Bioscience. ج. 12: 1079–1093. DOI:10.2741/2128. PMID:17127363.
- ^ Lim YA، Rhein V، Baysang G، Meier F، Poljak A، Raftery MJ، Guilhaus M، Ittner LM، Eckert A، Götz J (أبريل 2010). "Abeta and human amylin share a common toxicity pathway via mitochondrial dysfunction". Proteomics. ج. 10 ع. 8: 1621–1633. DOI:10.1002/pmic.200900651. PMID:20186753.
- ^ Schapira AH (يوليو 2006). "Mitochondrial disease". Lancet. ج. 368 ع. 9529: 70–82. DOI:10.1016/S0140-6736(06)68970-8. PMID:16815381.
- ^ Pieczenik SR، Neustadt J (أغسطس 2007). "Mitochondrial dysfunction and molecular pathways of disease". Experimental and Molecular Pathology. ج. 83 ع. 1: 84–92. DOI:10.1016/j.yexmp.2006.09.008. PMID:17239370.
- ^ Bugger H، Abel ED (نوفمبر 2010). "Mitochondria in the diabetic heart". Cardiovascular Research. ج. 88 ع. 2: 229–240. DOI:10.1093/cvr/cvq239. PMC:2952534. PMID:20639213.
- ^ Richter C، Park JW، Ames BN (سبتمبر 1988). "Normal oxidative damage to mitochondrial and nuclear DNA is extensive". Proceedings of the National Academy of Sciences of the United States of America. ج. 85 ع. 17: 6465–6467. Bibcode:1988PNAS...85.6465R. DOI:10.1073/pnas.85.17.6465. PMC:281993. PMID:3413108.
- ^ Harman D (يوليو 1956). "Aging: a theory based on free radical and radiation chemistry". Journal of Gerontology. ج. 11 ع. 3: 298–300. CiteSeerX:10.1.1.663.3809. DOI:10.1093/geronj/11.3.298. PMID:13332224.
- ^ Harman D (أبريل 1972). "The biologic clock: the mitochondria?". Journal of the American Geriatrics Society. ج. 20 ع. 4: 145–147. DOI:10.1111/j.1532-5415.1972.tb00787.x. PMID:5016631.
- ^ "Mitochondria and Aging". circuitblue.co. مؤرشف من الأصل في 2017-09-29.
- ^ Boffoli D، Scacco SC، Vergari R، Solarino G، Santacroce G، Papa S (أبريل 1994). "Decline with age of the respiratory chain activity in human skeletal muscle". Biochimica et Biophysica Acta. ج. 1226 ع. 1: 73–82. DOI:10.1016/0925-4439(94)90061-2. PMID:8155742.
- ^ de Grey AD (2004). "Mitochondrial mutations in mammalian aging: an over-hasty about-turn?". Rejuvenation Research. ج. 7 ع. 3: 171–174. DOI:10.1089/rej.2004.7.171. PMID:15588517.
- ^ Bender A، Krishnan KJ، Morris CM، Taylor GA، Reeve AK، Perry RH، Jaros E، Hersheson JS، Betts J، Klopstock T، Taylor RW، Turnbull DM (مايو 2006). "High levels of mitochondrial DNA deletions in substantia nigra neurons in aging and Parkinson disease". Nature Genetics. ج. 38 ع. 5: 515–517. DOI:10.1038/ng1769. PMID:16604074.
- ^ Narcisse، Evan (10 أغسطس 2010). "20,000 Per Cell: Why Midi-chlorians Suck". Time. مؤرشف من الأصل في 2019-05-28. اطلع عليه بتاريخ 2016-06-19.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Byrne، Nathan (13 مايو 2016). "So, Mitochondria Aren't Actually The Powerhouse Of The Cell After All". Newsy. مؤرشف من الأصل في 2019-03-17. اطلع عليه بتاريخ 2016-06-19.
{{استشهاد ويب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ أ ب ت ث ج ح خ د ذ ر {{https://arabicedition.nature.com/journal/2016/04/nature16876/%D8%A7%D9%84%D8%AA%D8%B7%D9%88%D9%91%D8%B1:-%D8%A7%D9%84%D9%85%D9%8A%D8%AA%D9%88%D9%83%D9%88%D9%86%D8%AF%D8%B1%D9%8A%D8%A7__-%D8%A7%D9%84%D9%81%D8%B5%D9%84-%D8%A7%D9%84%D8%AB%D8%A7%D9%86%D9%8A#ref3}} "نسخة مؤرشفة". مؤرشف من الأصل في 2020-11-12. اطلع عليه بتاريخ 2021-06-08.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Ernster L، Schatz G (ديسمبر 1981). "Mitochondria: a historical review". The Journal of Cell Biology. ج. 91 ع. 3 Pt 2: 227s–255s. DOI:10.1083/jcb.91.3.227s. PMC:2112799. PMID:7033239.
- ^ Altmann, R. 1890 . Die Elementarorganismen und ihre Beziehungen zu den Zellen. Veit, Leipzig, [1]. نسخة محفوظة 3 نوفمبر 2018 على موقع واي باك مشين.
- ^ Benda C (1898). "Ueber die Spermatogenese der Vertebraten und höherer Evertebraten. II. Theil: Die Histiogenese der Spermien". Arch. Anal. Physiol.: 393–398. مؤرشف من الأصل في 2019-02-24.
- ^ Ernster's citation Meves، Friedrich (مايو 1908). "Die Chondriosomen als Träger erblicher Anlagen. Cytologische Studien am Hühnerembryo". Archiv für Mikroskopische Anatomie. ج. 72 ع. 1: 816–867. DOI:10.1007/BF02982402. مؤرشف من الأصل في 2020-01-09. is wrong, correct citation is Meves، Friedrich (1904). "Über das Vorkommen von Mitochondrien bezw. Chondromiten in Pflanzenzellen". Ber. Dtsch. Bot. Ges. ج. 22: 284–286., cited in Meves' 1908 paper and in Schmidt، Ernst Willy (1913). "Pflanzliche Mitochondrien". Progressus Rei Botanicae. ج. 4: 164–183. اطلع عليه بتاريخ 2012-09-21., with confirmation of Nymphaea alba
- ^ Martin WF، Garg S، Zimorski V (سبتمبر 2015). "Endosymbiotic theories for eukaryote origin". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. ج. 370 ع. 1678: 20140330. DOI:10.1098/rstb.2014.0330. PMC:4571569. PMID:26323761.
| في كومنز صور وملفات عن: ميتوكندريون |


