سرطان البنكرياس: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
ط بوت:عنونة مرجع غير معنون (1.3) |
|||
| سطر 436: | سطر 436: | ||
}}</ref> |
}}</ref> |
||
تستخدم المعلاجة الإشعاعية أحيانًا إذا كان هناك ألم بسبب الامتداد التشريحي مثل انبثاث إلى العظام. تمتص بعض الأورام العصبية الصماوية البنكرياسية ببتيدات أو هرمونات معينة، وقد تستجيب الأورام العصبية الصماوية البنكرياسية للعلاج بالطب النووي باستخدام الببتيدات أو الهرمونات الموسومة بالنظائر المُشعَّة مثل يوبينجوين (اليود 131-MIBG). يمكن أيضًا استخدام الاستئصال الراديوي (RFA) |
تستخدم المعلاجة الإشعاعية أحيانًا إذا كان هناك ألم بسبب الامتداد التشريحي مثل انبثاث إلى العظام. تمتص بعض الأورام العصبية الصماوية البنكرياسية [[ببتيد|ببتيدات]] أو هرمونات معينة، وقد تستجيب الأورام العصبية الصماوية البنكرياسية للعلاج [[طب نووي|بالطب النووي]] باستخدام الببتيدات أو الهرمونات [[قائفة مشعة|الموسومة بالنظائر المُشعَّة]] مثل يوبينجوين (اليود 131-MIBG).<ref name="Gulenchyn">{{cite journal|vauthors=Gulenchyn KY, Yao X, Asa SL, Singh S, Law C|title=Radionuclide therapy in neuroendocrine tumours: a systematic review|journal=Clinical Oncology|volume=24|issue=4|pages=294–308|date=May 2012|pmid=22221516|doi=10.1016/j.clon.2011.12.003}}</ref><ref name="Vinik">{{cite journal|vauthors=Vinik AI|title=Advances in diagnosis and treatment of pancreatic neuroendocrine tumors|journal=Endocrine Practice|volume=20|issue=11|pages=1222–30|date=November 2014|pmid=25297671|doi=10.4158/EP14373.RA}}</ref><ref name="Kwekkeboom">{{cite journal|vauthors=Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP|title=Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors|journal=Seminars in Nuclear Medicine|volume=40|issue=2|pages=78–88|date=March 2010|pmid=20113677|doi=10.1053/j.semnuclmed.2009.10.004}}</ref><ref name="Bodei">{{cite journal|vauthors=Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G|title=Peptide receptor radionuclide therapy for advanced neuroendocrine tumors|journal=Thoracic Surgery Clinics|volume=24|issue=3|pages=333–49|date=August 2014|pmid=25065935|doi=10.1016/j.thorsurg.2014.04.005|hdl-access=free|hdl=11392/2378236}}</ref> يمكن أيضًا استخدام [[استئصال راديوي|الاستئصال الراديوي]] (RFA) و<nowiki/>[[استئصال بالتبريد|الاستئصال بالتبريد]] و<nowiki/>[[انصمام الشريان الكبدي]].<ref name="Castellano">{{cite journal|vauthors=Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E|title=Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors|journal=Cancer Chemotherapy and Pharmacology|volume=75|issue=6|pages=1099–114|date=June 2015|pmid=25480314|doi=10.1007/s00280-014-2642-2|s2cid=39434924}}</ref><ref name="Singh2014">{{cite journal|vauthors=Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, Mukhtar T, Pasieka J, Rayson D, Rowsell C, Sideris L, Wong R, Law C|display-authors=6|title=Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group|journal=Annals of Surgical Oncology|volume=22|issue=8|pages=2685–99|date=August 2015|pmid=25366583|doi=10.1245/s10434-014-4145-0|s2cid=8129133}}</ref> |
||
=== رعاية مُلطِّفة === |
=== رعاية مُلطِّفة === |
||
الرعاية الملطفة هي رعاية طبية تركز على علاج أعراض الأمراض الخطيرة مثل السرطان وتحسين |
الرعاية الملطفة هي رعاية طبية تركز على علاج أعراض الأمراض الخطيرة مثل السرطان وتحسين جودة الحياة،<ref>{{cite web |
||
| url = http://www.cancer.org/treatment/treatmentsandsideeffects/palliativecare/index |
|||
| title = Palliative or Supportive Care |
|||
| date = 2014 |
|||
| publisher = American Cancer Society |
|||
| archive-url = https://web.archive.org/web/20140821054618/http://www.cancer.org/treatment/treatmentsandsideeffects/palliativecare/index |
|||
| archive-date = 21 August 2014 |
|||
| access-date = 20 August 2014 |
|||
| url-status = live |
|||
}}</ref> نظرًا لأن سرطانة البنكرياس الغدية تُشخَّص عادةً بعد تقدمها إلى مرحلة متقدمة فإن الرعاية الملطفة كعلاج للأعراض غالبًا ما تكون العلاج الوحيد الممكن.<ref>{{cite journal|vauthors=Buanes TA|title=Pancreatic cancer-improved care achievable|journal=World Journal of Gastroenterology|volume=20|issue=30|pages=10405–18|date=August 2014|pmid=25132756|pmc=4130847|doi=10.3748/wjg.v20.i30.10405}}</ref> |
|||
لا تركز الرعاية الملطفة على علاج السرطان الأساسي ولكن على علاج الأعراض مثل الألم أو الغثيان، ويمكن أن تساعد في اتخاذ القرار بما في ذلك متى أو إذا كانت رعاية المسنين مفيدة. |
لا تركز الرعاية الملطفة على علاج السرطان الأساسي ولكن على علاج الأعراض مثل الألم أو الغثيان، ويمكن أن تساعد في اتخاذ القرار بما في ذلك متى أو إذا كانت رعاية المسنين مفيدة.<ref>{{cite web |
||
| url = http://www.cancer.org/cancer/pancreaticcancer/detailedguide/pancreatic-cancer-after-no-longer-working |
|||
| title = If treatment for pancreatic cancer stops working |
|||
| date = 11 June 2014 |
|||
| publisher = American Cancer Society |
|||
| archive-url = https://web.archive.org/web/20141022070844/http://www.cancer.org/cancer/pancreaticcancer/detailedguide/pancreatic-cancer-after-no-longer-working |
|||
| archive-date = 22 October 2014 |
|||
| access-date = 20 August 2014 |
|||
}}</ref> يمكن إدارة الألم بأدوية مثل أشباه الأفيونات أو من خلال التدخل الإجرائي عن طريق إحصار عصبي على الضفيرة البطنية (CPB). هذا يغير أو يدمر الأعصاب التي تنقل الألم من البطن وفقًا للتقنية المستخدمة، يعد CPB طريقة آمنة وفعالة لتقليل الألم مما يقلل بشكل عام من الحاجة إلى استخدام مسكنات الألم الأفيونية والتي لها آثار جانبية سلبية كبيرة.<ref name="Wolfgang20136">{{cite journal|vauthors=Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH|title=Recent progress in pancreatic cancer|journal=CA: A Cancer Journal for Clinicians|volume=63|issue=5|pages=318–48|date=September 2013|pmid=23856911|pmc=3769458|doi=10.3322/caac.21190}}</ref><ref>{{cite journal|vauthors=Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA|title=Celiac plexus block for pancreatic cancer pain in adults|journal=The Cochrane Database of Systematic Reviews|issue=3|pages=CD007519|date=March 2011|pmid=21412903|pmc=6464722|doi=10.1002/14651858.CD007519.pub2|veditors=Arcidiacono PG}}</ref> |
|||
الأعراض أو المضاعفات الأخرى التي يمكن علاجها بالجراحة الملطفة هي الانسداد بسبب ورم الأمعاء أو القنوات الصفراوية. بالنسبة للحالة الأخيرة -التي تحدث في أكثر من نصف الحالات- يمكن إدخال أنبوب معدني صغير يسمى الدعامة بواسطة المنظار الداخلي للحفاظ على تصريف القنوات. يمكن أن تساعد الرعاية الملطفة أيضًا في علاج الاكتئاب الذي يأتي غالبًا مع تشخيص سرطان البنكرياس. |
الأعراض أو المضاعفات الأخرى التي يمكن علاجها بالجراحة الملطفة هي الانسداد بسبب ورم الأمعاء أو القنوات الصفراوية. بالنسبة للحالة الأخيرة -التي تحدث في أكثر من نصف الحالات- يمكن إدخال أنبوب معدني صغير يسمى الدعامة بواسطة المنظار الداخلي للحفاظ على تصريف القنوات.<ref name="Cruz4">{{cite journal|vauthors=De La Cruz MS, Young AP, Ruffin MT|title=Diagnosis and management of pancreatic cancer|journal=American Family Physician|volume=89|issue=8|pages=626–32|date=April 2014|pmid=24784121}}</ref> يمكن أن تساعد الرعاية الملطفة أيضًا في علاج الاكتئاب الذي يأتي غالبًا مع تشخيص سرطان البنكرياس.<ref name="Wolfgang20138">{{cite journal|vauthors=Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH|title=Recent progress in pancreatic cancer|journal=CA: A Cancer Journal for Clinicians|volume=63|issue=5|pages=318–48|date=September 2013|pmid=23856911|pmc=3769458|doi=10.3322/caac.21190}}</ref> |
||
غالبًا ما تؤدي كل من الجراحة والأورام المتقدمة غير الصالحة للجراحة إلى اضطرابات في الجهاز الهضمي بسبب نقص إفراز البنكرياس الخارجي، يمكن علاج هذه الاضطرابات عن طريق تناول البنكرياتين الذي يحتوي على إنزيمات البنكرياس المصنعة ويفضل تناوله مع الطعام، تعد صعوبة إفراغ المعدة (تأخر إفراغ المعدة) أمرًا شائعًا ويمكن أن تكون مشكلة خطيرة تتضمن دخول المستشفى، قد يشمل العلاج مجموعة متنوعة من الأساليب بما في ذلك تصريف المعدة عن طريق الشفط الأنفي المعدي وأدوية تسمى مثبطات مضخة البروتون أو مضادات مستقبلات الهستامين 2 وكلاهما يقلل من إنتاج حمض المعدة. يمكن أيضًا استخدام الأدوية مثل ميتوكلوبراميد لتنظيف محتويات المعدة. |
غالبًا ما تؤدي كل من الجراحة والأورام المتقدمة غير الصالحة للجراحة إلى اضطرابات في الجهاز الهضمي بسبب نقص إفراز البنكرياس الخارجي، يمكن علاج هذه الاضطرابات عن طريق تناول البنكرياتين الذي يحتوي على إنزيمات البنكرياس المصنعة ويفضل تناوله مع الطعام،<ref name="Bond-Smith5">{{cite journal|vauthors=Bond-Smith G, Banga N, Hammond TM, Imber CJ|title=Pancreatic adenocarcinoma|journal=BMJ|volume=344|issue=may16 1|pages=e2476|date=May 2012|pmid=22592847|doi=10.1136/bmj.e2476|s2cid=206894869}}</ref> تعد صعوبة إفراغ المعدة (تأخر إفراغ المعدة) أمرًا شائعًا ويمكن أن تكون مشكلة خطيرة تتضمن دخول المستشفى، قد يشمل العلاج مجموعة متنوعة من الأساليب بما في ذلك تصريف المعدة عن طريق الشفط الأنفي المعدي وأدوية تسمى مثبطات مضخة البروتون أو مضادات مستقبلات الهستامين 2 وكلاهما يقلل من إنتاج حمض المعدة. يمكن أيضًا استخدام الأدوية مثل ميتوكلوبراميد لتنظيف محتويات المعدة.<ref name="Bond-Smith6">{{cite journal|vauthors=Bond-Smith G, Banga N, Hammond TM, Imber CJ|title=Pancreatic adenocarcinoma|journal=BMJ|volume=344|issue=may16 1|pages=e2476|date=May 2012|pmid=22592847|doi=10.1136/bmj.e2476|s2cid=206894869}}</ref> |
||
== النتائج == |
== النتائج == |
||
نسخة 09:56، 10 يوليو 2021
| سرطان البنكرياس | |
|---|---|
| Pancreatic Cancer | |
رسم تخطيطي يظهر موقع البنكرياس
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | أمراض البنكرياس، وورم البنكرياس، وسرطان الجهاز الهضمي، ومرض |
| الموقع التشريحي | بنكرياس[1] |
| الأسباب | |
| عوامل الخطر | التدخين والسمنة والسكري بالإضافة إلى حالات وراثية نادرة |
| المظهر السريري | |
| البداية المعتادة | بعد سن الأربعين[2] |
| الأعراض | ألم بطني ويرقان والتهاب البنكرياس الحاد وفقدان الشهية وعلامة تروسو للخباثة.[3] |
| الإدارة | |
| الوقاية | عدم التدخين والحفاظ على وزن صحي والتقليل من تناول اللحوم الحمراء.[4] |
| التشخيص | التصوير الطبي واختبارات الدم والخزعة.[5][6] |
| العلاج | الجراحة والعلاج الإشعاعي والكيميائي والرعاية التلطيفية.[3] |
| أدوية | |
| المآل | توقع الحياة من 4 إلى 6 أشهر[7] ، يكون معدل البقاء على قيد الحياة لمدة خمس سنوات 5% فقط.[8][9] |
| الوبائيات | |
| الوفيات | 411,600 (عام 2015).[10] |
| تعديل مصدري - تعديل | |
سرطان البنكرياس هو سرطان ينشأ عندما تبدأ خلايا البنكرياس –عضو غُدِّي خلف المعدة- في التضاعُف وتخرج عن السيطرة حيثُ تُكَوِّن ورمًا، يكون لتلك الخلايا السرطانية القدرة على غزو أجزاء أخرى من الجسم[11]، ويوجد عدد من أنواع سرطان البنكرياس[8] ولكن النوع الأكثر شيوعًا هو سرطانة البنكرياس الغُدِّية التي تمثِّل حوالي 85% من الحالات، لذلك يُستخدم مُصطلح "سرطان البنكرياس" أحيانًا للإشارة إلى هذا النوع[8]، تبدأ هذه السرطانات الغدية في أجزاء من البنكرياس التي تكوِّن الإنزيمات الهضمية، كما أن أنواع أخرى كثيرة للسرطان –التي غالبًا تُمَثِّل اللاسرطانات- يُمكن أن تنشأ أيضًا من هذه الخلايا[8]، تكون 1 إلى 2% من حالات سرطان البنكرياس أورامًا صمّاوية عصبية تنشأ من الخلايا المفرزة للهرمونات في البنكرياس[8]، وهي على العموم تكون أقل عُدوانيةً من السرطانات الغدية.[8]
تشمل العلامات والأعراض للشكل الأكثر شيوعًا لسرطان البنكرياس: اليرقان وآلام البطن أو الظهر ومتلازمة الهزال وانفتاح لون البراز واغمقاق البول وفقدان الشهية[3]، غالبًا لا توجد أعراض في المراحل الأولى من المرض ولا تظهر الأعراض المميزة لسرطان البنكرياس حتى يصل المرض لمرحلة متقدمة[2][3]، فعند تشخيص المرض يكون غالبًا قد انتشر للأجزاء الأخرى من الجسم.[8][12]
نادرًا ما يحدث سرطان البنكرياس قبل سن الأربعين، وأكثر من نصف حالات سرطانة البنكرياس الغدية تحدث عند هؤلاء الذين تزيد أعمارهم عن 70[2]، تشمل عوامل خطر سرطان البنكرياس: التدخين والسمنة والسكري وحالات جينية معينة نادرة[2]، يرتبط حوالي 25% من الحالات بالتدخين[5]، وحوالي 5-10% بالجينات المتوارثة[2]، يتم تشخيص سرطان البنكرياس غالبًا بواسطة تقنيات تصوير طبية كالفوق صوتية أو التصوير المقطعي المحوسب (CT) واختبارات الدم وفحص عينات الأنسجة (الخزعة)[5][6]، ينقسم المرض إلى مراحل بدايةً من المرحلة المبكرة (المرحلة الأولى) وحتى المرحلة المتأخرة (المرحلة الرابعة)[12]، وقد وُجِد أن التنظير الشعاعي للمرضى عامةً ليس فعالًا.[13][14]
تكون خطورة تطور سرطان البنكرياس ضعيفة بين الذين لا يدخنون والأشخاص الذين يحافظون على وزن صحي ويحدون من استهلاك اللحوم المصنَّعة أو الحمراء[4]، ولكن تقل فرصة تطور المرض لدى المدخنين إذا توقفوا عن التدخين وغالبًا ما يعود المرض لباقي المرضى بعد 20 سنة[8]، يُمكن أن يُعالَج سرطان البنكرياس بالجراحة أو العلاج الإشعاعي أو العلاج الكيميائي أو الرعاية التلطيفية أو مزيج مما سبق[3]، خيارات العلاج تعتمد بشكل جزئي على مرحلة السرطان[3]، وتكون الجراحة هي العلاج الوحيد الذي يمكن أن يعالج سرطانة البنكرياس الغدية[12]، ويمكن أيضًا أن يعمل على تحسين جودة الحياة بدون جهد للعلاج، يكون هناك حاجة أحيانًا لإدارة الألم وأخذ الأدوية لتحسين الهضم[12]، ويُنصح بالرعاية التلطيفية المبكرة حتى لهؤلاء الذين يتلقون علاج يهدف إلى العلاج.[15][16]
في عام 2015 تسببت سرطانات البنكرياس بكل أنواعها في موت 411.600 شخص عالميًا[10]، ويُعد سرطان البنكرياس خامس أكثر الأسباب شيوعًا للموت بفعل السرطان في المملكة المتحدة والثالث شيوعًا في الولايات المتحدة.[17][18]، يحدث المرض في أغلب الأحيان في دول العالم المتقدمة حيث نشأت حوالي 70% من الحالات الجديدة هناك عام 2012[8]، يكون لسرطانة البنكرياس الغدية مآلًا سيئًا، فبعد التشخيص يبقى 25% من الأشخاص على قيد الحياة لمدة عام بينما يبقى 5% فقط لمدة 5 سنوات[8][9]، وبالنسبة للسرطانات التي تُشخص مبكرًا يصل معدل البقاء على قيد الحياة لمدة 5 سنوات إلى 20%[19]، ويكون للسرطانات الصمَّاوية العصبية مآلًا أفضل؛ فبعد 5 سنوات من التشخيص يبقى 65% من الحالات المشخصة على قيد الحياة بالرغم من أن معدلات البقاء تختلف كليًا بناءً على نوع الورم.[8]
الأنواع

يُمكن أن تنقسم الأنواع العديدة من سرطان البنكرياس لمجموعتين عامتين، وتحدث الأغلبية العُظمى من الحالات (حوالي 95%) في جزء من البنكرياس الذي يُنتج الإنزيمات الهاضمة والذي يُعرف بالمكون ذي الإفراز الخارجي، يوجد العديد من الأنواع الفرعية لسرطان البنكرياس ذي الإفراز الخارجي لكن تشخيصهم وعلاجهم به الكثير من الأشياء المشتركة، بينما للأقلية النادرة من السرطانات التي تنشأ في النسيج المفرز للهرمونات (الصماوي) تكون لها صفات سريرية مختلفة وتُسمى أورام عصبية-صمَّاوية بنكرياسية (PanNet)، تحدث كلا المجموعتين بشكل رئيسي –لكن ليس استثنائي- في الأشخاص الذين تزيد أعمارهم عن 40 عام، وتكون أكثر شيوعًا لدى الرجال، لكن بعض الأنواع الفرعية النادرة تحدث بشكل رئيسي في النساء والأطفال.[20][21]
السرطانات خارجية الإفراز
تشيع تسمية المجموعة خارجية الإفراز للسرطانة الغدية البنكرياسية (والتسميات المختلفة قد تُضيف مصطلح "المغيرة" و"القنوية")، وهو يُعد أكثر الأنواع شيوعًا حتى الآن حيث يُمثل حوالي 85% من كل سرطانات البنكرياس[2]، غالبًا تبدأ هذه الأنواع في قنوات البنكرياس وتُعرف بـ السرطانة الغدية القنوية البنكرياسية (PDAC)[22]، ذلك بالرغم من أن ظهارة قنوات البنكرياس التي ينشأ منها السرطان تشكِّل أقل من 10% من البنكرياس عبر حجم الخلية، ذلك لأنه يكون القنوات فقط في البنكرياس[23]، ينشأ هذا السرطان في القنوات التي تحمل الإفرازات (كالإنزيمات والبيكربونات) بعيدًا عن البنكرياس، تحدث 60-70% من السرطانات الغدية في منطقة الرأس من البنكرياس.[2]
يُعد ثاني أكثر أنواع سرطان البنكرياس شيوعًا هو سرطانة الخلايا العنيبية للبنكرياس والتي تنشأ من العُنيبة التي تفرز إنزيمات، يشكِّل هذا النوع 5% من السرطانات خارجية الإفراز في البنكرياس[24]، وكمثل السرطانات البنكرياسية الصماوية الوظيفية التي سيتم توضيحها بالأسفل فقد تسبب سرطانات الخلايا العنيبية زيادة إنتاج جزيئات معينة (كالإنزيمات الهاضمة) والتي قد تسبب أعراض كالطفح الجلدي أو ألم المفاصل.
تمثِّل السرطانة الغدية الكيسية 1% من سرطانات البنكرياس ويكون لها مآل أفضل من الأنواع الأخرى ذات الإفراز الخارجي.[24]
الورم الأرومي البنكرياسي هو شكل نادر يحدث على الأغلب في مرحلة الطفولة ويكون له مآل جيد نسبيًا، تشمل السرطانات ذات الإفراز الخارجي الأخرى:
- السرطانة الغدية الحرشفية
- السرطانة ختمية الخلايا
- الورم الشبيه بالكبد
- السرطانة الغروانية
- السرطانة اللامتمايزة
- السرطانة اللامتمايزة ذات الخلايا العملاقة الشبيهة بناقضة العظم.
يُعد الورم الحليمي الكاذب الصلب ورمًا بدرجة منخفضة نادرة التي تؤثر في أغلب الأحيان على السيدات الأصغر سنًا وبصفة عامة يكون لها مآل جيد جدًا.[2][25]
تكوِّن الأورام الكيسية الموسينية البنكرياسية مجموعة واسعة من أورام البنكرياس التي تحمل درجات مختلفة من الخباثة، يتم اكتشافها بدرجات متزايدة حيث أصبح التصوير المقطعي المحوسب أكثر قوة وشيوعًا، وتستمر المناقشات حول أفضل الطرق لعلاجهم على الرغم من أن الكثير منهم يكون حميدًا.[26]
ورم عصبي صماوي
تُعد أقلية صغيرة من الأورام التي تنشأ في مكان آخر في البنكرياس بشكل رئيسي أورام عصبية-صماوية بنكرياسية (PanNETs)[27]، وأورام الغدد العصبية الصماء (NETs) هي مجموعة متنوعة من الأورام الحميدة أو الخبيثة التي تنشأ من خلايا عصبية-صماوية في الجسم وهي الخلايا المسؤولة عن دمج الجهاز العصبي والغدد الصماء. يمكن أن تبدأ أورام الغدد العصبية الصماء في معظم أعضاء الجسم -بما في ذلك البنكرياس- حيث تعتبر جميع الأنواع الخبيثة المختلفة نادرة، تُصنَّف الأورام العصبية-الصماوية البنكرياسية إلى: "فعَّالة" و"غير فعَّالة" بناءً على درجة إفرازها للهرمونات، فالأنواع الفعَّالة تُفرز هرمونات كالإنسولين والغاسترين والجلوكاجون في الدم، وعند إفرازها لهذه الهرمونات بكميات كبيرة تتسبب في أعراض خطيرة مثل نقص سكر الدم، ولذلك فإن هذا النوع يُكتشف مبكرًا نسبيًا، وتُعد الأورام العصبية-الصماوية البنكرياسية الأكثر شيوعًا هي الأورام الإنسولينية والأورام الغاسترينية –التي تُسَمَّى نسبةً للهرمونات التي تفرزها.
أما الأنواع غير الفعَّالة فهي لا تفرز هرمونات بكميات كافية للتسبب بأعراض سريرية واضحة؛ ولهذا السبب فإن الأورام العصبية-الصماوية البنكرياسية الغير فعالة لا تُشخَّص إلى بعد أن يكون السرطان قد انتشر لأجزاء أخرى في الجسم.[28]
وكما هو الحال مع أورام الغدد العصبية الصماء الأخرى فإن تاريخ المصطلحات وتصنيف الأورام العصبية-الصماوية البنكرياسية معقد[27]، فهي أحيانًا تسمَّى أورام خلايا الجزيرة[29] بالرغم من أنه من المعروف الآن أنها لا تنشأ بالتحديد من جزر لانغرهانس كما كان يُعتقد سابقًا.[28]
العلامات والأعراض

عادة لا يسبب سرطان البنكرياس أية أعراض واضحة في مراحله المبكرة، ولذلك لا يتم عادة تشخيص المرض قبل انتشاره خارج البنكرياس نفسه.[6] ويُعد هذا واحدًا من العوامل الرئيسية في ضآلة معدل البقاء على قيد الحياة للمصابين، ويُستثنى من ذلك الأورام العصبية-الصماوية البنكرياسية حيث يمكن أن يؤدي الإفراط في إنتاج الهرمونات النشطة المختلفة إلى ظهور الأعراض (التي تعتمد على نوع الهرمون).[30]
كما الأخذ في الاعتبار أن المرض نادرًا ما يتم تشخيصه قبل سن الأربعين، وتشمل أعراض السرطانة الغدية البنكرياسية التي تظهر قبل التشخيص ما يلي:
- ألم في الجزء العلوي من البطن أو الظهر، وغالبًا ما ينتشر من حول المعدة إلى الخلف. موضع الألم يمكن أن يشير إلى جزء من البنكرياس حيث يقع الورم، وقد يكون الألم أسوأ في الليل وقد يزيد بمرور الوقت ليصبح خطيرًا ومتواصلًا[31]، ويمكن أن يقل قليلًا عند الانحناء إلى الأمام.[32] في المملكة المتحدة يتم تشخيص حوالي نصف الحالات سرطان البنكرياس الجديدة بعد زيارة إلى قسم الطوارئ في المستشفى لعوارض الألم أو اليرقان، ويصل عدد المرضى الذين يكون عرضهم الأساسي ألم في البطن إلى ثلثى العدد الإجمالى، حيث 46% من الإجمالي يعاني من ألم البطن مع اليرقان، بينما 13% منهم يعانون من اليرقان دون ألم.[33]
- يرقان (لون أصفر خفيف في بياض العين أو اصفرار الجلد، وقد يرافقه بول داكن) مصحوب أو غير مصحوب بألم[34] وهذا ينتج عن انسداد للقناة الصفراوية المشتركة بواسطة سرطان رأس البنكرياس -الذي يمثل 75% من الحالات- لأنها تعبر خلال البنكرياس.[35]
- الهزال سواء بسبب فقدان الشهية أو خسارة الوظيفة خارجية الإفراز مما يتسبب في عسرهضم.[36]
- يمكن أن يضغط الورم الأعضاء المجاورة فيُسبِّب خللًا في العمليات الهضمية مما يجعل من الصعب تفريغ المعدة وقد ينتج عن ذلك العثيان والشعور بالامتلاء، تُسبِّب الدهون غير المهضومة رائحة كريهة وإسهال دهني يصعُب طرده خارج الجسم[36]، ويُعد الإمساك أيضًا عرضًا شائعًا.[37]
- 50% على الأقل من الأشخاص المصابين بالسرطانة الغدية البنكرياسية يكونون مصابين بداء السكري وقت التشخيص[38]، فبينما الإصابة بداء السكري لفترة طويلة تُعد من أسباب الإصابة بسرطان البنكرياس (انظر مخاطر الإصابة) فيمكن أيضًا أن يتسبب سرطان البنكرياس بالإصابة بداء السكري، وفي هذه الحالة يمكن اعتبار ظهور مرض السكري حديثًا علامة مبكرة على المرض[39]، المصابون بالسكري وتزيد أعمارهم عن 50 عامًا معرضون للإصابة بالسرطانة الغدية البنكرياسية خلال ثلاث سنوات 8 مرات نسبة إصابة غير المصابين، وبعد الثلاث سنوات تقل الخطورة النسبية.[36]
أعراض أخرى
- متلازمة تروسو والتي تشمل الجلطات الدموية التي تتشكل تلقائيا في الأوعية الدموية البابية (خثرة الوريد البابي) أو الأوردة العميقة في الأطراف أو الأوردة السطحية في أي مكان على الجسم، قد تُصاحب سرطان البنكرياس في حوالي 10% من الحالات.[40]
- تم الإبلاغ عن الاكتئاب السريري المُرافق لسرطان البنكرياس في 10-20% من الحالات، وهو يمكن أن يكون عائقًا أمام سير العلاج والتحكم الأمثل، أحيانًا يظهر الاكتئاب قبل أن يتم تشخيص السرطان، مما يُشير إلى أنه قد ينشأ من قِبَل بيولوجية المرض.[40]
كما توجد أعراض أخرى شائعة تشمل: التعب والضعف بسهولة، جفاف الحلق ومشاكل في النوم ووجود كتلة بطنية مجسوسة.[41]
أعراض الانتشار
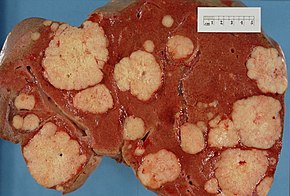
ربما يُسبِّب انتشار سرطان البنكرياس لأعضاء أخرى (الانبثاث) أعراضًا أيضًا، تنتشر سرطانة البنكرياس الغدية أولًا إلى العقد الليمفاوية القريبة، ثم مؤخرًا إلى الكبد أو التجويف الصفاقي أو إلى الأمعاء الغليظة أو الرئتين[40]، ومن غير الشائع أن تنتشر إلى العظام أو الدماغ.[42]
وقد تكون السرطانات في البنكرياس أيضًا سرطانات ثانوية أي تنتشر من أجزاء أخرى من الجسم، وهذا غير شائع ويحدث في 2% فقط من حالات سرطان البنكرياس، وحتى الآن يُعتبر سرطان الكلية هو أكثر السرطانات التي تنتشر إلى البنكرياس شيوعًا، يليه سرطان القولون والمستقيم ثم سرطانات الجلد والثدي والرئة، ويُمكن إجراء عمليات جراحية للبنكرياس في حالات معينة سواء للعلاج أو لتخفيف الأعراض.[43]
عوامل الخطر
تشمل عوامل الخطر لسرطانة البنكرياس الغدية:[36][38][44][45]
- العمر والجنس والإثنية. ويزداد خطر تطور سرطان البنكرياس مع العمر؛ حيث تحدث أغلب الحالات بعد عمر 65[44] بينما حالات الإصابة قبل عمر 40 غير شائعة، ويكون المرض شائعًا بين الرجال أكثر منه بين النساء.[44] وفي الولايات المتحدة تزداد احتمالية حدوثه للأمريكيين الأفارقة بنسبة 1.5 بالرغم من أن نسب حدوثه في أفريقيا ضئيلة.[44]
- يُعد تدخين السجائر أفضل عامل خطر لسرطان البنكرياس يمكن تجنبه، تتضاعف نسبة الإصابة لدى المدخنين على المدى الطويل، حيث يزداد الخطر بزيادة عدد السجائر التي تّدخَّن وزيادة سنوات التدخين، ويقل الخطر ببطء بعد الإقلاع عن التدخين ويستغرق زمنًا قد يصل إلى 20 عامًا حتى تعود نسبة إصابة الشخص كالغير مدخنين.[46]
- السمنة: فالشخص الذي يزيد مؤشر كتلة جسمه عن 35 تزداد نسبة خطر إصابته إلى 1.5.[36]
- تاريخ العائلة: 5-10% من الحالات المصابة بسرطان البنكرياس لديها عامل وراثي حيث لديهم تاريخ عائلي للإصابة بسرطان البنكرياس[38][47]، يزداد خطر الإصابة كثيرًا إذا كان أكثر من قريب من الدرجة الأولى مصابًا بالمرض، ويزداد بشكل أكثر تواضعًا إذا أصيبوا به قبل عمر 50[48]، لم يتم تحديد معظم الجينات المعنيَّة[38][49]، لكن يزيد التهاب البنكرياس الوراثي من خطر الإصابة بسرطان البنكرياس مدى الحياة بنسبة تتراوح من 30 إلى 40% حتى سن 70[40]، يمكن تقديم فحص سرطان البنكرياس المبكر للأفراد المصابين بالتهاب البنكرياس الوراثي على أساس البحث[50]، وقد يختار بعض الناس إزالة البنكرياس جراحيًا لمنع السرطان من التطور في المستقبل.[40]
يرتبط سرطان البنكرياس بالمتلازمات الوراثية النادرة التالية:
متلازمة بوتز-جيغرز (بسبب الطفرات في جين STK11 الكابت للورم، وهي متلازمة نادرة جدًا ولكنها مع ذلك عامل خطر قوي جدًا)
متلازمة وحمة خلل التنسج (أو متلازمة الورم الميلانيني عديد الرحى اللانموذجي العائلي FAMMM-PC) بسبب الطفرات في جين CDKN2A الكابت للورم.
رنح توسع الشعيرات السائد والمتنحي (نتيجة لطفرات وراثية في جين BRCA2 وجين PALB2.
سرطان قولوني مستقيمي لاسليلي وراثي (متلازمة لينش).
داء السلائل الورمي الغدي العائلي.
ترتبط الأورام العصبية-الصماوية البنكرياسية بأورام الغدد الصماء المتعددة النوع 1 (MEN1) ومتلازمات فون هيبل-لينداو.[38][40][48]
- يُضاعف التهاب البنكرياس المزمن خطر الإصابة بسرطان البنكرياس لثلاث مرات -كما هو الحال مع مرضى السكري-، قد يكون ظهور التهاب البنكرياس من أعراض الورم[40]، ويُعد خطر الإصابة بسرطان البنكرياس لدى الأفراد المصابين بالتهاب البنكرياس العائلي مرتفعًا بشكل خاص.[40][49]
- يُعد داء السكري عامل خطر لسرطان البنكرياس، و(كما هو موضح في قسم العلامات والأعراض) قد يكون ظهور مرض السكري علامة مبكرة على المرض، الأشخاص الذين تم تشخيصهم بسكري النوع الثاني لمدة تزيد عن عشر سنوات قد يتزايد لديهم خطر الإصابة بسرطان البنكرياس إلى 1.5 مقارنة بالأشخاص الذين ليس لديهم مرض السكري.[40]
- لم يثبت بوضوح أن أنواع معينة من الطعام (يجب تمييز ذلك عن السمنة) تزيد من خطر الإصابة بسرطان البنكرياس[38][51]، تشمل العوامل الغذائية التي يوجد لها بعض الأدلة أنها تزيد خطر الإصابة بشكل طفيف: اللحوم المصنعة واللحوم الحمراء واللحوم المطبوخة في درجات حرارة عالية جدًا (على سبيل المثال عن طريق القلي أو الشواء أو الشوي).[51][52]
الكحول
يعد الإفراط في شرب الكحول سببًا رئيسيًا لالتهاب البنكرياس المزمن وهذا بدوره يُمهِّد لسرطان البنكرياس، ومع ذلك فقد فشلت أبحاث كبيرة في تأكيد أن استهلاك الكحول يُعد عامل خطر مباشر لسرطان البنكرياس، وبشكل عام فالعلاقة بين التدخين وسرطان البنكرياس ضعيفة باستمرار، ولم تجد غالبية الدراسات أية علاقة مع التدخين، لكن الدليل يكون أقوى للعلاقة بين سرطان البنكرياس والمشروبات الثقيلة بما لا يقل عن ستة مشروبات يوميًا.[40][53]
الفيزيولوجيا المرضية


محتمل التسرطن
يُعتقد أن السرطانات ذات الإفراز الخارجي تنشأ من عدة أنواع من آفات السرطانة اللابدة داخل البنكرياس، لكن هذه الآفات لا تتطور دائمًا لتصبح سرطانًا، ولا يتم علاج جميع الأعداد المتزايدة التي تم اكتشافها كناتج ثانوي للاستخدام المتزايد لمسح الأشعة المقطعية لأسباب أخرى[54]، بصرف النظر عن الأورام الغدية الكيسية المصلية البنكرياسية (SCNs) والتي تكون غالبًا حميدة فإنه يتم التعرف على أربعة أنواع من الآفات السرطانية.
- النوع الأول هو الأورام داخل ظهارة البنكرياس، تُعد هذه الآفات تشوهات مجهرية في البنكرياس وغالبًا ما توجد في تشريح الجثث للأشخاص الذين لم يتم تشخيص إصابتهم بالسرطان، قد تتطور هذه الآفات من الدرجة المنخفضة إلى الدرجة العالية ثم إلى الورم، أكثر من 90% من الحالات في جميع المراحل تحمل جين KRAS خاطئ، بينما تحمل المرحلتين 2 و 3 تلفًا لثلاثة جينات أخرى: CDKN2A (بي16) و بي53 وSMAD4 والتي يتم العثور عليها بشكل متزايد.[55]
- النوع الثاني هو الأورام الحليمية المخاطية داخل الأقنية (IPMNs)، يُعد هذا النوع آفات عينية توجد في حوالي 2% من جميع البالغين، يرتفع هذا المعدل إلى 10% تقريبًا بحلول سن 70، 25% من هذه الآفات قد تتطور إلى سرطان غازي، قد يكون لديهم طفرات في جين KRAS (في حوالي 40-65% من الحالات) وفي وحدة فرعية ألفا Gs GNAS وRNF43 التي تؤثر على مسار إشارة بروتين دبيلو.أن.تي[55]، وحتى إذا تمت إزالته جراحيًا فلا يزال هناك خطر متزايد بشكل كبير للإصابة بسرطان البنكرياس في وقت لاحق.[54]
- النوع الثالث هو الأورم الكيسية المخاطية البنكرياسية (MCNs) وهي تحدث بشكل رئيسي في النساء، وقد تظل حميدة أو تتطور إلى سرطان[56]، وإذا أصبحت هذه الآفات كبيرة أو تسببت في ظهور أعراض أو سمات مُثيرة للشك فإنه يمكن إزالتها بنجاح عن طريق الجراحة.[54]
- النوع الرابع هو الأورام الأنبوبية-الحليمية داخل الأقنية، تم التعرف على هذا النوع من قبل منظمة الصحة العالمية في عام 2010 ويُشكِّل حوالي 1-3% من جميع الأورام البنكرياسية، متوسط العمر عند التشخيص هو 61 سنة (يتراوح بين 35-78 سنة)، تصبح حوالي 50% من هذه الآفات غازية، يعتمد التشخيص على علم الأنسجة حيث يصعب للغاية تمييز هذه الآفات عن الآفات الأخرى على أسس سريرية أو إشعاعية.[57]
سرطان غزوي
مُيِّزَت الأحداث الوراثية الموجودة في سرطانة الأققنية الغدية بشكل جيد واكتمل تسلسل الإكسوم للأنواع الشائعة من الورم، وعُثِر على أربعة جينات مُحوَّرة في غالبية الأورام الغدية: KRAS (في 95% من الحالات)، CDKN2A (أيضًا في 95٪)، TP53 (75%) وSMAD4 (55%)، ويرتبط الأخير بشكل خاص بسوء المآل.[40] تحدث طفرات/حذف SWI/SNF في حوالي 10-15% من السرطانات الغدية[38]، كما أجرِيَت الأبحاث عن التغيرات الجينية في عدة أنواع أخرى من سرطان البنكرياس والآفات السرطانية، وقد وُجِدت تحليلات النسخوميات وتسلسل mRNA للأشكال الشائعة لسرطان البنكرياس أن 75% من الجينات البشرية يُعبَّر عنها في الأورام، حيث يتم التعبير عن حوالي 200 جين بشكل أكثر تحديدًا في سرطان البنكرياس مقارنة بأنواع الأورام الأخرى.[58][59]
أورام عصبية-صماوية بنكرياسية
غالبًا ما تختلف الجينات الموجودة في الأورام العصبية-الصماوية البنكرياسية عن تلك الموجودة في سرطان البنكرياس ذي الإفراز الخارجي[60]، فعلى سبيل المثال: عادة ما تكون طفرة KRAS غائبة، بدلاً من ذلك تؤدي الطفرات الجينية الوراثية MEN1 إلى ظهور متلازمة MEN1 (الورم الصماوي متعدد النوع 1)، حيث تحدث الأورام الأولية في الغدد الصماء أو أكثر، حوالي 40-70% من الأشخاص الذين ولدوا مع طفرة MEN1 تطوَّر لديهم في النهاية شبكة من الأورام العصبية-الصماوية البنكرياسية[61]، تشمل الجينات الأخرى التي تُحوَّر بشكل متكرر DAXX وmTOR وATRX.[28]
تطور سرطان البنكرياس قد ينطوي على المبالغة في التعبير عن الجينات المسرطنة، تثبيط قمع جينات الورم أو تحرير مختلف الإشارات البروتينية.[62] الطفرات التي تؤدى إلى السرطان قد تتسارع بواسطة عوامل وراثية أو بيئية وعوامل الخطر الأخرى التي سبق وصفها بالفعل. الطفرات محددة وتختلف بين وحتى داخل فئات الأنسجة الخلوية التي ستجرى مناقشتها أدناه.
التشخيص



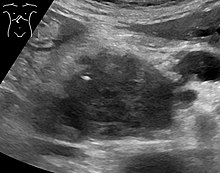
لا تظهر أعراض سرطانة غدية في البنكرياس عادةً في المراحل الأولى من المرض، ولا تختلف بشكل فردي عن المرض[63][64][65]، تختلف الأعراض عند التشخيص وفقًا لموقع السرطان في البنكرياس الذي يقسمه علماء التشريح (من اليسار إلى اليمين في معظم المخططات) إلى الرأس السميك والرقبة والجسم المستدق وينتهي بالذيل.
وبغض النظر عن موقع الورم فإن أكثر الأعراض شيوعًا هو فقدان الوزن غير المبرر والذي قد يكون خطيرًا، أقلية كبيرة (بين 35% و47%) من الأشخاص الذين تم تشخيصهم بالمرض يكون لديهم غثيان أو قيء أو شعور بالضعف، عادةً ما تسبب الأورام الموجودة في رأس البنكرياس اليرقان والألم وفقدان الشهية والبول الداكن والبراز ذي الألوان الفاتحة، بينما عادةً ما تسبب أورام الجسم والذيل ألمًا.[65]
يصاب الناس أحيانًا بمرض السكري النوع الثاني غير النمطي الذي يصعب السيطرة عليه، أو تاريخ من التهاب الأوعية الدموية الحديث لكن غير مبرر الناجم عن جلطات الدم (التهاب الوريد الخثاري) المعروف باسم علامة تروسو، أو معاناة سابقة من التهاب البنكرياس[65]، قد يشتبه الطبيب في الإصابة بسرطان البنكرياس عندما يصاحب ظهور مرض السكري لدى شخص يزيد عمره عن 50 عامًا أعراضًا نمطية مثل فقدان الوزن غير المبرر أو الألم المستمر للبطن أو الظهر أو عسر الهضم أو القيء أو البراز الدهني[64]، وقد يُثير الشك أيضًا اليرقان المصحوب بالمرارة المتورمة بدون ألم (المعروفة باسم علامة كورفوازييه)، كما يمكنه أن يساعد في التمييز بين سرطان البنكرياس وحصوات المرارة.[66]
تُستخدم تقنيات التصوير الطبية كالتصوير المقطعي المحوسب والتنظير بالموجات فوق الصوتية في التشخيص والمساعدة في اتخاذ قرار إذا كان الورم يُمكن إزالته جراحيًا (قابلية استئصاله)[64]، ففي تباين التصوير المقطعي المحوسب يُظهر سرطان البنكرياس زيادة تدريجية في امتصاص مادة التباين الشعاعي، وذلك يختلف عن الإزالة السريعة التي تُرى في حالة البنكرياس الطبيعي، أو البطيئة التي تُرى في حالة التهاب البنكرياس المزمن.[67] يمكن أيضًا استخدام التصوير بالرنين المغنطيسي والتصوير المقطعي بالإصدار البوزيتروني[68] وكذلك يُمكن أن يكون تصوير البنكرياس والأوعية الصفراوية بالرنين المغناطيسي مفيدًا في بعض الحالات[65]، يُعد تخطيط الصدى البطني أقل حساسية وربما يفقد الأورام الصغيرة لكنه يُمكنه التعرُّف على السرطانات التي تنتشر إلى الكبد وتتكون من سائل في التجويف الصفاقي(استسقاء بطني)[64]، لذلك يمكن استخدامه للفحص الأولي السريع والرخيص قبل التقنيات الأخرى.[69]

يمكن استخدام الخزعة -التي غالبًا ما يتم توجيهها بواسطة الموجات فوق الصوتية بالمنظار- عندما يكون هناك شك بشأن التشخيص، ولكن التشخيص النسيجي ليس مطلوبًا عادةً للمضي قدمًا في إزالة الورم عن طريق الجراحة.[64]
يمكن أن تظهر اختبارات وظائف الكبد مجموعة من النتائج التي تشير إلى انسداد القناة الصفراوية (ارتفاع البيليروبين المقترن وناقلة الببتيد غاما غلوتاميل ومستويات الفوسفاتيز القلوي)، كما يُعد المستضد الكربوهيدراتي 19-9 (CA19-9) واصمًا للورم حيث يزداد بصورة متكررة في حالات سرطان البنكرياس، ومع ذلك فإنه ينقصه الحساسية والنوعية كما أن 5% من الأشخاص يفتقرون إلى مستضد لويس (أ) ولا يمكنهم إنتاج CA19-9، نسبة حساسية CA19-9 80% ونوعية 73% للكشف عن السرطانة الغدية البنكرياسية، ويستخدم لمتابعة الحالات المعروفة بدلاً من التشخيص.[64][68]
علم أمراض الأنسجة
تتميز السرطانة الغدية للبنكرياس -الشكل الأكثر شيوعًا لسرطان البنكرياس- بتراكيب غدية متوسطة إلى ضعيفة التمايز تظهر في الفحص المجهري، كما يوجد تنسج ليفي أو تكوين لسدى ليفي كثيف أو أنسجة هيكلية تتكون من أنواع مختلفة من الخلايا بما في ذلك: الأرومة الليفية العضلية والخلايا البلعمية والخلايا اللمفاوية والخلايا البدينة، بالإضافة لمواد مترسبة مثل: النوع الأول من الكولاجين وحمض الهيالورونيك، ذلك يخلق بيئة مجهرية مناسبة للأورام تتميز بنقص الأوعية الدموية ونقص الأكسجين،[70] يُعتقد أن ذلك يمنع العديد من أدوية العلاج الكيميائي من الوصول إلى الورم، وذاك يُعتبر أحد العوامل التي تجعل السرطان صعب العلاج.[70][71]
| نوع السرطان | الوقوع النسبي[72] | موجودات الفحص المجهري[72] | الصورة المجهرية | واسمات الكيمياء النسيجية المناعية[72] | التعديلات الجينية[72] |
|---|---|---|---|---|---|
| السرطانة الغدية القنوية للبنكرياس (PDAC) | 90% | الغدد والتنسُّج الليفي | 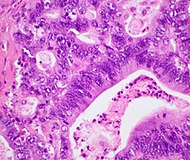 |
||
| سرطانة الخلايا العنيبية للبنكرياس (ACC) | من 1% إلى 2% | مظهر حبيبي | 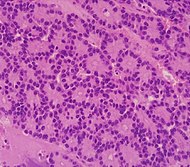
|
||
| سرطانة غدية حرشفية | 1% إلى 4%[73] | خليط بين خلايا شبيهة بالغدد وخلايا ظهارية قشرية |  |
إيجابي لـ:
سلبي لـ: |
|
| ورم خلايا الجزيرة | 5% | Multiple nests of tumor cells | 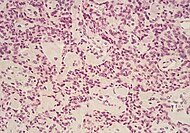 |
| |
| ورم محتمل التسرطن للمقارنة: | |||||
| محتمل التسرطن: ورم حليمي مخاطي داخل قنوي (IPMN) |
3% | الخلايا الظهارية المخاطية.[74] قناة البنكرياس.[75] | 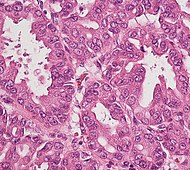
|
||
تصنيف المراحل
السرطانات خارجية الإفراز
عادة ما تُصنَّف مرحلة سرطان البنكرياس بعد الفحص بالتصوير المقطعي المحوسب،[76] نظام تصنيف مراحل السرطان الأكثر استخدامًا لسرطان البنكرياس هو النظام الذي صاغته اللجنة الأمريكية المشتركة للسرطان (AJCC) مع اتحاد السيطرة الدولية على السرطان (UICC). يحدد نظام التدريج AJCC-UICC أربع مراحل رئيسية عامة: تتراوح من المرض المبكر إلى المتقدم، بناءً على نظام تصنيف TNM لحجم الورم وانتشاره إلى العقد الليمفاوية وانبثاثه.[77]
تُقسَّم الأورام أيضًا إلى ثلاث فئات أوسع استنادًا إلى ما إذا كان الاستئصال الجراحي يبدو ممكنًا للمساعدة في تحديد العلاج، وبهذه الطريقة يُحكَم على الأورام بأنها "قابلة للاستئصال" أو "قابلة للاستئصال الحدِّي" أو "غير قابلة للاستئصال".[78] عندما يكون المرض لا يزال في مراحله المبكرة -المرحلة الأولى والثانية من AJCC-UICC- دون أن ينتشر إلى الأوعية الدموية الكبيرة أو الأعضاء البعيدة مثل الكبد أو الرئتين يمكن إجراء الاستئصال الجراحي للورم بشكل طبيعي، وذلك في حالة كون المريض على استعداد للخضوع لهذه العملية الكبيرة ويُعتَقَد أنها مناسبة بشكل كافٍ.[79]
يسمح نظام التدريج AJCC-UICC بالتمييز بين أورام المرحلة الثالثة التي يُحكم عليها بأنها "قابلة للاستئصال الحدِّي" (حيث تكون الجراحة مجدية تقنيًا لأن كل من الشريان البطني والشريان المساريقي العلوي لا يزالان طليقين) وتلك التي "لا يمكن استئصالها" (بسبب مرض متقدم موضعيًا)، من حيث تصنيف TNM الأكثر تفصيلاً، تتوافق هاتان المجموعتان مع T3 و T4 على التوالي.[71]
تنتشر السرطانات الغدية المتقدمة موضعيًا إلى الأعضاء المجاورة، والتي قد تكون أيًا مما يلي (بترتيب تنازلي تقديري حسب تكرار الحدوث): الإثنا عشر أو المعدة أو القولون المستعرض أو الطحال أو الغدة الكظرية أو الكلى، غالبًا ما تنتشر أيضًا إلى الأوعية الدموية والأوعية اللمفاوية والأعصاب المهمة القريبة من البنكرياس مما يجعل الجراحة أكثر صعوبة. المواقع النموذجية لانتشار النقائل -المرحلة الرابعة للمرض- هي: الكبد وجوف الصفاق والرئتين، وكلها تحدث في 50% أو أكثر من الحالات المتقدمة تمامًا.[80]
الأورام العصبية الصماوية البنكرياسية
يُقسِّم تصنيف منظمة الصحة العالمية لعام 2010 لأورام الجهاز الهضمي جميع الأورام العصبية الصماوية البنكرياسية(PanNETs) إلى ثلاث فئات، وذلك بناءً على درجة تمايزها الخلوي من "NET G1" مرورًا إلى ضعيفة التمايز "NET G3"،[81] توصي الشبكة الوطنية الأمريكية الشاملة للسرطان باستخدام نفس نظام التدريج AJCC-UICC المستخدم في السرطانة الغدية،[82]:52 باستخدام هذا المخطط فإن النتائج المرحلية لـ PanNETs تختلف عن تلك الخاصة بسرطانات الإفرازات الخارجية.[83] كما اقتُرِح نظام TNM مختلف لـ PanNETs من قبل الجمعية الأوروبية للأورام العصبية الصماوية.[81]
الوقاية والتحري
بصرف النظر عن الإقلاع عن التدخين توصي جمعية السرطان الأمريكية أيضًا بالحفاظ على وزن صحي وزيادة استهلاك الفواكه والخضروات والحبوب الكاملة مع تقليل استهلاك اللحوم الحمراء والمعالجة، ذلك على الرغم من عدم وجود دليل ثابت على أن هذا سوف يمنع أو يقلل من سرطان البنكرياس على وجه التحديد.[84] خلصت مراجعة بحثية أجريت عام 2014 إلى أن هناك دليلًا على أن استهلاك الليمون والكركومين يقلل من خطر الإصابة بسرطان البنكرياس، بينما قد يكون هناك إفادة من الحبوب الكاملة وحمض الفوليك والسيلينيوم والأسماك غير المقلية.[85]
بشكل عام لا يعتبر فحص المجموعات الكبيرة فعالاً وقد يكون ضارًا اعتبارًا من عام 2019[86] على الرغم من تقييم التقنيات الحديثة وفحص المجموعات المستهدفة بإحكام.[87][88] ومع ذلك فإنه يوصى بالفحص المنتظم بالموجات فوق الصوتية بالمنظار والتصوير بالرنين المغناطيسي/التصوير المقطعي المحوسب للأشخاص المعرضين لخطر كبير من الجينات الموروثة.[6][89][88][90]
إدارة المرض
السرطانات خارجية الإفراز
يُعد التقييم الأساسي الذي يُجرى بعد التشخيص هو ما إذا كان الاستئصال الجراحي للورم ممكنًا (انظر تصنيف المراحل) لأن هذا هو العلاج الوحيد لهذا السرطان. تعتمد إمكانية إجراء الاستئصال الجراحي أم لا على مدى انتشار السرطان، يعد الموقع الدقيق للورم أيضًا عاملاً مهمًا، ويمكن أن يُظهر التصوير المقطعي المحوسب مدى ارتباطه بالأوعية الدموية الرئيسية التي تمر بالقرب من البنكرياس. يجب أيضًا تقييم الصحة العامة للمريض، لكن العمر في حد ذاته لا يمثل عقبة أمام الجراحة.[71]
من المرجح أن يُقدَّم العلاج الكيميائي -وبدرجة أقل- العلاج الإشعاعي لمعظم الناس سواء كانت الجراحة ممكنة أم لا. ينصح المتخصصون بأن يكون علاج سرطان البنكرياس في أيدي فريق متعدد التخصصات يضم متخصصين في العديد من جوانب علم الأورام وبالتالي فمن الأفضل علاجه في المراكز الكبيرة.[70][71]
جراحة


تكون الجراحة بقصد العلاج ممكنة فقط في حوالي خمس (20٪) الحالات الجديدة.[79] وعلى الرغم من أن التصوير المقطعي المحوسب يساعد إلا أنه من الناحية العملية قد يكون من الصعب تحديد ما إذا كان يمكن إزالة الورم بالكامل ("قابليته للاستئصال")، وقد يتضح فقط أثناء الجراحة أنه لا يمكن إزالة الورم بنجاح دون الإضرار بالأنسجة الحيوية الأخرى. تعتمد إمكانية إجراء الاستئصال الجراحي على عدة عوامل بما في ذلك المدى الدقيق للتجاور التشريحي الموضعي للأوعية الدموية الوريدية أو الشريانية أو تورطها[70] بالإضافة إلى الخبرة الجراحية والنظر الدقيق للشفاء المتوقَّع بعد الجراحة،[91][92] لا يعتبر عمر الشخص في حد ذاته سببًا لعدم إجراء عملية جراحية ولكن يجب أن تكون حالة أدائه العامة كافية لإجراء عملية كبرى.[79]
إحدى السمات الخاصة التي تُقيَّم هي الوجود المشجع أو الغياب المحبط لطبقة أو مستوى واضح من الدهون مما يخلق حاجزًا بين الورم والأوعية.[71] تقليديًا يُجرى تقييم لقرب الورم من الأوعية الدموية الوريدية أو الشرايين الرئيسية من ناحية كونه "دعمة"(1) أو "تقمص أو غطاء"(2) أو تورط الأوعية الدموية بالكامل.[93]:22 قد يكون الاستئصال الذي يتضمن أقسامًا مغطاة من الأوعية الدموية ممكنًا في بعض الحالات،[94][95] خاصة إذا كان العلاج الأولي المساعد ممكنًا[96][97][98] باستخدام العلاج الكيميائي[92][93]:36[99] و/أو العلاج الإشعاعي.[93]:29–30
حتى عندما يبدو أن العملية كانت ناجحة غالبًا ما توجد خلايا سرطانية حول حواف الأنسجة المزالة عندما يفحصها أخصائي علم الأمراض مجهريًا (يُجرى ذلك دائمًا)، مما يشير إلى أن السرطان لم يُزال بالكامل.[70] علاوة على ذلك فإنه لا تظهر الخلايا الجذعية السرطانية عادة بالميكروسكوب وإذا كانت موجودة فقد تستمر في التطور والانتشار.[100][101] لذلك يمكن إجراء تنظير البطن الاستكشافي للحصول على فكرة أوضح عن نتيجة العملية الكاملة.[102]
بالنسبة للسرطانات التي تصيب رأس البنكرياس فإن إجراء ويبل هو العلاج الجراحي الأكثر شيوعًا، ويُعد هذا الإجراء عملية كبرى تتضمن استئصال رأس البنكرياس ومنحنى الإثني عشر معًا، وتحويل مسار الطعام من المعدة إلى الصائم ("فغر المعدة والصائم") وربط حلقة من الصائم إلى قناة المرارة لتصريف العصارة الصفراوية ("فغر المرارة - فغر الصائم"). لا يمكن إجراؤها إلا إذا كان من المرجح أن ينجو الشخص من الجراحة الكبيرة وإذا كان السرطان موضعيًا دون غزو التراكيب الموضعية ودون انبثاث، وبالتالي لا يمكن إجراؤها إلا في حالات قليلة. يمكن استئصال سرطانات ذيل البنكرياس باستخدام إجراء يُعرف باسم استئصال البنكرياس البعيد والذي غالبًا ما يستلزم أيضًا استئصال الطحال.[70][71] في الوقت الحاضر يمكن القيام بذلك غالبًا باستخدام جراحة طفيفة التوغل.[70][71]
على الرغم من أن الجراحة العلاجية لم تعد تستتبع ارتفاع معدلات الوفيات كما كان يحدث حتى ثمانينيات القرن الماضي إلا أن نسبة عالية من الناس (حوالي 30-45٪) لا يزالون بحاجة إلى العلاج من مرض ما بعد الجراحة لا يسببه السرطان نفسه، وتُعد المضاعفات الأكثر شيوعًا للجراحة هي صعوبة إفراغ المعدة.[71] يمكن أيضًا استخدام إجراءات جراحية أكثر محدودية لتخفيف الأعراض (انظر الرعاية الملطِّفة)، على سبيل المثال إذا كان السرطان يغزو الإثني عشر أو الأمعاء الغليظة أو يضغط عليهما. في مثل هذه الحالات قد تتغلب جراحة المجازة على العوائق وتحسن نوعية الحياة ولكن لا يُقصد منها أن تكون علاجًا.[79]
علاج كيميائي
بعد الجراحة يمكن تقديم العلاج الكيميائي المساعد باستخدام الجيمسيتابين أو الفلورويوراسيل إذا كان الشخص لائقًا بشكل كافٍ وذلك بعد فترة تعافي من شهر إلى شهرين.[103][104] في الأشخاص غير المناسبين للجراحة العلاجية يمكن استخدام العلاج الكيميائي لإطالة العمر أو تحسين جودته.[71] قبل الجراحة يمكن استخدام المعالجة التمهيدية المساعدة أو العلاج الإشعاعي الكيميائي في الحالات التي تعتبر "قابلة للاستئصال الحدودي" (انظر تصنيف المراحل) من أجل تقليل السرطان إلى مستوى يمكن أن تكون الجراحة فيه مفيدة. في حالات أخرى تظل المعالجة التمهيدية المساعدة مثيرةً للجدل لأنها تؤخر الجراحة.[71][103][105]
ووفِقَ على جيمسيتابين من قبل إدارة الغذاء والدواء الأمريكية (FDA) في عام 1997 بعد أن أبلغت تجربة سريرية عن تحسن في نوعية الحياة وتحسن لمدة 5 أسابيع في متوسط معدل البقاء على قيد الحياة لدى الأشخاص المصابين بسرطان البنكرياس المتقدم.[106] كان هذا أول دواء للعلاج الكيميائي ووفِق عليه من قبل إدارة الغذاء والدواء بشكل أساسي لنقطة نهاية تجربة سريرية غير قابلة للنجاة.[107] كان العلاج الكيميائي باستخدام جيمسيتابين وحده هو المعيار لمدة عقد تقريبًا حيث فشل عدد من التجارب التي اختبرته مع أدوية أخرى في إظهار نتائج أفضل بشكل ملحوظ. ومع ذلك فإنه عُثِر على مزيج من جيمسيتابين مع إرلوتينيب لزيادة البقاء على قيد الحياة بشكل متواضع، ورُخِّصّ إرلوتينيب من قبل إدارة الغذاء والدواء الأمريكية لاستخدامه في سرطان البنكرياس في عام 2005.[108]
عُثِر على نظام العلاج الكيميائي فولفيرينوكس (FOLFIRINOX) باستخدام أربعة عقاقير أكثر فعالية من جيمسيتابين ولكن مع آثار جانبية كبيرة، وبالتالي فهو مناسب فقط للأشخاص الذين يتمتعون بحالة أداء جيدة. وينطبق هذا أيضًا على أبراكسين والذي رُخِّص من قبل إدارة الغذاء والدواء في عام 2013 للاستخدام مع الجيمسيتابين في سرطان البنكرياس.[109] بحلول نهاية عام 2013 كان يُنظر إلى كل من فولفيرينوكس وناب-باكليتاكسيل مع جيمسيتابين كخيارات جيدة لأولئك القادرين على تحمل الآثار الجانبية، وظل جيمسيتابين خيارًا فعالًا للغير قادرين. يُنتظر إجراء محاكمة مباشرة بين الخيارين الجديدين، وتستمر التجارب التي تحقق في الاختلافات الأخرى. ومع ذلك فإن التغييرات التي حدثت في السنوات القليلة الماضية أدت إلى زيادة أوقات البقاء على قيد الحياة لبضعة أشهر فقط.[106] غالبًا ما تُجرى تجارب سريرية للحصول على معالجات مساعدة جديدة.[103]
المعالجة الإشعاعية
كان دور المعالجة الإشعاعية كعلاج مساند بعد الجراحة العلاجية المحتملة مثيرًا للجدل منذ الثمانينيات.[110] توصي الجمعية الأوروبية لطب الأورام بأن المعلاجة الإشعاعية المساندة يجب أن تستخدم فقط للأشخاص المسجلين في التجارب السريرية.[111] ومع ذلك هناك ميل مستمر للأطباء في الولايات المتحدة عن أولئك الموجودين في أوروبا لاستخدام المعلاجة الإشعاعية المساندة. اختبرت العديد من التجارب السريرية مجموعة متنوعة من تركيبات العلاج منذ الثمانينيات لكنها فشلت في تسوية الأمر بشكل قاطع.[110][112]
قد تشكل المعالجة الإشعاعية جزءًا من العلاج لمحاولة تقليص الورم إلى حالة قابلة للاستئصال لكن استخدامه على الأورام غير القابلة للاستئصال يظل مثيرًا للجدل نظرًا لوجود نتائج متضاربة من التجارب السريرية. قُدِّمت النتائج الأولية لتجربة واحدة في عام 2013 وقد "قللت بشكل ملحوظ الحماس" لاستخدامها في الأورام المتقدمة موضعيًا.[113]
الأورام العصبية الصماوية البنكرياسية
قد يشمل علاج الأورام العصبية الصماوية البنكرياسية -بما في ذلك الأنواع الخبيثة الأقل شيوعًا- عددًا من الأساليب.[114][115][116][117] بعض الأورام الصغيرة التي يقل طولها عن 1 سم التي يتم تحديدها بالمصادفة -عند إجراء فحص بالأشعة المقطعية لأغراض أخرى على سبيل المثال- قد يتبعها انتظار يقظ،[118] هذا يعتمد على المخاطر المقدرة للجراحة والتي تتأثر بموقع الورم ووجود مشاكل طبية أخرى.[118] يمكن استئصال الأورام الموجودة داخل البنكرياس فقط (الأورام الموضعية) أو الأورام ذات النقائل المحدودة - في الكبد مثلًا- عن طريق الجراحة. يعتمد نوع الجراحة على مكان الورم ودرجة انتشاره إلى الغدد الليمفاوية.[119]
بالنسبة للأورام الموضعية قد يكون الإجراء الجراحي أقل امتدادًا بكثير من أنواع الجراحة المستخدمة لعلاج سرطانة البنكرياس الغدية الموصوفة بالأعلى، ولكن بخلاف ذلك تكون الإجراءات الجراحية مماثلة لتلك الخاصة بأورام الغدد خارجية الإفراز. يختلف نطاق النتائج المحتملة اختلافًا كبيرًا؛ فبعض الأنواع لديها معدل بقاء مرتفع جدًا بعد الجراحة، بينما البعض الآخر لديه نظرة مستقبلية سيئة. نظرًا لأن كل هذه المجموعة نادرة فإن الإرشادات تؤكد أن العلاج يجب أن يتم في مركز متخصص.[119][120] يمكن النظر في استخدام زرع الكبد في حالات معينة من النقيلة الكبدية.[121]
بالنسبة للأورام العاملة يمكن لفئة مضاهيات السوماتوستاتين -مثل الأوكتريوتيد- أن تقلل من الإنتاج المفرط للهرمونات،[119] كما يمكن أن يبطئ اللانريوتيد نمو الورم.[122][123][124] إذا كان الورم غير قابل للإزالة الجراحية ويسبب أعراضًا فإن العلاج الموجه باستخدام الإيفيروليموس أو السونيتينيب يمكن أن يقلل الأعراض ويبطئ تقدم المرض.[120] لا يعتبر العلاج الكيميائي القياسي السُمِّي للخلايا فعالًا بشكل عام مع الأورام العصبية الصماوية البنكرياسية ولكن يمكن استخدامه عندما تفشل العلاجات الدوائية الأخرى في منع المرض من التقدم[120] أو في الأورام العصبية الصماوية البنكرياسية المتمايزة بشكل سيئ.[125]
تستخدم المعلاجة الإشعاعية أحيانًا إذا كان هناك ألم بسبب الامتداد التشريحي مثل انبثاث إلى العظام. تمتص بعض الأورام العصبية الصماوية البنكرياسية ببتيدات أو هرمونات معينة، وقد تستجيب الأورام العصبية الصماوية البنكرياسية للعلاج بالطب النووي باستخدام الببتيدات أو الهرمونات الموسومة بالنظائر المُشعَّة مثل يوبينجوين (اليود 131-MIBG).[126][127][128][129] يمكن أيضًا استخدام الاستئصال الراديوي (RFA) والاستئصال بالتبريد وانصمام الشريان الكبدي.[130][131]
رعاية مُلطِّفة
الرعاية الملطفة هي رعاية طبية تركز على علاج أعراض الأمراض الخطيرة مثل السرطان وتحسين جودة الحياة،[132] نظرًا لأن سرطانة البنكرياس الغدية تُشخَّص عادةً بعد تقدمها إلى مرحلة متقدمة فإن الرعاية الملطفة كعلاج للأعراض غالبًا ما تكون العلاج الوحيد الممكن.[133]
لا تركز الرعاية الملطفة على علاج السرطان الأساسي ولكن على علاج الأعراض مثل الألم أو الغثيان، ويمكن أن تساعد في اتخاذ القرار بما في ذلك متى أو إذا كانت رعاية المسنين مفيدة.[134] يمكن إدارة الألم بأدوية مثل أشباه الأفيونات أو من خلال التدخل الإجرائي عن طريق إحصار عصبي على الضفيرة البطنية (CPB). هذا يغير أو يدمر الأعصاب التي تنقل الألم من البطن وفقًا للتقنية المستخدمة، يعد CPB طريقة آمنة وفعالة لتقليل الألم مما يقلل بشكل عام من الحاجة إلى استخدام مسكنات الألم الأفيونية والتي لها آثار جانبية سلبية كبيرة.[135][136]
الأعراض أو المضاعفات الأخرى التي يمكن علاجها بالجراحة الملطفة هي الانسداد بسبب ورم الأمعاء أو القنوات الصفراوية. بالنسبة للحالة الأخيرة -التي تحدث في أكثر من نصف الحالات- يمكن إدخال أنبوب معدني صغير يسمى الدعامة بواسطة المنظار الداخلي للحفاظ على تصريف القنوات.[137] يمكن أن تساعد الرعاية الملطفة أيضًا في علاج الاكتئاب الذي يأتي غالبًا مع تشخيص سرطان البنكرياس.[138]
غالبًا ما تؤدي كل من الجراحة والأورام المتقدمة غير الصالحة للجراحة إلى اضطرابات في الجهاز الهضمي بسبب نقص إفراز البنكرياس الخارجي، يمكن علاج هذه الاضطرابات عن طريق تناول البنكرياتين الذي يحتوي على إنزيمات البنكرياس المصنعة ويفضل تناوله مع الطعام،[139] تعد صعوبة إفراغ المعدة (تأخر إفراغ المعدة) أمرًا شائعًا ويمكن أن تكون مشكلة خطيرة تتضمن دخول المستشفى، قد يشمل العلاج مجموعة متنوعة من الأساليب بما في ذلك تصريف المعدة عن طريق الشفط الأنفي المعدي وأدوية تسمى مثبطات مضخة البروتون أو مضادات مستقبلات الهستامين 2 وكلاهما يقلل من إنتاج حمض المعدة. يمكن أيضًا استخدام الأدوية مثل ميتوكلوبراميد لتنظيف محتويات المعدة.[140]
النتائج
| المرحلة السريرية | معدل البقيا لخمس سنوات بالولايات المتحدة للحالات المشخَّصة بين عامي 1992-1998 | |
|---|---|---|
| سرطانات خارجية الإفراز | سرطانات عصبية صماوية عولِجت بالجراحة | |
| IA / I | 14 | 61 |
| IB | 12 | |
| IIA / II | 7 | 52 |
| IIB | 5 | |
| III | 3 | 41 |
| IV | 1 | 16 |
لسرطانة البنكرياس الغدية وغيرها من السرطانات الخارجية الأقل شيوعًا مآلًا سيئًا للغاية؛ حيث تشخَّص عادة في مرحلة متأخرة عندما يكون السرطان بالفعل متقدمًا موضعيًا أو قد انتشر إلى أجزاء أخرى من الجسم.[70] النتائج أفضل بكثير بالنسبة للأورام العصبية الصماوية البنكرياسية: فالعديد منها حميدة وبدون أعراض سريرية تمامًا، وحتى تلك الحالات التي لا يمكن علاجها بالجراحة لها معدل بقاء لمدة خمس سنوات يبلغ 16٪،[141] على الرغم من أن التوقعات تختلف اختلافًا كبيرًا وفقًا للنوع.[142]
بالنسبة لسرطانة البنكرياس الغدية المتقدمة موضعيًا والنقائل -والتي تمثل معًا أكثر من 80% من الحالات- أظهرت العديد من التجارب التي تقارن أنظمة العلاج الكيميائي زيادة في فترات البقاء على قيد الحياة ولكن ليس لأكثر من عام واحد.[70][106] تحسن معدل البقاء على قيد الحياة لمدة خمس سنوات لسرطان البنكرياس في الولايات المتحدة من 2% في الحالات التي شُخِّصت في 1975-1977 و4% في الحالات التي شخِّصت 1987-1989 إلى 6% في الحالات التي شُخِّصت 2003-2009،[143] من بين أقل من 20% من حالات سرطانة البنكرياس الغدية مع تشخيص نمو سرطاني موضعي وصغير (أقل من 2 سم في المرحلة T1) يعيش حوالي 20% من الأمريكيين لمدة خمس سنوات.[144]
يرتبط حوالي 1500 جين بالنتائج في سرطانة البنكرياس الغدية، وتضم هذه الجينات جينات غير مرغوبة حيث يرتبط التعبير العالي لبعض الجينات بالنتيجة السيئة (على سبيل المثال C-Met وMUC-1)، وجينات مرغوبة حيث يرتبط التعبير العالي لبعض الجينات ببقاء أفضل (على سبيل المثال عامل النسخ PELP1).[145][146]
التوزيع

في عام 2015 تسببت سرطانات البنكرياس بجميع أنواعها في وفاة 411600 شخص على مستوى العالم،[147] في عام 2014 كان من المتوقع أن يُشخَّص ما يقدر بنحو 46000 شخص في الولايات المتحدة بسرطان البنكرياس وموت 40.000 شخص بسببه.[70] على الرغم من أنه يمثل 2.5% فقط من الحالات الجديدة، إلا أن سرطان البنكرياس مسؤول عن 6% من وفيات السرطان كل عام.[148] وهو سابع أعلى سبب للوفاة من السرطان في جميع أنحاء العالم،[149] كما أنه خامس أكثر أسباب الوفاة شيوعًا من السرطان في المملكة المتحدة،[150] وثالث الأكثر شيوعًا في الولايات المتحدة.[151]
يحتل سرطان البنكرياس عالميًا المرتبة الـ 11 بين أكثر أنواع السرطانات شيوعًا بين النساء، والمرتبة الـ 12 الأكثر شيوعًا عند الرجال،[149] تحدث غالبية الحالات المسجَّلة في البلدان المتقدمة.[149] يتعرض الأشخاص من الولايات المتحدة لخطر متوسط مدى الحياة يبلغ حوالي 1 من 67 (أو 1.5٪) للإصابة بالمرض،[152] وهو ما يُعتبر أعلى قليلاً من الرقم في المملكة المتحدة.[153] يُعد المرض أكثر شيوعًا بين الرجال منه لدى النساء[70][149] على الرغم من أن الاختلاف في المعدلات قد تقلص خلال العقود الأخيرة مما يعكس -على الأرجح- الزيادات السابقة في تدخين الإناث. في الولايات المتحدة يكون الخطر على الأمريكيين الأفارقة أكبر بنسبة 50% منه بالنسبة للبيض، لكن المعدلات في إفريقيا وشرق آسيا أقل بكثير من تلك الموجودة في أمريكا الشمالية أو أوروبا. لدى كل من: الولايات المتحدة وأوروبا الوسطى والشرقية والأرجنتين والأوروغواي معدلات عالية.[149]
الأورام العصبية الصماوية البنكرياسية
يُعد معدل الحدوث السنوي للأورام العصبية الصماوية البنكرياسية المعترف بها سريريًا منخفضًا (حوالي 5 لكل مليون شخص كل سنة) وتهيمن عليه الأنواع غير العاملة،[154] يُعتقد أن ما بين 45% و 90% من الأورام العصبية الصماوية البنكرياسية من الأنواع غير العاملة.[81][155] كشفت الدراسات التي أجريت على تشريح الجثث عن أورام عصبية صماوية بنكرياسية صغيرة بشكل متكرر، مما يشير إلى أن انتشار الأورام التي تظل خاملة وبدون أعراض قد يكون مرتفعًا نسبيًا.[155] يُعتقد أ تلك الأورام بشكل عام مسؤولة عن حوالي 1 إلى 2% من جميع أورام البنكرياس.[154] لقد تغير تعريفها وتصنيفها بمرور الوقت مما أثر على ما هو معروف عن علم الأوبئة وأهميتها السريرية.[156]
التاريخ
التعرُّف والتشخيص
يُعزى أول اكتشاف لسرطان البنكرياس في القرن الثامن عشر إلى العالم الإيطالي جيوفاني باتيستا مورجاني -الأب التاريخي لعلم الأمراض التشريحي الحديث- الذي ادعى أنه تتبَّع عدة حالات من السرطان في البنكرياس، كان العديد من الأطباء في القرنين الثامن عشر والتاسع عشر متشككين في وجود المرض وذلك لأن علاماته كانت ممائلة لالتهاب البنكرياس. نُشر عدد من تقارير حالات في عشرينيات وثلاثينيات القرن التاسع عشر، وسجل الطبيب الأمريكي جاكوب مينديز دا كوستا تشخيصًا اعتمادًا على علم أمراض الأنسجة، وقد كان من المشكِّكين أيضًا في موثوقية تفسيرات مورغاني. مع بداية القرن العشرين أصبح سرطان رأس البنكرياس تشخيصًا راسخًا.[157]
فيما يتعلق بالاعتراف بـ الأورام العصبية الصماوية البنكرياسية اقتُرِحَت إمكانية الإصابة بسرطان الخلايا الجزيرية في البداية في عام 1888. بُلِّغ عن أول حالة لفرط الإنسولينية بسبب ورم من هذا النوع في عام 1927. يُنسب التعرف على نوع الأورام العصبية الصماوية البنكرياسية غير المفرز للأنسولين بشكل عام إلى الجراحين الأمريكيين: آر إم زولينجر وإي إتش إليسون، اللذين أعطيا اسميهما لمتلازمة زولينجر إيليسون بعد افتراض وجود ورم بنكرياس يفرز الغاسترين في تقرير عن حالتين من القرحة الهضمية الشديدة بشكل غير عادي نُشر عام 1955.[157] في عام 2010 أوصت منظمة الصحة العالمية بأن يشار إلى الأورام العصبية الصماوية البنكرياسية باسم الأورام "العصبية الصماء" بدلاً من الأورام "الصماء".[158]
يُكشَف عن الأورام الصغيرة محتملة التسرطن للعديد من سرطانات البنكرياس بمعدلات متزايدة بشكل كبير عن طريق التصوير الطبي الحديث. أحد أنواع الأورام المخاطية الحليمية داخل القناة وُصِف لأول مرة من قبل الباحثين اليابانيين عام 1982، ولوحظ في عام 2010 أنه: "بالنسبة للعقد التالي لم يُعطى اهتمام كبير لهذا التقرير؛ ومع ذلك فإنه على مدى السنوات الخمسة عشر اللاحقة كان هناك انفجارًا فعليًا في التعرف على هذا الورم.[159]
الجراحة
أجرِيت أول عملية استئصال جزئي للبنكرياس والإثني عشر أُبلِغ عنها من قبل الجراح الإيطالي أليساندرو كوديفيلا في عام 1898، لكن المريض نجا فقط 18 يومًا قبل الخضوع للمضاعفات. تعرضت العمليات المبكرة للخطر جزئيًا بسبب الاعتقاد الخاطئ بأن الناس سيموتون إذا أُزيلت الإثني عشر، وأيضًا سيموتون في البداية إذا توقف تدفق عصارة البنكرياس. في وقت لاحق ساد اعتقاد خاطئ آخر أن القناة البنكرياسية يمكن ببساطة ربطها دون آثار ضارة خطيرة؛ في الواقع غالبًا ما تتسرب العصارة منها لاحقًا. في عامي 1907-1908 بعد بعض العمليات غير الناجحة التي قام بها جراحون آخرون جُرِّبت الإجراءات التجريبية على الجثث من قبل الجراحين الفرنسيين.[160]
في عام 1912 كان الجراح الألماني فالتر كوش أول من أزال أجزاء كبيرة من الإثني عشر والبنكرياس معًا (جملة)، كان هذا في بريسلاو -فروتسواف الآن- في بولندا. في عام 1918 ثبت في العمليات التي أجريت على الكلاب أنه من الممكن البقاء على قيد الحياة حتى بعد الإزالة الكاملة للعفج، ولكن لم يبلَّغ عن مثل هذه النتيجة في الجراحة البشرية حتى عام 1935 عندما نشر الجراح الأمريكي ألين أولدفاذر ويبل نتائج سلسلة من ثلاث عمليات جراحية في مستشفى نيويورك-بريسبيتيريان. أزيلت الاثنا عشر بالكامل لمريض واحد فقط، لكنه نجا لمدة عامين قبل أن يموت من ورم خبيث في الكبد.
كانت العملية الأولى غير مخطط لها، حيث اكتُشِفَ السرطان في غرفة العمليات فقط، أظهر نجاح ويبل الطريق إلى المستقبل، لكن العملية ظلت صعبة وخطيرة حتى العقود الأخيرة. نَشر العديد من التحسينات على إجرائه بما في ذلك أول إزالة كاملة للاثني عشر في عام 1940 لكنه أجرى 37 عملية فقط.[160]
أدى كل من الاكتشاف في أواخر الثلاثينيات من القرن الماضي إلى أن فيتامين ك منع النزيف المصحوب باليرقان، وتطور نقل الدم كعملية يومية إلى تحسين البقاء على قيد الحياة بعد الجراحة،[160] ولكن حوالي 25% من الأشخاص لم يغادروا المستشفى أحياءً حتى أواخر السبعينيات.[161] في سبعينيات القرن الماضي مجموعة من الجراحين الأمريكيين كتبوا يحثون على أن الإجراء خطير للغاية ويجب التخلي عنه، منذ ذلك الحين تحسنت النتائج في المراكز الكبيرة بشكل كبير، وغالبًا ما تكون الوفيات الناتجة عن العملية أقل من 4٪.[162]
في عام 2006 نُشر تقرير عن سلسلة من 1000 عملية استئصال للبنكرياس والإثني عشر متتالية قام بها جراح واحد من مستشفى جونز هوبكنز بين عامي 1969 و2003، وزاد معدل هذه العمليات بشكل مطرد خلال هذه الفترة مع ثلاث عمليات فقط قبل عام 1980، وانخفض متوسط مُدَّة العملية من 8.8 ساعة في السبعينيات إلى 5.5 ساعة في العقد الأول من القرن الحادي والعشرين، وبلغ معدل الوفيات في غضون 30 يومًا أو في المستشفى 1% فقط.[160][161] أظهرت سلسلة أخرى من 2050 عملية جراحية في مستشفى ماساتشوستس العام بين عامي 1941 و 2011 صورة مماثلة من التحسن.[163]
اتجاهات البحث
تتضمن أبحاث المراحل المبكرة حول سرطان البنكرياس دراسات في علم الوراثة والاكتشاف المبكر والعلاج لمراحل السرطان المختلفة والإستراتيجيات الجراحية والعلاجات المستهدفة مثل تثبيط عوامل النمو والعلاجات المناعية واللقاحات.[164][165][166][167][168]
السؤال الرئيسي هو توقيت الأحداث مع تطور المرض وتقدمه -ولا سيما دور مرض السكري-[169][170] وكيف ومتى ينتشر المرض.[171] إن معرفة أن الظهور الجديد لمرض السكري يمكن أن يكون علامة مبكرة للمرض يمكن أن يسهل التشخيص والوقاية في الوقت المناسب إذا أمكن تطوير إستراتيجية فحص عملية.[169][170][172] تهدف تجربة السجل الأوروبي لالتهاب البنكرياس الوراثي وسرطان البنكرياس العائلي (EUROPAC) إلى تحديد ما إذا كان الفحص المنتظم مناسبًا للأشخاص الذين لديهم تاريخ عائلي للمرض.[173]
تقيَّم جراحة ثقب المفتاح (تنظير البطن) بدلاً من إجراء ويبل خاصة فيما يتعلق بوقت الشفاء.[174] ويُعد التخريم الكهربائي اللا عكسي تقنية استئصال جديدة نسبيًا مع إمكانية تقليل مرحلة السرطان وإطالة فترة بقاء الأشخاص المصابين بمرض متقدم موضعيًا خاصةً بالنسبة للأورام القريبة من الأوعية المحيطة بالبنكرياس دون التعرض لخطر الإصابة برضح وعائي.[175][176]
تجري الجهود حاليًا نحو تطوير عقاقير جديدة، بما في ذلك تلك التي تستهدف الآليات الجزيئية لظهور السرطان[177][178] والخلايا الجذعية[101] وتكاثر الخلايا.[178][179] كما ينطوي نهج آخر على استخدام العلاج المناعي مثل فيروسات الورم.[180] تُعد الآليات الخاصة بالجالكتين للبيئة المكروية للورم قيد الدراسة.[181]
الهوامش
- «1»: تُعرّف على أنها الورم الذي لا يلامس أكثر من نصف محيط الأوعية الدموية دون أي دهون لفصله.
- «2»: عندما يحيط الورم بمعظم محيط الوعاء الدموي.
المراجع
- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ أ ب ت ث ج ح خ د Ryan DP، Hong TS، Bardeesy N (سبتمبر 2014). "Pancreatic adenocarcinoma" (PDF). N. Engl. J. Med. ج. 371 ع. 11: 1039–49. DOI:10.1056/NEJMra1404198. PMID:25207767. مؤرشف من الأصل (PDF) في 26 ديسمبر 2014.
- ^ أ ب ت ث ج ح "Pancreatic Cancer Treatment (PDQ®) Patient Version". National Cancer Institute. National Institutes of Health. 17 أبريل 2014. مؤرشف من الأصل في 2014-07-05. اطلع عليه بتاريخ 2014-06-08.
- ^ أ ب "Can pancreatic cancer be prevented?". American Cancer Society. 11 يونيو 2014. مؤرشف من الأصل في 2014-11-13. اطلع عليه بتاريخ 2014-11-13.
- ^ أ ب ت Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–48. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ أ ب ت ث Vincent، A؛ Herman، J؛ Schulick، R؛ Hruban، RH؛ Goggins، M (13 أغسطس 2011). "Pancreatic cancer". Lancet. ج. 378 ع. 9791: 607–20. DOI:10.1016/S0140-6736(10)62307-0. PMID:21620466.
- ^ "pancreatic cancer - General Practice Notebook". www.gpnotebook.co.uk. مؤرشف من الأصل في 2004-11-24. اطلع عليه بتاريخ 2019-09-09.
- ^ أ ب ت ث ج ح خ د ذ ر ز World Cancer Report 2014. World Health Organization. 2014. Chapter 5.7. ISBN:978-92-832-0429-9.
- ^ أ ب "Cancer Facts & Figures 2010" (PDF). American Cancer Society. 2010. مؤرشف من الأصل (PDF) في 14 يناير 2015. اطلع عليه بتاريخ 5 ديسمبر 2014. See p. 4 for incidence estimates, and p. 19 for survival percentages.
- ^ أ ب GBD 2015 Mortality and Causes of Death، Collaborators. (8 أكتوبر 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. ج. 388 ع. 10053: 1459–1544. DOI:10.1016/s0140-6736(16)31012-1. PMC:5388903. PMID:27733281.
{{استشهاد بدورية محكمة}}:|الأول1=باسم عام (مساعدة)صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) - ^ "What is Cancer? Defining Cancer". National Cancer Institute, National Institutes of Health. 7 مارس 2014. مؤرشف من الأصل في 2014-06-25. اطلع عليه بتاريخ 2014-12-05.
- ^ أ ب ت ث Bond-Smith G، Banga N، Hammond TM، Imber CJ (2012). "Pancreatic adenocarcinoma" (PDF). BMJ (Clinical Research Ed.). ج. 344: e2476. DOI:10.1136/bmj.e2476. PMID:22592847. مؤرشف من الأصل (PDF) في 9 يناير 2015.
- ^ Bussom S، Saif MW (5 March 2010). "Methods and rationale for the early detection of pancreatic cancer. Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22–24, 2010". Journal of the Pancreas. ج. 11 ع. 2: 128–30. PMID:20208319. مؤرشف من الأصل في 8 December 2014. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ "Draft Recommendation Statement: Pancreatic Cancer: Screening - US Preventive Services Task Force". www.uspreventiveservicestaskforce.org. مؤرشف من الأصل في 2019-04-19. اطلع عليه بتاريخ 2019-02-11.
- ^ Shahrokni A، Saif MW (10 يوليو 2013). "Metastatic pancreatic cancer: the dilemma of quality vs. quantity of life". Journal of the Pancreas. ج. 14 ع. 4: 391–4. DOI:10.6092/1590-8577/1663. PMID:23846935.
- ^ Bardou M، Le Ray I (ديسمبر 2013). "Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies". Best Practice & Research. Clinical Gastroenterology. ج. 27 ع. 6: 881–92. DOI:10.1016/j.bpg.2013.09.006. PMID:24182608.
- ^ "Cancer facts and figures · Why we exist · Pancreatic Cancer Research Fund". www.pcrf.org.uk. مؤرشف من الأصل في 2019-02-26. اطلع عليه بتاريخ 2019-04-05.
- ^ "Pancreatic Cancer - Cancer Stat Facts". SEER (بالإنجليزية). Archived from the original on 2019-09-09. Retrieved 2019-04-04.
- ^ "Pancreatic Cancer Treatment (PDQ®) Health Professional Version". National Cancer Institute. National Institutes of Health. 21 فبراير 2014. مؤرشف من الأصل في 2014-10-22. اطلع عليه بتاريخ 2014-11-24. "The highest cure rate occurs if the tumor is truly localized to the pancreas; however, this stage of disease accounts for less than 20% of cases. In cases with localized disease and small cancers (<2 cm) with no lymph node metastases and no extension beyond the capsule of the pancreas, complete surgical resection is still associated with a low actuarial five-year survival rate of 18% to 24%."
- ^ Harris، RE (2013). "Epidemiology of pancreatic cancer". Epidemiology of Chronic Disease. Jones & Bartlett. ص. 181–190. ISBN:978-0-7637-8047-0. مؤرشف من الأصل في 24 يونيو 2016.
- ^ Öberg K، Knigge U، Kwekkeboom D، Perren A (أكتوبر 2012). "Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii124–30. DOI:10.1093/annonc/mds295. PMID:22997445. مؤرشف من الأصل في 11 أكتوبر 2013. (Table 5 outlines the proposed TNM staging system for PanNETs.) نسخة محفوظة 11 أكتوبر 2013 على موقع واي باك مشين.
- ^ Handbook of Pancreatic Cancer. New York: Springer. 2009. ص. 288. ISBN:978-0-387-77497-8. مؤرشف من الأصل في 2017-09-10. اطلع عليه بتاريخ 2016-06-12.
- ^ Govindan R (2011). DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology (ط. 9th). Lippincott Williams & Wilkins. Chapter 35: Cancer of the Pancreas: Surgical Management. ISBN:978-1-4511-0545-2. Online edition, with updates to 2014
- ^ أ ب Tobias JS، Hochhauser D (2014). Cancer and its Management (ط. 7th). ص. 297. ISBN:978-1-118-46871-5.
- ^ "Types of Pancreas Tumors". The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. مؤرشف من الأصل في 8 أكتوبر 2014. اطلع عليه بتاريخ 18 نوفمبر 2014.
- ^ Farrell JJ، Fernández-del Castillo C (يونيو 2013). "Pancreatic cystic neoplasms: management and unanswered questions". Gastroenterology. ج. 144 ع. 6: 1303–15. DOI:10.1053/j.gastro.2013.01.073. PMID:23622140.
- ^ أ ب The PanNET denomination is in line with منظمة الصحة العالمية guidelines for the classification of tumors of the digestive system "WHO classification of tumours of the digestive system – NLM Catalog – NCBI". مؤرشف من الأصل في 2017-09-09. اطلع عليه بتاريخ 2017-09-07. published in 2010. Historically, PanNETs have also been referred to by a variety of terms, and are still commonly called "pancreatic endocrine tumors". See: Klimstra، David S.؛ Modlin، Irvin R.؛ Coppola، Domenico؛ Lloyd، Ricardo V.؛ Suster، Saul (أغسطس 2010). "The Pathologic Classification of Neuroendocrine Tumors". Pancreas. ج. 39 ع. 6: 707–712. DOI:10.1097/MPA.0b013e3181ec124e. PMID:20664470.
- ^ أ ب ت Burns WR، Edil BH (مارس 2012). "Neuroendocrine pancreatic tumors: guidelines for management and update". Current Treatment Options in Oncology. ج. 13 ع. 1: 24–34. DOI:10.1007/s11864-011-0172-2. PMID:22198808.
- ^ The نظام فهرسة المواضيع الطبية indexing system refers to "islet cell carcinoma", which is subdivided into gastrinoma, ورم غلوكاغوني، somatostatinoma and فيبوما. See: 2014 MeSH tree at "Pancreatic Neoplasms [C04.588.322.475]" نسخة محفوظة 19 مارس 2016 على موقع واي باك مشين. 16 October 2014
- ^ "Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas". The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. مؤرشف من الأصل في 5 يناير 2015. اطلع عليه بتاريخ 5 يناير 2015.
- ^ Tobias JS، Hochhauser D (2014). Cancer and its Management (ط. 7th). ص. 297. ISBN:978-1-118-46871-5.
- ^ Tobias Jeffrey S., Hochhauser, Daniel, Cancer and its Management, 2010 (6th edn), pp. 276-277, ISBN 1-118-71325-7, 9781118713259
- ^ Bond-Smith، G؛ Banga، N؛ Hammond، TM؛ Imber، CJ (16 مايو 2012). "Pancreatic adenocarcinoma". BMJ (Clinical research ed.). ج. 344: e2476. DOI:10.1136/bmj.e2476. PMID:22592847.
- ^ "What You Need To Know About Cancer of the Pancreas — National Cancer Institute". 16 سبتمبر 2002. ص. 4/5. مؤرشف من الأصل في 2014-10-05. اطلع عليه بتاريخ 2007-12-22.
- ^ De La Cruz MS، Young AP، Ruffin MT (أبريل 2014). "Diagnosis and management of pancreatic cancer". Am Fam Physician. ج. 89 ع. 8: 626–632. PMID:24784121.
- ^ أ ب ت ث ج Bond-Smith، G.؛ Banga، N.؛ Hammond، T. M.؛ Imber، C. J. (16 مايو 2012). "Pancreatic adenocarcinoma". BMJ. ج. 344 ع. may16 1: e2476. DOI:10.1136/bmj.e2476. PMID:22592847.
- ^ Alberts، SR؛ Goldberg، RM (2009). "Chapter 9: Gastrointestinal tract cancers". في Casciato، DA؛ Territo، MC (المحررون). Manual of clinical oncology. Lippincott Williams & Wilkins. ص. 188–236. ISBN:978-0-7817-6884-9. مؤرشف من الأصل في 2020-06-28.
- ^ أ ب ت ث ج ح خ Ryan، David P.؛ Hong، Theodore S.؛ Bardeesy، Nabeel (11 سبتمبر 2014). "Pancreatic Adenocarcinoma". New England Journal of Medicine. ج. 371 ع. 11: 1039–1049. DOI:10.1056/NEJMra1404198. PMID:25207767.
- ^ Pannala R، Basu A، Petersen GM، Chari ST (يناير 2009). "New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer". The Lancet. Oncology. ج. 10 ع. 1: 88–95. DOI:10.1016/S1470-2045(08)70337-1. PMC:2795483. PMID:19111249.
- ^ أ ب ت ث ج ح خ د ذ ر ز Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–348. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ Alberts، SR؛ Goldberg، RM (2009). "Chapter 9: Gastrointestinal tract cancers". في Casciato، DA؛ Territo، MC (المحررون). Manual of clinical oncology. Lippincott Williams & Wilkins. ص. 188–236. ISBN:978-0-7817-6884-9. مؤرشف من الأصل في 2020-06-27.
- ^ "Chapter 15; Pancreas" (PDF). Manual for Staging of Cancer (ط. 2nd). American Joint Committee on Cancer. ص. 95–98. مؤرشف (PDF) من الأصل في 29 نوفمبر 2014. See p. 95 for citation regarding "... lesser degree of involvement of bones and brain and other anatomical sites."
- ^ Sperti C، Moletta L، Patanè G (15 أكتوبر 2014). "Metastatic tumors to the pancreas: The role of surgery". World Journal of Gastrointestinal Oncology. ج. 6 ع. 10: 381–392. DOI:10.4251/wjgo.v6.i10.381. PMC:4197429. PMID:25320654.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب ت ث World Cancer Report. World Health Organization. 2014. Chapter 5.7. ISBN:978-92-832-0429-9.
- ^ "Causes of pancreatic cancer". NHS Choices. National Health Service, England. 7 أكتوبر 2014. مؤرشف من الأصل في 2014-11-06. اطلع عليه بتاريخ 2014-12-05.
- ^ Bosetti C، Lucenteforte E، Silverman DT، Petersen G، Bracci PM، Ji BT، Negri E، Li D، Risch HA، Olson SH، Gallinger S، Miller AB، Bueno-de-Mesquita HB، Talamini R، Polesel J، Ghadirian P، Baghurst PA، Zatonski W، Fontham E، Bamlet WR، Holly EA، Bertuccio P، Gao YT، Hassan M، Yu H، Kurtz RC، Cotterchio M، Su J، Maisonneuve P، Duell EJ، Boffetta P، La Vecchia C (يوليو 2012). "Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium (Panc4)". Annals of Oncology. ج. 23 ع. 7: 1880–1888. DOI:10.1093/annonc/mdr541. PMC:3387822. PMID:22104574.
- ^ Peters، ML؛ Tseng، JF؛ Miksad، RA (31 مارس 2016). "Genetic Testing in Pancreatic Ductal Adenocarcinoma: Implications for Prevention and Treatment". Clinical Therapeutics. ج. 38 ع. 7: 1622–1635. DOI:10.1016/j.clinthera.2016.03.006. PMID:27041411.
- ^ أ ب Vincent A، Herman J، Schulick R، Hruban RH، Goggins M (أغسطس 2011). "Pancreatic cancer" (PDF). Lancet. ج. 378 ع. 9791: 607–620. DOI:10.1016/S0140-6736(10)62307-0. PMC:3062508. PMID:21620466. مؤرشف من الأصل (PDF) في 12 يناير 2015.
- ^ أ ب Reznik R، Hendifar AE، Tuli R (2014). "Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma". Front Physiol. ج. 5: 87. DOI:10.3389/fphys.2014.00087. PMC:3939680. PMID:24624093.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Greenhalf، W.؛ Grocock، C.؛ Harcus، M.؛ Neoptolemos، J. (مايو 2009). "Screening of High-Risk Families for Pancreatic Cancer". Pancreatology. ج. 9 ع. 3: 215–222. DOI:10.1159/000210262. PMID:19349734.
- ^ أ ب "Cancer Facts and Figures 2014". American Cancer Society. مؤرشف (PDF) من الأصل في 2014-12-18. اطلع عليه بتاريخ 2015-01-05., p. 19, "Though evidence is still accumulating, consumption of red or processed meat, or meat cooked at very high temperatures, may slightly increase risk."
- ^ Larsson SC، Wolk A (يناير 2012). "Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies". Br J Cancer. ج. 106 ع. 3: 603–607. DOI:10.1038/bjc.2011.585. PMC:3273353. PMID:22240790.
- ^ Pericleous M، Rossi RE، Mandair D، Whyand T، Caplin ME (يناير 2014). "Nutrition and pancreatic cancer". Anticancer Research. ج. 34 ع. 1: 9–21. PMID:24403441.
- ^ أ ب ت Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–348. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ أ ب Ryan، David P.؛ Hong، Theodore S.؛ Bardeesy، Nabeel (11 سبتمبر 2014). "Pancreatic Adenocarcinoma". New England Journal of Medicine. ج. 371 ع. 11: 1039–1049. DOI:10.1056/NEJMra1404198. PMID:25207767.
- ^ Delpu Y، Hanoun N، Lulka H، Sicard F، Selves J، Buscail L، Torrisani J، Cordelier P (2011). "Genetic and epigenetic alterations in pancreatic carcinogenesis". Curr Genomics. ج. 12 ع. 1: 15–24. DOI:10.2174/138920211794520132. PMC:3129039. PMID:21886451.
- ^ Rooney، Sarah L.؛ Shi، Jiaqi (أكتوبر 2016). "Intraductal Tubulopapillary Neoplasm of the Pancreas: An Update From a Pathologist's Perspective". Archives of Pathology & Laboratory Medicine. ج. 140 ع. 10: 1068–1073. DOI:10.5858/arpa.2016-0207-RA. PMID:27684978.
- ^ "The human pathology proteome in pancreatic cancer – The Human Protein Atlas". www.proteinatlas.org. مؤرشف من الأصل في 2018-10-29. اطلع عليه بتاريخ 2017-09-28.
- ^ Uhlen, Mathias; Zhang, Cheng; Lee, Sunjae; Sjöstedt, Evelina; Fagerberg, Linn; Bidkhori, Gholamreza; Benfeitas, Rui; Arif, Muhammad; Liu, Zhengtao (18 Aug 2017). "A pathology atlas of the human cancer transcriptome". Science (بالإنجليزية). 357 (6352): eaan2507. DOI:10.1126/science.aan2507. ISSN:0036-8075. PMID:28818916.
- ^ Lewis MA، Yao JC (فبراير 2014). "Molecular pathology and genetics of gastrointestinal neuroendocrine tumours". Current Opinion in Endocrinology, Diabetes and Obesity. ج. 21 ع. 1: 22–27. DOI:10.1097/MED.0000000000000033. PMID:24310147.
- ^ Thakker، Rajesh V.؛ Newey، Paul J.؛ Walls، Gerard V.؛ Bilezikian، John؛ Dralle، Henning؛ Ebeling، Peter R.؛ Melmed، Shlomo؛ Sakurai، Akihiro؛ Tonelli، Francesco؛ Brandi، Maria Luisa؛ Endocrine، Society. (1 سبتمبر 2012). "Clinical Practice Guidelines for Multiple Endocrine Neoplasia Type 1 (MEN1)". The Journal of Clinical Endocrinology & Metabolism. ج. 97 ع. 9: 2990–3011. DOI:10.1210/jc.2012-1230. PMID:22723327.
- ^ Sarkar FH, Banerjee S, Li Y (نوفمبر 2007). "Pancreatic cancer: pathogenesis, prevention and treatment". Toxicol. Appl. Pharmacol. ج. 224 ع. 3: 326–36. DOI:10.1016/j.taap.2006.11.007. PMC:2094388. PMID:17174370.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–48. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ أ ب ت ث ج ح Bond-Smith G، Banga N، Hammond TM، Imber CJ (مايو 2012). "Pancreatic adenocarcinoma". BMJ. ج. 344 ع. may16 1: e2476. DOI:10.1136/bmj.e2476. PMID:22592847. S2CID:206894869.
- ^ أ ب ت ث De La Cruz MS، Young AP، Ruffin MT (أبريل 2014). "Diagnosis and management of pancreatic cancer". American Family Physician. ج. 89 ع. 8: 626–32. PMID:24784121.
- ^ Fitzgerald JE، White MJ، Lobo DN (أبريل 2009). "Courvoisier's gallbladder: law or sign??". World Journal of Surgery. ج. 33 ع. 4: 886–91. DOI:10.1007/s00268-008-9908-y. PMID:19190960. S2CID:21799234.
- ^ Piraka C، Scheiman JM (سبتمبر 2011). "New diagnostic imaging modalities for pancreatic disease". Current Opinion in Gastroenterology. ج. 27 ع. 5: 475–80. DOI:10.1097/MOG.0b013e328349e30c. PMID:21743318. S2CID:38963685.
- ^ أ ب Ryan DP، Hong TS، Bardeesy N (سبتمبر 2014). "Pancreatic adenocarcinoma". The New England Journal of Medicine. ج. 371 ع. 11: 1039–49. DOI:10.1056/NEJMra1404198. PMID:25207767.
- ^ Seufferlein T، Bachet JB، Van Cutsem E، Rougier P (أكتوبر 2012). "Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii33-40. DOI:10.1093/annonc/mds224. PMID:22997452. مؤرشف من الأصل في 2020-09-10.
- ^ أ ب ت ث ج ح خ د ذ ر ز Ryan DP، Hong TS، Bardeesy N (سبتمبر 2014). "Pancreatic adenocarcinoma". The New England Journal of Medicine. ج. 371 ع. 11: 1039–49. DOI:10.1056/NEJMra1404198. PMID:25207767.
- ^ أ ب ت ث ج ح خ د ذ ر Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–48. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ أ ب ت ث Unless otherwise specified in boxes, reference is: Pishvaian MJ، Brody JR (مارس 2017). "Therapeutic Implications of Molecular Subtyping for Pancreatic Cancer". Oncology. ج. 31 ع. 3: 159–66, 168. PMID:28299752. مؤرشف من الأصل في 2021-03-09.
- ^ Skafida E، Grammatoglou X، Glava C، Zissis D، Paschalidis N، Katsamagkou E، وآخرون (فبراير 2010). "Adenosquamous carcinoma of the pancreas: a case report". Cases Journal. ج. 3 ع. 1: 41. DOI:10.1186/1757-1626-3-41. PMC:2825199. PMID:20205828.
- ^ Diana Agostini-Vulaj. "Pancreas – Exocrine tumors / carcinomas – Intraductal papillary mucinous neoplasm (IPMN)". Pathology Outlines. مؤرشف من الأصل في 2021-06-07. Topic Completed: 1 July 2018. Revised: 9 March 2020
- ^ Adsay V، Mino-Kenudson M، Furukawa T، Basturk O، Zamboni G، Marchegiani G، وآخرون (يناير 2016). "Pathologic Evaluation and Reporting of Intraductal Papillary Mucinous Neoplasms of the Pancreas and Other Tumoral Intraepithelial Neoplasms of Pancreatobiliary Tract: Recommendations of Verona Consensus Meeting". Annals of Surgery. ج. 263 ع. 1: 162–77. DOI:10.1097/SLA.0000000000001173. PMC:4568174. PMID:25775066.
- ^ De La Cruz MS، Young AP، Ruffin MT (أبريل 2014). "Diagnosis and management of pancreatic cancer". American Family Physician. ج. 89 ع. 8: 626–32. PMID:24784121.
- ^ Cascinu S، Falconi M، Valentini V، Jelic S (مايو 2010). "Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 21 Suppl 5 ع. Supplement 5: v55–58. DOI:10.1093/annonc/mdq165. PMID:20555103.
- ^ أ ب "Staging of pancreatic cancer". American Cancer Society. 11 يونيو 2014. مؤرشف من الأصل في 2020-08-10. اطلع عليه بتاريخ 2014-09-29.
- ^ أ ب ت ث Bond-Smith G، Banga N، Hammond TM، Imber CJ (مايو 2012). "Pancreatic adenocarcinoma". BMJ. ج. 344 ع. may16 1: e2476. DOI:10.1136/bmj.e2476. PMID:22592847. S2CID:206894869.
- ^ Zyromski NJ، Nakeeb A، Lillemoe KD (2010). Silberman H، Silberman AW (المحررون). Principles and practice of surgical oncology : multidisciplinary approach to difficult problems (ط. online). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. Chapter 35. ISBN:978-0-7817-6546-6. مؤرشف من الأصل في 2015-02-06. اطلع عليه بتاريخ 2014-11-03.
{{استشهاد بكتاب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ أ ب ت Öberg K، Knigge U، Kwekkeboom D، Perren A، وآخرون (ESMO Guidelines Working Group) (أكتوبر 2012). "Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7 ع. suppl 7: vii124-30. DOI:10.1093/annonc/mds295. PMID:22997445. (Table 5 outlines the proposed TNM staging system for PanNETs.)
- ^ "Neuroendocrine tumors, NCCN Guidelines Version 1.2015" (PDF). National Comprehensive Cancer Network, Inc. NCCN). 11 نوفمبر 2014. مؤرشف من الأصل (PDF) في 2021-04-24. اطلع عليه بتاريخ 2014-12-25.
- ^ National Cancer Institute. Pancreatic Neuroendocrine Tumors (Islet Cell Tumors) Treatment (PDQ®) Incidence and Mortality "Archived copy". مؤرشف من الأصل في 2015-01-04. اطلع عليه بتاريخ 2014-12-29.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link) - ^ "Diet and activity factors that affect risks for certain cancers: Pancreatic cancer section". جمعية السرطان الأمريكية. 20 أغسطس 2012. مؤرشف من الأصل في 2014-11-04. اطلع عليه بتاريخ 2014-11-04.
- ^ Pericleous M، Rossi RE، Mandair D، Whyand T، Caplin ME (يناير 2014). "Nutrition and pancreatic cancer". Anticancer Research. ج. 34 ع. 1: 9–21. PMID:24403441.
- ^ Owens DK، Davidson KW، Krist AH، Barry MJ، Cabana M، Caughey AB، وآخرون (أغسطس 2019). "Screening for Pancreatic Cancer: US Preventive Services Task Force Reaffirmation Recommendation Statement". JAMA. ج. 322 ع. 5: 438–44. DOI:10.1001/jama.2019.10232. PMID:31386141.
- ^ He XY، Yuan YZ (أغسطس 2014). "Advances in pancreatic cancer research: moving towards early detection". World Journal of Gastroenterology. ج. 20 ع. 32: 11241–48. DOI:10.3748/wjg.v20.i32.11241. PMC:4145762. PMID:25170208.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب Okano K، Suzuki Y (أغسطس 2014). "Strategies for early detection of resectable pancreatic cancer". World Journal of Gastroenterology. ج. 20 ع. 32: 11230–40. DOI:10.3748/wjg.v20.i32.11230. PMC:4145761. PMID:25170207.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Seufferlein T، Bachet JB، Van Cutsem E، Rougier P (أكتوبر 2012). "Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii33–40. DOI:10.1093/annonc/mds224. PMID:22997452.
- ^ Goggins M، Overbeek KA، Brand R، Syngal S، Del Chiaro M، Bartsch DK، وآخرون (يناير 2020). "Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium". Gut. ج. 69 ع. 1: 7–17. DOI:10.1136/gutjnl-2019-319352. PMC:7295005. PMID:31672839.
- ^ Gurusamy KS، Kumar S، Davidson BR، Fusai G (فبراير 2014). "Resection versus other treatments for locally advanced pancreatic cancer". The Cochrane Database of Systematic Reviews. ج. 2 ع. 2: CD010244. DOI:10.1002/14651858.CD010244.pub2. PMID:24578248.
- ^ أ ب Mollberg N، Rahbari NN، Koch M، Hartwig W، Hoeger Y، Büchler MW، Weitz J (ديسمبر 2011). "Arterial resection during pancreatectomy for pancreatic cancer: a systematic review and meta-analysis". Annals of Surgery. ج. 254 ع. 6: 882–93. DOI:10.1097/SLA.0b013e31823ac299. PMID:22064622. S2CID:42685174. مؤرشف من الأصل في 2021-06-28.
- ^ أ ب ت "Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015" (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 4 ديسمبر 2014. مؤرشف من الأصل (PDF) في 2007-02-08. اطلع عليه بتاريخ 2014-12-26.
- ^ Alamo JM، Marín LM، Suarez G، Bernal C، Serrano J، Barrera L، وآخرون (أكتوبر 2014). "Improving outcomes in pancreatic cancer: key points in perioperative management". World Journal of Gastroenterology. ج. 20 ع. 39: 14237–45. DOI:10.3748/wjg.v20.i39.14237. PMC:4202352. PMID:25339810.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Lopez NE، Prendergast C، Lowy AM (أغسطس 2014). "Borderline resectable pancreatic cancer: definitions and management". World Journal of Gastroenterology. ج. 20 ع. 31: 10740–51. DOI:10.3748/wjg.v20.i31.10740. PMC:4138454. PMID:25152577.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Polistina F، Di Natale G، Bonciarelli G، Ambrosino G، Frego M (يوليو 2014). "Neoadjuvant strategies for pancreatic cancer". World Journal of Gastroenterology. ج. 20 ع. 28: 9374–83. DOI:10.3748/wjg.v20.i28.9374 (غير نشط 31 مايو 2021). PMC:4110569. PMID:25071332.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) صيانة الاستشهاد: وصلة دوي غير نشطة منذ 2021 (link) - ^ Gillen S، Schuster T، Meyer Zum Büschenfelde C، Friess H، Kleeff J (أبريل 2010). "Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages". PLOS Medicine. ج. 7 ع. 4: e1000267. DOI:10.1371/journal.pmed.1000267. PMC:2857873. PMID:20422030.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Christians KK، Evans DB (يونيو 2015). "Additional support for neoadjuvant therapy in the management of pancreatic cancer". Annals of Surgical Oncology. ج. 22 ع. 6: 1755–58. DOI:10.1245/s10434-014-4307-0. PMID:25519932.
- ^ Tsvetkova EV، Asmis TR (أغسطس 2014). "Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?". Current Oncology. ج. 21 ع. 4: e650–7. DOI:10.3747/co.21.2006. PMC:4117630. PMID:25089113.
- ^ Zhan HX، Xu JW، Wu D، Zhang TP، Hu SY (فبراير 2015). "Pancreatic cancer stem cells: new insight into a stubborn disease". Cancer Letters. ج. 357 ع. 2: 429–37. DOI:10.1016/j.canlet.2014.12.004. PMID:25499079.
- ^ أ ب Tanase CP، Neagu AI، Necula LG، Mambet C، Enciu AM، Calenic B، وآخرون (أغسطس 2014). "Cancer stem cells: involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics". World Journal of Gastroenterology. ج. 20 ع. 31: 10790–801. DOI:10.3748/wjg.v20.i31.10790. PMC:4138459. PMID:25152582.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Allen VB، Gurusamy KS، Takwoingi Y، Kalia A، Davidson BR (يوليو 2016). "Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer". The Cochrane Database of Systematic Reviews. ج. 7: CD009323. DOI:10.1002/14651858.CD009323.pub3. PMC:6458011. PMID:27383694.
- ^ أ ب ت Vincent A، Herman J، Schulick R، Hruban RH، Goggins M (أغسطس 2011). "Pancreatic cancer" (PDF). Lancet. ج. 378 ع. 9791: 607–20. DOI:10.1016/S0140-6736(10)62307-0. PMC:3062508. PMID:21620466. مؤرشف من الأصل (PDF) في 12 يناير 2015.
- ^ Seufferlein T، Bachet JB، Van Cutsem E، Rougier P (أكتوبر 2012). "Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii33–40. DOI:10.1093/annonc/mds224. PMID:22997452.
- ^ Heinemann V، Haas M، Boeck S (أكتوبر 2013). "Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer". Annals of Oncology. ج. 24 ع. 10: 2484–92. DOI:10.1093/annonc/mdt239. PMID:23852311.
- ^ أ ب ت Thota R، Pauff JM، Berlin JD (يناير 2014). "Treatment of metastatic pancreatic adenocarcinoma: a review". Oncology. ج. 28 ع. 1: 70–74. PMID:24683721.
- ^ Ryan DP (8 يوليو 2014). "Chemotherapy for advanced exocrine pancreatic cancer: Topic 2475, Version 46.0" (subscription required). آب تو ديت. ولترز كلوير. مؤرشف من الأصل في 8 ديسمبر 2014. اطلع عليه بتاريخ 18 نوفمبر 2014.
- ^ "Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride". National Cancer Institute. National Institutes of Health. 3 يوليو 2013. مؤرشف من الأصل في 29 نوفمبر 2014. اطلع عليه بتاريخ 5 ديسمبر 2014.
- ^ Borazanci E، Von Hoff DD (سبتمبر 2014). "Nab-paclitaxel and gemcitabine for the treatment of patients with metastatic pancreatic cancer". Expert Review of Gastroenterology & Hepatology. ج. 8 ع. 7: 739–47. DOI:10.1586/17474124.2014.925799. PMID:24882381. S2CID:31633898.
- ^ أ ب Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–48. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ Seufferlein T، Bachet JB، Van Cutsem E، Rougier P (أكتوبر 2012). "Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii33–40. DOI:10.1093/annonc/mds224. PMID:22997452.
- ^ Vincent A، Herman J، Schulick R، Hruban RH، Goggins M (أغسطس 2011). "Pancreatic cancer" (PDF). Lancet. ج. 378 ع. 9791: 607–20. DOI:10.1016/S0140-6736(10)62307-0. PMC:3062508. PMID:21620466. مؤرشف من الأصل (PDF) في 12 يناير 2015.
- ^ Ryan DP، Hong TS، Bardeesy N (سبتمبر 2014). "Pancreatic adenocarcinoma". The New England Journal of Medicine. ج. 371 ع. 11: 1039–49. DOI:10.1056/NEJMra1404198. PMID:25207767.
- ^ "Neuroendocrine tumors, NCCN Guidelines Version 1.2015" (PDF). National Comprehensive Cancer Network, Inc. NCCN). 11 نوفمبر 2014. مؤرشف من الأصل (PDF) في 2021-06-23. اطلع عليه بتاريخ 2014-12-25.
- ^ Falconi M، Bartsch DK، Eriksson B، Klöppel G، Lopes JM، O'Connor JM، وآخرون (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: well-differentiated pancreatic non-functioning tumors". Neuroendocrinology. ج. 95 ع. 2: 120–34. DOI:10.1159/000335587. PMID:22261872. S2CID:6985904.
- ^ Jensen RT، Cadiot G، Brandi ML، de Herder WW، Kaltsas G، Komminoth P، وآخرون (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes". Neuroendocrinology. ج. 95 ع. 2: 98–119. DOI:10.1159/000335591. PMC:3701449. PMID:22261919.
- ^ Pavel M، Baudin E، Couvelard A، Krenning E، Öberg K، Steinmüller T، وآخرون (2012). "ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary". Neuroendocrinology. ج. 95 ع. 2: 157–76. DOI:10.1159/000335597. PMID:22262022. S2CID:2097604.
- ^ أ ب "Neuroendocrine tumors, NCCN Guidelines Version 1.2015" (PDF). National Comprehensive Cancer Network, Inc. NCCN). 11 نوفمبر 2014. اطلع عليه بتاريخ 2014-12-25.
- ^ أ ب ت Öberg K، Knigge U، Kwekkeboom D، Perren A، وآخرون (ESMO Guidelines Working Group) (أكتوبر 2012). "Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7 ع. suppl 7: vii124-30. DOI:10.1093/annonc/mds295. PMID:22997445. (Table 5 outlines the proposed TNM staging system for PanNETs.)
- ^ أ ب ت Burns WR، Edil BH (مارس 2012). "Neuroendocrine pancreatic tumors: guidelines for management and update". Current Treatment Options in Oncology. ج. 13 ع. 1: 24–34. DOI:10.1007/s11864-011-0172-2. PMID:22198808. S2CID:7329783.
- ^ Rossi RE، Massironi S، Conte D، Peracchi M (يناير 2014). "Therapy for metastatic pancreatic neuroendocrine tumors". Annals of Translational Medicine. ج. 2 ع. 1: 8. DOI:10.3978/j.issn.2305-5839.2013.03.01. PMC:4200651. PMID:25332984.
- ^ Nick Mulcahy (17 ديسمبر 2014). "FDA Approves Lanreotide for Neuroendocrine Tumors". Medscape Medical News. WebMD LLC. مؤرشف من الأصل في 2015-01-18. اطلع عليه بتاريخ 2014-12-25.
- ^ Everolimus Approved for Pancreatic Neuroendocrine Tumors نسخة محفوظة 16 July 2016 على موقع واي باك مشين. The ASCO Post. 15 May 2011, Volume 2, Issue 8
- ^ National Cancer Institute. Cancer Drug Information. FDA Approval for Sunitinib Malate نسخة محفوظة 5 January 2015 على موقع واي باك مشين.. Pancreatic Neuroendocrine Tumors
- ^ Text is available electronically (but may require free registration) See: Benson AB، Myerson RJ، Sasson AR (2010). Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach (ط. 13th). ISBN:978-0-615-41824-7. مؤرشف من الأصل في 2011-05-15.
- ^ Gulenchyn KY، Yao X، Asa SL، Singh S، Law C (مايو 2012). "Radionuclide therapy in neuroendocrine tumours: a systematic review". Clinical Oncology. ج. 24 ع. 4: 294–308. DOI:10.1016/j.clon.2011.12.003. PMID:22221516.
- ^ Vinik AI (نوفمبر 2014). "Advances in diagnosis and treatment of pancreatic neuroendocrine tumors". Endocrine Practice. ج. 20 ع. 11: 1222–30. DOI:10.4158/EP14373.RA. PMID:25297671.
- ^ Kwekkeboom DJ، de Herder WW، van Eijck CH، Kam BL، van Essen M، Teunissen JJ، Krenning EP (مارس 2010). "Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors". Seminars in Nuclear Medicine. ج. 40 ع. 2: 78–88. DOI:10.1053/j.semnuclmed.2009.10.004. PMID:20113677.
- ^ Bodei L، Cremonesi M، Kidd M، Grana CM، Severi S، Modlin IM، Paganelli G (أغسطس 2014). "Peptide receptor radionuclide therapy for advanced neuroendocrine tumors". Thoracic Surgery Clinics. ج. 24 ع. 3: 333–49. DOI:10.1016/j.thorsurg.2014.04.005. hdl:11392/2378236. PMID:25065935.
- ^ Castellano D، Grande E، Valle J، Capdevila J، Reidy-Lagunes D، O'Connor JM، Raymond E (يونيو 2015). "Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors". Cancer Chemotherapy and Pharmacology. ج. 75 ع. 6: 1099–114. DOI:10.1007/s00280-014-2642-2. PMID:25480314. S2CID:39434924.
- ^ Singh S، Dey C، Kennecke H، Kocha W، Maroun J، Metrakos P، وآخرون (أغسطس 2015). "Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group". Annals of Surgical Oncology. ج. 22 ع. 8: 2685–99. DOI:10.1245/s10434-014-4145-0. PMID:25366583. S2CID:8129133.
- ^ "Palliative or Supportive Care". American Cancer Society. 2014. مؤرشف من الأصل في 2014-08-21. اطلع عليه بتاريخ 2014-08-20.
- ^ Buanes TA (أغسطس 2014). "Pancreatic cancer-improved care achievable". World Journal of Gastroenterology. ج. 20 ع. 30: 10405–18. DOI:10.3748/wjg.v20.i30.10405. PMC:4130847. PMID:25132756.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "If treatment for pancreatic cancer stops working". American Cancer Society. 11 يونيو 2014. مؤرشف من الأصل في 2014-10-22. اطلع عليه بتاريخ 2014-08-20.
- ^ Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–48. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ Arcidiacono PG، Calori G، Carrara S، McNicol ED، Testoni PA (مارس 2011). Arcidiacono PG (المحرر). "Celiac plexus block for pancreatic cancer pain in adults". The Cochrane Database of Systematic Reviews ع. 3: CD007519. DOI:10.1002/14651858.CD007519.pub2. PMC:6464722. PMID:21412903.
- ^ De La Cruz MS، Young AP، Ruffin MT (أبريل 2014). "Diagnosis and management of pancreatic cancer". American Family Physician. ج. 89 ع. 8: 626–32. PMID:24784121.
- ^ Wolfgang CL، Herman JM، Laheru DA، Klein AP، Erdek MA، Fishman EK، Hruban RH (سبتمبر 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. ج. 63 ع. 5: 318–48. DOI:10.3322/caac.21190. PMC:3769458. PMID:23856911.
- ^ Bond-Smith G، Banga N، Hammond TM، Imber CJ (مايو 2012). "Pancreatic adenocarcinoma". BMJ. ج. 344 ع. may16 1: e2476. DOI:10.1136/bmj.e2476. PMID:22592847. S2CID:206894869.
- ^ Bond-Smith G، Banga N، Hammond TM، Imber CJ (مايو 2012). "Pancreatic adenocarcinoma". BMJ. ج. 344 ع. may16 1: e2476. DOI:10.1136/bmj.e2476. PMID:22592847. S2CID:206894869.
- ^ "Staging of pancreatic cancer". American Cancer Society. 11 يونيو 2014. مؤرشف من الأصل في 2021-06-14. اطلع عليه بتاريخ 2014-09-29.
- ^ "Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas". The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. مؤرشف من الأصل في 5 يناير 2015. اطلع عليه بتاريخ 5 يناير 2015.
- ^ "Cancer Facts and Figures 2014" (PDF). American Cancer Society. مؤرشف (PDF) من الأصل في 2014-12-18. اطلع عليه بتاريخ 2015-01-05., Table, p. 18, rates adjusted for normal life expectancy
- ^ "Pancreatic Cancer Treatment (PDQ®) Health Professional Version". National Cancer Institute. National Institutes of Health. 21 فبراير 2014. مؤرشف من الأصل في 2014-10-22. اطلع عليه بتاريخ 2014-11-24. "The highest cure rate occurs if the tumor is truly localized to the pancreas; however, this stage of disease accounts for less than 20% of cases. In cases with localized disease and small cancers (<2 cm) with no lymph-node metastases and no extension beyond the capsule of the pancreas, complete surgical resection is still associated with a low actuarial five-year survival rate of 18% to 24%."
- ^ "The human pathology proteome in pancreatic cancer – The Human Protein Atlas". www.proteinatlas.org. مؤرشف من الأصل في 2020-07-03. اطلع عليه بتاريخ 2017-09-28.
- ^ Uhlen M، Zhang C، Lee S، Sjöstedt E، Fagerberg L، Bidkhori G، وآخرون (أغسطس 2017). "A pathology atlas of the human cancer transcriptome". Science. ج. 357 ع. 6352: eaan2507. DOI:10.1126/science.aan2507. PMID:28818916.
- ^ Wang H، Naghavi M، Allen C، Barber RM، Bhutta ZA، Carter A، وآخرون (GBD 2015 Mortality and Causes of Death Collaborators) (أكتوبر 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. ج. 388 ع. 10053: 1459–1544. DOI:10.1016/s0140-6736(16)31012-1. PMC:5388903. PMID:27733281.
- ^ Jemal A، Siegel R، Ward E، Murray T، Xu J، Thun MJ (2007). "Cancer statistics, 2007". Ca. ج. 57 ع. 1: 43–66. DOI:10.3322/canjclin.57.1.43. PMID:17237035. S2CID:22305510. مؤرشف من الأصل في 2021-02-04.
- ^ أ ب ت ث ج World Cancer Report. World Health Organization. 2014. Chapter 5.7. ISBN:978-92-832-0429-9.
- ^ "Cancer facts and figures – Why we exist – Pancreatic Cancer Research Fund". www.pcrf.org.uk. مؤرشف من الأصل في 2020-12-05. اطلع عليه بتاريخ 2019-04-05.
- ^ "Pancreatic Cancer – Cancer Stat Facts". SEER (بالإنجليزية). Archived from the original on 2021-05-24. Retrieved 2019-04-04.
- ^ "What are the key statistics about pancreatic cancer?". American Cancer Society. 11 يونيو 2014. مؤرشف من الأصل في 2014-11-11. اطلع عليه بتاريخ 2014-11-11.
- ^ "Pancreatic cancer statistics". Cancer Research UK. مؤرشف من الأصل في 2014-12-18. اطلع عليه بتاريخ 2014-12-18.; "In 2010, in the UK, the lifetime risk of developing pancreatic cancer is 1 in 73 for men and 1 in 74 for women", noting "The lifetime risk ... has been calculated ... using the 'Current Probability' method; this is a different method used from most other cancer sites since the possibility of having more than one diagnosis of pancreatic cancer over the course of their lifetime is very low"
- ^ أ ب "Types of Pancreas Tumors". The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. مؤرشف من الأصل في 8 أكتوبر 2014. اطلع عليه بتاريخ 18 نوفمبر 2014.
- ^ أ ب Burns WR، Edil BH (مارس 2012). "Neuroendocrine pancreatic tumors: guidelines for management and update". Current Treatment Options in Oncology. ج. 13 ع. 1: 24–34. DOI:10.1007/s11864-011-0172-2. PMID:22198808. S2CID:7329783.
- ^ Lewis MA، Yao JC (فبراير 2014). "Molecular pathology and genetics of gastrointestinal neuroendocrine tumours". Current Opinion in Endocrinology, Diabetes and Obesity. ج. 21 ع. 1: 22–27. DOI:10.1097/MED.0000000000000033. PMID:24310147. S2CID:31094880.
- ^ أ ب Busnardo AC، DiDio LJ، Tidrick RT، Thomford NR (نوفمبر 1983). "History of the pancreas". American Journal of Surgery. ج. 146 ع. 5: 539–50. DOI:10.1016/0002-9610(83)90286-6. PMID:6356946.
- ^ The PanNET denomination is in line with منظمة الصحة العالمية guidelines for the classification of tumors of the digestive system "WHO classification of tumours of the digestive system – NLM Catalog – NCBI". مؤرشف من الأصل في 2017-09-09. اطلع عليه بتاريخ 2017-09-07. published in 2010. Historically, PanNETs have also been referred to by a variety of terms, and are still commonly called "pancreatic endocrine tumors". See: Klimstra DS، Modlin IR، Coppola D، Lloyd RV، Suster S (أغسطس 2010). "The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems". Pancreas. ج. 39 ع. 6: 707–12. DOI:10.1097/MPA.0b013e3181ec124e. PMID:20664470. S2CID:3735444.
- ^ Zyromski NJ، Nakeeb A، Lillemoe KD (2010). Silberman H، Silberman AW (المحررون). Principles and practice of surgical oncology : multidisciplinary approach to difficult problems (ط. online). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. Chapter 35. ISBN:978-0-7817-6546-6. مؤرشف من الأصل في 2015-02-06. اطلع عليه بتاريخ 2014-11-03.
{{استشهاد بكتاب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ أ ب ت ث Are C، Dhir M، Ravipati L (يونيو 2011). "History of pancreaticoduodenectomy: early misconceptions, initial milestones and the pioneers". HPB. ج. 13 ع. 6: 377–84. DOI:10.1111/j.1477-2574.2011.00305.x. PMC:3103093. PMID:21609369.
- ^ أ ب Cameron JL، Riall TS، Coleman J، Belcher KA (يوليو 2006). "One thousand consecutive pancreaticoduodenectomies". Annals of Surgery. ج. 244 ع. 1: 10–5. DOI:10.1097/01.sla.0000217673.04165.ea. PMC:1570590. PMID:16794383.
- ^ Govindan R (2011). DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology (ط. 9th). Lippincott Williams & Wilkins. Chapter 35: Cancer of the Pancreas: Surgical Management. ISBN:978-1-4511-0545-2. Online edition, with updates to 2014
- ^ Fernández-del Castillo C، Morales-Oyarvide V، McGrath D، Wargo JA، Ferrone CR، Thayer SP، وآخرون (سبتمبر 2012). "Evolution of the Whipple procedure at the Massachusetts General Hospital". Surgery. ج. 152 ع. 3 Suppl 1: S56-63. DOI:10.1016/j.surg.2012.05.022. PMC:3806095. PMID:22770961.
- ^ Reznik R، Hendifar AE، Tuli R (2014). "Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma". Frontiers in Physiology. ج. 5: 87. DOI:10.3389/fphys.2014.00087. PMC:3939680. PMID:24624093.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "What's new in pancreatic cancer research and treatment?". American Cancer Society. 2019. مؤرشف من الأصل في 2021-06-14. اطلع عليه بتاريخ 2019-05-02.
- ^ "Pancreatic cancer research". Cancer Research UK. مؤرشف من الأصل في 2014-02-18. اطلع عليه بتاريخ 2014-07-17.
- ^ "Australian Pancreatic Genome Initiative". Garvan Institute. مؤرشف من الأصل في 2014-07-26. اطلع عليه بتاريخ 2014-07-17.
- ^ Biankin AV، Waddell N، Kassahn KS، Gingras MC، Muthuswamy LB، Johns AL، وآخرون (نوفمبر 2012). "Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes". Nature. ج. 491 ع. 7424: 399–405. Bibcode:2012Natur.491..399.. DOI:10.1038/nature11547. PMC:3530898. PMID:23103869.
- ^ أ ب "What's new in pancreatic cancer research and treatment?". American Cancer Society. 2019. مؤرشف من الأصل في 2021-06-14. اطلع عليه بتاريخ 2019-05-02.
- ^ أ ب Pannala R، Basu A، Petersen GM، Chari ST (يناير 2009). "New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer". The Lancet. Oncology. ج. 10 ع. 1: 88–95. DOI:10.1016/S1470-2045(08)70337-1. PMC:2795483. PMID:19111249.
- ^ Graham JS، Jamieson NB، Rulach R، Grimmond SM، Chang DK، Biankin AV (سبتمبر 2015). "Pancreatic cancer genomics: where can the science take us?". Clinical Genetics. ج. 88 ع. 3: 213–9. DOI:10.1111/cge.12536. PMID:25388820. S2CID:26414866.
- ^ Bruenderman EH، Martin RC (مارس 2015). "High-risk population in sporadic pancreatic adenocarcinoma: guidelines for screening". The Journal of Surgical Research. ج. 194 ع. 1: 212–9. DOI:10.1016/j.jss.2014.06.046. PMC:4559279. PMID:25479908.
- ^ "About EUROPAC". European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC). University of Liverpool. مؤرشف من الأصل في 2014-07-26. اطلع عليه بتاريخ 2014-07-17.
- ^ Subar D، Gobardhan PD، Gayet B (فبراير 2014). "Laparoscopic pancreatic surgery: An overview of the literature and experiences of a single center". Best Practice & Research. Clinical Gastroenterology. ج. 28 ع. 1: 123–32. DOI:10.1016/j.bpg.2013.11.011. PMID:24485260.
- ^ Weiss MJ، Wolfgang CL (2013). "Irreversible electroporation: a novel pancreatic cancer therapy". Current Problems in Cancer. ج. 37 ع. 5: 262–5. DOI:10.1016/j.currproblcancer.2013.10.002. PMID:24331180.
- ^ Moir J، White SA، French JJ، Littler P، Manas DM (ديسمبر 2014). "Systematic review of irreversible electroporation in the treatment of advanced pancreatic cancer". European Journal of Surgical Oncology. ج. 40 ع. 12: 1598–604. DOI:10.1016/j.ejso.2014.08.480. PMID:25307210.
- ^ Kleger A، Perkhofer L، Seufferlein T (يوليو 2014). "Smarter drugs emerging in pancreatic cancer therapy". Annals of Oncology. ج. 25 ع. 7: 1260–1270. DOI:10.1093/annonc/mdu013. PMID:24631947.
- ^ أ ب Tang SC، Chen YC (أغسطس 2014). "Novel therapeutic targets for pancreatic cancer". World Journal of Gastroenterology. ج. 20 ع. 31: 10825–44. DOI:10.3748/wjg.v20.i31.10825. PMC:4138462. PMID:25152585.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Rossi ML، Rehman AA، Gondi CS (أغسطس 2014). "Therapeutic options for the management of pancreatic cancer". World Journal of Gastroenterology. ج. 20 ع. 32: 11142–59. DOI:10.3748/wjg.v20.i32.11142. PMC:4145755. PMID:25170201.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Ady JW، Heffner J، Klein E، Fong Y (2014). "Oncolytic viral therapy for pancreatic cancer: current research and future directions". Oncolytic Virotherapy. ج. 3: 35–46. DOI:10.2147/OV.S53858. PMC:4918362. PMID:27512661.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Ren B، Cui M، Yang G، Wang H، Feng M، You L، Zhao Y (يوليو 2018). "Tumor microenvironment participates in metastasis of pancreatic cancer". Molecular Cancer. ج. 17 ع. 1: 108. DOI:10.1186/s12943-018-0858-1. PMC:6065152. PMID:30060755.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link)
وصلات خارجية
- Pancreatic Cancer Action Network (PanCAN)
- The Pancreatic Society of Great Britain and Ireland
- The Johns Hopkins Pancreatic Cancer Web Site
- Rare Pancreatic & Neuroendocrine Cancer Support
- Pancreatic Cancer UK
- Confronting Pancreatic Cancer (Pancreatica.org)
- Cancer of the Pancreas (Cancer Supportive Care Program)
- American Cancer Society: Detailed Guide on Pancreatic Cancer
- The National Familial Pancreas Tumor Registry
- Pancreatic Cancer Collaborative Registry (PCCR)
- The Lustgarten Foundation For Pancreatic Cancer Research
| سرطان البنكرياس في المشاريع الشقيقة: | |
| |






