فسفور
| |||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
يوجد بأشكال عدّة حسب البنية، مثل الفوسفور الأبيض والأحمر والبنفسجي والأسود
| |||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||
| الاسم، العدد، الرمز | فسفور، 15، P | ||||||||||||||||||||||||
| تصنيف العنصر | لا فلز | ||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 15، 3، p | ||||||||||||||||||||||||
| الكتلة الذرية | 30.973762 غ·مول−1 | ||||||||||||||||||||||||
| توزيع إلكتروني | Ne]; 3s2 3p3] | ||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 5 (صورة) | ||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | (أبيض) 1.823، (أحمر) ≈ 2.2 – 2.34، (بنفسجي) 2.36، (أسود) 2.69 غ·سم−3 | ||||||||||||||||||||||||
| نقطة الانصهار | (أبيض) 44.2 °س، (أسود) 610 °س | ||||||||||||||||||||||||
| نقطة التسامي | (أحمر) ≈ 416 – 590 °س، (بنفسجي) 620 °س | ||||||||||||||||||||||||
| نقطة الغليان | (أبيض) 280.5 °س | ||||||||||||||||||||||||
| حرارة الانصهار | (أبيض) 0.66 كيلوجول·مول−1 | ||||||||||||||||||||||||
| حرارة التبخر | (أبيض) 12.4 كيلوجول·مول−1 | ||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | (أبيض) 23.824 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||
| ضغط البخار (أبيض) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| ضغط البخار (أحمر، نقطة غليان 431 °س) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||
| أرقام الأكسدة | 5, 4, 3, 2, 1 [1], -1, -2, -3 (أكاسيده حمضية ضعيفة) | ||||||||||||||||||||||||
| الكهرسلبية | 2.19 (مقياس باولنغ) | ||||||||||||||||||||||||
| طاقات التأين | الأول: 1011.8 كيلوجول·مول−1 | ||||||||||||||||||||||||
| الثاني: 1907 كيلوجول·مول−1 | |||||||||||||||||||||||||
| الثالث: 2914.1 كيلوجول·مول−1 | |||||||||||||||||||||||||
| نصف قطر تساهمي | 3±107 بيكومتر | ||||||||||||||||||||||||
| نصف قطر فان دير فالس | 180 بيكومتر | ||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||
| المغناطيسية | (أبيض،أحمر،بنفسجي،أسود) مغناطيسية مسايرة[2] | ||||||||||||||||||||||||
| الناقلية الحرارية | (أبيض) 0.236، (أسود) 12.1 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||
| معامل الحجم | (أبيض) 5، (أحمر) 11 غيغاباسكال | ||||||||||||||||||||||||
| رقم CAS | 7723-14-0 | ||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الفسفور | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
الفسفور [ملاحظة 1] هو عنصر كيميائي رمزه P وعدده الذرّي 15، ويقع ضمن عناصر الدورة الثالثة وفي المجموعة الخامسة عشر (المجموعة الخامسة وفق ترقيم المجموعات الرئيسية) في الجدول الدوري، حيث يقع في المرتبة الثانية في مجموعة النتروجين، بالتالي فهو من النكتوجينات. يصنّف الفوسفور كيميائياً ضمن اللافلزّات، وهو يوجد بشكله الحرّ بعدّة أشكال (متآصلات)، أشهرها الفوسفور الأبيض والأحمر؛ إلّا أنّه بسبب التفاعلية والنشاط الكيميائي الكبير فهو لا يوجد بشكله الحرّ في الطبيعة، إنّما يدخل في تركيب مركّبات كيميائية مختلفة. يصل تركيز الفوسفور في القشرة الأرضية إلى حوالي غرام واحد لكل كيلوغرام؛ وغالباً ما يوجد بشكل مرتبط مع الأكسجين على شكل فوسفات.
عُزلَ هذا العنصر لأوّل مرّة سنة 1669 على شكل فوسفور أبيض، وبسبب إصداره لوميضٍ خافتٍ عند تعرّضه للأكسجين فقد سمّي بهذا الاسم من الإغريقية Φωσφόρος (فوسفوروس)، والتي تعني حامل الضوء، وذلك بشكل يشير إلى نجمة الصباح، أي كوكب الزهرة.
يعدّ الفوسفور عنصراً أساسياً للحياة، حيث يدخل في تركيب الفوسفات 3−PO4، والذي بدوره يعدّ من المكوّنات الأساسية للحمض النووي الريبوزي منقوص الأكسجين (DNA) وللحمض النووي الريبوزي (RNA) وأدينوسين ثلاثي الفوسفات (ATP) وكذلك للدهون الفوسفورية. كما تعدّ التراكيز المنخفضة من الفوسفات ضرورية للنمو عند بعض الأحياء المائية. تصف دورة الفوسفور حركة هذا العنصر في الغلاف الصخري والغلاف المائي والمحيط الحيوي على سطح الأرض. يُستحصَل على الفوسفور من معادن الفوسفات، ويستخدم بشكل أساسي في صناعة الأسمدة؛ وكذلك في صناعة المنظّفات ومبيدات الآفات وغيرها من الصناعات الأخرى.
التاريخ[عدل]
أصل التسمية[عدل]
لتسمية الفوسفور جذورٌ إغريقية، فقد كانت تطلق تسمية «فوسفوروس» في اليونان القديمة على كوكب الزهرة. تُشتقّ تسمية «فوسفوروس Φωσφόρος» من الجذر فوس φῶς بمعنى ضوء، ومن فيرو φέρω بمعنى حامل، وبذلك يكون المعنى تقريبيّاً «حامل الضوء».[3] استُخدِم اسم فوسفوروس في الأساطير اليونانية لتجسيد نجمة الصباح، وذلك بشكلٍ مماثلٍ لاستخدام هسبيروس لتجسيد نجمة المساء.
الاكتشاف[عدل]


كان عنصر الفوسفور أوّل العناصر الكيميائية المكتشفة في العصر الحديث؛ ويُنسَب الاكتشاف إلى الألماني هينيغ براند سنة 1669، رغم وجود الاعتقاد أنّ العنصر يمكن أن يكون قد اكتُشِف من كيميائيين آخرين في نفس تلك الفترة.[4] كان براند يعمل في مدينة هامبورغ، وكان يقوم ببعض التجارب على البول وذلك بهدف الحصول على حجر الفلاسفة؛ إلا أنه لك يكن يعلم حينئذٍ أنّ البول يحوي طبيعياً على الفوسفور على هيئة فوسفات منحلّة نتيجةً لعمليات الاستقلاب؛[3] بالتالي، وبتلك العملية حصل براند على مادّة بيضاء توهّجت في الظلمة واحترقت بشكلٍ خلّاب؛ فأسماها «phosphorus mirabilis»، والتي تعني تقريباً حاملة الضوء المعجزة.[5] تضمّنت طريقة براند ترك البول لعدّة أيّام إلى أن أصدرَ رائحةً كريهةً جدّاً، ثم قام بغليه حتّى تحوّل إلى قوامٍ هلاميٍّ، ثم قام بتسخين هذا الهلام إلى درجات حرارة مرتفعة وقام بتمرير الأبخرة في الماء. بذلك استحصل براند على المادّة الشمعية البيضاء، والتي هي عنصر الفوسفور بالنهاية. وفق المعطيات العلمية الحديثة يمكن تفسير أن براند كان قد استخلص مركّب «فوسفات الصوديوم والأمونيوم الهيدروجينية» NH4)NaHPO4). وإذا كانت الكمّيّات الموصوفة صحيحة فقد تطلّب منه تقطير حوالي 1100 ليتر من البول للحصول على 60 غرام من الفوسفور، على الرغم من أنّ البيانات الحديثة بَيّنت أنّ البول يحوي على نسبة مقاربة من هذا المركّب، إلّا أنّه لم يكن من الضروري ترك البول ليتعتّق.[6]
تكتّمَ براند في البداية على هذه الطريقة، ولم يَبُحْ بها لأحد؛[7] إلّا أنّه باع الوصفة فيما بعد بملبغ 200 تالر إلى شخص يدعى يوهان دانييل كرافت [ملاحظة 2] من مدينة دريسدن الألمانية،[3] والذي تمكّن وفقها من الحصول على الفوسفور أيضاً، فطاف بها أرجاء أوروبا متأمّلاً كسبَ بعض المال. تسرّبت أنباء أنّ هذه الطريقة تستخدم البول مادّةً أوّليةً إلى أسماع عدّة علماء في تلك الفترة، منهم يوهانس كونكل في السويد (سنة 1678) ولاحقاً روبرت بويل في إنجلترا (سنة 1680)، والذي تمكّن من الحصول على الفوسفور بهذا الأسلوب، وغالباً بمعاونة من مساعده أمبروس غودفراي-هانكفيتز [ملاحظة 3]، إذ أن الأخير بدأ بمشروع صناعي للحصول على الفوسفور بناءً على هذا الأسلوب. قام بويل بنشر هذا الاكتشاف؛[3] ثم قام لاحقاً بتطوير طريقة براند الأصلية عن طريق استخدام الرمل بالإضافة إلى الفحم.
كان بويل أيضاً أوّل من استخدم الفوسفور لإيقاد عيدان خشبية على رأسها قطع من الكبريت سنة 1680، وذلك بأسلوب كان رائداً في تطوير صناعة عيدان الثقاب.[8] بسبب التلقائية الكبيرة للاشتعال عند تعريضه للهواء كان يطلق على الفوسفور أحياناً «عنصر الشيطان».[9]
في سنة 1769 بيّّنَ يوهان غوتليب غان وكارل فلهلم شيله أنّ فوسفات الكالسيوم Ca3(PO4)2 يوجد في العظام، وتمكّنا من الحصول على الفوسفور من رماد العظام. بعد ذلك قام أنطوان لافوازييه بإدراج الفوسفور ضمن لائحة العناصر الكيميائية التي وضعها سنة 1777.[10] اكتشفت متآصلات الفوسفور الأخرى في القرن التاسع عشر؛ فتمكّن أنتون شروتر سنة 1847 من وصف الفوسفور الأحمر؛[11] أمّا الفوسفور البنفسجي فتمكّن يوهان فيلهلم هيتورف من استحصاله أوّل مرّة سنة 1865؛[12] في حين قام بيرسي ويليامز بريجمان باستحصال الفوسفور الأسود أوّل مرّة سنة 1914.[12]
تاريخ الإنتاج[عدل]

كان رماد العظام مصدراً رئيسياً للفوسفور حتى أواسط القرن التاسع عشر،[13] وكانت الطريقة تعتمد على تحميص العظام، ثمّ بوضعها داخل معوّجات فخّارية ضمن أفران آجرّية ساخنة جدّاً بهدف التخلّص من منتجات الفوسفور السامّة.[14] بشكلٍ آخر، كانت العظام تعالج بالأحماض القويّة المركّزة؛ ثم تسخّن مع الرمل والفحم في معوّجات بهدف تقطير الفوسفات المترسّبة للحصول على الفوسفور؛[15] في حين أنّ الغازات المستحصلة وفق تلك العملية، مثل أحادي أكسيد الكربون، كانت تحرق في المداخن.
منذ أواسط القرن التاسع عشر جرى التركيز على مصدرٍ جديدٍ للفوسفور وهو الاستحصال من ذرق الطيور في الجزر الاستوائية في أمريكا الجنوبية، ممّا ولّد صراعات سياسية جديدة في ذلك الحين، تمثلت بإصدار قانون جزر غوانو في الولايات المتّحدة، واندلاع حرب جزر تشينتشا بين إسبانيا ومستعمراتها السابقة في أمريكا الجنوبية. كان الحصول على الفوسفات من هذا المصدر مهمّاً من أجل تحضير الأسمدة منذ النصف الثاني للقرن التاسع عشر.[16] في نفس تلك الفترة جرى اكتشاف صخر الفوسفات (الفوسفوريت) الحاوي على فوسفات الكالسيوم، كما تزامن الاكتشاف مع تطوير جيمس ريدمان [ملاحظة 4] لنوعٍ خاصٍّ من فرن القوس الكهربائي للحصول على الفوسفور من هذه الخامة سنة 1888؛[17] وبذلك تحوّلت الجهود للحصول على عنصر الفوسفور من تسخين رماد العظام إلى الإنتاج من صخر الفوسفات بأفران القوس الكهربائية؛[18][19] خاصّةً بعد أن نضبت مصادر الحصول على الفوسفات من مصادر عضوية، وأصبح الإنتاج غير مجدٍ اقتصادياً.[17]
جرى التفكير باستخدام الفوسفور في صناعة الأسلحة بعد التمكّن من الحصول على هذا العنصر بكمّيّات جيّدة وفق هذه الطريقة الحديثة.[20][21] ففي الحرب العالمية الأولى استُخدِم الفوسفور في صناعة القنابل الحارقة وفي إصدار الستار الدخاني وكذلك في صناعة الطلقات الخطّاطة.[21] أمّا في الحرب العالمية الثانية فاستُخدِم الفوسفور في تحضير الزجاجات الحارقة، كما توسّع استخدام القنابل الفوسفورية الحارقة بشكل أكبر من ذي قبل، خاصّةً أنّه من الصعب إطفاؤها.[22] استُخدِم الفوسفور الأبيض في البداية في صناعة أعواد الثقاب، وكان ذاك أمراً خطيراً ترافق مع وقوع عدّة حوادث؛[20] مثل حدوث نخر لعظام الفكّ لدى العمال [ملاحظة 5]. بعد اكتشاف طريقة آمنة لتصنيع أعواد الثقاب من الفوسفور الأحمر جرى الحثّ على تطبيقها على نطاق صناعي.[23]
تزايد الإنتاج بعد الحرب العالمية الثانية، ولا يزال الإنتاج متزايداً بشكل مطّرد، إذ لم يتمّ الوصول إلى ذروة الفوسفور بعد؛ خاصّةً أنّ صخر الفوسفات لا يزال مادّةً أساسيةً في صناعة الأسمدة، حيث يعالج مع حمض الكبريتيك للحصول على منتجات سوبر فوسفات المختلفة.
الوفرة الطبيعية[عدل]
يُنتَج الفوسفور في المستعرات العظمى في عمليات التخليق النووي داخلها؛ ووُجِدَ أنّ نسبة الفوسفور إلى الحديد في بقايا المستعرات العظمى أعلى بحوالي 100 مرة ممّا هو في أجرام درب التبانة على العموم.[24]
يصل تركيز الفوسفور في القشرة الأرضية إلى 0.09%،[25] أي حوالي 1 غرام لكل كيلوغرام؛ وهو لا يوجد بشكله الحرّ في الطبيعة، إنّما مرتبطاً في الغالب مع الأكسجين في عدّة معادن على شكل فوسفات.[26] يعدّ صخر الفوسفات اللاعضوي المصدر الأساسي للإنتاج العالمي من الفوسفور، وهو يتكوّن بشكلٍ أساسي من الأباتيت (Ca5(PO4)3(F,Cl,OH (شكل من أشكال فوسفات الكالسيوم). توجد معادن أخرى للفوسفات، ولكن بوفرةٍ أقلّ، مثل الويفيليت Al3(PO4)2(OH)3·5H2O والفيفيانيت Fe3(PO4)2·8H2O. ينتشر صخر الفوسفات بشكلٍ واسعٍ في المنطقة العربية، وذلك في دول شمال أفريقيا[27] وفي بلاد الشام؛ كما ينتشر في عدّة مناطق أخرى من العالم مثل الولايات المتحدة والصين وجنوب أفريقيا وغيرها.[28]
يحوي ذرق الطيور البحرية على كمّيّات جيّدة نسبياً من الفوسفات العضوي بنسبةٍ تصل إلى حوالي 40%.[29] كانت توضّعات الغوانو كبيرةً نسبياً في منتصف القرن التاسع عشر، خاصّةً في الجزر الاستوائية، حيث جرى الاتّجارُ بها مصدراً للفوسفات قبل اكتشاف المصدر اللاعضوي من صخر الفوسفات.[17] كما توجد أيضاً نسبة من الفوسفات في الحمأة وفي الحتات.[30]
الإنتاج[عدل]

يُستحصَل على الفوسفور انطلاقاً من صخر الفوسفات، والذي يُحوَّل إلى حمض الفوسفوريك إمّا بمعالجة معادن الفوسفات مع حمض الكبريتيك، أو بالاختزال أوّلاً إلى الفوسفور الأبيض ثم بالتحويل إلى حمض الفوسفوريك. بعد ذلك وانطلاقاً من حمض الفوسفوريك يمكن الحصول على أملاح الفوسفات المختلفة ذات الأهميّة في صناعات عدّة منها تحضير الأسمدة، خاصّةً مع ازدياد الطلب على الأسمدة عالمياً؛[27] ومع وجود منافسة حادّة بين عدّة دول من العالم في إنتاج حمض الفوسفوريك النقي.[31] قدّرت هيئة المسح الجيولوجي الأمريكية الإنتاج العالمي من الفوسفات بحوالي 261 مليون طن سنة 2016؛[32] والاحتياطي العالمي من هذه الخامة سنة 2017 بحوالي 68 مليار طن. هناك عدّة تقديرات وتخمينات متباينة فيما يخصّ الاحتياطي العالمي وزمن الوصول المحتمل إلى ذروة الفوسفور.[27][33][34][35][36]
لاستحصال الفوسفور الأبيض صناعياً يسخَّن صخر الفوسفات إلى درجات حرارة تتراوح بين 1200-1500 °س في نوع خاص من فرن القوس الكهربائي (فرن قوس كهربائي مغمور [ملاحظة 6]) مع الرمل وفحم الكوك؛[37] ثم تعالَج أبخرة الفوسفور وتُكثَّف على الفور تحت الماء لمنع الأكسدة، ولكن رغم ذلك فإنّ الفوسفور الأبيض يتحوّل إلى الشكل المتآصل الآخر من الفوسفور الأحمر الأكثر ثباتية.
تتضمّن المنتجات الثانوية لهذه العملية الحصول على سيليكات الكالسيوم وذلك على شكل خبث، والذي يمكن أن يكون مفيداً ضمن مواد البناء؛ في حين أنّ فلوريد الكالسيوم يمكن أن يستخدم في فلورة الماء. عند وجود الحديد في الخامة يرتبط مع الفوسفور للحصول على ما يعرف باسم الفوسفور الحديدي.

يمكن التعديل على شروط العملية بجعل درجة الحرارة حوالي 1500 °س:[38]
في الماضي كان رماد العظام يستخدم في الحصول على الفوسفور، حيث يُحوَّل فوسفات ثلاثي الكالسيوم إلى فوسفات أحادي الكالسيوم بالمعالجة مع حمض الكبريتيك:
ثمّ بإجراء تفاعل نزع ماء (بلمهة) للحصول على مركّب ميتافوسفات الموافق:
والذي يدوره يُحرَق مع الفحم للحصول على الفوسفور الأبيض.
النظائر[عدل]
هناك ثلاثٌ وعشرون نظيراً معروفاً للفوسفور،[39] تتراوح كتلها الذرّية من 25P إلى 47P؛[40] رغم أنّ النظير فوسفور-31 31P هو الوحيد المستقرّ بينها بوفرةٍ طبيعية مقدارها 100%، لذلك يعدّ الفوسفور عنصراً أحادي النظير.
بسبب وفرته الطبيعية الكبيرة، ولكون اللَفِّ المغزلي للفوسفور-31 ذي مقدارٌ كسري، لذلك يستخدم هذا النظير في نوعٍ خاصٍّ من مطيافية الرنين المغناطيسي النووي [ملاحظة 7]، والتي تعدّ ذات أهمية في التحليل الكيميائي للعيّنات الحاوية على الفوسفور في تركيبها.
للفوسفور نظيرَين مشعَّين، واللَّذَين يمكن استخدامَهما في التجارب النووية الحيوية، نظراً لأن عمر النصف لديهما كبير بالشكل الكافي؛ وهما:
- النظير 32P، وهو مصدر لجسيمات بيتا (طاقة مقدارها 1.71 ميغا إلكترون-فولت MeV)، وله عمر نصف مقداره 14.3 يوم، بالتالي فهو صالح لأن يستخدم بشكل متداول في مختبرات العلوم الحيوية، وذلك بشكل رئيسي في عمليات الوسم الإشعاعي لجزيئات DNA وRNA على مسبار التهجين والكشف عنه بواسطة بصورة إشعاعية ذاتية.
- النظير 33P، وهو مصدر لجسيمات بيتّا أيضاً (طاقة مقدارها 0.25 ميغا إلكترون-فولت MeV)، وله عمر نصف مقداره 25.4 يوم، ويستخدم في التطبيقات التي عندما يكون فيها مقدار الطاقة المنبعثة منخفضاً أمراً ذي أفضلية، مثل تجارب تسلسل الحمض النووي.
ينبغي اتّباع إجراءات السلامة والصحّة المهنية عند التعامل مع نظائر الفوسفور المشعّة.[41]
الخواص الفيزيائية[عدل]
يوجد الفوسفور في الطبيعة على أربع أشكال (متآصلات) رئيسية، وهي الفوسفور الأبيض والأحمر والبنفسجي والأسود. تختلف البنية البلورية، ممّا ينتج عنه اختلاف كبير في الخواص على العموم.[42][43] يُستحصَل على الفوسفور بشكله الأبيض، ومنه يمكن التحويل إلى الأشكال المتبقيّة فيما بينها عن طريق تطبيق ضغوط ودرجات حرارة مرتفعة. يعدّ الفوسفور الأسود أكثر أشكال هذا العنصر استقراراً، ويستحصل عليه من تطبيق ضغوط مرتفعة على الفوسفور الأبيض؛ في حين تكون الأشكال الأخرى شبه مستقرّة بسبب انخفاض سرعة التحوّل الكيميائي. من الفوسفور الأبيض يُستحصَل على الفوسفور الأحمر بالتسخين بمعزل عن الأكسجين؛[44] وبدوره عند تسخين الفوسفور الأحمر يُستحصَل على الفوسفور البنفسجي.
الأشكال المختلفة[عدل]

- الفوسفور الأبيض
وهو أوّل الأشكال اكتشافاً وأكثرها شهرةً بين متآصلات الفوسفور. يوجد الفوسفور الأبيض في الشروط القياسية على شكل صلب شمعي طريّ، وتتألّف بنيته الكيميائية من جزيء رباعي الفوسفور P4، تتوضّع فيه الذرّات على رؤوس رباعي سطوح، وترتبط الذرات فيما بينها برابطة أحادية. يمكن أن يوجد جزيء رباعي الفوسفور في الحالة السائلة والغازية عند درجات حرارة أعلى من 800°س، حيث يبدأ حينها بالتفكّك إلى جزيء ثنائي الفوسفور P2.[45] توجد البنية البلورية للفوسفور الأبيض على هيئَتين؛ الأولى هي الهيئة ألفا (α)، وهي الحالة القياسية للعنصر، إلّا أنّها شبه مستقرّة تحت الشروط القياسية؛[46] وهي تتبع النظام البلوري المكعّب مركزي الجسم، وتتحوّل بشكل عكوس إلى الهيئة بيتّا (β) عند الدرجة 195.2 كلفن (−78.0 °س)، وهي تتبع النظام البلّوري السداسي.[47] يختلف هذان الشكلان عن بعضِهما في التوجّه النسبي لرباعيات السطوح P4 في البنية البلّورية.[48][49]
إنّ الفوسفور الأبيض هو الشكل الأقلّ كثافةً والأقلّ استقراراً، والأكثر تفاعليةً والأكثر تطايريةً. يتحوّل الفوسفور الأبيض إلى الشكل الأحمر ببطء، ولذلك تبدو عيّنات الفوسفور الأبيض صفراء في بعض الأحيان، بسبب احتوائها على نسبة من الفوسفور الأحمر؛[50] ويمكن تسريع ذاك التحوّل بأثرٍ من الضوء والحرارة.
- ثنائي الفوسفور

يعطي التفكّك الحراري للفوسفور الأبيض P4 عند حوالي 800°س جزيء ثنائي الفوسفور P2، وهو يوجد في الحالة الغازية فقط، وهو غير مستقرّ. يتألّف الجزيء من ذرَّتي فوسفور ترتبطان مع بعضهما البعض برابطة ثلاثية على غرار جزيء النتروجين N2. كما يمكن الحصول عليه على شكل مركّب وسطي قصير العمر في المحلول عن طريق التفكّك الحراري لمركّبات الفوسفور العضوي.[51] عند درجات حرارة أعلى يتفكّك P2 إلى الفوسفور الذرّي P.[22][52][ملاحظة 8]

- الفوسفور الأحمر
ما يميّز الفوسفور الأحمر عن الأبيض هو وجود بنية بوليميرية، يمكن النظر إليها أنّها مشتقّة من P4، حيث تنفصم رابطة P-P واحدة، وتنشأ رابطة جديدة مع رباعي وجوه مجاور، ممّا يؤدّي إلى الحصول على بنية شبه متسلسلة. يُستحصَل على الفوسفور الأحمر بتسخين الشكل الأبيض إلى درجات حرارة تفوق 250 °س، أو بتعريض الفوسفور الأبيض إلى ضوء الشمس بمعزل عن أكسجين الهواء.[3] يكون الشكل الأحمر إبّان التشكّل مادّةً لابلّورية، والتي تتحوّل إلى شكل متبلور مع استمرار التسخين؛ بالتالي فإنّ الشكل الأحمر هو شكل وسطي بين الفوسفور الأبيض والفوسفور البنفسجي. يكون الفوسفور الأحمر المحضّر حديثاً ذا تفاعلية كيميائية جيّدة ويشتعل عند حوالي الدرجة 300 °س؛[53] لكنّه يبقى أكثر استقراراً من الفوسفور الأبيض.[54] يؤدّي التخزين أو التعرّض المطوّل للحرارة إلى دكون لونه (الفوسفور البنفسجي)، بحيث يصبح الناتج الحاصل أكثر استقراراً ولا يشتعل تلقائياً عند التماس مع الهواء.[55]
- الفوسفور البنفسجي
وهو شكل أكثر استقراراً للفوسفور من الشكلين الأبيض والأحمر، ويُستحصَل عليه من الفوسفور الأحمر بالتعرّض المطوّل للحرارة فوق الدرجة 550 °س.[56] يطلق على هذا الشكل أحياناً اسم «فوسفور هيتورف»، نسبةً إلى مكتشفه يوهان فيلهلم هيتورف.[57]
- الفوسفور الأسود
يعدّ الفوسفور الأسود أكثر أشكال الفوسفور استقراراً من الناحية الديناميكية الحرارية، وأقلّها تفاعليةً من الناحية الكيميائية، وله بنية تشبه بنية الغرافيت.[58][59] يُستحصَل على هذا الشكل بتسخين الفوسفور الأبيض تحت ضغوط مرتفعة جدّاً؛[60] كما يمكن أن يُستحصَل عليه بطرقٍ أقلّ مشقّةً من الناحية التقنية.[61][62][63]
يشبه الفوسفور الأسود إلى حدٍّ ما الغرافيت بشكله وببنيته وبخواصّه، حيث أنّه يوجد على شكل قشورٍ سوداء، وله بنية شبه مستوية، وهو موصل للكهرباء.[64]
| الشكل | أبيض(α) | أبيض(β) | بنفسجي | أسود |
|---|---|---|---|---|
| البنية البلورية | نظام بلوري مكعّب مركزي الجسم | نظام بلوري ثلاثي الميل | نظام بلوري أحادي الميل | نظام بلوري معيني قائم |
| رمز بيرسون | aP24 | mP84 | oS8 | |
| زمرة فراغية | I43m | P1 No.2 | P2/c No.13 | Cmca No.64 |
| الكثافة (غ/سم3) | 1.828 | 1.88 | 2.36 | 2.69 |
| فجوة النطاق (إلكترون فولت) | 2.1 | 1.5 | 0.34 | |
| قرينة الانكسار | 1.8244 | 2.6 | 2.4 |
الضيائية الكيميائية[عدل]
لوحظ عند عزل الفوسفور الأبيض انبعاث وميضٍ أخضرٍ خافتٍ منه عندما يكون موضوعاً في إناء، ثم ما يلبث أن يتوقّف؛ وحاول روبرت بويل تفسير ذلك في ضوء المعارف المتداولة آنذاك. في القرن الثامن عشر وجد أنّ الفوسفور لا يصدر هذا الضياء بالمرّة في وسطٍ من الأكسجين النقي؛[65] إذ أنّ هذا الضياء يصدر ضمن مجالٍ محدّدٍ من الضغط الجزئي للأكسجين؛ كما يحدث ضمن مجال معيّنٍ من درجات الحرارة.[66]
جرى تفسير هذه الظاهرة علمياً سنة 1974؛[20][67] إذ يحدث التفاعل مع الأكسجين على سطح الفوسفور الصلب، حيث تتشكّل جزيئات قصيرة العمر من HPO و P2O2، والتي تكون مسؤولةً عن إصدار الضوء المرئي في العيّنة. هذا التفاعل بطيء، ويكفي فيه وجود عدد قليل من تلك المركّبات الوسطية النشيطة لإصدار هذه الظاهرة الضيائية.
منذ اكتشاف عنصر الفوسفور كان يطلق بشكلِ غير مضبوطِ على مادّة تصدر الضياء من غير حدوث اشتعالِ أنّها مادّة فسفورية أو متفسفرة. ورغم أنّ تلك المصطلحات مشتقّة من لفظ الفوسفور، إلّا أنّه من المعروف حالياً أنّ الظاهرة المسؤولة عن ضياء الفوسفور هي الضيائية الكيميائية (إصدارُ ضياءٍ نتيجةَ تفاعلٍ كيميائي داخلي) وليست الفسفورية (إعادةُ إصدارٍ الضوء نتيجةً لحدوث حالةٍ مثارةٍ للمادّة من مؤثّرٍ خارجي).[6]
الخواص الكيميائية[عدل]

الفوسفور الأبيض هو أكثر أشكال الفوسفور نشاطاً من الناحية الكيميائية؛ فهو ذو قابلية مرتفعة للاشتعال وبشكلٍ تلقائي عند التماس مع الهواء، ولأبخرة الفوسفور الأبيض الناتجة عن احتراقه رائحة مميّزة تشبه رائحة الثوم؛ وغالباً ما تغطّى العيّنات منه بمركّب خماسي أكسيد الفوسفور أبيض اللون. عند حوالي الدرجة 50 °س يحترق بالكامل إلى خماسي أكسيد الفوسفور P4O10، لذلك تُحفَظ عيّنات الفوسفور الأبيض تحت الماء.
لمركّب خماسي أكسيد الفوسفور قابلية استرطاب مرتفعة، لذلك عند احتراق الفوسفور بالهواء الرطب تتشكّل أبخرة من حمض الفوسفوريك. لا يذوب الفوسفور الأبيض في الماء، لكنّه ينحلّ في ثنائي كبريتيد الكربون؛[22] ويؤدّي تبخير محاليل الفوسفور الأبيض إلى الحصول على شكل أحمر قانئ.[57]
يتفاعل الفوسفور بشكلٍ عنيف وناشرٍ للحرارة مع الهالوجينات والفلزّات النشيطة والكبريت، حيث تتشكّل الهاليدات والفوسفيدات والكبريتيدات الموافقة، على الترتيب. بأثرٍ من المحاليل القلويّة المركّزة عند درجات حرارة مرتفعة يتحوّل الفوسفور إلى مركّبات الفوسفانات المختلفة. للفوسفور ألفة كيميائية تجاه الأكسجين، بالتالي فله خواصّ مختزلة، فهو قادرٌ على سبيل المثال عند اختزال ذرّة الكبريت عند تسخين حمض الكبريتيك مع الفوسفور إلى ثنائي أكسيد الكبريت.
المركّبات الكيميائية[عدل]
الفوسفور عنصرٌ نشيط كيميائياً، ويشكّل العديد من المركّبات الكيميائية التساهمية مع اللافلزّات. كما يتفاعل مع الفلزّات لتشكيل الفوسفيدات الموافقة. هناك عدّة حالات أكسدة مختلفة للفوسفور، وهي تقع بين -3 و +5؛ أمّا العدد التناسقي للفوسفور فيقع بين 1 و 6، وغالباً ما يكون إمّا 3 أو 4. كان يعتقد في البداية أنّ الفوسفور الخماسي يُشرك مدارات d في تشكيل الروابط الجزيئية، إلّا أنّ النَمْذَجة الحاسوبية وفق نظرية المدارات الجزيئية بَيّنت أنّ الترابط الكيميائي يتضمّن مدارات s و p فقط.[68] إنّ أكثر مركّبات الفوسفور انتشاراً هي مركّبات الفوسفات بسبب الحالة المستقرّة لها، ولذلك تدخل في تركيب معادن الفوسفات في القشرة الأرضية.
مع الهيدروجين[عدل]
يطلق على مركّبات الفوسفور الثلاثي مع عنصر الهيدروجين اسم الفوسفانات؛ وأبسط هذه المركّبات هو الفوسفان PH3 (والذي يعرف أيضاً باسمه الشائع فوسفين) وكذلك ثنائي P2H4 وثلاثي الفوسفان P3H5.
يمكن لذرّات الهيدروجين في الفوسفانات أن تستبدل بمجموعات عضوية، ليتمّ الحصول على مركّب فوسفور عضوي كما هو الحال في مركّب ثلاثي فينيل الفوسفين؛ ويجب أن يكون الارتباط حينها مباشراً بين الفوسفور والكربون برابطة P-C؛ إذ أنّ الترابط عبر ذرّات الأكسجين P-O-C يعطي مجموعة أخرى من المركّبات، والتي تدعى إسترات الفوسفيت (أو الفوسفيتات العضوية).
مع الفلزّات[عدل]
تتشكّل مجموعة من المركّبات تسمّى الفوسفيدات الحاوية على أنيون الفوسفيد 3−P عند تفاعل الفوسفور الأحمر مع بعض الفلزّات، خاصّةً النشيطة كيميائياً، مثل الفلزّات القلوية والفلزّات القلوية الترابية. عند تفاعل الفوسفيدات مع الماء (تفاعل حلمهة) ينطلق غاز الفوسفين؛ كما هو الحال في مركّب فوسفيد الكالسيوم Ca3P2. تكون حالة أكسدة الفوسفور في الفوسفيدات -3.
هناك طيفٌ واسعٌ من الفوسفيدات ذات التطبيقات الصناعية،[22] كما توجد فوسفيدات طبيعية غنيّة بالفلزّات، مثل معدن الشرايبرسيت الموجود في بنية بعض النيازك.
الأكاسيد[عدل]
يشكّل الفوسفور مع الأكسجين العديد من الأكاسيد، نظراً لإمكانية وجود الفوسفور بعدّة حالات أكسدة مختلفة، ويكون الترابط الكيميائي في تلك الأكاسيد بين الفوسفور والأكسجين إمّا على شكل رابطة أحادية أو رابطة ثنائية أو على شكل روابط جسرية P-O-P لها هيكل الأدامانتان. من هذه الأكاسيد:
- ثلاثي أكسيد الفوسفور P4O6 (أكسيد الفوسفور الثلاثي)، ويوجد على شكل مركّب أبيض طريّ، ذي سمّية مرتفعة ونشاط كيميائي كبير، وهو يتأكسد بسرعة إلى خماسي أكسيد الفوسفور.
- رباعي أكسيد ثنائي الفوسفور P2O4 وهو أكسيد مختلط للفوسفور في حالتي الأكسدة +3 و +4، ولذلك يسمّى أيضاً أكسيد الفوسفور الثلاثي والرباعي، ويُستحصَل عليه بالأكسدة الجزئية لثلاثي أكسيد الفوسفور في وسط عضوي من رباعي كلوريد الكربون.
- خماسي أكسيد الفوسفور P4O10 (أكسيد الفوسفور الخماسي)، وهو أكثر أكاسيد الفوسفور انتشاراً وشهرةً، ويتميّز بخواصّه الاسترطابية المرتفعة، لذلك يصلح استخدامه ضمن المواد المجفّفة. يمكن اعتبار P4O10 من الناحية الكيميائية أنه أنهيدريد (بلا ماء) حمض الفوسفوريك.
الأحماض الأكسجينية[عدل]
يشكّل الفوسفور العديد من الأحماض الأكسجينية ذات الأهمّيّة التطبيقية. ما يميّز تلك الأحماض هو التفاوت في بنيتها وفي حالات أكسدة الفوسفور فيها، وفي عدد البروتونات فيها والتي تحدد الوظيفة الحمضية، إذ يمكن للبعض منها أن تحوي ذرّات هيدروجين غير قابلة للتأيّن، أي أنها غير قادرة على تشكيل بروتونات.[22] كما يمكن التمييز بين أحماض الفوسفور الأكسجينية حسب عدد ذرّات الفوسفور فيها بين الأحادية والثنائية والمتعدّدة.
| حالة أكسدة الفوسفور | البنية الجزيئية | اسم الحمض | عدد البروتونات الأعظمي | اسم الملح الموافق |
|---|---|---|---|---|
| أحماض الفوسفور الأحادية | ||||
| +I |  |
حمض الهيبوفوسفوروز | 1 | هيبوفوسفيت / فوسفينات (مشتقّات عضوية) |
| +III |  |
حمض الفوسفوروز | 2 | فوسفيت / فوسفونات (مشتقّات عضوية) |
| +V | 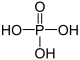 |
حمض الفوسفوريك | 3 | فوسفات فوسفات عضوي (مشتقّات عضوية) |
| +V |  |
حمض بيروكسي أحادي الفوسفوريك | 3 | بيروكسي أحادي فوسفات |
| أحماض الفوسفور الثنائية | ||||
| +II |  |
حمض هيبو ثنائي الفوسفوروز | 2 | هيبو ثنائي فوسفيت |
| +III |  |
حمض ثنائي الفوسفوروز | 2 | ثنائي فوسفيت |
| +IV | 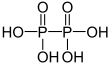 |
حمض الهيبوفوسفوريك (حمض هيبو ثنائي الفوسفوريك) |
4 | هيبوفوسفات (هيبو ثنائي فوسفات) |
| +V |  |
حمض البيروفوسفوريك (حمض ثنائي الفوسفوريك) |
4 | بيروفوسفات (ثنائي فوسفات) |
| +V |  |
حمض بيروكسي ثنائي الفوسفوريك | 4 | بيروكسي ثنائي فوسفات |
| أحماض الفوسفور المتعدّدة | ||||
| +V |  |
حمض ثلاثي الفوسفوريك | 5 | ثلاثي فوسفات |
| +V |  |
أحماض ميتا الفوسفوريك | (n (n=3,4,6 | ميتافوسفات |
| +V |  |
أحماض متعدد الفوسفوريك (بولي فوسفوريك) |
(n+2 (n=1-6 | متعدد فوسفات (بولي فوسفات) |
لأملاح الأحماض الأكسجينية تطبيقات مهمّة وهي واسعة الانتشار، وأشهرها الفوسفات، وهي القاعدة المرافقة لحمض الفوسفوريك. لهذا الأنيون بنية على شكل رباعي سطوح 3−PO4.[69] تميل الفوسفات إلى تشكيل حلقات وسلاسل حاوية على جسور أكسجينية على الشكل P-O-P، كما هو الحال في حمض ثلاثي الفوسفوريك وملح ثلاثي فوسفات الصوديوم Na5P3O10. يمكن الحصول على مشتقّات كبريتية لأحماض الفوسفور الأكسجينية، مثل حمض الثيوفوسفوريك، وتسمّى أملاحه ثيوفوسفات.
الهاليدات[عدل]

يستطيع الفوسفور تشكيل العديد من الهاليدات المختلفة حسب حالة الأكسدة، وذلك من الأنماط P2X4 أو PX3 أو PX5. بالنسبة لهاليدات الفوسفور تكون مركّبات الفلوريد غازية، أمّا الكلوريد فهي سائلة أو صلبة، في حين تكون مركّبات البروميد واليوديد صلبة. تتميّز هاليدات الفوسفور أنها سامّة، وهي حسّاسة للحلمهة وينبغي عند تخزينها حمايتها من الرطوبة الجوية. يكون لهاليدات الفوسفور الخماسي بنية جزيئية هرمية مزدوجة ثلاثية، خاصّة في الشكل المصهور أو في الحالة الغازية؛[22] وهي تصنّف كيميائياً ضمن أحماض لويس.
من الهاليدات المعروفة للفوسفور على اختلاف أشكالها كلّ من الفلوريدات (الثنائية P2F4 والثلاثية PF3 والخماسية PF5) والكلوريدات (الثنائية P2Cl4 والثلاثية PCl3 والخماسية PCl5) والبروميدات (الثنائية P2Br4 والثلاثية PBr3 والخماسية PBr5) واليوديدات (الثنائية P2I4 والثلاثية PI3؛ في حين أنّ خماسي يوديد الفوسفور PI5 مختلَفٌ على وجوده.[22] )
كما توجد هاليدات مختلطة للفوسفور مع الأكسجين من النمط POX3، والتي تسمّى هاليدات الفوسفوريل (مثل فلوريد POF3 وكلوريد POCl3 وبروميد الفوسفوريل POBr3 بالإضافة إلى كلوريد ثنائي فلوريد الفوسفوريل POF2Cl)؛ ومع الكبريت من النمط PSX3، والتي تسمى هاليدات الثيوفوسفوريل (مثل فلوريد PSF3 وكلوريد الثيوفوسفوريل PSCl3 بالإضافة إلى كلوريد ثنائي فلوريد الثيوفوسفوريل PSClF2).
كانت هاليدات الفوسفور من أُولى هاليدات اللافلزات التي أجريت دراسات عليها، وذلك منذ القرن التاسع عشر، على يدِ باحثِين من أمثال لوي جوزيف غي لوساك وهمفري ديفي وبيير لوي دولون.
مركبات لاعضوية أخرى[عدل]
يشكّل الفوسفور مع الكبريت سلسلةً من الكبريتيدات التي تعتمد في بنيتها على وجود رباعي سطوح من P4 تتوضّع فيه ذرّات الكبريت بشكلٍ موزَّع على الرؤوس أو بين الأضلاع. تتبع هذه الكبريتيدات الصيغة العامة (P4Sx (x = 3–10، ويمكن استحصالها من تسخين الفوسفور الأحمر مع الكبريت بنسبٍ مختلفة. من الأمثلة عليها كلّ من خماسي كبريتيد الفوسفور P4S10 وهو أشهرها، والذي له بنية مماثلة لبنية خماسي أكسيد الفوسفور P4O10؛[70] بالإضافة إلى ثلاثي كبريتيد رباعي الفوسفور P4S3. كما توجد أيضاً سلسلة من السيلينيدات المعروفة للفوسفور.
أمّا مع النتروجين فيشكّل الفوسفور مركّب خماسي نتريد ثلاثي الفوسفور P3N5، والذي يعطي عند تفكّكه الحراري فوق الدرجة 800 °س مركّب أحادي نتريد الفوسفور PN. يدخل الفوسفور في تركيب نتريدات مختلطة مع الهالوجينات، والتي تدخل في بنية شبكية لتشكّل ما يسمّى متعدّدات الفوسفازين (بولي فوسفازين). فعلى سبيل المثال، يستحصل على سلسلة من المركّبات ذات الصيغة PNCl2)n)، مثل المركب سداسي كلورو الفوسفازين، من معالجة خماسي كلوريد الفوسفور مع كلوريد الأمونيوم. من الممكن إدخال مجموعات ألكوكسيد بدلاً من ذرّات الكلور في هذه المركّبات، ممّا قد يفتح المجال للحصول على طائفة جديدة من البوليميرات ذات الخواص المميّزة.[71]

مركبات الفوسفور العضوية[عدل]
يتمّ التمييز في مركّبات الفوسفور العضوية بين المركّبات التي تحوي رابطة كيميائية بين ذرّات الفوسفور والكربون وبين التي لا تحويها. يندرج ضمن الصنف الأول عددٌ من المركّبات مثل مشتقّات الفوسفانات العضوية والفوسفينوكسيدات R3PO وكذلك ألكيلات حمض الهيبوفوسفوروز (R2PO(OH وألكيلات حمض الفوسفوروز R-PO(OH)2، بالإضافة إلى أملاح الفوسفونيوم المختلفة؛ أمّا الصنف الثاني فهو إسترات أحماض الهيبوفوسفوروز (الفوسفينات) والفوسفوروز (الفوسفونات). من الأمثلة على مركّبات الفوسفور العضوية كل من مشتقّات الفوسفين مثل ثلاثي ميثيل الفوسفين وثلاثي فينيل الفوسفين وثنائي كلورو فينيل الفوسفين؛ وكذلك المركّبات الحلقية غير المتجانسة مثل الفوسفول والفوسفورين؛ وكذلك مركّبات ثلاثي فينيل الفوسفيت وثلاثي فينيل الفوسفات، بالإضافة إلى الإيليدات الفوسفوريلية التي لها دورٌ مهمّ في تفاعلات عضوية عدّة منها تفاعل فيتيغ.
تعدّ مركّبات الفوسفات العضوية ذاتَ أهمّيّة في الكيمياء الحيوية؛ إذ توجد هذه المركّبات في العديد من المركّبات الكيميائية الحيوية الضرورية للحياة بما فيها الحمض النووي الريبوزي منقوص الأكسجين (DNA) والحمض النووي الريبوزي (RNA)، بالإضافة إلى العوامل المرافقة (أو المتمّمة)، والتي لها دورٌ أساسي في استمرار الحياة. من الأمثلة المهمّة الأخرى كلّ من فوسفات الأدينوسين الأحادية (AMP) والثنائية (ADP) والثلاثية (ATP)؛ وكذلك فوسفات الغوانوسين الأحادية (GMP) والثنائية (GDP) والثلاثية (GTP)؛ بالإضافة إلى الدهون الفوسفورية (فوسفورليبيدات).
التحليل الكيميائي[عدل]
مطيافياُ[عدل]
يمكن تحليل الفوسفور مطيافياً باستخدام نوع خاصّ من مطيافية الرنين المغناطيسي النووي (31P-NMR)، والتي تعتمد على النظير فوسفور-31، نظراً لكونه النظير الوحيد المستقرّ للفوسفور والمتوفّر طبيعياً، كما أن له لف مغزلي مقداره 1/2. بالمقارنة مع مطيافية الرنين المغناطيسي النووي للبروتون 1H-NMR فإنّ الحساسية النسبية تبلغ مقدار 6.6%؛ أمّا مجال الرنين فيصل إلى حوالي 700 جزء في المليون (ppm)؛ كما يمكن أن يستخدم حمض الفوسفوريك بتركيز 85% مادّةً معيارية قياسية.
يسهل نظرياُ تحليل وتقييم الأطياف وفق هذه الطريقة التحليلية، خاصّةً عند فكّ الازدواج مع الهيدروجين، ممّا يؤدّي إلى الحصول على إشارات ذات استبانة طيفية جيدة. لكن على العموم تستخدم هذه التقنية لتعيين بنية مركّبات معروفة البنية؛ إذ أنّ إجراء القياسات على مركّبات مجهولة يترافق بصعوبات، خاصّةً مع ندرة وجود مجال طيفي معيّن لنوع محدّد من الارتباط.
تفاعلات الكشف[عدل]

يجري الكشف عن الفوسفور نوعاً وكمّياً بوسائل تقليدية عبر تحليل أنيون الفوسفات 3−PO4.
يمكن الكشف عن أيونات الفوسفات باستخدام موليبدات الصوديوم في وسطٍ من حمض الكبريتيك، حيث يُستحصَل أوّلاً على محلول أصفر اللون من موليبدوفوسفات الصوديوم، والذي يتحوّل عند إضافة محلول من حمض الأسكوربيك على الساخن إلى الحصول على مركب «أزرق الموليبدنوم». يمكن استخدام موليبدات الأمونيوم أيضاً لهذا الغرض؛ حيث أنّ أنيون الموليبدات هو المسؤول عن التفاعل، حيث يخضع أوّلاً في الوسط المائي إلى تفاعل توازن داخلي:
بحيث يكون التفاعل مع أنيون الفوسفات على الشكل:
أمّا عند الوسط القاعدي من الأمونيا فتحدث عملية ترسيب للفوسفات بوجود أيونات المغنسيوم على شكل ملح مزدوج من فوسفات الأمونيوم والمغنسيوم:
يمكن استخدام تفاعل الكشف لإجراء تحليل وزني للفوسفات، ومنه تحديد نسبة الفوسفور بإجراء الحسابات التناسبية. كما يمكن إجراء معايرة حجمية للفوسفات بالترسيب بأيونات اللانثانوم 3+La أو بمحلول قياسي من البزموت 3+Bi؛ ثم بالمعايرة الرجعية باستخدام ثنائي أمين الإيثيلين رباعي حمض الأسيتيك (EDTA).
الدور الحيوي[عدل]
ينحصر الدور الحيوي للفوسفور في الجسم على شكل فوسفات لاعضوي، إذ أنّ أغلب مركّبات الفوسفور العضوية هي مركّبات سامّة. يدخل الفوسفور بشكله اللاعضوي على هيئة أيون فوسفات 3−PO4 في العديد من أشكال أنواع الحياة المعروفة؛[72] وقد يرمز أحياناً للفوسفات اللاعضوي بالرمز ("Pi") في سياق الحيوية الحيوية.[73] يلعب الفوسفات دوراً محورياً في هيكل جزيئات الحمض النووي الريبوزي منقوص الأكسجين (DNA) والحمض النووي الريبوزي (RNA) الأساسية لعملية التكاثر وصنع البروتينات؛ وكذلك يدخل الفوسفات في تركيب أدينوسين ثلاثي الفوسفات (ATP)، الضروري لعمليّات نقل الطاقة الخلوية وكذلك من أجل عمليات الفسفرة الخلوية المهمّة داخل الخلايا. بالإضافة إلى ذلك، يدخل الفوسفور في تركيب الدهون الفوسفورية وهي مكوّنات مهمّة للأغشية الخلوية. تُشتَقّ الدهون الفوسفورية من الغليسرول، حيث تحل مجموعتا إستر من الأحماض الدهنية مكان مجموعتي هيدروكسيل فيه، في حين أنّ الثالثة تحلّ محلّها مجموعة فوسفات مرتبطة بكحول آخر.[74] من جهة أخرى، فإنّ لأملاح فوسفات الكالسيوم دوراً في المساعدة بتقوية وتدعيم مينا الأسنان والعظام.[22]
يحوي جسم إنسان بالغ وسطياً من الفوسفور ما مقداره 700 غرام؛ يكون حوالي 85–90% منه وزناً في العظام والأسنان على شكل أباتيت؛ أمّا الباقي فهو موجود في الأنسجة الطريّة والسوائل خارج الخلايا. تكون نسبة الفوسفور حوالي 0.5% وزناً عند الرضّع والأطفال، وتزداد لتصل إلى ما بين 0.65–1.1% وزناً عند البالغين. إنّ متوسط نسبة تركيز الفوسفور في الدم حوالي 0.4 غ/ل، وحوالي 70% منه على شكل عضوي في حين أنّ النسبة المتبقية من 30% هي فوسفات لاعضوي.[75] يستهلك ويطرح إنسان بالغ عند تناوله لوجبة غذائية صحّية حوالي 1-3 غرام من الفوسفور يومياً، حيث يكون الداخل منه على شكل فوسفات لاعضوي وجزيئات حيوية حاوية على الفوسفور مثل الأحماض النووية والدهون الفوسفورية، في حين أنّ المطروح يكون تقريباً بشكل حصري على هيئة أيونات الفوسفات.
توصف حركة الفوسفور خلال الغلاف الصخري والغلاف المائي والغلاف الحيوي بواسطة دورة الفوسفور، وهي دورة حيوية جيولوجية كيميائية. كما يعدّ الفوسفور عاملاً محدّداً في الأنظمة البيئية، إذ أنّ ندرته في الوسط تحدّ من معدّل نموّ الكائنات فيه؛ لذلك يكثر مثلاً استخدام الأسمدة الغنيّة بالفوسفات في الزراعة؛[76] بالمقابل فإنّ زيادته عن المعدّلات الطبيعية، وخاصّةً في الأوساط المائية، يخلّ بالتوازن الطبيعي، إذ يمكن أن تؤدّي حالة من فرط المغذيات إلى فرط نمو وانتشار الطحالب.[27] تحوي الكتلة الجافة من النباتات ما مقداره 0.2% وسطياً من الفوسفور؛ وهو يعدّ ذا دورٍ حيويٍ مهمّ بالنسبة للنباتات، فهو من العناصر الغذائية الضرورية لنموّها، وهو أمرٌ يُدرَس في علم تأثير التربة من أجل معرفة الكمّيّة الضرورية حسب نوع النبات. عند نقص تركيز الفوسفات في نطاق 1-2 ملم في منطقة الغلاف الجذوري للنباتات، فإنّ ذلك يترافق مع زيادة في نمو الجذور.[77]
نقص الفوسفور[عدل]
يمكن أن تحدث متلازمة نقص الفوسفور عند الإنسان طبّياً إمّا بسبب سوء التغذية، أو حدوث حالة فشل في امتصاص الفوسفات، أو بسبب متلازمات استقلابية تؤدّي إلى سحب الفوسفات من الدم (مثل حدوث متلازمة إعادة التغذية بعد حالة من سوء التغذية[78])، أو بسبب طرح كمّيات كبيرة منه في البول. ما يميّز نقص الفوسفور هو ظهور أعراض نقص فوسفات الدم، وهي حالة تتّسم بانخفاض نسبة الفوسفات المنحلّة في بلازما الدمّ وداخل الخلايا. من أعراض نقص فوسفات الدم حدوث خلل وظيفي عصبي واضطرابات في خلايا الدم والعضلات بسبب نقص أدينوسين ثلاثي الفوسفات ATP. من جهةٍ أخرى، فإنّ زيادة نسبة الفوسفات في الدمّ تؤدّي إلى الإسهال وتكلّس الأعضاء والأنسجة الطرية، ويمكن أن يتداخل في مقدرة الجسم على استخدام أيونات الحديد والكالسيوم والمغنسيوم والزنك.[79]
التغذية[عدل]
قامت الأكاديمية الوطنية للطبّ في الولايات المتّحدة الأمريكية بنشر معدّل الحاجة التقريبي والكمّيات الغذائية المسموحة والموصى بها ومعدّل الحاجة التقريبي من الفوسفور سنة 1997.[80] يصل معدّل الحاجة التقريبي من الفوسفور للبالغين من فوق عمر 19 إلى حوالي 580 مغ/اليوم؛ أمّا الكمّية الغذائية المرجعية فهي حوالي 700 مغ/اليوم، وهي تشمل الحوامل والمرضعات. بالنسبة للأعمار ما بين 1-18 سنة فإنّ الكمّية المرجعية تزيد مع تقدم العمر من 460 إلى 1250 مغ/اليوم. أمّا المستوى الأقصى المقبول من الفوسفور وفق تلك التوصيات فهو 4000 مغ/اليوم.[80] أمّا الهيئة الأوروبية لسلامة الأغذية فحدّدت نسبة الكمّية المقبولة من الفوسفور بشكلٍ مقاربٍ للتوصيات الأمريكية، حيث أنّ كلاهما يوصي بكمّيات أكبر لليافعين بالمقارنة مع البالغين.[81] كما حدّدَت الكمّيّات القصوى في مراجعة أخرى.[82]
يترافق وجود الفوسفور عادةً في الوجبات الغذائية الحاوية على نسبةٍ مرتفعة من البروتين، مثل الحليب واللحم، وكذلك البروتينات من مصادر نباتية مثل البقوليات والصويا. على العموم، فإنّ الوجبة الغذائية الحاوية على كمّيّاتٍ كافيةٍ من البروتين والكالسيوم فهي على الأغلب غنيّة بالفوسفور أيضاً.[83]
الاستخدامات[عدل]
يندر استخدام الفوسفور العنصري بشكل مباشر في الحياة اليومية؛ إذ إنّ التطبيقات المفيدة له هي لمركّباته الكيميائية، والمستخدمة بشكل واسع في الصناعة، مثل صناعة الأسمدة والمبيدات والمنظّفات وغيرها. يُحوَّل أغلب الفوسفور الأبيض المنتَج إلى خماسي أكسيد الفوسفور، والذي بدوره يُحوَّل إلى حمض الفوسفوريك، الذي يعدّ مادة أساسية لتحضير مركّبات الفوسفات المختلفة.
| مركبات واسعة الانتشار | الاستخدام |
|---|---|
| Ca(H2PO4)2·H2O | صناعة الأسمدة ومسحوق الخَبْز |
| CaHPO4·2H2O | مضاف غذائي وصناعة مساحيق الأسنان |
| H3PO4 | صناعة الأسمدة الفوسفاتية |
| PCl3 | تحضير المبيدات ومركّبات الفوسفور العضوية |
| POCl3 | صناعة الملدّنات |
| P4S10 | صناعة المبيدات |
| Na5P3O10 | صناعة المنظّفات |
- الأسمدة
إنّ الفوسفور هو عنصر غذائي أساسي لنموّ النباتات، ولذلك فإنّ أغلب الإنتاج العالمي من الفوسفور يستخدم في صناعة الأسمدة. نتيجةً للزيادة المستمرّة في تعداد السكان في أنحاء العالم فإنّ الطلب على الأسمدة بتزايدٍ مستمرٍّ أيضاً، وهو أمرٌ لوحظ في الارتفاع الكبير في إنتاج الفوسفات منذ النصف الثاني للقرن العشرين.[84] يعدّ السماد الفوسفاتي المصنَّع ضرورياً لأهميّة الفوسفور الحيوية، ولكون المركّبات الحاوية على الفوسفور طبيعياً غير منحلّة، مما يحول دون وصولها إلى جذور النباتات، وكذلك بسبب بطء دورة الفوسفور الطبيعية.
يعدّ سماد سوبرفوسفات من الأسمدة شائعة الانتشار، وهو مزيجٌ من فوسفات أحادي الكالسيوم Ca(H2PO4)2 وكبريتات الكالسيوم ثنائي الهيدرات CaSO4·2H2O. يعتمد إنتاج الأسمدة الفوسفاتية بشكلٍ كبير ٍعلى حمض الكبريتيك.[85]
- مركّبات الفوسفور العضوية
يستخدم الفوسفور الأبيض لإنتاج هاليدات وكبريتيدات الفوسفور، والتي بدورها تستخدم لتحضير مركّبات الفوسفور العضوية.[86] تستخدم هذه المركّبات في صناعة وتحضير الملدّنات ومثبّطات اللهب والمبيدات، وكذلك في معالجة المياه.[22][87]
- التعدين
يدخل الفوسفور أيضاً في إنتاج الفولاذ وفي صناعة البرونز المُفَسفر؛[88][89] كما يضاف الفوسفور أثناء تعدين النحاس في مرحلة الصَهْر للتخلّص من الأكسجين الموجود في النحاس على شكل شائبة، ممّا يؤدّي إلى الحصول على سبيكة نحاس خالية من الأكسجين وحاوية على الفوسفور CuOFP، والتي تتميّز بمقاومتها للتقصّف الهيدروجيني بالمقارنة مع النحاس العادي.[90]
- أعواد الثقاب

صُنعَت أعواد الثقاب المعتمدة على الفوسفور لأوّل مرّة سنة 1830، ويُنسَب الاختراع إلى الفرنسي شارل سَورِيَه. خضعت أعواد الثقاب تلك إلى سلسلةٍ متعاقبةٍ من التحويرات، ولكنّها كانت على العموم ذات رؤوسٍ مصنوعةٍ من الفوسفور الأبيض، مع وجود مركّبات مطلقة للأكسجين (مثل كلورات البوتاسيوم أو ثنائي أكسيد الرصاص أو مركّبات النترات أحياناً)، بالإضافة إلى مادّة رابطة. نظراً لسمّية الفوسفور الأبيض فقد تعرّض العمال أثناء تصنيع أعواد الثقاب إلى مخاطر صحّية،[91] كما كانت صعبة التخزين وخطيرة عند احتكاكها مصادفةً مع سطحٍ خشن؛[92][93] مما دفع بعض الدول إلى إيقاف إنتاجها في الفترو ما بين 1872 و 1925.[94] في سنة 1906 وُقِّعَت اتّفاقية برن الدولية، والتي منعت استخدام الفوسفور الأبيض في صناعة أعواد الثقاب.[20]
نتيجةً لذلك جرى تطوير عيدان ثقاب حلّ فيها مركّب ثلاثي كبريتيد رباعي الفوسفور P4S3 مكان الفوسفور الأبيض، بالإضافة إلى وجود مزيج من الكبريت وكبريتيد الإثمد؛ وهي تعرف باسم أعواد الثقاب الآمنة، وذلك لأنّه من الصعب إشعالها على أيّ سطح غير السطوح المخصّصة لذلك، والتي عادةً ما توجد على شكل شريط ضيّق على جانبي العلبة الحاوية عليها. تحوي هذه السطوح على الفوسفور الأحمر، الذي يسخن بالاحتكاك ويتفاعل مع المركّبات المطلقة للأكسجين ويتفاعل مع المواد القابلة للاشتعال الموجودة في الرأس.[53][86]
- معالجة المياه
يضاف أحياناً مركب ثلاثي فوسفات الصوديوم إلى مساحيق الغسيل في بعض البلدان، في حين أنّه ممنوعٌ في أخرى،[55] وذلك من أجل تخفيض قساوة المياه أثناء عملية غسل الملابس، وهو الأمر الذي يحسّن من أداء المنظّف ويمنع التآكل وترسّب الكلس.[95]
- متفرّقات
- تستخدم نظائر الفوسفور مثل 32P و 33P في الوسم الإشعاعي في مختبرات الكيمياء الحيوية.[96]
- في بعض الأحيان يدخل مسحوق من الفوسفور الأحمر بنسب ضئيلة في خلطة بعض البوليمرات مثل بولي الأميد لدورها في تثبيط اللهب، انطلاقاً من مقدرتها العالية على الارتباط مع الأكسجين والبوادئ الجذرية.[97]
- يستخدم الفوسفور الأبيض في الصناعات العسكرية لصناعة القنابل الحارقة والقنابل الدخانية والذخيرة الخطّاطة.[98][99][100] يعدّ استخدام القنابل الفوسفورية ممنوعاً وفق القوانين الدولية المتعلّقة بأسلحة الحرب.[101]
- تستخدم الفوسفات في صناعة زجاج من نوعٍ خاصٍّ لمصابيح بخار الصوديوم.[55]
- تستخدم مركّبات فوسفات الكالسيوم في صناعة الخزف الصيني.[55]
- يستخدم حمض الفوسفوريك ومركّبات الفوسفات المختلفة في الصناعات الغذائية ضمن الإضافات الغذائية.[86]
المخاطر[عدل]

تتفاوت المخاطر الناجمة عن الفوسفور بين الفوسفور العنصري ومركّباته الكيميائية، وخاصّةً مركّباته العضوية. تشمل مركّبات الفوسفور العضوية على العموم طيفاً واسعاً من المواد، إذ في حين أنّ العديد منها ضروريٌ للحياة؛ إلّا أنّ البعضَ الآخر سامّ للغاية، فعلى سبيل المثال تعدّ إسترات الفلوروفوسفات من بين أكثر السموم العصبية تأثيراً. تُستخدَم مركّبات الفوسفور العضوية نظراً لسمّيتها بشكل واسع في صناعة مبيدات الآفات (مبيدات الأعشاب والحشرات والفطريات وغيرها)؛ كما تستخدم أحياناً في صناعة الأسلحة. بالمقابل فإنّ أغلب مركّبات الفوسفات اللاعضوية هي غير سامّة.[22]
يمثّل الفوسفور الأبيض خطراً كبيراً، لأنّه يشتعل تلقائياً في الهواء، وذلك عند درجة حرارة حوالي 30 °س، وهي قريبةٌ من درجة حرارة الغرفة؛ كما أنّ تفاعل الأكسدة (الاحتراق) إلى خماسي أكسيد الفوسفور هو تفاعل طارد للحرارة بشكلٍ كبير. يمكن أن يؤدّي التماس مع الماء والهيدروكسيدات القلوية إلى تشكّل غاز الفوسفين السامّ ومشتقات الفوسفانات السامّة أيضاً. أدّى التعرّض المستمرّ للفوسفور الأبيض، الذي كان مستخدماً في صناعة أعواد الثقاب، إلى الإصابة بمرضٍ مِهَنيٍّ يحدث فيه نخر لعظام الفكّ السفلي. بالإضافة إلى ذلك، فإنّ الفوسفور الأبيض سامّ جداً، ويسبّب أضراراً شديدةً للكبد والأجهزة الداخلية في الجسم.[102] كان محلول 2% من كبريتات النحاس مستخدماً في الماضي لعلاج حالات التعرّض الخارجي للفوسفور، حيث يشكّل مركّبات أقلّ ضرراً يمكن غسلها بعيداً عن الجسم؛ إلّا هذا الأسلوب أصبح متقادماً، خاصّةً أنّ مركّب كبريتات النحاس ضارٌّ بحدِّ ذاته.[103]
عيّنَت إدارة السلامة والصحة المهنية الأمريكية حدّ التعرض للفوسفور المسموح به في مكان العمل بمقدار 0.1 مغ/م3 خلال يوم عمل من 8 ساعات؛ وهو نفسه الحدّ الأقصى للتعرّض الموصى به من قبل المعهد الوطني للسلامة والصحة المهنية الأمريكي. عند مستويات تصل إلى 5 مغ/م3 فإنّ الفوسفور يمثّل خطورةً فوريّةً للحياة أو الصحّة.[104]
هوامش[عدل]
المراجع[عدل]
- ^ Ellis، Bobby D.؛ MacDonald، Charles L. B. (2006). "Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds". Inorganic Chemistry. ج. 45 ع. 17: 6864. DOI:10.1021/ic060186o. PMID:16903744.
{{استشهاد بدورية محكمة}}: no-break space character في|title=في مكان 22 (مساعدة) - ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ أ ب ت ث ج Parkes & Mellor 1939، صفحة 717
- ^ Beatty, Richard (2000). Phosphorus. Marshall Cavendish. ص. 7. ISBN:0-7614-0946-7. مؤرشف من الأصل في 2020-02-04.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Schmundt, Hilmar (21 April 2010), "Experts Warn of Impending Phosphorus Crisis", Der Spiegel. نسخة محفوظة 27 يناير 2012 على موقع واي باك مشين.
- ^ أ ب Michael A. Sommers (15 أغسطس 2007). Phosphorus. The Rosen Publishing Group, 2007. ص. 25. ISBN:978-1404219601. مؤرشف من الأصل في 2020-01-04.
- ^ Stillman، J. M. (1960). The Story of Alchemy and Early Chemistry. New York: Dover. ص. 418–419. ISBN:0-7661-3230-7.
- ^ Baccini، Peter؛ Paul H. Brunner (10 فبراير 2012). Metabolism of the Anthroposphere. MIT Press, 2012. ص. 288. ISBN:978-0262300544.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - ^ Emsley، John (7 يناير 2002). The 13th Element: The Sordid Tale of Murder, Fire, and Phosphorus. John Wiley & Sons. ISBN:978-0-471-44149-6. مؤرشف من الأصل في 2017-02-02. اطلع عليه بتاريخ 2012-02-03.
- ^ cf. "Memoir on Combustion in General" Mémoires de l'Académie Royale des Sciences 1777, 592–600. from Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400–1900 (New York: McGraw Hill, 1952) "نسخة مؤرشفة". مؤرشف من الأصل في 2018-03-24. اطلع عليه بتاريخ 2019-12-24.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Schrötter, Neue Modifikation des Phosphors, Liebigs Annalen der Chemie, Band 68, 1848, S. 247–253
- ^ أ ب W. Hittorf, Zur Kenntniss des Phosphors, Annalen der Physik, Band 202, 1865, S. 193–228
- ^ Von Wagner، Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co. ص. 411. مؤرشف من الأصل في 2019-12-28.
- ^ Thomson, Robert Dundas (1870). Dictionary of chemistry with its applications to mineralogy, physiology and the arts. Rich. Griffin and Company. ص. 416. مؤرشف من الأصل في 2020-01-08.
- ^ Threlfall 1951، صفحات 49–66
- ^ Robert B. Heimann؛ Hans D. Lehmann (10 مارس 2015). Bioceramic Coatings for Medical Implants. John Wiley & Sons, 2015. ص. 4. ISBN:978-3527684007.
- ^ أ ب ت Arthur D. F. Toy (22 أكتوبر 2013). The Chemistry of Phosphorus. Elsevier, 2013. ص. 389. ISBN:978-1483147413.
- ^ Threlfall 1951، صفحات 81–101
- ^ Parkes & Mellor 1939، صفحة 718–720.
- ^ أ ب ت ث Emsley، John (2000). The Shocking History of Phosphorus. London: Macmillan. ISBN:0-330-39005-8.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - ^ أ ب Threlfall 1951، صفحات 167–185
- ^ أ ب ت ث ج ح خ د ذ ر Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. (ردمك 0-7506-3365-4).
- ^ Lewis R. Goldfrank؛ Neal Flomenbaum؛ Mary Ann Howland؛ Robert S. Hoffman؛ Neal A. Lewin؛ Lewis S. Nelson (2006). Goldfrank's toxicologic emergencies. McGraw-Hill Professional. ص. 1486–1489. ISBN:0-07-143763-0. مؤرشف من الأصل في 2020-02-04.
- ^ Koo، B.-C.؛ Lee، Y.-H.؛ Moon، D.-S.؛ Yoon، S.-C.؛ Raymond، J. C. (2013). "Phosphorus in the Young Supernova Remnant Cassiopeia A". Science. ج. 342 ع. 6164: 1346–8. arXiv:1312.3807. Bibcode:2013Sci...342.1346K. DOI:10.1126/science.1243823. PMID:24337291.
- ^ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 928–931
- ^ Abundance. ptable.com نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- ^ أ ب ت ث Philpott، Tom (مارس–April 2013). "You Need Phosphorus to Live—and We're Running Out". Mother Jones. مؤرشف من الأصل في 2 سبتمبر 2019.
{{استشهاد بمجلة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Klein, Cornelis and Cornelius S. Hurlbut, Jr., Manual of Mineralogy, Wiley, 1985, 20th ed., p. 360, (ردمك 0-471-80580-7)
- ^ M. Okrusch, S. Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer, 2005, ISBN 3-540-23812-3.
- ^ Dietmar Kunath: Phosophor. In: Claus Schaefer, Torsten Schröer (Hrsg.): Das große Lexikon der Aquaristik. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9, S. 772.
- ^ Podger 2002، صفحات 297–298
- ^ "Phosphate Rock" (PDF). USGS. مؤرشف من الأصل في 2017-05-13. اطلع عليه بتاريخ 2017-03-20.
- ^ Carpenter S.R.؛ Bennett E.M. (2011). "Reconsideration of the planetary boundary for phosphorus". Environmental Research Letters. ج. 6 ع. 1: 014009. Bibcode:2011ERL.....6a4009C. DOI:10.1088/1748-9326/6/1/014009.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|last-author-amp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Reilly، Michael (26 مايو 2007). "How Long Will it Last?". New Scientist. ج. 194 ع. 2605: 38–39. Bibcode:2007NewSc.194...38R. DOI:10.1016/S0262-4079(07)61508-5. ISSN:0262-4079.
- ^ Lewis, Leo (23 يونيو 2008). "Scientists warn of lack of vital phosphorus as biofuels raise demand". The Times. مؤرشف من الأصل في 2011-08-10.
- ^ Grantham، Jeremy (12 نوفمبر 2012). "Be persuasive. Be brave. Be arrested (if necessary)". Nature. ج. 491 ع. 7424: 303. Bibcode:2012Natur.491..303G. DOI:10.1038/491303a. PMID:23151541. مؤرشف من الأصل في 2019-10-08.
- ^ موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
- ^ Shriver, Atkins. Inorganic Chemistry, Fifth Edition. W. H. Freeman and Company, New York; 2010; p. 379.
- ^ Audi، G.؛ Kondev، F. G.؛ Wang، M.؛ Huang، W. J.؛ Naimi، S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. ج. 41 ع. 3. Bibcode:2017ChPhC..41c0001A. DOI:10.1088/1674-1137/41/3/030001. مؤرشف من الأصل (PDF) في 2020-09-08.
- ^ Neufcourt، L.؛ Cao، Y.؛ Nazarewicz، W.؛ Olsen، E.؛ Viens، F. (2019). "Neutron drip line in the Ca region from Bayesian model averaging". Physical Review Letters. ج. 122 ع. 6: 062502–1–062502–6. arXiv:1901.07632. Bibcode:2019PhRvL.122f2502N. DOI:10.1103/PhysRevLett.122.062502. PMID:30822058.
- ^ "Phosphorus-32" (PDF). University of Michigan Department of Occupational Safety & Environmental Health. مؤرشف من الأصل (PDF) في 2016-05-28. اطلع عليه بتاريخ 2010-11-18.
- ^ Horst Briehl: Chemie der Werkstoffe. Springer-Verlag, 2014, ISBN 978-3-658-06225-5, S. 24
- ^ أ ب A. Holleman؛ N. Wiberg (1985). "XV 2.1.3". Lehrbuch der Anorganischen Chemie (ط. 33rd). de Gruyter. ISBN:3-11-012641-9.
- ^ Ralf Steudel: Chemie der Nichtmetalle Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 978-3-11-021128-3, S. 360
- ^ Simon, Arndt؛ Borrmann، Horst؛ Horakh، Jörg (1997). "On the Polymorphism of White Phosphorus". Chemische Berichte. ج. 130 ع. 9: 1235. DOI:10.1002/cber.19971300911.
- ^ Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 392. ISBN 978-0-13-039913-7
- ^ Durif، M.-T. Averbuch-Pouchot; A. (1996). Topics in phosphate chemistry. Singapore [u.a.]: World Scientific. ص. 3. ISBN:978-981-02-2634-3.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Welford C. Roberts؛ William R. Hartley (16 يونيو 1992). Drinking Water Health Advisory: Munitions (ط. illustrated). CRC Press, 1992. ص. 399. ISBN:0873717546.
- ^ Marie-Thérèse Averbuch-Pouchot؛ A. Durif (1996). Topics in Phosphate Chemistry. World Scientific, 1996. ص. 3. ISBN:9810226349.
- ^ Stefanie Ortanderl, Ulf Ritgen: Chemie für Dummies. Das Lehrbuch. John Wiley & Sons, 2014, ISBN 978-3-527-70924-3, S. 541
- ^ Piro, N. A.؛ Figueroa، J. S.؛ McKellar، J. T.؛ Cummins، C. C. (2006). "Triple-Bond Reactivity of Diphosphorus Molecules". Science. ج. 313 ع. 5791: 1276–9. Bibcode:2006Sci...313.1276P. DOI:10.1126/science.1129630. PMID:16946068. مؤرشف من الأصل في 2020-03-12.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Alfons Klemenc: Anorganische Chemie auf physikalisch-chemischer Grundlage. Springer-Verlag, 2013, ISBN 978-3-7091-7793-8, S. 202
- ^ أ ب Egon Wiberg؛ Nils Wiberg؛ Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. ص. 683–684, 689. ISBN:978-0-12-352651-9. مؤرشف من الأصل في 2017-02-28. اطلع عليه بتاريخ 2011-11-19.
- ^ Parkes & Mellor 1939، صفحات 721–722
- ^ أ ب ت ث Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (ط. 81st). CRC press. ISBN:0-8493-0481-4.
- ^ Grundlagen und Hauptgruppenelemente Band 1: Grundlagen und Hauptgruppenelemente. Walter de Gruyter GmbH & Co KG, 2016, ISBN 3-11-049585-6, S. 852
- ^ أ ب ت Berger, L. I. (1996). Semiconductor materials. CRC Press. ص. 84. ISBN:0-8493-8912-7. مؤرشف من الأصل في 2020-04-16.
- ^ A. Brown؛ S. Runquist (1965). "Refinement of the crystal structure of black phosphorus". Acta Crystallogr. ج. 19 ع. 4: 684. DOI:10.1107/S0365110X65004140.
- ^ Cartz, L.؛ Srinivasa, S.R.؛ Riedner, R.J.؛ Jorgensen, J.D.؛ Worlton, T.G. (1979). "Effect of pressure on bonding in black phosphorus". Journal of Chemical Physics. ج. 71 ع. 4: 1718–1721. Bibcode:1979JChPh..71.1718C. DOI:10.1063/1.438523.
- ^ Bridgman، P. W. (1 يوليو 1914). "Two New Modifications of Phosphorus". Journal of the American Chemical Society. ج. 36 ع. 7: 1344–1363. DOI:10.1021/ja02184a002. ISSN:0002-7863.
- ^ Lange, Stefan؛ Schmidt, Peer؛ Nilges, Tom (2007). "Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus". Inorg. Chem. ج. 46 ع. 10: 4028–35. DOI:10.1021/ic062192q. PMID:17439206.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|last-author-amp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Stefan Lange, Peer Schmidt, Tom Nilges: Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus. In: Inorg. Chem. 46 (10), 2007, S. 4028–4035; doi:10.1021/ic062192q.
- ^ G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. Vol. 1, Academic Press 1963, S. 518–525.
- ^ Robert Engel (18 ديسمبر 2003). Synthesis of Carbon-Phosphorus Bonds (ط. 2). CRC Press, 2003. ص. 11. ISBN:0203998243.
- ^ "Nobel Prize in Chemistry 1956 – Presentation Speech by Professor A. Ölander (committee member)". مؤرشف من الأصل في 2008-10-07. اطلع عليه بتاريخ 2009-05-05.
- ^ "Phosphorus Topics page, at Lateral Science". مؤرشف من الأصل في 2009-02-21. اطلع عليه بتاريخ 2009-05-05.
- ^ Vanzee، Richard J.؛ Khan، Ahsan U. (1976). "The phosphorescence of phosphorus". The Journal of Physical Chemistry. ج. 80 ع. 20: 2240. DOI:10.1021/j100561a021.
- ^ Kutzelnigg, W. (1984). "Chemical Bonding in Higher Main Group Elements" (PDF). Angew. Chem. Int. Ed. Engl. ج. 23 ع. 4: 272–295. DOI:10.1002/anie.198402721. مؤرشف من الأصل (PDF) في 16 أبريل 2020. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam 1995. (ردمك 0-444-89307-5).
- ^ Heal, H. G. "The Inorganic Heterocyclic Chemistry of Sulfur, Nitrogen, and Phosphorus" Academic Press: London; 1980. (ردمك 0-12-335680-6).
- ^ Mark, J. E.; Allcock, H. R.; West, R. "Inorganic Polymers" Prentice Hall, Englewood, NJ: 1992. (ردمك 0-13-465881-7).
- ^ Ruttenberg, K.C. Phosphorus Cycle – Terrestrial Phosphorus Cycle, Transport of Phosphorus, from Continents to the Ocean, The Marine Phosphorus Cycle. (archived link) نسخة محفوظة 3 أكتوبر 2011 على موقع واي باك مشين.
- ^ Lipmann D. (1944) "Enzymatic Synthesis of Acetyl Phosphate" J Biol Chem. 155, 55-70. نسخة محفوظة 19 يناير 2020 على موقع واي باك مشين.
- ^ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. (ردمك 1-57259-153-6).
- ^ Bernhardt, Nancy E.؛ Kasko, Artur M. (2008). Nutrition for the Middle Aged and Elderly. Nova Publishers. ص. 171. ISBN:978-1-60456-146-3. مؤرشف من الأصل في 2020-04-16.
- ^ Lincoln Taiz, Eduardo Zeiger: Physiologie der Pflanzen. Spektrum, Akad. Verlag, Heidelberg/ Berlin 1998, ISBN 3-8274-0537-8.
- ^ K. Mengel: Ernährung und Stoffwechsel der Pflanze. Gustav Fischer Verlag, Jena 1991, S. 324–334.
- ^ Mehanna HM، Moledina J، Travis J (يونيو 2008). "Refeeding syndrome: what it is, and how to prevent and treat it". BMJ. ج. 336 ع. 7659: 1495–8. DOI:10.1136/bmj.a301. PMC:2440847. PMID:18583681.
- ^ Anderson، John J. B. (1996). "Calcium, Phosphorus and Human Bone Development". Journal of Nutrition. ج. 126 ع. 4 Suppl: 1153S–1158S. DOI:10.1093/jn/126.suppl_4.1153S. PMID:8642449.
- ^ أ ب Institute of Medicine (1997). "Phosphorus". Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington, DC: The National Academies Press. ص. 146–189. DOI:10.17226/5776. ISBN:978-0-309-06403-3. PMID:23115811. مؤرشف من الأصل في 2020-04-16.
- ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). 2017. مؤرشف من الأصل (PDF) في 2020-01-07.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF)، European Food Safety Authority، 2006، مؤرشف من الأصل (PDF) في 2020-01-07
- ^ Phosphorus in diet: MedlinePlus Medical Encyclopedia. Nlm.nih.gov (2011-11-07). Retrieved on 2011-11-19. نسخة محفوظة 5 يوليو 2016 على موقع واي باك مشين.
- ^ Philpott، Tom (مارس–April 2013). "You Need Phosphorus to Live—and We're Running Out". Mother Jones. مؤرشف من الأصل في 15 يناير 2020.
{{استشهاد بمجلة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Jessica Elzea Kogel، المحرر (2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. SME, 2006. ص. 964. ISBN:0873352335.
- ^ أ ب ت Threlfall, R.E. (1951). 100 years of Phosphorus Making: 1851–1951. Oldbury: Albright and Wilson Ltd.
- ^ Diskowski, Herbert and Hofmann, Thomas (2005) "Phosphorus" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a19_505
- ^ Sustainable Phosphorus Management: A Global Transdisciplinary Roadmap. Springer Science & Business Media, 2014. 12 مارس 2014. ص. 175. ISBN:978-9400772502.
{{استشهاد بكتاب}}: الوسيط غير المعروف|المحررين=تم تجاهله (مساعدة) - ^ Mel Schwartz (6 يوليو 2016). Encyclopedia and Handbook of Materials, Parts and Finishes. CRC Press, 2016. ISBN:978-1138032064.
- ^ Joseph R. Davisz، المحرر (يناير 2001). Copper and Copper Alloys. ASM International, 2001. ص. 181. ISBN:0871707268.
- ^ Hughes, J. P. W; Baron, R.; Buckland, D. H., Cooke, M. A.; Craig, J. D.; Duffield, D. P.; Grosart, A. W.; Parkes, P. W. J.; & Porter, A. (1962). "Phosphorus Necrosis of the Jaw: A Present-day Study: With Clinical and Biochemical Studies". Br. J. Ind. Med. ج. 19 ع. 2: 83–99. DOI:10.1136/oem.19.2.83. PMC:1038164. PMID:14449812.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Crass, M. F., Jr. (1941). "A history of the match industry. Part 9" (PDF). Journal of Chemical Education. ج. 18 ع. 9: 428–431. Bibcode:1941JChEd..18..428C. DOI:10.1021/ed018p428. مؤرشف من الأصل (PDF) في 2020-04-16. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Oliver, Thomas (1906). "Industrial disease due to certain poisonous fumes or gases". Archives of the Public Health Laboratory. Manchester University Press. ج. 1: 1–21. مؤرشف من الأصل في 2017-02-12.
- ^ Charnovitz، Steve (1987). "The Influence of International Labour Standards on the World Trading Regime. A Historical Overview". International Labour Review. ج. 126 ع. 5: 565, 571.
- ^ Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" in Ullmann’s Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a19_465.pub3
- ^ David A. Atwood، المحرر (19 فبراير 2013). Radionuclides in the Environment. John Wiley & Sons, 2013. ISBN:978-1118632697.
- ^ E.-C. Koch: Specials Materials in Pyrotechnics: IV. The Chemistry of Phosphorus and its Compounds. In: J. Pyrotech. 21, 2005, S. 39; Abstract. نسخة محفوظة 26 يناير 2020 على موقع واي باك مشين.
- ^ "Obsolete hand grenades". GlobalSecurity.Org. مؤرشف من الأصل في 2017-09-07. اطلع عليه بتاريخ 2009-08-03.
- ^ Dockery, Kevin (1997). Special Warfare Special Weapons. Chicago: Emperor's Press. ISBN:1-883476-00-3.
- ^ E.-C. Koch: Specials Materials in Pyrotechnics: V. Military Applications of Phosphorus and its Compounds. In: Propellants Explos. Pyrotech. 33, 2008, S. 165; دُوِي:10.1002/prep.200700212.
- ^ I. J. MacLeod and A. P. V. Rogers. "The Use of White Phosphorus and the Law of War", in Yearbook of International Humanitarian Law (2007) نسخة محفوظة 20 أغسطس 2016 على موقع واي باك مشين.
- ^ "CBRNE – Incendiary Agents, White Phosphorus (Smoking Stool Syndrome)". مؤرشف من الأصل في 2008-12-01. اطلع عليه بتاريخ 2009-05-05.
- ^ "US Navy's Treatment of Chemical Agent Casualties and Conventional Military Chemical Injuries: FM8-285: Part 2 Conventional Military Chemical Injuries". مؤرشف من الأصل في 2005-11-22. اطلع عليه بتاريخ 2009-05-05.
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Phosphorus (yellow)". www.cdc.gov. مؤرشف من الأصل في 2020-01-29. اطلع عليه بتاريخ 2015-11-21.
| فسفور في المشاريع الشقيقة: | |
| |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||









![{\displaystyle {\ce {PO4^3- + 12MoO4^2- + 24H3O+ + 3NH4+ <=> (NH4)3[P(Mo3O10)4] + 36 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb26219c3cab9f7c0612f33ef53af1422e1214ff)
