أكسيد النيتروس: الفرق بين النسختين
| [نسخة منشورة] | [نسخة منشورة] |
ASammourBot (نقاش | مساهمات) ط روبوت (1.2): إضافة تصانيف معادلة + تصنيف:مركبات النيتروجين |
ط بوت:إصلاح تحويلات القوالب |
||
| سطر 12: | سطر 12: | ||
| تسمية الاتحاد الدولي = |
| تسمية الاتحاد الدولي = |
||
| اسماء أخرى = |
| اسماء أخرى = |
||
| قسم1 = {{معلومات كيمياء -معرفات |
| قسم1 = {{معلومات كيمياء - معرفات |
||
| Abbreviations = |
| Abbreviations = |
||
| CASNo = 10024-97-2 |
| CASNo = 10024-97-2 |
||
| سطر 92: | سطر 92: | ||
== التواجد == |
== التواجد == |
||
[[ملف:Major greenhouse gas trends.png|تصغير|DSHV|200px|مناحي غاز الدفيئة.]] |
[[ملف:Major greenhouse gas trends.png|تصغير|DSHV|200px|مناحي غاز الدفيئة.]] |
||
أكسيد النيتروز تطلقه [[بكتيريا|بكتريا]] في التربة وفي المحيطات، ولذلك فهو جزء من الغلاف الجوي للأرض [[حقبة (جيولوجيا)|لحقب طويلة]]. الزراعة هي المصدر الرئيسي لأكسيد النيتروز المنتج بشرياً: زرع التربة، واستخدام [[سماد|الأسمدة النيتروجينية]]، والتعامل مع مخلفات الحيوانات، كلهم يمكنهم أن ينشطوا البكتريا المتواجدة طبيعياً لأن تنتج المزيد من أكسيد النيتروز. قطاع المواشي (بالذات الأبقار، والدجاج والخنازير) ينتج 65% من أكسيد النيتروز المرتبط بالبشر.<ref>{{ |
أكسيد النيتروز تطلقه [[بكتيريا|بكتريا]] في التربة وفي المحيطات، ولذلك فهو جزء من الغلاف الجوي للأرض [[حقبة (جيولوجيا)|لحقب طويلة]]. الزراعة هي المصدر الرئيسي لأكسيد النيتروز المنتج بشرياً: زرع التربة، واستخدام [[سماد|الأسمدة النيتروجينية]]، والتعامل مع مخلفات الحيوانات، كلهم يمكنهم أن ينشطوا البكتريا المتواجدة طبيعياً لأن تنتج المزيد من أكسيد النيتروز. قطاع المواشي (بالذات الأبقار، والدجاج والخنازير) ينتج 65% من أكسيد النيتروز المرتبط بالبشر.<ref>{{استشهاد ويب |
||
| مسار = http://www.virtualcentre.org/en/library/key_pub/longshad/A0701E00.htm |
| مسار = http://www.virtualcentre.org/en/library/key_pub/longshad/A0701E00.htm |
||
| عنوان = Livestock’s long shadow -- Environmental issues and options |
| عنوان = Livestock’s long shadow -- Environmental issues and options |
||
| سطر 103: | سطر 103: | ||
== تاريخ اكتشافه == |
== تاريخ اكتشافه == |
||
اُكْتُشِفَ الغاز من قبل جوزيف بريستلي في 1772. اختبر همفري دافي الغاز على نفسه وبعض من أصدقائه في العام 1790.<ref name="Nitrous Oxide pioneers">{{Cite journal|مسار= http://journals.lww.com/anesthesiology/citation/1941/09000/The_Development_of_Anesthesia.8.aspx |مؤلف=Keys TE|عنوان=The_Development_of_Anesthesia|عمل=Anesthesiology journal |سنة=1941|المجلد=2|صفحات=552–574 |bibcode=1982AmSci..70..522D |صحيفة=American Scientist|مسار أرشيف= https://web.archive.org/web/20140112122739/http://journals.lww.com/anesthesiology/citation/1941/09000/The_Development_of_Anesthesia.8.aspx|تاريخ أرشيف=2014-01-12}}</ref> نشر اكتشافه في تجارب الكتاب والملاحظات على "مختلف أنواعها من الهواء" (1775)، حيث أنه وصف لكيفية إنتاج الإعداد من "تقلص الهواء النيتروز"، بتدفئة برادة الحديد مبللة بحمض النتريك [[حمض النتريك]].<ref name="Joseph Priestley">{{ |
اُكْتُشِفَ الغاز من قبل جوزيف بريستلي في 1772. اختبر همفري دافي الغاز على نفسه وبعض من أصدقائه في العام 1790.<ref name="Nitrous Oxide pioneers">{{Cite journal|مسار= http://journals.lww.com/anesthesiology/citation/1941/09000/The_Development_of_Anesthesia.8.aspx |مؤلف=Keys TE|عنوان=The_Development_of_Anesthesia|عمل=Anesthesiology journal |سنة=1941|المجلد=2|صفحات=552–574 |bibcode=1982AmSci..70..522D |صحيفة=American Scientist|مسار أرشيف= https://web.archive.org/web/20140112122739/http://journals.lww.com/anesthesiology/citation/1941/09000/The_Development_of_Anesthesia.8.aspx|تاريخ أرشيف=2014-01-12}}</ref> نشر اكتشافه في تجارب الكتاب والملاحظات على "مختلف أنواعها من الهواء" (1775)، حيث أنه وصف لكيفية إنتاج الإعداد من "تقلص الهواء النيتروز"، بتدفئة برادة الحديد مبللة بحمض النتريك [[حمض النتريك]].<ref name="Joseph Priestley">{{استشهاد ويب|مسار=http://www.erowid.org/chemicals/nitrous/nitrous_journal1.shtml|مؤلف=Priestley J|عنوان=Experiments and Observations on Different Kinds of Air (vol.2, sec.3)|سنة=1776| مسار أرشيف = https://web.archive.org/web/20190517224752/https://www.erowid.org/chemicals/nitrous/nitrous_journal1.shtml | تاريخ أرشيف = 17 مايو 2019 }}</ref> |
||
هو أحد مواد التخدير الغازية في العمليات الجراحية، عديم اللون ولهُ رائحة مميزة وغريبة وتوصف بشكل غريب أيضا بــ (طعمها حلو !). غاز الضحك مفعوله فوري ويشمل الشعور بالبهجة والتنميل في الجسم والضحك غير المتحكم فيه ولذلك يسمى غاز الضحك. يحس من يتعرض للغاز بشعور بالخفة والطفو وأحيانا ما يشبه الهلاوس ولكن ليس بشكل كامل أو واضح. بعض المستخدمين يشعرون بالقلق بل بنوبات الهلع. كل تأثيرات غاز الضحك مؤقتة وتزول خلال دقائق معدودة بعد التوقف عن استنشاقه. |
هو أحد مواد التخدير الغازية في العمليات الجراحية، عديم اللون ولهُ رائحة مميزة وغريبة وتوصف بشكل غريب أيضا بــ (طعمها حلو !). غاز الضحك مفعوله فوري ويشمل الشعور بالبهجة والتنميل في الجسم والضحك غير المتحكم فيه ولذلك يسمى غاز الضحك. يحس من يتعرض للغاز بشعور بالخفة والطفو وأحيانا ما يشبه الهلاوس ولكن ليس بشكل كامل أو واضح. بعض المستخدمين يشعرون بالقلق بل بنوبات الهلع. كل تأثيرات غاز الضحك مؤقتة وتزول خلال دقائق معدودة بعد التوقف عن استنشاقه. |
||
| سطر 155: | سطر 155: | ||
{{نواقل عصبية}} |
{{نواقل عصبية}} |
||
{{ضبط استنادي}} |
{{ضبط استنادي}} |
||
{{معرفات |
{{معرفات مركب كيميائي}} |
||
{{التخدير العام}} |
{{التخدير العام}} |
||
{{شريط بوابات|الكيمياء|طب|صيدلة|علم الفلك}} |
{{شريط بوابات|الكيمياء|طب|صيدلة|علم الفلك}} |
||
نسخة 07:37، 6 مايو 2020
| أكسيد النيتروس | |
|---|---|
| المعرفات | |
| رقم CAS | 10024-97-2 |
| بوب كيم (PubChem) | 948 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | N2O |
| الكتلة المولية | 44.0128 g/mol |
| المظهر | colorless gas |
| الكثافة | 1222.8 kg m-3 (liquid) 1.8 kg m-3 (gas STP) |
| نقطة الانصهار | -90.86 °س، 182 °ك، -132 °ف |
| نقطة الغليان | -88.48 °س، 185 °ك، -127 °ف |
| البنية | |
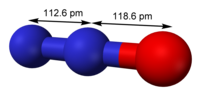
| البنية الجزيئية | linear |
| عزم جزيئي ثنائي القطب | 0.166ديباي |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
+82.05 |
| إنتروبيا مولية قياسية S |
219.9 جول لكل مول كلفن[3] |
| علم الأدوية | |
| طريق التناول | شهيق |
| الاستقلاب | 0.004% |
| Elimination half-life |
5 minutes |
| إخراج | جهاز تنفسي |
| الوضع القانوني | {{{legal_status}}} |
| المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
|
| مركبات متعلقة | |
| مركبات ذات علاقة | أحادي أكسيد النيتروجين, ثنائي أكسيد النيتروجين, ثلاثي أكسيد ثنائي النتروجين, رباعي أكسيد ثنائي النتروجين, خماسي أكسيد ثنائي النتروجين, حمض النتريك, حمض النتروز |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
أكسيد النيتروس (بالإنجليزية: Nitrous oxide) يعرف أيضا بأكسيد النيتروجين الثنائي أو أحادي أكسيد ثنائي النيتروجين وهو مشهور باسم غاز الضحك لأثاره المنشطة عند استنشاقه، وهو مركب كيميائي بالصيغة الكيميائية N2O، في الحالة الطبيعية هو غاز عديم اللون، غير قابل للاشتعال، له رائحة محببة للنفس، شبه حلوة. يستخدم في الجراحة وطب الأسنان لأثاره المسكنة والمخدرة. ويستعمل أكسيد النيتروس كوسيلة لتفعيل فترات قصيرة من الأداء الفائق في محركات الحرق الداخلي في السيارات، وذلك يتم بإدخال أكسجين إضافي إلى الشحنة الداخلة والذي بالتالي يسمح بدخول كمية أكبر من الوقود الذي يتم حرقه وزيادة الكمية الناتجة من الطاقة بشكل مطرد، مؤدياً إلى زيادة القوة التي ينتجها المحرك. أكسيد النيتروس موجود في الهواء ويعد من غازات الدفيئة.
التواجد

أكسيد النيتروز تطلقه بكتريا في التربة وفي المحيطات، ولذلك فهو جزء من الغلاف الجوي للأرض لحقب طويلة. الزراعة هي المصدر الرئيسي لأكسيد النيتروز المنتج بشرياً: زرع التربة، واستخدام الأسمدة النيتروجينية، والتعامل مع مخلفات الحيوانات، كلهم يمكنهم أن ينشطوا البكتريا المتواجدة طبيعياً لأن تنتج المزيد من أكسيد النيتروز. قطاع المواشي (بالذات الأبقار، والدجاج والخنازير) ينتج 65% من أكسيد النيتروز المرتبط بالبشر.[4]
تاريخ اكتشافه
اُكْتُشِفَ الغاز من قبل جوزيف بريستلي في 1772. اختبر همفري دافي الغاز على نفسه وبعض من أصدقائه في العام 1790.[5] نشر اكتشافه في تجارب الكتاب والملاحظات على "مختلف أنواعها من الهواء" (1775)، حيث أنه وصف لكيفية إنتاج الإعداد من "تقلص الهواء النيتروز"، بتدفئة برادة الحديد مبللة بحمض النتريك حمض النتريك.[6]
هو أحد مواد التخدير الغازية في العمليات الجراحية، عديم اللون ولهُ رائحة مميزة وغريبة وتوصف بشكل غريب أيضا بــ (طعمها حلو !). غاز الضحك مفعوله فوري ويشمل الشعور بالبهجة والتنميل في الجسم والضحك غير المتحكم فيه ولذلك يسمى غاز الضحك. يحس من يتعرض للغاز بشعور بالخفة والطفو وأحيانا ما يشبه الهلاوس ولكن ليس بشكل كامل أو واضح. بعض المستخدمين يشعرون بالقلق بل بنوبات الهلع. كل تأثيرات غاز الضحك مؤقتة وتزول خلال دقائق معدودة بعد التوقف عن استنشاقه.
استعماله الطبي الأساسي كمادة مساعدة في التخدير للعمليات الجراحية واستخدامه وحده لا يكفي لإحداث تخدير بينما مزجه مع الأوكسجين يسكن الألم بشكل كبير. له استخدامات أخرى لأطباء الأسنان والنساء والولادة. كما أن له استخدامات صناعية غير طبية كمادة تضاف لزيادة أداء محرك المركبات.
تكمن خطورة غاز الضحك عند استخدامه غير القانوني في الوفيات التي من الممكن أن يسببها حيث يعمل على إزاحة الأوكسجين من الرئتين. كما أن من أسباب الوفيات الأخرى هو عدم انتظام ضربات القلب المفاجئة عندما يجري استنشاق المادة بتركيز 100% من كيس مليء به مثلا.
هناك خطورة أخرى وهو التعرض المستمر والزمن لهذه المادة في أماكن العمل كالمستشفيات والورش الصناعية حيث يرتبط بحدوث تشوه للأجنة.
يعرف القليل بشأن الاعتمادية على هذه المادة ولكن الخطورة موجودة بسبب سهولة الحصول عليها واستنشاقها.
النيتروس Nitrous Oxide System NOS
استخدامه في السيارات
فكره عمله تعتمد على وجود انبوبة بها غاز الاكسى نيتروجين وعندما تريد ان تزيد من قدرة السيارة تقوم بفتح صمام الخروج الذي يؤدي إلى إنفاق غاز الأكسي نيتروجين.
إلى غرفة الاحتراق فيعمل الأكسجين على زيادة نسبة الانضغاط وبالتالى زيادة قدرة السيارة.
ويعمل النيتروجين على تبريد غرفة الاحتراق لأن الحرارة تزداد جدا بسبب قوة عملية الاحتراق.
مميزاته
- يقدر ثمن غاز النيتروس بـ 165 دولار لعبوة سعتها 60 لتر أي أنه يعد رخيص الثمن.
- يتم تركيبة على جميع أنواع السيارات (ديزل _ بنزين).
- يزيد قدرة المحرك بنسبة 60 %.
- التحكم في عملية زيادة القدرة عند فتح أو غلق صمام الغاز.
- سهولة التركيب.
عيوبه
- تعتبر عملية زيادة القدرة محدودة بحجم الأنبوبة المركبة بالسيارة لأن عند انتهائها يتوقف عمل النظام كله.
- نوعا ما غير أمن لاحتمال تسرب الغازات أو انفجار الأنبوبة.
المراجع
- ^ أ ب nitrous oxide (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ https://chem.libretexts.org/Bookshelves/General_Chemistry/Book%3A_ChemPRIME_(Moore_et_al.)/16%3A_Entropy_and_Spontaneous_Reactions/16.06%3A_Standard_Molar_Entropies. اطلع عليه بتاريخ 2019-01-25.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة) والوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة) - ^ H. Steinfeld, P. Gerber, T. Wassenaar, V. Castel, M. Rosales, C. de Haan (2006). "Livestock's long shadow -- Environmental issues and options". مؤرشف من الأصل في 2014-08-06. اطلع عليه بتاريخ 2008-02-02.
{{استشهاد ويب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Keys TE (1941). "The_Development_of_Anesthesia". American Scientist. ج. 2: 552–574. Bibcode:1982AmSci..70..522D. مؤرشف من الأصل في 2014-01-12.
{{استشهاد بدورية محكمة}}: الوسيط|عمل=و|صحيفة=تكرر أكثر من مرة (مساعدة) - ^ Priestley J (1776). "Experiments and Observations on Different Kinds of Air (vol.2, sec.3)". مؤرشف من الأصل في 2019-05-17.
وصلات خارجية
- Occupational Safety and Health Guideline for Nitrous Oxide
- Paul Crutzen Interview Freeview video of Paul Crutzen Nobel Laureate for his work on decomposition of ozone talking to Harry Kroto Nobel Laureate by the Vega Science Trust.
- National Pollutant Inventory – Oxide of nitrogen fact sheet
- National Institute for Occupational Safety and Health – Nitrous Oxide
- Nitrous Oxide FAQ
- Erowid article on Nitrous Oxide
- Nitrous oxide fingered as monster ozone slayer, Science News
- Dental Fear Central article on the use of nitrous oxide in dentistry
| في كومنز صور وملفات عن: أكسيد النيتروس |
- أدوية أساسية حسب منظمة الصحة العالمية
- أدوية تخدير عام
- أكاسيد
- دوافع هوائية
- دورة النيتروجين
- غازات دفيئة
- غازات صناعية
- كيمياء لاعضوية
- مركبات الأكسجين
- مركبات النيتروجين
- مركبات نتروجين لاعضوية
- مسببات الابتهاج
- مسببات التفارق
- معدلات تفارغية موجبة لمستقبل غابا أ
- مناهضات مستقبل ن-مثيل-د-أسبارتات
- مناهضات نيكوتينية
- ناهضات مستقبل الغلايسين
- نظافة مهنية