كلوريد الصوديوم
| كلوريد الصوديوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
كلوريد صوديوم |
|
| أسماء أخرى | |
* ملح الطعام
|
|
| المعرفات | |
| رقم CAS | 7647-14-5 |
| بوب كيم | 5234 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | NaCl |
| الكتلة المولية | 58.44 غ/مول |
| المظهر | مسحوق بلوري أبيض |
| الكثافة | 2.16 غ/سم3 |
| نقطة الانصهار | 801 °س |
| نقطة الغليان | 1465 °س |
| الذوبانية في الماء | 36 غ/100 مل ماء |
| المخاطر | |
| توصيف المخاطر | لا يوجد |
| تحذيرات وقائية | لا يوجد |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
كلوريد الصوديوم هو مركب كيميائي أيوني قاعدي يرمز له بـ NaCl. يتكون من الكلور والصوديوم، ويدعى باسمه الشائع ملح الطعام، ويعد المركب المسبب الرئيسي لملوحة مياه المحيطات.
يوجد المركب على هيئة بلورية مكعبة، تترتب فيها أيونات الصوديوم الصغيرة لتملأ الفراغات الثمانية بين أيونات الكلور الأكبر.[3]
الاستخدامات
[عدل]بالإضافة إلى الاستخدامات المألوفة للملح، تشتمل التطبيقات الأكثر شيوعًا لما يقرب من 250 مليون طن من الإنتاج سنويًا (بيانات 2008) على المواد الكيميائية وإزالة الجليد.[4]
إنتاج الكيماويات
[عدل]يستخدم الملح بشكل مباشر أو غير مباشر في إنتاج العديد من المواد الكيميائية التي تستهلك معظم إنتاج العالم.
صناعة الكلور القلوي
[عدل]هي نقطة الانطلاق لعملية الكلور القلوي وهي العملية الصناعية لإنتاج الكلور وهيدروكسيد الصوديوم حسب المعادلة الكيميائية
2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOH
يتم إجراء هذا التحليل الكهربائي إما في خلية زئبقية أو خلية غشاء أو خلية غشائية. يستخدم كل من هؤلاء طريقة مختلفة لفصل الكلور عن هيدروكسيد الصوديوم. هناك تقنيات أخرى قيد التطوير بسبب الاستهلاك العالي للطاقة في التحليل الكهربائي، حيث يمكن أن تؤدي التحسينات الصغيرة في الكفاءة إلى مردود اقتصادي كبير. تتضمن بعض تطبيقات الكلور المطهرات والمذيبات. يمكّن هيدروكسيد الصوديوم الصناعات التي تنتج الورق والصابون والألمنيوم.
صناعة رماد الصودا
[عدل]يستخدم كلوريد الصوديوم في عملية سولفاي لإنتاج كربونات الصوديوم وكلوريد الكالسيوم. تستخدم كربونات الصوديوم بدورها لإنتاج الزجاج وبيكربونات الصوديوم والأصباغ، بالإضافة إلى عدد لا يحصى من المواد الكيميائية الأخرى. في عملية مانهايم وفي عملية هارجريفز، يستخدم كلوريد الصوديوم لإنتاج كبريتات الصوديوم وحمض الهيدروكلوريك.
الاستخدامات الصناعية المتنوعة
[عدل]يستخدم كلوريد الصوديوم بكثافة، لذلك حتى التطبيقات الصغيرة نسبيًا يمكن أن تستهلك كميات هائلة. في التنقيب عن النفط والغاز، يعتبر الملح مكونًا مهمًا لسوائل الحفر في حفر الآبار. يتم استخدامه لتلبد وزيادة كثافة سائل الحفر للتغلب على ضغوط الغاز العالية. عندما يصطدم مثقاب بتكوين ملح، يضاف الملح إلى سائل الحفر لتشبع المحلول لتقليل الانحلال داخل طبقة الملح.[5] يستخدم الملح أيضًا في زيادة معالجة الخرسانة في الأغلفة الأسمنتية.
في المنسوجات والصباغة، يستخدم الملح كمحلول ملحي لفصل الملوثات العضوية، ولتعزيز «تمليح» رواسب الصباغة، والمزج مع الأصباغ المركزة لتوحيدها. أحد أدواره الرئيسية هو توفير شحنة أيونات موجبة لتعزيز امتصاص الأصباغ سالبة الشحنة.
كما تستخدم في معالجة الألمنيوم والبريليوم والنحاس والفولاذ والفاناديوم. في صناعة اللب والورق، يستخدم الملح لتبييض لب الخشب. كما يستخدم في صنع كلورات الصوديوم التي تضاف مع حمض الكبريتيك والماء لتصنيع ثاني أكسيد الكلور، وهو مادة كيميائية ممتازة للتبييض تعتمد على الأكسجين. أصبحت عملية ثنائي أكسيد الكلور، التي نشأت في ألمانيا بعد الحرب العالمية الأولى، أكثر شيوعًا بسبب الضغوط البيئية لتقليل أو التخلص من مركبات التبييض المكلورة. في الدباغة ومعالجة الجلود، يضاف الملح إلى جلود الحيوانات لتثبيط النشاط الجرثومي على الجانب السفلي من الجلود وجذب الرطوبة مرة أخرى إلى الجلود.
في صناعة المطاط، يستخدم الملح لصنع أنواع بونا ونيوبرين ومطاط أبيض. يتم استخدام محلول ملحي وحمض الكبريتيك لتخثر مادة اللاتكس المستحلب المصنوعة من البوتادين المكلور.
يضاف الملح أيضًا لتأمين التربة ولتوفير الصلابة للأساس الذي تُبنى عليه الطرق السريعة. يعمل الملح على تقليل آثار التحول الذي يحدث في باطن الأرض من خلال التغيرات في الرطوبة والحمل المروري.
يستخدم كلوريد الصوديوم أحيانًا كمجفف رخيص وآمن نظرًا لخصائصه المرطبة، مما يجعل التمليح طريقة فعالة لحفظ الطعام تاريخيًا؛ يسحب الملح الماء من البكتيريا من خلال الضغط الاسموزي، مما يمنعه من التكاثر، وهو مصدر رئيسي لفساد الطعام. على الرغم من توفر مواد مجففة أكثر فعالية، إلا أن القليل منها آمن للبشر.
تليين المياه
[عدل]يحتوي الماء العسر على أيونات الكالسيوم والمغنيسيوم التي تتداخل مع عمل الصابون وتساهم في تكوين مقياس أو غشاء من الرواسب المعدنية القلوية في المعدات والأنابيب المنزلية والصناعية. تستخدم وحدات معالجة عسر المياه التجارية والسكنية راتنجات التبادل الأيوني لإزالة الأيونات المخالفة التي تسبب الصلابة. يتم توليد هذه الراتنجات وإعادة توليدها باستخدام كلوريد الصوديوم.
صناعة الأغذية والزراعة
[عدل]لا تستطيع العديد من الكائنات الحية الدقيقة العيش في بيئة مالحة: يُسحب الماء من خلاياها عن طريق التناضح. لهذا السبب يستخدم الملح لحفظ بعض الأطعمة، مثل لحم الخنزير المقدد أو السمك أو الملفوف.
يضاف الملح إلى الغذاء، إما عن طريق منتج الغذاء أو من قبل المستهلك، كمُحسِّن للنكهة، مادة حافظة، مادة رابطة، مادة مضافة للتحكم في التخمير، عامل التحكم في الملمس ومطور اللون. يتم تقسيم استهلاك الملح في صناعة المواد الغذائية، بترتيب تنازلي للاستهلاك، إلى منتجات معالجة الأغذية الأخرى، وتعليب اللحوم، والتعليب، والخبز، ومنتجات الألبان ومنتجات مطاحن الحبوب. يضاف الملح لتعزيز تطور اللون في لحم الخنزير المقدد ولحم الخنزير ومنتجات اللحوم المصنعة الأخرى. كمادة حافظة، يمنع الملح نمو البكتيريا. يعمل الملح كموثق في النقانق ليشكل مادة هلامية ملزمة مكونة من اللحوم والدهون والرطوبة. يعمل الملح أيضًا كمُحسِّن للنكهة ومُطِّر.
الطب
[عدل]يستخدم كلوريد الصوديوم مع الماء كأحد الحلول الأولية للمعالجة الوريدية. يحتوي رذاذ الأنف غالبًا على محلول ملحي.
مكافحة الحريق
[عدل]
كلوريد الصوديوم هو عامل الإطفاء الرئيسي في طفايات الحريق (Met-L-X ، Super D) المستخدمة في حرائق المعادن القابلة للاشتعال مثل سبائك المغنيسيوم والبوتاسيوم والصوديوم وسبائك NaK (الفئة D). يضاف مسحوق اللدائن الحرارية إلى الخليط، جنبًا إلى جنب مع العزل المائي (ستيرات معدنية) ومواد مقاومة للتكتل (فوسفات ثلاثي الكالسيوم) لتشكيل عامل الإطفاء. عندما يتم تطبيقه على النار، يعمل الملح مثل المشتت الحراري، ويشتت الحرارة من النار، ويشكل أيضًا قشرة خالية من الأكسجين لإخماد النار. تذوب المادة المضافة البلاستيكية وتساعد القشرة على الحفاظ على سلامتها حتى يبرد المعدن المحترق تحت درجة حرارة الاشتعال. تم اختراع هذا النوع من الطفايات في أواخر الأربعينيات من القرن الماضي كوحدة تعمل بالخرطوشة، على الرغم من أن إصدارات الضغط المخزن أصبحت شائعة الآن. الأحجام الشائعة هي 30 رطلاً (14 كجم) محمولة و 350 رطلاً (160 كجم) بعجلات.
الاستخدام البصري
[عدل]تتميز بلورات كلوريد الصوديوم الخالية من العيوب بنفاذية بصرية تبلغ حوالي 90٪ لضوء الأشعة تحت الحمراء، وتحديداً بين 200 نانومتر و 20 ميكرومتر. لذلك تم استخدامها في المكونات البصرية (النوافذ والمنشورات) التي تعمل في هذا النطاق الطيفي، حيث يوجد عدد قليل من البدائل غير الممتصة وحيث تكون متطلبات عدم التجانس الميكروسكوب أقل صرامة من النطاق المرئي. في حين أن بلورات كلوريد الصوديوم غير مكلفة، فهي ناعمة ورطبة - عند تعرضها للهواء المحيط ، فإنها تغطي تدريجياً «بالصقيع». هذا يحد من تطبيق كلوريد الصوديوم في البيئات الجافة، ومناطق التجميع المختومة بالفراغ أو للاستخدامات قصيرة المدى مثل النماذج الأولية. في الوقت الحاضر، تُستخدم مواد مثل سيلينيد الزنك، وهي أقوى ميكانيكيًا وأقل حساسية للرطوبة، بدلاً من كلوريد الصوديوم في النطاق الطيفي للأشعة تحت الحمراء.
الكيمياء
[عدل]كلوريد الصوديوم الصلب
[عدل]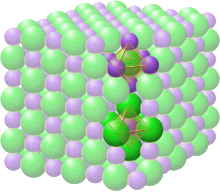
في كلوريد الصوديوم الصلب، يُحاط كل أيون بستة أيونات من الشحنة المعاكسة كما هو متوقع على أسس كهروستاتيكية. توجد الأيونات المحيطة في رؤوس مجسم ثماني منتظم. في لغة التعبئة المتراصة، يتم ترتيب أيونات الكلوريد الأكبر (167 بيكومتر في الحجم[6]) في مصفوفة مكعبة بينما تملأ أيونات الصوديوم الأصغر (116 بيكومتر [6]) جميع الفجوات المكعبة (الفراغات الاوكتاهدرا) بينهما. تم العثور على نفس الهيكل الأساسي في العديد من المركبات الأخرى والمعروف باسم هيكل بلوري الهاليت أو الملح الصخري. يمكن تمثيلها على شكل نظام بلوري مكعب الوجه ذات أساس ذرتين أو كشبكتين مكعبتين متداخلتين على الوجه. تقع الذرة الأولى في كل نقطة شعرية، وتقع الذرة الثانية في منتصف المسافة بين نقاط الشبكة على طول حافة خلية وحدة النظام البلوري المكعب.
تبلغ درجة انصهار كلوريد الصوديوم الصلب 801 درجة مئوية. الموصلية الحرارية لكلوريد الصوديوم كدالة لدرجة الحرارة بحد أقصى 2.03 وات / (سم كلفن) عند 8 كلفن (265.15 درجة مئوية ؛ −445.27 درجة فهرنهايت) وتنخفض إلى 0.069 عند 314 كلفن (41 درجة مئوية ؛ 106 درجة فهرنهايت).
محاليل مائية
[عدل]
يكون التجاذب بين أيونات الصوديوم والكلوريد في المادة الصلبة قويًا لدرجة أن المذيبات عالية القطبية فقط مثل الماء تذوب جيدًا كلوريد الصوديوم.
عندما يذوب في الماء، يتفكك إطار كلوريد الصوديوم حيث تصبح أيونات الصوديوم والكلوريد محاطة بجزيئات الماء القطبية. تتكون هذه المحاليل من مركب معدني مائي مع الصيغة [Na (H2O) 8] + بمسافة Na-O تبلغ 250 بيكومتر. يتم أيضًا إذابة أيونات الكلوريد بقوة، كل منها محاط بمتوسط 6 جزيئات من الماء. لمحاليل كلوريد الصوديوم خصائص مختلفة جدًا عن الماء النقي. نقطة التجمد هي -21.12 درجة مئوية (-6.02 درجة فهرنهايت) لكسر كتلة 23.31٪ من الملح، ونقطة غليان محلول الملح المشبع تقترب من 108.7 درجة مئوية (227.7 درجة فهرنهايت).
الأس الهيدروجيني لمحاليل كلوريد الصوديوم
[عدل]يبقى الرقم الهيدروجيني لمحلول كلوريد الصوديوم ≈7 بسبب ضعف قاعدية أيونات الكلور، وهو القاعدة المترافقة لحمض الهيدروكلوريك القوي. بعبارة أخرى، ليس لكلوريد الصوديوم أي تأثير على الرقم الهيدروجيني للنظام في المحاليل المخففة حيث تكون تأثيرات القوة الأيونية ومعاملات النشاط ضئيلة.
الإنتاج
[عدل]ينتج الملح حاليًا بكميات كبيرة عن طريق تبخر مياه البحر أو المحلول الملحي من الآبار المالحة والبحيرات المالحة. يعد تعدين الملح الصخري أيضًا مصدرًا رئيسيًا. الصين هي المورد الرئيسي للملح في العالم. في عام 2017، قدر الإنتاج العالمي بـ 280 مليون طن، وكان أكبر خمسة منتجين (بالمليون طن) الصين (68.0) والولايات المتحدة (43.0) والهند (26.0) وألمانيا (13.0) وكندا (13.0). الملح هو أيضا منتج ثانوي لتعدين البوتاسيوم.
على الرغم من أنه يتشكل بسهولة من خلال مزيج من عنصري الصوديوم والكلور :
2Na(s) + Cl2(g) → 2NaCl (s)
في تفاعل احتراق يطلق حوالي 411 كيلوجول من الطاقة لكل مول من المركب، لا يتم إنشاؤه عمليا عن قصد بسبب عنف هذا التفاعل - ما لم يتم قياس خصائص هذا التفاعل.
انظر أيضًا
[عدل]المراجع
[عدل]- ^ ا ب ج sodium chloride (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Jonathan B.؛ Mason، Kenneth A.؛ Singer، Susan R.؛ Raven، Peter H.؛ Johnson، George B.؛ Hill، Mc Graw (19 أغسطس 2014). علم الأحياء: biology. العبيكان للنشر. ISBN:9786035032087. مؤرشف من الأصل في 2019-12-15.
- ^ Gisbert; Kristen, Gerhard; Wegener, Wilhelm; Ambatiello, Peter; Geyer, Helmut; Epron, Bernard; Bonal, Christian; Steinhauser, Georg; Götzfried, Franz (2010). Sodium Chloride (بالإنجليزية). John Wiley & Sons, Ltd. DOI:10.1002/14356007.a24_317.pub4. ISBN:978-3-527-30673-2. Archived from the original on 2021-03-08.
- ^ Westphal, Gisbert et al. (2002) "Sodium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim doi:10.1002/14356007.a24_317.pub4.
- ^ ا ب Shannon, R. D. (1 Sep 1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallographica Section A: Crystal Physics, Diffraction, Theoretical and General Crystallography (بالإنجليزية). 32 (5): 751–767. DOI:10.1107/S0567739476001551. ISSN:0567-7394. Archived from the original on 2021-10-15.
روابط خارجية
[عدل]| في كومنز صور وملفات عن: كلوريد الصوديوم |



